Method Article
Enolonium 種によるケトン類の極性転換を高機能化 2 段階のプロトコル
要約
Enolonium 種にケトン レートの極性転換と α-位へ求核剤の付加のための 2 つのステップ ワンポット プロトコル、説明します。求核剤には、芳香族化合物、アリル シラン、アゾール アジ化塩化物が含まれます。
要約
超原子価ヨウ素試薬によるレートの極性転換によるケトンの α 化、有機合成化学で重要な概念です。最近では、ケトンのエノラート極性転換アゾールを使用してアミノ化、アジド、塩素処理法の開発を有効にしているため 2 段階戦略を開発しました。さらに、炭素-炭素結合-形成 arylation とアリル化反応を開発しました。これらのメソッドの中心に反応求核剤の付加の前に中間と高反応性 enolonium 種の準備です。この戦略は準備および古典的な合成化学金属レートの使用を連想させるためです。この戦略は、そうでなければ互換性がありません強く酸化超原子価ヨウ素試薬を用いる求核試薬の使用をできます。本稿では塩素、アジド、N heteroarylation、arylation、およびアリル化のための詳しいプロトコルを提案する.製品は、薬効製品で普及しているモチーフです。この記事はこれらのメソッドを使用して他の人を容易になります。
概要
レートは、古典的な炭素求核試薬有機化学の中で最も広く使用されています。求 enolonium 種を作成するレートの極性転換では、貴重な方法 α 修飾ケトンを生成するし、古典的なエノラート化学経由で可能ではない新規反応を有効にすることができます。Enolonium 種は、超原子価ヨウ素試薬を含む特定の反応における多くの反応中間体として提案されています。これらの反応は、他の反応の2,の3,4,の5と同様に、α-ハロゲン化、酸素化、アミノ化1に含まれます。
しかし、これらの反応の範囲常に反応 enolonium 種の過渡的な性質によって制限されていました。このさせますは、強く酸化超原子価ヨウ素試薬カルボニル レートの反応反応混合物内に存在する任意の求核剤を必要な。したがって、電子豊富な芳香族化合物 (複素環化合物) など、アルケンの酸化しやすい、求核剤が使用しません。
最後の年に我々 は、enolonium 種は 2 番目のステップで求核剤の付加によって続いて 1 つのステップの離散中間体として形成される条件を開発することによりこれらの制限を克服しています。このプロトコルにより、塩素処理6などの機能化の古典的なタイプだけでなく、アリルシラン6,8レート1,6など、酸化炭素求核試薬の使用 7および電子豊富な芳香族化合物9炭素-炭素結合形成反応の結果します。アリル化方法は、第四紀と第三紀のセンターの形成に影響を受けやすいです。ケトンの arylation メソッドは、芳香族誘導グループ9を必要とせず化合物の正式な C H 官能基化を構成します。最近では、我々 はよく11としてアゾールとアザイド10の追加を報告しています。プロトコルの詳細なプレゼンテーションは、合成有機化学者の日常ツール ボックスへのこれらの方法の導入を支援する予定です。
プロトコル
1 Enolonium 種の準備
警告: プロトコルを実行する前に、すべての試薬、溶剤の MSDS をご相談します。
注: すべての新しい試薬は、商業ソースから受け取ったとして使用されました。ホウ素三フッ化 etherate が格納されている場合は、使用する前に蒸留します。
- 丸底フラスコ電磁攪拌用隔壁と磁石装備乾燥 Koser の試薬を追加 (1.5 当量)、窒素またはアルゴンとフラスコをフラッシュします。
- 0.234 mol/L の正式な濃度の懸濁液を与える乾燥ジクロロ メタンを追加します。
- -78 ° c ドライアイス/アセトン浴または冷たい指楽器/アセトン浴を使用して懸濁液を冷却します。
- きちんとした BF3OEt2を追加 (1.5 当量) ゆっくりと。
- 黄色の溶液を形成するまで部屋の温度に異種混合物を温めます。通常、これは 5 分以内に発生します。
- クール-78 ° C への解決策
- 冷却ソリューションに追加トリメチルシリル enolether (1 当量、0.313 mol/L) 乾燥ジクロロ メタンの滴 (規模) に応じて 2 10 分以上。シリル エノール エーテル添加が完了すると、enolonium 種の形成が完了します。
注: enolonium 種のソリューションは-78 ° c 少なくとも 30 分収率で劣化させることがなく左ことができます。Enolonium 種は報告された NMR 研究6で示されるようにこの時間の間に安定しました。
2. Enolonium 種の機能化
- 塩化物の陰イオンと塩素化
- Enolonium 種の調製した溶液、塩化ベンジル-ジメチル-decylammonium を追加 (2.0 当量、1.25 mol/L) ドロップ賢明な方法で乾燥ジクロロ メタン。-55 ° C 以下温度のままそのレートでこのソリューションを追加します。0.5 - 2 モルのスケール、また 5 分以上は満足。
- 5 分間-78 ° C で反応混合物を残します。
- 冷却槽を取り外して、部屋の温度に達するまで反応混合物を許可します。
- 20 分間室温で反応を残します。
- (ジクロロ メタン enolonium 種の準備で使用されるの半分の量) 反応混合物に水を追加します。
- 三度ジクロロ メタンで抽出します。通常、0.5-2 各抽出で 2-3 回反応体積を使用モル小規模。
- 塩水で 2 回した有機層を洗ってください。通常、複合反応ボリュームとして塩水の同じボリュームを使用します。
- 30 分間、無水硫酸ナトリウムで乾燥。
- (例えば、セライト プラグ) を硫酸ナトリウムをフィルター処理します。
- ロータリーエバポレーター 40 ° C、減圧下での溶媒を除去します。
- ヘキサン及び酢酸エチルの溶離液を使用して、溶剤を除去した後、純粋な対応する α アジドフェニル ケトンを余裕するシリカゲル カラムクロマトグラフィーにより粗製品を浄化します。
注: のトリメチルシリル エノラートの 2 モルに 0.5 モルのスケールで、15 cm の高さ (長さ) で標準的なシリカゲル 60 を使用して直径 2 cm のガラスカラムにカラム ・ クロマトグラフィを実行します。ボリュームは、他のスケールの内容を変更する必要があります。
- TMS アジとアジド
注意: 有機アザイド一般に爆発は、処理と製品を準備する。TMS アジは有毒であります。使用前に MSDS を参照してください。- -78 ° c の enolonium 種の準備のソリューションにきちんとした azidotrimethylsilane を追加 (2.5 当量) 滴下方式で。-55 ° C 以下の温度のまま、速度でこのソリューションを追加します。0.5 - 2 モルのスケール、加えて 2-3 分以上は満足。
- -78 ° C で 15 分間反応混合物をかき混ぜる
- -55 ° C に反応混合物を熱し、2 に 3 時間この温度で残します。
- (ジクロロ メタン enolonium 種の準備で使用されるの半分の量) 反応混合物に水を追加します。
- 三度ジクロロ メタンで抽出します。通常、0.5-2 各抽出で 2-3 回反応体積を使用モル小規模。
- 塩水で 2 回した有機層を洗ってください。通常、複合反応ボリュームとして塩水の同じボリュームを使用します。
- 30 分間、無水硫酸ナトリウムで抽出物を乾燥させます。
- 硫酸ナトリウムをフィルター処理します。
- ロータリーエバポレーター 40 ° C、減圧下での溶媒を除去します。
- ヘキサン及び酢酸エチルの溶離液を使用して、溶剤を除去した後、純粋な対応する α アジドフェニル ケトンを余裕するシリカゲル カラムクロマトグラフィーにより粗製品を浄化します。
- アゾールとの反応
- -78 ° c の enolonium 種の調製した溶液、アゾール系を追加 (4 に 5 当量, 1 mol/L) 滴ファッションにジクロロ メタン 5 mL に溶解しました。0.5 - 2 モルのスケール、また 5 分以上は満足。
注: テトラゾール系化合物など難溶性アゾールの場合に、ジクロロ メタンの代わりに 0.5 mol/L の濃度でアセトニ トリルを使用します。-55 ° C 以下の温度のまま、速度でこのソリューションを追加します。 - -78 ° C で 15 分間反応混合物をかき混ぜる
- -55 ° C に反応混合物を熱し、4 に 8 時間この温度で残します。
- (Enolonium 種の準備で使用される有機溶剤の半分の量) 反応混合物に水を追加します。
- 三度ジクロロ メタンで抽出します。通常、0.5-2 各抽出で 2-3 回反応体積を使用モル小規模。
- 塩水で 2 回した有機層を洗ってください。通常、複合反応ボリュームとして塩水の同じボリュームを使用します。
- 30 分間、無水硫酸ナトリウムで抽出物を乾燥させます。
- 硫酸ナトリウムをフィルター処理します。
- ロータリーエバポレーター 40 ° C、減圧下での溶媒を除去します。
- ヘキサン及び酢酸エチルの溶離液を使用して、溶剤を除去した後、純粋な対応する α-アゾール系ケトンを余裕するシリカゲル カラムクロマトグラフィーにより粗製品を浄化します。
- -78 ° c の enolonium 種の調製した溶液、アゾール系を追加 (4 に 5 当量, 1 mol/L) 滴ファッションにジクロロ メタン 5 mL に溶解しました。0.5 - 2 モルのスケール、また 5 分以上は満足。
- アリル化、crotylation、cinnamylation、およびプレニル化アリル シランを使用して
- きちんとしたアリル、クロチル、シンナミル、追加またはプレニル トリメチルシラン (2 当量)-78 ° C でゆっくりと-55 ° C 以下の温度のまま、速度でこのソリューションを追加します。0.5 - 2 モルのスケール、加えて 2-3 分以上は満足。
- -78 ° C で 10 分間反応混合物をかき混ぜる
- ゆっくりと室温に冷却槽を外して暖かいに反応混合物を許可します。20 分間室温で反応を残します。
- (ジクロロ メタン enolonium 種の準備で使用されるの半分の量) 反応混合物に水を追加します。
- 三度ジクロロ メタンで抽出します。通常、0.5-2 各抽出で 2-3 回反応体積を使用モル小規模。
- 塩水で 2 回した有機層を洗ってください。通常、複合反応ボリュームとして塩水の同じボリュームを使用します。
- 30 分間、無水硫酸ナトリウムで抽出物を乾燥させます。
- 硫酸ナトリウムをフィルター処理します。
- ロータリーエバポレーター 40 ° C、減圧下での溶媒を除去します。
- ヘキサン及び酢酸エチルの溶離液を使用して、溶剤を除去した後、純粋な対応する α-アリル製品を買う余裕するシリカゲル カラムクロマトグラフィーにより粗製品を浄化します。
- Arylation
メモ: arylation、使用して BF3OEt2等価な 3 enolonium 種の準備の間に主要な側面の反作用として enolonium 種の tosylation を避けるために。一般に、芳香族基質のみ 1.6 相当が必要です。ただし、芳香族基質、pyrane、チオフェン、またはピロール、最良の結果を芳香族基質の 5 の同等を使用して達成されています。- 準備された enolonium の溶液に種は乾燥ジクロロ メタン芳香族基質のソリューションを追加 (1.6 当量、0.5 mol/L) 滴下方法で。-55 ° C 以下の温度のまま、速度でこのソリューションを追加します。0.5 - 2 モル スケール添加 5-10 分以上は満足。
- 芳香族基質の添加が完了後、-55 ° C への混合物の温度を上げるし、20 分間この温度で混合物を残します。
- (ジクロロ メタン enolonium 種の準備で使用されるの半分の量) 反応混合物に水を追加します。
- 三度ジクロロ メタンで抽出します。通常、0.5-2 各抽出で 2-3 回反応体積を使用モル小規模。
- 塩水で 2 回した有機層を洗ってください。通常、複合反応ボリュームとして塩水の同じボリュームを使用します。
- 30 分間、無水硫酸ナトリウムで抽出物を乾燥させます。
- 硫酸ナトリウムをフィルター処理します。
- ロータリーエバポレーター 40 ° C、減圧下での溶媒を除去します。
- ヘキサン及び酢酸エチルの溶離液を使用して、溶剤を除去した後、純粋な対応する α-arylated のケトンを余裕するシリカゲル カラムクロマトグラフィーにより粗製品を浄化します。
結果
代表的な成果、次のプロトコルは、図 1に与えられているし、ディスカッション セクションで論議されます。特に、異なるケトンの非常に大きい範囲が正常に使用する反応のアジド11の見られるかもしれないように、良好な収率で、製品を提供します。ケトンの α 位のアゾールを導入するための反応の範囲には、ほとんど一般的なモノラル繰返し二環式窒素複素環化合物を含むにはが含まれます。アリル化のプロシージャのスコープには、両方アリル, クロチル, プレニル トリメチルシラン6が含まれています。のみ cinnamylation は、わずかに異なる条件を必要とします。BF3、3 の同等物の使用同様に C arylation のために必要な条件、結果を与える最適なこの場合。C arylation プロシージャは、インドール、電子豊富なベンゼン誘導体です。チオフェン、フラン、ピロールも良い基板ですが、製品が若干低い利回り9で分離されます。我々 は手順に正確に従ってください注意した限り、0.5 モルから、利回りは重要な変化とトリメチルシリル エノラートの 2 モルまでのスケールで手順をテストしています。このスケールのカラム ・ クロマトグラフィは 15 cm の高さ (長さ) でさまざまな商業ソースから標準シリカゲル 60 を使用して直径 2 cm のガラスカラムに行われます。TLC の示される溶剤もクロマトグラフィー用溶媒です。
例:
塩素化反応(2-chloro-1-phenylethan-1-one の合成)。
1-フェニル-1-trimethylsiloxyethylene (239 mg、1.24 モル) 説明プロトコルに従っての塩素化は、無色の固体として 2 chloroacetophenone12 (146 mg, 76%) を与えられます。化合物のキャラクタリゼーション データは次のとおり: Rf = 0.4 (1:9 v/v エチル/ヘキサン);1H NMR (400 MHz、CDCl3) δ 7.97 (d、J = 7.2 Hz、2 H)、7.61 (t、J = 7.2 Hz、1 H)、7.51 (t、J = 7.2 Hz、2 H)、4.72 (s, 2 H);13C NMR (101 MHz、CDCl3) δ 191.2、46.2, 128.6 129.0 134.1 134.3。
アジド(2-Azido-1-(4-fluorophenyl)ethan-1-one) の合成。
1-(4-フルオロフェニル) のアジド化ビニール) オキシ) (150 mg、0.71 モル) トリメチルシラン アジド化、製品13 (98 mg, 77%) として白色固体を与えるためのプロトコルに従って行われました。化合物のキャラクタリゼーション データは次のとおり: Rf = 0.5 (1:20 v/v エチル/ヘキサン);1H NMR (400 MHz、CDCl3) δ 8.01 7.88 (m, 2 H) 7.23 7.12 (m, 2 H)、4.53 (s, 2 H);13C NMR (101 MHz、CDCl3) δ 192.9、167.5 (d、J 256.7 Hz =) 132.1、(d、J = 3.1 Hz) 131.95、(d、J = 9.5 Hz)、129.7 (d、J 106.6 Hz =) 117.5、(d、J = 22.1 Hz) 56.0。
アゾールの追加(1-Phenyl-2-(1H-tetrazol-1-yl)ethan-1-one) の合成。
トリメチル ((1-phenylvinyl) 酸素) シラン (300 mg、1.56 モル) が白色固体としてテトラゾール系化合物製品 (229 mg, 78%) を与えるための添加のとおりの 1 H-テトラゾール (4.9 当量、17 mL、0.45 M、7.65 ミリ モル) と相まってだった。化合物のキャラクタリゼーション データは次のとおり: Rf = 0.3 (1:1 v/v エチル/ヘキサン);mp 122-124 ° C;赤外: Ѵmax 3141, 2936, 2869, 2115, 1695、1596、1449、1351, 1228、1173 cm-1;1H NMR (400 MHz、CDCl3): δ (s, 1 H)、886万 7.99 (dd、J = 8.5 1.2 Hz 2 H)、7.70 (tt、J = 7.5 2.9 Hz、1 H)、7.56 (t、J = 7.8 Hz、2 H)、5.98 (s, 2 H);13C NMR (101 MHz、CDCl3): δ 189.0、144.2、135.2、133.5、129.5, 128.3 53.5;C9H9N4O 189.0776 [M + H]+; HRMS (ESI +): m/z calcd189.0745 を発見しました。
アリル化(3,3-dimethyl-1-phenylpent-4-en-1-one の合成)。
1-フェニル-1-trimethylsiloxyethylene (99 mg, 0.517 mmol) のプレニル化は、製品14 (73 mg、75% の利回り) 無色油状物として余裕がプロトコルに従って行われました。化合物のキャラクタリゼーション データは次のとおり: Rf = 0.3 (1:20 v/v エチル/ヘキサン);1H NMR (400 MHz、CDCl3) 784万 (d、J = 7.2, 2 H) $7.45、(t、J = 1 H 7.3)、7.36 (t、J = 7.6, 2 H)、5.94 5.84 (m、J = 17.4, 10.7, 1 H)、4.92 4.81 (m、J = 14.1、11.6、0.8、2 H)、2.89 (s, 2 H)、1.10 (s、6 H);13C NMR (101 MHz、CDCl3) 13C NMR (101 MHz、CDCl3) δ 199.48、147.43、138.37、132.76、128.47、128.25、110.57、49.17、36.73、27.30。
Arylation(4-Methoxyphenyl)-2-(2-methyl-1H-indol-3-yl)propan-1-one) の合成
合成が実施された (200 mg, 0.846 mmol) の 1-(4-methoxyphenyl)prop-1-en-1-yl)oxy)trimethylsilane の arylation の 2-メチル-1 H-インドール (1.5 と同等) を使用して、無色の固体として製品 (205 mg, 83%) を与えます。化合物のキャラクタリゼーション データは次のとおり: Rf: 0.2 (1:5 v/v、EtOAc/ペットボトル エーテル)IR (cm-1): 3377, 吉田 2967, 1739、1595, 1458, 1362, 1208, 837;1H NMR: (400 MHz、CDCl3) δ 7.91 (dt は、J = 9.1、2.8 Hz、2 H)、7.80 (英国 s.、1 H) 7.64 (m, 1 H)、7.20 (m, 1 H)、7.09 (dt、J = 9.1 4.1 Hz、2 H)、6.74 (dt は、J = 9.1、2.8 Hz、2 H) 4.76、(q、J 6.9 Hz、1 H =)、3.73 (s、3 H)、(s, 3 H) 2.33、1.54 (d、J = 6.9 Hz、3 H)。13C NMR: (101 MHz、CDCl3) δ 199.3 162.9 比は 135.1、131.0、130.5、129.7, 127.3、121.1、119.6、118.1、111.6、されて 111.4、110.3、55.2、38.7, 16.9, 12.0;HRMS (ESI +): C19H20m/z calcd2 294.1494 [M + H] +;294.1490 を発見しました。
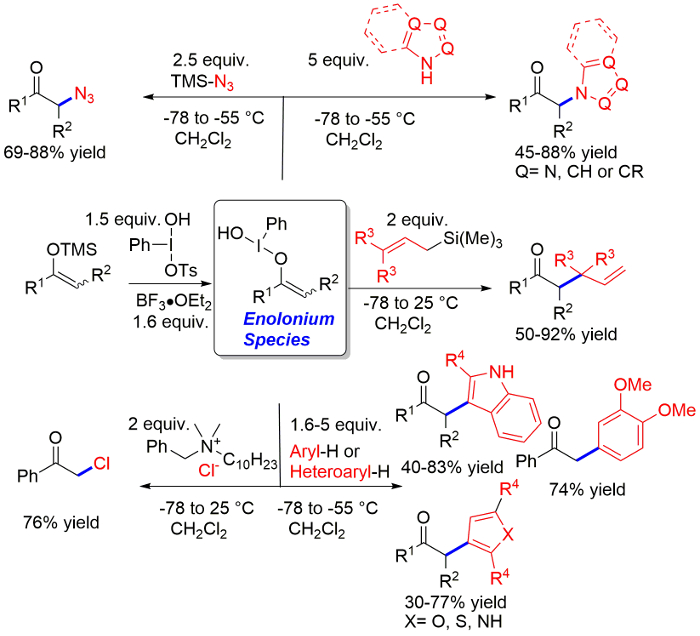
図 1: アゾール、アリル化、arylation プロトコルと塩素処理、アジド化、アミノ化反応を使用して達成可能収量を示す代表的な結果。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
TMS レート産 enolonium 種の成功の準備はいくつかの要因に依存しています。準備の手順で主要な側の反応は、TMS エノラートの分子で形成された enolonium 種の分子との反応によって原料のホモ結合です。したがって、反応条件の要件は二量体化の率を基準にして追加された TMS エノラートとルイス酸活性化超原子価ヨウ素試薬の高速反応させるこの二量化を避けるためです。これはアクティブにして可 Koser 試薬の化学量論組成の BF3を使用してプロトコルで実現されます。Koser 試薬を含む多くの超原子価ヨウ素試薬はある有機溶剤の溶解性が悪い。三フッ化ホウ素の役割、ダブルです。まず第一に、おそらくトシル基のグループと、そのリガンドの 1 つ残してグループの能力を高めることによって Koser 試薬の反応性を強化します。これにより TMS enolether と高速反応です。第二に、活性の Koser 試薬は特に unactivated Koser 試薬に対して非常に溶けるです。それは TMS enolether を追加する前にすべての試薬の溶解していることを確認することが欠かせません。反応の成功を確保するために小さな過剰試薬が必要です。注目されるプロトコルは、1.5 同等物各 Koser の試薬と三フッ化ホウ素を使用します。この量は初めてのユーザーのために望ましいです。しかし、反応が均等に実施されるルイス酸の超原子価ヨウ素としてはほとんど 1.2 同等と正常に。手順に正確に従ってください注意した限り、我々 は通常 0.5 を 2 モル収量、重要な変化を除くトリメチルシリル エノラートのスケールで記述されていたプロトコルを行った。
もう一つの重要なパラメーターとして避けるために反応混合物の地域地球温暖化だけでなく TMS enolether の両方低濃度を確保するために反応する TMS enolether の遅い付加であります。指摘のスケールでまた 2 10 分以上は通常十分であるか加算にかかる時間の 5 分が 1 モルの縮尺で使用されます。しかし、ケトンのエノラートのホモ結合を観察すると、活性 Koser 試薬添加時間が長くして TMS enolether のあまりにも急激な付加からこの可能性が高い茎が使用必要があります。大規模な反応 TMS enolether の事前冷却ソリューションを使用することをお勧めします。Β - ケトエステルの TMS-enolether を使用する必要はありません、これらの enolonium 種はないホモのカップルとして追加のいずれかに時間と温度の予防策を講じる必要はありません。さらに、β - ケトエステルの反応ははるかに遅い、したがって室温で実施することができます。Β - ケトエステルのリチウム レートは、反応率を高めるために使えます。アセトンの TMS enolether はホモ結合この妨害されていない化合物は非常に急速なとして良い基板ではありません。
プロトコルはさまざまな電子を引き出す、電子供与基同様と置換芳香族アルキル ケトンの成功です。ジアルキル ケトン反応また動作します。特に、共役二重結合を含むレートが反応に成功した基板です。ただし、α, α-二ケトンしばしば失敗する求核付加反応後続の手順で競合反応による比較的妨げられていないトシル基陰イオンが求核基の立体障害の場合。Α Tosyloxy ケトンは、多くの反応でマイナーな副産物として観察されます。
Enolonium 種の調製した溶液は −78 ° C で 30 分間以上安定プロトコルの 2 番目のステップで反応求核剤が追加されます。求核試薬の広い範囲は Koser 試薬やルイス酸 Koser 試薬と反応があると求核剤を含む enolonium 種と互換性があります。したがって、酸化しやすい基板を可能性があります塩化物またはアジ化物の陰イオンのような両方の伝統的な求核試薬を使用可能性があります。特に、アリル シランは反応で正常に動作します。置換アリル シランとの反応の 2 つ目の顕著な特徴は、アリル シランのターミナルの位置に結合形成と完全な位置選択性です。したがって、プレニル シランを使用すると、記述のプロトコルのように第四センターが形成されます。芳香族とヘテロ芳香族基質も使えます。驚くことに、1 つ以上の窒素と窒素を窒素反応のない置換基を持つ芳香を含窒素。対照的に、ピロールやインドール、炭素のみで反応します。攻撃の位置はフリーデル工芸品のこれらの基質の反応性によって予測された入力反応。これらの反応は、C-H 官能基化反応を構成し、古典的な遷移金属触媒によるカップリング反応のようにハロゲン化芳香族化合物の必要性を未然に防ぐ。スコープは電子豊富な芳香族化合物に限定: インドールやピロール、フラン、チオフェン、電子豊富なベンゼン誘導体。電子豊富な芳香族化合物は、enolonium 種ではなくホモ結合と、他の反応につながる超原子価ヨウ素によって酸化を受ける傾向にあることに注目すべきです。ほとんどの場合より貴重な材料は反応に使用可能性がありますので、基板は 1.6 相当が必要です。余分な芳香族基質を分離することが。置換ピロールの場合にのみ、および furanes 推奨 5 同等の使用であります。
したがって、このプロトコルでここで報告は不活性、伝統的な求核剤として求核剤も相性が伝統的な反応のプロトコルの使用をできます。適切な求核剤のリストは、将来的に拡大する確かにいきます。
開示事項
何を開示する必要があります。
謝辞
アリエル大学と ISF 個別研究助成から創業助成金 (1914/15) AMS には感謝して承諾します。
資料
| Name | Company | Catalog Number | Comments |
| Chlorotrimethylsilane, 98+% | Alfa Aesar | A13651 | TMS-Cl |
| Boron trifluoride diethyl etherate, 98+% | Alfa Aesar | A15275 | BF3*Et2O |
| 2-Methylindole, 98+% | Alfa Aesar | A10764 | 2-Me-indole |
| Hydroxy(tosyloxy) iodobenzene, 97% | Alfa Aesar | L15701 | Koser's reagent |
| Acetophenone, >98% | Merck | 800028 | |
| n-Butyllithium solution 1.6M in hexanes | Aldrich | 186171 | nBuLi |
| BIS(ISOPROPYL)AMINE | Apollo | OR1090 | DIPA |
| Trimethylsilyl azide, 94% | Alfa Aesar | L00173 | TMS-N3 |
参考文献
- Mizar, P., Wirth, T. Flexible stereoselective functionalizations of ketones through umpolung with hypervalent iodine reagents. Angewandte Chemie International Edition. 53 (23), 5993-5997 (2014).
- Yoshimura, A., Zhdankin, V. V. Advances in synthetic applications of hypervalent iodine compounds. Chemical Reviews. 116 (5), 3328-3435 (2016).
- Zhdankin, V. V. . Hypervalent Iodine Chemistry: Preparation, Structure, and Synthetic Applications of Polyvalent Iodine Compounds. , (2013).
- Wirth, T. . Topics in Current Chemistry. 373, (2016).
- Merritt, E. A., Olofsson, B. α-functionalization of carbonyl compounds using hypervalent iodine reagents. Synthesis. 4 (4), 517-538 (2011).
- Arava, S., et al. Enolonium Species-Umpoled Enolates. Angewandte Chemie International Edition. 56 (10), 2599-2603 (2017).
- Parida, K. N., Maksymenko, S., Pathe, G. K., Szpilman, A. M. Cross-Coupling of Dissimilar Ketone Enolates via Enolonium Species to afford Nonsymmetrical 1,4-Diketones. Beilstein Journal of Organic Chemistry. 14, 992-997 (2018).
- Zhdankin, V. V., et al. Carbon-carbon bond formation in reactions of PhIO·HBF4-silyl enol ether adduct with alkenes or silyl enol ethers. Journal of Organic Chemistry. 54 (11), 2605-2608 (1989).
- Maksymenko, S., et al. Transition-metal-free intermolecular α-arylation of ketones via enolonium species. Organic Letters. 19 (23), 6312-6315 (2017).
- Vita, M. V., Waser, J. Azidation of β-keto esters and silyl enol ethers with a benziodoxole reagent. Organic Letters. 15 (13), 3246-3249 (2013).
- More, A., et al. α-N-Heteroarylation and α-azidation of ketones via enolonium species. Journal of Organic Chemistry. 83, 2442-2447 (2018).
- Xie, L., et al. Gold-catalyzed hydration of haloalkynes to α-halomethyl ketones. Journal of Organic Chemistry. 78 (18), 9190-9195 (2013).
- Patonay, T., Juhász-Tóth, &. #. 2. 0. 1. ;., Bényei, A. Base-induced coupling of α-azido ketones with aldehydes − An easy and efficient route to trifunctionalized synthons 2-azido-3-hydroxy ketones, 2-acylaziridines, and 2-acylspiroaziridines. European Journal of Organic Chemistry. 2002 (2), 285-295 (2002).
- Li, C., Breit, B. Rhodium-catalyzed chemo- and regioselective decarboxylative addition of β-ketoacids to allenes: Efficient construction of tertiary and quaternary carbon Centers. Journal of the American Chemical Society. 136 (3), 862-865 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved