Method Article
Un protocollo in due fasi per Umpolung funzionalizzazione di chetoni Via Enolonium le specie
In questo articolo
Riepilogo
Un protocollo di uno-pentola due tappe per il umpolung di enolati chetone enolonium specie e l'aggiunta di un nucleofilo nella α-posizione è descritto. Nucleofili includono cloruro, azoturo, azoli, allil-silani e composti aromatici.
Abstract
Α-funzionalizzazione di chetoni via umpolung di enolati di reagenti di iodio ipervalente è un concetto importante in chimica organica sintetica. Recentemente, abbiamo sviluppato una strategia in due fasi per chetone enolato umpolung che ha permesso lo sviluppo di metodi per la clorazione, azidation e amminazione utilizzando azoli. Inoltre, abbiamo sviluppato C-C bond – formando reazioni di arilazione e allilazioni. Nel cuore di questi metodi è la preparazione della specie enolonium intermedi e altamente reattivo prima dell'aggiunta di un reattivo nucleofilo. Questa strategia è così ricorda la preparazione e l'uso di metallo enolati in chimica sintetica classica. Questa strategia consente l'utilizzo di nucleofili che altrimenti sarebbe incompatibile con i reagenti di iodio ipervalente fortemente ossidanti. In questa carta presentiamo un protocollo dettagliato per la clorazione, azidation, N-heteroarylation, arilazione e allilazioni. I prodotti includono motivi prevalente nei prodotti medicinale attivi. In questo articolo gli altri sarà di grande aiuto nell'uso di questi metodi.
Introduzione
Enolati sono nucleofili classico carbonio in chimica organica e tra i più ampiamente utilizzati. Umpolung di enolati per creare specie elettrofile enolonium permette importanti modi alternativi per produrre chetoni α-funzionalizzati, nonché per consentire nuove reazioni non possibile tramite chimica classica enolato. Specie di Enolonium sono stati proposti come prodotti intermedi in numerose reazioni, in particolare reazioni che coinvolgono i reagenti di iodio ipervalente. Queste reazioni includono α-alogenazione, ossigenazione e amminazione1 , come pure altre reazioni2,3,4,5.
Tuttavia, gli ambiti di queste reazioni erano sempre limitati dalla natura transitoria della specie reattiva enolonium. Questa transitorietà necessaria qualsiasi nucleofilo ad essere presenti nella miscela di reazione durante la reazione degli enolati carbonile con il reagente di iodio ipervalente fortemente ossidanti. Così, qualsiasi nucleofilo incline all'ossidazione, come composti aromatici ricchi di elettroni (eterocicli) e alcheni, non poteva essere utilizzato.
Nell'ultimo anno, abbiamo superato queste limitazioni di circostanze in cui le specie di enolonium sono formata come un discreto intermedio in un unico passaggio, seguito dalla aggiunta di nucleofilo in una seconda fase di sviluppo. Questo protocollo permette non solo il tipo classico di funzionalizzazione ad esempio clorazione6, ma anche l'uso di nucleofili al carbonio ossidabili, come allylsilanes6,8, enolati1,6, 7ed elettrone ricca di composti aromatici9, con conseguente formazione di legami C-C. Il metodo allilazioni è favorevole alla formazione di centri di terziari e quaternari. Il metodo di arilazione chetone costituisce formale funzionalizzazione di C-H del composto senza l'esigenza di un gruppo dirigente9l'aromatico. Recentemente, abbiamo segnalato l'aggiunta di azoli e azidi10 come ben11. La presentazione dettagliata del protocollo è previsto per facilitare l'introduzione di questi metodi nella cassetta degli attrezzi di giorno in giorno del chimico organico sintetico.
Protocollo
1. preparazione della specie Enolonium
Attenzione: Prima di effettuare il protocollo, consultare la scheda di sicurezza per tutti i reagenti e solventi.
Nota: Tutti i nuovi reagenti sono stati utilizzati come ricevuto dall'origine commerciale. Se il etherate del trifluoruro di boro è stato archiviato, distillare prima dell'uso.
- In un luogo asciutto tondo pallone a fondo dotato di un setto e un magnete per agitazione magnetica, aggiungere il reagente di Koser (1.5 equiv.) e lavare il matraccio con azoto o argon.
- Aggiungere diclorometano asciutto per dare una sospensione di 0,234 mol/L di concentrazione formale.
- Raffreddare la sospensione a-78 ° C utilizzando un bagno di ghiaccio secco/acetone o un strumento/acetone bagno dito freddo.
- Aggiungere ordinata BF3OEt2 (1.5 equiv.) lentamente.
- Riscaldare la miscela eterogenea a temperatura ambiente fino alla formazione della soluzione di colore giallo. In genere, questo accade entro 5 min.
- Raffreddare la soluzione a-78 ° C.
- Alla soluzione raffreddata, aggiungere il trimetilsilile-enolether (1 equiv., 0,313 mol/L) in asciutto diclorometano goccia a goccia oltre il 2-10 min (a seconda della scala). Dopo l'aggiunta di etere enol Silile è completa, la formazione delle specie enolonium è completa.
Nota: La soluzione di enolonium specie può essere lasciata a-78 ° C per almeno 30 min senza deterioramento nella resa. La specie enolonium è stabile durante questo tempo, come indicato da segnalati NMR studi6.
2. funzionalizzazione della specie Enolonium
- Clorazione con l'anione cloruro
- Per la soluzione preparata di specie enolonium, aggiungere cloruro di benzil-dimetil-decylammonium (2.0 equiv., 1,25 mol/L) in diclorometano asciutto in un modo saggio di goccia. Aggiungere questa soluzione a una velocità tale che la temperatura rimane sotto-55 ° C. Al 0,5-2 scala mmol, aggiunta oltre 5 min è soddisfacente.
- Lasciare la miscela di reazione a-78 ° C per 5 min.
- Rimuovere il bagno di raffreddamento e lasciare che la miscela di reazione raggiunga la temperatura ambiente.
- Lasciare la reazione a temperatura ambiente per 20 min.
- Aggiungere acqua alla miscela di reazione (la metà del volume del diclorometano utilizzato nella preparazione delle specie enolonium).
- Estrarre tre volte con diclorometano. In genere, utilizzare il volume di reazione di 2 - 3 volte in ogni estrazione al 0,5-2 mmol su piccola scala.
- Lavare gli strati organici combinati due volte con salamoia. In genere, è possibile utilizzare lo stesso volume di salamoia come il volume di reazione combinata.
- Asciutto con solfato di sodio anidro per 30 min.
- Filtrare fuori il solfato di sodio (ad esempio tramite una spina di Celite).
- Rimuovere il solvente su un evaporatore rotante a pressione ridotta e a 40 ° C.
- Purificare il prodotto grezzo da cromatografia a colonna su gel di silice utilizzando eluenti esano e acetato di etile per permettersi, dopo la rimozione dei solventi, il puro corrispondente α-azido chetone.
Nota: Alle scale di 0,5 mmol a 2 mmol di trimetilsilile enolato, eseguire cromatografia a colonna su una colonna di vetro del diametro di 2 cm utilizzando standard del gel di silice 60 ad un'altezza (lunghezza) di 15 cm. Il volume dovrà essere variata per altre scale.
- Azidation con TMS-Azide
Attenzione: Azidi organiche in generale sono esplosivi e cura dovrebbe essere presa nella gestione e preparazione dei prodotti. TMS-azide è tossica. Consultare MSDS prima dell'uso.- Per la soluzione preparata di specie enolonium a-78 ° C, aggiungere azidotrimethylsilane pulito (2.5 equiv.) in modo goccia a goccia. Aggiungere questa soluzione ad un tasso in modo che la temperatura rimane sotto-55 ° C. Al 0,5-2 scala mmol, aggiunta oltre 2-3 min è soddisfacente.
- Mescolare la miscela di reazione per 15 min a-78 ° C.
- Riscaldare la miscela di reazione a-55 ° C e lasciare a questa temperatura per 2 o 3 h.
- Aggiungere acqua alla miscela di reazione (la metà del volume del diclorometano utilizzato nella preparazione delle specie enolonium).
- Estrarre tre volte con diclorometano. In genere, utilizzare il volume di reazione di 2 - 3 volte in ogni estrazione al 0,5-2 mmol su piccola scala.
- Lavare gli strati organici combinati due volte con salamoia. In genere, è possibile utilizzare lo stesso volume di salamoia come il volume di reazione combinata.
- Asciugare gli estratti con solfato di sodio anidro per 30 min.
- Filtrare fuori il solfato di sodio.
- Rimuovere il solvente su un evaporatore rotante a pressione ridotta e a 40 ° C.
- Purificare il prodotto grezzo da cromatografia a colonna su gel di silice utilizzando eluenti esano e acetato di etile per permettersi, dopo la rimozione dei solventi, il puro corrispondente α-azido chetone.
- Reazione con azoli
- Per la soluzione preparata di specie enolonium a-78 ° C, aggiungere azolici (4 o 5 equiv., 1 mol/L) disciolto in 5 mL di diclorometano in modo goccia a goccia. Al 0,5-2 scala mmol, aggiunta oltre 5 min è soddisfacente.
Nota: Nel caso di azoli scarsamente solubili quali tetrazoles, utilizzare acetonitrile ad una concentrazione di 0,5 mol/L invece di diclorometano. Aggiungere questa soluzione ad un tasso in modo che la temperatura rimane sotto-55 ° C. - Mescolare la miscela di reazione per 15 min a-78 ° C.
- Riscaldare la miscela di reazione a-55 ° C e lasciare a questa temperatura per 4-8 h.
- Aggiungere acqua alla miscela di reazione (la metà del volume di solventi organici utilizzati nella preparazione delle specie enolonium).
- Estrarre tre volte con diclorometano. In genere, utilizzare il volume di reazione di 2 - 3 volte in ogni estrazione al 0,5-2 mmol su piccola scala.
- Lavare gli strati organici combinati due volte con salamoia. In genere, è possibile utilizzare lo stesso volume di salamoia come il volume di reazione combinata.
- Asciugare gli estratti con solfato di sodio anidro per 30 min.
- Filtrare fuori il solfato di sodio.
- Rimuovere il solvente su un evaporatore rotante a pressione ridotta e a 40 ° C.
- Purificare il prodotto grezzo da cromatografia a colonna su gel di silice utilizzando eluenti esano e acetato di etile per permettersi, dopo la rimozione dei solventi, il chetone puro corrispondente α-azolici.
- Per la soluzione preparata di specie enolonium a-78 ° C, aggiungere azolici (4 o 5 equiv., 1 mol/L) disciolto in 5 mL di diclorometano in modo goccia a goccia. Al 0,5-2 scala mmol, aggiunta oltre 5 min è soddisfacente.
- Allilazioni, crotylation, cinnamylation e prenilazione con allil-silani
- Aggiungere neat allile,-, crotile-, cinnamil-, o prenyl-trimethylsilane (2 equiv.) lentamente a-78 ° C. Aggiungere questa soluzione ad un tasso in modo che la temperatura rimane sotto-55 ° C. Presso un 0,5-2 scala mmol, aggiunta oltre 2-3 min è soddisfacente.
- Mescolare la miscela di reazione per 10 min a-78 ° C.
- Lasciare che la miscela di reazione scaldare lentamente a temperatura ambiente, eliminando il bagno di raffreddamento. Lasciare la reazione a temperatura ambiente per 20 min.
- Aggiungere acqua alla miscela di reazione (la metà del volume del diclorometano utilizzato nella preparazione delle specie enolonium).
- Estrarre tre volte con diclorometano. In genere, utilizzare il volume di reazione di 2 - 3 volte in ogni estrazione al 0,5-2 mmol su piccola scala.
- Lavare gli strati organici combinati due volte con salamoia. In genere, è possibile utilizzare lo stesso volume di salamoia come il volume di reazione combinata.
- Asciugare gli estratti con solfato di sodio anidro per 30 min.
- Filtrare fuori il solfato di sodio.
- Rimuovere il solvente su un evaporatore rotante a pressione ridotta e a 40 ° C.
- Purificare il prodotto grezzo da cromatografia a colonna su gel di silice utilizzando eluenti esano e acetato di etile per permettersi, dopo la rimozione dei solventi, il prodotto puro corrispondente α-allilico.
- Arilazione
Nota: Per arilazione, utilizzare 3 equivalenti di BF3OEt2 durante la preparazione della specie enolonium al fine di evitare tosylation della specie enolonium come una reazione collaterale principali. In generale, è necessario solo 1,6 equivalente del substrato aromatico. Tuttavia, se il substrato aromatico è un pyrane, tiofene o pirrolo, i migliori risultati si ottengono utilizzando 5 equivalenti del substrato aromatico.- Per la soluzione di preparati enolonium specie aggiungere una soluzione di substrato aromatico in diclorometano asciutto (1.6 equiv., 0,5 mol/L) in un modo goccia a goccia. Aggiungere questa soluzione ad un tasso in modo che la temperatura rimane sotto-55 ° C. Al 0,5-2 scala mmol, aggiunta oltre 5-10 min è soddisfacente.
- Dopo aver completato l'aggiunta del substrato aromatico, aumentare la temperatura della miscela di-55 ° C e lasciare la miscela a questa temperatura per 20 min.
- Aggiungere acqua alla miscela di reazione (la metà del volume del diclorometano utilizzato nella preparazione delle specie enolonium).
- Estrarre tre volte con diclorometano. In genere, utilizzare il volume di reazione di 2 - 3 volte in ogni estrazione al 0,5-2 mmol su piccola scala.
- Lavare gli strati organici combinati due volte con salamoia. In genere, è possibile utilizzare lo stesso volume di salamoia come il volume di reazione combinata.
- Asciugare gli estratti con solfato di sodio anidro per 30 min.
- Filtrare fuori il solfato di sodio.
- Rimuovere il solvente su un evaporatore rotante a pressione ridotta e a 40 ° C.
- Purificare il prodotto grezzo da cromatografia a colonna su gel di silice utilizzando eluenti esano e acetato di etile per permettersi, dopo la rimozione dei solventi, il chetone puro corrispondente α-arylated.
Risultati
Risultati rappresentativi, realizzati seguendo il protocollo, sono riportati nella Figura 1 e sono discussi nella sezione discussione. In particolare, una gamma molto ampia di chetoni differenti può essere utilizzata con successo nella reazione per dare i prodotti in buone rese come può essere visto per la azidation11. L'ambito della reazione per l'introduzione di azoli nella α-posizione di chetoni include la maggior parte dell'azoto mono-ciclico e biciclico comune contenenti eterocicli. La portata della procedura allilazioni comprende sia allile-, crotile - e prenyl-trimethylsilane6. Solo cinnamylation richiede condizioni leggermente diverse. L'uso di 3 equivalenti di BF3, analogamente alle condizioni necessarie per C-arilazione, dà ottimi risultati in questo caso. La procedura C-arilazione funziona per entrambi gli indoli e derivati del benzene elettrone-ricchi. Tiofene, furane e pirroli sono anche buoni substrati, ma i prodotti sono isolati in leggermente più bassi rendimenti9. Abbiamo testato la procedura in una scala da 0,5 mmol a 2 mmol di trimetilsilile enolato con nessuna variazione significativa nel rendimento, fino a quando la cura è stata presa a seguire esattamente la procedura. A questa scala, cromatografia a colonna avviene su una colonna di vetro del diametro di 2 cm utilizzando standard del gel di silice 60 da diverse fonti commerciali ad un'altezza (lunghezza) di 15 cm. Il solvente indicato per TLC è anche il solvente utilizzato per la cromatografia.
Esempi:
Clorazione (sintesi di 2-chloro-1-phenylethan-1-one).
La clorazione di 1-fenil-1-trimethylsiloxyethylene (239 mg, 1,24 mmol) secondo il protocollo descritto è permesso 2-chloroacetophenone12 (146 mg, 76%) come un solido incolore. I dati di caratterizzazione per il composto erano come segue: Rf = 0.4 (1:9 v/v EtOAc/esano); 1 H NMR (400 MHz, CDCl3) δ 7.97 (s, J = 7,2 Hz, 2h), 7.61 (t, J = 7,2 Hz, 1h), 7.51 (t, J = 7,2 Hz, 2h), 4.72 (s, H 2); 13 C NMR (101 MHz, CDCl3) δ 191,2, 134.3 134.1, 129.0, 128,6, 46.2.
Azidation (sintesi di 2-Azido-1-(4-fluorophenyl)ethan-1-one).
Azidation di 1-(4-fluorophenyl) vinile) ossi) trimethylsilane (150 mg, 0.71 mmol) è stato effettuato secondo il protocollo per azidation dare il prodotto13 (98 mg, 77%) come solido bianco. I dati di caratterizzazione per il composto erano come segue: Rf = 0.5 (01:20 v/v EtOAc/esano); 1 H NMR (400 MHz, CDCl3) δ 8.01-7,88 (m, H 2), 7,23-7.12 (m, H 2), 4,53 (s, 2h); 13 C NMR (101 MHz, CDCl3) δ 192,9, 167,5 (s, J = 256,7 Hz), 132,1 (s, J = 3,1 Hz), 131.95 (s, J = 9,5 Hz), 129,7 (s, J = 106,6 Hz), 117,5 (s, J = 22,1 Hz), 56,0.
Aggiunta di azoli (Sintesi di 1-Phenyl-2-(1H-tetrazol-1-yl)ethan-1-one).
Trimetil ((1-phenylvinyl) oxy) Silano (300 mg, 1,56 mmol) è stato accoppiato con 1h-tetrazolico (4,9 equiv., 17 mL, 0.45 M, 7.65 mmol) come descritto per l'aggiunta di tetrazoles per dare al prodotto (229 mg, 78%) come solido bianco. I dati di caratterizzazione per il composto erano come segue: Rf = 0.3 (1:1 v/v EtOAc/esano); MP 122-124 ° C; FT-IR: Ѵmax 3141, 2936, 2869, 2115, 1695, 1596, 1449, 1351, 1228, 1173 cm-1; 1 H NMR (400 MHz, CDCl3): δ 8,86 (s, 1h), 7.99 (dd, J = 8.5, 1,2 Hz, 2h), 7.70 (tt, J = 7.5, 2,9 Hz, 1 H), 7.56 (t, J = 7.8 Hz, 2 H), 5,98 (s, H 2); 13 C NMR (101 MHz, CDCl3): δ 189.0, 144.2, 135,2, 133,5, 129,5, 128,3, 53,5; HRMS (ESI +): m/z calcolato per C9H9N4O 189.0776 [M + H]+; trovato 189.0745.
Allilazioni (sintesi di 3,3-dimethyl-1-phenylpent-4-en-1-one).
La prenilazione di 1-fenil-1-trimethylsiloxyethylene (99 mg, 0,517 mmol) è stato effettuato secondo il protocollo di permettersi il prodotto14 (73 mg, 75% di rendimento) come un olio incolore. I dati di caratterizzazione per il composto erano come segue: Rf = 0,3 (01:20 v/v EtOAc/esano); 1 H NMR (400 MHz, CDCl3) 7,84 (s, J = 7.2, 2h), 7,45 (t, J = 7.3, 1h), 7,36 (t, J = 7.6, 2h), 5,94-5,84 (m, J = 17,4, 10.7, 1 H), 4,92-4.81 (m, J = 14,1, 11.6, 0,8, 2h), 2.89 (s, 2h), 1.10 (s, 6h); 13 C NMR (101 MHz, CDCl3) 13C NMR (101 MHz, CDCl3) δ 199.48, 147.43, 138.37, 132.76, 128.47, 128,25, 110.57, 49.17, 36.73, 27.30.
Arilazione (Sintesi di 4-Methoxyphenyl)-2-(2-methyl-1H-indol-3-yl)propan-1-one)
La sintesi è stata effettuata come descritto per arilazione di 1-(4-methoxyphenyl)prop-1-en-1-yl)oxy)trimethylsilane (200 mg, 0.846 mmol) usando 2-metil-1H-indole (1.5 equivalente) per dare al prodotto (205 mg, 83%) come un solido incolore. I dati di caratterizzazione per il composto erano come segue: Rf: 0,2 (1:5 v/v, EtOAc/PET. etere); IR (cm-1): 3377, 2967, 1739, 1595, 1458, 1362, 1208, 837; 1 H NMR: (400 MHz, CDCl3) δ 7,91 (dt, J = 9.1, 2,8 Hz, 2h), 7.80 (fr. s., 1h), 7.64 (m, 1 H), 7,20 (m, 1 H), 7,09 (dt, J = 9.1, 4,1 Hz, 2h), 6.74 (dt, J = 9.1, 2,8 Hz, 2h), 4,76 (q, J = 6,9 Hz, 1 H), 3,73 (s 3 H), 2.33 (s, 3 H), 1.54 (s, J = 6,9 Hz, 3 H). 13 C NMR: (101 MHz, CDCl3) δ 199,3 162,9, 135.1, 131,0, 130.5, 129,7, 127,3, 121.1, 119,6, 118.1, 111.6, 111.4, 110,3, 55.2, 38,7, 16,9, 12.0; HRMS (ESI +): m/z calcolato per C19H20NO2 294.1494 [M + H] +; trovato 294.1490.
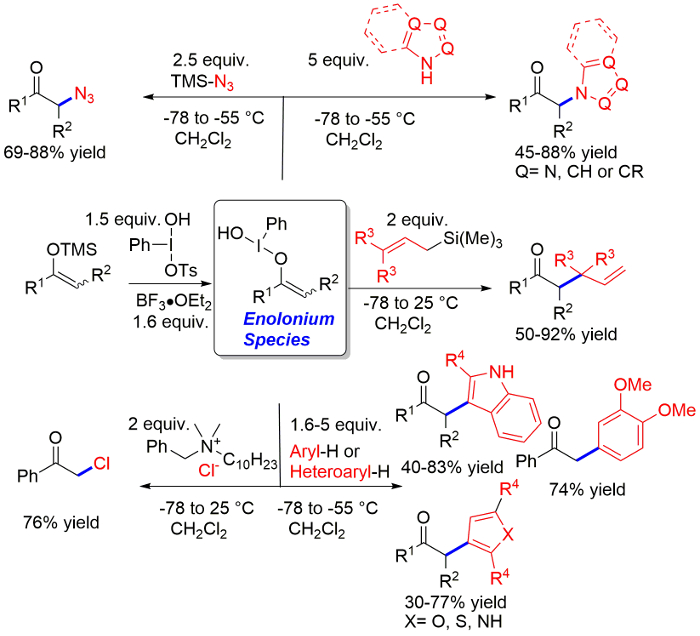
Figura 1: risultati rappresentativi mostrando i rendimenti ottenibili mediante clorazione, azidation, amminazione con azoli, allilazioni e protocolli di arilazione. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La corretta preparazione delle specie enolonium da TMS-enolati dipende da una serie di fattori. La reazione di lato principali il passaggio di preparazione è l'accoppiamento di homo della materia prima dalla reazione di una molecola di enolonium formata specie con una molecola di TMS-enolato. Pertanto, il requisito delle condizioni di reazione è di evitare questa dimerizzazione garantendo la rapida reazione del reagente di iodio ipervalente attivato acido di Lewis con aggiunto TMS-enolato rapporto al tasso di dimerizzazione. Questo avviene nel protocollo attivando e solubilizzanti il reagente Koser utilizzando stechiometrico BF3. Molti reagenti di iodio ipervalente incluso il reagente Koser hanno scarsa solubilità in solventi organici standard. Il ruolo del trifluoruro di boro è quindi doppio. Prima di tutto, aumenta la reattività del reagente Koser aumentando la capacità di gruppo lasciando di uno dei suoi ligandi, presumibilmente il gruppo di tosile. In questo modo la reazione veloce con la TMS-enolether. In secondo luogo, il reagente di Koser attivato è altamente solubile soprattutto riguardante il reagente Koser unactivated. È essenziale controllare che tutti i reagenti hanno dissolto prima di aggiungere il TMS-enolether. Al fine di assicurare la reazione di successo, un piccolo eccesso di reagente è richiesto. Il noto protocollo utilizza 1,5 equivalenti del reagente di Koser e del trifluoruro di boro. Questo importo è preferibile per la prima volta gli utenti. Tuttavia, la reazione può essere ugualmente effettuata con successo con appena 1,2 equivalenti di acido di Lewis e lo iodio ipervalente. Abbiamo effettuato i protocolli descritti al 0,5-2 mmol scale di trimetilsilile enolato con nessuna variazione significativa della resa, in genere come cura è stata presa a seguire esattamente la procedura.
Un altro parametro fondamentale è lenta aggiunta di TMS-enolether per la reazione al fine di garantire sia una bassa concentrazione di TMS-enolether così da evitare un riscaldamento locale della miscela di reazione. Presso la celebre scala, aggiunta più di 2-10 minuti è solitamente sufficiente; cinque minuti di tempo inoltre è usato a 1 mmol scala. Tuttavia, se si osserva un homo-accoppiamento del chetone enolato, questo probabilmente deriva dal troppo rapida aggiunta di TMS-enolether al attivato Koser reagente e tempi più lunghi di aggiunta deve essere utilizzato. Per una reazione su larga scala, è preferibile utilizzare una soluzione pre-raffreddata di TMS-enolether. Per gli esteri di β-cheto, non è necessario utilizzare un TMS-enolether, e non è necessario prendere uno qualsiasi dell'aggiunta precauzioni tempo e temperatura come queste specie di enolonium fanno non homo paio. Inoltre, la reazione di β-cheto estere è molto più lenta e quindi può essere effettuata a temperatura ambiente. Litio enolati di β-cheto estere possono essere utilizzato per aumentare la velocità di reazione. La TMS-enolether di acetone non è un buon substrato come homo-accoppiamento per questo composto senza ostacoli è molto rapido.
Il protocollo è successo per un'ampia varietà di chetoni di Aril-alchil sostituiti con ritiro dell'elettrone ed elettrone donando sostituenti uguali. La reazione funziona anche per dialchil chetoni. In particolare, enolati contenenti doppi legami coniugati sono substrati di successo nella reazione. Tuttavia, α, α-disostituite chetoni spesso non riescono nella fase successiva addizione nucleofila se il nucleofilo stericamente è ostacolato a causa della reazione concorrenti dall'anione di tosile relativamente indisturbata. Chetoni α-Tosyloxy sono osservati come minori sottoprodotti in molte reazioni.
La soluzione preparata di specie enolonium è stabile per almeno 30 minuti a −78 ° C. Nella seconda fase del protocollo viene aggiunto un nucleofilo reattivo. Una vasta gamma di nucleofili sono compatibili con la specie di enolonium tra cui nucleofili che avrebbero reagito con il reagente di Koser o l'acido di Lewis reagente Koser. Così, entrambi tradizionali nucleofili come anione cloruro o azoturo possono essere utilizzati come substrati facilmente ossidabili. In particolare, allil-silani lavorano con successo nella reazione. Una seconda caratteristica notevole della reazione con sostituiti allilico-silani è la regioselettività completa con formazione di legami nella posizione terminale del silano dell'allilico. Così, quando prenil silano viene utilizzato, come il protocollo descritto, si formano centri quaternari. Possono essere utilizzati anche substrati aromatici ed eteroaromatici. Notevolmente, eteroaromatici contenenti azoto con più azoto e con nessun sostituenti sull'azoto reagiscono ad azoto. Al contrario, indoli e pirroli reagiscono esclusivamente al carbonio. La posizione dell'attacco è come predetto dalla reattività di questi substrati di Friedel-Crafts tipo reazioni. Queste reazioni costituiscono la reazione di funzionalizzazione di C-H e ovviare alla necessità di substrati aromatici alogenati come reazioni di coupling catalizzata classica del metallo di transizione. L'ambito è limitato all'elettrone-ricchi composti aromatici: indoli, pirroli, furani, tiofene e benzeni ricco di elettroni. È da nota che i composti aromatici elettrone-ricchi tendono a subiscono l'ossidazione dallo iodio ipervalente, portando a homo-accoppiamento e altre reazioni, ma non da enolonium specie. Nella maggior parte dei casi, solo 1,6 equivalente del substrato è necessaria affinché più preziosi materiali possono essere utilizzati nella reazione. Il substrato aromatico in eccesso può essere isolato. Solo nel caso non sostituiti pirroli, tiofeni e furani è l'uso di 5 equivalenti consigliato.
Così, questo protocollo segnalato qui consente l'utilizzo di nucleofili inerte, tradizionale così come nucleofili incompatibile con protocolli di reazione tradizionale. L'elenco di nucleofili adatti certamente continuerà a espandere in futuro.
Divulgazioni
Non abbiamo nulla di divulgare.
Riconoscimenti
Una sovvenzione di Start-up da Ariel University e un assegno di ricerca individuale di ISF (1914/15) per AMS si ringraziano.
Materiali
| Name | Company | Catalog Number | Comments |
| Chlorotrimethylsilane, 98+% | Alfa Aesar | A13651 | TMS-Cl |
| Boron trifluoride diethyl etherate, 98+% | Alfa Aesar | A15275 | BF3*Et2O |
| 2-Methylindole, 98+% | Alfa Aesar | A10764 | 2-Me-indole |
| Hydroxy(tosyloxy) iodobenzene, 97% | Alfa Aesar | L15701 | Koser's reagent |
| Acetophenone, >98% | Merck | 800028 | |
| n-Butyllithium solution 1.6M in hexanes | Aldrich | 186171 | nBuLi |
| BIS(ISOPROPYL)AMINE | Apollo | OR1090 | DIPA |
| Trimethylsilyl azide, 94% | Alfa Aesar | L00173 | TMS-N3 |
Riferimenti
- Mizar, P., Wirth, T. Flexible stereoselective functionalizations of ketones through umpolung with hypervalent iodine reagents. Angewandte Chemie International Edition. 53 (23), 5993-5997 (2014).
- Yoshimura, A., Zhdankin, V. V. Advances in synthetic applications of hypervalent iodine compounds. Chemical Reviews. 116 (5), 3328-3435 (2016).
- Zhdankin, V. V. . Hypervalent Iodine Chemistry: Preparation, Structure, and Synthetic Applications of Polyvalent Iodine Compounds. , (2013).
- Wirth, T. . Topics in Current Chemistry. 373, (2016).
- Merritt, E. A., Olofsson, B. α-functionalization of carbonyl compounds using hypervalent iodine reagents. Synthesis. 4 (4), 517-538 (2011).
- Arava, S., et al. Enolonium Species-Umpoled Enolates. Angewandte Chemie International Edition. 56 (10), 2599-2603 (2017).
- Parida, K. N., Maksymenko, S., Pathe, G. K., Szpilman, A. M. Cross-Coupling of Dissimilar Ketone Enolates via Enolonium Species to afford Nonsymmetrical 1,4-Diketones. Beilstein Journal of Organic Chemistry. 14, 992-997 (2018).
- Zhdankin, V. V., et al. Carbon-carbon bond formation in reactions of PhIO·HBF4-silyl enol ether adduct with alkenes or silyl enol ethers. Journal of Organic Chemistry. 54 (11), 2605-2608 (1989).
- Maksymenko, S., et al. Transition-metal-free intermolecular α-arylation of ketones via enolonium species. Organic Letters. 19 (23), 6312-6315 (2017).
- Vita, M. V., Waser, J. Azidation of β-keto esters and silyl enol ethers with a benziodoxole reagent. Organic Letters. 15 (13), 3246-3249 (2013).
- More, A., et al. α-N-Heteroarylation and α-azidation of ketones via enolonium species. Journal of Organic Chemistry. 83, 2442-2447 (2018).
- Xie, L., et al. Gold-catalyzed hydration of haloalkynes to α-halomethyl ketones. Journal of Organic Chemistry. 78 (18), 9190-9195 (2013).
- Patonay, T., Juhász-Tóth, &. #. 2. 0. 1. ;., Bényei, A. Base-induced coupling of α-azido ketones with aldehydes − An easy and efficient route to trifunctionalized synthons 2-azido-3-hydroxy ketones, 2-acylaziridines, and 2-acylspiroaziridines. European Journal of Organic Chemistry. 2002 (2), 285-295 (2002).
- Li, C., Breit, B. Rhodium-catalyzed chemo- and regioselective decarboxylative addition of β-ketoacids to allenes: Efficient construction of tertiary and quaternary carbon Centers. Journal of the American Chemical Society. 136 (3), 862-865 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon