Method Article
Un protocole en deux étapes pour Umpolung fonctionnalisation de cétones par espèce de Enolonium
Dans cet article
Résumé
Un protocole d’un pot de deux étapes pour l’umpolung d’énolates de cétone enolonium espèces et addition d’un nucléophile sur la position α est décrit. Nucléophiles notamment chlorure, azoture, dérivés azolés, allyl-silanes et composés aromatiques.
Résumé
Α-fonctionnalisation des cétones via umpolung des énolates de réactifs d’iode hypervalent est un concept important en chimie organique de synthèse. Récemment, nous avons mis au point une stratégie en deux étapes pour la cétone énolate umpolung qui a permis le développement de méthodes pour la chloration et azidation amination utilisant les dérivés azolés. En outre, nous avons développé des réactions arylation et d’allylation formant liaison C-C. Au cœur de ces méthodes est la préparation de l’espèce enolonium intermédiaires et très réactif avant l’addition d’un réactif nucléophile. Cette stratégie est donc penser à la préparation et l’utilisation des énolates de métal dans la chimie de synthèse classique. Cette stratégie permet l’utilisation de nucléophiles qui seraient incompatibles avec les réactifs d’iode hypervalent fortement oxydant. Dans cet article, nous présentons un protocole détaillé pour la chloration, azidation, N-heteroarylation, arylation et allylation. Les produits comprennent des motifs répandus en produits actifs en médecine. Cet article d’autres aidera grandement dans l’utilisation de ces méthodes.
Introduction
Énolates sont nucléophiles de carbone classiques en chimie organique et parmi les plus couramment utilisées. Umpolung des énolates de créer enolonium électrophile espèces permet de précieux moyens alternatifs pour produire les cétones α-fonctionnalisés ainsi que pour permettre de nouvelles réactions n’est pas possibles via classique d’énolates chimie. Espèces de Enolonium ont été proposés comme intermédiaires dans nombreuses réactions, en particuliers réactions impliquant des réactifs d’iode hypervalent. Ces réactions incluent α-halogénation, oxygénation et amination1 ainsi que les autres réactions2,3,4,5.
Cependant, les portées de ces réactions étaient toujours limitées par la nature transitoire des espèces réactives d’enolonium. Ce déplacement requis tout nucléophile d’être présents dans le mélange réactionnel lors de la réaction des énolates carbonyle avec le réactif d’iode hypervalent fortement oxydant. Ainsi, n’importe quel nucléophile sujette à l’oxydation, telles que les composés aromatiques riches électron (hétérocycles) et alcènes, ne pouvait servir.
L’année dernière, nous avons surmonté ces limitations en développant des conditions dans lesquelles l’espèce d’enolonium est formé comme un intermédiaire discret en une seule étape, suivi par l’addition du nucléophile dans un second temps. Ce protocole permet non seulement le type classique de fonctionnalisation par exemple chloration6, mais aussi l’utilisation des nucléophiles carbone oxydables, comme allylsilanes6,8, énolates1,6, 7et électrons des composés aromatiques riches9, aboutissant à la formation de la liaison C-C. La méthode allylation se prête à la formation de centres quaternaires et tertiaires. La méthode arylation de cétone constitue officiellement fonctionnalisation de C-H de l’aromatique composé sans la nécessité d’un dirigeant du groupe9. Récemment, nous avons rapporté l’adjonction de dérivés azolés et les azotures10 comme bien11. La présentation détaillée du protocole devrait aider à l’introduction de ces méthodes dans la boîte à outils au jour le jour du chimiste organique synthétique.
Protocole
1. préparation de l’espèce Enolonium
ATTENTION : Avant d’effectuer le protocole, consulter la FS pour tous les réactifs et solvants.
Remarque : Tous les nouveaux réactifs ont été utilisés comme provenant de la source commerciale. Si l’éthérate de trifluorure de bore a été conservé, il distiller avant utilisation.
- Dans un endroit sec à fond ballon équipé d’une cloison et un aimant pour agitateur magnétique rond, ajouter le réactif de Koser (1,5 équiv.) et rincer le ballon avec azote ou argon.
- Ajouter dichlorométhane sèche pour obtenir une suspension de concentration formelle de 0,234 mol/L.
- Cool la suspension à-78 ° C à l’aide d’un bain de glace carbonique/acétone ou un bain d’instrument/acétone doigt froid.
- Ajouter soignée BF3OEt2 (1,5 équiv.) lentement.
- Réchauffer le mélange hétérogène à la température ambiante jusqu'à la formation de la solution jaune. En général, cela se passe au sein de 5 min.
- Refroidir la solution à-78 ° C.
- La solution refroidie, ajouter le triméthylsilyl-enolether (1 équivalent, 0.313 mol/L) dans du dichlorométhane sèche goutte à goutte plus 2-10 min (en fonction de l’échelle). Après que l’addition d’éther d’énol silylé est terminée, la formation de l’espèce d’enolonium est terminée.
Remarque : Vous pouvez laisser la solution d’enolonium espèces à-78 ° C pendant au moins 30 min sans perte de rendement. L’espèce enolonium est stable pendant cette période comme indiqué par le rapporté NMR studies6.
2. la fonctionnalisation des espèces Enolonium
- Chloration avec l’anion chlorure
- Ajouter à la solution ainsi préparée des espèces enolonium chlorure de benzyle-diméthyl-décylammonium (2.0 équiv., 1,25 mol/L) dans du dichlorométhane sèche d’une manière sage de goutte. Ajouter cette solution à un rythme tel que la température reste inférieure à-55 ° C. 0,5-2 mmol échelle, ajout de plus de 5 min est satisfaisante.
- Laissez le mélange réactionnel à-78 ° C pendant 5 min.
- Retirer le bain de refroidissement et laisser le mélange réactionnel à température ambiante.
- Laissez la réaction à température ambiante pendant 20 min.
- Ajouter de l’eau au mélange réactionnel (la moitié du volume de dichlorométhane utilisé dans la préparation de l’espèce enolonium).
- Extrait trois fois avec du dichlorométhane. En général, utiliser 2 ou 3 fois le volume réactionnel dans chaque extraction 0,5-2 mmol à petite échelle.
- Laver les couches organiques combinés deux fois avec de la saumure. En général, utilisez le même volume d’eau glycolée comme le volume réactionnel combinée.
- Sec avec du sulfate de sodium anhydre pendant 30 min.
- Filtrer sur le sulfate de sodium (par exemple, par le biais d’une fiche de Célite).
- Éliminer le solvant sur un évaporateur rotatif à pression réduite et 40 ° C.
- Purifier le produit brut par chromatographie sur gel de silice utilisant éluants hexane et l’acétate d’éthyle pour vous permettre, après élimination des solvants, pure cétone α-azido correspondante.
Note : À l’échelle de 0,5 mmol à 2 mmol de triméthylsilyle énolate, effectuer par chromatographie sur colonne sur une colonne de verre de 2 cm de diamètre à l’aide de gel de silice standard 60 à 15 cm de hauteur (longueur). Le volume devra être modifié pour les autres échelles.
- Azidation avec TMS-azoture
ATTENTION :-Azotures organiques en général sont explosifs et il faut veiller à la manipulation et la préparation des produits. TMS-azoture est toxique. Consulter FS avant utilisation.- Ajouter à la solution ainsi préparée des espèces d’enolonium à-78 ° C azidotrimethylsilane soignée (2.5 équiv.) d’une manière goutte à goutte. Ajouter cette solution à un taux afin que la température reste inférieure à-55 ° C. 0,5-2 mmol échelle, ajout pendant 2-3 min est satisfaisante.
- Remuer le mélange réactionnel pendant 15 min à-78 ° C.
- Faites chauffer le mélange réactionnel à-55 ° C et laisser à cette température pendant 2 à 3 h.
- Ajouter de l’eau au mélange réactionnel (la moitié du volume de dichlorométhane utilisé dans la préparation de l’espèce enolonium).
- Extrait trois fois avec du dichlorométhane. En général, utiliser 2 ou 3 fois le volume réactionnel dans chaque extraction 0,5-2 mmol à petite échelle.
- Laver les couches organiques combinés deux fois avec de la saumure. En général, utilisez le même volume d’eau glycolée comme le volume réactionnel combinée.
- Sécher les extraits avec sulfate de sodium anhydre pendant 30 min.
- Filtrer sur le sulfate de sodium.
- Éliminer le solvant sur un évaporateur rotatif à pression réduite et 40 ° C.
- Purifier le produit brut par chromatographie sur gel de silice utilisant éluants hexane et l’acétate d’éthyle pour vous permettre, après élimination des solvants, pure cétone α-azido correspondante.
- Réaction avec les dérivés azolés
- La solution ainsi préparée des espèces d’enolonium à-78 ° C Ajouter azole (4 à 5 équivalent, 1 mol/L) dissous dans 5 mL de dichlorométhane dans un mode goutte à goutte. 0,5-2 mmol échelle, ajout de plus de 5 min est satisfaisante.
Remarque : Dans le cas des azoles peu solubles tels que tétrazole, utilisez l’acétonitrile à une concentration de 0,5 mol/L au lieu de dichlorométhane. Ajouter cette solution à un taux afin que la température reste inférieure à-55 ° C. - Remuer le mélange réactionnel pendant 15 min à-78 ° C.
- Faites chauffer le mélange réactionnel à-55 ° C et laisser à cette température pendant 4 à 8 h.
- Ajouter de l’eau au mélange réactionnel (la moitié du volume de solvants organiques utilisés dans la préparation de l’espèce enolonium).
- Extrait trois fois avec du dichlorométhane. En général, utiliser 2 ou 3 fois le volume réactionnel dans chaque extraction 0,5-2 mmol à petite échelle.
- Laver les couches organiques combinés deux fois avec de la saumure. En général, utilisez le même volume d’eau glycolée comme le volume réactionnel combinée.
- Sécher les extraits avec sulfate de sodium anhydre pendant 30 min.
- Filtrer sur le sulfate de sodium.
- Éliminer le solvant sur un évaporateur rotatif à pression réduite et 40 ° C.
- Purifier le produit brut par chromatographie sur gel de silice utilisant éluants hexane et l’acétate d’éthyle pour vous permettre, après élimination des solvants, pure cétone α-azole correspondante.
- La solution ainsi préparée des espèces d’enolonium à-78 ° C Ajouter azole (4 à 5 équivalent, 1 mol/L) dissous dans 5 mL de dichlorométhane dans un mode goutte à goutte. 0,5-2 mmol échelle, ajout de plus de 5 min est satisfaisante.
- Allylation, crotylation, cinnamylation et prénylation utilisant allyl-silanes
- Ajouter allyle soignée, crotyle-, cinnamyl-, ou prényl-triméthylsilane (2 équiv.) lentement à-78 ° C. Ajouter cette solution à un taux afin que la température reste inférieure à-55 ° C. Un 0,5-2 mmol échelle, ajout pendant 2-3 min est satisfaisante.
- Remuer le mélange réactionnel pendant 10 min à-78 ° C.
- Laissez le mélange réactionnel se réchauffe lentement à température ambiante en enlevant le bain de refroidissement. Laissez la réaction à température ambiante pendant 20 min.
- Ajouter de l’eau au mélange réactionnel (la moitié du volume de dichlorométhane utilisé dans la préparation de l’espèce enolonium).
- Extrait trois fois avec du dichlorométhane. En général, utiliser 2 ou 3 fois le volume réactionnel dans chaque extraction 0,5-2 mmol à petite échelle.
- Laver les couches organiques combinés deux fois avec de la saumure. En général, utilisez le même volume d’eau glycolée comme le volume réactionnel combinée.
- Sécher les extraits avec sulfate de sodium anhydre pendant 30 min.
- Filtrer sur le sulfate de sodium.
- Éliminer le solvant sur un évaporateur rotatif à pression réduite et 40 ° C.
- Purifier le produit brut par chromatographie sur gel de silice utilisant éluants hexane et l’acétate d’éthyle pour vous permettre, après élimination des solvants, le pur produit de α-allyl correspondant.
- Arylation
Remarque : Pour arylation, utilisez 3 équivalents de BF3OEt2 lors de la préparation de l’espèce enolonium afin d’éviter la tosylation des espèces enolonium comme une réaction secondaire importante. En général, il faut seulement 1,6 équivalent du substrat aromatique. Toutefois, si le substrat aromatique est un pyrane, thiophène ou pyrrole, les meilleurs résultats sont obtenus en utilisant 5 équivalents du substrat aromatique.- À la solution de prêt enolonium espèces ajouter une solution de substrat aromatique dans du dichlorométhane sèche (1.6 équiv., 0,5 mol/L) d’une manière goutte à goutte. Ajouter cette solution à un taux afin que la température reste inférieure à-55 ° C. 0,5-2 mmol échelle, ajout pendant 5-10 min est satisfaisante.
- Après que l’ajout du substrat aromatique est terminée, augmenter la température du mélange à-55 ° C et laisser le mélange à cette température pendant 20 min.
- Ajouter de l’eau au mélange réactionnel (la moitié du volume de dichlorométhane utilisé dans la préparation de l’espèce enolonium).
- Extrait trois fois avec du dichlorométhane. En général, utiliser 2 ou 3 fois le volume réactionnel dans chaque extraction 0,5-2 mmol à petite échelle.
- Laver les couches organiques combinés deux fois avec de la saumure. En général, utilisez le même volume d’eau glycolée comme le volume réactionnel combinée.
- Sécher les extraits avec sulfate de sodium anhydre pendant 30 min.
- Filtrer sur le sulfate de sodium.
- Éliminer le solvant sur un évaporateur rotatif à pression réduite et 40 ° C.
- Purifier le produit brut par chromatographie sur gel de silice utilisant éluants hexane et l’acétate d’éthyle pour vous permettre, après élimination des solvants, pure cétone α-accès correspondante.
Résultats
Résultats représentatifs, réalisés selon le protocole, sont donnés à la Figure 1 et sont discutés dans la section « discussion ». Notamment, une très large gamme de différents corps cétoniques peut être utilisée avec succès dans la réaction pour donner les produits avec de bons rendements, comme on le voit dans l' azidation11. Le champ d’application de la réaction pour introduire des azoles en position α des cétones comprend la majeure partie de l’azote de mono-cycliques et bicyclique commun contenant des hétérocycles. Le champ d’application de la procédure allylation comprend allyl-, crotyle - tant prényl-triméthylsilane6. Seulement cinnamylation exige des conditions légèrement différentes. L’utilisation de 3 équivalents de BF3, de même que les conditions nécessaires pour C-arylation, donne des résultats optimaux dans ce cas. La procédure C-arylation fonctionne pour les indoles et dérivés du benzène riches en électrons. Thiophène, furane et pyrroles sont aussi de bons substrats, mais les produits sont isolés dans un peu plus bas rendements9. Nous avons testé la procédure dans une échelle de 0,5 mmol à 2 mmol de triméthylsilyle énolate avec aucune variation significative du rendement, tant qu’on a pris soin de suivre la procédure avec précision. À cette échelle, chromatographie sur colonne est effectué sur une colonne de verre de 2 cm de diamètre à l’aide de gel de silice standard 60 provenant de différentes sources commerciales à 15 cm de hauteur (longueur). Le solvant indiqué pour TLC est également le solvant utilisé pour la chromatographie.
Exemples :
Chloration (synthèse de 2-chloro-1-phenylethan-1-one).
La chloration de 1-phényl-1-trimethylsiloxyethylene (239 mg, 1,24 mmol) selon le protocole décrit offerte 2-chloroacétophénone12 (146 mg, 76 %) sous forme de solide incolore. Les données de caractérisation du composé ont été comme suit : Rf = 0,4 (1:9 v/v EtOAc/hexane) ; 1 H RMN (400 MHz, CDCl3) δ 7.97 (d, J = 7,2 Hz, 2 H), 7.61 (t, J = 7,2 Hz, 1 H), 7.51 (t, J = 7,2 Hz, 2 H), 4.72 (s, 2 H) ; 13 C RMN (101 MHz, CDCl3) δ 191,2, 134,3, 134.1, 129,0, 128,6 46,2.
Azidation (synthèse de 2-Azido-1-(4-fluorophenyl)ethan-1-one).
Azidation de 1-(4-fluorophényl) vinyle) oxy) triméthylsilane (150 mg, 0.71 mmol) a été réalisée selon le protocole d’azidation donner le produit13 (98 mg, 77 %) sous forme de solide blanc. Les données de caractérisation du composé ont été comme suit : Rf = 0,5 (01:20 v/v EtOAc/hexane) ; 1 H RMN (400 MHz, CDCl3) δ 8.01-7.88 (m, 2 H), 7.23-7.12 (m, 2 H), 4,53 (s, 2 H) ; 13 C RMN (101 MHz, CDCl3) δ 192,9, 167,5 (d, J = 256,7 Hz), 132,1 (d, J = 3,1 Hz), 131.95 (d, J = 9,5 Hz), 129,7 (d, J = 106,6 Hz), 117,5 (d, J = 22,1 Hz), 56,0.
Ajout des azoles (Synthèse de 1-Phenyl-2-(1H-tetrazol-1-yl)ethan-1-one).
Triméthyl ((1-phenylvinyl) oxy) silane (300 mg, 1.56 mmol) a été couplé avec 1 H-tétrazole (4,9 équiv., 17 mL, 0,45 M, 7,65 mmol) comme pour l’addition de tétrazole pour donner le produit (229 mg, 78 %) sous forme de solide blanc. Les données de caractérisation du composé ont été comme suit : Rf = 0,3 (1:1 v/v EtOAc/hexane) ; MP 122-124 ° C ; FT-IR : Ѵmax 3141, 2936, 2869, 2115, 1695, 1596, 1449, 1351, 1228, 1173 cm-1; 1 H RMN (400 MHz, CDCl3) : δ 8,86 (s, 1 H), 7,99 (dd, J = 8,5, 1,2 Hz, 2 H), 7,70 (tt, J = 7.5, 2,9 Hz, 1 H), 7,56 (t, J = 7,8 Hz, 2 H), 5,98 (s, 2 H) ; 13 RMN du 13C (101 MHz, CDCl3) : δ 189,0 144,2, 135,2, 133,5, 129,5, 128.3, 53,5 ; SGRH (ESI +) : m/z calculé pour C9H9N4O 189.0776 [M + H]+; trouvé 189.0745.
Allylation (synthèse de 3,3-dimethyl-1-phenylpent-4-en-1-one).
La prénylation des 1-phényl-1-trimethylsiloxyethylene (99 mg, 0,517 mmol) a été réalisée selon le protocole de payer le produit14 (73 mg, rendement 75 %) comme étant une huile incolore. Les données de caractérisation du composé ont été comme suit : Rf = 0,3 (01:20 v/v EtOAc/hexane) ; 1 H RMN (400 MHz, CDCl3) 7.84 (d, J = 7,2, 2 H), 7,45 (t, J = 7,3, 1 H), 7,36 (t, J = 7,6, 2 H), 5,94-5,84 (m, J = 17,4, 10.7, 1 H), 4,92-4,81 (m, J = 14,1, 11.6, 0,8, 2 H), 2,89 (s, 2 H), 1.10 (s, 6 H) ; 13 C RMN (101 MHz, CDCl3) 13C RMN (101 MHz, CDCl3) δ 199.48, 147.43, 138,37, 132.76, 128.47, 128.25, 110,57, 49.17, 36,73, 27,30.
Arylation (Synthèse des 4-Methoxyphenyl)-2-(2-methyl-1H-indol-3-yl)propan-1-one)
La synthèse a été effectuée comme pour arylation de 1-(4-methoxyphenyl)prop-1-en-1-yl)oxy)trimethylsilane (200 mg, 0.846 mmol) à l’aide de 2-méthyl-1H-indole (1,5 équivalent) pour donner le produit (205 mg, 83 %) sous forme de solide incolore. Les données de caractérisation du composé ont été comme suit : Rf: 0,2 (1:5 v/v, EtOAc/PET. éther) ; IR (cm-1) : 3377, 2967, 1739, 1595, 1458, 1362, 1208, 837 ; 1 H NMR : (400 MHz, CDCl3) δ 7.91 (dt, J = 9.1, 2,8 Hz, 2 H), 7,80 (s. fr., 1 H), 7.64 (m, 1 H), 7.20 (m, 1 H), 7.09 (dt, J = 9.1, 4,1 Hz, 2 H), 6.74 (dt, J = 9.1, 2,8 Hz, 2 H), 4.76 (q, J = 6,9 Hz, 1 H), 3,73 (s 3 H), 2.33 (s, 3 H), 1,54 (d, J = 6,9 Hz, 3 H). 13 RMN du 13C : (101 MHz, CDCl3) δ 199,3 162,9, 135.1, 131,0, 130,5, 129,7, 127,3, 121,1, 119,6, 118.1, 111,6, 111,4, 110,3, 55.2, 38,7, 16,9, 12.0 ; SGRH (ESI +) : m/z calculé pour C19H20NO2 294.1494 [M + H] + ; trouvé 294.1490.
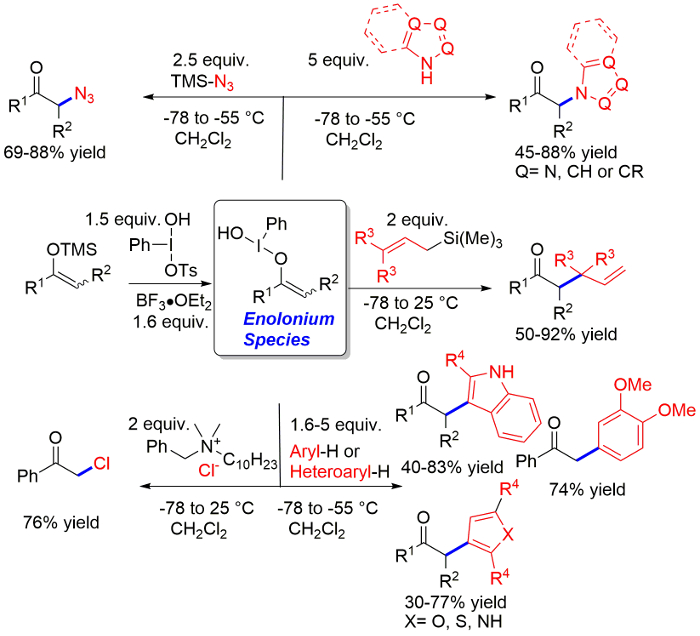
Figure 1 : résultats représentatifs montrant les rendements réalisables à l’aide de la chloration, l’azidation, l’amination azoles allylation et protocoles arylation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le succès de la préparation des enolonium espèces de TMS-énolates dépend de plusieurs facteurs. La réaction de côté majeur à l’étape de préparation est le couplage homo des matières premières par la réaction d’une molécule d’espèces enolonium formé avec une molécule de TMS-énolate. Ainsi, l’exigence de conditions de la réaction est d’éviter cette dimérisation de garantir une réaction rapide du réactif iode hypervalent activés acide Lewis avec TMS-énolique supplémentaire par rapport au taux de dimérisation. Ceci est réalisé dans le protocole en activant et en solubilisant le réactif de Koser selon stoechiométrique BF3. Plusieurs réactifs d’iode hypervalent, y compris le réactif Koser ont faible solubilité dans les solvants organiques standards. Le rôle du trifluorure de bore est donc double. Tout d’abord, il augmente la réactivité du réactif Koser en augmentant la capacité de groupe partant de l’un de ses ligands, sans doute le groupe tosyl. Ceci assure une réaction rapide avec la TMS-enolether. Deuxièmement, le réactif de Koser activé est très soluble en particulier par rapport au réactif Koser non activé. Il est indispensable de vérifier que tous les réactifs ont dissous avant d’ajouter le TMS-enolether. Afin d’assurer une réaction efficace, il faut un léger excès de réactif. Le protocole indiqué utilise 1,5 équivalent de réactif de Koser et de trifluorure de bore. Ce montant est préférable pour la première fois que des utilisateurs. Cependant, la réaction peut être réalisée également avec succès avec aussi peu que 1,2 équivalents d’acide de Lewis et de l’iode hypervalent. Nous avons effectué généralement les protocoles décrits à 0.5 à 2 mmol selon les échelles de triméthylsilyle énolate avec aucune variation significative du rendement, tant qu’on a pris soin de suivre la procédure avec précision.
Un autre paramètre déterminant est l’addition lente de TMS-enolether à la réaction afin d’assurer les deux une faible concentration de TMS-enolether ainsi à éviter un réchauffement local du mélange réactionnel. À l’échelle du célèbre, addition plus 2-10 minutes est généralement suffisante ; cinq minutes de temps de l’addition est utilisé à le 1 échelle de mmol. Toutefois, si homo-couplage de l’énolate de cétone est observée, ce découle probablement injection trop rapide de la TMS-enolether aux activés Koser réactif et plus longs addition doit servir. Pour une réaction à grande échelle, il est préférable d’utiliser une solution de refroidissement préalable de TMS-enolether. Pour β-cétoesters, il n’est pas nécessaire d’utiliser un TMS-enolether, et il n’est pas nécessaire de prendre de l’ajout temps et température précautions comme ces espèces d’enolonium ne fais pas les couple homo. En outre, la réaction des β-cétoester est beaucoup plus lente et peut donc se faire à température ambiante. Les énolates de lithium de β-cétoester peuvent servir à augmenter la vitesse de réaction. Le TMS-enolether d’acétone n’est pas un bon substrat que homo-attelage pour ce composé sans entrave est très rapid.
Le protocole est efficace pour une grande variété de substitués aryl-alkyl cétones avec électro affinitaires et comme substituants électro-donneurs. La réaction fonctionne également pour les cétones dialkyl. Notamment, énolates contenant des liaisons doubles conjugués sont des substrats réussies dans la réaction. Cependant, α, cétones α-disubstitués souvent échouent lors de l’étape d’addition nucléophile subséquente si le nucléophile est stériquement causée par la réaction concurrente par l’anion tosyl relativement sans entrave. Les cétones α-Neber sont observés comme sous-produits mineurs dans de nombreuses réactions.
La solution préparée des espèces enolonium est stable pendant au moins 30 minutes à −78 ° C. Dans la deuxième étape du protocole réactif nucléophile est ajouté. Une large gamme de nucléophiles sont compatibles avec l’espèce d’enolonium y compris nucléophiles qui auraient réagi avec le réactif de Koser ou l’acide de Lewis Koser réactif. Ainsi, les deux nucléophiles traditionnels comme le chlorure ou azoture anion peuvent servir comme substrats facilement oxydables. Notamment, allyl-silanes travaillent avec succès dans la réaction. Une deuxième caractéristique remarquable de la réaction avec substitués allyl-silanes est la régiosélectivité complete avec la formation de la liaison en position terminale du silane allylique. Ainsi, lorsque prényl silane est utilisé, comme dans le protocole décrit, centres quaternaires sont formés. Substrats aromatiques et hétéroaromatiques peuvent également être utilisés. Remarquablement, hétéroaromatiques contenant de l’azote avec plus d’un azote et pas de substituants sur l’azote réagissent à l’azote. En revanche, indoles et pyrroles réagissent exclusivement au carbone. La position d’attaque est tel que prédit par la réactivité de ces substrats de Friedel-Crafts tapez réactions. Ces réactions constituent la réaction de fonctionnalisation de C-H et inutile le substrats aromatiques halogénés comme les métaux de transition classique catalysée par des réactions de couplage. La portée est limitée aux composés aromatiques riches en électrons : indoles, pyrroles, furannes, thiophène et benzènes riche d’électron. Il est à noter que les composés aromatiques riches en électrons ont tendance à subir une oxydation de l’iode hypervalent, menant à couplage homo et d’autres réactions, mais pas par des espèces d’enolonium. Dans la plupart des cas, seulement 1,6 équivalent du substrat est nécessaire afin que le plus précieux matériaux peuvent être utilisés dans la réaction. Le substrat aromatique excédentaire peut être isolé. Seulement dans le cas des pyrroles substitués, thiophènes et furanes est l’utilisation de 5 équivalent recommandé.
Ainsi, ce protocole rapporté ici en permet l’utilisation de tant nucléophiles traditionnels et inertes que nucléophiles incompatibles avec des protocoles de réaction traditionnelle. La liste des nucléophiles adaptés continuera certainement d’élargir à l’avenir.
Déclarations de divulgation
Nous n’avons rien à divulguer.
Remerciements
Une subvention de démarrage de l’Université Ariel et une subvention de recherche individuelle ISF (1914/15) à AMS tient à reconnaître.
matériels
| Name | Company | Catalog Number | Comments |
| Chlorotrimethylsilane, 98+% | Alfa Aesar | A13651 | TMS-Cl |
| Boron trifluoride diethyl etherate, 98+% | Alfa Aesar | A15275 | BF3*Et2O |
| 2-Methylindole, 98+% | Alfa Aesar | A10764 | 2-Me-indole |
| Hydroxy(tosyloxy) iodobenzene, 97% | Alfa Aesar | L15701 | Koser's reagent |
| Acetophenone, >98% | Merck | 800028 | |
| n-Butyllithium solution 1.6M in hexanes | Aldrich | 186171 | nBuLi |
| BIS(ISOPROPYL)AMINE | Apollo | OR1090 | DIPA |
| Trimethylsilyl azide, 94% | Alfa Aesar | L00173 | TMS-N3 |
Références
- Mizar, P., Wirth, T. Flexible stereoselective functionalizations of ketones through umpolung with hypervalent iodine reagents. Angewandte Chemie International Edition. 53 (23), 5993-5997 (2014).
- Yoshimura, A., Zhdankin, V. V. Advances in synthetic applications of hypervalent iodine compounds. Chemical Reviews. 116 (5), 3328-3435 (2016).
- Zhdankin, V. V. . Hypervalent Iodine Chemistry: Preparation, Structure, and Synthetic Applications of Polyvalent Iodine Compounds. , (2013).
- Wirth, T. . Topics in Current Chemistry. 373, (2016).
- Merritt, E. A., Olofsson, B. α-functionalization of carbonyl compounds using hypervalent iodine reagents. Synthesis. 4 (4), 517-538 (2011).
- Arava, S., et al. Enolonium Species-Umpoled Enolates. Angewandte Chemie International Edition. 56 (10), 2599-2603 (2017).
- Parida, K. N., Maksymenko, S., Pathe, G. K., Szpilman, A. M. Cross-Coupling of Dissimilar Ketone Enolates via Enolonium Species to afford Nonsymmetrical 1,4-Diketones. Beilstein Journal of Organic Chemistry. 14, 992-997 (2018).
- Zhdankin, V. V., et al. Carbon-carbon bond formation in reactions of PhIO·HBF4-silyl enol ether adduct with alkenes or silyl enol ethers. Journal of Organic Chemistry. 54 (11), 2605-2608 (1989).
- Maksymenko, S., et al. Transition-metal-free intermolecular α-arylation of ketones via enolonium species. Organic Letters. 19 (23), 6312-6315 (2017).
- Vita, M. V., Waser, J. Azidation of β-keto esters and silyl enol ethers with a benziodoxole reagent. Organic Letters. 15 (13), 3246-3249 (2013).
- More, A., et al. α-N-Heteroarylation and α-azidation of ketones via enolonium species. Journal of Organic Chemistry. 83, 2442-2447 (2018).
- Xie, L., et al. Gold-catalyzed hydration of haloalkynes to α-halomethyl ketones. Journal of Organic Chemistry. 78 (18), 9190-9195 (2013).
- Patonay, T., Juhász-Tóth, &. #. 2. 0. 1. ;., Bényei, A. Base-induced coupling of α-azido ketones with aldehydes − An easy and efficient route to trifunctionalized synthons 2-azido-3-hydroxy ketones, 2-acylaziridines, and 2-acylspiroaziridines. European Journal of Organic Chemistry. 2002 (2), 285-295 (2002).
- Li, C., Breit, B. Rhodium-catalyzed chemo- and regioselective decarboxylative addition of β-ketoacids to allenes: Efficient construction of tertiary and quaternary carbon Centers. Journal of the American Chemical Society. 136 (3), 862-865 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon