Method Article
子宮内エレクトロポレーション マウス大脳皮質における Cre lox 組換えを誘導します。
要約
脳における遺伝子の細胞の自律的機能損失を誘導することによって学ぶことができるまたは細胞のまばらな人口の機能を得る。ここでは、関数の vivoの損失を引き起こす floxed の遺伝子を持つ皮質ニューロンの開発のまばらな人口に Cre リコンビナーゼを提供する子宮内エレクトロポレーションについて述べる。
要約
遺伝子の細胞自律神経機能の損失を引き起こすことによって明らかになることやニューロンの小さく、まばらな人口の遺伝子の機能を得る。そうニューロンの損失または遺伝子の機能のゲインが遺伝的摂動組織に囲まれているモザイクを生成する必要があります。ここでは、我々 はニューロンの遺伝子の細胞の自律的機能を研究するために使用できるモザイク脳組織を生成するために子宮内でエレクトロポレーションと Cre lox 組換えシステムを組み合わせます。DNA コンストラクト (リポジトリを通じて利用可能)、蛍光ラベルと Cre リコンビナーゼのコーディングが両脇に loxP サイトで子宮を用いたマウス胚の脳における遺伝子を含む皮質ニューロンの開発に導入します。エレクトロポレーション。さらに、子宮内でエレクトロポレーション法の存続性と再現性を向上させる様々 な適応について述べる。このメソッドはまた、ニューロンのスパースまたは密な人口の Cre 介する組み換え価を確立します。ラベル付けされた脳組織の組織学的準備を必要としない (しかしに合わせることができる) の免疫組織化学。使用構造を保証する蛍光ニューロン キャリー Cre リコンビナーゼの遺伝子に分類します。組織学的準備は、アーバーの樹状突起と軸索と樹状突起スパインの共焦点イメージングによるニューロンの形態素解析を許可します。損失または利得関数のスパース モザイク組織で実現するため、このメソッドは、遺伝子製品生体内での細胞の自律的必要性の検討とを許可します。
概要
興味の遺伝子の機能を理解するための古典的な実験パラダイムは、遺伝のモザイクを生成します。遺伝子は細胞の表現型に必要なかどうかを決定するには、最も簡単な方法は有機体 (例えばノックアウト) を通して遺伝子の機能の損失を引き起こしています。ただし、遺伝子が特定の細胞型で特に必要なかどうかを決定、生物全体の遺伝子のノックアウトは有効なアプローチではありません。代わりに、メソッドが必要なしの野生型 (すなわち遺伝的摂動) 組織に囲まれている間特定のセルに遺伝子の機能の損失と、-つまり、モザイク組織を作成します。突然変異体の細胞が突然変異体の表現型を示していますが、周囲の野生型細胞は、細胞自律的方法で遺伝子機能。解析モザイク組織、変異細胞が野生型組織に囲まれているは、遺伝子、特にニューロンとグリア細胞が組織の広大な相互接続ネットワークを形成する脳の細胞の自律的機能の理解に最適です。
モザイク脳組織のいくつかのフォームは、遺伝子の細胞の自律的機能を調べるための強力なモデルを提供しています。神経移植1、女性 X-リンクされてモザイク2,3,4に焦点を当てた研究とモザイクに基づいて彼らの結論を描画している内因性の体細胞モザイク5,6脳組織。Cre lox 組換えシステムを介して遺伝子の条件削除は、トランスジェニック マウス線の偉大な可用性を最大限に活用する方法です。このメソッドは、loxP サイト同じ方向 ("floxed") の両方の顔が並ぶそれを残して (エクソン) など遺伝子の必要なシーケンスのいずれかの側で 2 つの loxP サイトを紹介しています。Cre リコンビナーゼ loxP サイト7間のシーケンスを切り取る。Cre を介する組み換えは、セル (「Cre 記者ライン」) のサブセットに蛍光マーカーと一緒に Cre リコンビナーゼを表現する別のマウス線横断 floxed マウスで実現できます。これは、さまざまな興奮性神経細胞やアストロ サイト8などの細胞のサブセットの遺伝子の機能を明らかにする方法で実証されています。Cre 記者行クレエT2 (単一ニューロン誘導 Cre を介したノックアウトまたは滑らかでラベル付け) という薬物誘導する Cre を介した結合を許可するを表すことができます9。ダブル マーカー (MADM)10,11モザイク解析と呼ばれる別の戦略、Cre を介した染色体間組換えホモ接合体変異ヘテロ接合体組織と一緒に作成することができます。これらのアプローチのマウスの新しい行は各候補遺伝子またはテストされる細胞のサブタイプのたびに生成される必要があります。イオントフォレシス12通したり、ウイルスのベクトル (例えばアデノ随伴ウイルス13またはレンチ14細胞サブタイプに固有を運ぶ Cre リコンビナーゼを後天的導入できる代わりに、発起人)。この戦略は、強いと生後のラベルを作成します。まばらと胎生期大脳皮質ニューロンの開発を対象とするには、理想的な戦略は蛍光マーカーで Cre リコンビナーゼのエレクトロポレーション子宮内です。
体内組織モザイク エレクトロポレーション子宮内で生成する Cre lox 再結合を結合することに加えて、その他公開プロトコルから15,16、手順にいくつかの適応を紹介 17,18,19,20,21。繁殖タイミング妊娠した女性の成功を改善するために情報を提供いたします。我々 はまた、大脳皮質組織の神経細胞の疎と明るいラベリングを導入する我々 の 2 つの戦略を概説: Cre リコンビナーゼの蛍光マーカー22single コンストラクト コーディングのレベルを滴定する戦略の 1 つです。別の戦略は、心23,24でこれらのパラメーターを具体的に設計された「超新星」システムを使用することです。さらに、一貫性のあるマイクロインジェクション ピペットと子宮の穿孔手術を簡素化の生産の改善を提供しています。最後に、我々 はさらに汚れるか、または免疫組織化学を樹状突起スパインの樹状突起と軸索のアーバー、分析できる簡易組織の準備で重要な手順を概説します。
プロトコル
ここで説明する方法は、やすべての関連する規制・制度のガイドラインの遵守動物ケアおよび使用委員会 (ACUC) のジェームズ ・ マディソン大学によって承認されています。
1. マウスのセットアップ
- 若者の家 (> P60) ブリーダー ペア25を設定する一緒に男性と女性のホモ floxed マウス。
注: 良いネガティブ コントロールする Cre リコンビナーゼ式ないがモザイク26野生型マウスの追加ブリーダー ペアを設定することです。 - 出産する男性と彼女の最初のごみを発生させる女性を許可します。ごみの生存を増加する女性と男性を維持します。例えば生後日 (P) 21、ごみを離乳後別の女性と男性。
-
マウスの繁殖
- 男女25の間でタイミング合うを設定します。視覚的な合図を使用して、女性27, 発情周期を判断して交尾25後朝膣にプラグをチェックします。
- プラグインが見つからない場合、分離し、女性の重量を量る。(E) 0.5 日と日をカウントします。
- 引き続き女性すべての 3-5 日の彼女が妊娠しているかどうかを重量を量るします。妊娠中の女性が 10-20% 増加体重受胎 (E0) 後 7-10 日。
注: この手順は、以前、目視検査25より確実に妊娠を確認します。 - 女性は妊娠していない場合は、1.3.1-1.3.3 が手順繰り返します。
- 妊娠が確認されれば子宮内エレクトロポレーションの日付を選択します。層 II/III 皮質錐体神経前駆細胞を対象とするには、E15.5 でエレクトロポレーションを実行します。
2. DNA セットアップ
- 単一 DNA 構築 Cre リコンビナーゼとして緑色蛍光タンパク質 (GFP)28,29などの蛍光マーカーがコードを選択します。また、以前の出版物23,24でくわしく述べる「超新星」システムを使用します。たとえば材料のリストを作成を参照してください。
- ステップ 2.1 標準的な微生物学的テクニック30を使用して E. 大腸菌の DNA construct(s) を増幅します。
- 製造元の指示に従ってエンドトキシン プラスミド精製キット、DNA コンストラクトを浄化します。溶出水のエンドトキシン フリーで構築。
注: 標準浄化キット上のエンドトキシン精製キットの選択は重要です。 - 必要なラベル密度26によって 1-3 mg/mL に DNA 溶出液を集中します。
注: 力価は常にニーズを異なる長さとプロモーターは、新しい DNA コンストラクトを使用するときを確立します。いくつかの異なる濃度および/または量の式を評価するためにコンス トラクターを注入することを検討してください。たとえば、1 μ L または 2.0 mg/mL GFP の 1.5 μ L 注入。Cre は疎 (1 μ L) または密 (1.5 μ L) を引き起こすことができる層 II/III 視覚皮質錐体細胞26のラベリングします。 - 追加 0.4% トリパン ブルー 1 リン酸緩衝生理食塩水 (PBS; 137 mM NaCl、KCl、2.7 mM 10 mM Na2HPO4, 1.8 mM KH2PO4 H2O、pH 塩酸で 7.4 に調整) x 1:10 DNA 濃縮します。
- 濃縮された DNA 溶液に 10 x PBS 1:10 を追加します。
- 4 ° C で濃縮された DNA 溶液を保存します。ソリューションは、無期限に保存されるかもしれない。
3. ピペット セットアップ
-
非常に長いとピペットを引くガラス キャピラリー引き手を使用して (10-15 mm) テーパー、非常に細かいチップ、萌芽期の幹細胞の注入または核移植31用ピペットの典型的な。
注: 破片のピペットの汚染を防ぐためにされなければならない手術の 2 日以内。- 製造元の指示に従って、ランプのテストを実行することによってガラス キャピラリー引き手を調整します。引きをプログラムする結果の熱値は次のパラメーターを使用してプロトコルの使用: 熱 = (ランプ テスト値 + 15) を引く 30、ヴェルを = = 120、時間 = 100、圧力 = 200。ガラス管を挿入、引き手、上クランプに固定、ガラス管にテーパーを作成するプログラムの引きプロトコルをアクティブにします。
- 確実に間テーパー長さ 10-15 mm の複合光学顕微鏡 (例えば10 × 対物)31を使用して。
-
20-25 μ m の直径にざらざらの先端を形成するピペット ブレーク バック。
- センターのシングル タスク ワイプ (材料のリスト参照) 50 mL をビーカーとストレッチ拭く片手でピンと張った。片方の手で押しワイプ、テーパの31の決別の原因の中心を垂直にし、完全にピペット (下テーパ側) をプッシュします。
注: ワイプを完全にピペットを押す 20-25 μ m 径先端約 70% の時間になります。 - (例えば20 × 対物) 複合光学顕微鏡で確認します。
注意: は、ガラスを破壊しながら眼の保護を使用します。
- センターのシングル タスク ワイプ (材料のリスト参照) 50 mL をビーカーとストレッチ拭く片手でピンと張った。片方の手で押しワイプ、テーパの31の決別の原因の中心を垂直にし、完全にピペット (下テーパ側) をプッシュします。
- 0.4% トリパン ブルー 1x PBS での 1 μ L 吸引によって部分的に満たされた piptte にピペットを調整し、細いアルコール耐性マーカーを使用して、ピペットで 1 μ L の高さに基づいてマーキング 1 μ L ピペットを卒業します。破棄する前にその他のピペットを卒業するのに校正のピペットを使用します。ピペット ピペット ホルダーほこりや他の物質から無料してください。
4.子宮内エレクトロポレーション
- ステンレス トレイにグレーフェ鉗子、アイリスはさみ、ハートマン モスキート鉗子、不織布-ガーゼ スポンジ、リング先端の鉗子やシャーレを置き、アルミホイルで包みます。オートクレーブでトレイと 1 L 0.9% 生理食塩水 (0.9 %wt/集水に塩化ナトリウム) を配置します。121 ° c のオートクレーブと 40 分の 3.5 kPa は、オートクレーブから外し、消毒手術領域に配置。
注: 手術中に滅菌状態を維持するために重要です。 - オートクレーブ手術前に 38 ° C 少なくとも 2 h に小さな水のお風呂で 1 リットルの生理食塩水ボトルを温めます。
- ピンセット型の電極とフットペダルをジェネレーターに接続 (資料の一覧を参照してください)。製造元の指示に従って設定時 (950 ms 間隔) で 50 V の 5 50 ms のパルスを提供するジェネレーター フットペダルによってトリガーされます。ピンセット型の電極を消毒して、消毒手術領域に配置.
- 以前に発行された32麻酔鼻の円錐形を作るが、鼻の円錐形の開口部にしっかりと合ったダイヤフラムを形成するニトリルまたはラテックス手袋指末を使用します。マウスの鼻の上に合うように十分な大きさのダイヤフラムの穴をカットします。
- 深く純粋な酸素 1 L/分で流れるのイソフルラン (2-4%) で満ちていた誘導区域で E15.5 で妊娠マウスを麻酔します。立ち直り反射をテスト ~ 1 分後 (優しく誘導室を傾けるし、マウスが、自体にはない右を確認)。鎮痛効果後術中投与の投与量を決定するのには、マウスの重量を量る。
- 外科領域にマウスを移動し、手術面でマウスを維持するために鼻の円錐形を 1 L/分で流れる純粋な酸素の吸入イソフルラン (1-2%) を管理します。ペダルの反射をテストする鉗子を使用 (足を優しくつまむし、マウスが反射を返さないことを確認) anesthetization を確認します。呼吸と深い、定期的な呼吸を探して努力を監視 (70 ~ 100 呼吸/分)、粘膜がピンク色で、しっとりと。
- プロシージャの間に乾燥から保護するためにそれらを完全にカバーする目に十分な獣医眼科用軟膏を塗布します。
- Flex で密封袋の金属活性化ディスクいっぱい過飽和食塩 (資料の一覧を参照)、塩の発熱結晶を活性化します。ポーチから、上に 2 のシングル タスク ワイプを置き、体温を維持するためにポーチにマウス カーソルを置きます。
- 腹部の毛皮 (約 20-40 秒) が溶解するまで綿棒で腹部に脱毛クリームをマッサージし、腹部の毛をふき取りなさい。70% のエタノールおよび綿の綿棒で残りの残基と脱毛クリームをきれいに慎重に。滅菌手術用ドレープを腹部領域に置きます。
- 無菌技術を使用して、グレーフェ ピンセットで、腹部から皮膚を引っ張ったりし、アイリスはさみ、基になる筋肉が切断されていないことを確認を使用して肌で 〜 2 cm の腹側正中切開を行います。
注: グレーフェ ピンセットとアイリスのはさみで切開することを受諾可能な代わりは以前17を公開、メスを使用します。 - リネアを見つけるアルバ腹直筋の正中線を可視化します。グレーフェ ピンセットで、腹部から筋肉を引っ張るとアイリスはさみ、腹腔内を公開することで別 〜 2 cm 正中切開が (子宮は半透明と胚は下に表示されます)。子宮と腸の組織の基になるを切っていないことを確認します。引き出し、子宮を取りそろえた公開切開だけ十分に大きい (通常 〜 2 cm) を作る。
注: グレーフェ ピンセットとアイリスのはさみで切開することを受諾可能な代わりは以前17を公開、メスを使用します。 - 10 μ L の滅菌ピペットの先端を使用して、鎮痛の腹腔内に 4 mg/kg (0.9% 生理食塩水に溶解) カルプロフェンを調剤します。
- 1 つハートマン モスキート鉗子を直腹切開の左端に取り締まります。切開、切開部の左側が開いたままの左側に横転したシャーレに鉗子を置きます。別のハートマン モスキート鉗子直腹切開の右端で締め金で止めるし、切開、切開の右側が開いたままの右側に横転したシャーレに鉗子を休みます。切開部周辺ガーゼ スポンジを配置します。
- (添付制限ねじ) なしリング鉗子を使って、破砕または任意の組織を傷つけることがなく任意の 2 つの隣接の胚の子宮に引き出します。切開、スポンジ ガーゼの上にそれらを置くすべての胚を撤退を開始します。腹腔内から最後の胚を引き出してから、卵巣や子宮頸部に引っ張らないように確認します。一度公開、子宮を温かい生理食塩水を湿った保つことが重要です。子宮は通常、5 と 8 の胚の間含まれています。
注: 生理食塩水17にペニシリンとストレプトマイシンを追加することが可能です。 - 校正ピペットを吸引管に接続 (資料の一覧を参照)、し、子宮の壁を通って各胚の側脳室に、2 ステップで、DNA 溶液の正確 1 μ L を注入します。側脳室は (パッチは終脳の組織を周囲よりも暗い) 胚の背側終脳の 2 つのパッチとして表示されます。マイクロインジェクションとエレクトロポレーションの間に親指と人差し指を使用して、明らかに側脳室、注入中に子宮の壁に優しくプッシュする胚、胚を操作します。トリパン ブルー側脳室を埋める観察することによって成功した射出を確認します。
- 子宮の内側と尾側皮質視覚野を対象とする上に直接 (材料のリスト参照) ピンセット型の電極の陰極を配置 (異なる電極配置が必要が代替する脳の領域をターゲット)16、 26。子宮だけ劣ると胎児の頭の前方のアノードを配置します。
- アノードとカソードが適切な場所で胚を取り囲む子宮に触れていることを確認します。足元のペダルで電極間で (950 ms 間隔) で 50 V の 5 50 ms パルスの配信をトリガーします。
注: 挿入された、マイナスに帯電 DNA は、陰極に向かって移動、陰極に最も近い心室ゾーン細胞に組み込まれます。 - それが発見された同じ向きで腹腔内に子宮を戻ります。それを導く手動で非常にゆっくりと子宮内の位置から胚がずれないように世話しながら子宮を潤滑するため生理食塩水を使用します。
- 吸収性縫合糸 (資料の一覧を参照してください) と腹部の筋肉を閉じる外科医の結び目の両端を結ぶ簡単な中断されたステッチを使用しています。両端の結び目近くにもクリップしないか結び目が席になります。
注: これは重要な腹部の筋肉傷のエッジが完全に閉まっているようなシャット ダウン、縫合が筋肉のブランチングを引き起こすことがなく。席は指定できませんので、ノットがタイトなする必要があります。 - (簡単な中断されたステッチ、4.19 のステップのように、外科医の結び目) の吸収性縫合糸と皮膚の層を閉じます。傷を密封する組織接着剤の少量を適用します。緩めるようにノットに組織接着剤を適用します。マイクロ ピペットを使用して、マイクロ ピペットで吸引することができます傷を周囲の組織接着剤を削除します。
- 0.5 〜 1.5 にイソフルラン レベルを下げる %。組織接着剤が乾燥 (接着剤をグローブに触れることによってテスト)、イソフルランから削除し、暖かいケージ内だけで回復する女性を許可します。1 mL 注射器を用いた、26 G、½"0.03 mg/kg 腹腔内にブプレノルフィンを管理針。
- マウスは完全に回復するまで、マウスを監視し続け、正常に動作して (すなわちグルーミング、ケージを探索、食事や飲む)。回復、一度は配置のオスとケージに戻って女性。
注: すべての手順に従っている場合マウスは通常 2 分以内に意識を取り戻すし、すぐに不快感の兆しを見せて、ケージの移動を開始します。 - マウスに不快感 (例えば猫背の姿勢、ポルフィリン分泌物)33の兆候が見られる場合は、0.1 Mg/ml と水の供給でカルプロフェンを管理します。ケタミン (240 mg/kg) - キシラジン (48 mg/kg) - の腹腔内致死注射を投与することによって、マウスがすぐに安楽死不快感のいくつかの兆候がある場合、またはカルプロフェン投与にもかかわらず 4 h 以上の不快感が続く場合は、1 mL 注射器を用いた、26 G、½"アセプロマジン (1.85 mg/kg) カクテル、針、安楽死33の承認された二次形態に従ってください。
- 生後後 electroporated 胚の生存率を高めるためケージを静かな部屋、騒音や振動から解放を保持してください。プラスチック製イグルー、ネスト材料 (材料のリスト参照) ヒマワリの種などの栄養補助食品と環境を豊かに。移動または分娩後最初の 3 日間、特に中にケージを邪魔しないでください。
5 蛍光顕微鏡用組織の準備
注: この組織学のプロトコルは、electroporatedの子宮にいた生後 (P) 13 より古い動物から組織の準備に最適です。若い生後動物 (P0 P13) から組織を準備するには、勧めします (transcardial の灌流を含む) すべての手順を実行するセクション (ステップ 5.9) を準備する前に寒天培地に埋め込む脳が。組織が準備するもエレクトロポレーション後 1 〜 2 日以内の胚からメソッドを使用して前に説明した18,20。
-
パラホルムアルデヒド (PFA) ソリューションを準備します。
注: それは実験の 1 日以内の新鮮な PFA を準備することが不可欠です。
注意: パラホルムアルデヒドは毒性があり適切な個人用保護具と発煙のフードで処理する必要があります。- 4% の 50 mL をする PFA、60 ° C に 40 mL の水を加熱ガラス棒や攪拌バーで攪拌しながら 2 g PFA を追加します。PFA が溶けるまで 10 メートル naoh 水溶液 2 分ごとの 10 μ L を追加します。
- 10 x PBS の 5 mL を追加し、50 mL の水での最終巻にソリューションをもたらします。
- ソリューションを 50 mL に読み込んだら、クール、4 ° C で保存し 10 M HCl。 許可するソリューションに応じて 7.4 に pH を合わせなさい。
- マウスを安楽死させるアセプロマジン (1.85 mg/kg) カクテル 1 mL 注射器を用いた、26 G、½"針のケタミン (240 mg/kg) - キシラジン 48 mg/kg の腹腔内注入。Transcardially は、10 または 20 mL 冷たい 1 × PBS、25 〜 40 mL たて、冷えた 4% PFA17続いてを灌流します。若い生後 (P0 P13) マウスと古いマウスの高いボリュームの低いボリュームを使用 (P14 および上記)。
- 灌流後すぐに大きなハサミで後頭骨と C1 椎間マウスの死体の首をはねると離れて皮をむくとアイリスのはさみを使って頭蓋骨の周りの皮膚のほとんどを破棄、特に皮膚の周囲の前頭葉、頭頂、後頭骨。頭蓋骨と脳をそのまま維持します。
- 頭蓋骨と脳が 10 mL 4%、後組織を修正するための 4 ° C で 24 時間の 50 mL のコニカル チューブ PFA。1% の解決策を希釈するための円錐管に 30 mL の 1x PBS を追加 4 ° C で保存用 PFA
注: は、修正後に各頭蓋骨と脳は別の円錐管を使用します。脳を孵化しないで 1% で 2 週間、または蛍光より長く PFA が衰退し始めます。 - 脳と頭蓋骨を平らな面に一層タスク ワイプ 1x PBS で湿らせた。残り皮膚や頭蓋骨を包む膜を除去するピンセット (資料の一覧を参照してください) を使用します。
- ピンセットを使用して、後頭骨をまず削除し、脳の表面からを離れ、ピンセットを移動、頭頂骨を慎重に取り外します。皮質への損傷を防ぐため、髄膜を慎重に取り外します。
- 脳を外し、ピンセットの後ろ、脳神経を断絶する頭蓋骨に沿って脳の下でくさびで留めます。
-
若い生後 (P0 P13) 頭脳の
- 25 mL の 1x PBS 80 ° C に加熱することによって 4% 寒天培地を 25 mL を作るかき混ぜるし、ガラス棒や攪拌バーと 1 g の寒天を溶かす)。
- 攪拌しながら 35 ° C にクールなソリューションです。(例えば50 mL のコニカル チューブのキャップ)、小型の容器に脳を配置し、脳に寒天液を注ぐ。寒天を強化するを許可します。
- シングル エッジかみそりの刃を使用して手動で約 0.5 mm 前に吻側脳を介してコロナのカットにします。別のコロナ カットを介して行う脳約 0.5 mm 尾視覚皮質に。振動ミクロトーム試料ディスクの中心に脳の吻側端と同じ直径のシアノアクリ レート系接着剤のプールを配置します。場所吻側端の接着剤、プールの上に脳組織の吻側全面が接着剤で試料ディスクにバインドされていることを確認します。
- 振動ミクロトームにバッファー トレイをマウントし、内蔵のクランプ レバーで固定します。ナイフ ホルダーに刃を挿入し、内蔵クランプねじをミクロトームを振動にナイフ ホルダーをマウントします。バッファー トレイ内蔵クランプ装置を使用する脳と試料ディスクを保護します。5.70 (0.285 mm/s =)、速度設定、周波数設定を 5.33 (53.3 Hz) に設定します。
- 1x PBS で脳のレベル上のチャンバを記入し、PBS に刃を下げてください。組織を 100 μ m のコロナ セクションを取り始めます。
-
場合は 4' 6-diamidino-2-phenylindole (DAPI) 核染色や免疫染色などのさらに処理を必要としません。
- 微細先端ペイント ブラシを使用すると、各スライドに 4-6 節をフィッティング顕微鏡スライド上に振動ミクロトームから直接セクションを転送します。
- 脳スライスはもはやスライドにドリフトするよう細かい先端絵筆で距離をソリューションを吸い取り乾燥するセクションを許可します。
- 次に、フィルターとフィルターの 1 つのドロップを配置 (材料のリスト参照) スライドの各セクションの。
- ゆっくり 24 x 50 mm coverslip を上に置きますと、セクション、2) セクションのフォームを移動しないでください、1) 空気泡を確保すること、3) フィルターとフィルターは完全にスライドと coverslip のエリアをカバーしています。少なくとも 24-48 時間を治すためフィルターとフィルターを許可します。
-
DAPI 皮質ラミナの病理組織学的検査のための核を染色するには
- 各セクションを含む 10 μ g/mL DAPI (材料のリスト参照) 原液 (20 mg/mL 水の DAPI) から 1 × PBS で希釈したソリューションに転送するのに微細先端絵筆を使用します。
- DAPI 溶液、室温で 5 分間インキュベートし、微細先端絵筆を使用して 1x PBS に DAPI 溶液からセクションを転送し、室温で 5 分間 1x PBS で孵化させなさい。2 番目のセクションの複数回を 5 分新鮮な 1 × PBS に転送します。顕微鏡スライド上にセクション微細先端絵筆、転送を使用して、次の手順 5.11.2-5.11.4 し 5.13 の手順に進みます。
- 完全に溶けるまで弱火でホット プレート上の Valap (パラフィン、ラノリン、ワセリンの等しい部分) を含むガラス シャーレを加熱します。シールは、溶融 Valap のブラッシングによってスライドの端を公開しました。
- 光学顕微鏡や共焦点顕微鏡を使用して、組織の蛍光を検査する (資料の一覧を参照してください)、フィルター設定蛍光体を表示するための十分な (例えばDAPI: 励起 325-375 nm、発光 435-485 nm;GFP: 励起 450-490 nm、発光 500 550 nm)17。低共焦点画像を取られる場合があります (4 X 開口数 NA = 0.20)、中-(20 X、NA = 0.75)、高出力 (60 X、NA = 1.40) 目的。
結果
シングルは、GFP を構築します。Cre は E15.5 で electroporated をされ、P14 の可視化 (材料の一覧を参照してください)。コンストラクトの濃度や注入量、に応じてスパースまたは高密度の結果22,26を取得できます。たとえば、2 mg/mL GFP の 1 μ l 注入。明るい (図 1 a)、および、ローカライズされた層 II/III (図 1 b) をすることができますいくつかのラベル付きセルの希薄な分布で Cre の結果。組織が 100 μ m 厚には、樹状のアーバーのほとんどは (図 1) が保持されます。高倍率 (60 X での樹状突起棘を観察できます。図 1)。同じ濃度で 1.5 μ l 注入は非常に密な神経突起やスパイン (図 2) の元を追跡することは困難だと準最適できる層 II/III (図 2 b) (図 2 a) をラベリングの結果します。ただし、ラベル部分 (図 2 D) の周囲の明るいセルを選択し (図 2 D) ニューロンおよびプロセス (図 2 e) をイメージすることも可能です。
最後に、標識細胞の疎な分布を維持しながら神経細胞の明るさを最大化することが可能です。超新星 GFP が E15.5 で electroporated をだった (資料の一覧を参照) ここでは、P23 の可視化と。様々 な産後の年齢で採取した脳組織の観察に基づくことに注意が、どの蛍光構成要素の輝度に及ぼす年齢はここで23,24,26を使用するが表示されません。1 mg/mL Sn GFP (CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE) および 10 μ G/ml トレ Cre 結果層 II/III (図 3 b) の明るい細胞 (図 3 a) 主に希薄な分布を含む混合物の 1 μ l 注入。樹状突起と軸索のプロセス (図 3 b) と樹状突起スパイン (図 3) を視覚化することができます。我々 の経験では、いずれかで GFP などの単一の構造を標的とします。Cre または「超新星」構造が再現性をもって electroporated 胚の少なくとも 75% で式を生成します。
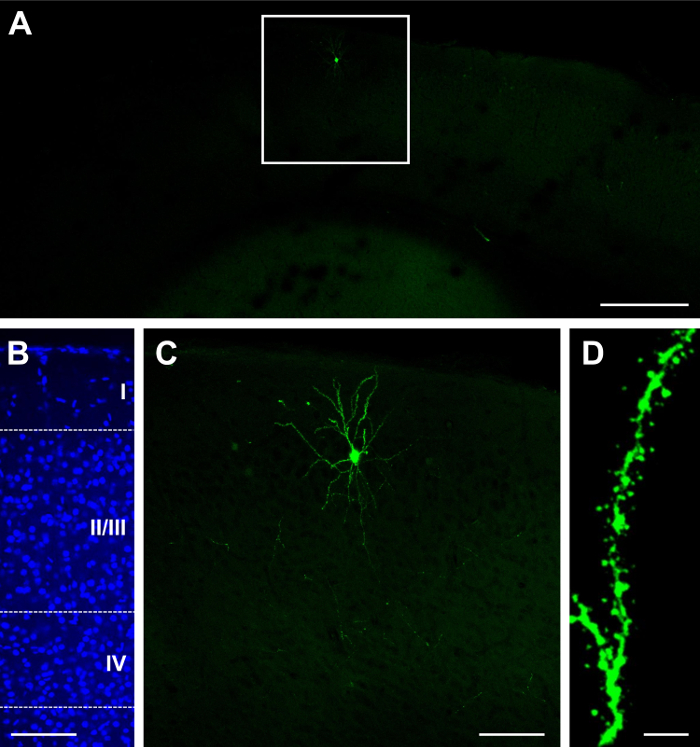
図 1:スパースと子宮内で単一のエレクトロポレーション後明るい表情構築含む GFP と Cre リコンビナーゼ。(A) E15.5 でエレクトロポレーション後 P23、大脳皮質の低倍率 (4 X) の蛍光顕微鏡像。(B) 皮質ラミネート (類、II/III、IV、および IV への深い層の層) を明らかに、DAPI 核染色の中倍率 (20 X) 蛍光顕微鏡像。(C) 単一ニューロンの中倍率 (20 X) 蛍光顕微鏡像。(D) 樹状突起スパインの高倍率 (60 X) 蛍光顕微鏡像。スケール バー = 200 μ m (A);100 μ m (B, C);5 μ m (D)。この図の拡大版を表示するのにはここをクリックしてください。
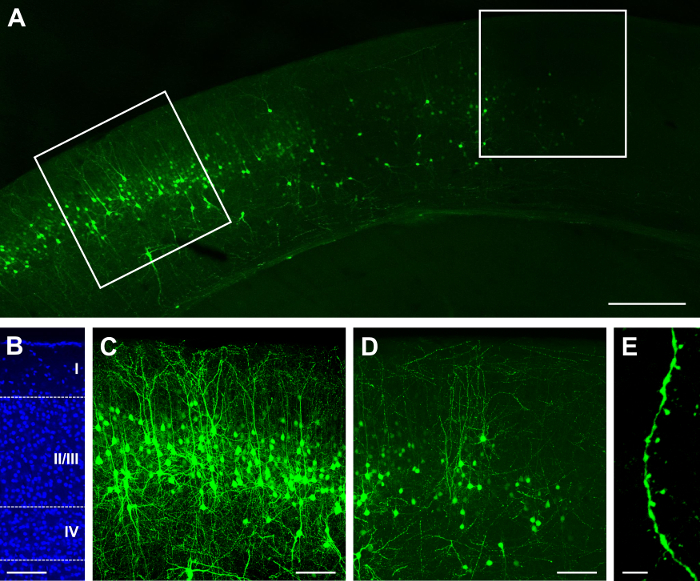
図 2:高密度と子宮内で単一のエレクトロポレーション後明るい表情構築含む GFP と Cre リコンビナーゼ。(A) E15.5 でエレクトロポレーション後 P14、大脳皮質の低倍率 (4 X) 蛍光顕微鏡像。(B) 皮質ラミネート (類、II/III、IV、および IV への深い層の層) を明らかに、DAPI 核染色の中倍率 (20 X) 蛍光顕微鏡像。(C) 分類の最も密の領域のニューロンの中倍率 (20 X) 蛍光顕微鏡像。(D) 分類の最も密の領域の周辺で撮影されたニューロンの中倍率 (20 X) 蛍光顕微鏡像。(E) 樹状突起スパインの高倍率 (60 X) 蛍光顕微鏡像。スケール バー = 200 μ m (A);100 μ m (B, C, D)。5 μ m (E)。この図の拡大版を表示するのにはここをクリックしてください。

図 3:スパースと明るい表情に超新星 GFP子宮内エレクトロポレーション構築含む GFP と Cre リコンビナーゼ後。(A) E15.5 でエレクトロポレーション後 P14、大脳皮質の低倍率 (4 X) 蛍光顕微鏡像。(B) 皮質ラミネート (類、II/III、IV、および IV への深い層の層) を明らかに、DAPI 核染色の中倍率 (20 X) 蛍光顕微鏡像。(C) 単一ニューロンの中倍率 (20 X) 蛍光顕微鏡像。(D) 樹状突起スパインの高倍率 (60 X) 蛍光顕微鏡像。スケール バー = 200 μ m (A);100 μ m (B, C);5 μ m (D)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
モザイク脳組織を生成する floxed マウスにおける Cre リコンビナーゼとエレクトロポレーションの子宮内の組み合わせを紹介します。このアプローチの利点は、新しいマウス行が異なる細胞サブタイプが対象とするたびに生成する必要はありません: 興奮性ニューロン、抑制ニューロンまたは時間によってグリア細胞を対象に子宮内でエレクトロポレーションを使用できますエレクトロポレーション15,16,17,18,19,20,21,34のと場所。我々 のアプローチで大脳皮質をターゲットが一貫して再現可能な我々 は発展途上の終脳の広い地域にわたって配置することができます 5 mm 径エレクトロポレーション電極を使用するため。別のサイト (例えば間脳、網膜)、脳や大脳皮質内の領域の具体的なターゲットを対象とする手順、この目的のために明示的に設計された電極使用15,かもしれませんが16. また明るいラベルを提供し、すべての蛍光標識ニューロンに Cre リコンビナーゼが含まれていることを保証する単一の構造を提供します。明るい表示を達成するために単一の構造を使用しての欠点はラベル付きの人口密度が高すぎる (図 2) をすることができます (図 2 D) 標識領域の周囲の細胞のイメージングによって解決できます。また、Cre リコンビナーゼ式17に依存する蛍光の構造式をデザインできるようにする、低発現レベルは、蛍光マーカーの免疫染色を必要があります。この制限は、Cre 依存蛍光マーカー式 (図 3 a)23,24の「超新星」システムによって扱われます。
子宮内エレクトロポレーション Cre lox 再結合を結合することに加えてタイミング妊娠女性の最適な繁殖のためのいくつかの改善を提供しています。騒音、振動による層流フードなどの機器から自由であるホールディング ルームでマウスを維持することが重要です。入れ子の材料、プラスチックのイグルーと環境を豊かにし、ヒマワリの種 (材料のリスト参照) のようなサプリメントします。環境への配慮から離れて女性の最初のごみが通常最も低い生存率を我々 は気づいています。したがって、我々 のプロトコルは、子宮内でエレクトロポレーションを実行する女性の 2 番目の妊娠まで待っているを示唆しています。この戦略は、くずの生存率を高める、それはまた、手術時間を長くことができますし、手術の成功をこのように低くくずサイズを大きく傾向があります。したがって、特に多数の胚 (例えば8 以上) が発生して、組織が最も損傷を受けやすいいくつかの胚は、胚を特に卵巣や子宮頸部に最も近い、エレクトロポレーションをスキップをお勧めします。さらに、(プラスチック イグルー、素材、栄養サプリメントをネスト) 上記同じ環境エンリッチメントの戦略を使用して出産後仔の生存を増加する傾向があります。また、その発情では起こり、女性で初のごみの分娩後数時間注意してくださいすることが重要です。この場合、彼女の 2 番目のくずに出産し、別の交配を試みるために離乳タイムになった後に女性を許可します。とき膣のプラグを探して、特に雌は、発情前に、の晩の場合プラグインが見つからない場合でも、女性を分離することをお勧めします。特定の菌株のプラグはスポットには、困難であり概念が既に発生している場合があります。
改善の別の領域が子宮内でエレクトロポレーション用の適切なマイクロインジェクション ピペットを生産です。重要なステップは、側脳室に DNA 注入用ピペットを引っ張るします。ここでは、一貫性のある先端サイズと大まかな先端のピペットを設定するための詳しいプロトコルを提供します。他の方法は戻ってメス刃15で先端を壊すなど鉗子16,17で先端をつまんでします。ピペット チップが小さすぎる、彼らが正しく子宮壁に穴を開けるが、噴射流量がピペットが胎生期脳に詰まっている時間の延長、低過ぎることに注意してください。ピペット チップがあまりにも大きい場合は、子宮壁と胎生期脳を傷める可能性があります。ピペット チップがあまりにも滑らかな場合損傷胚を破壊する前に子宮壁および/または胎児の頭蓋骨に大きなディボットが発生します。20-25 μ m チップを生産し、(例えば対物レンズ 10 倍の) に簡単な光学顕微鏡の下のヒントを検査する大まかな区切りの作成の練習まで一貫性のある結果を達成。その液体をテストすることができますヒントのサイズが許容範囲内であることを確認する別の方法は、吸引チューブ アセンブリと合理的なレート (例: ~0.5 μ L/s) で戻します。インジェクション ピペット校正し、卒業、側脳室に配信される DNA の正確な量が知られています。これは大きさの順に再現性をもって必要なスパース性を達成するための最も重要なステップです。つまり、指定された濃度をラベリングなど特定の範囲内で 10 に 100 ラベル付きニューロン得られるはず。
プロトコルの最も重要なステップは、子宮内のエレクトロポレーション手順です。子宮をあらわにしながら非常に優しくすること。腹腔内から最後の胚を引き出してから、卵巣や子宮頸部に引っ張らないように確認します。マイクロインジェクションとエレクトロポレーションの間に親指と人差し指を使用して側脳室を明らかにする胚の穏やかな、器用な操作ができ胚子宮壁に対して優しくプッシュすることができます。非常に穏やかなタッチは、子宮と胚を処理するときに重要です。穏やかなタッチを達成するために困難な場合、胎児や組織の損傷を引き起こす、子宮を取り締まってから鉗子を防ぐために組み込みの制限ねじリング鉗子を使用します。さらなる考察はカルプロフェンと手術前にすぐにブプレノルフィンの両方を管理する、子宮の手術中に胚の生存に影響を与えることがなく効果的な疼痛管理を提供するために表示される練習料金35.
私たちの組織学的手順の簡略化を以下では、いくつかの手順が重要です。定着剤の実験的脳を灌後、は、脳をポスト固定の間に損傷から脳組織を保護する頭蓋骨のまま。重合 PFA ソリューションとして数週間、その蛍光を注意してください日間 PFA が減少 1% の脳を保存することが可能です。100 μ m をスライス コロナ セクションは通常十分に薄いセクション全体を通じて多くの樹状突起と軸索の形態を維持しながら共焦点顕微鏡を許可です。固定が正しく発生した場合は、シアノアクリ レート系接着剤で単に振動ミクロトームに P13 より古い動物から脳をマウントできます。ただし、脳が振動ミクロトームのカットにもしなやかな場合、接着小さな寒天やアガロース ブロックそれ断面化の対象は、曲げからそれを防ぐためには、脳の後ろにダウン。問題が解決しない場合は、若い生後脳 (ステップ 5.8) の候補として、振動ミクロトームをカットするブロックを形成する寒天に脳を埋め込みます。
このメソッドは、ニューロンの遺伝子の細胞の自律的機能を研究するために使用できるモザイクを生成するために子宮内エレクトロポレーションと Cre lox 組換えシステムを兼ね備えています。このメソッドは、遺伝子構造 (例えばCRISPR/Cas9)6、またはすべて可能性があります他のサイト固有リコンビナーゼを (例えばFlp/FRT やドレ/ロックス24)、編集の子宮内でエレクトロポレーションをサポートする構成もでした。モザイク脳組織を生成する設計されています。モザイク組織が生成される可能性があります 1 つの有望な代替手法は、新生児マウス36側脳室内投与によるウイルスの配信です。15,16,17,18,19,20、ここと他の場所で実証として萌芽期の年齢で脳室内注入と組み合わせる 21,22,37, Cre リコンビナーゼ符号化ウイルスベクターは、心室のゾーンで floxed 前駆細胞に感染する出生前に配信でした。1 つの重要な考慮事項は、ウイルスのベクトルがまばらな切除とラベリングを達成するために十分に希釈されてことを確認するでしょう。ただし、これは神経解剖学的観察 (例えば樹状突起スパインまたは楔形)24の本質的な蛍光マーカーを含む、配信されているコンストラクトの低コピー数であります。この落とし穴、「超新星」として同じ戦略を使用して新しい構成要素に対抗するためここに示す構造は、ラベル付きセル24明るさに対応する減少せずまばらなラベリングを達成するためにされる可能性があります。ウイルス配信で別の重要な考慮事項は、配信構造あるプロモーターの研究されている細胞集団 (例えば興奮性錐体細胞) に固有であることを確認です。ウイルスのベクトルの脳室内注入ゾーンを含むだけでなく、心室背終脳の皮質と海馬の興奮性ニューロンの生成場所、心室を囲むすべての組織だけでなく、内側の感染症が発生し、横方向の神経節隆起多く皮質介在ニューロンが34を生まれています。構造のウイルスの配信と比較して子宮内エレクトロポレーションのもう一つの特徴は、配信の比較的狭いタイム ウィンドウです。ウイルス側脳室に注入は術後の心室のゾーンの内側を覆う細胞に感染し続けている保持できます。対照的に、エレクトロポレーションは、秒、はるか特定セルのセットをターゲットに発生します。これが長所や短所によって調査されるべき細胞亜集団の調査担当者にあります。
我々 のアプローチは単一の構造または「超新星」構造の導入による Cre lox 再結合をサポートしていますいます。「超新星」の構成要素の場合に利点と制限のこの戦略を使用精通する捜査官をお勧めします。たとえば、Cre 削除のタイミングは、層 II/III24大脳皮質の興奮性ニューロンで 2 日以内に発生する実証されています。したがって、それはもっともらしい Cre 切除できるエレクトロポレーションの直後ではなく、次のエレクトロポレーション、48 時間以上発生することです。したがって、述べ、タイミングおよび Cre 切除 (例えばCre レポーター マウスの線を使用して) の位置の他の形態は小さな枠内 Cre 切除が重要な研究を中心に、この新技術の使用を補完するために使用ください。考察。別の潜在的な落とし穴は、「超新星」の実験で細胞の小さな割合が Cre リコンビナーゼを表現できることです。たとえば、図 3、我々 はコロラド州 electroporated 2 プラスミドの: CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE の高濃度と低濃度トレ Cre。TRE は、漏れのプロモーターは、これはまれな出来事でしょうが、Cre リコンビナーゼがトレ Cre プラスミドがない, 停止, EGFP tTA プラスミドを受け取った細胞の表現でした。必須のラベルのすべてのセルがあるいかなる Cre を介した切除、「超新星」実験する Cre の recombinase の外式標識細胞制御実験を補充する必要があります実験の評価は、ほか (例: Cre リコンビナーゼ免疫組織化学) を意味します。
要約すると、我々 のプロトコルは簡単に子宮内エレクトロポレーション モザイク解析のためのさらに便利で適応法を作って、これらの新しい構造に合わせて変更されます。したがって勉強するモザイク脳組織体内の複数の方法で遺伝子組み換えの力で子宮内でエレクトロポレーションを結合できます。
開示事項
著者はある利益相反を開示します。
謝辞
著者らは、ジェームズ ・ マディソン大学生物教室・ ジェームズ ・ マディソン大学光顕微鏡イメージング施設の寛大なサポートをありがとうございます。夫妻ジャスティン ・ w ・ ブラウンとコーリー ・ l ・ クレランド手術材料と空間の寛大な調整のために博士マーク ・ l ・ ガブリエレ若い生後ティッシュの準備、に関する有益な助言を。この研究はだった 4-バージニア州、連邦のバージニア州 (G.S.V.) を推進するための共同パートナーシップとによってバージニア州アカデミーの科学小プロジェクト研究助成金 (G.S.V.) 共同研究助成金によって一部で賄われて。学部研究生奨学金 (K.M.B.) に、ファレル夏研究奨学金 (K.M.B.) をジェームズ ・ マディソン大学第 2 世紀への奨学金 (K.M.B.)、寛大サポート ベティ Jo 愛するバトラー 58年基金によって提供されているジェームズマディソン大学百周年記念奨学金 (C.J.H.) に、ジェームズ ・ マディスン大学ルーシー ロビンソン検索 30年記念奨学金 (Z.L.H.) に、科学と数学教員援助交付金 (G.S.V.) にジェームズ ・ マディソン大学。
資料
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | The Jackson Laboratory | #000664 | See "1. Mouse set-up" (step 1.1, "wildtype mice") |
| GFP.Cre empty vector | AddGene | #20781 | See "2. DNA set-up" (step 2.1 "single DNA construct that codes for Cre recombinase as well as a fluorescent marker"). GFP.Cre empty vector was a gift from Tyler Jacks. |
| pK029.CAG-loxP-stop-loxP-RFP-ires-tTA-WPRE (Supernova) | AddGene | #69138 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK029.CAG-loxP-stop-loxP-RFP-ires-tTA-WPRE (Supernova) was a gift from Takuji Iwasato. |
| pK031.TRE-Cre (Supernova) | AddGene | #69136 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK031.TRE-Cre (Supernova) was a gift from Takuji Iwasato. |
| pK038.CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE (Supernova) | AddGene | #85006 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK038.CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE (Supernova) was a gift from Takuji Iwasato. |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | #12362 | See "2. DNA set-up" (step 2.3 "endotoxin-free plasmid purification kit") |
| Trypan Blue powder, BioReagent grade | Sigma | T6146-5G | See "2. DNA set-up" (step 2.5 "trypan blue") |
| Sodium Chloride, ACS, 2.5 kg | VWR | BDH9286-2.5KG | See "2. DNA set-up" (step 2.5 "NaCl") |
| Potassium Chloride, ACS, 500 g | VWR | #97061-566 | See "2. DNA set-up" (step 2.5 "KCl") |
| Sodium phosphate dibasic, ReagentPlus, 100 g | Sigma-Aldrich | S0876-100G | See "2. DNA set-up" (step 2.5 "Na2HPO4") |
| Potassium phosphate monobasic, ReagentPlus, 100 g | Sigma-Aldrich | P5379-100G | See "2. DNA set-up" (step 2.5 "KH2PO4") |
| Hydrochloric acid, ACS reagent, 500 mL | Fisher Scientific | A144-500 | See "2. DNA set-up" (step 2.5 "HCl") |
| P-97 Micropipette Puller | Sutter Instrument | P-97 | See "3. Pipette set-up" (step 3.1 "glass capillary puller") |
| 3.0 mm wide trough filament | Sutter Instrument | FT330B | See "3. Pipette set-up" (step 3.1 "glass capillary puller") |
| Thin Wall Glass Capillaries, 4", 1 / 0.75 OD/ID | World Precision Instruments | TW100-4 | See "3. Pipette set-up" (step 3.1.1 "glass capillary") |
| Single Ply Soft-Tech Wipes, 4.5" | Phenix | LW-8148 | See "3. Pipette set-up" (step 3.2.1 "single-ply task wipe"); other single-ply wipes (e.g. Kimwipes) can be used. |
| Graefe Forceps, 7 cm, Straight, 0.7 mm 1x2 Teeth | World Precision Instruments | #14140 | See "4. In utero electroporation" (step 4.1 "Graefe forceps") |
| Iris Scissors, 11.5 cm, Straight, 12-pack | World Precision Instruments | #503708-12 | See "4. In utero electroporation" (step 4.1 "iris scissors") |
| Hartman Mosquito Forceps, 9 cm, Straight, 12-pack | World Precision Instruments | #503728-12 | See "4. In utero electroporation" (step 4.1 "Hartman mosquito forceps") |
| General Purpose Non-Woven Sponges, 2" x 2", 4-ply | Medrepexpress | #2204-c | See "4. In utero electroporation" (step 4.1 "non-woven gauze sponges") |
| Ring Tipped Forceps, 10 cm, Straight, 2.2mm ID | World Precision Instruments | #503203 | See "4. In utero electroporation" (step 4.1 "ring-tipped forceps") |
| Pyrex petri dishes complete, O.D. × H 100 mm × 20 mm | Sigma-Aldrich | CLS3160102-12EA | See "4. In utero electroporation" (step 4.1 "Petri dishes") |
| Flat Type Instrument Tray, Stainless Steel, 13-5/8" x 9-3/4" x 5/8" | Amazon | B007SHGAHA | See "4. In utero electroporation" (step 4.1 "stainless steel tray") |
| Platinum Tweezertrode, 5 mm | BTX | #45-0489 | See "4. In utero electroporation" (step 4.3 and 4.16 "tweezer-type electrodes") |
| ECM 830 Foot Pedal | BTX | #45-0211 | See "4. In utero electroporation" (step 4.3 and 4.17 "foot pedal") |
| ECM 830 Generator | BTX | #45-0052 | See "4. In utero electroporation" (step 4.3 "generator") |
| Single Animal Isoflurane Anesthesia System with Small Induction Box | Harvard Apparatus | #72-6468 | See "4. In utero electroporation" (step 4.4 and 4.6 "nose cone", step 4.4 "induction chamber") |
| Ophthalmic ointment | Hanna Pharmaceutical Supply Co | #0536108691 | See "4. In utero electroporation" (step 4.7 "veterinary ophthalmic ointment") |
| Space Gel (AIMS) | VWR | #95059-640 | See "4. In utero electroporation" (step 4.8 "sealed pouch filled with supersaturated salt solution") |
| Hair Remover Gel Cream, Sensitive Formula | Veet | #062200809951 | See "4. In utero electroporation" (step 4.9 "depilatory cream") |
| 10ul Low Retention Tip Starter (960 tips/pk) | Phenix Research Products | TSP-10LKIT | See "4. In utero electroporation" (step 4.12 "sterile 10 µL micropipette tip") |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177 | See "4. In utero electroporation" (step 4.15 "aspirator tube assembly") |
| Braided Absorbable Suture, 4-0, Needle NFS-2(FS-2), 27" | Medrepexpress | MV-J397 | See "4. In utero electroporation" (step 4.19 "absorbable sutures") |
| “LiquiVet Rapid” Tissue Adhesive | Medrepexpress | VG3 | See "4. In utero electroporation" (step 4.20 "tissue adhesive") |
| Hypodermic syringes, polypropylene, Luer lock tip, capacity 1.0 mL | Sigma-Aldrich | Z551546-100EA | See "4. In utero electroporation" (step 4.21 "1 mL syringe") |
| BD Precisionglide syringe needles gauge 26, L 1/2 in. | Sigma-Aldrich | Z192392-100EA | See "4. In utero electroporation" (step 4.21 "26G, ½” needle") |
| Nestlets Nesting Material | Ancare | NES3600 | See "4. In utero electroporation" (step 4.24 "nesting materials") |
| Sunflower Seeds, Black Oil, Sterile | Bio-Serv | S5137 | See "4. In utero electroporation" (step 4.24 "sunflower seeds") |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | See "5. Histology" (step 5.1.1 "PFA") |
| Economy Tweezers #3, 11 cm, 0.2 x 0.4 mm tips | World Precision Instruments | #501976 | See "5. Histology" (step 5.5 "tweezers") |
| Agar powder | Alfa Aesar | #10752 | See "5. Histology" (step 5.8.1 "agar") |
| Single-edge razor blades, #9 blade | Stanley Tools | #11-515 | See "5. Histology" (step 5.9 "single-edge razor blade") |
| Specimen disc S D 50 mm | Leica | #14046327404 | See "5. Histology" (step 5.9 "vibrating microtome specimen disc") |
| Buffer tray S assembly | Leica | #1404630132 | See "5. Histology" (step 5.10 "buffer tray") |
| VT1000 S Vibratome | Leica | #14047235612 | See "5. Histology" (step 5.10 "vibrating microtome") |
| Double Edge Razor Blades | Personna | BP9020 | See "5. Histology" (step 5.10 "blade") |
| Knife Holder S | Leica | #14046230131 | See "5. Histology" (step 5.10 "knife holder") |
| Studio Elements Golden Taklon Short Handle Round Brush Set | Amazon | B0089KU6XE | See "5. Histology" (step 5.12.1 "fine tipped paintbrush") |
| Superfrost Plus Slides | Electron Microscopy Services | #71869-11 | See "5. Histology" (step 5.12.1 "microscope slide") |
| ProLong Diamond Antifade Mountant, 10 ml | Thermofisher | P36970 | See "5. Histology" (step 5.12.3-5.12.4 "mountant") |
| Cover Glass, 24 x 50 mm, No. 1 | Phenix Research Products | MS1415-10 | See "5. Histology" (step 5.12.4 "coverslip") |
| 4′,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | Sigma-Aldrich | D9542 | See "5. Histology" (step 5.13.1 "DAPI") |
| Fixed Stage Upright Microscope | Olympus | BX51WI | See "5. Histology" (step 5.15 "light microscope") |
| Laser Scanning Confocal Microscope | Nikon | TE2000/C2si | See "5. Histology" (step 5.15 "confocal microscope") |
| 4x objective, NA = 0.20 | Nikon | CFI Plan Apo Lambda 4X | See "5. Histology" (step 5.15 "low-power objective") |
| 20x objective, NA = 0.75 | Nikon | CFI Plan Apo Lambda 20X | See "5. Histology" (step 5.15 "medium-power objective") |
| 60x objective, NA = 1.40 | Nikon | CFI Plan Apo VC 60X Oil | See "5. Histology" (step 5.15 "high-power objective") |
参考文献
- Southwell, D. G., Froemke, R. C., Alvarez-Buylla, A., Stryker, M. P., Gandhi, S. P. Cortical plasticity induced by inhibitory neuron transplantation. Science. 327 (5969), 1145-1148 (2010).
- Hanson, J. E., Madison, D. V. Presynaptic FMR1 genotype influences the degree of synaptic connectivity in a mosaic mouse model of fragile X syndrome. J. Neurosci. 27 (15), 4014-4018 (2007).
- Patel, A. B., Hays, S. A., Bureau, I., Huber, K. M., Gibson, J. R. A Target Cell-Specific Role for Presynaptic Fmr1 in Regulating Glutamate Release onto Neocortical Fast-Spiking Inhibitory Neurons. J. Neurosci. 33 (6), 2593-2604 (2013).
- Patel, A. B., Loerwald, K. W., Huber, K. M., Gibson, J. R. Postsynaptic FMRP promotes the pruning of cell-to-cell connections among pyramidal neurons in the L5A neocortical network. J. Neurosci. 34 (9), 3413-3418 (2014).
- McConnell, M. J., et al. Mosaic Copy Number Variation in Human Neurons. Science. 342 (6158), 632-637 (2013).
- McConnell, M. J., et al. Intersection of diverse neuronal genomes and neuropsychiatric disease: The Brain Somatic Mosaicism Network. Science. 356 (6336), eaal1641 (2017).
- Gu, H., Marth, J. D., Orban, P. C., Mossmann, H., Rajewsky, K. Deletion of a DNA polymerase beta gene segment in T cells using cell type-specific gene targeting. Science. 265 (5168), 103-106 (1994).
- Hodges, J. L., et al. Astrocytic Contributions to Synaptic and Learning Abnormalities in a Mouse Model of Fragile X Syndrome. Biol. Psychiatry. (17), 1-11 (2016).
- Young, P., Qiu, L., Wang, D., Zhao, S., Gross, J. Single-neuron labeling with inducible cre-mediated knockout in transgenic mice. Nat. Neurosci. 11 (6), 721-728 (2011).
- Zong, H., Espinosa, J. S., Su, H. H., Muzumdar, M. D., Luo, L. Mosaic Analysis with Double Markers in Mice. Cell. 121 (3), 479-492 (2005).
- Hippenmeyer, S., et al. Genetic mosaic dissection of Lis1 and Ndel1 in neuronal migration. Neuron. 68 (4), 695-709 (2010).
- De la Rossa, A., Jabaudon, D. In vivo rapid gene delivery into postmitotic neocortical neurons using iontoporation. Nat. Protoc. 10 (1), 25-32 (2015).
- Lu, W., Bushong, E. A., Shih, T. P., Ellisman, M. H., Nicoll, R. A. The cell-autonomous role of excitatory synaptic transmission in the regulation of neuronal structure and function. Neuron. 78 (3), 433-439 (2013).
- Duan, Y., et al. Semaphorin 5A inhibits synaptogenesis in early postnatal- and adult-born hippocampal dentate granule cells. eLife. 3, 1-24 (2014).
- Dixit, R., et al. Efficient Gene Delivery into Multiple CNS Territories Using In utero Electroporation. J. Vis. Exp. (52), e2957 (2011).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero Electroporation: Controlled Spatiotemporal Gene Transfection. J. Vis. Exp. (54), e3024 (2011).
- Briz, C. G., Navarrete, M., Esteban, J. A., Nieto, M. In utero Electroporation Approaches to Study the Excitability of Neuronal Subpopulations and Single-cell Connectivity. J. Vis. Exp. (120), (2017).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240 (1), 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nature protocols. 1 (3), 1552-1558 (2006).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 10 (3), 1027-1032 (2007).
- Pacary, E., et al. Visualization and Genetic Manipulation of Dendrites and Spines in the Mouse Cerebral Cortex and Hippocampus using In utero Electroporation. J. Vis. Exp. (65), e4163 (2012).
- Mizuno, H., et al. NMDAR-Regulated Dynamics of Layer 4 Neuronal Dendrites during Thalamocortical Reorganization in Neonates. Neuron. 82 (2), 365-379 (2014).
- Luo, W., et al. Supernova: A Versatile Vector System for Single-Cell Labeling and Gene Function Studies in vivo. Sci. Rep. 6, 35747 (2016).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab animal. 38 (9), 305-310 (2009).
- Vidal, G. S., Djurisic, M., Brown, K., Sapp, R. W., Shatz, C. J. Cell-Autonomous Regulation of Dendritic Spine Density by PirB. eNeuro. 3 (5), 1-15 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS ONE. 7 (4), 1-5 (2012).
- Andreu-Agullo, C., Maurin, T., Thompson, C. B., Lai, E. C. Ars2 maintains neural stem-cell identity through direct transcriptional activation of Sox2. Nature. 481, 195-198 (2011).
- Scotto-Lomassese, S., et al. Fragile X mental retardation protein regulates new neuron differentiation in the adult olfactory bulb. J. Neurosci. 31, 2205-2215 (2011).
- . . Plasmids 101: A Desktop Resource. , (2017).
- . . Pipette Cookbook. , (2015).
- Cuddington, B., Verschoor, M., Mossman, K. Handling of the Cotton Rat in Studies for the Pre-clinical Evaluation of Oncolytic Viruses. J. Vis. Exp. (93), e52232 (2014).
- Leary, S., et al. . AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Anderson, S. A., Eisenstat, D. D., Shi, L., Rubenstein, J. L. R. Interneuron Migration from Basal Forebrain to Neocortex: Dependence on Dlx Genes. Science. 28 (5337), 474-476 (1997).
- Parker, J. M., Austin, J., Wilkerson, J., Carbone, L. Effects of Multimodal Analgesia on the Success of Mouse Embryo Transfer Surgery. J. Am. Assoc. Lab. Anim. Sci. 50 (4), 466-470 (2011).
- Kim, J. -. Y., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualising and manipulating neuronal circuits in vivo. Eur. J. Neurosci. 37 (8), 1203-1220 (2013).
- Pierfelice, T. J., Gaiano, N. Ultrasound-Guided Microinjection into the Mouse Forebrain In Utero at E9.5. J. Vis. Exp. (45), e2047 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved