Method Article
גרימת Cre-לקס רקומבינציה ב העכבר קליפת המוח דרך בתוך הרחם אלקטרופורציה
* These authors contributed equally
In This Article
Summary
פונקציות תא-אוטונומי של גנים במוח יכולים להילמד על ידי גרימת הפסד או רווח של פונקציה באוכלוסיות דלילה של תאים. כאן, אנו מתארים בתוך הרחם אלקטרופורציה לספק Cre recombinase לאוכלוסיות דליל לפתח נוירונים בקליפת המוח עם הגנים floxed לגרום לאובדן פונקציה בתוך vivo.
Abstract
תא-אוטונומי פונקציות עצביים של גנים יכולים להתגלות על ידי גרימת הפסד או רווח של פונקציה של גנים באוכלוסיה דלילים וקטנים של נוירונים. כדי לעשות זאת מחייבת יצירת פסיפס שבו הם נוירונים עם הפסד או רווח של תפקוד הגן מוקף ברקמה גנטית בשלוות נפש. כאן, אנו משלבים את המערכת רקומבינציה Cre-לקס עם אלקטרופורציה בתוך הרחם על מנת ליצור פסיפס רקמת המוח יכול לשמש כדי לחקור את תפקוד התא-אוטונומי גנים בנוירונים. דנ א בונה (זמין באמצעות מאגרים), קידוד עבור תווית פלורסנט ו Cre recombinase, יוכנסו פיתוח נוירונים בקליפת המוח, המכיל גנים תמר מוקף עם אתרי loxP במוחם של עוברי העכבר באמצעות בתוך הרחם אלקטרופורציה. בנוסף, אנו מתארים עיבודים שונים בשיטה אלקטרופורציה בתוך הרחם להגביר שרידות ו הפארמצבטית. שיטה זו כרוכה גם הקמה של כייל עבור בתיווך Cre רקומבינציה אוכלוסיה דלילה או צפופה של נוירונים. ההכנות היסטולוגית של רקמת המוח שכותרתו אינם דורשים (אך ניתן להתאים) אימונוהיסטוכימיה. המבנה משמש ערובה זה fluorescently שכותרתו נוירונים לשאת הגן של יצורים recombinase. ההכנות היסטולוגית מאפשרים ניתוח מורפולוגי של נוירונים באמצעות הדמיה קונאפוקלית של דנדריטים, עצב ובשבילים, הדנדריטים. כי הפסד או רווח של פונקציה זו מושגת ברקמת פסיפס דליל, שיטה זו מאפשרת למידת הצורך תא-אוטונומי תנאי הכרחי של ג'ין מוצרים ויוו.
Introduction
יצירת פסיפס גנטי היא פרדיגמה ניסיוני הקלאסי להבנת הפונקציה של הגן עניין. כדי לקבוע אם הגן הוא הכרחי עבור הפנוטיפ הסלולר, הגישה הפשוטה ביותר היא הגורם לאובדן של הפונקציה של הגן בכל האורגניזם (למשל נוקאאוט). עם זאת, כדי לקבוע אם גן דרושה במיוחד סוג תא מסוים, נוקאאוט של הגן בכל האורגניזם אינה בגישה חוקי. במקום זאת, דרושה שיטה וזה יגרום אובדן התפקוד של גנים בתא נתון בזמן זה הוא מוקף ברקמה wildtype (דהיינו גנטית בשלוות נפש) – במילים אחרות, יצירת פסיפס רקמות. אם התא מוטציה מראה הפנוטיפ המוטנטי, אבל התאים המקיפים אותם wildtype לא, הפונקציות ג'ין באופן אוטונומי-תא ניתוח של רקמות פסיפס, שבה מוטציה בתאים מוקפים רקמה wildtype, אידיאלי להבנת פונקציות התא האוטונומי של גנים, במיוחד במוח שבו נוירונים עכשיו, דונלד יוצרים מחוברות רשת ענפה של רקמות.
כמה צורות של רקמת המוח פסיפס סיפקו עוצמה מודלים לחקור פונקציות התא האוטונומי של גנים. התמקדו ב השתלת עצביים1,2,פסיפס X-linked נקבה3,4, ו-5,פסיפס סומאטית אנדוגני6 נמשכים שלהם מסקנות בהתבסס על פסיפס רקמת המוח. מחיקה מותנה של הגן דרך מערכת רקומבינציה Cre-סלומון היא שיטה זה לוקח את מלוא היתרונות של הזמינות הגדולה של קווים העכבר מהונדס. בשיטה זו, שני אתרים loxP הם הציגו משני צדדיו רצף הנדרש של הגן (כמו אקסון), להשאירו ולצדו אתרי loxP כי שניהם מול באותו כיוון ("floxed"). Cre recombinase excises הרצף בין אתרי loxP7. בתיווך Cre רקומבינציה יכולה להיות מושגת על ידי עכברים floxed מעבר לקו אחר העכבר, לבטא Cre recombinase יחד עם סמן פלורסנט בקבוצת משנה של תאים ("קו כתב Cre"). זה הוכח במגוון דרכים כדי לחשוף את הפונקציות של גנים של קבוצות משנה של תאים, כמו נוירונים סינאפסות או האסטרוציטים8. Cre כתב שורות יכול לבטא CreERT2 כדי לאפשר בתיווך Cre רקומבינציה להיות סמים-inducible (יחיד-נוירון תיוג עם הסתרה inducible בתיווך Cre, או חלקלק)9. באסטרטגיה אחרת נקרא ניתוח פסיפס עם כפול סמנים (גברת)10,11, בתיווך Cre רקומבינציה interchromosomal מאפשר מוטציה homozygous להיווצר לצד משפחתית ולא משפחתית הטרוזיגוטיים רקמות. על הגישות הללו קו חדש של עכברים צריך להיות מיוצר בכל פעם עבור כל מועמד ג'ין או סוג של הסלולר זה נבדק. לחלופין, Cre recombinase יכול להיות מוצג נוצרו אחרי הלידה דרך iontophoresis12 או ויראלי וקטורים (כגון וירוסים adeno-הקשורים13 או lentiviruses14 נושא הסלולר סוג ספציפי היזמים). אסטרטגיה זו יוצרת חזקה ופוסט תיוג. כדי להתמקד בפיתוח נוירונים בקליפת המוח מוחי בדלילות prenatally, אסטרטגיית האידיאלי הוא בתוך הרחם אלקטרופורציה של Cre recombinase עם סמן פלורסנט.
בנוסף שילוב רקומבינציה Cre-סלומון דרך בתוך הרחם אלקטרופורציה לייצר פסיפס רקמות ויוו, אנו מציגים מספר עיבודים להליכים אחרים שפורסמו פרוטוקולים15,16, 17,18,19,20,21. אנו מספקים מידע כדי לשפר את ההצלחה אצל נקבות בהריון-מתוזמן הרבייה. אנחנו גם מתאר שתי אסטרטגיות שלנו להציג דלילים ובהירים תיוג של נוירונים בתוך הרקמה קורטיקלית: אסטרטגיה אחת היא titrate את הרמות של קידוד לבנות יחידה Cre recombinase, סמן פלורסנט22. אסטרטגיה נוספת היא להשתמש במערכת "סופרנובה", תוכנן במיוחד עם פרמטרים אלה המוח23,24. בנוסף, אנו מציעים שיפורים על הפקת פיפטות microinjection עקבית, העבודה הניתוח אלקטרופורציה בתוך הרחם . בסופו של דבר, אנחנו חלוקה לרמות בשלבים קריטיים הכנה היסטולוגית מפושט המאפשר הניתוח של הדנדריטים, דנדריטים, עצב ובשבילים, מבלי להכתים נוספת או אימונוהיסטוכימיה.
Protocol
השיטות המתוארות כאן אושרו על ידי חיה על עצמך ועל שימוש הוועדה (ACUC) של ג'יימס מדיסון אוניברסיטת, בהתאמה, תאימות עם כל הרלוונטיים ההנחיות הרגולטוריות ומוסדיים.
1. עכבר הקמה
- בית צעיר (> P60) העכבר floxed homozygous זכר ונקבה ביחד כדי להגדיר של זוג מגדל25.
הערה: פקד שלילי טוב הוא להגדיר זוג עכברים wildtype, ב- Cre איזה ביטוי recombinase לא יגרום פסיפס26מגדל נוסף. - לאפשר הנקבה ללדת ולגדל את הגורים הראשונים שלה עם הזכר. להשאיר את הזכר יחד עם הנקבה להגדיל ההישרדות של הגורים. לאחר הגמילה הגורים, למשל ביום כמחנכת (P) 21, להפריד את הנקבה ואת זכר.
-
רבייה מאתר
- בצע כיוונון מתוזמן של הזדווגות בין הנקביים והזכריים25. השתמש ברמזים חזותיים כדי לקבוע מחזור ייחום של נקבה27ובדוק מהנרתיק פקקים בבוקר לאחר ההזדווגות25.
- אם פקק, להפריד, ולשקול את הנקבה. ספירת היום יום עובריים (E) 0.5.
- המשך שקילה הנקבה כל 3-5 ימים כדי לקבוע אם היא בהריון. נקבות בהריון תהיה העלאה של 10-20% במשקל הגוף 7-10 ימים לאחר ההתעברות (E0).
הערה: שלב זה מאשר הריון קודם לכן בצורה מהימנה יותר מאשר בדיקה ויזואלית25. - אם הנקבה לא בהריון, חזור על השלבים 1.3.1-1.3.3.
- לאחר ההריון הוא אישר, לבחור את התאריך של אלקטרופורציה בתוך הרחם . כדי למקד שכבה II/III קורטיקלית אבות עצביים כפירמידה, מבצעים אלקטרופורציה ב E15.5.
2. הגדרת דנ א
- לבחור DNA בודד לבנות את הקודים Cre recombinase, כמו גם סמן פלורסנט, כגון חלבון פלואורסצנטי ירוק (GFP)28,29. לחלופין, השתמש במערכת "סופרנובה", תיאר בפירוט פרסומים קודמים23,24. ראה רשימת חומרים לדוגמה בונה.
- להגביר את construct(s) ה-DNA מ שלב 2.1 ב e. coli באמצעות טכניקות מיקרוביולוגית תקן30.
- לטהר את מבנה ה-DNA עם ערכת טיהור פלסמיד נטולת אנדוטוקסין ההוראות של היצרן. Elute הבונה עם אנדוטוקסין ללא מים.
הערה: בחירת ערכת טיהור ללא אנדוטוקסין מעל ערכת טיהור הסטנדרטי הוא קריטי. - לרכז את eluate DNA ל 1-3 מ"ג/מ"ל בהתאם להזמנה צפיפות תיוג26.
הערה: כייל נוגדנים תמיד צריך שתוקם בעת עבודה עם תבנית ה-DNA חדש, בהתחשב בכך שיש להם באורכים שונים, היזמים. לשקול הזרקת בונה על מספר ריכוזים שונים ו/או כמויות כדי להעריך את הביטוי. לדוגמה, זריקה של 1 µL או µL 1.5 על 2.0 mg/mL GFP. Cre הוא מסוגל לגרום דליל (µL 1) או צפופה (µL 1.5) תיוג של שכבה II/III חזותי נוירונים כפירמידה קורטיקלית26. - להוסיף 0.4% trypan blue 1 x buffered פוספט תמיסת מלח (PBS; 137 מ מ NaCl, מ מ 2.7 אשלגן כלורי, 10 מ מ נה2HPO4, מ מ 1.8 ח'2PO4 H2O, מותאם pH 7.4 עם HCl) 1:10 לפתרון ה-DNA מרוכז.
- להוסיף 10 x PBS 1:10 תמיסה מרוכזת ה-DNA.
- חנות הפתרון DNA מרוכזת בשעה 4 ° C. הפתרון ניתן לאחסן ללא הגבלת זמן.
3. הגדרת פיפטה
-
שימוש של פולר נימי זכוכית, משוך על פיפטה עם רב מאוד (10-15 מ מ) להתחדד וטובים מאוד עצה, אופייני של מדי סוכר הזרקת תאי גזע עובריים או העברת גרעין31.
הערה: כדי למנוע פסולת שמזהם את מדי סוכר, הם צריכה להיעשות תוך יומיים של הניתוח.- כיילו את פולר נימי זכוכית על-ידי ביצוע מבחן הרמפה, ההוראות של היצרן. שימוש הערך החום שנוצר כדי לתכנת את משיכת פרוטוקול באמצעות הפרמטרים הבאים: חום = (ערך מבחן כבש + 15), למשוך = 30, ול = 120, זמן = 100, לחץ = 200. הכנס את נימי זכוכית, הדקו את התפסים על פולר ולאחר להפעיל פרוטוקול מושך מתוכנתים, יצירת נר על נימי זכוכית.
- להבטיח כי האורך להתחדד הוא בין 10-15 מ מ באמצעות מיקרוסקופ אור מורכבות (למשל 10 X המטרה)31.
-
לשבור בחזרה על פיפטה להקים טיפ עם קצוות קשים בקוטר 20-25 מיקרומטר.
- מרכז מחיקה חד-רובדי הפעילות (ראה רשימת חומרים) מעל 50 מל גביע ומתח לנגב מתוח עם יד אחת. עם היד השנייה, להחזיק ודחף של פיפטה (להתחדד בצד למטה) בניצב, מלא דרך מרכז המחיקה, גורמת להפסקה להתחדד31.
הערה: לדחוף את פיפטה במלואן דרך המחיקה יהיה לייצר טיפ קוטר מיקרומטר 20-25 בערך 70% מהזמן. - אשר תחת מיקרוסקופ אור מורכבות (למשל 20 x המטרה).
התראה: שימוש הגנה העין תוך שבירת הזכוכית.
- מרכז מחיקה חד-רובדי הפעילות (ראה רשימת חומרים) מעל 50 מל גביע ומתח לנגב מתוח עם יד אחת. עם היד השנייה, להחזיק ודחף של פיפטה (להתחדד בצד למטה) בניצב, מלא דרך מרכז המחיקה, גורמת להפסקה להתחדד31.
- לכייל פיפטה מאת שואבת 1 µL של 0.4% trypan blue ב- 1 x PBS לתוך piptte מלא חלקית ולאחר מכן שסיימה את פיפטה עם סימנים 1 µL המבוסס על הגובה של µL 1 ב הפיפטה באמצעות סמן עמידים אלכוהול שקצהו פיין. השתמש את פיפטה מכוילת לסיים את פיפטות אחרים לפני השלכת. שמור פיפטות בעל פיפטה חינם מפני אבק וחלקיקים אחרים.
4. בתוך הרחם אלקטרופורציה
- במקום Graefe מלקחיים מספריים איריס, הרטמן יתושים מלקחיים, ארוגים גזה ספוגים, שקצהו טבעת מלקחיים, צלחות פטרי על מגש נירוסטה, עוטפים ברדיד אלומיניום. הכנס אוטוקלב מגש על saline 0.9% 1 ליטר (0.9% wt/כרך NaCl במים). אוטוקלב ב 121 מעלות צלזיוס ו kPa 3.5 במשך 40 דקות להסיר את החיטוי ולמקם באזור הניתוח מחוטא.
הערה: חיוני כדי לשמור על תנאים סטריליים במהלך הניתוח. - חממו את הבקבוק בלוק 1 ליטר מלוחים באמבט מים קטן עד 38 מעלות צלזיוס לפחות 2 שעות לפני הניתוח.
- להתחבר האלקטרודות פינצטה-סוג של דוושת רגל הגנרטור (ראה רשימת חומרים). בעקבות הוראות היצרן, להגדיר את הגנרטור להעביר חמישה 50 מילישניות פולסים של 50 V (עם מרווח 950 ms) כאשר מופעלות על ידי דוושת רגל. לחטא האלקטרודות פינצטה-סוג ומניחים על אזור הניתוח מחוטא.
- להפוך של חרוט האף הרדמה כפי שפורסמו בעבר32, אבל להשתמש הקצה של האצבע הכפפות latex nitrile או כדי ליצור בדיאפרגמה שמתאים בצורה מאובטחת על הפתיחה האף חרוט. חותכים חור מספיק גדול כדי להתאים על האף של העכבר הסרעפת.
- עמוק עזים ומתנגד עכברים בהריון ב E15.5 ב חדר אינדוקציה עם איזופלוריין (2-4%) מילוי חמצן טהור זורמים ב- 1 ליטר/דקה. לאחר מין ~ 1, לבחון את רפלקס שקמה בעצמה אחרי שמפילים (בעדינות להטות את התא אינדוקציה, להבטיח העכבר, לא בסדר עצמה). לשקול את העכבר כדי לקבוע מינונים של שיכוך כאבים מנוהל מאוחר יותר במהלך הניתוח.
- להעביר את העכבר האזור הכירורגי ולפקח בשאיפה איזופלוריין (1-2%) בחמצן טהור זורמים ב- 1 ליטר/דקה דרך קונוס האף כדי לשמור על העכבר במישור כירורגי. להשתמש מלקחיים כדי לבדוק את רפלקס פדלים (לצבוט הכפה בעדינות ולוודא כי העכבר אינו מחזיר רפלקס) כדי לוודא ההרדמה. לפקח על קצב נשימה ומאמץ, מחפש עמוק, נשימה רגיל (~ 70-100 נשימות לדקה), הקרומים הריריים הם ורודים. צבעה ולחה.
- להחיל משחה אופטלמולוגיות וטרינרי מספיק מעל העיניים כדי לכסות אותם לחלוטין להגנה מפני ייבוש במהלך ההליך.
- פלקס דיסק מתכת activator נרתיק אטום מלא supersaturated תמיסת מלח (ראה רשימת חומרים), הפעלת של התגבשות אקסותרמית של המלח. להניח 2 מגבונים חד-רובדי פעילות על התיק, במקום בעכבר על המשקה כדי לשמור על טמפרטורת הגוף.
- עיסוי קרם depilatory אל אזור הבטן עם ספוגיות כותנה עד הבטן פרווה מתמוסס (כ 20-40 s), לאחר מכן לנגב את הפרווה בטן. בזהירות תנקה כל קרם שאריות ו דפילציה הנותרים עם 70% אתנול וביו -כותנה מטליות. הצב fenestrated תלוי כירורגי סטרילי באזור הבטן.
- באמצעות הטכניקה aseptic, משוך את העור בבטן ולהרחיקו עם מלקחיים Graefe, עושים חתך קו האמצע הגחון ~ 2 ס מ על העור בעזרת מספריים איריס, המבטיח כי השריר הבסיסית לא מתאים.
הערה: מקובל חלופה ביצוע חתך במספריים מלקחיים ואיריס Graefe היא להשתמש אזמל, כפי שפורסם בעבר17. - למצוא את linea alba להמחיש האמצע של שרירי הבטן הישרים. למשוך שריר הבטן ולהרחיקו עם מלקחיים Graefe, ולגרום חיתוך קו האמצע ~ 2 ס מ נוסף שם עם מספריים איריס, לחשוף את חלל הבטן (הרחם הוא שקוף, העוברים יהיה גלוי מתחת). ודא כי שבבסיס רקמת הרחם, מעיים לא מתאים. לבצע את החתך בלבד גדול מספיק (בדרך כלל ~ 2 ס מ) להוציא ולחשוף את הרחם בנוחות.
הערה: מקובל חלופה ביצוע חתך במספריים מלקחיים ואיריס Graefe היא להשתמש אזמל, כפי שפורסם בעבר17. - באמצעות טיפ סטרילי µL 10 micropipette, לוותר על carprofen (מומס saline 0.9% סטרילי) ב 4 מ"ג/ק"ג לתוך חלל הבטן על שיכוך כאבים.
- תהדק את המלקחיים יתוש אחד של הרטמן על הקצה השמאלי של החתך הבטן הישר rectus. הנח המלקחיים על פטרי שהתהפכה משמאל של החתך, לשמור על הצד השמאלי של החתך. מהדק עוד מלקחיים יתושים הרטמן על הקצה הימני של החתך הבטן הישר rectus ולנוח המלקחיים על צלחת פטרי שהתהפכה בצד ימין של החתך, לשמור על הצד הנכון של החתך. הניחו ספוג גזה סביב האזור. של החתך.
- באמצעות הטבעת מלקחיים (ללא בורג הגבלת המצורפת), משוך את הרחם בין כל שני העוברים שכנות ללא ריסוק או ופצעו כל רקמות. להתחיל לשלוף כל העוברים דרך החתך, להניח אותן על גבי פד ספוג. כשאני מוציאה את העוברים האחרון של חלל הבטן, ודא כי לא למשוך על השחלות או צוואר הרחם. ברגע נחשף, חיוני לשמור על הרחם לח עם מלחית. הרחם מכילה בדרך כלל בין 5 ו 8 עוברי.
הערה: זה ניתן להוסיף פניצילין, סטרפטומיצין מלוחים17. - להתחבר פיפטה מכוילת של מכלול צינור ליניקת (ראה רשימת חומרים), ולהזריק µL אחת בדיוק של הפתרון דנ א מוכן בשלב 2 בקיר הרחם לתוך החדר הלטראלי של כל העובר. החדרים הצדדיים מופיעים שני טלאים telencephalon הגבי של העובר (תיקונים הם כהים יותר סביב רקמות של telencephalon). להשתמש את האגודל והאצבע במהלך microinjection ואלקטרופורציה לתמרן את העוברים, חשיפת החדרים הצדדיים ומאפשר את העוברים להיות דחף בעדינות בקיר הרחם במהלך ההזרקה. לאשר זריקה מוצלחת על ידי התבוננות trypan blue מילוי החדר הלטראלי.
- במקום הקתודה של פינצטה-סוג אלקטרודות (ראה רשימת חומרים) על הרחם, ישירות מעל קליפת המדיאלי, סימטרית כדי למקד את קליפת הראייה (פילוח חלופי אזורי המוח ידרוש אלקטרודה שונים השמה)16, 26. במקום האנודה על הרחם, רק נחות, והשתרשה עמוק בלבה הראש של העובר.
- לאשר אנודת ואת קטודית, נוגעות הרחם המקיף את העובר במקומות המתאימים. עם דוושת, לעורר את המשלוח של חמש 50 מילישניות פולסים של 50 V (עם מרווח 950 ms) על פני האלקטרודות.
הערה: מוזרק,-אניון DNA ינוע לכיוון הקתודה ו ישולבו לתוך אזור חדרית התאים הקרובים הקתודה. - להחזיר את הרחם חלל הבטן בכיוון זהה שהיא נמצאה. השתמש תמיסת מלח כדי לשמן את הרחם בזמן מנחה אותו באופן ידני, מאוד בעדינות, מטפל לא לעקור עוברי שררה ברחם.
- לסגור את שרירי הבטן בתפרים נספגים (ראה רשימת חומרים) באמצעות תפר קטעה פשוטה, לקשור את הקצוות עם קשר של המנתח. לא קליפ שהקצוות קרוב מדי את הקשר או שהקשר יהפוך התיר.
הערה: זה קריטי תפר שרירי הבטן כך קצוות הפצע סגורים לגמרי סגור, אך מבלי לגרום בישול לבן של השריר. קשרים צריך להיות צמוד אז הם לא יכולים להיות התיר. - סגור את שכבת העור בתפרים נספגים (תפר קטעה פשוטה, קשר מנתח, כמו שלב 4.19). למרוח כמות קטנה של רקמות דבק כדי לאחות את הפצע. החל רקמות דבק על הקשרים כדי למנוע unfastening. השתמש micropipette כדי להסיר כל דבק רקמות המקיפים את הפצע. זה יכול להיות aspirated מאת micropipette.
- להוריד את רמות איזופלוריין של 0.5-1.5%. ברגע רקמות דבק יבש (מבחן על-ידי נגיעה הכפפות כדי דבק), להסיר את איזופלוריין ולאפשר הנשי להחלים לבד בכלוב חמים. לנהל הבופרנורפין intraperitoneally-0.03 נקודות מ"ג/ק"ג בעזרת מזרק 1 מ"ל 26G, ½" מחט.
- להמשיך לעקוב אחר העכבר עד העכבר הוא התאושש לחלוטין, להתנהג בדרך כלל (כלומר לטפח, לחקור את הכלוב, אכילה או שתייה). ברגע התאושש, הנח הנשי בחזרה לכלוב עם זכר.
הערה: אם כל השלבים עוקבים, העכבר בדרך כלל להכרה בתוך 2 דקות, מיד מתחילים לנוע את הכלוב, מראה שום סימנים של אי נוחות. - אם העכבר מוצגים סימנים של אי נוחות (למשל שפופות יציבה, הפרשות פורפירין)33, לנהל carprofen-0.1 מ"ג/מ"ל באספקת המים. אם יש כמה סימנים של אי נוחות, או אם אי נוחות נמשכת במשך יותר מ 4 שעות למרות carprofen מינהל, מיד המתת חסד העכבר על ידי מתן זריקה קטלנית בקרום הבטן של קטאמין (240 מ"ג/ק"ג) - חריגות השירותים הווטרינריים (48 מ"ג/ק"ג)- קוקטייל איזופרומאזין (1.85 מ"ג/ק"ג) בעזרת מזרק 1 מ"ל 26 G, ½" מחט, ופעל עם צורה משנית המאושרות של המתת חסד33.
- כדי לשפר את ההישרדות של עוברי electroporated לאחר הלידה, שמור את הכלוב שקט מחזיק בחדר, ללא רעשים ורעידות. להעשיר את הסביבה עם igloos פלסטיק, חומרי קינון של תוספי מזון כגון זרעי חמניות (ראה רשימת חומרים). אין להעביר או להפריע את הכלוב, במיוחד במהלך 3 הימים הראשונים לאחר parturition.
5. היסטולוגית לקראת זריחה מיקרוסקופ
הערה: פרוטוקול זה היסטולוגיה ממוטבת עבור הכנת הרקמה מבעלי חיים שגילם יום לאחר הלידה (P) 13 שהיו electroporated בתוך הרחם. כדי להכין טישו מבעלי חיים צעירים לאחר הלידה (P0-P13), מומלץ לעקוב אחר כל השלבים (כולל זלוף transcardial), למרות המוח צריך להיות מוטבעת אגר לפני הכנת מקטעים (שלב 5.9). אפילו עשוי להיות מוכן רקמות מעוברים בתוך 1-2 ימים לאחר אלקטרופורציה, בשיטות שתוארו קודם לכן18,20.
-
הכנת paraformaldehyde (PFA) פתרון.
הערה: זה הכרחי כדי להכין PFA טריים, תוך יום אחד של הניסוי.
התראה: Paraformaldehyde הוא רעיל ויש לטפל בשכונה fume עם ציוד מגן אישי המתאים.- כדי להפוך 50 מ של 4% מחברים, חום 40 מ"ל מים 60 מעלות צלזיוס. להוסיף 2 g PFA תוך כדי ערבוב עם זכוכית מוט או ערבוב בר. הוסף 10 µL של NaOH M 10 כל 2 דקות עד PFA מתמוסס.
- הוסף 5 מ של 10 x PBS ולהביא פתרון נפח סופי של 50 מ ל מים.
- לאחר הבאת פתרון ל 50 מ ל, להתאים pH ל 7.4 כנדרש עם 10 מ' פתרון HCl. אפשר מגניב ולאחסן ב 4 º C.
- המתת חסד עכבר עם זריקה בקרום הבטן של קטאמין (240 מ"ג/ק"ג) - חריגות השירותים הווטרינריים (48 מ"ג/ק"ג) - איזופרומאזין (1.85 מ"ג/ק"ג) קוקטייל באמצעות מזרק 1 מ"ל 26G, ½" מחט. Transcardially perfuse PBS קר כקרח x 1 mL 10 או 20, ואחריו 25 או 40 מ"ל טריים, קפואים 4% PFA17. להשתמש באמצעי אחסון נמוך יותר עבור עכברים צעירים (P0-P13) כמחנכת ואמצעי אחסון גבוה יותר עבור עכברים בוגרים (P14 ומעלה).
- מיד לאחר זלוף, לערוף קארקאס העכבר בין עצם העורף C1 חוליה עם מספריים גדולים, הקילוף, למחוק את רוב העור שמסביב הגולגולת באמצעות מספריים איריס במיוחד העור, חזיתי שמסביב, הקודקוד ואת העורף עצמות. לשמור את הגולגולת ואת המוח ללא שינוי.
- מניחים את הגולגולת ואת המוח 10 מ ל 4% מחברים צינור חרוטי 50 מל במשך 24 שעות ביממה ב 4 ° C לתקן שלאחר רקמות. לאחר מכן להוסיף 30 מ ל 1 x PBS צינור חרוטי כדי לדלל את פתרון 1% מחברים עבור אחסון ב 4 º C.
הערה: השתמש צינור חרוטי נפרד עבור כל הגולגולת והמוח צורך לתקן פוסט. לא דגירה המוח 1% PFA לתקופה העולה על שבועיים, או קרינה פלואורסצנטית יתחיל לדעוך. - ובמקום במוח הגולגולת על משטח שטוח עם יחיד-רובדי פעילות מגבונים לחלח עם 1 x PBS. השתמש זוג מלקחיים (ראה רשימת חומרים) כדי להסיר את כל העור שנותר או קרום המקיפים את הגולגולת.
- באמצעות פינצטה, הסר תחילה את עצם העורף ולאחר מכן הסר בזהירות לעצמות, הזזת את הפינצטה החוצה מפני השטח של המוח. הסר בזהירות בכל קרומי המוח כדי למנוע נזק קליפת המוח.
- וודג בגב הפינצטה לתוך המוח לאורך הגולגולת לנתק את כל עצבי, מסירים את המוח.
-
צעירה מוח (P0-P13) כמחנכת
- להפוך 25 מ של 4% אגר על-ידי חימום PBS 1 x 25 מ ל עד 80 ° C. מערבבים, להמיס 1 g אגר עם בר מוט או ערבוב זכוכית).
- פתרון מגניב עד 35 ° צלזיוס תוך לבחוש. מקום במוח במיכל קטן (למשל הכובע של צינור חרוטי 50 מ ל), שופכים אגר פתרון המוח. לאפשר אגר להקשיח.
- לעשות חתך הילתית באופן ידני באמצעות תער קצה חד דרך המוח, כ 0.5 מ מ rostral כדי bregma. לבצע חתך הילתית עוד דרך המוח כ 0.5 מ מ סימטרית קליפת הראייה. במקום בריכה של דבק מגע דבק בקוטר זהה, בעוד rostral של המוח על התקליטור הדגימה מיקרוטום רוטטת במרכז. חבר את הקצה rostral של המוח מעל הבריכה של דבק, המבטיח כי השטח rostral של רקמת מאוגדת לדיסק הדגימה עם דבק.
- הר מאגר מגש על גבי רוטטת מיקרוטום ולאבטח עם ידית clamping מובנה. להכניס להב הסכין מחזיק, והר מחזיק סכין על גבי רוטטת מיקרוטום עם בורג clamping מובנה. לאבטח הדגימה דיסק עם המוח על גבי מגש המאגר באמצעות מובנית clamping המכשיר. הגדר הגדרת מהירות עד 5.70 (= 0.285 מ מ/s) וקביעת תדירות 5.33 (: 53.3 Hz).
- למלא את התא מעל הרמה של המוח 1 x PBS ולהוריד את הלהב לתוך מגניב. להתחיל לקחת 100 מיקרומטר מקטעים הילתית דרך הרקמות.
-
אם לא דורש עיבוד נוסף, כגון 4', 6-diamidino-2-phenylindole (דאפי) גרעיני להכתים או אימונוהיסטוכימיה.
- להשתמש במכחול משופעת בסדר להעביר חלקים ישירות מ- האזמל הקטן רוטטת לשקופית מיקרוסקופ, התאמת סעיפים 4-6 על כל שקופית.
- לאפשר הסעיפים להתייבש על ידי הפתילה פתרון משם עם מברשת משופעת בסדר, כך פרוסות המוח כבר לא להיסחף בשקופיות.
- אז, במקום טיפה אחת של mountant (ראה רשימת חומרים) על כל מקטע בשקופית.
- בעדינות שכבה של coverslip 24 x 50 מ מ על גבי, להבטיח כי 1) אין בועות אוויר הטופס על הסעיפים, סעיפים 2) אל תזוז, mountant 3) מכסה במלואה את האזור בין שקופיות coverslip. אפשר את mountant לרפא לפחות 24-48 שעות.
-
כתם גרעינים עם דאפי לבדיקה היסטולוגית של סחוס בקליפת המוח
- להשתמש במכחול משופעת בסדר להעביר כל מקטע לתוך פתרון המכילה 10 µg/mL דאפי (ראה רשימת חומרים) מדולל ב- 1 x PBS מהפתרון מניות (20 מ"ג/מ"ל דאפי במים).
- דגירה בפתרון דאפי למשך 5 דקות בטמפרטורת החדר, ולאחר מכן להשתמש במכחול משופעת בסדר כדי להעביר מקטע דאפי פתרון 1 x PBS דגירה ב- PBS 1 x עבור 5 דקות בטמפרטורת החדר. העברת סעיף שתיים יותר פעמים טרי 1 x PBS למשך 5 דקות. לאחר מכן, שימוש במכחול משופעת בסדר, העברת המקטע לשקופית מיקרוסקופ, בצע את השלבים הבאים 5.11.2-5.11.4, ולהמשיך עם שלב 5.13.
- חום צלחת פטרי זכוכית המכילים Valap (חלקים שווים וזלין לנולין, פרפין) על פלטה חמה בקביעה בחום נמוך עד נמס לחלוטין. חותם נחשף קצות השקופיות על-ידי צחצוח על Valap נמס.
- כדי לבדוק קרינה פלואורסצנטית ברקמה, שימוש במיקרוסקופ אור או מיקרוסקופ קונפוקלי (ראה רשימת חומרים) ולהגדיר מסנן נאותה לצפייה fluorophore את (למשל דאפי: עירור 325-375 ננומטר, פליטה 435-485 ננומטר; GFP: עירור 450-490 nm, פליטה 500-550 ננומטר)17. תמונות קונאפוקלית עשוי להילקח עם נמוך - (4 X, מפתח נומרי, NA = 0.20), בינוני-(20 X, NA = 0.75), ואת ובעוצמת (60 X, NA = 1.40) מטרות.
תוצאות
הסינגל לבנות GFP. Cre (ראה רשימת חומרים) היה electroporated-E15.5, דמיינו את P14. בהתאם את הריכוז של הבונה את עוצמת הזריקה, תוצאה של דלילה או צפופה ניתן להשיג22,26. לדוגמה, הזרקה של 1 µL של 2 מ"ג/מ"ל GFP. תוצאות Cre בהתפלגות דלילה של תאים עם תוויות, אשר יכול להיות בהיר (איור 1 א'), המותאמות לשפות אחרות של שכבה II/III (איור 1B). מכיוון הרקמה הוא בעובי 100 מיקרומטר, רוב ובשבילים דנדריטים נשמרים (איור 1C). יכול להיות שנצפו הדנדריטים-הגדלה גבוהה (60 X; איור 1D). הזרקה של µL 1.5-ריכוז זהה תוצאות מאוד צפוף תיוג (איור 2 א) בשכבה II/III (איור 2B), אשר יכול להיות תת אופטימלית שכן קשה לעקוב אחר המקור של neurites הדנדריטים (איור 2C). עם זאת, עדיין אפשר תמונה נוירון (איור דו-ממדי) ותהליכים שלה (איור 2E) על-ידי בחירת התא מואר בפריפריה של האזור עם תוויות (איור דו-ממדי).
בסופו של דבר, זה אפשרי להגדיל את הבהירות של נוירונים תוך שמירה על התפלגות דלילה של תאים עם תוויות. כאן, סופרנובה-GFP (ראה רשימת חומרים) היה electroporated-E15.5, דמיינו-P23. שימו לב, המבוסס על תצפיות של רקמת המוח שצולמו כמחנכת בגילאים שונים, לא נראה שיש השפעה של גיל על הבהירות של כל המבנים פלורסנט המשמש כאן24,23,26. הזרקה של µL 1 של תערובת המכילה 1 מ"ג/מ"ל Sn-GFP (CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE) ו- µg/mL 10 טרה-Cre תוצאות בהתפלגות דליל בעיקר בהיר תאים (איור 3 א) בשכבה II/III (איור 3B). ניתן לאבחן תהליכים דנדריטי ואת עצב (איור 3B) ושל הדנדריטים (איור 3C). מניסיוננו, מיקוד עם גם מבנה יחיד כגון ה-GFP. Cre או עם "סופרנובה" בונה reproducibly תניב ביטוי לפחות 75% של electroporated עוברי.
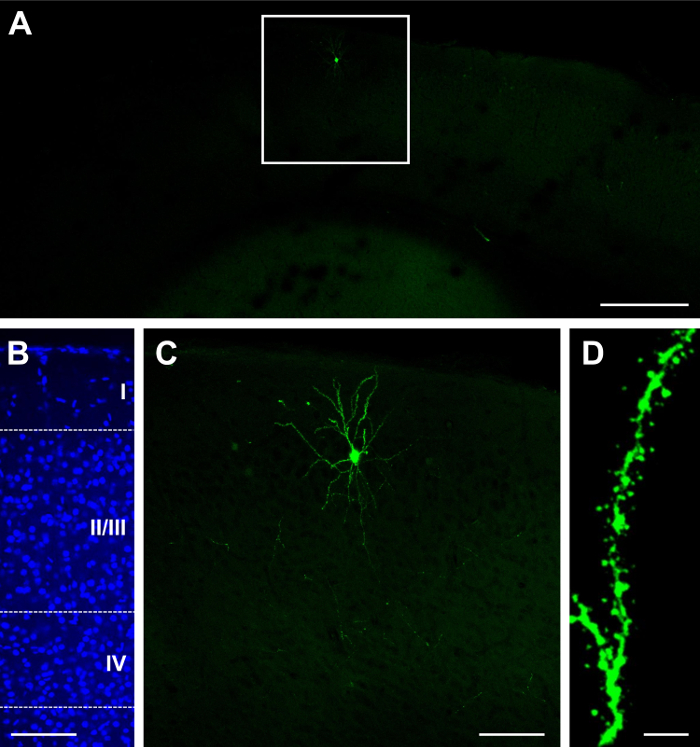
איור 1: Sparse וביטוי בהיר לאחר בתוך הרחם אלקטרופורציה יחיד לבנות המכיל recombinase GFP ו- Cre. (א) נמוך ההגדלה (4x) זריחה micrograph של קליפת-P23, לאחר אלקטרופורציה ב E15.5. (B) ההגדלה בינוני (20 X) micrograph זריחה של כתם גרעיני דאפי, חשיפת קורטיקלית למינציה (שכבות אני II/III, IV, שכבות עמוק עד IV). (ג) ההגדלה בינוני (20 X) micrograph זריחה של נוירון בודד. (ד) גבוהה ההגדלה (60 X) micrograph זריחה של הדנדריטים. גודל ברים = 200 מיקרומטר (א); 100 מיקרומטר (B, C); 5 מיקרומטר (D). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
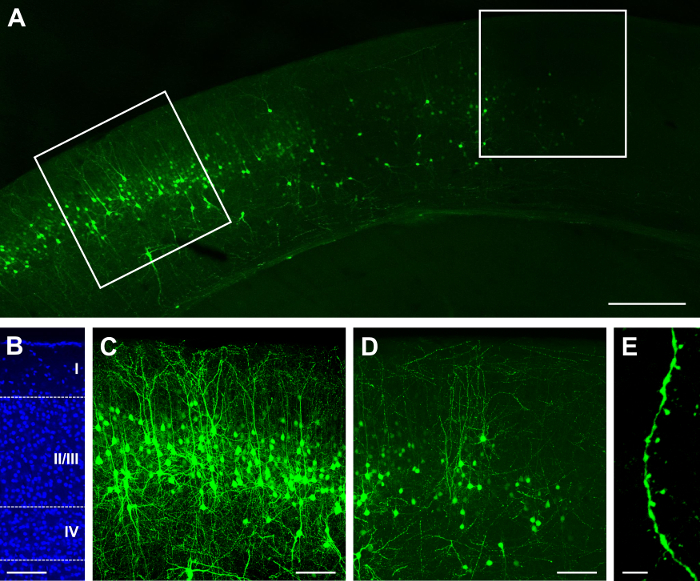
איור 2: Dense וביטוי בהיר לאחר בתוך הרחם אלקטרופורציה יחיד לבנות המכיל recombinase GFP ו- Cre. (א) נמוך ההגדלה (4x) זריחה micrograph של קליפת-P14, לאחר אלקטרופורציה ב E15.5. (B) ההגדלה בינוני (20 X) micrograph זריחה של כתם גרעיני דאפי, חשיפת קורטיקלית למינציה (שכבות אני II/III, IV, שכבות עמוק עד IV). (ג) אמצעי ההגדלה (20 X) micrograph זריחה של נוירונים באזור של תיוג הצפוף. (ד) micrograph קרינה פלואורסצנטית ההגדלה בינוני (20 X) של נוירונים נלקח בפריפריה של האזור של תיוג הצפוף. (E) גבוהה ההגדלה (60 X) micrograph זריחה של הדנדריטים. גודל ברים = 200 מיקרומטר (א); 100 מיקרומטר (B, C, D); 5 מיקרומטר (E). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3: Sparse וביטוי בהיר אחרי אלקטרופורציה בתוך הרחם עם סופרנובה-GFP בונה המכיל recombinase GFP ו- Cre. (א) נמוך ההגדלה (4x) זריחה micrograph של קליפת-P14, לאחר אלקטרופורציה ב E15.5. (B) ההגדלה בינוני (20 X) micrograph זריחה של כתם גרעיני דאפי, חשיפת קורטיקלית למינציה (שכבות אני II/III, IV, שכבות עמוק עד IV). (ג) ההגדלה בינוני (20 X) micrograph זריחה של נוירון בודד. (ד) גבוהה ההגדלה (60 X) micrograph זריחה של הדנדריטים. גודל ברים = 200 מיקרומטר (א); 100 מיקרומטר (B, C); 5 מיקרומטר (D). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
כאן, אנחנו מציגים את השילוב של אלקטרופורציה בתוך הרחם עם Cre recombinase בעכברים floxed כדי ליצור פסיפס רקמת המוח. היתרון בגישה זו הוא כי קו עכבר חדש לא צריך להיווצר בכל פעם תת סוג הסלולר שונים כדי להיות ממוקד: בתוך הרחם אלקטרופורציה יכול לשמש למטרה נוירונים סינאפסות, נוירונים מעכבות או עכשיו תלוי בזמן, דונלד המיקום של אלקטרופורציה15,16,17,18,19,20,21,34 בגישה שלנו, מיקוד קליפת המוח הוא עקבי לשחזור כי השתמשנו אלקטרודות אלקטרופורציה בקוטר 5 מ מ שניתן להעמידה על אזור גדול של telencephalon פיתוח. למטרה-אתרים חלופיים במוח (למשל diencephalon, רשתית העין), או עבור פילוח מדויק יותר של אזורים בתוך קליפת הליכים ואלקטרודות במפורש המיועד לכך עשוי להיות בשימוש15, 16. כמו כן אנו מספקים מבנה יחיד מספקת תיוג בהיר, מבטיחה כי כל ניורון fluorescently שכותרתו מכילה Cre recombinase. חיסרון של באמצעות מבנה יחיד כדי להשיג תיוג בהיר היא האוכלוסייה שכותרתו יכול להיות צפוף מדי (איור 2C), אבל זה יכול להיפתר על ידי הדמיה התאים בפריפריה של האזור עם תוויות (איור דו-ממדי). לחלופין, ניתן לעצב ביטוי של מבנה פלורסנט תלויים Cre recombinase ביטוי17, אך רמות הביטוי נמוך עשוי לדרוש immunostaining עבור דה מרקר פלורסנט. מגבלה זו מופנית על ידי מערכת "סופרנובה" תלויי-Cre פלורסנט סמן ביטוי (איור 3 א)23,24.
בנוסף שילוב Cre-לקס רקומבינציה עם אלקטרופורציה בתוך הרחם , אנו מציעים מספר שיפורים עבור גידול אופטימלי של נשים בהריון-מתוזמן. חשוב לשמור על העכברים בחדר מעצר ללא תשלום של רעשים ורעידות הנגרמת על ידי ציוד כגון וקולטי זרימה שכבתית. להעשיר את הסביבה עם igloos פלסטיק, קינון, גשמי, תוספי תזונה כמו זרעי חמניות (ראה רשימת חומרים). מלבד שיקולים סביבתיים, שמנו לב כי ההמלטה הראשונה של נקבה בדרך כלל יש שיעור ההישרדות הנמוך. לפיכך, פרוטוקול שלנו מציע לחכות עד ההריון השני של הנקבה לבצע אלקטרופורציה בתוך הרחם . בעוד אסטרטגיה זו מגבירה את הישרדותם של הגורים, הוא גם נוטה להגדיל את גודל המלטה, אשר ניתן להאריך את זמן הניתוח, ובכך להוריד את ההצלחה של הניתוח. לכן, אם נתקלים מספר גדול במיוחד של עוברי (למשל יותר מאשר 8), אנו מציעים לדלג את אלקטרופורציה על חלק העוברים, במיוחד העוברים הקרוב השחלות ואת הרחם, איפה הכי נוטה פציעה הרקמה. יתר על כן, באמצעות אסטרטגיה העשרה סביבתית באותו שהוזכרו לעיל (פלסטיק igloos, קינון של תוספי תזונה, גשמי) נוטה להגדיל את ההישרדות של המלטות לאחר הלידה. חשוב גם לציין שייחום הזה יכול להתרחש אצל הנקבה שעות ספורות לאחר parturition של ההמלטה הראשונה. במקרה זה, לאפשר הנקבה ללדת המלטה השני שלה, ואז להפריד לאחר הגמילה בניסיון מתוזמן ההזדווגות. כאשר מחפשים מהנרתיק פקקים, זה תרגול טוב כדי להפריד את הנקבה גם אם לא נמצא פקק, במיוחד אם הנקבה היה ייחום בלילה שלפני. תקעים ב זנים מסוימים קשה ספוט, התפישה אירעו כבר.
תחום נוסף של שיפור הוא בהפקת פיפטות microinjection נאותה אלקטרופורציה בתוך הרחם . משיכת פיפטות הזרקת הדנ א לתוך החדרים הצדדיים הוא שלב קריטי. כאן, אנו מספקים פרוטוקול מפורט להגדרת פיפטות עם גודל קצה עקבית, קצה קצה מחוספס. שיטות אחרות כוללות שבירת בחזרה את הטיפ עם להב סכין15 או צובט את קצהו עם מלקחיים16,17. שים לב כי אם פיפטה טיפים קטנים מדי, הם כראוי לנקב את הרחם אך הזרקת זרם המחירים יהיה נמוך מדי, התארכות הזמן שבו פיפטה מתפרש על המוח העוברי. אם פיפטה טיפים גדולים מדי, הם עלולים לגרום נזק את הרחם ואת המוח העוברי. אם פיפטה טיפים יותר מדי חלקלק, הם יגרמו גבשושית דשא גדול הרחם ו/או הגולגולת עובריים לפני שבירת דרך, העלול לגרום נזק העובר. אימון ליצירת הפסקה קשה לייצר טיפ מיקרומטר 20-25, לבדוק טיפים תחת מיקרוסקופ אור פשוט (למשל עם יעד X 10) עד מושגת תוצאה עקבית. בדיקת הנוזל הזה יכול להיות pipetted בקצב סביר (למשל ~0.5 µL/s) עם הרכבה צינור ליניקת היא שיטה אחרת שהייתך גודל קצה בתוך טווח מקובל. כי פיפטות הזרקת מכויל סיים את לימודיו, הסכום המדויק של ה-DNA נמסר הנוזלים לרוחב ידוע. זהו השלב הקריטי ביותר להשגת sparseness הרצוי של reproducibly כדי בסדר גודל. במילים אחרות, ריכוז נתון אמור להניב תיוג בתוך טווח מסוים, למשל נוירונים שכותרתו 10 ל- 100.
הצעד החשוב ביותר בפרוטוקול הוא ההליך אלקטרופורציה בתוך הרחם . להיות עדין ביותר תוך חשיפת הרחם. כשאני מוציאה את העוברים האחרון של חלל הבטן, ודא כי לא למשוך על השחלות או צוואר הרחם. השימוש את האגודל והאצבע במהלך microinjection ואלקטרופורציה מאפשר מניפולציה עדינה, מיומנות של העוברים כדי לחשוף את הנוזלים לרוחב ומאפשר את העוברים להיות דחף בעדינות בקיר הרחם. עדינה במיוחד היא קריטית בעת טיפול את הרחם ואת עוברי. אם קשה להשיג מגע עדין, להשתמש מלקחיים טבעת עם בורג הגבלת מובנה כדי למנוע את המלקחיים דיכויים העובר או הרחם, גרימת נזק לרקמות. שיקול נוסף הוא לנהל גם את carprofen וגם את הבופרנורפין מיד לפני הניתוח, שיטה אשר מופיעה כדי לספק ניהול כאב יעיל במהלך הניתוח בתוך הרחם מבלי להשפיע על הישרדות עובריים שיעורי35 .
הבא שלנו פשוטה היסטולוגית, מספר שלבים הם קריטיים. לאחר פרפוזיה מוחות ניסיוני עם מקבע, להחזיק את המוח ללא פגע בגולגולת כדי להגן על רקמת המוח מפני נזק במהלך קיבוע שאחרי. למרות שניתן לאחסן המוח 1% PFA במשך ימים, שבועות, לציין כי קרינה פלואורסצנטית יקטן ככל הפתרון PFA polymerizes. חותך 100 מיקרומטר מקטעים הילתית היא בדרך כלל מספיק דק להתיר מיקרוסקופיה קונפוקלית דרך מדור שלם תוך שמירה של המורפולוגיה דנדריטים, עצב. אם הקיבעון התרחשה כראוי, מוח מחיות שגילם P13 יכול להיות מותקן על גבי האזמל הקטן רוטטת פשוט עם דבק מגע, דבק. עם זאת, אם המוח הוא גם גמיש תוך שהוא נחתך על ידי האזמל הקטן רוטטת, הדבק למטה אגר קטן או בלוק agarose שמאחורי המוח כדי למנוע כיפוף בזמן זה הוא להיות למחלקה. אם הבעיה לא נפתרה, להטביע את המוח אגר להקים גוש לחתוך עם מיקרוטום רוטטת, כפי שהוצע שכל כמחנכת הצעיר (שלב 5.8).
שיטה זו משלבת מערכת רקומבינציה Cre-לקס עם אלקטרופורציה בתוך הרחם על מנת ליצור פסיפסים יכול לשמש כדי לחקור את תפקוד התא-אוטונומי גנים נוירונים. שיטה זו גם יכול להיות מוגדר לתמיכה בתוך הרחם אלקטרופורציה לייעו עריכה בונה (למשל CRISPR/Cas9)6, או אחרים recombinases בייעודי לאתר (למשל Flp/והשפלתם או דריי/רוקס24), אשר יכול להיות נועד לייצר רקמת המוח פסיפס. טכניקה חלופית מבטיח אחד יכול לשמש כדי לייצר רקמות פסיפס היא משלוח ויראלי באמצעות הזרקת ע עכברים neonatal36. בשילוב עם הזרקת ע בגילאים עובריים כפי שהוכח כאן ושם15,16,17,18,19,20, 21,22,37, וקטורים ויראלי קידוד Cre recombinase יכול להינתן לפני הלידה כדי להדביק את floxed ובתאים באיזור חדרית. שיקול מכריע אחד יהיה להבטיח הווקטורים ויראלי הם מדולל במידה מספקת כדי להשיג כריתה דליל ולקרוא. עם זאת, גם התוצאה תהיה נמוכה יותר מספרים עותק של הבונה שנגאלו, כולל פלורסנט סמנים חיוניים עבור תצפיות neuroanatomical (למשל הדנדריטים או arborization)24. כדי לסתור הזה כנחותים, מבנים חדשים באמצעות האסטרטגיה אותה בתור "סופרנובה" בונה המודגמות כאן יכול לשמש כדי להשיג תיוג דליל ללא ירידה הבהירות של תאים עם תוויות24המתאימה. עוד שיקול מכריע עם משלוח ויראלי היא לוודא שיש בונה ונמסרו היזמים מסוים באוכלוסייה תא נחקר (למשל סינאפסות כפירמידה נוירונים). ע הזרקה של וקטורים ויראלי גורם זיהום של כל רקמות המקיפים את החדרים, כולל לא רק חדרית באזור של telencephalon הגבי היכן נוצרים נוירונים סינאפסות קורטיקליים ו בהיפוקמפוס, אלא גם את המדיאלי, מיסרו הרוחביים ganglionic איפה interneurons קורטיקלית רבים נולדים34. תכונה נוספת בתוך הרחם אלקטרופורציה לעומת ויראלי מסירת בונה היא שלה חלון זמן קצר יחסית של משלוח. וירוסים מוזרק לתוך החדרים הצדדיים יכולות להימשך אחרי הניתוח, ממשיך להדביק את התאים המצפים את אזור חדרית. לעומת זאת, אלקטרופורציה מתרחשת תוך שניות, מיקוד קבוצה הרבה יותר ספציפית של תאים. זה עשוי להיות יתרון או חיסרון לחוקר, בהתאם subpopulation של תאים שילמדו.
הגישה שלנו תומך רקומבינציה Cre-לקס על ידי החדרת מבנה יחיד או בונה "סופרנובה". במקרה של המבנה "סופרנובה", אנו מבקשים החוקרים כדי להכיר היתרונות ואת המגבלות של שימוש באסטרטגיה זו. לדוגמה, העיתוי של מחיקה Cre הוכח להתרחש בתוך 2 ימי בנוירונים שכבה II/III מעוררים קליפת המוח24. לכן סביר כי כריתה Cre יכול להתרחש מעל 48 שעות בעקבות אלקטרופורציה, במקום מיד לאחר אלקטרופורציה. לכן, צורות אחרות של בעדות העיתוי והמיקום של Cre כריתה (למשל באמצעות שורת העכבר כתב Cre) אמור לשמש כדי להשלים את השימוש טכניקה חדשה זו, במיוחד במחקרים איפה קריטי Cre כריתה בתוך פרק זמן קטן התחשבות. מכשול פוטנציאלי נוסף הוא כי אחוז קטן של תאים ללא תווית בניסוי "סופרנובה" יכול להביע Cre recombinase. לדוגמה, ב- איור 3, אנחנו פלסמידים 2 co-electroporated: ריכוז גבוה של CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE, ריכוז נמוך של טרה-Cre. מכיוון טרה הוא מקדם דולפים, Cre recombinase יכול להתבטא תאים אשר קיבל את פלסמיד טרה-Cre. אבל לא את פלסמיד loxP-עצור-loxP-EGFP-tTA, למרות שזה נדיר. בניסוי שבו זה הכרחי כי כל התאים ללא תווית יש ללא כריתה בתיווך Cre בכלל, ניסוי "סופרנובה" ייתכן שתצטרך להיות בתוספת ניסוי שליטה ב- Cre איזה ביטוי recombinase מחוץ שכותרתו נוירונים שקובעת דרך השני אומר (למשל recombinase Cre אימונוהיסטוכימיה).
לסיכום, פרוטוקול שלנו משתנה בקלות כדי להתאים אלה מבנים חדשים, עושה בתוך הרחם אלקטרופורציה שיטה יותר שימושי וישימה עבור ניתוח פסיפס. לפיכך, ניתן לשלב בתוך הרחם אלקטרופורציה עם הכוח של שחלוף במספר דרכים שונות ללמוד פסיפס במוח רקמות ויוו.
Disclosures
המחברים יש שאין ניגודי אינטרסים לחשוף.
Acknowledgements
המחברים תודה לתמיכתה הנדיבה של ג'יימס מדיסון אוניברסיטת המחלקה של הביולוגיה ואת ג'יימס מדיסון אוניברסיטת מיקרוסקופ אור מתקן הדמיה. ד ר מארק ל' גבריאלה לקבלת עצות מועילות בנוגע צעיר רקמות כמחנכת הכנה, ד"ר ג'סטין וו בראון, קורי Cleland ל' לתיאום נדיב של חומרים כירורגי בחלל. מחקר זה מומן בחלקו על ידי מענק מחקר שיתופי 4-VA, שותפות שיתוף פעולה לקידום של חבר העמים של וירג'יניה (G.S.V.), וכן על ידי וירג'יניה האקדמיה של המדע קטן פרויקט במענק מחקר (G.S.V.). תמיכה בנדיבות סופק על ידי הקרן בטי ג'ו האוהב באטלר 58 לתואר ראשון מלגות מחקר (ל K.M.B.), פארל הקיץ מחקר מלגה (K.M.B.), ג'יימס מדיסון האוניברסיטה השנייה המאה מלגה (K.M.B.), ג'יימס המלגה מאוניברסיטת מדיסון סנטניאל (ל C.J.H.), ג'יימס מדיסון אוניברסיטת לוסי רובינסון חיפוש ' 30 אנדרטת מלגה (Z.L.H.) ו ג'יימס מדיסון קולג האוניברסיטה של מדע, מתמטיקה בפקולטה סיוע מענק (G.S.V.).
Materials
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | The Jackson Laboratory | #000664 | See "1. Mouse set-up" (step 1.1, "wildtype mice") |
| GFP.Cre empty vector | AddGene | #20781 | See "2. DNA set-up" (step 2.1 "single DNA construct that codes for Cre recombinase as well as a fluorescent marker"). GFP.Cre empty vector was a gift from Tyler Jacks. |
| pK029.CAG-loxP-stop-loxP-RFP-ires-tTA-WPRE (Supernova) | AddGene | #69138 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK029.CAG-loxP-stop-loxP-RFP-ires-tTA-WPRE (Supernova) was a gift from Takuji Iwasato. |
| pK031.TRE-Cre (Supernova) | AddGene | #69136 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK031.TRE-Cre (Supernova) was a gift from Takuji Iwasato. |
| pK038.CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE (Supernova) | AddGene | #85006 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK038.CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE (Supernova) was a gift from Takuji Iwasato. |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | #12362 | See "2. DNA set-up" (step 2.3 "endotoxin-free plasmid purification kit") |
| Trypan Blue powder, BioReagent grade | Sigma | T6146-5G | See "2. DNA set-up" (step 2.5 "trypan blue") |
| Sodium Chloride, ACS, 2.5 kg | VWR | BDH9286-2.5KG | See "2. DNA set-up" (step 2.5 "NaCl") |
| Potassium Chloride, ACS, 500 g | VWR | #97061-566 | See "2. DNA set-up" (step 2.5 "KCl") |
| Sodium phosphate dibasic, ReagentPlus, 100 g | Sigma-Aldrich | S0876-100G | See "2. DNA set-up" (step 2.5 "Na2HPO4") |
| Potassium phosphate monobasic, ReagentPlus, 100 g | Sigma-Aldrich | P5379-100G | See "2. DNA set-up" (step 2.5 "KH2PO4") |
| Hydrochloric acid, ACS reagent, 500 mL | Fisher Scientific | A144-500 | See "2. DNA set-up" (step 2.5 "HCl") |
| P-97 Micropipette Puller | Sutter Instrument | P-97 | See "3. Pipette set-up" (step 3.1 "glass capillary puller") |
| 3.0 mm wide trough filament | Sutter Instrument | FT330B | See "3. Pipette set-up" (step 3.1 "glass capillary puller") |
| Thin Wall Glass Capillaries, 4", 1 / 0.75 OD/ID | World Precision Instruments | TW100-4 | See "3. Pipette set-up" (step 3.1.1 "glass capillary") |
| Single Ply Soft-Tech Wipes, 4.5" | Phenix | LW-8148 | See "3. Pipette set-up" (step 3.2.1 "single-ply task wipe"); other single-ply wipes (e.g. Kimwipes) can be used. |
| Graefe Forceps, 7 cm, Straight, 0.7 mm 1x2 Teeth | World Precision Instruments | #14140 | See "4. In utero electroporation" (step 4.1 "Graefe forceps") |
| Iris Scissors, 11.5 cm, Straight, 12-pack | World Precision Instruments | #503708-12 | See "4. In utero electroporation" (step 4.1 "iris scissors") |
| Hartman Mosquito Forceps, 9 cm, Straight, 12-pack | World Precision Instruments | #503728-12 | See "4. In utero electroporation" (step 4.1 "Hartman mosquito forceps") |
| General Purpose Non-Woven Sponges, 2" x 2", 4-ply | Medrepexpress | #2204-c | See "4. In utero electroporation" (step 4.1 "non-woven gauze sponges") |
| Ring Tipped Forceps, 10 cm, Straight, 2.2mm ID | World Precision Instruments | #503203 | See "4. In utero electroporation" (step 4.1 "ring-tipped forceps") |
| Pyrex petri dishes complete, O.D. × H 100 mm × 20 mm | Sigma-Aldrich | CLS3160102-12EA | See "4. In utero electroporation" (step 4.1 "Petri dishes") |
| Flat Type Instrument Tray, Stainless Steel, 13-5/8" x 9-3/4" x 5/8" | Amazon | B007SHGAHA | See "4. In utero electroporation" (step 4.1 "stainless steel tray") |
| Platinum Tweezertrode, 5 mm | BTX | #45-0489 | See "4. In utero electroporation" (step 4.3 and 4.16 "tweezer-type electrodes") |
| ECM 830 Foot Pedal | BTX | #45-0211 | See "4. In utero electroporation" (step 4.3 and 4.17 "foot pedal") |
| ECM 830 Generator | BTX | #45-0052 | See "4. In utero electroporation" (step 4.3 "generator") |
| Single Animal Isoflurane Anesthesia System with Small Induction Box | Harvard Apparatus | #72-6468 | See "4. In utero electroporation" (step 4.4 and 4.6 "nose cone", step 4.4 "induction chamber") |
| Ophthalmic ointment | Hanna Pharmaceutical Supply Co | #0536108691 | See "4. In utero electroporation" (step 4.7 "veterinary ophthalmic ointment") |
| Space Gel (AIMS) | VWR | #95059-640 | See "4. In utero electroporation" (step 4.8 "sealed pouch filled with supersaturated salt solution") |
| Hair Remover Gel Cream, Sensitive Formula | Veet | #062200809951 | See "4. In utero electroporation" (step 4.9 "depilatory cream") |
| 10ul Low Retention Tip Starter (960 tips/pk) | Phenix Research Products | TSP-10LKIT | See "4. In utero electroporation" (step 4.12 "sterile 10 µL micropipette tip") |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177 | See "4. In utero electroporation" (step 4.15 "aspirator tube assembly") |
| Braided Absorbable Suture, 4-0, Needle NFS-2(FS-2), 27" | Medrepexpress | MV-J397 | See "4. In utero electroporation" (step 4.19 "absorbable sutures") |
| “LiquiVet Rapid” Tissue Adhesive | Medrepexpress | VG3 | See "4. In utero electroporation" (step 4.20 "tissue adhesive") |
| Hypodermic syringes, polypropylene, Luer lock tip, capacity 1.0 mL | Sigma-Aldrich | Z551546-100EA | See "4. In utero electroporation" (step 4.21 "1 mL syringe") |
| BD Precisionglide syringe needles gauge 26, L 1/2 in. | Sigma-Aldrich | Z192392-100EA | See "4. In utero electroporation" (step 4.21 "26G, ½” needle") |
| Nestlets Nesting Material | Ancare | NES3600 | See "4. In utero electroporation" (step 4.24 "nesting materials") |
| Sunflower Seeds, Black Oil, Sterile | Bio-Serv | S5137 | See "4. In utero electroporation" (step 4.24 "sunflower seeds") |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | See "5. Histology" (step 5.1.1 "PFA") |
| Economy Tweezers #3, 11 cm, 0.2 x 0.4 mm tips | World Precision Instruments | #501976 | See "5. Histology" (step 5.5 "tweezers") |
| Agar powder | Alfa Aesar | #10752 | See "5. Histology" (step 5.8.1 "agar") |
| Single-edge razor blades, #9 blade | Stanley Tools | #11-515 | See "5. Histology" (step 5.9 "single-edge razor blade") |
| Specimen disc S D 50 mm | Leica | #14046327404 | See "5. Histology" (step 5.9 "vibrating microtome specimen disc") |
| Buffer tray S assembly | Leica | #1404630132 | See "5. Histology" (step 5.10 "buffer tray") |
| VT1000 S Vibratome | Leica | #14047235612 | See "5. Histology" (step 5.10 "vibrating microtome") |
| Double Edge Razor Blades | Personna | BP9020 | See "5. Histology" (step 5.10 "blade") |
| Knife Holder S | Leica | #14046230131 | See "5. Histology" (step 5.10 "knife holder") |
| Studio Elements Golden Taklon Short Handle Round Brush Set | Amazon | B0089KU6XE | See "5. Histology" (step 5.12.1 "fine tipped paintbrush") |
| Superfrost Plus Slides | Electron Microscopy Services | #71869-11 | See "5. Histology" (step 5.12.1 "microscope slide") |
| ProLong Diamond Antifade Mountant, 10 ml | Thermofisher | P36970 | See "5. Histology" (step 5.12.3-5.12.4 "mountant") |
| Cover Glass, 24 x 50 mm, No. 1 | Phenix Research Products | MS1415-10 | See "5. Histology" (step 5.12.4 "coverslip") |
| 4′,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | Sigma-Aldrich | D9542 | See "5. Histology" (step 5.13.1 "DAPI") |
| Fixed Stage Upright Microscope | Olympus | BX51WI | See "5. Histology" (step 5.15 "light microscope") |
| Laser Scanning Confocal Microscope | Nikon | TE2000/C2si | See "5. Histology" (step 5.15 "confocal microscope") |
| 4x objective, NA = 0.20 | Nikon | CFI Plan Apo Lambda 4X | See "5. Histology" (step 5.15 "low-power objective") |
| 20x objective, NA = 0.75 | Nikon | CFI Plan Apo Lambda 20X | See "5. Histology" (step 5.15 "medium-power objective") |
| 60x objective, NA = 1.40 | Nikon | CFI Plan Apo VC 60X Oil | See "5. Histology" (step 5.15 "high-power objective") |
References
- Southwell, D. G., Froemke, R. C., Alvarez-Buylla, A., Stryker, M. P., Gandhi, S. P. Cortical plasticity induced by inhibitory neuron transplantation. Science. 327 (5969), 1145-1148 (2010).
- Hanson, J. E., Madison, D. V. Presynaptic FMR1 genotype influences the degree of synaptic connectivity in a mosaic mouse model of fragile X syndrome. J. Neurosci. 27 (15), 4014-4018 (2007).
- Patel, A. B., Hays, S. A., Bureau, I., Huber, K. M., Gibson, J. R. A Target Cell-Specific Role for Presynaptic Fmr1 in Regulating Glutamate Release onto Neocortical Fast-Spiking Inhibitory Neurons. J. Neurosci. 33 (6), 2593-2604 (2013).
- Patel, A. B., Loerwald, K. W., Huber, K. M., Gibson, J. R. Postsynaptic FMRP promotes the pruning of cell-to-cell connections among pyramidal neurons in the L5A neocortical network. J. Neurosci. 34 (9), 3413-3418 (2014).
- McConnell, M. J., et al. Mosaic Copy Number Variation in Human Neurons. Science. 342 (6158), 632-637 (2013).
- McConnell, M. J., et al. Intersection of diverse neuronal genomes and neuropsychiatric disease: The Brain Somatic Mosaicism Network. Science. 356 (6336), eaal1641 (2017).
- Gu, H., Marth, J. D., Orban, P. C., Mossmann, H., Rajewsky, K. Deletion of a DNA polymerase beta gene segment in T cells using cell type-specific gene targeting. Science. 265 (5168), 103-106 (1994).
- Hodges, J. L., et al. Astrocytic Contributions to Synaptic and Learning Abnormalities in a Mouse Model of Fragile X Syndrome. Biol. Psychiatry. (17), 1-11 (2016).
- Young, P., Qiu, L., Wang, D., Zhao, S., Gross, J. Single-neuron labeling with inducible cre-mediated knockout in transgenic mice. Nat. Neurosci. 11 (6), 721-728 (2011).
- Zong, H., Espinosa, J. S., Su, H. H., Muzumdar, M. D., Luo, L. Mosaic Analysis with Double Markers in Mice. Cell. 121 (3), 479-492 (2005).
- Hippenmeyer, S., et al. Genetic mosaic dissection of Lis1 and Ndel1 in neuronal migration. Neuron. 68 (4), 695-709 (2010).
- De la Rossa, A., Jabaudon, D. In vivo rapid gene delivery into postmitotic neocortical neurons using iontoporation. Nat. Protoc. 10 (1), 25-32 (2015).
- Lu, W., Bushong, E. A., Shih, T. P., Ellisman, M. H., Nicoll, R. A. The cell-autonomous role of excitatory synaptic transmission in the regulation of neuronal structure and function. Neuron. 78 (3), 433-439 (2013).
- Duan, Y., et al. Semaphorin 5A inhibits synaptogenesis in early postnatal- and adult-born hippocampal dentate granule cells. eLife. 3, 1-24 (2014).
- Dixit, R., et al. Efficient Gene Delivery into Multiple CNS Territories Using In utero Electroporation. J. Vis. Exp. (52), e2957 (2011).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero Electroporation: Controlled Spatiotemporal Gene Transfection. J. Vis. Exp. (54), e3024 (2011).
- Briz, C. G., Navarrete, M., Esteban, J. A., Nieto, M. In utero Electroporation Approaches to Study the Excitability of Neuronal Subpopulations and Single-cell Connectivity. J. Vis. Exp. (120), (2017).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240 (1), 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nature protocols. 1 (3), 1552-1558 (2006).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 10 (3), 1027-1032 (2007).
- Pacary, E., et al. Visualization and Genetic Manipulation of Dendrites and Spines in the Mouse Cerebral Cortex and Hippocampus using In utero Electroporation. J. Vis. Exp. (65), e4163 (2012).
- Mizuno, H., et al. NMDAR-Regulated Dynamics of Layer 4 Neuronal Dendrites during Thalamocortical Reorganization in Neonates. Neuron. 82 (2), 365-379 (2014).
- Luo, W., et al. Supernova: A Versatile Vector System for Single-Cell Labeling and Gene Function Studies in vivo. Sci. Rep. 6, 35747 (2016).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab animal. 38 (9), 305-310 (2009).
- Vidal, G. S., Djurisic, M., Brown, K., Sapp, R. W., Shatz, C. J. Cell-Autonomous Regulation of Dendritic Spine Density by PirB. eNeuro. 3 (5), 1-15 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS ONE. 7 (4), 1-5 (2012).
- Andreu-Agullo, C., Maurin, T., Thompson, C. B., Lai, E. C. Ars2 maintains neural stem-cell identity through direct transcriptional activation of Sox2. Nature. 481, 195-198 (2011).
- Scotto-Lomassese, S., et al. Fragile X mental retardation protein regulates new neuron differentiation in the adult olfactory bulb. J. Neurosci. 31, 2205-2215 (2011).
- . . Plasmids 101: A Desktop Resource. , (2017).
- . . Pipette Cookbook. , (2015).
- Cuddington, B., Verschoor, M., Mossman, K. Handling of the Cotton Rat in Studies for the Pre-clinical Evaluation of Oncolytic Viruses. J. Vis. Exp. (93), e52232 (2014).
- Leary, S., et al. . AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Anderson, S. A., Eisenstat, D. D., Shi, L., Rubenstein, J. L. R. Interneuron Migration from Basal Forebrain to Neocortex: Dependence on Dlx Genes. Science. 28 (5337), 474-476 (1997).
- Parker, J. M., Austin, J., Wilkerson, J., Carbone, L. Effects of Multimodal Analgesia on the Success of Mouse Embryo Transfer Surgery. J. Am. Assoc. Lab. Anim. Sci. 50 (4), 466-470 (2011).
- Kim, J. -. Y., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualising and manipulating neuronal circuits in vivo. Eur. J. Neurosci. 37 (8), 1203-1220 (2013).
- Pierfelice, T. J., Gaiano, N. Ultrasound-Guided Microinjection into the Mouse Forebrain In Utero at E9.5. J. Vis. Exp. (45), e2047 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved