Method Article
Induisant la recombinaison Cre-lox dans le Cortex cérébral par l’intermédiaire de In Utero électroporation de souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cellule autonome fonction des gènes dans le cerveau peut être étudiées en induisant la perte ou gain de fonction dans des populations clairsemées de cellules. Nous décrivons ici dans l’utérus l’électroporation pour livrer une recombinase Cre en populations clairsemées de mettre au point des neurones corticaux avec floxed gènes à provoquer une perte de fonction in vivo.
Résumé
Les fonctions neuronales cellule autonome de gènes peuvent être révélées par une perte ou gain de fonction d’un gène dans une petite population clairsemée des neurones. Pour ce faire nécessite générant une mosaïque dans laquelle des neurones avec perte ou gain de fonction d’un gène sont entourés de tissu génétiquement non perturbé. Ici, nous combinons le système de recombinaison Cre-lox avec in utero électroporation afin de générer des tissus cérébraux de mosaïque qui peuvent être utilisé pour étudier la fonction cellule autonome de gènes dans les neurones. Constructions d’ADN (disponible par le biais de dépôts), codant pour une étiquette fluorescent et la recombinase Cre, sont introduits dans le développement des neurones corticaux contenant des gènes flanqués de sites loxP dans le cerveau d’embryons de souris à l’aide de in utero électroporation. En outre, les auteurs décrivent les diverses adaptations de la méthode d’électroporation in utero qui augmentent les chances de survie et de la reproductibilité. Cette méthode consiste aussi à établir un titre pour la recombinaison Cre-mediated dans une population clairsemée ou dense des neurones. Préparations histologiques du tissu cérébral marqués n’ont pas besoin (mais peut être adaptées à) l’immunohistochimie. Les constructions utilisées garantissent que fluorescent étiqueté neurones portent le gène de la recombinase Cre. Préparations histologiques permettent une analyse morphologique des neurones par le biais de l’imagerie confocale des arbres dendritiques et axonales et des épines dendritiques. Parce que perte ou gain de fonction est fournie dans les tissus de mosaïque éparse, cette méthode permet l’étude des cellules autonomes nécessité et la suffisance des produits de gène in vivo.
Introduction
Générant une mosaïque génétique est un paradigme expérimental classique pour comprendre la fonction d’un gène d’intérêt. Pour déterminer si un gène est nécessaire pour un phénotype cellulaire, l’approche la plus simple est à l’origine une perte de fonction du gène dans l’ensemble de l’organisme (p. ex. knockout). Toutefois, pour déterminer si un gène est nécessaire précisément dans un certain type de cellule, Knock-out du gène dans l’ensemble de l’organisme n’est pas une approche valable. Au lieu de cela, il faut une méthode qui causera la perte de fonction d’un gène dans une cellule donnée alors qu’il est entouré par le tissu de type sauvage (c'est-à-dire génétiquement non perturbé) — en d’autres termes, création de tissus de mosaïque. Si la cellule mutante montre un phénotype mutant, mais les cellules environnantes de type sauvage n’est pas la fonction des gènes de manière autonome-cellule. Analyse du tissu de mosaïque, dans lequel les cellules mutantes sont entourés de tissu de type sauvage, est idéal pour comprendre les fonctions cellulaires-autonome des gènes, en particulier dans le cerveau où les neurones et cellules gliales forment un vaste réseau interconnecté de tissu.
Plusieurs formes de tissus cérébraux de mosaïque ont fourni des modèles puissants pour étudier les fonctions cellulaires-autonome des gènes. Études axées sur la transplantation de neurones1, femelle mosaïcisme liée à le X2,3,4, et le mosaïsme somatique endogène5,6 ont tiré leurs conclusions fondées sur la mosaïque tissu cérébral. Suppression conditionnelle d’un gène par le système de recombinaison Cre-lox est une méthode qui tire pleinement parti de la grande disponibilité des lignées de souris transgéniques. Dans cette méthode, deux sites loxP sont mis en ligne sur chaque côté d’une séquence requise d’un gène (par exemple un exon), laissant flanqué de sites loxP que tous deux faire face dans la même direction (« floxed »). Recombinase cre accises la séquence entre les sites de loxP7. Recombinaison CRE-négociée est possible en traversant floxed souris à une autre lignée de souris exprimant la recombinase Cre avec un marqueur fluorescent dans un sous-ensemble de cellules (« ligne de journaliste Cre »). Cela a été démontré dans une variété de façons de découvrir les fonctions d’un gène dans des sous-ensembles de cellules, telles que des neurones excitateurs ou astrocytes8. Lignes de journaliste cre peuvent exprimer CreERT2 pour permettre la recombinaison Cre-mediated être induit par drogue (single-neurone marquage avec masquage de Cre-mediated inductible ou SLICK)9. Dans une autre stratégie appelée analyse de mosaïque avec double marqueurs (MADM)10,11, induite par le Cre interchromosomique recombinaison permet un homozygote mutant à créer aux côtés de tissu hétérozygote. Dans ces approches, une nouvelle gamme de souris doit être produite chaque fois pour chaque gène candidat ou sous-type cellulaire qui est testé. Alternativement, une recombinase Cre peut être introduite après la naissance par iontophorèse12 ou par l’intermédiaire de vecteurs viraux (p. ex. virus adéno-associés13 ou lentivirus14 transportant sous-type cellulaire spécifique promoteurs). Cette stratégie crée fort et postnatale d’étiquetage. Pour cibler le développement des neurones du cortex cérébral faiblement et avant la naissance, une stratégie idéale est dans l’utérus l’électroporation de recombinase Cre avec un marqueur fluorescent.
En plus de combiner la recombinaison Cre-lox à travers dans l’utérus l’électroporation pour produire mosaïque tissu in vivo, nous introduisons plusieurs adaptations aux procédures des autres protocoles publiés15,16, 17,18,19,20,21. Nous fournir des informations pour améliorer la réussite dans les enceintes chronométré femelles reproductrices. Nous exposons également nos deux stratégies pour introduire clairsemée et lumineux, marquage des neurones dans les tissus corticaux : une stratégie consiste à titrer les niveaux d’une construction unique codant pour la recombinase Cre et un marqueur fluorescent22. Une autre stratégie consiste à utiliser le système de « Supernova », conçu spécifiquement pour ces paramètres en compte23,24. En outre, nous offrons des améliorations sur la production de pipettes de micro-injection cohérente et des simplifications à la chirurgie d’électroporation in utero . Enfin, nous décrivons les étapes critiques dans une préparation histologique simplifiée qui permet l’analyse des épines dendritiques et arbres dendritiques et axonales, sans autre coloration ou immunohistochimie.
Protocole
Méthodes décrites ici ont été approuvés par l’utilisation Comité (ACUC) de James Madison University et animalier et sont en conformité et le respect de toutes les directives réglementaires et institutionnels.
1. Configuration de la souris
- Accueillir un jeune (> P60) souris mâles et femelles floxed homozygotes ensemble pour mettre en place un éleveur paire25.
Remarque : Un bon contrôle négatif est de mettre en place une paire supplémentaire éleveur de souris de type sauvage, dans lequel Cre l’expression recombinase ne provoquera pas une mosaïque de26. - Permettre à la femelle donner naissance et élever sa première portée avec le mâle. Gardez le mâle avec la femelle pour augmenter la survie de la litière. Après le sevrage, la litière, par exemple à jour après la naissance (P) 21, séparer la femelle et le mâle.
-
Reproduction murine
- Mettre en place un chronométré d’accouplement entre les mâles et femelles25. Utiliser des indices visuels pour déterminer le cycle oestrus des femmes27et recherchez les fiches vaginales le matin après l’accouplement25.
- Si une fiche est trouvée, séparer et peser la femelle. Compter le jour comme jour embryonnaire (E) 0,5.
- Continuer de peser la femelle tous les 3-5 jours afin de déterminer si elle est enceinte. Les femelles gravides aura une augmentation de 10 à 20 % du poids corporel 7-10 jours après la conception (E0).
Remarque : Cette étape confirme la grossesse plus tôt et plus fiable qu’une inspection visuelle,25. - Si la femelle n’est pas enceinte, répétez les étapes 1.3.1-1.3.3.
- Dès que la grossesse est confirmée, choisir la date de l’électroporation in utero . Pour cibler la couche II/III corticale pyramidale neuronales progéniteurs, effectuer l’électroporation à E15.5.
2. installation de l’ADN
- Choisissez un ADN unique construire codant pour une recombinase Cre comme un marqueur fluorescent, comme la protéine fluorescente verte (GFP)28,29. Vous pouvez également utiliser le système de « Supernova », décrit en détail dans les précédentes publications23,24. Voir la liste des matériaux par exemple construit.
- Amplifier les exigences de l’ADN à l’étape 2.1 chez e. coli en utilisant des techniques microbiologiques standard30.
- Purifier la construction de l’ADN avec un kit de purification de plasmide exempte d’endotoxine suivant les instructions du fabricant. Éluer la construction avec de l’eau exempte d’endotoxine.
Remarque : Choisir un kit de purification exempte d’endotoxine sur un kit de purification standard est essentiel. - Concentrer l’éluat ADN à 1-3 mg/mL selon désiré étiquetage densité26.
NOTE : Un titre doit toujours être établi lorsque vous travaillez avec une nouvelle construction de l’ADN, étant donné qu’ils ont des promoteurs et longueurs différentes. Envisager une construction à plusieurs différentes concentrations et/ou s’élève à évaluer l’expression de l’injection. Par exemple, l’injection de 1 µL ou 1,5 µL de 2,0 mg/mL GFP. CRE est capable de provoquer de rares (1 µL) ou dense (1,5 µL) marquage de la couche II/III visuel cortical neurones pyramidaux26. - Ajouter 0,4 % trypan bleu en 1 x une solution saline tamponnée au phosphate (PBS ; 137 mM NaCl, KCl, 2,7 mM 10 mM Na2HPO4, 1,8 mM KH2PO4 H2O, ajusté à pH 7.4 avec HCl) 01:10 à la solution concentrée d’ADN.
- Ajouter 10 x PBS 01:10 à la solution concentrée d’ADN.
- Stocker la solution concentrée d’ADN à 4 ° C. La solution peut être conservée indéfiniment.
3. pipette Set-up
-
À l’aide d’un extracteur capillaire de verre, tirez une pipette avec une très longue pointe conique et très fine (10-15 mm), typique des pipettes pour l’injection de cellules souches embryonnaires ou transfert nucléaire31.
Remarque : Pour empêcher les débris de contaminer les pipettes, ils convient dans les 2 jours suivant la chirurgie.- Calibrer l’extracteur capillaire de verre en effectuant un essai de rampe, suivant les instructions du fabricant. Utiliser la valeur obtenue de la chaleur pour programmer un tirant du protocole en utilisant les paramètres suivants : chaleur = (valeur de test de rampe + 15), tirer = 30, vel = 120, temps = 100, pression = 200. Insérer le capillaire de verre, fixer à pinces sur extracteur et activer le protocole de tirage programmé, créant un cône sur le capillaire de verre.
- Assurez-vous que la longueur du cône est entre 10-15 mm à l’aide d’un microscope optique composé (par exemple 10 X, objectif)31.
-
Pause-retour la pipette pour former une pointe bords rugueux à 20-25 µm de diamètre.
- Centrer une lingette spéciale monocouche (voir la liste des matériaux) sur 50 mL bécher et étirement essuient tendues d’une main. Avec l’autre main, maintenez et pousser une pipette (défilement vers le bas) perpendiculairement et entièrement à travers le centre de la lingette, provoquant une rupture nette dans le cône31.
Remarque : En poussant la pipette entièrement par le biais de la lingette produira un embout de diamètre 20 à 25 µm environ 70 % du temps. - Confirmer sous un microscope optique composé (par exemple l’objectif 20 x).
ATTENTION : Utiliser une protection oculaire tout en brisant la vitre.
- Centrer une lingette spéciale monocouche (voir la liste des matériaux) sur 50 mL bécher et étirement essuient tendues d’une main. Avec l’autre main, maintenez et pousser une pipette (défilement vers le bas) perpendiculairement et entièrement à travers le centre de la lingette, provoquant une rupture nette dans le cône31.
- Calibrer une pipette par aspiration 1 µL de 0,4 % trypan blue en solution 1 PBS x dans un piptte partiellement rempli, puis avoir obtenu son diplôme de la pipette avec marquages 1 µL basée sur la hauteur de 1 µL dans la pipette, à l’aide d’un marqueur à pointe fine d’antialcool. Utilisez la pipette calibrée pour obtenir leur diplôme les autres pipettes avant de le jeter. Garder les pipettes dans un porte-pipette exempt de poussière et autres particules.
4. in Utero électroporation
- Placez Graefe forceps, iris ciseaux, Hartman pince mosquito, éponges de gaze non tissées, pince à embout anneau et Pétri sur un plateau en acier inoxydable et envelopper de papier d’aluminium. Placez le plateau et salin de 0,9 % 1 L (0,9 % wt/vol NaCl dans l’eau) en autoclave. Autoclave à 121 ° C et 3,5 kPa pendant 40 min. retirer de l’autoclave et placer dans une zone chirurgicale désinfectée.
Remarque : Il est essentiel de maintenir des conditions stériles pendant la chirurgie. - Réchauffer le flacon saline stérilisés à l’autoclave de 1 L dans un petit bain à 38 ° C au moins 2 h avant la chirurgie.
- Connecter les électrodes de type pince à épiler et la pédale au générateur (voir la liste des matériaux). Suivant les instructions du fabricant, régler le générateur de livrer cinq impulsions 50 ms 50 V (avec un intervalle de 950 ms) lorsque déclenchée par la pédale. Désinfecter les électrodes de type pince à épiler et placez sur la zone chirurgicale désinfectée.
- Faire un cône de nez anesthésie comme publiées antérieurement32, mais utiliser l’extrémité d’un nitrile ou doigt de gant en latex pour former une membrane qui s’adapte en toute sécurité sur l’ouverture du cône de nez. Découper un trou dans le diaphragme suffisamment grand pour contenir sur le museau de la souris.
- Profondément anesthésier souris gravides à E15.5 dans une chambre d’induction remplie d’isoflurane (2-4 %) dans l’oxygène pur à 1 L/min. Après environ 1 min, test du réflexe de redressement (doucement inclinez la chambre induction et faire en sorte que la souris ne pas droit lui-même). Peser la souris afin de déterminer les doses d’analgésiques administrés plus tard au cours de la chirurgie.
- Transférer la souris dans la zone chirurgicale et administrer par inhalation isoflurane (1-2 %) en oxygène pur à 1 L/min grâce à un cône de nez pour maintenir la souris au plan chirurgical. Utiliser des pinces pour tester le réflexe pédale (pincer la patte délicatement et faire en sorte que la souris ne retourne pas un réflexe) pour vérifier les anesthetization. Surveiller la fréquence respiratoire et l’effort, vous cherchez régulier de respiration profonde, (~ 70-100 respirations/min), et que les muqueuses sont couleur rose et humide.
- Appliquer suffisamment pommade ophtalmique vétérinaire au-dessus des yeux pour les couvrir complètement pour la protection contre l’assèchement durant la procédure.
- Flex, le disque de métal activateur d’un sachet rempli de sel solution sursaturée (voir la liste des matériaux), activant une cristallisation exothermique du sel. Posez 2 lingettes monopli tâche sur le dessus de la pochette et placez la souris sur la pochette pour maintenir la température du corps.
- Massage crème dépilatoire sur la zone abdominale avec des cotons-tiges jusqu'à dissolution de fourrure abdominale (environ 20-40 s), puis essuyez les fourrures abdominale. Nettoyez soigneusement tout reste de la crème dépilatoire et de résidus avec 70 % d’éthanol et coton écouvillons. Placez un drapé chirurgical stérile fenêtré sur la région abdominale.
- À l’aide d’une technique aseptique, tirer la peau vers le haut et loin l’abdomen avec une pince de Graefe et pratiquez une incision de la ligne médiane ventrale ~ 2 cm sur la peau à l’aide de ciseaux iris, veiller à ce que le muscle sous-jacent n’est pas coupé.
NOTE : Une alternative acceptable à faire une incision avec des ciseaux Graefe forceps et iris est d’utiliser un scalpel, tel que publié précédemment17. - Trouver la linea alba à visualiser la ligne médiane de la droit de l’abdomen. Tirer musculaire vers le haut de l’abdomen avec Graefe forceps et faire une autre incision médiane ~ 2 cm il avec des ciseaux iris, exposant ainsi la cavité abdominale (l’utérus est translucide et embryons sera masquées). Veiller à ce que qui sous-tendent les tissus utérins et intestinale n’est pas coupé. Faire l’incision seulement assez grande (généralement ~ 2 cm) de sortir et d’exposer l’utérus confortablement.
NOTE : Une alternative acceptable à faire une incision avec des ciseaux Graefe forceps et iris est d’utiliser un scalpel, tel que publié précédemment17. - À l’aide d’une pointe de micropipette µL 10 stérile, distribuer le carprofène (dissous dans la solution saline 0,9 % stérile) à 4 mg/kg dans la cavité abdominale pour l’analgésie.
- Pince un forceps de moustique Hartman au bord gauche de l’incision d’abdominis rectus. Reposer la pince sur renversé Pétri à gauche de l’incision, en gardant le côté gauche de l’incision ouverte. Clamp forceps de moustique Hartman un autre sur le bord droit de l’incision d’abdominis rectus et reposer la pince sur une boîte de Pétri renversé vers la droite de l’incision, en gardant le côté droit de l’incision ouverte. Placer le tampon de gaze autour de la zone de l’incision.
- À l’aide de pince anneau (sans une vis ci-joint), tirez sur l’utérus entre les deux embryons voisins sans écraser ou blesser n’importe quel tissu. Commencer tirant tous les embryons dans l’incision, les pose sur le dessus de la gaze, éponge. Lorsque vous retirez les derniers embryons dans la cavité abdominale, veillez à ne pas tirer sur les ovaires ou le col de l’utérus. Une fois exposé, il est essentiel de conserver l’utérus humide avec du sérum physiologique tiède. L’utérus contient généralement entre 5 et 8 embryons.
Remarque : Il est possible d’ajouter de la pénicilline et la streptomycine à la saline17. - Connecter une pipette calibrée à l’ensemble de tube d’aspirateur (voir la liste des matériaux) et injecter exactement 1 µL de la solution d’ADN préparée à l’étape 2 par le biais de la paroi de l’utérus dans un ventricule latéral de chaque embryon. Ventricules latéraux apparaissent comme deux taches sur le télencéphale dorsal de l’embryon (patchs sont plus sombres que les tissus du télencéphale environnants). Utiliser le pouce et l’index pendant la microinjection et électroporation pour manipuler les embryons, révélant les ventricules latéraux et en permettant les embryons qui se pousse doucement contre la paroi de l’utérus pendant l’injection. Confirmer injection réussie en observant trypan bleu de remplissage du ventricule latéral.
- Placer la cathode des électrodes de type pince (voir la liste des matériaux) sur l’utérus, directement sur le cortex médial et caudal pour cibler le cortex visuel (ciblant d’autres zones du cerveau différentes électrodes exigera)16, 26. Placez l’anode sur l’utérus, juste inférieure et antérieure à tête de l’embryon.
- Confirmer que l’anode et la cathode sont en contact avec l’utérus entourant l’embryon aux endroits appropriés. Avec une pédale, déclencher la livraison de cinq impulsions 50 ms 50 V (avec un intervalle de 950 ms) entre les électrodes.
Remarque : L’injection, charge négative ADN se déplacera vers la cathode et est incorporée dans les cellules de la zone ventriculaire plus proches de la cathode. - Retourner l’utérus dans la cavité abdominale dans le même sens, qu'il a été constaté. Utilisez une solution saline pour lubrifier l’utérus tout en guidant manuellement et très délicatement, prenant soin de ne pas pour déplacer des embryons de leur position dans l’utérus.
- Fermer les muscles abdominaux avec des sutures résorbables (voir la liste des matériaux) à l’aide d’un simple point interrompu, attacher les extrémités avec un nœud de chirurgien de. Ne pas agrafe que les extrémités trop près pour le noeud ou le nœud deviendra déverrouillé.
Remarque : Il est essentiel à la suture des muscles abdominaux tels que les bords de la plaie sont complètement fermés fermés, mais sans provoquer de blanchiment du muscle. Nœuds doivent être serrés, donc ils ne peuvent pas se détacher. - Fermer la couche de la peau avec des sutures résorbables (point interrompu simple, nœud de chirurgien, comme à l’étape 4.19). Appliquez une petite quantité de colle tissu pour sceller la plaie. Appliquer l’adhésif de tissu sur les noeuds pour empêcher le détachant. Utiliser une micropipette pour enlever n’importe quel tissu adhésif entourant la plaie qui peut être aspirée par une micropipette.
- Baisser les niveaux d’isoflurane pour 0,5 à 1,5 %. Une fois le tissu adhésif est sec (test en appuyant sur le gant à l’adhésif), retirer du isoflurane et permettre aux femelles de récupérer seul dans une cage chaude. Administrer la buprénorphine par voie intrapéritonéale à 0,03 mg/kg à l’aide d’une seringue de 1 mL avec un 26G, ½" aiguille.
- Continuer à surveiller la souris jusqu'à ce que la souris est complètement rétablie et comporte normalement (c'est-à-dire toilettage, explorant la cage, manger ou boire). Une fois rétabli, placer femelle en cage avec le mâle.
Remarque : Si toutes les mesures sont suivies, la souris sera généralement reprendre conscience dans les 2 min et commencer immédiatement se déplaçant autour de la cage, montrer aucun signe d’inconfort. - Si la souris donne des signes d’inconfort (p. ex. voûté de posture, les sécrétions de porphyrine)33, administrer carprofène à 0,1 mg/mL dans l’approvisionnement en eau. Si plusieurs signes d’inconfort sont présents, ou si l’inconfort persiste pendant plus de 4 h, malgré l’administration de carprofen, immédiatement euthanasier la souris en administrant une injection létale intrapéritonéale de kétamine (240 mg/kg) - xylazine (48 mg/kg)- cocktail d’acépromazine (1,85 mg/kg) à l’aide d’une seringue de 1 mL avec un 26 G, ½" d’aiguille et suivre avec une formule secondaire approuvée de l’euthanasie,33.
- Pour augmenter la survie des embryons d’électroporation après la naissance, garder la cage dans un endroit calme maintenant salle, exempt de bruits et de vibrations. Enrichir l’environnement avec des igloos en plastique, matériaux de nidification et des compléments alimentaires tels que les graines de tournesol (voir la liste des matériaux). Ne pas déplacer ou déranger la cage, surtout pendant les 3 premiers jours après l’accouchement.
5. histologique préparation pour la microscopie de Fluorescence
Remarque : Ce protocole histologie est optimisé pour la préparation des tissus provenant d’animaux plus vieux que le jour après la naissance (P) 13 qui étaient électroporation in utero. Pour préparer les tissus de jeunes animaux postnatals (P0-P13), il est recommandé de suivre toutes les étapes (y compris transcardial perfusion), bien que le cerveau doit être incluse dans la gélose avant de préparer les sections (étape 5,9). Tissu on peut même préparer des embryons dans 1-2 jours après l’électroporation, à l’aide des méthodes décrites précédemment18,20.
-
Préparer la solution de paraformaldéhyde (PFA).
Remarque : Il est impératif de préparer fraîche PFA, dans la journée de l’expérience.
ATTENTION : Paraformaldéhyde est toxique et doit être manipulé sous une hotte avec un équipement de protection individuelle approprié.- Faire 50 mL 4 % PFA, chaleur 40 mL d’eau à 60 ° C. Ajouter 2 g PFA en remuant avec verre tige ou agitation bar. Ajouter 10 µL de 10 M NaOH toutes les 2 min jusqu'à dissolution du PFA.
- Ajouter 5 mL de 10 x PBS et apporter la solution pour un volume final de 50 mL avec de l’eau.
- Après avoir longuement solution à 50 mL, ajuster le pH à 7,4 selon les besoins avec la solution de HCl. Allow 10 M pour refroidir et stocker à 4 ° C.
- Euthanasier des souris avec une injection intrapéritonéale de kétamine (240 mg/kg) - xylazine (48 mg/kg) - cocktail d’acépromazine (1,85 mg/kg) à l’aide d’une seringue de 1 mL avec un 26G, ½" aiguille. Transcardially perfuse 10 ou 20 mL x 1 glacee PBS, suivie de 25 ou 40 mL glacee, fraîchement faites 4 % PFA17. Utiliser des volumes plus faibles pour jeunes postnatal (P0-P13) souris et des volumes plus élevés chez les souris âgées (P14 et ci-dessus).
- Immédiatement après la perfusion, décapiter la carcasse de la souris entre l’os occipital et vertèbre C1 avec des grands ciseaux et décollez et jeter la majeure partie de la peau qui entoure le crâne à l’aide de ciseaux de l’iris, la peau particulièrement occipital, pariétal et frontal environnant OS. Garder intact le crâne et le cerveau.
- Placez le crâne et le cerveau en 10 mL 4 % PFA dans un tube conique de 50 mL à 4 ° C pendant 24 h pour fixer le tissu. Puis ajoutez 30 mL 1 x PBS à tube à fond conique pour diluer la solution à 1 % PFA pour stockage à 4 ° C.
Remarque : Utiliser un tube conique distinct pour chaque crâne et le cerveau pour être fixé après. Incuber pas le cerveau dans 1 % PFA pendant plus de 2 semaines, ou fluorescence commencera à s’estomper. - Place du cerveau et du crâne sur une surface plane avec monocouche lingettes tâche imbibés de solution 1 PBS x. Utilisez une paire de pinces (voir la liste des matériaux) pour lever les peau ou membrane qui entoure le crâne.
- À l’aide de pinces à épiler, retirez d’abord l’os occipital, puis retirez avec précaution les os pariétaux, déplacer les pinces en les éloignant de la surface du cerveau. Retirez soigneusement les méninges pour ne pas endommager le cortex.
- L’arrière de la pince à épiler une cale sous le cerveau le long du crâne de rompre des nerfs crâniens et retirer le cerveau.
-
Pour les jeunes cerveaux postnatal de (P0-P13)
- Faire 25 mL de gélose de 4 % en chauffage PBS 1 x 25 mL à 80 ° C. Remuer et dissoudre 1 g de gélose d’un verre tige ou agitation).
- Solution de cool à 35 ° C tout en continuant de remuer. Placer le cerveau dans un petit récipient (par exemple le bouchon d’un tube conique de 50 mL) et verser la solution d’agar sur cerveau. Permettre l’agar à durcir.
- Faites une coupe coronale manuellement à l’aide d’une simple lame de rasoir à travers le cerveau, environ 0,5 mm de rostral au bregma. Faites une autre coupe coronale à travers le cerveau environ 0,5 mm caudal au cortex visuel. Placer une piscine de la colle cyanoacrylate du même diamètre que l’extrémité rostrale du cerveau sur le centre du disque échantillon vibration microtome. Placer l’extrémité rostrale du cerveau sur le dessus de la piscine de la colle, en veillant à ce que la totalité de la surface rostrale du tissu est lié au disque échantillon avec de la colle.
- Monter le plateau de tampon sur vibration microtome et fixer avec levier de serrage intégré. Insérez la lame dans porte-couteau et monter le porte-couteau sur vibration microtome avec vis de serrage intégré. Fixer le disque de spécimen avec cerveau sur bac tampon à l’aide du dispositif de serrage intégré. Réglage de la vitesse programmée à 5,70 (= 0.285 mm/s) et réglage de la fréquence à 5,33 (53,3 Hz).
- Remplir la chambre au-dessus du niveau du cerveau avec du PBS 1 x et abaisser la lame dans du PBS. Commencer à prendre 100 µm coronale sections à travers le tissu.
-
Si ne nécessitant ne pas un traitement supplémentaire, tel que 4', 6-diamidino-2-phénylindole (DAPI) la coloration des noyaux ou immunohistochimie.
- Utiliser un pinceau à pointe fin pour transférer des articles directement à partir de la vibration microtome sur une lame de microscope, montage de 4 à 6 sections sur chaque diapositive.
- Laisser les sections séchant par mèche solution away avec un pinceau à pointe fine, telle que les tranches de cerveau n’est plus la dérive sur les diapositives.
- Ensuite, placez une goutte de milieu de montage (voir la liste des matériaux) sur chaque section sur la diapositive.
- Doucement, posez une lamelle de 24 x 50 mm sur le dessus, veiller à ce que 1) aucune bulle d’air forme sur les sections, 2) les sections ne se déplacent pas, et 3) le mountant couvre entièrement la zone située entre la lame et lamelle. Permettent le montage soigner pendant au moins 24-48 h.
-
Pour colorer les noyaux au DAPI pour examen histologique des limbes corticales
- Utiliser un pinceau à pointe fin pour transférer chaque section dans une solution contenant 10 µg/mL DAPI (voir la liste des matériaux) dilué dans du PBS 1 x de la solution mère (20 mg/mL DAPI dans l’eau).
- Incuber en solution DAPI pendant 5 min à température ambiante, puis utilisez un pinceau à pointe fin pour transférer la section de la solution DAPI à 1 x PBS et incuber dans du PBS 1 x pendant 5 min à température ambiante. Transférer la section deux fois plus de PBS frais 1 x de 5 min chacun. Puis, à l’aide d’un pinceau à pointe fin, transfert la section sur une lame de microscope, suivez les étapes 5.11.2-5.11.4 et passez à l’étape 5.13.
- Faire chauffer un plat de Pétri de verre contenant Valap (parts égales Vaseline, lanoline et paraffine) sur une plaque chauffante à une basse température jusqu'à ce que complètement fondu. Joint exposé bords de diapositives en les badigeonnant de Valap fondu.
- Pour inspecter la fluorescence dans les tissus, utiliser un microscope optique ou microscope confocal (voir la liste des matériaux) et un filtre défini adéquat pour visionner le fluorophore (p. ex. DAPI : excitation 325-375 nm, émission 435-485 nm ; GFP : excitation 450-490 nm, émission 500-550 nm)17. Images confocales peuvent être prises avec faible - (4 X, ouverture numérique, NA = 0,20), moyen-(20 X, NA = 0,75) et haute puissance (60 X, NA = 1,40) objectifs.
Résultats
La construction unique de GFP. CRE (voir la liste des matériaux) a été électroporés à E15.5 et visualisé à P14. Selon la concentration de la construction et le volume d’injection, un résultat dense ou clairsemé, peut être obtenu22,26. Par exemple, l’injection de 1 µL de 2 mg/mL GFP. Résultats de cre une distribution clairsemée des cellules marquées, dont certaines peuvent être vives (Figure 1 a) et localisée en couche II/III (Figure 1 b). Parce que le tissu est 100 µm d’épaisseur, la plupart des arbres dendritiques sont conservés (Figure 1). Les épines dendritiques peuvent être observés à forts grossissements (60 X ; La figure 1). Injection de 1,5 µL à la même concentration entraîne très dense d’étiquetage (Figure 2 a) dans la couche II/III (Figure 2 b), qui peut être sous-optimal car il est difficile d’identifier la source des neurites et épines dendritiques (Figure 2). Toutefois, il est toujours possible d’imager un neurone (Figure 2D) et ses processus (Figure 2E) en sélectionnant une cellule lumineuse dans la périphérie de la zone étiquetée (Figure 2D).
Enfin, il est possible d’optimiser la luminosité des neurones tout en conservant une distribution clairsemée de cellules marquées. Ici, Supernova-GFP (voir la liste des matériaux) a été électroporés à E15.5 et visualisé à P23. Notez que, basée sur des observations du tissu cérébral prises à divers âges postnatales, il ne semble pas être un effet de l’âge sur la luminosité de toute constructions fluorescentes utilisée ici23,24,26. Injection de 1 µL d’un mélange contenant 1 mg/mL (CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE) Sn-GFP et 10 µg/mL TRE-Cre entraîne une distribution clairsemée de surtout lumineux cellules (Figure 3 a) dans la couche II/III (Figure 3 b). Dendritiques et axonales processus (Figure 3 b) et les épines dendritiques (Figure 3) peuvent être visualisées. Dans notre expérience, ciblant avec soit une construction unique comme la GFP. CRE ou avec « Supernova » constructions rapportera reproductible expression au moins 75 % des embryons d’électroporation.
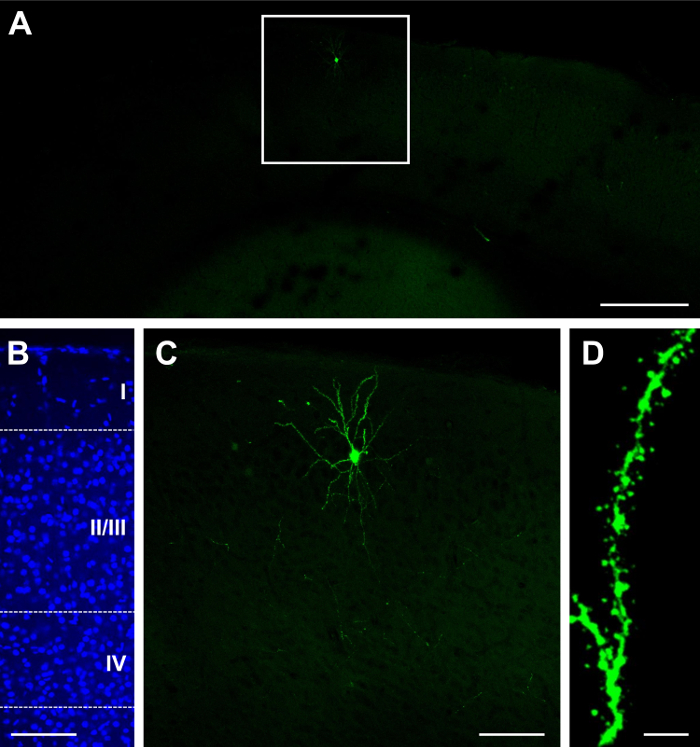
Figure 1 : Sparse et brillante expression après in utero électroporation avec une seule construisent contenant recombinase GFP et Cre. (A) à balayage fluorescence faible grossissement (X 4) du cortex cérébral à P23, après électroporation à E15.5. (B) micrograph fluorescence moyen grossissement (X 20) de coloration nucléaire DAPI, révélant la lamination corticale (couches I, II/III, IV et couches profondes à IV). (C) micrographie de fluorescence de grossissement moyen (X 20) d’un seul neurone. (D) micrographie de fluorescence à fort grossissement (X 60) d’épines dendritiques. Barreaux de l’échelle = 200 µm (A) ; 100 µm (B, C) ; et 5 µm (D). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
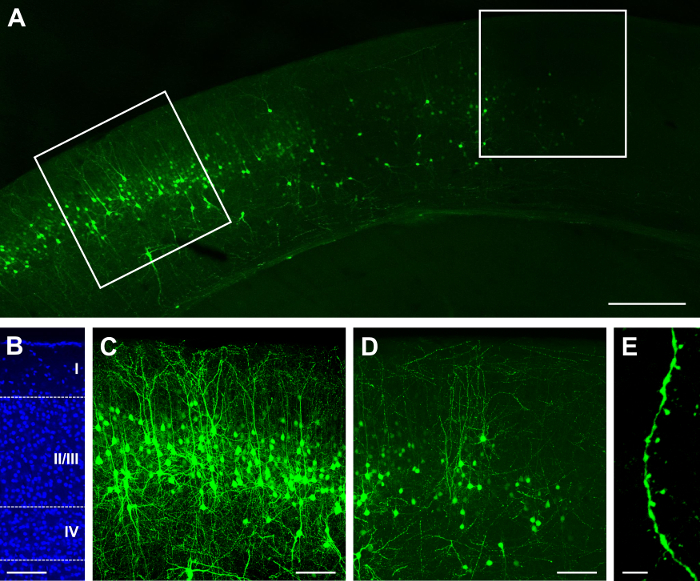
Figure 2 : Dense et brillante expression après in utero électroporation avec une seule construisent contenant recombinase GFP et Cre. (A) à balayage fluorescence faible grossissement (X 4) du cortex cérébral à P14, après électroporation à E15.5. (B) micrograph fluorescence moyen grossissement (X 20) de coloration nucléaire DAPI, révélant la lamination corticale (couches I, II/III, IV et couches profondes à IV). (C) micrograph fluorescence moyen grossissement (X 20) des neurones dans le domaine de l’étiquetage plus dense. (D) micrograph fluorescence moyen grossissement (X 20) des neurones pris la périphérie de la zone de marquage plus dense. (E) micrographie de fluorescence à fort grossissement (X 60) d’épines dendritiques. Barreaux de l’échelle = 200 µm (A) ; 100 µm (B, C, D) ; et 5 µm (E). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Sparse et brillante expression après in utero électroporation avec Supernova-GFP constructions contenant recombinase GFP et Cre. (A) à balayage fluorescence faible grossissement (X 4) du cortex cérébral à P14, après électroporation à E15.5. (B) micrograph fluorescence moyen grossissement (X 20) de coloration nucléaire DAPI, révélant la lamination corticale (couches I, II/III, IV et couches profondes à IV). (C) micrographie de fluorescence de grossissement moyen (X 20) d’un seul neurone. (D) micrographie de fluorescence à fort grossissement (X 60) d’épines dendritiques. Barreaux de l’échelle = 200 µm (A) ; 100 µm (B, C) ; et 5 µm (D). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ici, nous introduisons la combinaisondes in utero électroporation avec recombinase Cre chez la souris floxed pour générer des tissus cérébraux de mosaïque. Un avantage de cette approche est qu’une nouvelle ligne de souris n’a pas besoin d’être générés chaque fois qu’un autre sous-type cellulaire est d’être la cible : in utero électroporation permet de cibler des neurones excitateurs, neurones inhibiteurs ou cellules gliales selon la période et l’emplacement de l’électroporation15,16,17,18,19,20,21,34. Dans notre approche, ciblant le cortex cérébral est cohérente et reproductible car nous utilisons des électrodes d’électroporation de diamètre 5 mm qui peuvent être placés sur une grande surface du télencéphale en voie de développement. Pour cibler les sites alternatifs dans le cerveau (par exemple le diencéphale, rétine), ou pour un ciblage plus spécifique des régions dans le cortex cérébral, des procédures et des électrodes conçus expressément à cette fin peuvent être utilisé15, 16. nous fournissons également une construction unique qui prévoit un étiquetage clair et garantit que chaque neurone fluorescent marqué contienne une recombinase Cre. Un inconvénient d’utiliser une construction unique pour parvenir à un étiquetage clair est que la population marquée peut être trop dense (Figure 2), mais cela peut être résolu par l’imagerie de cellules à la périphérie de la zone étiquetée (Figure 2D). Par ailleurs, expression d’une construction fluorescente peut être conçue pour dépendre de Cre recombinase expression17, mais les niveaux d’expression faible peuvent exiger immunostaining pour le marqueur fluorescent. Cette limitation a été corrigée par le système de « Supernova » de Cre-dépendant du marqueur fluorescent expression (Figure 3 a)23,24.
En plus de combiner la recombinaison Cre-lox avec in utero électroporation, nous offrons plusieurs améliorations pour une reproduction optimale des femelles gravides chronométré. Il est important de garder les souris dans une salle d’exploitation qui est exempt de bruits et vibrations causées par les équipements tels que les hottes à flux laminaire. Enrichir l’environnement avec des igloos en plastique, matériaux de nidification, et des compléments alimentaires comme les graines de tournesol (voir la liste des matériaux). En dehors des considérations environnementales, nous avons remarqué que la première portée de la femelle a généralement le taux de survie plus faible. Ainsi, notre protocole suggère d’attendre la deuxième grossesse de la femelle à effectuer dans l’utérus de l’électroporation. Bien que cette stratégie augmente la survie de la litière, elle tend aussi à augmenter la taille de la portée, qui peut allonger le temps chirurgical et réduire ainsi le succès de la chirurgie. Donc, si il rencontre un nombre particulièrement élevé d’embryons (p. ex. plus de 8), nous suggérons l’électroporation à sauter sur certains des embryons, surtout des embryons plus proches pour les ovaires et l’utérus, où le tissu est plus vulnérables aux blessures. De plus, en utilisant la même stratégie d’enrichissement environnemental mentionnée ci-dessus (igloos en plastique, matières, diététiques de suppléments de nidification) tend à augmenter la survie des portées après la naissance. Il est également important de noter qu’oestrus peut survenir chez la femme quelques heures après l’accouchement de la première portée. Dans ce cas, permettre à la femelle donner naissance à sa deuxième portée, puis séparer après expiration de sevrage pour tenter l’accouplement. Lorsque vous cherchez des plugs vaginaux, il est conseillé de séparer la femelle même si une fiche n’est pas trouvée, surtout si la femelle est en oestrus la nuit précédente. Bouchons dans certaines souches sont difficiles à repérer, et conception peut-être ont déjà eu lieu.
Un autre domaine d’amélioration est en produisant des pipettes de micro-injection adéquate pour in utero électroporation. Tirant des pipettes pour injection d’ADN dans les ventricules latéraux est une étape cruciale. Ici, nous fournissons un protocole détaillé permettant de configurer des pipettes avec une taille de pointe compatible et pointe rugueuse. Autres méthodes incluent rupture retour la pointe avec une lame de bistouri Swann-Morton15 ou pincer l’extrémité avec la pince16,17. Notez que si les pointes de pipette sont trop petites, elles seront correctement perforer la paroi utérine mais débits d’injection sera trop faibles, allongeant le temps dans lequel la pipette se loge dans le cerveau embryonnaire. Si les pointes de pipette sont trop grands, ils peuvent endommager la paroi de l’utérus et le cerveau embryonnaire. Si les pointes de pipette sont trop lisses, qui en résultera une grande fourchettes dans la paroi utérine et/ou le crâne embryonnaire avant de percer, éventuellement endommager l’embryon. Pratique en créant une pause rugueuse pour produire une pointe de 20 à 25 µm et inspecter l’extrémité sous un microscope optique simple (par exemple avec un objectif 10 X) jusqu'à l’obtention d’un résultat cohérent. Ce fluide de vérification peut être reversé à un taux raisonnable (par exemple ~0.5 µL/s) avec un tuyau d’aspirateur est une autre méthode pour s’assurer que la taille de la pointe est dans des limites acceptables. Parce que les pipettes d’injection sont étalonnés et a obtenu son diplôme, le montant exact de l’ADN envoyée au ventricule latéral est connu. C’est l’étape la plus critique pour atteindre une rareté désirée reproductible à un ordre de grandeur. En d’autres termes, une concentration donnée devrait produire une étiquetage dans une fourchette donnée, par exemple les neurones marqués de 10 à 100.
L’étape la plus importante dans le protocole est la procédure d’électroporation in utero . Soyez extrêmement doux tout en exposant l’utérus. Lorsque vous retirez les derniers embryons dans la cavité abdominale, veillez à ne pas tirer sur les ovaires ou le col de l’utérus. En utilisant le pouce et l’index pendant la microinjection et électroporation permet une manipulation douce et agile des embryons pour révéler le ventricule latéral et les embryons qui se pousse doucement contre la paroi de l’utérus. Un toucher très doux est essentiel lors de la manipulation de l’utérus et les embryons. Si il est difficile de faire une douceur, l’utilisation de forceps de l’anneau avec une vis intégré limite pour empêcher la pince de serrage vers le bas sur un embryon ou de l’utérus, causant des dommages aux tissus. Une autre considération est d’administrer le carprofène et buprénorphine immédiatement avant la chirurgie, une pratique qui s’affiche pour assurer une gestion efficace de la douleur au cours de la chirurgie dans l’utérus sans affecter la survie des embryons taux35 .
En suivant notre procédure simplifiée histologique, plusieurs étapes sont essentielles. Après perfusant cerveaux expérimentale avec le fixateur, garder le cerveau intact dans le crâne pour protéger le tissu cérébral durant après fixation. Bien qu’il soit possible de stocker le cerveau dans % de 1 IFP pour les jours de semaines, noter cette fluorescence va diminuer comme la solution de la PFA se polymérise. Tranchage 100µm sections coronales est généralement assez mince pour permettre la microscopie confocale par le biais de la section entière tout en conservant une grande partie de la morphologie dendritique et axonale. Si la fixation a eu lieu correctement, cervelles d’animaux de plus de P13 peuvent être montés sur la vibration microtome tout simplement avec de la colle cyanoacrylate. Toutefois, si le cerveau est trop souple lors de la coupe de la vibration microtome, coller un petit agar ou agarose bloc derrière le cerveau pour l’empêcher de flexion alors que c’est être sectionné. Si le problème n’est pas résolu, incorporez le cerveau dans agar pour former un bloc pour couper avec le microtome vibrant, comme le suggère pour jeunes cerveaux postnatal (étape 5.8).
Cette méthode associe le système de recombinaison Cre-lox in utero électroporation afin de générer des mosaïques qui peuvent être utilisés pour étudier la fonction cellule autonome de gènes dans les neurones. Cette méthode peut également être configurée pour prendre en charge dans l’utérus l’électroporation de gène montage constructions (p. ex. CRISPR/Cas9)6ou autres recombinases propres au site(p. ex. Flp/FRT ou Dre/rox24), qui pourraient tous être conçu pour produire des tissus cérébraux de mosaïque. Une technique alternative prometteuse qui pourrait servir à produire des tissus de mosaïque est virale livraison via l’injection intraventriculaire de souris néonatales36. Combiné avec l’injection intraventriculaire à l’âge embryonnaire comme le démontre ici et d’ailleurs15,16,17,18,19,20, 21,22,37, vecteurs viraux codant pour une recombinase Cre ont pu être livrés avant la naissance d’infecter des cellules progénitrices floxed dans la zone ventriculaire. Un examen critique serait de faire en sorte que les vecteurs viraux sont dilués suffisamment pour atteindre l’excision clairsemée et l’étiquetage. Toutefois, cela se traduirait aussi en plus faible nombre de copies de la construction offert, y compris les marqueurs fluorescents essentiel pour neuroanatomiques observations (par exemple les épines dendritiques ou arborisation)24. Pour contrer cet écueil, de nouvelles constructions à l’aide de la même stratégie que les constructions de « Supernova » démontrées ici pourraient être utilisées pour atteindre clairsemée d’étiquetage sans une baisse correspondante de la luminosité des cellules marquées,24. Une autre considération critique avec livraison viral doit assurer d’avaient livré des constructions promoteurs spécifiques à la population de cellules à l’étude (p. ex. des neurones pyramidaux excitateur). L’injection intraventriculaire de vecteurs viraux provoque une infection de tous les tissus entourant les ventricules, y compris non seulement la zone ventriculaire de la dorsale télencéphale où neurones excitateurs corticales et hippocampe sont générés, mais aussi du côté médial et latérale des éminences ganglionnaires où nombreux interneurones corticaux sont nés à34. Une autre caractéristique de in utero électroporation comparée à virale livraison des constructions est sa fenêtre de temps relativement étroit de la livraison. Virus injectés dans les ventricules latéraux peuvent persister après la chirurgie, continuant à infecter les cellules qui tapissent la zone ventriculaire. En revanche, électroporation se produit en quelques secondes, ciblant un ensemble beaucoup plus spécifique des cellules. Cela peut être un avantage ou un désavantage à l’enquêteur, selon la sous-population de cellules à étudier.
Notre approche prend en charge la recombinaison Cre-lox par introduction d’une construction unique ou des constructions « Supernova ». Dans le cas des constructions « Supernova », nous exhortons les enquêteurs afin de vous familiariser avec les avantages et les limites de l’utilisation de cette stratégie. Par exemple, le moment de la suppression de la Cre a été démontré à se produire en 2 jours dans les neurones excitateurs de couche II/III du cortex cérébral24. Il est donc plausible que l’excision Cre pourrait se produire pendant les 48 h suivant l’électroporation, plutôt que d’électroporation qui suit immédiatement. Donc, les autres formes de corroborer le calendrier et la localisation de l’excision de la Cre (p. ex. à l’aide d’une lignée de souris journaliste Cre) devraient servir à compléter l’utilisation de cette nouvelle technique, en particulier dans les études où l’excision Cre dans un petit laps de temps est une critique examen. Un autre écueil potentiel est qu’un faible pourcentage de cellules non étiquetées dans une expérience de « Supernova » savaient exprimer une recombinase Cre. Par exemple, dans la Figure 3, nous co-électroporation deux plasmides : une forte concentration de CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE et une faible concentration de TRE-Cre. Car TRE est un promoteur qui fuit, une recombinase Cre pourrait être exprimée dans les cellules qui ont reçu le plasmide de TRE-Cre mais pas le plasmide loxP-stop-loxP-EGFP-tTA, bien que ce serait un événement rare. Dans une expérience où il est essentiel que toutes les cellules non marquées n’ont aucune excision induite par le Cre que ce soit, une expérience « Supernova » doive être complétée par une expérience de contrôle dans lequel Cre expression recombinase en dehors d’étiqueté neurones est évaluée au moyen d’autres moyens (par exemple l’immunohistochimie recombinase Cre).
En résumé, notre protocole est facilement modifié pour tenir compte de ces nouvelles constructions, de faire dans l’utérus électroporation une méthode encore plus utile et adaptable pour l’analyse de la mosaïque. Ainsi, dans l’utérus électroporation est cumulable avec la puissance de la recombinaison génétique de plusieurs manières d’étudier mosaïque cerveau tissu in vivo.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêt à divulguer.
Remerciements
Les auteurs remercient le généreux soutien du département de biologie de l’Université James Madison et James Madison University lumière microscopie Imaging Facility. Dr. Mark L. Gabriele pour obtenir des conseils utiles au sujet de la préparation de jeunes tissus postnatal, et Drs Justin W. Brown et Corey L. Cleland de coordination généreux d’espace et de matériel chirurgical. Cette recherche a été financée en partie par une subvention de recherche concertée par 4-VA, un partenariat de collaboration pour faire progresser le Commonwealth de la Virginie (G.S.V.) et par une Virginie Académie des Science petit projet subvention de recherche (G.S.V.). Appui a été généreusement fourni par une dotation de Betty Jo Butler aimante 58 pour la bourse de recherche de premier cycle (à K.M.B.), une bourse de recherche de l’été de Farrell (pour K.M.B.), une bourse de siècle deuxième James Madison University (pour K.M.B.), un James Madison University bourses du centenaire (à C.J.H.), un James Madison University recherche 30 Lucy Robinson Memorial Scholarship (à Z.L.H.) et un James Madison University College of Science et de la bourse d’aide Faculté de mathématiques (à G.S.V.).
matériels
| Name | Company | Catalog Number | Comments |
| C57BL/6J mice | The Jackson Laboratory | #000664 | See "1. Mouse set-up" (step 1.1, "wildtype mice") |
| GFP.Cre empty vector | AddGene | #20781 | See "2. DNA set-up" (step 2.1 "single DNA construct that codes for Cre recombinase as well as a fluorescent marker"). GFP.Cre empty vector was a gift from Tyler Jacks. |
| pK029.CAG-loxP-stop-loxP-RFP-ires-tTA-WPRE (Supernova) | AddGene | #69138 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK029.CAG-loxP-stop-loxP-RFP-ires-tTA-WPRE (Supernova) was a gift from Takuji Iwasato. |
| pK031.TRE-Cre (Supernova) | AddGene | #69136 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK031.TRE-Cre (Supernova) was a gift from Takuji Iwasato. |
| pK038.CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE (Supernova) | AddGene | #85006 | See "2. DNA set-up" (step 2.1 "Supernova" system) and http://snsupport.webcrow.jp/. pK038.CAG-loxP-stop-loxP-EGFP-ires-tTA-WPRE (Supernova) was a gift from Takuji Iwasato. |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | #12362 | See "2. DNA set-up" (step 2.3 "endotoxin-free plasmid purification kit") |
| Trypan Blue powder, BioReagent grade | Sigma | T6146-5G | See "2. DNA set-up" (step 2.5 "trypan blue") |
| Sodium Chloride, ACS, 2.5 kg | VWR | BDH9286-2.5KG | See "2. DNA set-up" (step 2.5 "NaCl") |
| Potassium Chloride, ACS, 500 g | VWR | #97061-566 | See "2. DNA set-up" (step 2.5 "KCl") |
| Sodium phosphate dibasic, ReagentPlus, 100 g | Sigma-Aldrich | S0876-100G | See "2. DNA set-up" (step 2.5 "Na2HPO4") |
| Potassium phosphate monobasic, ReagentPlus, 100 g | Sigma-Aldrich | P5379-100G | See "2. DNA set-up" (step 2.5 "KH2PO4") |
| Hydrochloric acid, ACS reagent, 500 mL | Fisher Scientific | A144-500 | See "2. DNA set-up" (step 2.5 "HCl") |
| P-97 Micropipette Puller | Sutter Instrument | P-97 | See "3. Pipette set-up" (step 3.1 "glass capillary puller") |
| 3.0 mm wide trough filament | Sutter Instrument | FT330B | See "3. Pipette set-up" (step 3.1 "glass capillary puller") |
| Thin Wall Glass Capillaries, 4", 1 / 0.75 OD/ID | World Precision Instruments | TW100-4 | See "3. Pipette set-up" (step 3.1.1 "glass capillary") |
| Single Ply Soft-Tech Wipes, 4.5" | Phenix | LW-8148 | See "3. Pipette set-up" (step 3.2.1 "single-ply task wipe"); other single-ply wipes (e.g. Kimwipes) can be used. |
| Graefe Forceps, 7 cm, Straight, 0.7 mm 1x2 Teeth | World Precision Instruments | #14140 | See "4. In utero electroporation" (step 4.1 "Graefe forceps") |
| Iris Scissors, 11.5 cm, Straight, 12-pack | World Precision Instruments | #503708-12 | See "4. In utero electroporation" (step 4.1 "iris scissors") |
| Hartman Mosquito Forceps, 9 cm, Straight, 12-pack | World Precision Instruments | #503728-12 | See "4. In utero electroporation" (step 4.1 "Hartman mosquito forceps") |
| General Purpose Non-Woven Sponges, 2" x 2", 4-ply | Medrepexpress | #2204-c | See "4. In utero electroporation" (step 4.1 "non-woven gauze sponges") |
| Ring Tipped Forceps, 10 cm, Straight, 2.2mm ID | World Precision Instruments | #503203 | See "4. In utero electroporation" (step 4.1 "ring-tipped forceps") |
| Pyrex petri dishes complete, O.D. × H 100 mm × 20 mm | Sigma-Aldrich | CLS3160102-12EA | See "4. In utero electroporation" (step 4.1 "Petri dishes") |
| Flat Type Instrument Tray, Stainless Steel, 13-5/8" x 9-3/4" x 5/8" | Amazon | B007SHGAHA | See "4. In utero electroporation" (step 4.1 "stainless steel tray") |
| Platinum Tweezertrode, 5 mm | BTX | #45-0489 | See "4. In utero electroporation" (step 4.3 and 4.16 "tweezer-type electrodes") |
| ECM 830 Foot Pedal | BTX | #45-0211 | See "4. In utero electroporation" (step 4.3 and 4.17 "foot pedal") |
| ECM 830 Generator | BTX | #45-0052 | See "4. In utero electroporation" (step 4.3 "generator") |
| Single Animal Isoflurane Anesthesia System with Small Induction Box | Harvard Apparatus | #72-6468 | See "4. In utero electroporation" (step 4.4 and 4.6 "nose cone", step 4.4 "induction chamber") |
| Ophthalmic ointment | Hanna Pharmaceutical Supply Co | #0536108691 | See "4. In utero electroporation" (step 4.7 "veterinary ophthalmic ointment") |
| Space Gel (AIMS) | VWR | #95059-640 | See "4. In utero electroporation" (step 4.8 "sealed pouch filled with supersaturated salt solution") |
| Hair Remover Gel Cream, Sensitive Formula | Veet | #062200809951 | See "4. In utero electroporation" (step 4.9 "depilatory cream") |
| 10ul Low Retention Tip Starter (960 tips/pk) | Phenix Research Products | TSP-10LKIT | See "4. In utero electroporation" (step 4.12 "sterile 10 µL micropipette tip") |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177 | See "4. In utero electroporation" (step 4.15 "aspirator tube assembly") |
| Braided Absorbable Suture, 4-0, Needle NFS-2(FS-2), 27" | Medrepexpress | MV-J397 | See "4. In utero electroporation" (step 4.19 "absorbable sutures") |
| “LiquiVet Rapid” Tissue Adhesive | Medrepexpress | VG3 | See "4. In utero electroporation" (step 4.20 "tissue adhesive") |
| Hypodermic syringes, polypropylene, Luer lock tip, capacity 1.0 mL | Sigma-Aldrich | Z551546-100EA | See "4. In utero electroporation" (step 4.21 "1 mL syringe") |
| BD Precisionglide syringe needles gauge 26, L 1/2 in. | Sigma-Aldrich | Z192392-100EA | See "4. In utero electroporation" (step 4.21 "26G, ½” needle") |
| Nestlets Nesting Material | Ancare | NES3600 | See "4. In utero electroporation" (step 4.24 "nesting materials") |
| Sunflower Seeds, Black Oil, Sterile | Bio-Serv | S5137 | See "4. In utero electroporation" (step 4.24 "sunflower seeds") |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | See "5. Histology" (step 5.1.1 "PFA") |
| Economy Tweezers #3, 11 cm, 0.2 x 0.4 mm tips | World Precision Instruments | #501976 | See "5. Histology" (step 5.5 "tweezers") |
| Agar powder | Alfa Aesar | #10752 | See "5. Histology" (step 5.8.1 "agar") |
| Single-edge razor blades, #9 blade | Stanley Tools | #11-515 | See "5. Histology" (step 5.9 "single-edge razor blade") |
| Specimen disc S D 50 mm | Leica | #14046327404 | See "5. Histology" (step 5.9 "vibrating microtome specimen disc") |
| Buffer tray S assembly | Leica | #1404630132 | See "5. Histology" (step 5.10 "buffer tray") |
| VT1000 S Vibratome | Leica | #14047235612 | See "5. Histology" (step 5.10 "vibrating microtome") |
| Double Edge Razor Blades | Personna | BP9020 | See "5. Histology" (step 5.10 "blade") |
| Knife Holder S | Leica | #14046230131 | See "5. Histology" (step 5.10 "knife holder") |
| Studio Elements Golden Taklon Short Handle Round Brush Set | Amazon | B0089KU6XE | See "5. Histology" (step 5.12.1 "fine tipped paintbrush") |
| Superfrost Plus Slides | Electron Microscopy Services | #71869-11 | See "5. Histology" (step 5.12.1 "microscope slide") |
| ProLong Diamond Antifade Mountant, 10 ml | Thermofisher | P36970 | See "5. Histology" (step 5.12.3-5.12.4 "mountant") |
| Cover Glass, 24 x 50 mm, No. 1 | Phenix Research Products | MS1415-10 | See "5. Histology" (step 5.12.4 "coverslip") |
| 4′,6-Diamidino-2-phenylindole dihydrochloride (DAPI) | Sigma-Aldrich | D9542 | See "5. Histology" (step 5.13.1 "DAPI") |
| Fixed Stage Upright Microscope | Olympus | BX51WI | See "5. Histology" (step 5.15 "light microscope") |
| Laser Scanning Confocal Microscope | Nikon | TE2000/C2si | See "5. Histology" (step 5.15 "confocal microscope") |
| 4x objective, NA = 0.20 | Nikon | CFI Plan Apo Lambda 4X | See "5. Histology" (step 5.15 "low-power objective") |
| 20x objective, NA = 0.75 | Nikon | CFI Plan Apo Lambda 20X | See "5. Histology" (step 5.15 "medium-power objective") |
| 60x objective, NA = 1.40 | Nikon | CFI Plan Apo VC 60X Oil | See "5. Histology" (step 5.15 "high-power objective") |
Références
- Southwell, D. G., Froemke, R. C., Alvarez-Buylla, A., Stryker, M. P., Gandhi, S. P. Cortical plasticity induced by inhibitory neuron transplantation. Science. 327 (5969), 1145-1148 (2010).
- Hanson, J. E., Madison, D. V. Presynaptic FMR1 genotype influences the degree of synaptic connectivity in a mosaic mouse model of fragile X syndrome. J. Neurosci. 27 (15), 4014-4018 (2007).
- Patel, A. B., Hays, S. A., Bureau, I., Huber, K. M., Gibson, J. R. A Target Cell-Specific Role for Presynaptic Fmr1 in Regulating Glutamate Release onto Neocortical Fast-Spiking Inhibitory Neurons. J. Neurosci. 33 (6), 2593-2604 (2013).
- Patel, A. B., Loerwald, K. W., Huber, K. M., Gibson, J. R. Postsynaptic FMRP promotes the pruning of cell-to-cell connections among pyramidal neurons in the L5A neocortical network. J. Neurosci. 34 (9), 3413-3418 (2014).
- McConnell, M. J., et al. Mosaic Copy Number Variation in Human Neurons. Science. 342 (6158), 632-637 (2013).
- McConnell, M. J., et al. Intersection of diverse neuronal genomes and neuropsychiatric disease: The Brain Somatic Mosaicism Network. Science. 356 (6336), eaal1641 (2017).
- Gu, H., Marth, J. D., Orban, P. C., Mossmann, H., Rajewsky, K. Deletion of a DNA polymerase beta gene segment in T cells using cell type-specific gene targeting. Science. 265 (5168), 103-106 (1994).
- Hodges, J. L., et al. Astrocytic Contributions to Synaptic and Learning Abnormalities in a Mouse Model of Fragile X Syndrome. Biol. Psychiatry. (17), 1-11 (2016).
- Young, P., Qiu, L., Wang, D., Zhao, S., Gross, J. Single-neuron labeling with inducible cre-mediated knockout in transgenic mice. Nat. Neurosci. 11 (6), 721-728 (2011).
- Zong, H., Espinosa, J. S., Su, H. H., Muzumdar, M. D., Luo, L. Mosaic Analysis with Double Markers in Mice. Cell. 121 (3), 479-492 (2005).
- Hippenmeyer, S., et al. Genetic mosaic dissection of Lis1 and Ndel1 in neuronal migration. Neuron. 68 (4), 695-709 (2010).
- De la Rossa, A., Jabaudon, D. In vivo rapid gene delivery into postmitotic neocortical neurons using iontoporation. Nat. Protoc. 10 (1), 25-32 (2015).
- Lu, W., Bushong, E. A., Shih, T. P., Ellisman, M. H., Nicoll, R. A. The cell-autonomous role of excitatory synaptic transmission in the regulation of neuronal structure and function. Neuron. 78 (3), 433-439 (2013).
- Duan, Y., et al. Semaphorin 5A inhibits synaptogenesis in early postnatal- and adult-born hippocampal dentate granule cells. eLife. 3, 1-24 (2014).
- Dixit, R., et al. Efficient Gene Delivery into Multiple CNS Territories Using In utero Electroporation. J. Vis. Exp. (52), e2957 (2011).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero Electroporation: Controlled Spatiotemporal Gene Transfection. J. Vis. Exp. (54), e3024 (2011).
- Briz, C. G., Navarrete, M., Esteban, J. A., Nieto, M. In utero Electroporation Approaches to Study the Excitability of Neuronal Subpopulations and Single-cell Connectivity. J. Vis. Exp. (120), (2017).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240 (1), 237-246 (2001).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nature protocols. 1 (3), 1552-1558 (2006).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: Visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 10 (3), 1027-1032 (2007).
- Pacary, E., et al. Visualization and Genetic Manipulation of Dendrites and Spines in the Mouse Cerebral Cortex and Hippocampus using In utero Electroporation. J. Vis. Exp. (65), e4163 (2012).
- Mizuno, H., et al. NMDAR-Regulated Dynamics of Layer 4 Neuronal Dendrites during Thalamocortical Reorganization in Neonates. Neuron. 82 (2), 365-379 (2014).
- Luo, W., et al. Supernova: A Versatile Vector System for Single-Cell Labeling and Gene Function Studies in vivo. Sci. Rep. 6, 35747 (2016).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab animal. 38 (9), 305-310 (2009).
- Vidal, G. S., Djurisic, M., Brown, K., Sapp, R. W., Shatz, C. J. Cell-Autonomous Regulation of Dendritic Spine Density by PirB. eNeuro. 3 (5), 1-15 (2016).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS ONE. 7 (4), 1-5 (2012).
- Andreu-Agullo, C., Maurin, T., Thompson, C. B., Lai, E. C. Ars2 maintains neural stem-cell identity through direct transcriptional activation of Sox2. Nature. 481, 195-198 (2011).
- Scotto-Lomassese, S., et al. Fragile X mental retardation protein regulates new neuron differentiation in the adult olfactory bulb. J. Neurosci. 31, 2205-2215 (2011).
- . . Plasmids 101: A Desktop Resource. , (2017).
- . . Pipette Cookbook. , (2015).
- Cuddington, B., Verschoor, M., Mossman, K. Handling of the Cotton Rat in Studies for the Pre-clinical Evaluation of Oncolytic Viruses. J. Vis. Exp. (93), e52232 (2014).
- Leary, S., et al. . AVMA Guidelines for the Euthanasia of Animals: 2013 Edition. , (2013).
- Anderson, S. A., Eisenstat, D. D., Shi, L., Rubenstein, J. L. R. Interneuron Migration from Basal Forebrain to Neocortex: Dependence on Dlx Genes. Science. 28 (5337), 474-476 (1997).
- Parker, J. M., Austin, J., Wilkerson, J., Carbone, L. Effects of Multimodal Analgesia on the Success of Mouse Embryo Transfer Surgery. J. Am. Assoc. Lab. Anim. Sci. 50 (4), 466-470 (2011).
- Kim, J. -. Y., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualising and manipulating neuronal circuits in vivo. Eur. J. Neurosci. 37 (8), 1203-1220 (2013).
- Pierfelice, T. J., Gaiano, N. Ultrasound-Guided Microinjection into the Mouse Forebrain In Utero at E9.5. J. Vis. Exp. (45), e2047 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon