Method Article
有糸分裂の多機能の細胞周期蛋白質の役割を研究する有糸分裂細胞同期と高分解能共焦点顕微鏡を組み合わせた
要約
高分解能共焦点顕微鏡を用いた解析に続いて HeLa 細胞の二重チミジン同期するためのプロトコルを提案します。このメソッドは、多数の有糸分裂、また界面機能を有する多機能性蛋白質の細胞分裂の役割の解明を可能にする S 期から同期的に進めるセルを取得するキーです。
要約
位相依存的に細胞周期の様々 な規制のイベントの研究は、細胞増殖と分裂についての明確な理解を提供します。細胞周期の特定の段階のセル人口の同期は、このような実験的努力で非常に役に立つ発見されています。比較的より少なく有毒な化学薬品処理による細胞の同期は、結果として細胞周期イベントの選択した分裂段階の特定の濃縮を得ようと研究の薬理学的阻害薬の使用上有利なすることができます。ここで、セルのさまざまな段階で同期のひと細胞周期 S 期と M 段階二重チミジン ブロックの両方を含むと染色体の整列の有糸分裂蛋白質の機能を研究するための手順をリリース プロトコルを説明します。分離。このプロトコルは、確立された界面の機能を持つ多機能タンパク質の細胞分裂の役割を研究するため非常に便利になっています。私たちのケースでは Cdt1、レプリケーション元ライセンス G1 期での重要な蛋白質の細胞分裂の役割を効果的に学ぶことができます G2/M 固有 Cdt1 が枯渇することができる場合にのみ。二重チミジンの同期を使用して特定の G2/M Cdt1 の枯渇のための詳しいプロトコルについて述べる。また、セル固定のプロトコルを説明し、チミジン リリース後高分解能共焦点顕微鏡を用いた細胞イメージングを住んでいます。メソッドは Hec1、複雑な Ndc80 のコンポーネントのように生理と摂動条件下で細胞分裂蛋白質の機能を分析し固定と生きている細胞の分裂期の細胞の大規模なサンプル サイズを取得することができるため便利分析も紹介します。
概要
細胞周期細胞は彼らのゲノムと増殖の正確な重複規制の厳しいと一時的制御イベントのシリーズを受けます。哺乳類細胞周期の間期と M 期ので構成されます。中間期の 3 つの段階 - G1、S から成っている、セル G2 のゲノムを複製し、正常な細胞周期進行1,2のために必要な成長を経る。(前期 prometaphase、中期、後期、終期) 有糸分裂と細胞質分裂から成る M 相親細胞は遺伝的に同一の 2 つの娘細胞を生成します。続いて中期プレート (中期) の整列の有糸分裂、姉妹染色分け体重複ゲノムの凝縮 (前期)、組み立て有糸分裂紡錘体 (prometaphase) の微小管による自分の体に取得されたドライブの姉妹染色分け体のに向かって分割し、反対側のスピンドルに運ばれる極 (後期) とき偏析と等しい。2 つの娘細胞は、アクチンに基づく収縮環 (終期と細胞質分裂) の活動によって物理的に分かれています。動原体染色分け体のセントロメア領域で組み立てて特殊なタンパク質の構造は、紡錘体微小管の添付ファイルをサイトとして.その主な機能は、染色体キャプチャ、配置を駆動し、染色体分離3,4の忠実性を維持するために紡錘アセンブリ チェックポイントを仲介しながら、不適切なスピンドル微小管の添付ファイルを修正することを支援することです。
セル同期の手法は、細胞周期の進行に関与する分子と構造のイベントを理解するための理想的なツールとして機能します。このアプローチは、さまざまな種類の解析、遺伝子発現のプロファイリングを含む細胞の生化学的なプロセスの解析とタンパク質の細胞内局在性の検出の特定のフェーズでセル人口を豊かに使用されています。個々 の遺伝子産物の研究のみならず遺伝子式5、miRNA 発現パターン6のマイクロ アレイ解析を含む全体のゲノムの解析を伴うアプローチ同期の哺乳類細胞を使用できます。翻訳制御7、および蛋白質の変更8のプロテオーム解析。同期は、細胞周期の進行に及ぼす影響の遺伝子発現やタンパク質ノックダウンまたはノックアウト、または化学物質の研究にも使用できます。
細胞は、細胞周期の異なった段階で同期できます。物理的、化学的、広くセル同期に使用されます。セル同期の最も重要な基準は、同期する必要があります noncytotoxic と可逆であること。潜在的な不利な細胞結果の薬理学的エージェントによってセルを同期する、ため化学依存メソッドはキー細胞周期イベントの勉強のために有利にできます。たとえば、ヒドロキシウレア、amphidicolin、ミモシン、ロバスタチン、G1/S 期の細胞の同期に使用できるが、彼らを阻害する生化学的経路の効果のために彼らは細胞周期チェックポイント機構をアクティブにし、重要なを殺すセル9,10の割合です。その一方で、「チミジン ブロック」として知られている成長媒体にチミジンを追加して DNA 複製のフィードバック阻害は特定ポイント11,12,13で細胞周期を挙げることが出来る。セルは、ノコダゾールと RO 33069,14と扱うことによって G2/m 期で同期できます。微小管重合を防ぐノコダゾールが比較的高い細胞毒性です。また、ノコダゾール逮捕細胞分裂すべりによって中間期の早期に返すことができます。二重チミジン ブロック逮捕セル G1/S 段階およびブロックからの解放後、細胞はある G2 から、有糸分裂に同期的に続行します。細胞周期細胞チミジン ブロックから解放のための通常の進行は、セル固定またはライブ イメージングによる高分解能共焦点顕微鏡の下で観察できます。セルを入力し、二重チミジン ブロックからリリース後有糸分裂に進むときに具体的に、有糸分裂蛋白質の摂動の効果を学ぶことができます。Cdt1、多機能性蛋白質、DNA 複製が G1 期でライセンスを起源に関与する有糸分裂15の中にも動原体微小管の添付ファイル必要です。有糸分裂 Cdt1 の機能を研究、レプリケーション ライセンス G1 フェーズ G2/M フェーズのみで具体的にその枯渇に影響を与えて同時に一方で、枯渇の影響を回避する手法を採用する必要があります。ここでは、固定と生細胞イメージングによる蛋白質の細胞周期の異なった段階の間に複数の機能を実行するの分裂の役割を研究する二重チミジン ブロックに基づく詳細なプロトコルを提案する.
プロトコル
1. 二重チミジン ブロックおよび解放: 試薬の準備
- ダルベッコ修飾イーグル培地 (DMEM) 培 10 %fbs、ペニシリン、ストレプトマイシンと 500 mL を作る。
- チミジンの 100 mM の在庫は、滅菌水と因数-80 ° C でストア
2 細胞分裂の進行 (図 1 a) の固定セルイメージ投射のためのプロトコル
- 日 1、5 HeLa 細胞の 10 倍 ~ 2 種 (70% エタノールと紫外線照射による殺菌) カバー スリップと DMEM 培地 2 mL 6 ウェル プレートのウェルに。37 ° C、5% CO2で 24 時間加湿のインキュベーターで細胞を成長します。
- 1stチミジン ブロック: 2 日目、徹底的に新鮮な DMEM メディア (100 mM 在庫、2 mM 最終濃度) のチミジンの必要量を混ぜます。
- チミジンを含む 2 mL を追加メディア 6 ウェルの細胞をプレートし、18 時間孵化させなさい。
- 3 日目、培地を吸引し、2 mL の 1x PBS で 2 回細胞と新鮮な prewarmed DMEM; に一度洗う9 h ブロックから細胞を解放する新鮮な prewarmed DMEM 培地で細胞を育ちます。
- 2ndチミジン ブロック: チミジンを含む 2 mL を再び追加メディア (最終濃度が 2 mM) 6 ウェル プレートの各ウェル内のセルにします。
- さらに 18 時間孵化させなさい。
- 4 日目、培地を吸引し、2 mL の 1x PBS で 2 回細胞と新鮮な prewarmed DMEM を洗ってください。
- 一緒にそれらをミックスし、室温 20 分間インキュベート希薄 Sirna (制御と Cdt1) と血清無料で 10 分間個別に培地にトランスフェクション試薬各トランスフェクションに使用する siRNA の最終濃度が 100 nM。チミジンから洗浄されたセルに反応混合物を追加します。
- インキュベート細胞ブロックから解放し、4% とカバー スリップ上のセルを修復する 9-10 h の 37 ° C で室温に 20 分間 PFA
注意: PFA は有毒である、適切な保護具を着用します。 -
Immunostain セル、常温の 10 分の 0.5% (v/v) 洗剤イオンと 5 分の 1 × PBS で 2 回細胞を洗浄後。
- 1% (w/v) で一次抗体 (マウス抗 α-チューブリン抗体希釈 1:1, 000、1: 400、1: 300 で希釈した抗リン ɣ H2AX マウスで希釈ウサギ抗 Zwint1 抗体) の 50 μ L とセルを扱う続く RT で 1 h の 1x PBS で 1 %bsa (w/v) で細胞をブロックします。37 oc 以上で 1 h の 1x PBS で BSA
- 1x PBS で細胞を 3 回洗浄した後室温 1 時間各カバー ガラス (アレクサ 488 と 1: 250 の 1% (w/v) BSA 1x PBS で希釈でローダミン レッド) 二次抗体の 50 μ L で細胞を治療します。
- 2 回各 5 分の 1 × PBS のセルを洗浄した後セル DAPI を扱う (0.1µg/mL の 1x PBS で) 右で 5 分間
- 2 回各 5 分の 1 × PBS のセルを洗浄した後クリア顕微鏡スライド上の適切なマウント メディアにセルに直面してカバー スリップを配置します。
- 60 X 100 X 1.4 NA 計画アポクロマート DIC 油浸対物レンズと immunostained タンパク質の細胞が必要なイメージの品質に応じて適切なカメラを装備して逆の高分解能共焦点顕微鏡にマウントされているイメージ。
- 顕微鏡用ソフトウェアを用いた 0.2 μ m 厚の z スタックが適切なは、室温で画像を取得します。
3. 細胞分裂の進行 (図 3 a) の生きているセルイメージ投射のためのプロトコル
- 1 日に 1.5 mL DMEM 培地で 35 mm ガラス底培養皿に mCherry H2B と GFP-α-チューブリン (少しセルの種類および蛋白質の表現に基づいて変数) を安定発現約 0.5-1 x 105 HeLa 細胞を播くし、加湿のそれらを育てる37 oC と 5% CO2で 24 h のためのインキュベーター。
- 1stチミジン ブロック: 2 日目、チミジンを含む 1.5 mL を加える料理 (100 mM チミジン、2 mM 最終濃度) のセルにメディア。
- 18 時間孵化させなさい。
- 3 日目、チミジンを含む培地を吸引し、2 mL の 1x PBS で 2 回と新鮮な prewarmed DMEM 三度、セルを洗浄します。
- 一緒にそれらをミックスし、室温 20 分間インキュベート希薄 Sirna (制御と Hec1) と 10 分ごとに個別に血清フリー培地でのトランスフェクション試薬各トランスフェクションに使用する siRNA の最終濃度が 100 nM。チミジンから洗浄されたセルに反応混合物を追加します。
- 1.5 mL 8 h ブロックから細胞を解放する新鮮な prewarmed DMEM 培地で細胞を成長します。
- 2ndチミジン ブロック: チミジンを含む 1.5 mL を追加料理のセルにメディア (2 mM 最終濃度)。
- さらに 18 時間孵化させなさい。
- 4 日目、培地を吸引し、2 mL の 1x PBS で 2 回と新鮮な prewarmed DMEM 三度、セルを洗浄します。細胞を成長し、新鮮な prewarmed ・ リーボヴィッツの (L-15) 媒体補われる 10 %fbs と 20 mM HEPES pH 7.0 8 h ブロックから細胞を解放します。
- 既にステージと実験の温度を安定させるためにイメージングを開始する前に少なくとも 30 分間点灯する高分解能共焦点顕微鏡で設定温度制御チャンバーに皿を置きます。
- セルが表示される、まで 60 × 対物と明るいフィールドにフォーカスし、手動で選択した領域に、ステージ上でふるいにかけます。
- 光とレーザー パワー/露出、画像集録パラメーターと選択の顕微鏡画像集録ソフトウェアを使用してテスト期間を設定します。GFP (488 励起; 385 nm 発光) と mCherry (561 nm 励起と 385 nm 発光) 画像を取得するためのフィルターを使用します。
- タイムラプスの実験を実行するには、別に 16 h までの期間にパルス送信される光と蛍光画像 10 分ごとを取得します。
- 12 1.0 μ m で区切られたソフトウェアを使用して二重チミジン ブロックからのリリース後 9 h z-飛行機の顕微鏡に適切なは、画像を取得します。
- 細胞分裂の進行を追跡画像を解析し、最終的にソース ソフトウェア フィジー/ImageJ で対応する映画を組み立てます。
結果
有糸分裂の進行と細胞内微小管の安定性に関する研究は二重チミジン ブロックからリリース後固定
Cdt1 は G1 期に DNA の複製の起源のライセンスに関与しています。それは S 期は劣化が、G2/m 期で再蓄積します。有糸分裂におけるその役割を研究、内因性 Cdt1 を使用して最も適したセル同期方式の二重チミジン ブロック15G/M 段階で具体的には枯渇する必要があります。細胞は、細胞は、S 相し、その時点でまた Cdt1 関数が必要です、G1 での複製の起源のライセンスが長い完了したとき 2ndチミジン ブロックからリリース後すぐに Sirna を導入させた。SiCdt1 トランスフェクションと二重チミジン ブロック リリースの 9 時間後 Cdt1 の枯渇は、(図 1 b) に西部のしみが付くことによって検証されました。セル 9 h 二重チミジン ブロックからリリース コントロールと Cdt1 siRNA の中期段階でほとんどセルであることを示しています後の固定は、セルを transfected しました。二重チミジン ブロックからの解放後の細胞 10 h 固定 Cdt1 siRNA で処理された細胞のほとんどは、制御の細胞は後期を入力し、通常期待される (図 1 として染色体を分離する間は prometaphase 後期の逮捕まだですけれども).-動原体微小管 (kMT) 安定性に関する Cdt1 枯渇の影響を理解するには、細胞で固定した 9 h からリリース後二重チミジン ブロック安定した動原体微小管 (kMTs) によって保持されるだけ、風邪の治療が続きます。コントロール細胞 (図 1) と比較して低温処理後 Cdt1 枯渇細胞 kMTs は堅牢性の比較的低い。したがって、このアプローチを使用すると、関心の分裂蛋白の機能の摂動後細胞の有糸分裂の進行学ぶことができる効果的に生きているセルイメージ投射の使用がなくても。
図 2は、DNA の複製の起源のライセンスはない摂動制御の細胞で認められた当社のプロトコルを使用して G2/M 段階 Cdt1 の細胞が枯渇しているときを示します。細胞を G2/m 期 Cdt1 の枯渇はその後 G2 フェーズでのリン酸化 ɣH2AX、DNA の損傷のマーカーの蓄積を誘導しなかった一方 Cdt1 を破壊する非同期文化の siRNA トランスフェクションによる不適切な DNA 複製ライセンスによる DNA 損傷の可能性があるため、リン ɣH2AX 陽性の病巣の蓄積。
ライブセル イメージングによる二重チミジン ブロックからリリース後細胞分裂の進行に関する研究
核膜崩壊 (NEB) 後、(の分裂タンパク質による摂動のない) 通常の細胞は有糸分裂を入力し、約 30-60 分 (図 3 b) 内有糸分裂から終了する後期発症を受けます。しかし、Hec1、堅牢な kMT アタッチメント形成に必要な主要動原体タンパク質の RNAi によるノックダウンは通常の細胞分裂の進行を遅らせることが判明します。このシナリオでは、ほとんどの細胞 NEB 後、細胞分裂を入力が後期発症を受けるか有糸分裂有糸分裂 (図 3) の遅延のいくつかの時間後も終了。同様に、体や細胞分裂時に機能を有するものに他の蛋白質の RNAi によるノックダウン効果が二重チミジン ブロックからの解放後の生細胞イメージングを用いたで効果的に観察したがってことができます。有糸分裂の進行、遅延、および逮捕の性質を研究するには、このメソッドを使用して試金することができる他のキー分裂現象のいくつかのほか染色体の整列、有糸分裂紡錘体の形成と活性化をポジショニングとの沈黙、スピンドル集合チェックポイント。
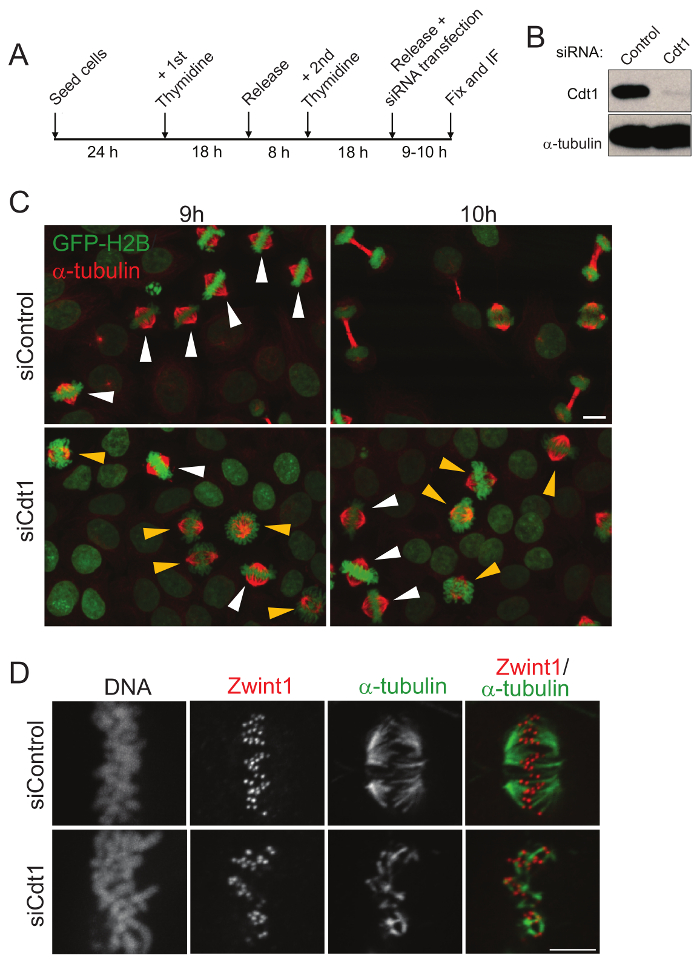
図 1: 細胞分裂の進行と二重チミジン同期後固定細胞における動原体微小管の安定性の解析。(A) A セル同期、固定、および蛍光抗体法の略図。(B) 第 2 チミジン ブロックからリリースの 9 時間後 Cdt1 のノックダウンのため西部のしみ。(C) 細胞分裂のセルを表示する蛍光顕微鏡二重チミジン ブロックとコントロール (上) または Cdt1 siRNA (下) と治療からの解放後の 9 と 10 h の固定します。赤は、α-チューブリンの染色、DNA は緑の細胞が GFP ヒストン H2B を表現。スケール バー = 10 μ m Prometaphase と中期の細胞黄色を使用して示され、それぞれの矢印を白します。(D) HeLa 細胞コントロール siRNA (上部パネル) と治療後と Cdt1 枯渇 (底板) からのリリース後 9 h の後冷たいリーボウィッツ (L-15) 処理後二重チミジン ブロック中、固定します。細胞は、スピンドル MT (緑) と Zwint1 (赤) と白と黒の DNA の DAPI 動原体マーカーの免疫染色しました。スケール バー = 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。
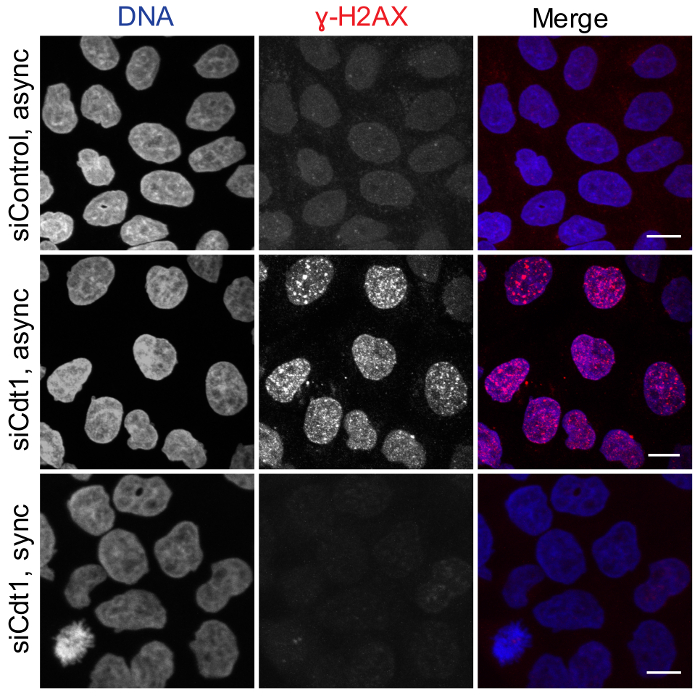
図 2: G2/m 期 Cdt1 枯渇はない複製ライセンスを摂動します。非同期の HeLa 細胞処理制御ルシフェラーゼ (上部パネル) またはcdt1 Sirna (中央のパネル) または二重チミジン同期 2ndチミジン ウォッシュ アウト 10 h で固定が続く中cdt1 siRNA HeLa 細胞(底板) のリリース後は、DAPI (疑似カラー グリーン) と抗リン ɣH2AX 抗体 (赤) 染色された.スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
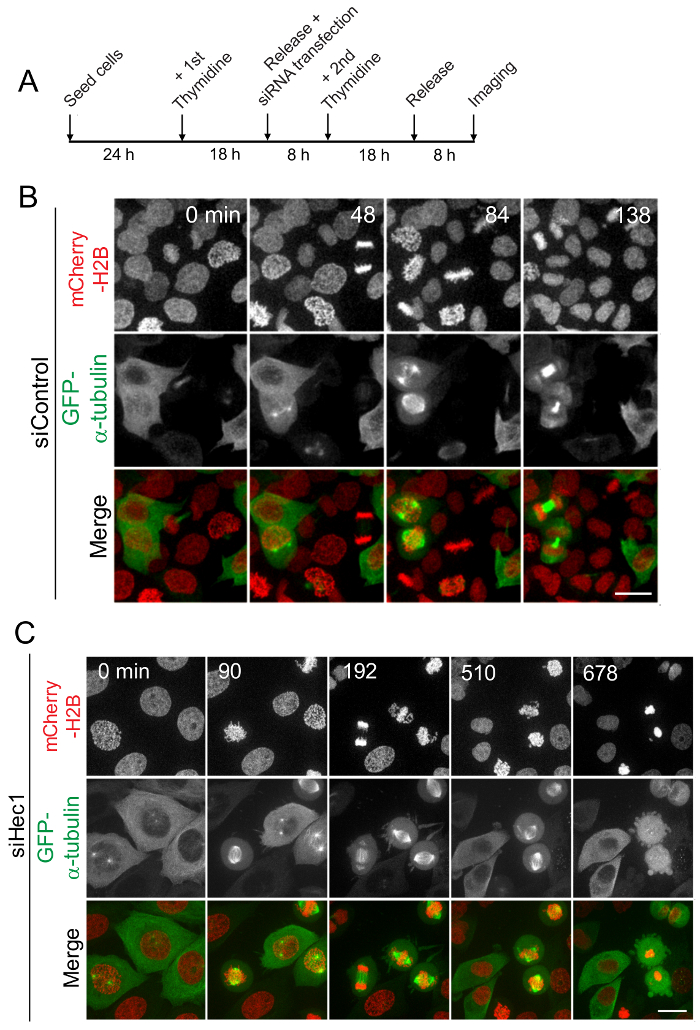
図 3: ライブセル イメージングによる細胞分裂の進行による同期セル。(A) A セル同期および生きているセルイメージ投射の模式図。HeLa 細胞の安定に発現する mCherry ヒストン H2B と GFP-α-チューブリンは S 相逮捕から G2/M 段階に進むように 8 h の二重チミジン ブロックから解放されました。ライブ イメージングは、チミジン ブロックから細胞を解放し、その時点から最大 16 時間継続後 8 h を開始高分解能共焦点顕微鏡を用いたを行った。ここでは 10 分毎に任意分裂蛋白質 (B) の摂動のない制御セルまたはセル (C) 複雑な Ndc80 の Hec1 サブユニットの枯渇をキャプチャ ビデオから静止画像。尺度バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
二重チミジン同期の最も重要な利点は、染色体の整列、バイポーラの解析もでき、一斉に有糸分裂を入力これらの細胞の多くは短時間の窓の分裂期細胞の増加し、サンプル サイズを提供すること主軸形成と染色体分配のエネルギー効率の向上。
多くの規定する蛋白質複合体とシグナル伝達経路有糸分裂を通して通常進行を確保するために専念しているし、このプロセスの規制緩和が腫瘍形成につながった可能性があります。安定 mCherry H2B と GFP チューブリンを表現し、ほとんど制御の細胞がくちばし (図 3 b) 後約 60 分以内で後期に染色体を分離する二重チミジン ブロック番組からリリースされた HeLa 細胞の細胞イメージングを住んでいます。その一方で、Hec1 関数はほとんどの細胞が続く後期発症またはアポトーシス (図 3) ずれている染色体と長い間分裂期にとどまることを示しますと摂動された HeLa 細胞の細胞イメージングを住んでいます。
過剰チミジンは、G1/S 相11セルをブロック S 段階で DNA 合成を阻害します。二重チミジン ブロック同期は細胞周期と細胞分裂の進行の研究で最もよく使用されるメソッドが、このメソッドの制限のいくつかの重要な 1 つ必要があります。重要なは、それは、化学洗浄されている徹底的に (7-8 h) のため、効果は完全に元に戻せるし、細胞は細胞周期の残りの部分を正常に続行することができますを確保する必要があります。以外セル可能性がありますいない不適切な進行も細胞分裂を引き起こしている 2 番目のサイクルを入力します。同期の細胞の割合は単一のチミジン ブロックと十分に高いかもしれないし、有糸分裂の特定の段階を勉強して関心を持っている場合は特に、二重チミジン ブロックを同期の細胞の数を増やす必要があります。チミジン処理の期間は、世代時間に応じて細胞のタイプ間の異なる感度のため最適化されなければなりません。たとえば、ハムスターのセルは世代時間の 16 時間を有し、最適な同期の17の 11 h のチミジンで扱われています。本研究ではチミジンの 16-18 h の HeLa 細胞を扱われます。また、余分なチミジンだけでなく DNA 合成を防ぐことができますがも可能性がありますセル11,12,18の重要な一部分を殺す、この損失をモニターに支払われる注意が必要を閉じる。本研究で用いたチミジン原液滅菌蒸留水で準備する必要があり。、細胞をトランスフェクション siRNA のメディアを追加した後の沈殿物を避けるためにし、またその同種の細胞培養媒体で徹底的に混合する必要があります。培養細胞周辺分布。
有糸分裂の進行中にタンパク細胞分裂の機能を勉強して、細胞理想的だろう siRNA をノックダウンする興味の蛋白質のレベル 1stチミジン ブロック中または処理 1セントからのリリース時にチミジン ブロック、効率的なタンパク質ノックダウン19,20,21を取得する必要な時間によって異なります。その一方で、有糸分裂の間 Cdt1 など多機能性蛋白質の役割を研究するため G2/M 枯渇を取得する 2ndチミジン ブロックからのリリース時に siCdt1 で細胞を治療するために必要です。Cdt1 は DNA の複製の起源の15のライセンスで重要な選手です。その特殊な役割有糸分裂のライセンスにおけるその役割に干渉することがなく、Cdt1 ニーズを理解するには、G2/M フェーズでは、二重チミジン同期によって効率的に達成することができます具体的に枯渇するので他に頼る必要があります。有糸分裂特異摂動方法実行しにくい。非同期の文化で Cdt1 の枯渇は、順番、有糸分裂の間この蛋白質の機能解析を混乱するいると DNA の複製の起源のライセンスの中断による DNA 損傷応答を誘発します。したがって、二重チミジン同期技術は、G1、S 相を施行したが、G2 と M 段階 Cdt1 機能に欠けていたセルを生成するユニークな実験的アプローチを提供しています。同期プロトコルの意義は有糸分裂の間に新たな機能を勉強する (G2/M) の特定のフェーズで多機能性蛋白質の阻害であります。したがって、このメソッドは、異なる細胞周期段階で複数の機能を持つ蛋白質のも染色体の整列、kMT の添付ファイル、および染色体分配の過程で任意の分裂タンパク質の役割を研究するだけでなく役に立つでしょう。
予め温めておいたリーボウィッツ (L-15) で二重チミジン ブロックからの解放後の生きているセルイメージ投射のため細胞を培養する必要があります画像の初めまで 10-20 %fbs 培。細胞は、細胞の種類に応じてチミジン ブロックからの解放後変数時点で有糸分裂を入力します。イメージをキャプチャまたは固定の開始時刻は、細胞の種類に応じて最適化する必要があります。生きているセルイメージ投射のため従来の共焦点顕微鏡の使用率は、長期的なイメージング中に退色あります。その一方で、高分解能共焦点顕微鏡はフォトブリーチング効果の最小範囲を明確かつ高解像度イメージを与えます。
このプロトコルの重要なステップは、チミジン治療期間、チミジン、siRNA トランスフェクションのタイミングおよびイメージングの開始タイミングの適切なウォッシュ アウト。
開示事項
著者は、彼らが競合する財務持分を有してないことを宣言します。
謝辞
MCherry ヒストン H2B と GFP-α-チューブリンを安定発現 HeLa 細胞を共有するため東北大学の田中幸三に感謝しております。この作品は、DV (R00CA178188) に NCI の助成金、ノースウェスタン大学からスタートアップ資金にサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| DMEM (1x) | Life Technologies | 11965-092 | Store at 4 °C |
| DPBS (1x) | Life Technologies | 14190-144 | Store at 4 °C |
| Leibovitz’s (1x) L-15 medium | Life Technologies | 21083-027 | Store at 4 °C |
| Serum reduced medium (Opti-MEM) | Life Technologies | 319-85-070 | Store at 4 °C |
| Penicillin and streptomycin | Life Technologies | 15070-063 (Pen Strep) | 1:1,000 dilution |
| Dharmafect2 | GE Dharmacon | T-2002-02 | Store at 4 °C |
| Thymidine | MP Biomedicals LLC | 103056 | Dissolved in sterile distiled water |
| Cdt1 siRNA | Life Technologies | Ref 10 | |
| Hec1 siRNA | Life Technologies | Ref 13 | |
| HeLa cells expressing GFP-H2B | |||
| HeLa cells expressing GFP-α-tubulin and mCherry H2B | Generous gift from Dr. Kozo Tanaka of Tohoku university, Japan | ||
| Formaldehyde solution | Sigma-Aldrich Corporation | F8775 | Toxic, needs caution |
| DAPI | Sigma-Aldrich Corporation | D9542 | Toxic, needs caution |
| Mouse anti-α-tubulin | Santa Cruz Biotechnology | Sc32293 | 1:1,000 dilution |
| Rabbit ant-Zwint1 | Bethyl | A300-781A | 1:400 dilution |
| Mouse anti-phospho-γH2AX (Ser139) | Upstate Biotechnology | 05-626, clone JBW301 | 1:300 dilution |
| Alexa 488 | Jackson ImmunoResearch | 1:250 dilution | |
| Rodamine Red-X | Jackson ImmunoResearch | 1:250 dilution | |
| BioLite 6 well multidish | Thermo Fisher Scientific | 130184 | |
| 35 mm Glass bottom dish | MatTek Corporation | P35GCOL-1.5-14-C | |
| Nikon Eclipse TiE inverted microscope | Nikon Instruments | ||
| Spinning disc for confocal | Yokagawa | CSU-X1 | |
| Ultra 888 EM-CCD Camera | Andor | iXon Ultra EMCCD | |
| 4 wave length laser | Agilent Technologies | ||
| Incubation System for Microscopes | Tokai Hit | TIZB | |
| NIS-elements software | Nikon Instruments |
参考文献
- Lajtha, L. G., Oliver, R., Berry, R., Noyes, W. D. Mechanism of radiation effect on the process of synthesis of deoxyribonucleic acid. Nature. 182 (4652), 1788-1790 (1958).
- Puck, T. T., Steffen, J. Life Cycle Analysis of Mammalian Cells. I. A Method for Localizing Metabolic Events within the Life Cycle, and Its Application to the Action of Colcemide and Sublethal Doses of X-Irradiation. Biophys. J. 3, 379-392 (1963).
- Santaguida, S., Musacchio, A. The life and miracles of kinetochores. EMBO J. 28 (17), 2511-2531 (2009).
- Musacchio, A., Desai, A. A Molecular View of Kinetochore Assembly and Function. Biology (Basel). 6 (1), E5 (2017).
- Chaudhry, M. A., Chodosh, L. A., McKenna, W. G., Muschel, R. J. Gene expression profiling of HeLa cells in G1 or G2 phases. Oncogene. 21 (12), 1934-1942 (2002).
- Zhou, J. Y., Ma, W. L., Liang, S., Zeng, Y., Shi, R., Yu, H. L., Xiao, W. W., Zheng, W. L. Analysis of microRNA expression profiles during the cell cycle in synchronized HeLa cells. BMB Rep. 42 (9), 593-598 (2009).
- Stumpf, C. R., Moreno, M. V., Olshen, A. B., Taylor, B. S., Ruggero, D. The translational landscape of the mammalian cell cycle. Mol. Cell. 52 (4), 574-582 (2013).
- Chen, X., Simon, E. S., Xiang, Y., Kachman, M., Andrews, P. C., Wang, Y. Quantitative proteomics analysis of cell cycle-regulated Golgi disassembly and reassembly. J. Biol. Chem. 285 (10), 7197-7207 (2010).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nature Protocols. 8 (3), 602-626 (2013).
- Coquelle, A., et al. Enrichment of non-synchronized cells in the G1, S and G2 phases of the cell cycle for the study of apoptosis. Biochem. Pharmacol. 72 (11), 1396-1404 (2006).
- Amon, A. Synchronization procedures. Methods Enzymol. 351, 457-467 (2002).
- Cooper, S. Rethinking synchronization of mammalian cells for cell cycle analysis. Cell Mol. Life Sci. 60 (6), 1099-1106 (2003).
- Whitfield, M. L., Sherlock, G., Saldanha, A. J., Murray, J. I., Ball, C. A., Alexander, K. E., Matese, J. C., Perou, C. M., Hurt, M. M., Brown, P. O., Botstein, D. Identification of genes periodically expressed in the human cell cycle and their expression in tumors. Mol. Biol. Cell. 13 (6), 1977-2000 (2002).
- Vassilev, L. T., et al. Selective small-molecule inhibitor reveals critical mitotic functions of human CDK1. Proc Natl Acad Sci U S A. 103 (28), 10660-10665 (2006).
- Varma, D., Chandrasekaran, S., Sundin, L. J., Reidy, K. T., Wan, X., Chasse, D. A., Nevis, K. R., DeLuca, J. G., Salmon, E. D., Cook, J. G. Recruitment of the human Cdt1 replication licensing protein by the loop domain of Hec1 is required for stable kinetochore-microtubule attachment. Nat. Cell Biol. 14 (6), 593-603 (2012).
- Garcia, M., Westley, B., Rochefort, H. 5-Bromodeoxyuridine specifically inhibits the synthesis of estrogen-induced proteins in MCF7 cells. Eur. J. Biochem. 116 (2), 297-301 (1981).
- Bostock, C. J., Prescott, D. M., Kirkpatrick, J. B. An evaluation of the double thymidine block for synchronizing mammalian cells at the G1-S border. Exp. Cell Res. 68 (1), 163-168 (1971).
- Martin-Lluesma, S., Stucke, V. M., Nigg, E. A. Role of Hec1 in spindle checkpoint signaling and kinetochore recruitment of Mad1/Mad2. Science. 297, 2267-2270 (2002).
- Brouwers, N., Mallol Martinez, N., Vernos, I. Role of Kif15 and its novel mitotic partner KBP in K-fiber dynamics and chromosome alignment. PLoS One. 12 (4), e0174819 (2017).
- Dou, Z., et al. Dynamic localization of Mps1 kinase to kinetochores is essential for accurate spindle microtubule attachment. Proc Natl Acad Sci USA. 112 (33), E4546-E4555 (2015).
- Chan, Y. W., Jeyaprakash, A. A., Nigg, E. A., Santamaria, A. Aurora B controls kinetochore-microtubule attachments by inhibiting Ska complex-KMN network interaction. J Cell Biol. 196 (5), 563-571 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved