Method Article
الجمع بين الخلية الانقسامية المزامنة وعالية الدقة [كنفوكل] الفحص المجهري لدراسة دور البروتينات المتعددة الوظائف دورة الخلية أثناء الانقسام
In This Article
Summary
نقدم بروتوكولا للتزامن thymidine مزدوجة من خلايا هيلا متبوعاً بالتحليل باستخدام دقة عالية [كنفوكل] مجهرية. هذا الأسلوب هو المفتاح للحصول على عدد كبير من الخلايا التي تشرع شكل متزامن من مرحلة ثانية للانقسام، تمكين الدراسات المتعلقة بأدوار الانقسامية من البروتينات المتعددة الوظائف التي تمتلك أيضا مهام الطور البيني.
Abstract
وتقدم الدراسة مختلف الأحداث التنظيمية لدورة الخلية بطريقة تعتمد على مرحلة فهم واضح حول نمو الخلايا وشعبة. تزامن السكان خلية في مراحل معينة من دورة الخلية قد وجد أن تكون مفيدة جداً في مثل هذه المساعي التجريبية. المزامنة للخلايا بالعلاج بالمواد الكيميائية التي نسبيا أقل سمية يمكن أن تكون مفيدة عبر استخدام العقاقير الدوائية المثبطة لدراسة دورة الخلية ما يترتب عليها من أحداث، والحصول على إثراء محددة المراحل الانقسامية المحدد. هنا، يمكننا وصف البروتوكول لمزامنة الخلايا البشرية في مراحل مختلفة من الخلية دورة، بما في ذلك على حد سواء في مرحلة ثانية وم مع كتلة thymidine مزدوجة والإصدار الداخلي لدراسة الأداء الوظيفي للبروتينات الانقسامية في محاذاة كروموسوم والعزل. هذا البروتوكول كانت مفيدة للغاية لدراسة أدوار الانقسامية من البروتينات المتعددة الوظائف التي تملك وظائف ثابتة الطور البيني. في حالتنا، الانقسامية دور Cdt1، بروتين حاسمة بالنسبة للنسخ المتماثل الترخيص الأصلية في المرحلة G1، يمكن دراسة فعالية إلا عندما يمكن أن تنضب Cdt1 G2/M-محددة. ونحن تصف البروتوكول مفصلاً لاستنفاد Cdt1 G2/M-خاصة باستخدام المزامنة thymidine مزدوجة. ونحن أيضا تفسير البروتوكول لتثبيت الخلية، ويعيش تصوير الخلية استخدام الفحص المجهري [كنفوكل] عالية الدقة بعد الإفراج عن thymidine. الأسلوب أيضا مفيدة لتحليل وظيفة البروتينات الانقسامية في ظل الظروف الفسيولوجية والقلق على حد سواء كما هو الحال ل Hec1، مكون من Ndc80 المعقدة، كما أنها تمكن واحد للحصول على أحجام عينات كبيرة من الخلايا الانقسامية للخلايا الثابتة ويعيش تحليل كما نعرض هنا.
Introduction
في دورة الخلية، الخلايا الخضوع لسلسلة من الأحداث عالية التنظيم والتي تسيطر عليها وقتيا لازدواجية دقيقة للجينوم والانتشار. في الثدييات، تتألف من الطور البيني والمرحلة م دورة الخلية. في الطور البيني، الذي يتكون من ثلاث مراحل-G1, S، و G2، الخلية التكرارات الجينوم ويخضع النمو اللازمة لدورة الخلية العادية التقدم1،2. في المرحلة م، الذي يتألف من الانقسام (الطور الأول، بروميتافاسي، الطورية، طور الصعود والطور النهائي) وسيتوكينيسيس، تنتج خلية أبوية خليتين ابنه متطابقة وراثيا. في الانقسام، الأخت شقاً الصبغي للجينوم المكررة مكثف (الطور الأول)، ويتم التقاطها في كينيتوتشوريس واسطة microtubules المغزل التفتلي المجمعة (بروميتافاسي)، أن يدفع اتساقها في لوحة الطورية (الطورية) تليها بهم يساوي التفرقة عند الأخت انقسام تجاه شقاً الصبغي ونقلها إلى محور الدوران المعاكس أعمدة (طور الصعود). يتم فصل الخليتين ابنه جسديا بنشاط على أساس أكتين الهوس عصابة (الطور النهائي و cytokinesis). Kinetochore البنية البروتينية متخصصة التي تجمع في منطقة سينتروميريك من شقاً الصبغي وتكون بمثابة مواقع الحجز المغزل microtubules. وظيفتها الرئيسية هي محرك التقاط كروموسوم، والمحاذاة، والمساعدة في تصحيح مرفق microtubule شوكي غير لائق، بينما الوساطة الحاجز الجمعية المغزل للحفاظ على الإخلاص كروموسوم الفصل3،4.
تقنية التزامن الخلية بمثابة أداة مثالية لفهم الأحداث الجزيئية والهيكلية تشارك في تقدم دورة الخلية. وقد استخدمت هذا النهج إثراء سكان الخلية في مراحل محددة لأنواع مختلفة من التحليلات، بما في ذلك إنشاء تشكيل جانبي للتعبير الجيني، تحليلات للعمليات الكيميائية الحيوية الخلوية، والكشف عن التعريب سوبسيلولار من البروتينات. يمكن استخدام خلايا الثدييات متزامنة لدراسة المنتجات الجينات الفردية، بل أيضا للنهج التي تنطوي على تحليل الجينوم كله بما في ذلك تحليل الجينات التعبير5، ميرنا أنماط التعبير6، ميكرواري تنظيم متعدية الجنسيات7، وتحليل البروتين البروتين التعديلات8. يمكن أيضا استخدام المزامنة دراسة آثار التعبير الجيني أو البروتين تدق لأسفل أو المغلوب، أو المواد الكيميائية على تقدم دورة الخلية.
يمكن مزامنة الخلايا في مراحل مختلفة من دورة الخلية. الوسائل المادية والكيميائية تستخدم على نطاق واسع لتزامن الخلية. أهم المعايير لتزامن الخلية أن التزامن نونسيتوتوكسيك وعكسها. بسبب العواقب الخلوية الضارة المحتملة لمزامنة الخلايا وكلاء الدوائية، أساليب تعتمد على المواد الكيميائية يمكن أن تكون مفيدة لدراسة الأحداث الرئيسية الخلية دورة. على سبيل المثال، هيدروكسيوريا، أمفيديكولين، ميموسيني، ولوفاستاتين، يمكن استخدامها لمزامنة الخلية في المرحلة G1/S ولكن بسبب أثرها على المسارات البيوكيميائية التي تمنع، تفعيل آليات تفتيش دورة الخلية وتقتل هام جزء من ال9،الخلايا10. من ناحية أخرى، يمكن القبض على تثبيط التغذية المرتدة من تكرار الحمض النووي عن طريق إضافة thymidine إلى وسائط النمو، المعروفة باسم "كتلة thymidine"، دورة الخلية في بعض النقاط11،،من1213. يمكن أيضا مزامنة الخلايا في المرحلة G2/M بالتعامل مع نوكودازولي و9،رو-330614. وقد نوكودازولي، مما يمنع الجمعية ميكروتوبولي، سيتوتوكسيسيتي عالية نسبيا. وعلاوة على ذلك، يمكن إرجاع القبض على نوكودازولي الخلايا الطور البيني بريكوسيوسلي بانزلاق الانقسامية. ضعف thymidine كتلة القبض على الخلايا في المرحلة G1/S وبعد الإفراج عنهم من الكتلة، تم العثور على خلايا المضي في شكل متزامن عن طريق G2 وإلى الانقسام. ويمكن ملاحظة التقدم العادي لدورة الخلية للخلايا من كتلة thymidine تحت المجهر [كنفوكل] عالية الدقة قبل تثبيت الخلية أو تصوير حية. يمكن دراسة أثر اضطراب البروتينات الانقسامية على وجه التحديد عند إدخال الخلايا والمضي قدما من خلال الانقسام بعد الإفراج عنهم من كتلة thymidine مزدوجة. تشارك في النسخ المتماثل الترخيص المنشأ في المرحلة G1 الحمض النووي Cdt1، بروتين متعددة الوظائف، وهي أيضا مطلوبة من أجل المرفقات ميكروتوبولي kinetochore أثناء الانقسام15. دراسة وظيفة Cdt1 أثناء الانقسام، يحتاج المرء اعتماد أسلوب أن يتجنب تأثير استنفادها في النسخ المتماثل الترخيص خلال المرحلة G1، بينما في الوقت نفسه أحداث استنفادها على وجه التحديد خلال مرحلة G2/M فقط. نقدم هنا، بروتوكولات مفصلة تستند إلى كتلة thymidine مزدوجة لدراسة دور البروتينات مهام متعددة أثناء المراحل المختلفة لدورة الخلية الانقسامية بالتصوير الثابت وخلية يعيش.
Protocol
1-ضعف كتلة Thymidine والإصدار: الاستعدادات الكاشف
- جعل 500 مل دولبيكو تعديل النسر المتوسطة (دميم) المتوسطة وتستكمل مع 10% FBS والبنسلين والستربتوميسين.
- جعل الأسهم 100 مم من التريتيوم في الماء المعقم ومخزن في مختبرين في-80 درجة مئوية.
2-البروتوكول المتعلق بتصوير ثابت الخلية الانقسامية التدرج (الشكل 1A)
- في اليوم 1، البذور ~ 2 × 105 هيلا الخلايا في آبار لوحة 6-جيدا مع زلة الغطاء (تعقيم مع الإيثانول 70% واشعاع الأشعة فوق البنفسجية) و 2 مل من المتوسطة دميم. تنمو الخلايا في حاضنة هوميديفيد عن 24 ساعة عند 37 درجة مئوية و 5% CO2.
- كتلة thymidineش 1: في اليوم 2، مزيج دقيق حجم المطلوب من التريتيوم في وسائط الإعلام دميم الطازجة (100 ملم الأسهم، 2 مم النهائي تركيز).
- إضافة 2 مل thymidine التي تحتوي على وسائط الإعلام إلى الخلايا في كل بئر 6-البئر لوحة واحتضانها ح 18.
- في يوم 3، نضح المتوسطة وتغسل الخلايا مرتين مع 2 مل من 1 x PBS ومرة مع دميم بريوارميد جديدة؛ تنمو الخلايا في المتوسطة دميم بريوارميد جديدة ح 9 للإفراج عن الخلايا من كتلة.
- 2nd thymidine كتلة: أضف مرة أخرى مل 2 التي تحتوي على thymidine وسائل الإعلام (تركيز نهائي 2 مم) إلى الخلايا في كل من لوحة 6-جيدا جيدا.
- احتضانها لآخر ح 18.
- في يوم 4، نضح المتوسطة وغسل الخلايا مرتين مع 2 مل من 1 x PBS ومرة مع دميم بريوارميد الطازجة.
- سيرناس مخفف (التحكم و Cdt1) وكاشف تعداء في المصل النمو الحر المتوسط بشكل منفصل عن الحد الأدنى 10 مزجها معا واحتضان لمدة 20 دقيقة في الرايت وكان تركيز siRNA المستخدمة في كل تعداء النهائي 100 نانومتر. إضافة خليط رد فعل للخلايا التي قد تم غسلها من أصل Thymidine.
- احتضان خلايا في 37 درجة مئوية ح 9-10 لإطلاق سراح من حظر وإصلاح الخلايا على كشوف الغطاء مع 4% منهاج العمل لمدة 20 دقيقة في الرايت
تنبيه: منهاج العمل السامة، وارتداء الحماية المناسبة. -
خلايا إيمونوستين، بعد بيرميبيليزينج مع المنظفات 0.5% (v/v) لمدة 10 دقائق في الرايت وغسل الخلايا مرتين مع 1 x برنامج تلفزيوني لمدة 5 دقائق.
- كتلة الخلايا مع جيش صرب البوسنة 1% (w/v) في برنامج تلفزيوني x 1 ح 1 في الرايت متبوعاً بعلاج الخلايا مع 50 ميليلتر من الأجسام الأولية (الماوس المضادة-α-tubulin جسم المخفف 1:1، 000 جسم Zwint1 مكافحة الأرانب المخفف 1: 400، والماوس المضادة-والرمات-ɣ H2AX المخفف في رافعة) في 1% (w/v) جيش صرب البوسنة في 1 x برنامج تلفزيوني عن ح 1 في 37 ياجيم
- بعد الغسيل خارج الخلايا مع برنامج تلفزيوني x 1 ثلاث مرات وعلاج الخلايا مع 50 ميليلتر من الأجسام المضادة الثانوية لكل تغطية الزجاج (488 أليكسا والأحمر والرودامين في تخفيف 1: 250 في 1% (w/v) جيش صرب البوسنة في برنامج تلفزيوني x 1) ح 1 في الرايت
- بعد الغسيل الخلايا مع PBS 1 x مرتين لمدة 5 دقائق، يعامل الخلايا مع DAPI (0.1µg/مل في برنامج تلفزيوني 1 x) لمدة 5 دقائق في الرايت
- بعد الغسيل الخلايا مع PBS 1 x مرتين لمدة 5 دقائق، ضع بكشف الغطاء تواجه الخلايا إلى وسائل الإعلام المناسبة المتصاعدة على شريحة مجهرية واضحة.
- صورة الخلايا للبروتينات إيمونوستاينيد مع 60 X أو النفط 1.4 X نا خطة اللازيغيه DIC 100 الغمر الهدف شنت على مجهر [كنفوكل] مقلوب عالية دقة مزودة كاميرا مناسبة اللازمة لنوعية الصور المطلوبة.
- الحصول على صور في درجة حرارة الغرفة كما z-رزمة سمك 0.2 ميكرون باستخدام البرمجيات المناسبة للمجهر.
3-بروتوكول لتصوير خلية حية لتطور الانقسامية (الشكل 3A)
- في يوم 1، البذور حوالي 0.5-1 × 105 خلايا هيلا ستابلي الإعراب عن H2B مشري وبروتينات فلورية خضراء-α-tubulin (متغير قليلاً استناداً إلى نوع من الخلايا والبروتينات وهم يعربون عن) إلى 35 ملم الزجاج أسفل الأطباق مع 1.5 مل متوسطة دميم وتنمو لهم في هوميديفيد حاضنة ح 24 37 سج و شركاه 5%2.
- كتلة thymidineش 1: في اليوم 2، إضافة 1.5 مل thymidine التي تحتوي على وسائط الإعلام إلى الخلايا في الطبق (thymidine 100 مم، وتركيز نهائي 2 مم،).
- احتضانها ح 18.
- في يوم 3، نضح المتوسطة التي تتضمن التريتيوم وتغسل الخلايا ثلاث مرات، مرتين مع 2 مل من برنامج تلفزيوني 1 x ومرة مع دميم بريوارميد الطازجة.
- سيرناس مخفف (التحكم و Hec1) وكاشف تعداء مع المصل النمو الحر المتوسط بشكل منفصل عن الحد الأدنى 10 مزجها معا واحتضان لمدة 20 دقيقة في الرايت وكان تركيز siRNA المستخدمة في كل تعداء النهائي 100 نانومتر. إضافة خليط رد فعل للخلايا التي قد تم غسلها من أصل Thymidine.
- تنمو الخلايا في 1.5 مل من الطازجة المتوسطة دميم بريوارميد ح 8 بالإفراج عن الخلايا من كتلة.
- 2nd thymidine كتلة: إضافة 1.5 مل thymidine التي تحتوي على وسائط الإعلام (تركيز نهائي 2 مم) إلى الخلايا في الطبق.
- احتضانها لآخر ح 18.
- في يوم 4، نضح المتوسطة وتغسل الخلايا ثلاث مرات، مرتين مع 2 مل من برنامج تلفزيوني 1 x ومرة مع دميم بريوارميد الطازجة. ثم تنمو خلايا في يبوفيتش بريوارميد جديدة المتوسطة (L-15) تستكمل مع 10% FBS و 20 مم حبيس في درجة الحموضة 7.0 ح 8 بالإفراج عن خلايا من الكتلة.
- ضع الطبق في قاعة مراقبة درجة الحرارة في المجهر [كنفوكل] عالية الدقة التي قد تحولت بالفعل على الأقل 30 دقيقة قبل البدء التصوير استقرار درجات الحرارة المسرح والتجريبية.
- التركيز في الحقل مشرق مع الهدف 60 x حتى تكون الخلايا مرئية، ثم فرزت يدوياً المسرح في المنطقة لاختيار.
- قم بإعداد الضوء والليزر الطاقة/التعرض، والمعلمات الحصول على صورة، ومدة التجربة باستخدام البرمجيات اكتساب صورة مجهر الاختيار. استخدام عوامل التصفية للتجارة والنقل (488 الإثارة؛ 385 nm الانبعاثات) ومشري (561 نانومتر الإثارة و 385 nm الانبعاثات) الحصول على الصور.
- إجراء التجربة مرور الزمن باكتساب نابض ضوء المنقولة بشكل منفصل والأسفار الصور كل 10 دقائق لمدة تصل إلى 16 ساعة.
- الحصول على الصور حسب الاقتضاء 1.0 اثنا عشر فصل ميكرومتر z-الطائرات في 9 ح بعد الإفراج عنهم من كتلة thymidine مزدوجة باستخدام البرمجيات للمجهر.
- تحليل الصور تتبع الخلايا الفردية للتقدم الانقسامية وأخيراً تجميع الفيلم المقابلة مع برمجيات المصدر فيجي/إيماجيج.
النتائج
دراسة تطور الانقسامية والاستقرار ميكروتوبولي في الخلايا الثابتة بعد الإفراج عنهم من ضعف thymidine كتلة
وتشارك Cdt1 في منح التراخيص لأصول النسخ المتماثل الحمض النووي في المرحلة G1. تتحلل خلال المرحلة S ولكن إعادة يتراكم في المرحلة G2/M. لدراسة دورها في الانقسام، يحتاج Cdt1 الذاتية أن تستنفد على وجه التحديد إلى المرحلة ز/م باستخدام تقنية التزامن الخلية الأكثر ملاءمة، thymidine مزدوجة القطعة15. تم transfected الخلايا مع سيرناس فورا بعد الإفراج عنهم من كتلة thymidine 2nd ، عندما تكون الخلايا في ليالي المرحلة وهو الوقت الذي منح التراخيص لأصول النسخ المتماثل في G1، الذي يتطلب أيضا الدالة Cdt1، منذ وقت طويل وقد اكتمل. تم التحقق من صحة استنزاف Cdt1 بعد ح 9 من تعداء siCdt1 وضعف thymidine كتلة الإصدار بغربي النشاف (الشكل 1B). تثبيت خلايا ح 9 بعد الإفراج عن كتلة thymidine مزدوجة تبين أن معظم الخلايا في مرحلة الطورية في السيطرة و Cdt1 siRNA transfected الخلايا. ولكن يظهر تثبيت الخلايا 10 ح بعد الإفراج عنهم من كتلة thymidine مزدوجة القبض عليه معظم الخلايا المعالجة siRNA Cdt1 في أواخر المرحلة بروميتافاسي ما زالت بينما الخلايا التحكم أدخل طور الصعود وعادة فصل الكروموسومات بهم كالمتوقع (الرقم 1 ). لفهم تأثير استنفاد Cdt1 على الاستقرار كينيتوتشوري-ميكروتوبولي (الحزب الوطني)، تم إصلاح الخلايا في ح 9 بعد الإفراج عنهم من ضعف كتلة thymidine متبوعاً بالعلاج البارد، الذي يحتفظ فقط بمستقر كينيتوتشوري-ميكروتوبوليس (كمتس). كمتس الخلايا Cdt1 المستنفد نسبيا أقل متانة بعد العلاج البارد مقارنة بمراقبة الخلايا (الشكل 1). وهكذا، باستخدام هذا النهج، تطور الخلايا الانقسامية العادية بعد اضطراب وظيفة protein(s) الانقسامية التي تهم يمكن دراستها فعلياً، حتى بدون استخدام التصوير خلية حية.
ويبين الشكل 2 أن الترخيص من أصل النسخ المتماثل الحمض النووي لا قلق عندما تنضب الخلايا من Cdt1 أثناء مرحلة G2/M استخدام لدينا بروتوكول، الذي احتفل به أيضا في خلايا المراقبة. خلايا المستنفد من Cdt1 أثناء مرحلة G2/M الحث على عدم تراكم فوسفوريلاتيد ɣH2AX، علامة لضرر الحمض النووي، خلال مرحلة G2 اللاحقة؛ بينما تعداء siRNA من الثقافات غير متزامن إلى استنزاف Cdt1 التي يسببها تراكم البؤر والرمات-ɣH2AX-إيجابية، ربما بسبب تلف الحمض النووي الناجم عن سوء الحمض النووي النسخ المتماثل الترخيص.
دراسة عن تطور الانقسامية في الخلايا بعد الإفراج عنهم من كتلة thymidine مزدوجة بتصوير الخلية الحية
بعد انهيار المغلف النووية (NEB)، أدخل الانقسام الخلايا الطبيعية (في غياب اضطراب بروتين الانقسامية وظيفية) والخضوع لبداية طور الصعود للخروج من الانقسام داخل حوالي 30-60 دقيقة (الشكل 3B). ولكن ضربة قاضية [رني] بوساطة من Hec1، بروتين kinetochore رئيسية المطلوبة لتشكيل حزب الكومينتانغ قوية مرفق، يتم العثور على تأخير تطور الانقسامية العادي. في هذا السيناريو، معظم الخلايا أدخل الانقسام بعد NEB، لكن عدم الخضوع لبداية طور الصعود أو الخروج من الانقسام حتى بعد عدة ساعات من التأخير في الانقسام (الشكل 3). وبالمثل، أثر ضربة قاضية [رني] بوساطة أي البروتين الأخرى التي يموضع إلى كينيتوتشوريس أو وجود دالة أثناء الانقسام وبالتالي يلاحظ فعالية باستخدام التصوير خلية حية بعد الإفراج عنهم من كتل thymidine مزدوجة. بالإضافة إلى دراسة طبيعة التقدم الانقسامية وتأخير القبض، تشمل بعض الظواهر الانقسامية الرئيسية الأخرى التي يمكن أن تكون جزيئي في استخدام هذا الأسلوب كروموسوم المحاذاة وتكوين المغزل الانقسامية، والتنشيط لتحديد المواقع وتكميم أفواه حاجز الجمعية المغزل.
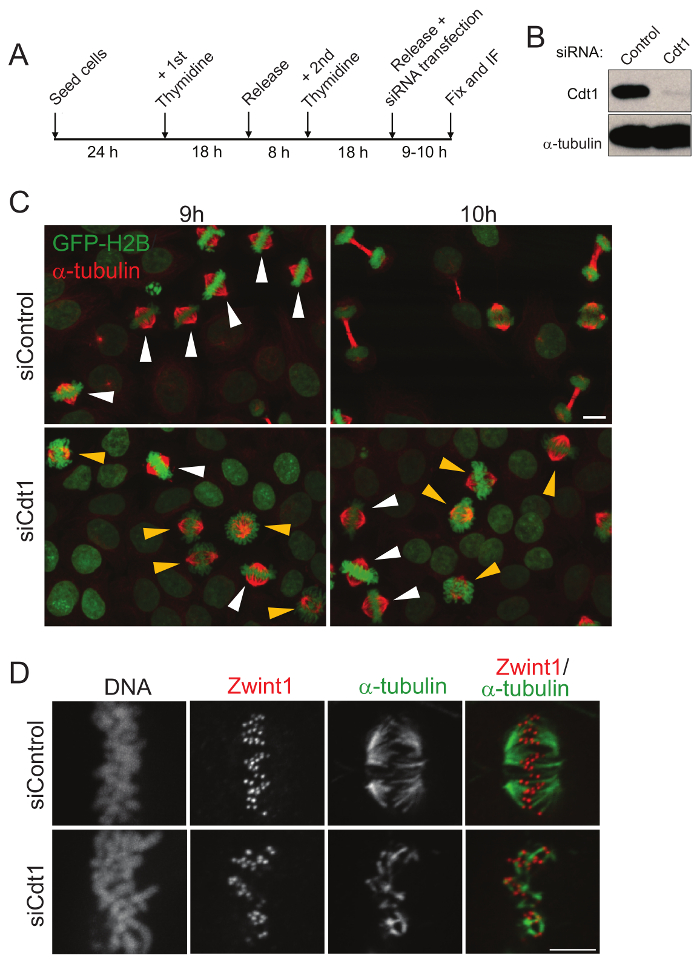
رقم 1: تحليل لتطور الانقسامية واستقرار ميكروتوبوليس kinetochore في الخلايا الثابتة بعد مزدوج thymidine التزامن. (أ) بالتمثيل التخطيطي تزامن الخلية وتثبيت الفلورة. (ب) الغربية وصمة عار لضربة قاضية Cdt1 بعد ح 9 الإفراج عن كتلة thymidine الثانية. (ج) ميكروجرافس الفلورة لإظهار الخلايا الانقسامية الثابتة 9 و 10 ح بعد الإفراج عنهم من كتلة thymidine مزدوجة والمعاملة مع عنصر التحكم (أعلى) أو siRNA Cdt1 (أسفل). Α-tubulin تلطيخ باللون الأحمر، الحمض النووي باللون الأخضر كما أعرب الخلايا H2B هستون بروتينات فلورية خضراء. شريط المقياس = 10 ميكرون. الخلايا بروميتافاسي والطوريه وترد باستخدام اللون الأصفر والأبيض رؤوس الأسهم على التوالي. هيلا (د) الخلايا بعد العلاج مع مراقبة siRNA (اللوحة العلوية) وبعد استنفاد Cdt1 (أسفل اللوحة) ح 9 بعد الإفراج عنهم من ضعف كتلة thymidine متبوعاً بالعلاج مع المثلج ليبوفيتش (L-15) المتوسطة والتثبيت. وكانت الزنزانات الملطخة المناعي المغزل طن متري (الأخضر) وعلامة كينيتوتشوري، Zwint1 (أحمر) و DAPI للحمض النووي بالأسود والأبيض. شريط المقياس = 5 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
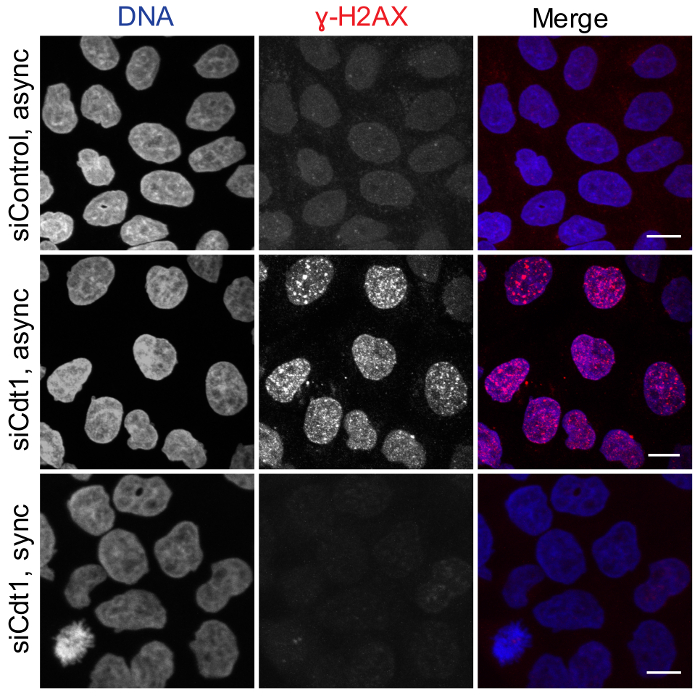
رقم 2: Cdt1-استنفاد أثناء مرحلة G2/M التشويش لا النسخ المتماثل الترخيص. غير متزامن هيلا الخلايا تعامل مع التحكم لوسيفراس (اللوحة العلوية) أو cdt1 سيرناس (الفريق الأوسط) أو thymidine مزدوجة متزامنة هيلا الخلايا تعامل مع cdt1 siRNA أثناء 2nd thymidine يغسل متبوعاً بالتثبيت في 10 ح بعد الإفراج عن (أسفل اللوحة) كانت ملطخة ب DAPI (الزائفة اللون الأخضر) والأجسام المضادة-والرمات-ɣH2AX (أحمر). شريط المقياس = 10 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
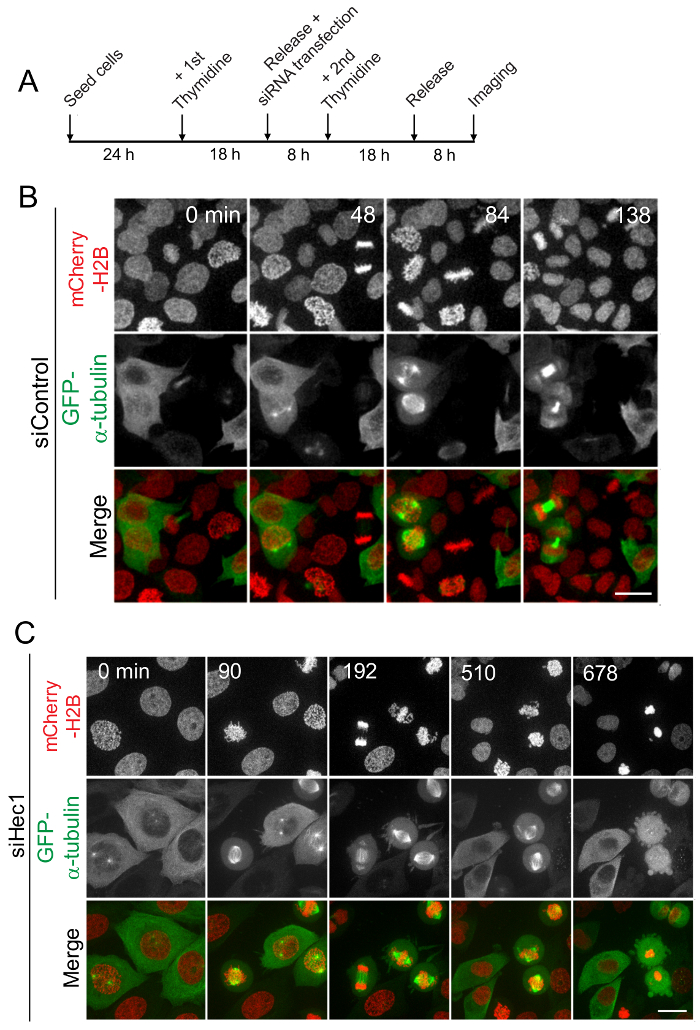
رقم 3: تحليل لتطور الانقسامية بخلية يعيش التصوير في مزامنة الخلايا. (أ) بالتمثيل التخطيطي تزامن الخلية وتصوير الخلايا الحية. خلايا هيلا ستابلي معربا عن H2B مشري--هيستون وبروتينات فلورية خضراء-α-tubulin أفرج عنهم من كتلة thymidine مزدوجة ح 8 للسماح لهم بالمضي قدما إلى مرحلة G2/M من الإقامة الجبرية في مرحلة ثانية. تصوير الحية أجريت باستخدام مجهر [كنفوكل] عالية دقة ابتداء من 8 ح بعد الإفراج عن الخلايا من كتلة thymidine واستمرار ليصل إلى 16 ساعة من تلك النقطة. يظهر هنا هي الصور الثابتة من الفيديو القبض على كل 10 دقيقة لمراقبة الخلايا دون اضطراب لأي بروتين الانقسامية (ب) أو للخلايا المنضب فرعية Hec1 من Ndc80 معقدة (ج). أشرطة مقياس = 10 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
الأكثر أهمية وميزة التزامن thymidine مزدوج أنه يوفر عينة زيادة حجم الخلايا الانقسامية في إطار زمني قصير مع العديد من هذه الخلايا تدخل الانقسام في انسجام، مما يمكن أيضا تحليلات لمحاذاة كروموسوم، ثنائي القطب مغزل تشكيل، والعزل الصبغي بكفاءة أعلى كثيرا.
العديد من مجمعات البروتين التنظيمي ومسارات الإشارات مكرسة لضمان تطور طبيعي عن طريق الانقسام وإلغاء الضوابط التنظيمية لهذه العملية قد أدت إلى توموريجينيسيس. ويعيش تصوير خلية من خلايا هيلا ستابلي الإعراب عن H2B مشري والتجارة والنقل-tubulin وأفرج عنه من كتلة thymidine مزدوجة تبين أن معظم الخلايا التحكم عزل الكروموسومات في طور الصعود ضمن حوالي 60 دقيقة بعد NEB (الشكل 3B). من ناحية أخرى، يعيش تصوير خلية من خلايا هيلا القلق مع Hec1 الدالة يظهر أن معظم الخلايا البقاء في مرحلة الانقسامية لفترة طويلة مع الكروموسومات المنحرفة التي تليها في بداية طور الصعود أو المبرمج (الشكل 3).
Thymidine الزائد يحول دون تركيب الدنا مرحلة ثانية، وبالتالي منع الخلايا في المرحلة G1/S11. على الرغم من أن مزامنة كتلة thymidine مزدوج الأسلوب الأكثر استخداماً في دراسة دورة الخلية وتطور الانقسامية، يحتاج المرء أن يكون انتقاداً لبعض أوجه القصور في هذا الأسلوب. الأهم من ذلك، فإنه يحتاج إلى ضمان أن المادة الكيميائية تم غسلها دقة (على ح 7-8) حيث أن التأثير عكسها تماما ويمكن أن تشرع الخلايا عادة من خلال ما تبقى دورة الخلية. إلا أن الخلايا قد لا أدخل دورة الثانية تسبب التقدم غير مناسب على الرغم من الانقسام. قد لا تكون نسبة الخلايا متزامنة عالية بما فيه الكفاية مع كتلة thymidine واحدة وكتلة thymidine مزدوجة قد يكون من الضروري زيادة عدد الخلايا متزامنة، لا سيما إذا كان أحد مهتم بدراسة مرحلة محددة من الانقسام. يجب أن يكون الأمثل مدة العلاج thymidine نظراً لحساسية مختلفة بين أنواع الخلايا تبعاً للوقت الجيل. على سبيل المثال، خلايا الهامستر ح 16 من الوقت جيل وتعامل مع التريتيوم ح 11 للتزامن الأمثل17. في هذه الدراسة، ونحن يعامل خلايا هيلا ح 16-18 مع thymidine. وعلاوة على ذلك، thymidine الزائدة ليس فقط يمنع تركيب الدنا ولكن أيضا قد قتل الكسور هامة من ال12،11،الخلايا18 وإغلاق ينبغي العناية بدفعها إلى رصد هذه الخسارة. الحل thymidine الأوراق المالية المستخدمة في هذه الدراسة ينبغي أن يعد في الماء المقطر المعقم وينبغي أن تكون مختلطة تماما في وسائل الإعلام ثقافة الخلية لتجنب بهطول الأمطار بعد إضافته إلى وسائل الإعلام siRNA transfected الخلايا، ولضمان لها متجانسة التوزيع حول الخلايا المستزرعة.
لدراسة وظيفة البروتين الانقسامية المستهدفة خلال تطور الانقسامية، من الناحية المثالية سيكون الخلايا تعامل مع siRNA لضربة قاضية من مستويات بروتين الفائدة أثناء كتلة thymidine 1st أو أثناء إطلاق سراح من ش1 كتلة التريتيوم، اعتماداً على الوقت اللازم للحصول على كفاءة البروتين ضربة قاضية19،،من2021. من ناحية أخرى، لدراسة دور البروتينات متعددة الوظائف مثل Cdt1 أثناء الانقسام، من الضروري لعلاج الخلايا مع siCdt1 أثناء إطلاق سراح من كتلة thymidine 2nd الحصول على استنفاد محددة G2/M. Cdt1 لاعب حاسم في إصدار التراخيص للحمض النووي النسخ المتماثل أصول15. لفهم دورها المتخصصة أثناء الانقسام دون التدخل بدورها في إصدار التراخيص، يحتاج Cdt1 أن تستنفد على وجه التحديد في مرحلة G2/M، والتي يمكن أن تتحقق كفاءة بضعف thymidine التزامن، وبالتالي تجنب الحاجة إلى اللجوء إلى أخرى النهج اضطراب حدة الانقسام التي من الصعب تنفيذها. استنفاد Cdt1 في الثقافات غير متزامن حمل الحمض النووي الضرر استجابة بسبب توقف إصدار التراخيص لأصول النسخ المتماثل الحمض النووي، الذي بدوره سوف يكون مشوش تحليل وظيفة ممكنة لهذا البروتين أثناء الانقسام. وهكذا، يوفر تقنية التزامن thymidine مزدوجة نهج تجريبي فريد لتوليد الخلايا التي شهدت مرحلة G1 و S عادي ولكنها تفتقر إلى الدالة Cdt1 خلال المرحلة G2 وم. تكمن أهمية خاصة لدينا بروتوكول المزامنة في تثبيط البروتينات المتعددة الوظائف في مرحلة معينة (G2/M) لدراسة مهامهم رواية أثناء الانقسام. وهكذا، سيكون هذا الأسلوب مفيداً ليس فقط لدراسة دور البروتينات التي لها وظائف متعددة وخلال مراحل مختلفة من دورة الخلية ولكن أيضا لأن أي بروتين الانقسامية عملية المحاذاة كروموسوم والمرفقات حزب الكومينتانغ، والعزل الصبغي.
لتصوير الخلايا الحية، بعد الإفراج عنهم من كتلة thymidine مزدوجة، ينبغي المحتضنة الخلايا بحرارة قبل ليبوفيتش (L-15) المتوسطة وتستكمل مع 10-20% FBS حتى بداية التصوير. أدخل الخلايا الانقسام في نقاط زمنية متغيرة بعد الإفراج عنهم من كتلة thymidine تبعاً لنوع الخلية. وقت بدء التقاط الصور أو التثبيت يحتاج إلى أن يكون الأمثل اعتماداً على نوع الخلية. لتصوير الخلايا الحية، قد يتسبب استخدام الفحص المجهري [كنفوكل] التقليدية فوتوبليتشينج أثناء التصوير الطويلة الأجل. من ناحية أخرى، ميكروكوبي [كنفوكل] عالية الدقة يعطي صورة واضحة وعالية الدقة مع أدنى حد من آثار فوتوبليتشينج.
الخطوات الحاسمة في هذا البروتوكول هي مدة العلاج التريتيوم، وتبييض السليم التريتيوم وتوقيت تعداء siRNA وتوقيت بدء التصوير.
Disclosures
الكتاب يعلن أن لديهم أي مصلحة مالية المتنافسة.
Acknowledgements
ونحن ممتنون للدكتور كوزو تاناكا من جامعة توهوكو باليابان لتقاسم خلايا هيلا ستابلي الإعراب عن H2B مشري--هيستون وبروتينات فلورية خضراء-α-توبولين. وأيد هذا العمل بمنحه لجنة التحقيق الوطنية إلى العنف المنزلي (R00CA178188) ومن أموال بدء التشغيل من جامعة نورث وسترن.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM (1x) | Life Technologies | 11965-092 | Store at 4 °C |
| DPBS (1x) | Life Technologies | 14190-144 | Store at 4 °C |
| Leibovitz’s (1x) L-15 medium | Life Technologies | 21083-027 | Store at 4 °C |
| Serum reduced medium (Opti-MEM) | Life Technologies | 319-85-070 | Store at 4 °C |
| Penicillin and streptomycin | Life Technologies | 15070-063 (Pen Strep) | 1:1,000 dilution |
| Dharmafect2 | GE Dharmacon | T-2002-02 | Store at 4 °C |
| Thymidine | MP Biomedicals LLC | 103056 | Dissolved in sterile distiled water |
| Cdt1 siRNA | Life Technologies | Ref 10 | |
| Hec1 siRNA | Life Technologies | Ref 13 | |
| HeLa cells expressing GFP-H2B | |||
| HeLa cells expressing GFP-α-tubulin and mCherry H2B | Generous gift from Dr. Kozo Tanaka of Tohoku university, Japan | ||
| Formaldehyde solution | Sigma-Aldrich Corporation | F8775 | Toxic, needs caution |
| DAPI | Sigma-Aldrich Corporation | D9542 | Toxic, needs caution |
| Mouse anti-α-tubulin | Santa Cruz Biotechnology | Sc32293 | 1:1,000 dilution |
| Rabbit ant-Zwint1 | Bethyl | A300-781A | 1:400 dilution |
| Mouse anti-phospho-γH2AX (Ser139) | Upstate Biotechnology | 05-626, clone JBW301 | 1:300 dilution |
| Alexa 488 | Jackson ImmunoResearch | 1:250 dilution | |
| Rodamine Red-X | Jackson ImmunoResearch | 1:250 dilution | |
| BioLite 6 well multidish | Thermo Fisher Scientific | 130184 | |
| 35 mm Glass bottom dish | MatTek Corporation | P35GCOL-1.5-14-C | |
| Nikon Eclipse TiE inverted microscope | Nikon Instruments | ||
| Spinning disc for confocal | Yokagawa | CSU-X1 | |
| Ultra 888 EM-CCD Camera | Andor | iXon Ultra EMCCD | |
| 4 wave length laser | Agilent Technologies | ||
| Incubation System for Microscopes | Tokai Hit | TIZB | |
| NIS-elements software | Nikon Instruments |
References
- Lajtha, L. G., Oliver, R., Berry, R., Noyes, W. D. Mechanism of radiation effect on the process of synthesis of deoxyribonucleic acid. Nature. 182 (4652), 1788-1790 (1958).
- Puck, T. T., Steffen, J. Life Cycle Analysis of Mammalian Cells. I. A Method for Localizing Metabolic Events within the Life Cycle, and Its Application to the Action of Colcemide and Sublethal Doses of X-Irradiation. Biophys. J. 3, 379-392 (1963).
- Santaguida, S., Musacchio, A. The life and miracles of kinetochores. EMBO J. 28 (17), 2511-2531 (2009).
- Musacchio, A., Desai, A. A Molecular View of Kinetochore Assembly and Function. Biology (Basel). 6 (1), E5 (2017).
- Chaudhry, M. A., Chodosh, L. A., McKenna, W. G., Muschel, R. J. Gene expression profiling of HeLa cells in G1 or G2 phases. Oncogene. 21 (12), 1934-1942 (2002).
- Zhou, J. Y., Ma, W. L., Liang, S., Zeng, Y., Shi, R., Yu, H. L., Xiao, W. W., Zheng, W. L. Analysis of microRNA expression profiles during the cell cycle in synchronized HeLa cells. BMB Rep. 42 (9), 593-598 (2009).
- Stumpf, C. R., Moreno, M. V., Olshen, A. B., Taylor, B. S., Ruggero, D. The translational landscape of the mammalian cell cycle. Mol. Cell. 52 (4), 574-582 (2013).
- Chen, X., Simon, E. S., Xiang, Y., Kachman, M., Andrews, P. C., Wang, Y. Quantitative proteomics analysis of cell cycle-regulated Golgi disassembly and reassembly. J. Biol. Chem. 285 (10), 7197-7207 (2010).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nature Protocols. 8 (3), 602-626 (2013).
- Coquelle, A., et al. Enrichment of non-synchronized cells in the G1, S and G2 phases of the cell cycle for the study of apoptosis. Biochem. Pharmacol. 72 (11), 1396-1404 (2006).
- Amon, A. Synchronization procedures. Methods Enzymol. 351, 457-467 (2002).
- Cooper, S. Rethinking synchronization of mammalian cells for cell cycle analysis. Cell Mol. Life Sci. 60 (6), 1099-1106 (2003).
- Whitfield, M. L., Sherlock, G., Saldanha, A. J., Murray, J. I., Ball, C. A., Alexander, K. E., Matese, J. C., Perou, C. M., Hurt, M. M., Brown, P. O., Botstein, D. Identification of genes periodically expressed in the human cell cycle and their expression in tumors. Mol. Biol. Cell. 13 (6), 1977-2000 (2002).
- Vassilev, L. T., et al. Selective small-molecule inhibitor reveals critical mitotic functions of human CDK1. Proc Natl Acad Sci U S A. 103 (28), 10660-10665 (2006).
- Varma, D., Chandrasekaran, S., Sundin, L. J., Reidy, K. T., Wan, X., Chasse, D. A., Nevis, K. R., DeLuca, J. G., Salmon, E. D., Cook, J. G. Recruitment of the human Cdt1 replication licensing protein by the loop domain of Hec1 is required for stable kinetochore-microtubule attachment. Nat. Cell Biol. 14 (6), 593-603 (2012).
- Garcia, M., Westley, B., Rochefort, H. 5-Bromodeoxyuridine specifically inhibits the synthesis of estrogen-induced proteins in MCF7 cells. Eur. J. Biochem. 116 (2), 297-301 (1981).
- Bostock, C. J., Prescott, D. M., Kirkpatrick, J. B. An evaluation of the double thymidine block for synchronizing mammalian cells at the G1-S border. Exp. Cell Res. 68 (1), 163-168 (1971).
- Martin-Lluesma, S., Stucke, V. M., Nigg, E. A. Role of Hec1 in spindle checkpoint signaling and kinetochore recruitment of Mad1/Mad2. Science. 297, 2267-2270 (2002).
- Brouwers, N., Mallol Martinez, N., Vernos, I. Role of Kif15 and its novel mitotic partner KBP in K-fiber dynamics and chromosome alignment. PLoS One. 12 (4), e0174819 (2017).
- Dou, Z., et al. Dynamic localization of Mps1 kinase to kinetochores is essential for accurate spindle microtubule attachment. Proc Natl Acad Sci USA. 112 (33), E4546-E4555 (2015).
- Chan, Y. W., Jeyaprakash, A. A., Nigg, E. A., Santamaria, A. Aurora B controls kinetochore-microtubule attachments by inhibiting Ska complex-KMN network interaction. J Cell Biol. 196 (5), 563-571 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved