Method Article
単球のホーミングと末梢動脈疾患のマウスモデルにおける腫瘍関連血管新生の生体顕微鏡
要約
単球は、末梢動脈疾患のコンテキストでの arteriogenesis の重要な伝達物質です。単球のホーミングと腫瘍関連血管新生は、大腿動脈結紮マウスモデルにおける単球注入後基底膜のような行列と生体顕微鏡を使用して、このプロトコルを調査します。
要約
末梢動脈疾患と虚血性心疾患の治療の目的は、血行動態の狭窄による虚血性の領域への血流を増やすことです。血管手術は、痛み、重症虚血肢、または生活に大きな混乱を休むか、または作業の進行など手術の適応のない患者が選択した場合は、実行可能な選択肢は、彼らの病気を軽減するためのほとんどの可能性がありません。担保の形成の刺激による単球が強化された血流を介して細胞療法は、非侵襲的ないくつかのオプションの 1 つです。
当社グループは、後肢の虚血モデルを用いたマウスに単球移植後 arteriogenesis を調べます。以前は、破傷風刺激同系単球移植を使用して後肢灌流の改善を説明してきました。担保の形成に及ぼす影響、に加えて腫瘍の成長はこの療法にも影響が。これらの効果を調べるためには、大腿動脈の閉塞後マウスの側面に Engelbreth ・ ホルム群れ肉腫の細胞外マトリックスを注入することにより基底膜のようなマトリクス マウス モデルを使用します。
後人工腫瘍学、生体顕微鏡を使用して、生体内で腫瘍の血管新生と担保動脈内ホーミング球を検討します。以前の研究では、事後の成果物をその後の分析を前提とする動物モデルの組織学的検討を説明しています。我々 のアプローチ リアルタイム シーケンスで担保の領域に単球のホーミングを可視化する、実行するために簡単ですし、arteriogenesis と腫瘍血管新生の生体内のプロセスを調査。
概要
冠動脈疾患や末梢動脈疾患などの心血管疾患で死亡の最も一般的な原因は、グローバル1。細胞治療は、外科的介入を受けることができない人に特に心血管疾患の治療に有望なアプローチです。治療ツール2,3、灌流を改善し、虚血性と underperfused 組織の機能を維持する全体的な目標として細胞やその分泌物質を使用するいくつかのアプローチがあります。この目標を達成するために 1 つの試みは、担保動脈の開発を高める arteriogenesis を改善することです。単球は、担保に関連付けられている重要な細胞タイプです。当社グループは、特に虚血およびそれに続く炎症6を誘発する後肢虚血モデルを用いた単球の炎症4、5、地区の影響を研究に集中しています。単球の炎症の故郷であり、担保7の開発につながる複雑な全身反応を起こします。
生体顕微鏡を使って、我々 は、これらの細胞の生体内での挙動を調べるし、炎症の領域に注入された単球のホーミングを観察できます。ほとんどの元の研究では、事後解析、組織学的成果物および準備のために必要な動物の多数の導入を含む不利な点を保持するのみについて説明します。私たちのアプローチで免疫学プロセスを調べることができます、複数の時点で担保の形成を介してライブ イメージング。
担保動脈虚血領域での開発に加え単球も腫瘍の成長に影響します。これらのプロセスを調べるためには、Engelbreth ・ ホルム群マウス肉腫、腫瘍細胞外マトリックス蛋白質8で豊富なから抽出した基底膜のようなマトリクスを注入し、生体顕微鏡による分析します。この行列は内皮細胞ネットワーク形成や血管新生の抑制を介して抗腫瘍療法のスクリーン テストの分子に使用します。この場合、私たちは単球細胞療法9,10,11のための潜在的な腫瘍血管新生を評価します。
このプロトコルの目的は、生体内でモデルの虚血によって引き起こされる免疫学プロセスを勉強する簡単で効率的な方法を示すことです。事後筋肉組織の組織学的精密検査と比較して、現実的なテスト環境を生成します。
プロトコル
ドイツ動物保護法の第 8 章によるとザクセン = アンハルト州 Landesverwaltungsamt ハレの状態の許可を得て本研究を行った。(8、18.05.2016 - BGBI から動物保護のためのドイツの法律の項を参照。1206 を s. 13.08.2013 からの § 31 TierSchVersV 1313).
注: ここで実験のため 12 週古い男性 balb/c マウスに 8 が使用されたと献血者からひと単球使用した生体顕微鏡による単球の可視化
。1 ですセル準備
注: 単球の分離、参照してください私たちの以前公開されたビデオ ゼウスについて: " 分離と静脈内注射のマウス骨髄由来。単球 " ワグナー ら によって 4
注: とき汚染を避けるために滅菌する必要があります、セルのすべての手順を操作します
。- 細胞染色 3, 3 '-Dioctadecyloxacarbocyanine 過塩素酸
- 1 x 10 6 セル/mL の濃度と血清フリー培地の細胞を再懸濁します
。 注: のみ血清の自由な媒体により、効率的な染色、脂溶性色素に既に血清の脂溶性成分によってキャプチャされるそれ以外の場合からです 。
- 1 mM 3, 3 の追加の 5 μ L '-細胞懸濁液 1 mL にジメチルホルムアミド中 Dioctadecyloxacarbocyanine 過塩素酸と慎重に再懸濁します 。
- 加温 20 分の 37 ° C で携帯ソリューション
- 37 ° C で 500 x g で 5 分間細胞を遠心分離
- 上清を除去し、37 ° C 暖かい胎仔血清添加培地で細胞を再懸濁します 。
- 1.1.4 と 1.1.5 の手順を 2 回繰り返します 。
- は、数式でセルをカウント:

- 150 μ L 滅菌 0.9 %nacl 水溶液の細胞を再懸濁します 。
- 尾静脈にセルを挿入します 。
- 1 x 10 6 セル/mL の濃度と血清フリー培地の細胞を再懸濁します
2。麻酔
- 吸入麻酔
- 化学物質安全フードの下で閉鎖した箱に 5% の濃度を使用して気化器の助けを借りて、イソフルラン気化します 。
- マウスを慎重に扱う、ビンに入れて 。
- それは移動が停止した後、後頚部の皮膚で動物を処理します 。
- 腹腔内麻酔
注: 使用イソフルラン麻酔、手順 2.1、腹腔内投与を行う。高速リカバリとイソフルラン麻酔の麻酔効果を短時間作用、マウスを処理し、腹腔内麻酔を注入する簡単です。- 腹腔内投与の 2.4 mL ケタミン (10%)、0.8 mL (2%)、キシラジンと 6.8 mL 塩化ナトリウム (0.9%) のソリューションを使用します 。
- 麻酔薬を適用する前に動物の重量を量ます
。 注: 数式が麻酔薬です:

- 1 mL インスリン注射器 30 G の針を使用して、左の下腹部に薬液を注入します 。
- はその檻の中にマウスを置くし、麻薬効果を待つ
。 注: 注入が成功した場合、麻酔の効果は通常表示 5 分以内。通常、制御呼吸率と同様、蓋反射またはつま先ピンチへの反作用の不在によって麻酔の正しい深さを決定ことができます 。
3。基底膜のようなマトリックスの注入
注: 単球注入後腫瘍の血管新生の研究に私たちのグループによってこのメソッドを使用します。実験によって成長因子は基底膜のようなマトリックスに追加できます。マウスの側面に腫瘍を注入する前に大腿動脈の結紮を行った。マトリックスは、注入のための 4 ° C の温度が必要です。この温度で行列が液ゲルが体温 (37 ° C) で固体に固まります。皮下行列の優れた視認性プラグ、注射部位にマウスの皮膚を削る
。注: オプション: 追加 100 ng 塩基性繊維芽細胞成長因子、300 ng 血管内皮増殖因子、および基底膜のようなマトリックスを無菌条件下で 26 i. u. ヘパリン
。- 使用まで 30 G インスリン注射器と氷のストアに行列の 1 つの mL を読み込む 。
- 動物をテーブルに置き、側面に注射部位の横にマウスの皮膚を保持します 。
- が基底膜のようなマトリックスの 500 μ L を皮下注入します
。 注: 実用的な理由から必要だコンパクト皮下の分散を避けるために 1 つの場所で基底膜のようなマトリックスを挿入します。実験の終わりにマウスを犠牲にした後、組織から人工の腫瘍を取り除くために容易になります 。
4。尾静脈注射
注: 実験前に実験動物の NaCl 水溶液で尾静脈注射の練習します。単球は、尾静脈に十分に注入できない場合、は、全身に及ぼす影響は担保されません。このプロトコルでは、250 万球を注入されます。体重の以上 5 μ L/g を注入しよう
。- [ステップ 1.1.8 250 万単球を含む準備単球ソリューションを使用します 。
- 注射用 30 G 針、1 mL インスリン注射を使用します 。
- 慎重にマウスを処理、落で動物を抑制、マウスで害がない、呼吸に十分なスペースを確認してください 。
- 尾プレートに接触することができます加熱パッドで、落を配置します 。
- 尾の側面にある尾静脈を識別します 。
- 尾静脈が尾の上側に表示されますので尾 90 ° を有効にします 。
- 単球を注射する前に注入側でウイルス駆除します 。 間違いなく直面している針の傾斜面と平らな角度の単球溶液を注入しようとする
これは失敗した注入の兆候として注意: は水疱がある場合注入を停止します。上記の手順をもう一度より近位 。
- 約 60 尾に穏やかな圧力を適用することによって、注射部位の出血を停止します 。
- 全身性副作用を監視し、そのケージにマウスを置くと動物は完全に回復した後に 30 分のための動物を観察します 。
5。生体顕微鏡
- 準備
- 粘着テープで一定の温度を維持し、場所に足を修正加熱パッド (37 ° C) の麻酔下のマウスを配置します 。
- 脚や顕微鏡に使用される側面のサイトで皮膚を消毒します 。
- 髪との干渉を避けるためより良いハンドリングのための関心領域を剃る 。
- 滅菌メスと 0.5 × 0.5 cm の正方形の領域の微細鉗子で皮膚を切除します
。 注意: 湿った; 関心領域を保つことが重要です。それ以外の場合、画像や組織の品質が低下します。食塩は地域を湿らせて使用できます 。
- 2 つの調節可能なスタンプの間の脚を置き、スタンプの上にカバーガラスを配置します 。
- 組織が濡れているとガラスとの接触が確保します 。
- Inject 50 μ L ローダミン デキストラン球より良い可視性のための血管の静脈系にします 。
- 顕微鏡を起動し、必要な場合は、脚の位置を調整します 。
- 生体顕微鏡を設定
- 顕微鏡、コンピューター、電子インターフェイス、およびレーザーをオンにします 。
- 培養室の暖房ユニットをオンにおよび/または加熱ステージ (プレート/パッド) と温度を 37 に設定 ° C
- は、集録ソフトウェアを起動します。顕微鏡には共振型スキャナーが装備されている場合はこの高速スキャン モードを選択します 。
- 待機温度に達する一定レベル (35-37 ° C) まで
注: 安定した温度は重要である: (a) マウスを麻酔下で体の温度を (b) 回避するか、少なくとも最小限に抑える焦点ドリフトを制御できません。これは周囲の条件 (例えば、空調システム、人々 を含む部屋の熱源の数) によって、数時間に 1 h を取ることができます。浸漬の目的を使用している場合、レンズとカバーガラス (または組織) 間の接触領域は不安定性の代表的なソースです。レンズを客観的ヒーターで加熱してください。また、オート フォーカス システムと顕微鏡を強く推奨します 。
- 実験の解像度の要件を満たす高数字絞り値との倍率のレンズを選択 (このセクションの末尾にあるメモを参照してください).
- 利得、チャネル設定、スキャン速度、ピクセルの解像度、奥行きのボリューム、ステップ サイズ、およびステージで実験動物を配置する前に平均に関して顕微鏡設定を最適化します 。
- 取得時間を短縮する双方向をスキャンします 。
- 顕微鏡が安定した状態に達しているし、ダミーの助けを借りて、設定をテストされている後 prewarmed 顕微鏡ステージ上麻酔下マウスを配置します 。
- 明るい照明を使用してフォーカスに基底膜のようなマトリックス内の関心領域をもたらすと紫外線応用 fluorophores の十分なフィルター設定を簡単に毛細血管を調べる 。
- スキャン モードに切り替える 256 x 256 低解像度モードでスキャンを開始、ゲインを高めるし、レーザー出力信号はモニターに観察されるまで 。 興味の構造に焦点を
- 。すべての詳細が表示されるまで拡大します 。
- 定義 " 開始 " と " エンド " 軸方向位置 。
- スキャンを停止します 。
- ステップ サイズ (例えば、0.5 μ m) と焦点面 (例えば 10-20) の数を定義します 。 最高の動きに合った移動細胞内構造や細胞選択スキャンの速度に応じて最終的なピクセル解像度 (512 x 512 または 1,024 × 1,024)
- スイッチ速度 (スキャン周波数)スタックの取得を固定する双方向のスキャンをお勧めします
。 注: は、十分な画像品質を与えるスキャンの最高のスキャン レートを選択します。典型的なスキャナーは、400 Hz と 1.4 kHz の間の速度を提供します。共鳴スキャナーは、追加の 8 kHz または 12 kHz を提供します。Y 方向の行数を減らして、スキャン レートをさらに増やすことができます (一般的な値は、512 x 512, 512 x 256 または 512 x 200 ピクセルの解像度)。信号対雑音比によって 1 つは 2 と 4 の間の平均線を追加することで画像の品質を改善するために試すことができます。通常、8 KHz 共振型スキャナーの場合; 使用双方向モードで 18 ms の取得時間/フレームの平均結果なしで 512 x 200 の設定512 x 200 と平均 x 4、それはフレームあたり 56 ms まで遅くなります 。
結果
生体顕微鏡を用いた腫瘍と単球によって引き起こされる血管成長の検討は、arteriogenesis と腫瘍血管新生の分子機構の新局面を明らかに助けることができます。セルは準備する必要があります、プロトコルの手順を慎重に使用を注入します。違いは単一の実験の間のバリエーションにつながります。単球は、静脈システム (図 1) 全身の効果を維持し、塞栓、動脈系の注入を行った場合に発生する可能性を避けるために注入する必要があります。
基底膜のようなマトリクスを使用する場合は、さらに組織学的検査のためプラグ植に役立つ分散を避けるためにゆっくりと注入 (図 2、 図 3)。マウスを犠牲にすることの後のような基底膜マトリックスのプラグはマウスの側面から仔が。基底膜のようなマトリックスのプラグ内でさまざまな実験設定 (図 4図 5) 内の毛細血管をカウントすることによって血管新生を測定できます。
成功した実験を別の条件は、ソフトウェア、ハードウェア、および動物の準備 (図 6) に依存する顕微鏡設定です。場合細胞レベル下の構造 (< 2 μ m) を識別する必要がある、2 光子励起と水浸漬の目的 (20 X 25 X、数字絞り値 1.0) 長作動距離を持つ正立型顕微鏡 (> 2 mm) にお勧め。高数字絞り水浸漬の目的は屈折率変動に非常に敏感なので最適な画像解像度と明るさが目的で補正カラーを移動することによって調整する必要があります。残念ながら、手で調整は限られたスペースのためにかなり困難です。したがって、高価なモーターを備えられた首輪補正目的顕微鏡メーカー提供しています。
携帯電話の解像度 (5-10 μ m) で十分な場合 10 倍乾燥 0.4 以上数字開口部を持つレンズと長い作動距離 (> 2 mm) をお勧め。この場合、直立または倒立顕微鏡スタンドを選択できます。ライヴ ・ アット ・ ズーム倍率の高い乾燥したレンズ (数字絞り 0.4) X 10 の細胞イメージング (> 3) 古典の共焦点レーザ走査型顕微鏡 (すなわち、1 光子励起) を使用して、画像のスタックが十分なを取得できますので容易より安いは解像度。多くの時間が必要な画像の獲得のため容器内ローダミン デキストランの量が減少します。血管の可視性を向上、蛍光体の注入をする必要があります (図 7) を繰り返します。
さまざまな調整をサンプリングし、可能な限り最高の画像品質を決定する最も効果的です。細胞や基底膜のようなマトリックス (移植) することがなく肯定的なプローブの使用が最適な設定を取得できます。(図 8図 9) の血流や筋肉組織内の生体顕微鏡によるラベル付けされた単球を検出する可能性があります.組織切片の組織学的検討では、我々 の調査結果 (図 10) を確認します。

図 1: 250 万球の尾静脈注入。静脈は動脈は背側と腹側の尾の横側にあります。この図の拡大版を表示するのにはここをクリックしてください。
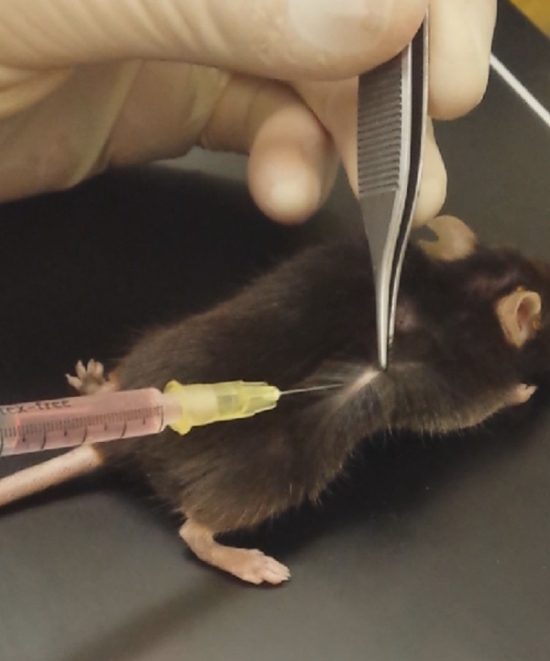
図 2: 基底膜のようなマトリックスの噴射。マウスの皮膚を処理し、麓の基底膜のようなマトリックスを挿入します。この図の拡大版を表示するのにはここをクリックしてください。
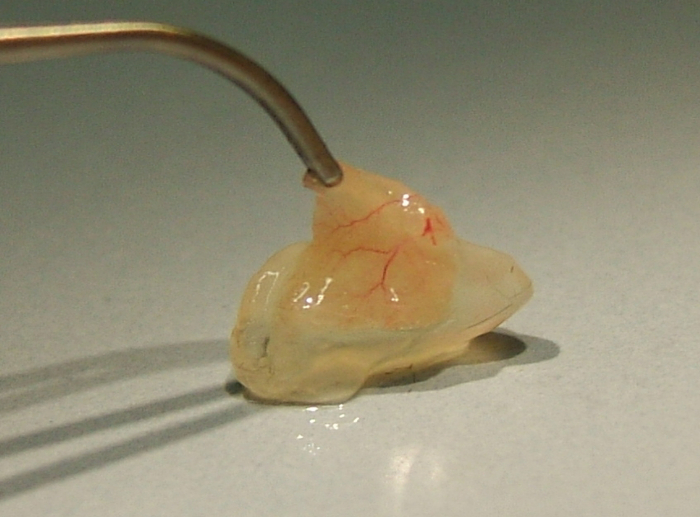
図 3: マウスの側面から explanted マトリクス プラグ (を参照してくださいポイント 3.5).株式会社船尾静脈経由で単球移植後 5 日。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 新生血管基底膜のようなマトリックス内の比較 (  + SD、n = 各グループの 3).追加成長因子と血管基底膜のようなマトリックスのプラグと比較して追加する成長因子なし (赤いバー)、基底膜のようなマトリクス プラグ内血管。基底膜のような行列に、成長因子の補充は、高められた血管の成長につながります。この図の拡大版を表示するのにはここをクリックしてください。
+ SD、n = 各グループの 3).追加成長因子と血管基底膜のようなマトリックスのプラグと比較して追加する成長因子なし (赤いバー)、基底膜のようなマトリクス プラグ内血管。基底膜のような行列に、成長因子の補充は、高められた血管の成長につながります。この図の拡大版を表示するのにはここをクリックしてください。
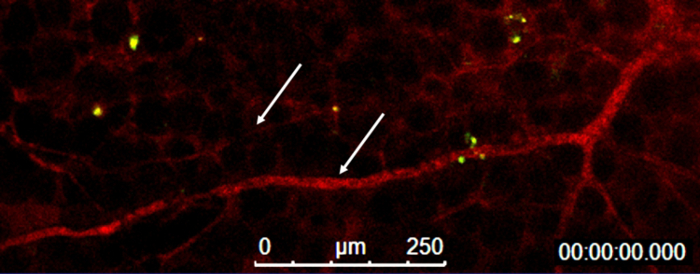
図 5:血管基底膜のようなマトリックスのプラグの内で。血の可視化の流れ (矢印) の血管や基底膜のようなマトリックスのプラグ内 (緑) ホーミング単球 (赤)。この図の拡大版を表示するのにはここをクリックしてください。
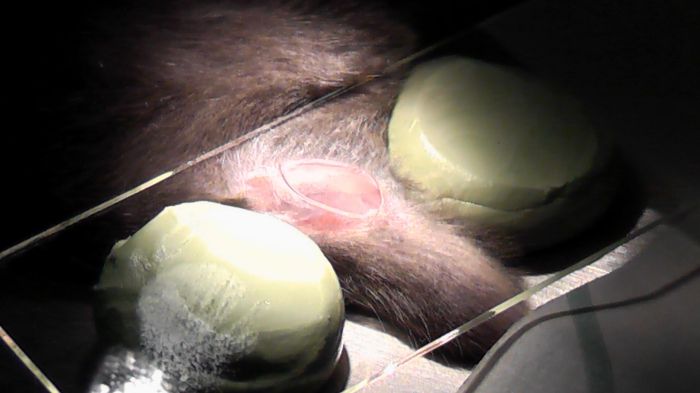
図 6: マウス画像の獲得のために準備します。足は粘着テープで固定、カバー ガラスは 2 つの調節可能なスタンプの上に配置されます。関心領域は、メスで切除されました。NaCl は、画像や組織の品質は妥協しない領域を湿めさせるために使用されます。 この図の拡大版を表示するのにはここをクリックしてください。
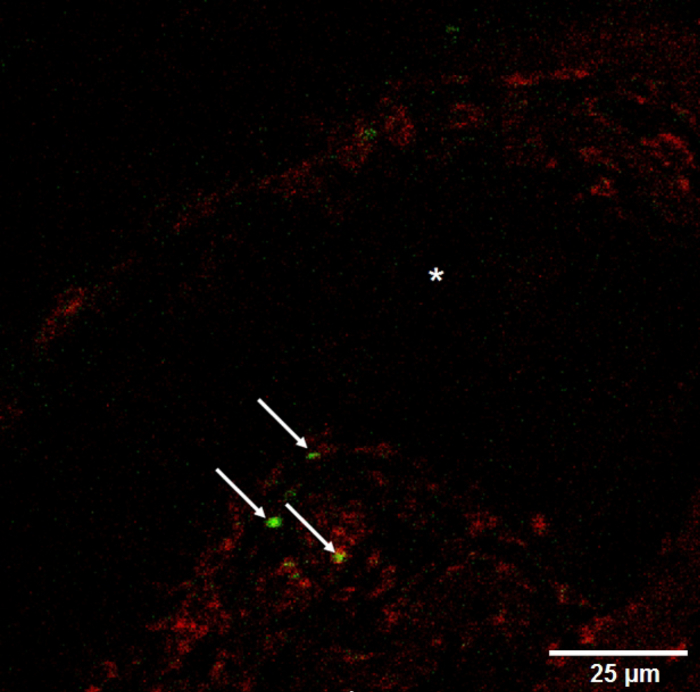
図 7:血管の可視性を減少します。船の横にある基底膜のようなマトリックス内球 (矢印) をステンド グラス 3, 3'-Dioctadecyloxacarbocyanine 過塩素酸塩 (縦断面図 *)。この図の拡大版を表示するのにはここをクリックしてください。

図 8:単球が血管にフラッシュします。3, 3'-Dioctadecyloxacarbocyanine 過塩素酸の生体内可視化は染色し、担保動脈 (*) の内で単球 (緑の矢印) を移植します。この図の拡大版を表示するのにはここをクリックしてください。
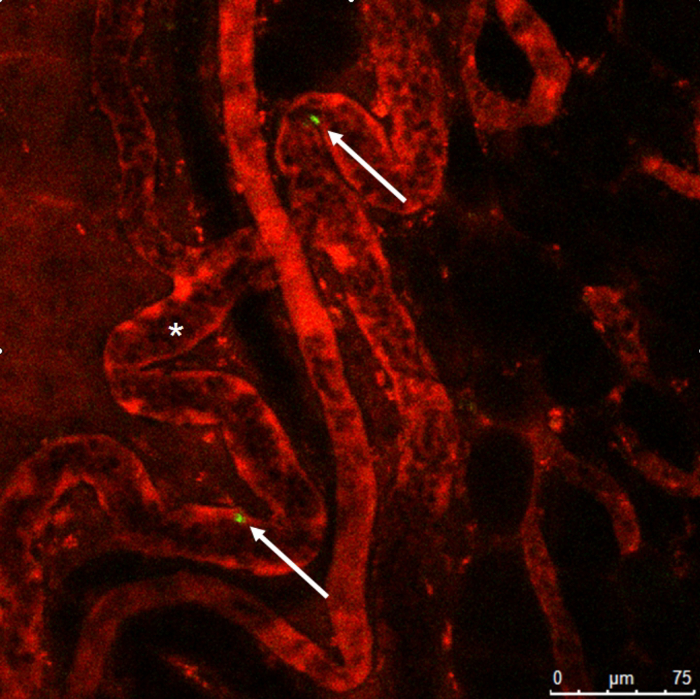
図 9:生体顕微鏡観察します。3, 3'-Dioctadecyloxacarbocyanine 過塩素酸染色単球 (矢印) 典型的ならせん形成 (*) と担保血管内でローダミン デキストランで染色します。この図の拡大版を表示するのにはここをクリックしてください。
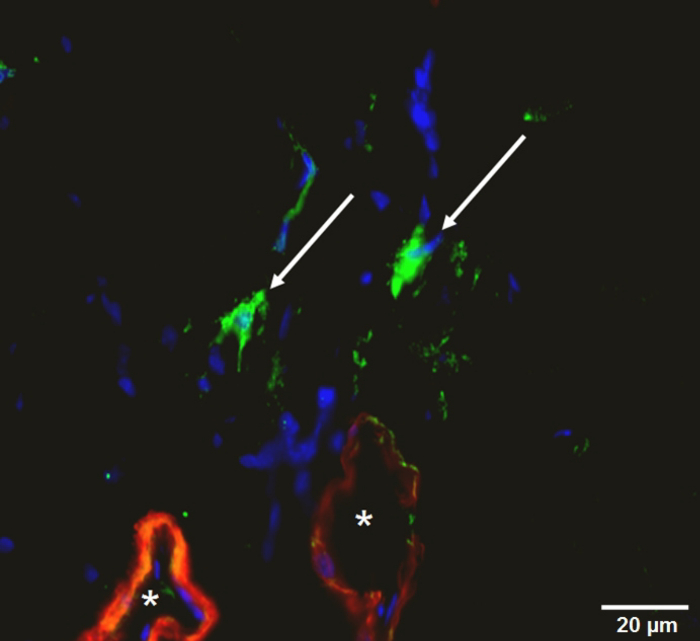
図 10:大腿筋の免疫組織学的染色します。船 (赤: α 平滑筋アクチン, *)、マクロファージ (緑: 3, 3'-Dioctadecyloxacarbocyanine 過塩素酸塩、矢印)、細胞核 (青)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ここで説明する方法は、担保動脈の開発、これらの血管の単球の挙動と arteriogenesis の過程に光を投げかけています。このプロトコルを適用するための手順が簡単に学び、科学の他の分野で使用することができます。これらの利点にもかかわらず、いくつかの欠点があります。例えば、顕微鏡装置は、記載された方法を実行する必要です。1 つの実験のための機器を取得は、デバイスを共有するその他の機関と協力する上で重要な持続可能なではないです。
練習を避けることがこのプロトコルで接続されているその他の困難があります。初めに、顕微鏡でマウスの位置の問題があることし、画質がこのような状況の下で苦しむことができます。もう一つの重要なポイントは、尾静脈注射です。単球静脈内に見られるは正しく挿入された場合のみ。したがって、マウスの前に注射を練習することをお勧めします。
単球の分離も重要です。単球は、しばしば様々 な結果やセル利回り12,13,14につながる複数のプロトコルを使用して別の種から分離できます。汚染を避けるため無菌状態で作業する必要があります。慎重にピペッティングし、一定温度を維持する細胞の損傷しないようにします。
これらの欠点にもかかわらずこの方法は実用的で行うには、簡単な末梢動脈疾患の背後にある基本的なメカニズムと腫瘍血管新生に光を当てるにユーザーを有効にします。
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
謝辞
この作品は、ELSE Kröner 財団によって支えられたと、 (ドイツ研究振興協会、ドイツ研究振興協会) DFG SFB 854 (Sonderforschungsbereich、共同研究センター)。ハンス ・ ホルガー ・ Gärtner、Audiovisuelles Medienzentrum、オットー ・ フォン ・ ゲーリケ大学マクデブルク Magdeburg, ドイツの, のおかげで特別なテクニカル サポート。
資料
| Name | Company | Catalog Number | Comments |
| 10% fetal calf serum (FCS) | Sigma Aldrich, Hamburg, Germany | ||
| 1% penicillin/streptomycin | Sigma Aldrich, Hamburg, Germany | ||
| 1mL Omnifix -F insuline syringe | B. Braun, Melsungen AG, Melsungen, Germany | ||
| 50 ml syringe | Fresenius Kabi AG, Bad Homburg, Germany | Injectomat- syringe 50 ml with canule | |
| 6-well-ultra-low-attachement-plates | Corning Incorporated, NY, USA | ||
| 8- 12 week old, male, C57BL/6, BalbC mice | Charles River, Sulzfeld, Germany | ||
| Adhesive tape | TESA SE, Hamburg, Germany | ||
| Acquisition Software | Leica, Wetzlar, Deutschland | Leica Application Suite Advanced Fluorescence (LAS AF); Version: 2.7.3.9723 | |
| Canules | B. Braun, Melsungen AG, Melsungen, Germany | 29G, 30G | |
| Cell culture dish | Greiner Bio-One GmbH, Frickenhausen, Germany | ||
| Cell culture medium | Manufactured by our group with single components | Medium199, 10% Fetal calf serum, 1% Antibiotic (penicillin/streptomycin) | |
| Centrifuge | Beckman Coulter GmbH, Krefeld, Germany | Allegra X-15R centrifuge | |
| Depilatory cream | Veet, Mannheim, Germany | ||
| DiO | Invitrogen Eugene, Oregon, USA | ||
| Disinfection agent | Schülke&Mayr GmbH, Norderstedt, Germany | ||
| Disposable scalpel No.10 | Feather safety razor Co.Ltd, Osaka, Japan | ||
| EDTA | Sigma Aldrich, Hamburg, Germany | ||
| Erlenmeyer flask | GVB, Herzogenrath, Germany | ||
| Ethanol 70% | Otto Fischar GmbH und Co KG, Saarbrücken, Germany | ||
| Fetal Calf Serum | Sigma Aldrich, Hamburg, Germany | ||
| Fine Forceps | Rubis, Stabio, Switzerland | ||
| Flurophor/Rhodamindextran | Thermo Fischer Scientific, Waltham, MA USA | Katalognummer: D-1819 | |
| Gloves | Rösner-Matby Meditrade GmbH, Kiefersfelden, Germany | ||
| Heating pad | Labotect GmbH, Göttingen, Germany | Hot Plate 062 | |
| Human macrophage-colony stimulating factor | Sigma Aldrich, Hamburg, Germany | SRP3110 | |
| Humane leucocyte filters | Blood preservation | ||
| Incubator | Ewald Innovationstechnik GmbH, Bad Nenndorf, Germany | ||
| Isoflurane | Baxter Deutschland GmbH, Unterschleißheim, Germany | ||
| Ketamine (10%) | Ketavet, Pfizer Deutschland GmbH, Berlin , Germany | ||
| Leukocyte separation tubes (tubes with filter) | Bio one GmbH, Frickenhausen, Germany | ||
| Light microscope | Carl Zeiss SMT GmbH, Oberkochen, Germany | Axiovert 40 C | |
| Lymphocyte separation medium LSM1077 | GE Healthcare, Pasching, Austria | ||
| Matrigel | Becton, Dickinson and Company, Franklyn Lakes, New Jersey, USA | ||
| Medium M199 | PAA Laboratories GmbH, Pasching, Austria | ||
| Microbiological work bench | Thermo Electron, LED GmbH, Langenselbold, Germany | Hera safe | |
| Microscope slide | Carl Roth GmbH + Co. KG, Karlsruhe | Art. Nr. 1879 | |
| Microscope stand with incubator and heating unit | Leica DMI 6000, Pecon, Germany | ||
| Monocyte wash buffer | Manufactured by our group with single components | PBS, 0,5% BSA, 2mM EDTA | |
| Mouse restrainer | Various | ||
| Multi-photon microscope | Leica, Wetzlar, Deutschland | Leica SP5 Confocal microscope, Cameleon, Coherent | |
| NaCl (0,9%) | Berlin Chemie AG, Berlin, Germany | ||
| Neubauer counting chamber | Paul Marienfeld GmbH und Co.KG, Lauda-Königshofen, Germany | ||
| Objective | Leica, Wetzlar, Deutschland | Leica HC PL APO 10x/0.4 CS | |
| PBS | Life technologies GmbH, Darmstadt, Germany | ph 7,4 sterile | |
| Penicillin/Streptomycin | Sigma Aldrich, Hamburg, Germany | ||
| Percoll | Manufactured by our group with single components | 90 % Percoll, 10% 1,5M NaCl, ρ= 1,064 g cm-3 | |
| Percoll solution | GE Healthcare, Bio-Science AB, Uppsala, Sweden | ||
| Pipettes | Eppendorf AG, Hamburg, Germany | 10µL/100µL/200µL/1000µL | |
| Pipettes serological | Greiner Bio-One GmbH, Frickenhausen, Germany | Cellstar2ml, 5ml, 10ml | |
| Pipetting heads | Eppendorf AG, Hamburg, Germany | ||
| Pipetus | Eppendorf AG, Hamburg, Germany | ||
| Polystyrol tube | Cellstar, Greiner Bio-One GmbH, Frickenhausen, Germany | ||
| Scissor | Word Precision Instruments, Inc., Sarasota, USA | ||
| Scale | Mettler PM4800 Delta Range, Mettler-Toledo GmbH, Gießen, Germany | ||
| Suction unit | Integra bioscience, Fernwald, Germany | Vacusafe comfort | |
| Surgical scissors | Word Precision Instruments, Inc., Sarasota, USA | ||
| Trypan blue solution 0,4 % | Sigma Aldrich, Hamburg, Germany | ||
| Tubes with cap | Greiner Bio-One GmbH, Frickenhausen, Germany | 15ml, 50ml Cellstar | |
| Xylazine (2 %) | Ceva Tiergesundheit GmbH, Düsseldorf, Germany |
参考文献
- Volz, K. S., Miljan, E., Khoo, A., Cooke, J. P. Development of pluripotent stem cells for vascular therapy. Vascular pharmacology. 56 (5-6), 288-296 (2012).
- Henry, T. D., et al. The VIVA trial: Vascular endothelial growth factor in Ischemia for Vascular Angiogenesis. Circulation. 107 (10), 1359-1365 (2003).
- Wagner, M., et al. Isolation and intravenous injection of murine bone marrow derived monocytes. Journal of visualized experiments JoVE. (94), (2014).
- Herold, J., et al. Transplantation of monocytes: a novel strategy for in vivo augmentation of collateral vessel growth. Human gene therapy. 15 (1), 1-12 (2004).
- Ito, W. D., Arras, M., Scholz, D., Winkler, B., Htun, P., Schaper, W. Angiogenesis but not collateral growth is associated with ischemia after femoral artery occlusion. The American journal of physiology. 273 (3 Pt 2), H1255-H1265 (1997).
- Herold, J., et al. Tetanus toxoid-pulsed monocyte vaccination for augmentation of collateral vessel growth. Journal of the American Heart Association. 3 (2), e000611 (2014).
- . Matrigel Matrix Available from: https://www.corning.com/au/en/products/life-sciences/products/surfaces/matrigel-matrix.html (2017)
- Eubank, T. D., Galloway, M., Montague, C. M., Waldman, W. J., Marsh, C. B. M-CSF induces vascular endothelial growth factor production and angiogenic activity from human monocytes. Journal of immunology (Baltimore, Md. 1950). 171 (5), 2637-2643 (2003).
- Fridman, R., et al. Enhanced tumor growth of both primary and established human and murine tumor cells in athymic mice after coinjection with Matrigel. Journal of the National Cancer Institute. 83 (11), 769-774 (1991).
- Woodman, S. E., et al. Caveolin-1 knockout mice show an impaired angiogenic response to exogenous stimuli. The American journal of pathology. 162 (6), 2059-2068 (2003).
- Francke, A., Weinert, S., Strasser, R. H., Braun-Dullaeus, R. C., Herold, J. Transplantation of bone marrow derived monocytes: a novel approach for augmentation of arteriogenesis in a murine model of femoral artery ligation. American journal of translational research. 5 (2), 155-169 (2013).
- Houthuys, E., Movahedi, K., Baetselier, P., de Van Ginderachter, J. o. A., Brouckaert, P. A method for the isolation and purification of mouse peripheral blood monocytes. J. Immunol. Methods. 359 (1-2), 1-10 (2010).
- Berthold, F. Isolation of human monocytes by Ficoll density gradient centrifugation. Blut. 43 (6), 367-371 (1981).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved