Method Article
小鼠外周动脉疾病模型中单核细胞归巢和肿瘤相关血管生成的活体显微镜观察
摘要
单核细胞是外周动脉疾病中 arteriogenesis 的重要介质。本协议采用基底膜样基质和活体显微镜, 研究单核细胞注射在股动脉结扎小鼠模型中的单核细胞归巢和肿瘤相关血管生成。
摘要
外周动脉疾病和缺血性心脏病的治疗目的是增加血流对血液动力学狭窄引起的缺血性区域。在某些病例中, 血管手术是一个可行的选择, 但是对于没有手术适应症的病人, 如进展到休息疼痛, 严重肢体缺血, 或严重的生命或工作中断, 几乎没有可能减轻他们的疾病。通过刺激侧枝形成的单核细胞强化灌注, 是少数非侵入性选择之一。
我们的小组检查 arteriogenesis 后单核细胞移植到小鼠使用后肢缺血模型。在此之前, 我们已经证明了改进的后肢灌注使用破伤风刺激体单核细胞移植。除了对侧枝形成的影响外, 该疗法还可能影响肿瘤的生长。为了研究这些效应, 我们使用了一个基底膜样基质小鼠模型, 通过注射 Engelbreth-栎-群肉瘤的胞外基质到小鼠的侧面, 在股动脉闭塞后。
在人工肿瘤研究后, 我们使用活体显微镜来研究体内肿瘤血管生成和单核细胞在侧支动脉内的归巢。先前的研究已经描述了动物模型的组织学检查, 这是预料随后对宰后伪影的分析。我们的方法直观地将单核细胞归巢到抵押的实时序列, 易于执行, 并研究了 arteriogenesis 和肿瘤血管生成的过程在体内。
引言
心血管疾病, 包括冠心病或周围动脉疾病, 是全球最常见的死亡原因1。细胞疗法是治疗心血管疾病的一种很有前途的方法, 特别是对于那些不能接受手术治疗的人。有几种方法使用细胞或其分泌物质作为治疗工具2,3, 其总体目标是改善缺血性和 underperfused 组织的灌注和维持功能。实现这一目标的一个尝试是改善 arteriogenesis, 从而提高侧枝动脉的发育。单核细胞是一种与抵押相关的重要单元类型。我们的小组专注于研究在炎症区域的单核细胞的影响4,5, 特别是使用后肢缺血模型诱导缺血和随后的炎症6。单核细胞的家到炎症的地区, 并导致复杂的系统性反应, 导致抵押的发展7。
随着活体显微镜的使用, 我们可以研究这些细胞的行为在体内, 并观察被注射的单核生物归巢到炎症区域。大多数以前的研究只描述了验尸分析, 它的缺点包括组织学文物的引入和准备工作所需的大量动物。通过我们的方法, 我们可以通过实时成像在多个时间点来研究免疫过程和侧枝形成。
除了在缺血地区发展侧枝动脉外, 单核细胞还会影响肿瘤的生长。为了研究这些过程, 我们注入了一个基底膜样基质从 Engelbreth-栎-群小鼠肉瘤, 一个富含细胞外基质蛋白的肿瘤8, 并使用活体显微镜进行分析。该矩阵用于筛选血管内皮细胞网络形成或通过血管生成抑制的抗癌治疗的实验分子;在这种情况下, 我们将评估肿瘤血管生成潜能的单核细胞治疗9,10,11。
本议定书的目的是证明一个简单和有效的方法来研究的免疫过程中造成的缺血在一个体内模型。我们可以产生一个更现实的测试环境与组织学检查的验尸肌肉组织。
研究方案
根据德国动物保护法8节的规定, 我们的研究是在萨克森-安哈尔特、Landesverwaltungsamt 哈雷州的许可下进行的。(和 #167; 8, 德国法律的1段为动物保护从 18.05.2016-BGBI。我的 1206, 1313, 和 #167; 31 TierSchVersV 从 13.08.2013).
注意: 在这里的实验中, 使用了8到12周的老雄性 balb/c/c 小鼠, 从献血者的人单核细胞通过活体显微镜将其用于单核细胞的可视化.
1. 单元格准备
注意: 为了隔离单核细胞, 请参阅我们以前发布的关于朱庇特的视频说明: 和 #34; 小鼠骨髓来源的分离与静脉注射单核细胞和 #34; 由瓦格纳 et al. 4
注意: 在处理单元格时, 所有步骤都必须是无菌的, 以避免污染.
- 33 和 #39 的细胞染色;-Dioctadecyloxacarbocyanine 高氯酸盐
- 重血清自由培养基中的细胞, 密度为 1 x 10 6 细胞/毫升.
注: 只有血清游离培养基能够有效染色, 因为脂溶性染料本来已经被血清的亲油性成分所捕获. - 添加5和 #181; 1 mM 33 和 #39;-Dioctadecyloxacarbocyanine 高氯酸盐在胺1毫升的细胞悬浮和重仔细.
- 在37和 #176 孵育单元解决方案; C 为 20 min.
- 在37和 #176 上离心细胞; C 和 500 x g, 5 分钟.
- 用37和 #176 将上清液取出并重; C. 温胎小牛血清补充培养基.
- 重复步骤1.1.4 和1.1.5 两次.
- 使用公式计算单元格数:

- 重150和 #181 的单元格, 不育 0.9% NaCl 溶液.
- 将细胞注入尾静脉.
- 重血清自由培养基中的细胞, 密度为 1 x 10 6 细胞/毫升.
2。麻醉
- 吸入麻醉
- 在一个化学安全罩下的一个密闭容器中使用浓度为5% 的蒸发器帮助汽化异氟醚.
- 小心地处理鼠标并将其放入纸盒中.
- 在停止移动后, 在后颈部的皮肤上处理该动物.
- 腹腔麻醉 注: 使用2.1 步中描述的异氟醚麻醉进行腹腔注射。随着异氟醚麻醉的快速恢复和短效麻醉效果, 对小鼠进行腹腔麻醉更容易处理。
- 使用2.4 毫升氯胺酮 (10%)、0.8 毫升嗪 (2%) 和6.8 毫升氯化钠 (0.9%) 进行腹腔注射的解决方案.
- 在应用麻醉前称其为动物.
注: 麻醉药的配方是:

- 使用1毫升的胰岛素注射器, 用30克针将溶液注入左下腹.
- 将鼠标放在笼子里, 等待麻醉效果.
注: 如果注射成功, 麻醉效果通常在5分钟内出现。正确的麻醉深度可以由没有眼睑反射或对脚趾捏的反应, 以及正常的, 控制的呼吸率来确定.
3。基底膜样基质的植入
注意: 本组采用该方法研究单核细胞注射后肿瘤血管生成。根据实验, 生长因子可添加到基底膜样基质中。我们进行了股动脉结扎术, 然后在老鼠的侧面注射肿瘤。该矩阵必须有一个温度为4和 #176; C 的注射。在这个温度下, 矩阵是流体;在体温 (37 和 #176; C) 中, 凝胶硬化成固体。为更好的可见性皮下基质插头, 剃须在注射现场的鼠标的皮肤.
注意: 可选: 添加 100 ng 碱性成纤维细胞生长因子, 300 ng 血管内皮生长因子, 26 单位肝素在无菌条件下对基底膜样基质.
- 将1毫升的基质装入30克胰岛素注射器并在冰上储存, 直到使用.
- 将动物放在桌子上, 并在侧面的注射部位旁边按住鼠标的皮肤.
- 注入500和 #181; 基底膜状基质的 L.
注: 由于实际的原因, 有必要将基底膜样基质紧密地注入一个位置, 以避免皮下分散。在实验结束后, 将人工肿瘤从组织中取出, 将会更容易.
4。尾静脉注射
注意: 在试验前, 在实验动物身上练习尾静脉和氯化钠溶液。如果单核细胞不能在尾静脉中充分注入, 就不会对抵押有系统性影响。在这个协议中, 我们注射了250万单核细胞。试着注入不超过5和 #181; 体重的 L/克.
- 使用在包含250万单核细胞的阶梯1.1.8 下制备的核细胞液.
- 使用30克针和1毫升胰岛素注射器注射.
- 小心处理鼠标, 抑制抑制剂中的动物, 确保鼠标不受伤害, 并有足够的呼吸空间.
- 将抑制剂放在加热板上, 使尾部可以与板接触.
- 识别尾部静脉, 它们位于尾部的侧面.
- 转动尾部90和 #176;, 尾部的尾静脉出现在尾部的上部.
- 在注射单核细胞前先消毒注入侧.
- 尝试将单核细胞溶液注入一个平坦的角度与针的斜面朝上.
注: 如果出现水疱, 请停止注射, 因为这是注射失败的征兆。再次尝试该过程更接近. - 在注射部位停止出血, 在尾部施加温和压力约 60s.
- 观察该动物30分钟, 监测系统的副作用, 并把鼠标在其笼子后, 动物已经完全恢复.
5。活体显微镜
- 准备
- 将麻醉鼠标放在加热垫 (37 和 #176; C) 上, 以保持恒温, 并将爪子固定在胶带上.
- 在用于显微镜的腿部或侧面的部位进行皮肤消毒.
- 剃须区域的利益, 以更好地处理和避免干扰头发.
- 在 0.5 x 0.5 cm 的正方形区域中使用无菌手术刀和细钳切除皮肤.
注意: 重要的是保持该地区的利益湿润;否则, 图像和组织的质量将受到影响。氯化钠溶液可用于滋润该地区. - 将腿放在两个可调整的邮票之间, 并在邮票顶部放置一个盖玻璃.
- 确保组织湿润并与玻璃接触.
- 注射液ect 50 和 #181; l-葡聚糖后进入静脉系统, 以提高血管的能见度.
- 启动显微镜并根据需要调整腿部的位置.
- 活体显微镜设置
- 打开显微镜、计算机、电子接口和激光器.
- 打开孵化室和/或加热阶段 (板/垫) 的加热单元, 并将温度设置为37和 #176; C.
- 启动购置软件。如果显微镜配备了共振扫描仪, 请选择此快速扫描模式.
- 等待温度达到恒定水平 (35-37 和 #176; C)
注意: 一个稳定的温度是重要的: (a) 鼠标, 这在麻醉下不能控制其体温, 和 (b) 避免或至少最小化焦点漂移。这可能需要 1 h 到几个小时, 这取决于周围的条件 ( 例如 , 空调系统和房间里的热源的数量, 包括人)。如果使用浸入式目标, 透镜与盖玻璃 (或组织) 之间的接触区是不稳定的典型来源。用物镜加热镜片可能有帮助;另外, 强烈建议使用自动对焦系统的显微镜. - 选择具有高数字光圈的放大镜头, 以满足实验的分辨率要求 (请参阅本节末尾的注释).
- 在将实验动物放在舞台上之前, 优化显微镜设置以获取增益、通道设置、扫描速度、像素分辨率、深度音量、步长和平均值.
- 扫描双向以减少捕获时间. 在显微镜达到稳定的条件后, 将麻醉小鼠放在 prewarmed 显微镜下, 并在假人的帮助下进行测试.
- 通过使用明亮的光照, 将基底膜状基质内的感兴趣区域带入焦点, 并通过紫外光对毛细管进行简要检查, 并对应用的荧光进行适当的过滤设置.
- 切换到扫描模式; 开始扫描低分辨率 256 x 256 模式, 并增强增益和激光功率, 直到显示器上出现信号.
- 关注感兴趣的结构。放大, 直到所有细节都可见.
- 定义和 #34; 开始和 #34; #34; 结束和 #34; 位置在轴向方向.
- 停止扫描
- 定义步进大小 ( 例如 、0.5 和 #181; m) 和焦点平面 ( (如 、10-20) 的数目.
- 根据移动的亚细胞结构或单元格的速度切换到最终像素分辨率 (512 x 512 或 1024 x 1024), 并选择最适合运动的扫描速度 (扫描频率)。建议使用双向扫描来固定堆栈的获取.
注意: 选择扫描的最高扫描速率, 以提供足够的图像质量。典型的点扫描器提供400赫兹和1.4 赫之间的速度。共振扫描仪提供额外的8赫或12赫。通过减少 y 方向的行数, 可以进一步提高扫描速率 (典型值为 512 x 512、512 x 256 或 512 x 200 像素分辨率)。根据信噪比, 可以通过在2和4之间添加线平均来提高图像质量。通常情况下, 512 x 200 的设置没有平均值, 在双向模式下使用8赫谐振扫描仪获得18毫秒的捕获时间/帧;512 x 200 和4x 平均, 它减慢到每帧56毫秒.
结果
活体显微镜检查肿瘤和侧枝血管的生长触发的单核细胞可以帮助揭示新的方面, 分子机制的肿瘤血管生成和 arteriogenesis。必须使用该协议的步骤精心准备和注射细胞。差异可以导致单一实验之间的变化。单核细胞必须注入静脉系统 (图 1), 以保持系统性的影响, 避免栓子, 这可能发生, 如果注射是在动脉系统进行。
如果使用基底膜样基质, 慢慢地注射以避免分散, 将有助于塞圆满进一步组织学检查 (图 2, 图 3)。在牺牲鼠标后, 基底膜状的基质插头将从鼠标的侧面说明。在基底膜状的基质塞中, 我们可以通过计算不同实验设置中的毛细血管 (图 4,图 5) 来测量血管。
成功实验的另一个条件是显微镜设置, 它取决于软件、硬件和动物准备 (图 6)。如果需要识别亚细胞结构 (和 #60; 2 µm), 则有2光子激发和浸水目标的直立显微镜 (20X 或 25X, 数字孔径 1.0), 工作距离长 (和 #62 2 mm) 为宜。由于高数字孔径的浸水目标对折射率变化非常敏感, 因此必须通过在目标处移动一个校正环来调整最佳的图像分辨率和亮度。不幸的是, 由于空间有限, 手工调整相当困难。因此, 用电动项圈校正的昂贵的目标由显微镜制造商提供。
如果细胞分辨率 (5-10 µm) 是足够的, 10x 干燥透镜与数字孔径0.4 或更高和一个长的工作距离 (和 #62; 2 毫米) 推荐。在这种情况下, 可以选择直立或倒置的显微镜支架。用10X 干透镜 (数字孔径 0.4) 在更高的变焦因子 (和 #62; 3) 的活细胞成像更容易和便宜, 因为经典的共焦激光扫描显微镜 (即, 1 光子励磁) 可以用来获得足够的图像堆栈决议.如果需要大量的时间来获取图像, 在血管内的罗丹明葡聚糖的数量减少。为了使容器有更好的可见性, 必须重复荧光的注入 (图 7)。
它是最有效的样本不同的调整, 并决定最好的图像质量可能。使用阳性探针的细胞或基底膜样基质 (不移植) 可以帮助获得最佳的设置。我们可以通过血流和肌肉组织内的活体显微镜检测到有标记的单核细胞 (图 8,图 9)。组织切片的组织学检查验证了我们的发现 (图 10)。

图 1: 将250万单核细胞注入尾静脉.脉位于尾巴的侧面, 背部和腹侧有动脉。请单击此处查看此图的较大版本.
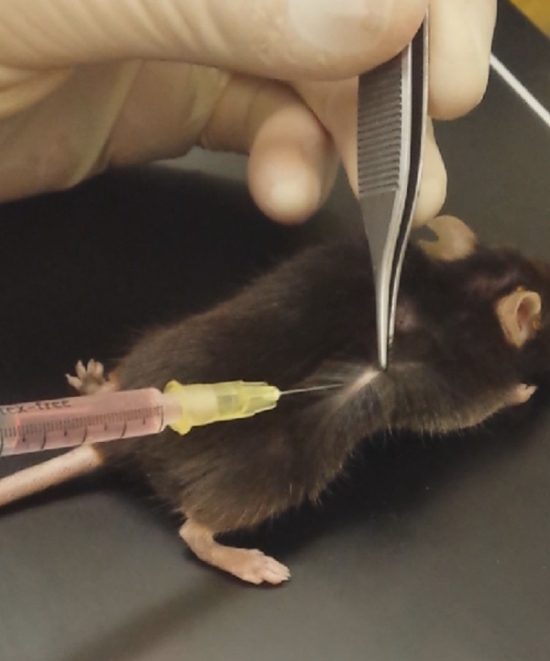
图 2: 注入基底膜状基质.处理鼠标的皮肤, 在侧面注入基底膜状基质。请单击此处查看此图的较大版本.
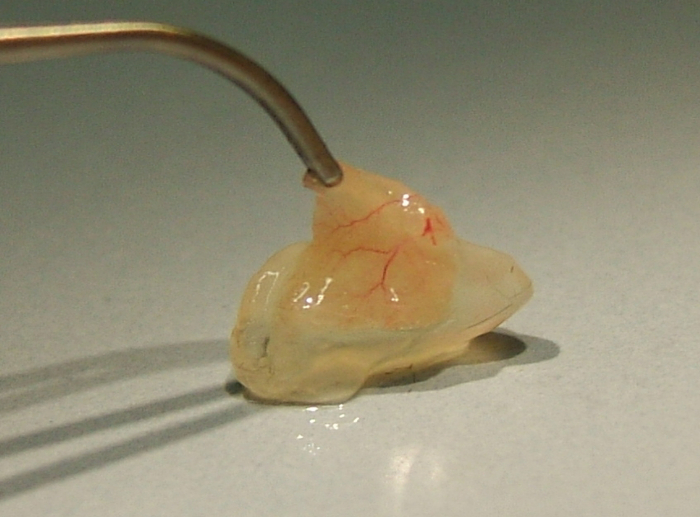
图 3: 说明的矩阵插头从鼠标的侧面 (参见点 3.5).在单核细胞移植后五天内经尾静脉。请单击此处查看此图的较大版本.

图 4: 在基底膜状基质中的血管化比较 ( + SD, n = 3 在每个组中).  容器内的基底膜状的基质塞, 无生长因子添加 (红条), 与基底膜状基质的容器相比, 增加了生长因子。基底膜样基质与生长因子的补充导致血管生长增加。请单击此处查看此图的较大版本.
容器内的基底膜状的基质塞, 无生长因子添加 (红条), 与基底膜状基质的容器相比, 增加了生长因子。基底膜样基质与生长因子的补充导致血管生长增加。请单击此处查看此图的较大版本.
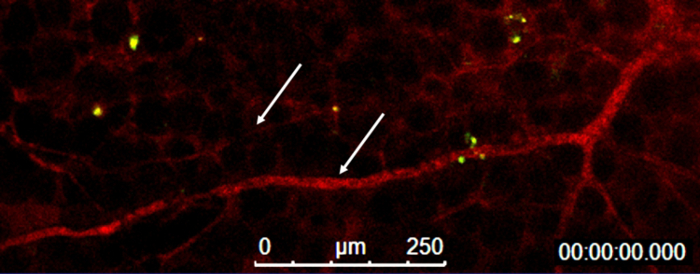
图 5:在地下室的容器内膜状的矩阵插头.血管 (箭头) 内的血流 (红色) 和单核细胞自导 (绿色) 在基底膜状基质塞中的可视化。请单击此处查看此图的较大版本.
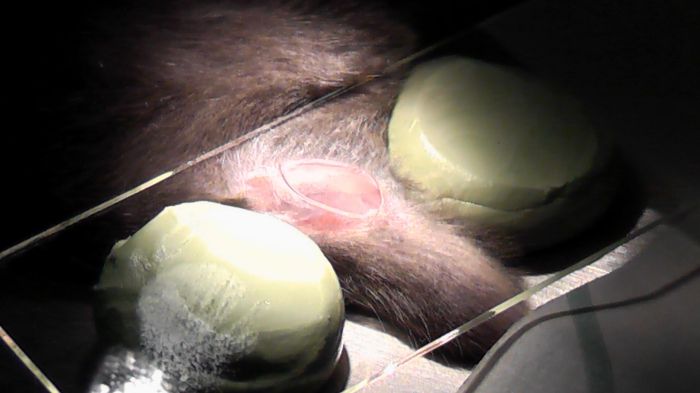
图 6: 为图像采集准备的鼠标.爪子是固定的胶带和盖玻璃的位置上的两个可调邮票的顶部。有兴趣的区域用手术刀切除。氯化钠被用来滋润这个区域, 所以图像和组织的质量不会受到损害。> 请点击这里查看这个数字更大的版本。
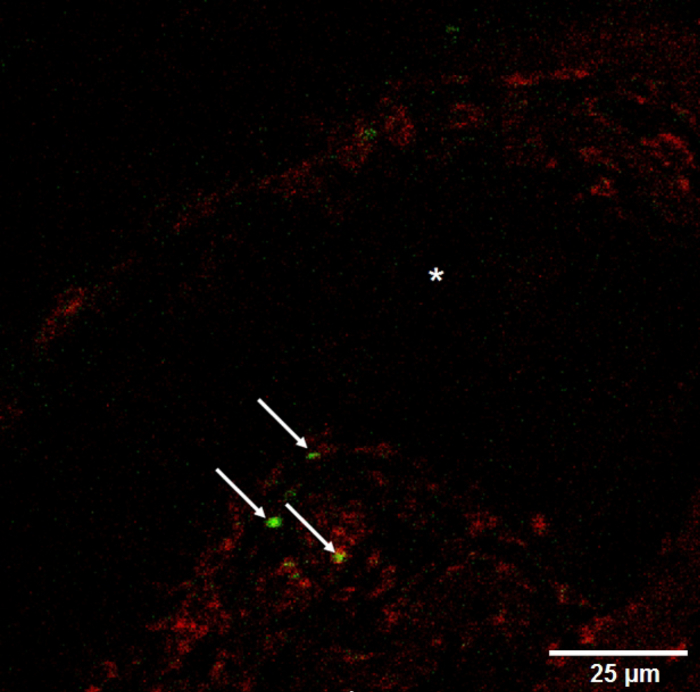
图 7:降低船只的能见度.33 '-Dioctadecyloxacarbocyanine 高氯酸盐染色单核细胞 (箭头) 在基底膜样基质的旁边的船只 (纵向部分, *)。请单击此处查看此图的较大版本.

图 8:单核细胞冲入血管.体内33-Dioctadecyloxacarbocyanine 高氯酸盐染色和移植单核细胞 (绿色, 箭头) 在侧枝动脉 (*) 内的可视化。请单击此处查看此图的较大版本.
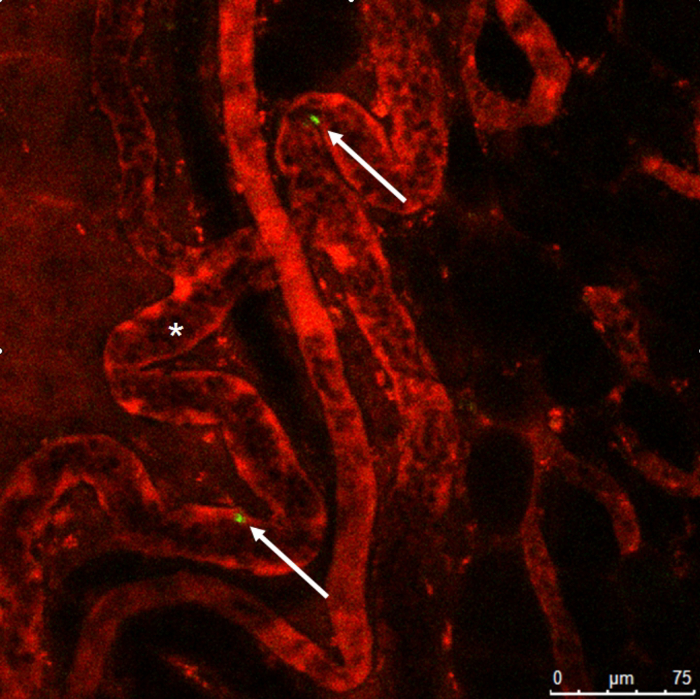
图 9:活体显微镜.33 '-Dioctadecyloxacarbocyanine 高氯酸盐染色单核细胞 (箭头) 在典型的螺旋状形成 (*) 染色与罗丹明葡聚糖。请单击此处查看此图的较大版本.
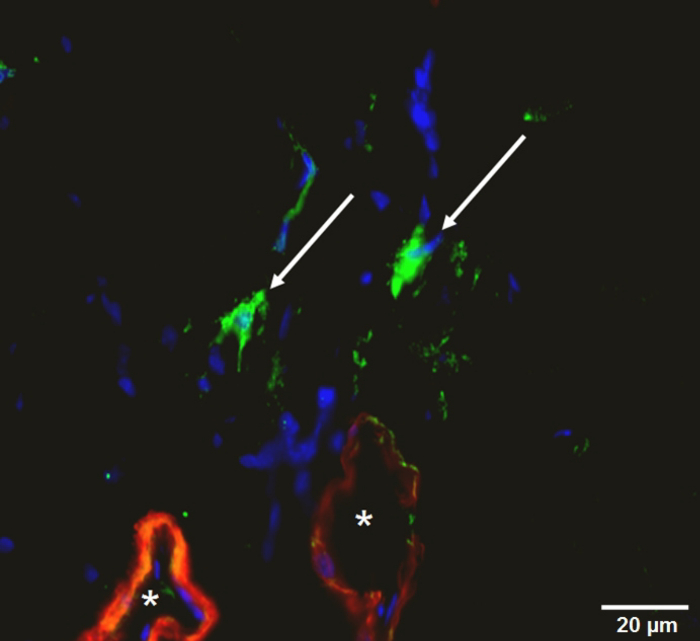
图 10:免疫的大腿肌组织染色.血管 (红色: α平滑肌肌动蛋白, *), 巨噬细胞 (绿色:33 '-Dioctadecyloxacarbocyanine 高氯酸盐, 箭头), 细胞核 (蓝色)。请单击此处查看此图的较大版本.
讨论
本文所述方法揭示了侧枝动脉的发展、这些血管中单核细胞的行为以及 arteriogenesis 的过程。应用该协议的步骤很容易学习, 可以用于其他科学领域。尽管有这些优点, 但也有一些缺点。例如, 需要显微设备来执行所描述的技术。为一个实验获取设备是不可持续的, 因此与其他机构合作共享这些设备是很重要的。
与此协议相关的其他困难也可以在实践中避免。一开始, 在显微镜下定位鼠标可能会出现问题, 在这种情况下, 图像质量会受到影响。另一个关键点是尾静脉注射。如果注射得当, 单核细胞只能在静脉中看到。因此, 在定位鼠标之前, 最好先练习注射。
单核细胞分离也是至关重要的。单核细胞可以使用多个协议从不同的物种中分离出来, 这通常会导致不同的结果和单元生成12,13,14。在无菌条件下工作是必要的, 以避免污染。移应小心防止细胞损伤, 并保持恒定的温度。
尽管有这些缺点, 这种方法是切实可行的, 易于执行, 使用户能够揭示肿瘤血管生成和周围动脉疾病的基本机制。
披露声明
作者声明他们没有竞争的金融利益。
致谢
这项工作得到了其他 kr-基金会和 DFG (德意志 Forschungsgemeinschaft, 德国研究基金会) SFB 854 (Sonderforschungsbereich, 合作研究中心) 的支持. 特别感谢汉斯-Holger Gärtner, Audiovisuelles Medienzentrum, 奥托-冯-奥托·冯·格里克大学马格德堡, 马格德堡, 德国, 技术支持。
材料
| Name | Company | Catalog Number | Comments |
| 10% fetal calf serum (FCS) | Sigma Aldrich, Hamburg, Germany | ||
| 1% penicillin/streptomycin | Sigma Aldrich, Hamburg, Germany | ||
| 1mL Omnifix -F insuline syringe | B. Braun, Melsungen AG, Melsungen, Germany | ||
| 50 ml syringe | Fresenius Kabi AG, Bad Homburg, Germany | Injectomat- syringe 50 ml with canule | |
| 6-well-ultra-low-attachement-plates | Corning Incorporated, NY, USA | ||
| 8- 12 week old, male, C57BL/6, BalbC mice | Charles River, Sulzfeld, Germany | ||
| Adhesive tape | TESA SE, Hamburg, Germany | ||
| Acquisition Software | Leica, Wetzlar, Deutschland | Leica Application Suite Advanced Fluorescence (LAS AF); Version: 2.7.3.9723 | |
| Canules | B. Braun, Melsungen AG, Melsungen, Germany | 29G, 30G | |
| Cell culture dish | Greiner Bio-One GmbH, Frickenhausen, Germany | ||
| Cell culture medium | Manufactured by our group with single components | Medium199, 10% Fetal calf serum, 1% Antibiotic (penicillin/streptomycin) | |
| Centrifuge | Beckman Coulter GmbH, Krefeld, Germany | Allegra X-15R centrifuge | |
| Depilatory cream | Veet, Mannheim, Germany | ||
| DiO | Invitrogen Eugene, Oregon, USA | ||
| Disinfection agent | Schülke&Mayr GmbH, Norderstedt, Germany | ||
| Disposable scalpel No.10 | Feather safety razor Co.Ltd, Osaka, Japan | ||
| EDTA | Sigma Aldrich, Hamburg, Germany | ||
| Erlenmeyer flask | GVB, Herzogenrath, Germany | ||
| Ethanol 70% | Otto Fischar GmbH und Co KG, Saarbrücken, Germany | ||
| Fetal Calf Serum | Sigma Aldrich, Hamburg, Germany | ||
| Fine Forceps | Rubis, Stabio, Switzerland | ||
| Flurophor/Rhodamindextran | Thermo Fischer Scientific, Waltham, MA USA | Katalognummer: D-1819 | |
| Gloves | Rösner-Matby Meditrade GmbH, Kiefersfelden, Germany | ||
| Heating pad | Labotect GmbH, Göttingen, Germany | Hot Plate 062 | |
| Human macrophage-colony stimulating factor | Sigma Aldrich, Hamburg, Germany | SRP3110 | |
| Humane leucocyte filters | Blood preservation | ||
| Incubator | Ewald Innovationstechnik GmbH, Bad Nenndorf, Germany | ||
| Isoflurane | Baxter Deutschland GmbH, Unterschleißheim, Germany | ||
| Ketamine (10%) | Ketavet, Pfizer Deutschland GmbH, Berlin , Germany | ||
| Leukocyte separation tubes (tubes with filter) | Bio one GmbH, Frickenhausen, Germany | ||
| Light microscope | Carl Zeiss SMT GmbH, Oberkochen, Germany | Axiovert 40 C | |
| Lymphocyte separation medium LSM1077 | GE Healthcare, Pasching, Austria | ||
| Matrigel | Becton, Dickinson and Company, Franklyn Lakes, New Jersey, USA | ||
| Medium M199 | PAA Laboratories GmbH, Pasching, Austria | ||
| Microbiological work bench | Thermo Electron, LED GmbH, Langenselbold, Germany | Hera safe | |
| Microscope slide | Carl Roth GmbH + Co. KG, Karlsruhe | Art. Nr. 1879 | |
| Microscope stand with incubator and heating unit | Leica DMI 6000, Pecon, Germany | ||
| Monocyte wash buffer | Manufactured by our group with single components | PBS, 0,5% BSA, 2mM EDTA | |
| Mouse restrainer | Various | ||
| Multi-photon microscope | Leica, Wetzlar, Deutschland | Leica SP5 Confocal microscope, Cameleon, Coherent | |
| NaCl (0,9%) | Berlin Chemie AG, Berlin, Germany | ||
| Neubauer counting chamber | Paul Marienfeld GmbH und Co.KG, Lauda-Königshofen, Germany | ||
| Objective | Leica, Wetzlar, Deutschland | Leica HC PL APO 10x/0.4 CS | |
| PBS | Life technologies GmbH, Darmstadt, Germany | ph 7,4 sterile | |
| Penicillin/Streptomycin | Sigma Aldrich, Hamburg, Germany | ||
| Percoll | Manufactured by our group with single components | 90 % Percoll, 10% 1,5M NaCl, ρ= 1,064 g cm-3 | |
| Percoll solution | GE Healthcare, Bio-Science AB, Uppsala, Sweden | ||
| Pipettes | Eppendorf AG, Hamburg, Germany | 10µL/100µL/200µL/1000µL | |
| Pipettes serological | Greiner Bio-One GmbH, Frickenhausen, Germany | Cellstar2ml, 5ml, 10ml | |
| Pipetting heads | Eppendorf AG, Hamburg, Germany | ||
| Pipetus | Eppendorf AG, Hamburg, Germany | ||
| Polystyrol tube | Cellstar, Greiner Bio-One GmbH, Frickenhausen, Germany | ||
| Scissor | Word Precision Instruments, Inc., Sarasota, USA | ||
| Scale | Mettler PM4800 Delta Range, Mettler-Toledo GmbH, Gießen, Germany | ||
| Suction unit | Integra bioscience, Fernwald, Germany | Vacusafe comfort | |
| Surgical scissors | Word Precision Instruments, Inc., Sarasota, USA | ||
| Trypan blue solution 0,4 % | Sigma Aldrich, Hamburg, Germany | ||
| Tubes with cap | Greiner Bio-One GmbH, Frickenhausen, Germany | 15ml, 50ml Cellstar | |
| Xylazine (2 %) | Ceva Tiergesundheit GmbH, Düsseldorf, Germany |
参考文献
- Volz, K. S., Miljan, E., Khoo, A., Cooke, J. P. Development of pluripotent stem cells for vascular therapy. Vascular pharmacology. 56 (5-6), 288-296 (2012).
- Henry, T. D., et al. The VIVA trial: Vascular endothelial growth factor in Ischemia for Vascular Angiogenesis. Circulation. 107 (10), 1359-1365 (2003).
- Wagner, M., et al. Isolation and intravenous injection of murine bone marrow derived monocytes. Journal of visualized experiments JoVE. (94), (2014).
- Herold, J., et al. Transplantation of monocytes: a novel strategy for in vivo augmentation of collateral vessel growth. Human gene therapy. 15 (1), 1-12 (2004).
- Ito, W. D., Arras, M., Scholz, D., Winkler, B., Htun, P., Schaper, W. Angiogenesis but not collateral growth is associated with ischemia after femoral artery occlusion. The American journal of physiology. 273 (3 Pt 2), H1255-H1265 (1997).
- Herold, J., et al. Tetanus toxoid-pulsed monocyte vaccination for augmentation of collateral vessel growth. Journal of the American Heart Association. 3 (2), e000611 (2014).
- . Matrigel Matrix Available from: https://www.corning.com/au/en/products/life-sciences/products/surfaces/matrigel-matrix.html (2017)
- Eubank, T. D., Galloway, M., Montague, C. M., Waldman, W. J., Marsh, C. B. M-CSF induces vascular endothelial growth factor production and angiogenic activity from human monocytes. Journal of immunology (Baltimore, Md. 1950). 171 (5), 2637-2643 (2003).
- Fridman, R., et al. Enhanced tumor growth of both primary and established human and murine tumor cells in athymic mice after coinjection with Matrigel. Journal of the National Cancer Institute. 83 (11), 769-774 (1991).
- Woodman, S. E., et al. Caveolin-1 knockout mice show an impaired angiogenic response to exogenous stimuli. The American journal of pathology. 162 (6), 2059-2068 (2003).
- Francke, A., Weinert, S., Strasser, R. H., Braun-Dullaeus, R. C., Herold, J. Transplantation of bone marrow derived monocytes: a novel approach for augmentation of arteriogenesis in a murine model of femoral artery ligation. American journal of translational research. 5 (2), 155-169 (2013).
- Houthuys, E., Movahedi, K., Baetselier, P., de Van Ginderachter, J. o. A., Brouckaert, P. A method for the isolation and purification of mouse peripheral blood monocytes. J. Immunol. Methods. 359 (1-2), 1-10 (2010).
- Berthold, F. Isolation of human monocytes by Ficoll density gradient centrifugation. Blut. 43 (6), 367-371 (1981).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。