Method Article
Microscopia intravital de monocito autoguiado hacia el blanco y la angiogénesis tumorales en un modelo murino de la enfermedad Arterial periférica
En este artículo
Resumen
Los monocitos son importantes mediadores de la Arteriogénesis en el contexto de la enfermedad arterial periférica. Utilizando una matriz similar a la membrana del sótano y microscopia intravital, este protocolo investiga monocito recalada y relacionados con el tumor angiogénesis después de la inyección de monocitos en el modelo murino de la ligadura de la arteria femoral.
Resumen
La meta terapéutica para la enfermedad arterial periférica y enfermedad isquémica del corazón es incrementar el flujo sanguíneo a áreas isquémicas causada por estenosis hemodinámica. Cirugía vascular es una opción viable en casos seleccionados, pero para los pacientes sin indicaciones para la cirugía como progresión para descanso dolor, isquemia crítica de miembros o importantes trastornos a la vida y de trabajo, hay pocas posibilidades para mitigar su enfermedad. Terapia celular mediante perfusión mejorada de monocitos a través de la estimulación de la formación de colaterales es uno de unas opciones no invasivas.
Nuestro grupo estudia Arteriogénesis después del trasplante del monocito en ratones utilizando el modelo de isquemia del miembro posterior. Previamente, hemos demostrado mejora en la perfusión de miembro posterior mediante trasplante de monocito syngeneic estimulado por el tétanos. Además de los efectos en la formación de colaterales, el crecimiento del tumor puede verse afectado por esta terapia así. Para investigar estos efectos, utilizamos un modelo de ratón de la matriz de la membrana del sótano-como mediante la inyección de la matriz extracelular del sarcoma de Engelbreth-Holm-Swarm en el flanco del ratón, después de la obstrucción de la arteria femoral.
Después de los estudios del tumor artificial, utilizamos microscopía intravital en vivo tumor angiogénesis y monocitos autoguiado hacia el blanco dentro de arterias colaterales. Estudios previos han descrito la examinación histológica de los modelos animales, que presupone el análisis subsecuente post mortem los artefactos. Nuestro enfoque visualiza homing de monocitos a las áreas de colateralización en secuencias de tiempo real, es fácil de realizar e investiga el proceso de la Arteriogénesis y tumor angiogénesis in vivo.
Introducción
Las enfermedades cardiovasculares, como cardiopatía coronaria o enfermedad arterial periférica, son las causas más comunes de muerte a nivel mundial1. La terapia celular es un enfoque prometedor para tratar la enfermedad cardiovascular, especialmente para las personas que no son capaces de someterse a intervenciones quirúrgicas. Existen varios enfoques para utilizar células o sus sustancias secretadas como una herramienta terapéutica2,3, con el objetivo general de mejorar la perfusión y mantener la función del tejido isquémico y underperfused. Un intento de lograr este objetivo es mejorar la Arteriogénesis, que mejora el desarrollo de arterias colaterales. Los monocitos son un tipo de célula importante asociado con colateralización. Nuestro grupo se ha centrado en investigar los efectos de monocitos en las áreas de inflamación4,5, en particular utilizando el modelo de isquemia del miembro posterior para inducir isquemia y subsecuente inflamación6. Monocitos hogar de áreas de la inflamación y causan respuestas sistémicas complejas que conducen al desarrollo de colateralización7.
Con el uso de la microscopia intravital, podemos estudiar el comportamiento de estas células en vivo y observar el homing de monocitos inyectados a las áreas de inflamación. Mayoría de los estudios anterior sólo describe análisis de post mortem , que desventajas incluyendo una introducción de artefactos histológicos y gran número de animales necesarios para las preparaciones. Con nuestro enfoque, podemos investigar procesos inmunológicos y formación de colaterales a través de viva imagen en múltiples puntos del tiempo.
Además el desarrollo de arterias colaterales en áreas isquémicas, monocitos también influyen en el crecimiento del tumor. Para investigar estos procesos, inyectar una matriz de la membrana del sótano-como extraída el sarcoma de ratón de Engelbreth-Holm-Swarm, un tumor rico en matriz extracelular proteínas8y analizar mediante microscopía intravital. Esta matriz se utiliza para las moléculas de la pantalla de prueba para la formación de redes de células endoteliales o terapias contra el cáncer mediante la inhibición de angiogénicos; en este caso, evaluamos el potencial angiogénico de tumor de monocitos para celular terapia9,10,11.
El objetivo de este protocolo es demostrar de una manera fácil y eficiente para estudiar procesos inmunológicos causados por isquemia en un modelo en vivo . Podemos generar un entorno de prueba más realista en comparación con el workup histológico de tejido post mortem del músculo.
Protocolo
nuestro estudio se realizó con el permiso del estado de Sajonia-Anhalt, Landesverwaltungsamt Halle, según el artículo 8 de la ley alemana de protección de los animales. (§ 8, párrafo 1 de la ley alemana de protección de los animales de 18.05.2016 - BGBI. I S. 1206, 1313, § 31 TierSchVersV de 13.08.2013).
Nota: para los experimentos se utilizaron 8 a 12 ratones BALB/c machos de semana vieja, y monocitos humanos de donantes de sangre fueron utilizadas para la visualización de los monocitos a través de microscopia intravital.
1. preparación de la célula
Nota: para el aislamiento de monocitos, por favor ver nuestro video publicado anterior en JoVE para instrucciones: " aislamiento e intravenosa inyección de murino médula ósea obtenidos Monocitos " por Wagner et al. 4
Nota: cuando trabaja con las células de todos los pasos debe ser estéril para evitar la contaminación.
- Célula tinción con 3,3 '-perclorato de Dioctadecyloxacarbocyanine
- resuspender las células en medio de cultivo libre de suero con una densidad de 1 x 10 6 células/mL.
Nota: Sólo medio libre de suero permite una coloración eficiente, ya que el tinte lipofílico sería lo contrario ya capturado por componentes lipofílicos del suero. - Añadir 5 μl de 1 mM 3,3 '-perclorato de Dioctadecyloxacarbocyanine en dimetilformamida a 1 mL de la suspensión de células y resuspender cuidadosamente.
- Incubar la solución de células a 37 ° C por 20 min.
- Centrifugar las células a 37 ° C y 500 x g por 5 min
- Desalojar el sobrenadante y resuspender las células con medio de 37 ° C caliente fetal becerro suero suplido.
- Repetir dos veces los pasos 1.1.4 y 1.1.5.
- Contar las celdas con la fórmula:

- resuspender las células con 150 μL estéril 0,9% NaCl solución.
- Inyectar las células en la vena de la cola.
- resuspender las células en medio de cultivo libre de suero con una densidad de 1 x 10 6 células/mL.
2. Anestesia
- Anestesia de inhalación
- vaporizar isoflurano con la ayuda de un vaporizador, usando una concentración del 5% en un depósito cerrado bajo una campana de seguridad química.
- Manejar el ratón con cuidado y colocarlo en la papelera de.
- Manejar los animales por la piel del cuello posterior cuando haya detenido.
- Anestesia intraperitoneal
Nota: la anestesia isoflurano uso, descrita en el paso 2.1, para realizar una inyección intraperitoneal. Con la rápida recuperación y efecto narcótico de acción corta de la anestesia isoflurano, es más fácil manejar el ratón e inyectar anestesia intraperitoneal.- Usar una solución de 2,4 mL ketamina (10%), 0.8 mL xilacina (2%) y 6,8 mL de NaCl (0,9%) para la inyección intraperitoneal.
- Pesar al animal antes de aplicar el anestésico.
Nota: La fórmula de la anestesia es:

- utilizar una jeringa de insulina 1 mL con una aguja de 30 G para inyectar la solución en el bajo vientre izquierdo.
- Colocar el ratón en su jaula y esperar efecto narcótico.
Nota: El efecto narcótico normalmente aparece dentro de 5 min si la inyección fue exitosa. La correcta profundidad de la anestesia se puede determinar por la ausencia del reflejo de la tapa o reacción a la presión del dedo del pie, así como una tasa regular y controlada de la respiración.
3. Implantación de la matriz de la membrana del sótano-como
Nota: este método se utiliza por nuestro grupo para el estudio de angiogénesis tumoral después de la inyección de monocitos. Según los experimentos, factores de crecimiento pueden agregarse a la matriz de la membrana basal-like. Se realizó ligadura de la arteria femoral antes de inyectar el tumor en el flanco del ratón. La matriz debe tener una temperatura de 4 ° C para la inyección. A esta temperatura, la matriz es líquido; el gel se endurece a un sólido a la temperatura corporal (37 ° C). Para una mejor visibilidad de la matriz subcutánea enchufe, afeitarse la piel del ratón en el sitio de inyección.
Nota: opcional: Añadir 100 ng del factor de crecimiento básico del fibroblasto, 300 ng factor endothelial vascular del crecimiento y 26 U.I. heparina bajo condiciones estériles a la matriz de la membrana del sótano como.
- Cargue 1 mL de matriz en una jeringa de insulina 30 G y tienda en hielo hasta su uso.
- Poner el animal sobre la mesa y mantener la piel del ratón al lado del sitio de inyección en el flanco.
- Inyectar 500 μl de la matriz de la membrana del sótano-como por vía subcutánea.
Nota: Por razones prácticas, es necesario inyectar la matriz de la membrana del sótano-como compacto en un solo lugar para evitar la dispersión subcutánea. Será más fácil sacar el tumor artificial del tejido después de sacrificar el ratón al final del experimento.
4. Inyección de la vena de la cola
Nota: practicar la inyección en la cola vena con solución de NaCl en animales antes de experimentación. Si los monocitos no pueden ser adecuadamente inyectados en la vena de la cola, no habrá ningún efecto sistémico en la colateralización. En este protocolo, inyectamos monocitos 2,5 millones. Tratar de inyectar no más de 5 μl/g de peso corporal.
- Utilizar la solución de monocito preparada bajo paso 1.1.8 que contienen monocitos 2,5 millones.
- Utilizar una aguja de 30 G y una jeringa de insulina 1 mL para la inyección.
- Cuidadosamente y manejar el ratón, refrenar el animal en el limitador y asegúrese de que el ratón no está dañado y tiene un espacio adecuado para la respiración.
- Poner el limitador en la almohada para que la cola puede contactar con la placa de.
- Identificar las venas de la cola, que se encuentran en el lado lateral de la cola.
- Gire la cola 90 °, para que la vena de la cola aparece en la parte superior de la cola.
- Desinfectar el lado de inyección antes de inyectar los monocitos.
- Tratar de inyectar la solución de monocitos en un ángulo de plano con el bisel de la aguja hacia arriba
Nota: Detener la inyección si aparece una ampolla, ya que es un signo de una inyección de fallido. Intente el procedimiento otra vez más proximally. - Detener el sangrado en el sitio de inyección, aplicando presión suave en la cola de unos 60 años.
- Observar el animal durante 30 min supervisar efectos secundarios sistémicos y colocar el ratón en su jaula después de que el animal se ha recuperado completamente.
5. La microscopia intravital
- preparación
- Coloque el ratón anestesiado en la almohada (37 ° C) para mantener una temperatura constante y fijar las patas en su lugar con cinta adhesiva.
- Desinfectar la piel en el sitio de la pierna o el flanco que se usa para microscopía.
- Afeitado de la región de interés para un mejor manejo y para evitar interferencias con el cabello.
- Suprimir la piel con un bisturí estéril y pinzas finas en un área cuadrada de 0,5 x 0,5 cm.
Nota: Es importante mantener la región de interés húmedas; de lo contrario, podría deteriorarse la calidad de las imágenes y tejido. Solución de NaCl se puede utilizar para humedecer la zona. - Colocar la pierna entre dos sellos ajustables y colocar un cristal encima de las estampillas.
- Asegurar el tejido es húmedo y está en contacto con el cristal.
- Injretrobulbar de dextrano de rodamina ect 50 μL en el sistema venoso para una mejor visibilidad de los vasos.
- Iniciar la microscopia y ajuste la posición de la pierna si es necesario.
- Ajustes de microscopia intravital
- encender el microscopio, computadoras, interfaces electrónicas y láseres.
- Encender la unidad de calentamiento de la cámara de incubación o fase (placa/almohadilla) y ajustar la temperatura a 37 ° C.
- Inicie el software de adquisición. Si el microscopio está equipado con un escáner de resonancia, seleccione este modo de escaneo rápido.
- Espere hasta que la temperatura alcanza un nivel constante (35-37 ° C)
Nota: Una temperatura estable es importante para: (a) el ratón, que bajo anestesia no puede controlar su temperatura corporal y (b) evitar o al menos minimiza deriva focal. Esto podría tomar 1 hora a varias horas, dependiendo de las condiciones circundantes (p. ej., sistema de aire acondicionado y el número de fuentes de calor en la habitación, incluidas las personas). Si se utilizan objetivos de inmersión, la zona de contacto entre la lente y cubierta de vidrio (o tejido) es una típica fuente de inestabilidad. La lente de la calefacción con un calentador objetivo puede ayudar; Alternativamente, un microscopio con un sistema de enfoque automático es muy recomendable. - Seleccionar una lente con una abertura numérica alta que cumple con los requisitos de la resolución del experimento (ver nota al final de esta sección).
- Optimizar la configuración del microscopio con respecto a la ganancia, ajustes del canal, velocidad de escaneo, píxeles de resolución, profundidad volumen, tamaño de paso y promedio antes de colocar el animal experimental en el escenario.
- Escaneo bidireccional para reducir el tiempo de la adquisición.
- Colocar el ratón anestesiado en la platina del microscopio precalentado después de que el microscopio ha alcanzado condiciones estables y los ajustes han sido probados con la ayuda de un muñeco.
- La región de interés dentro de la matriz de la membrana del sótano-como al enfoque mediante el uso de iluminación de luz brillante y examinar brevemente los capilares por la luz ultravioleta con la configuración de filtro adecuada para los fluoróforos aplicada.
- Cambiar a modo; de exploración iniciar la exploración en modo de baja resolución 256 x 256 y mejorar la ganancia de energía del laser hasta que una señal se observa en el monitor.
- Foco en la estructura de interés. Zoom hasta que todos los datos visibles.
- Define " Inicio " y " final " cargos en la dirección axial.
- Detener la exploración.
- Definir paso a paso (p. ej., 0,5 μm) y planos focales (e.g., 10-20).
- Interruptor para el píxel final de resolución (512 x 512 o 1.024 x 1.024) dependiendo de la velocidad del movimiento de estructuras subcelulares o células y seleccionar la exploración velocidad (frecuencia de exploración) que se adapta mejor a los movimientos. Escaneo bidireccional se recomienda sujetar la adquisición de pilas a.
Nota: Seleccione la tasa más alta de la exploración de exploración que da suficiente calidad de imagen. Típico punto escáneres proporcionan velocidades entre 400 Hz y kHz 1,4. Resonantes escáneres proporcionan un adicional de 8 kHz o 12 kHz. Reduciendo el número de líneas en la dirección y la frecuencia de barrido puede ser incrementada (los valores típicos son 512 x 512, 512 x 256 o 512 x 200 píxeles de resolución). Dependiendo de la relación de señal a ruido, se puede intentar mejorar la calidad de imagen mediante la adición de línea con un promedio de entre 2 y 4. Por lo general, un ajuste de 512 x 200 sin resultados promedio en un tiempo de adquisición de 18 ms en el modo bidireccional con un escáner de resonancia de 8 KHz; con 512 x 200 y 4 x promedio, retrasa hasta 56 ms por marco.
Resultados
La microscopia intravital de la examinación del tumor y crecimiento de vasos colaterales provocados por monocitos puede ayudar a revelar nuevos aspectos en los mecanismos moleculares del tumor angiogénesis y Arteriogénesis. Las células deben estar preparadas e inyección cuidadosamente siguiendo los pasos del protocolo. Las diferencias pueden conducir a variaciones entre experimentos individuales. Los monocitos se deben inyectar en el sistema venoso (figura 1) para mantener efectos sistémicos y evitar los émbolos, lo que pueden ocurrir si la inyección se realiza en el sistema arterial.
Si se utiliza la matriz de la membrana basal-like, inyectar lentamente para evitar la dispersión ayudará con explantation de enchufe para la examinación histológica adicional (figura 2, figura 3). Después de sacrificar el ratón, el enchufe de la matriz de la membrana del sótano-como será estos deberán retirarse desde el flanco del ratón. Dentro del matriz de la membrana del sótano-como enchufe, podemos medir la vascularización contando los capilares dentro de diferentes contextos experimentales (figura 4, figura 5).
Otra condición para los experimentos exitosos es el microscopio, que depende de software, hardware y preparación de animales (figura 6). Si estructuras subcelulares (< 2 μm) necesidad de identificarse, un microscopio vertical con 2 fotones de excitación y agua inmersión objetivos (20 X o 25 X, abertura numérica 1.0) con distancia de funcionamiento larga (> de 2 mm) son recomendables. Puesto que los objetivos de inmersión de agua con alta apertura numérica son extremadamente sensibles a las variaciones del índice de refracción, deben ajustarse la resolución de imagen óptima y brillo moviendo un collar de corrección en el objetivo. Lamentablemente, el ajuste a mano es bastante difícil debido al espacio limitado. Por lo tanto, costosos objetivos con una corrección de cuello motorizado son ofrecidos por fabricantes de microscopio.
Si celular resolución (5-10 μm) es suficiente, un 10 x secar la lente con una apertura numérica 0,4 o superior y una larga distancia de trabajo (> de 2 mm) se recomienda. En este caso, puede seleccionarse un vertical o un stand del microscopio invertido. Proyección de imagen de la célula con un objetivo seco (abertura numérica 0.4) 10 X en vivo en más altos factores de zoom (> 3) es mucho más fácil y más barato porque clásico láser confocal de barrido microscopía (es decir, 1 excitación de fotones) se puede utilizar para obtener pilas de imágenes con suficiente resolución. Si cuanto tiempo se requiere para la adquisición de imágenes, la cantidad de dextrano de rodamina en el recipiente disminuye. Para una mejor visibilidad de los vasos, la inyección de fluoróforo debe ser repetida (figura 7).
Es más eficaz a diversos ajustes de la muestra y decidir la mejor calidad de imagen posible. El uso de sondas positivos para las células o matriz de la membrana basal-like (sin trasplante) puede ayudar a obtener la configuración óptima. Podríamos detectar monocitos etiquetados mediante Microcopia intravital dentro de la sangre flujo y músculo tejido (figura 8, figura 9). La examinación histológica del tejido comprueba nuestros resultados (figura 10).

Figura 1 : Inyección de 2,5 millones de monocitos en la vena de la cola. Las venas se encuentran en el lado lateral de la cola, con arterias en la parte dorsal y ventral. Haga clic aquí para ver una versión más grande de esta figura.
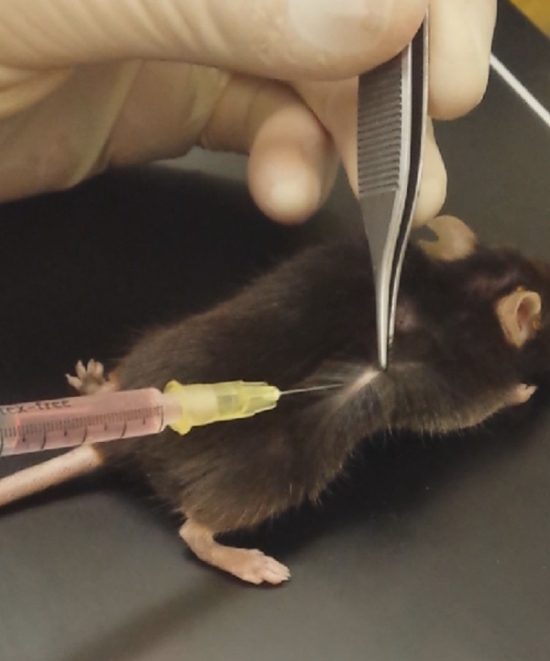
Figura 2 : Inyección de matriz de la membrana basal como. Manejar la piel del ratón e inyecte la matriz de la membrana del sótano-como en el flanco. Haga clic aquí para ver una versión más grande de esta figura.
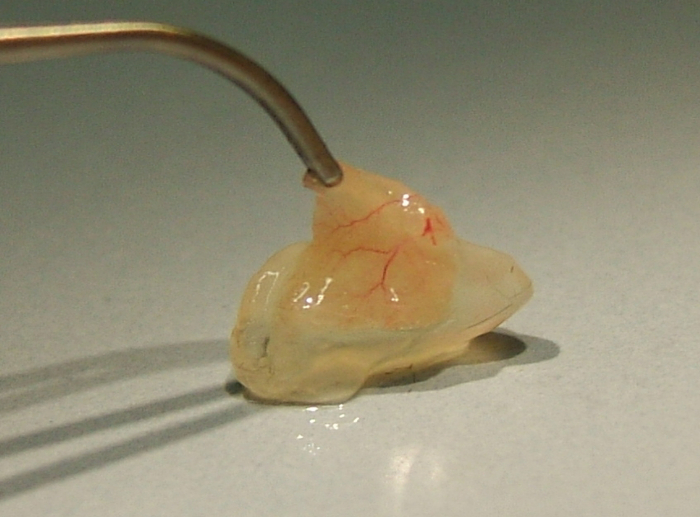
Figura 3 : Matriz explanted enchufe desde el flanco del ratón (ver punto 3.5). Vasos incorporados cinco días después del trasplante de monocitos a través de la vena de la cola. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Comparación de vascularización dentro de la matriz de la membrana basal-like (  + SD, n = 3 en cada grupo). Buques en el enchufe del matriz de la membrana basal-like, con ningún factor de crecimiento agregado (barra roja), en comparación con los vasos de matriz de la membrana del sótano-como enchufe con factor de crecimiento agregado. Los suplementos de la matriz de la membrana basal-like con factor de crecimiento conduce a un crecimiento mayor del buque. Haga clic aquí para ver una versión más grande de esta figura.
+ SD, n = 3 en cada grupo). Buques en el enchufe del matriz de la membrana basal-like, con ningún factor de crecimiento agregado (barra roja), en comparación con los vasos de matriz de la membrana del sótano-como enchufe con factor de crecimiento agregado. Los suplementos de la matriz de la membrana basal-like con factor de crecimiento conduce a un crecimiento mayor del buque. Haga clic aquí para ver una versión más grande de esta figura.
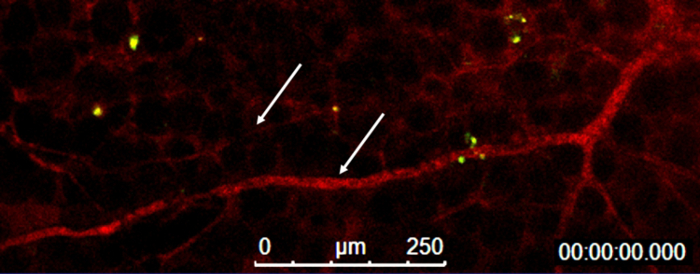
Figura 5 : Los buques en el tapón de la membrana del sótano-como matriz. Visualización de la sangre flujo (rojo) dentro de los vasos (flechas) y monocitos autoguiado hacia el blanco (verde) en el tapón de la membrana del sótano-como matriz. Haga clic aquí para ver una versión más grande de esta figura.
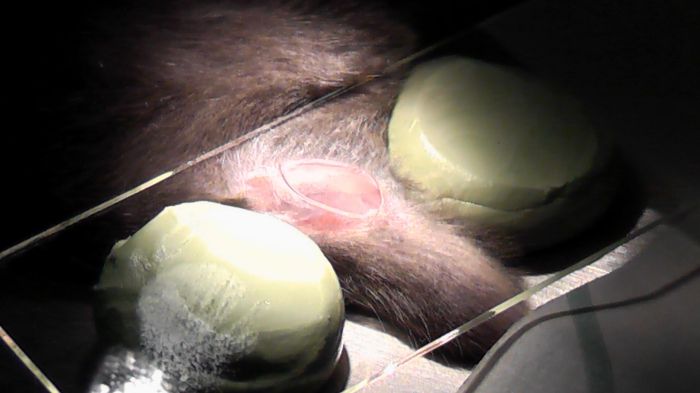
Figura 6 : Ratón preparado para la adquisición de la imagen. Las patas se fijan con cinta adhesiva y un cubierta de vidrio se coloca en la parte superior dos sellos ajustables. La región de interés fue suprimida con un bisturí. NaCl se utiliza para humedecer la zona por lo que no se verá afectada la calidad de las imágenes y tejido. haga clic aquí para ver una versión más grande de esta figura.
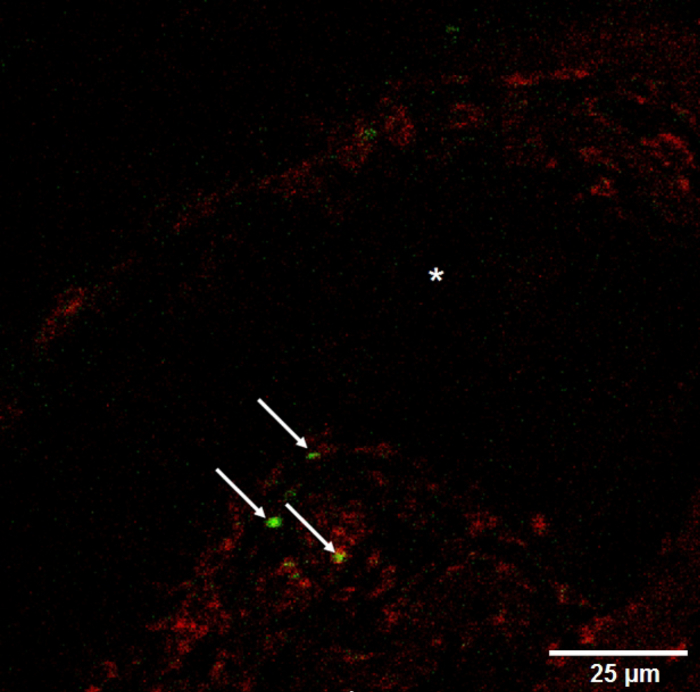
Figura 7 : Disminución de visibilidad de vasos. Perclorato de 3'-Dioctadecyloxacarbocyanine 3, teñido de monocitos (flechas) dentro de la membrana del sótano-como matriz al lado de un buque (sección longitudinal, *). Haga clic aquí para ver una versión más grande de esta figura.

Figura 8 : Monocitos lavado en el recipiente del. Visualización en vivo de 3, 3'-Dioctadecyloxacarbocyanine perclorato manchado y trasplantados monocitos (flecha verde) dentro de la arteria colateral (*). Haga clic aquí para ver una versión más grande de esta figura.
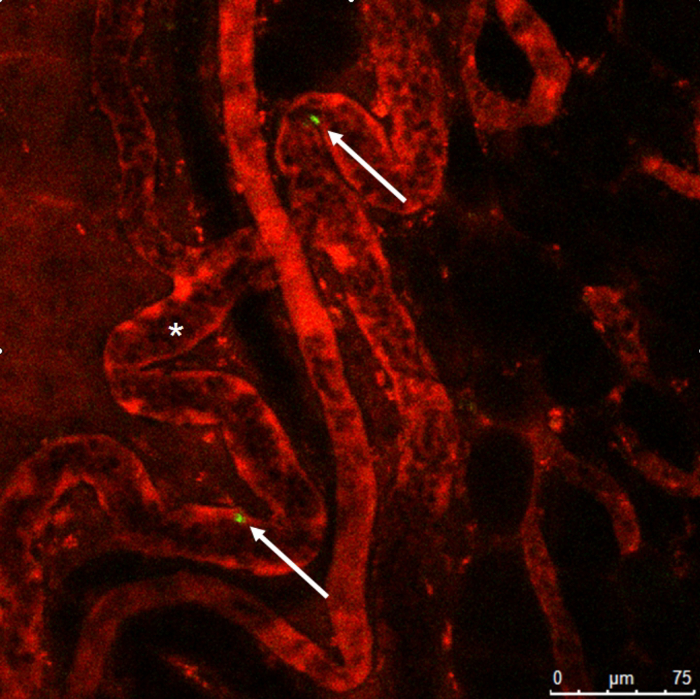
Figura 9 : Microscopia intravital. 3, 3'-Dioctadecyloxacarbocyanine perclorato manchado monocitos (flechas) dentro de los recipientes colaterales con la formación típica de sacacorchos (*) con dextrano de rodamina. Haga clic aquí para ver una versión más grande de esta figura.
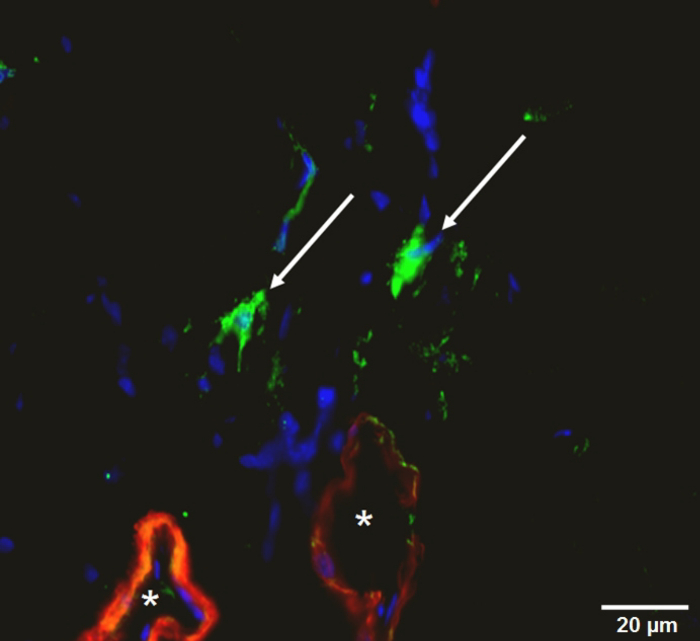
Figura 10 : Coloración de Immunohistological de la musculatura del muslo. Vasos (rojo: la actinia alfa del músculo liso, *), macrófagos (verde: 3, 3'-Dioctadecyloxacarbocyanine perclorato, flechas), núcleo de la célula (azul). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método aquí descrito arroja luz sobre el desarrollo de arterias colaterales, el comportamiento de los monocitos en estos vasos y el proceso de la Arteriogénesis. Los pasos para la aplicación de este protocolo son fáciles de aprender y puede ser utilizado en otros campos de la ciencia. A pesar de estas ventajas, existen algunas desventajas. Por ejemplo, equipo microscópico es necesario para ejecutar las técnicas descritas. Obtener equipos para un experimento es insostenible, por lo que es importante colaborar con otras instituciones para compartir los dispositivos.
Hay otras dificultades relacionadas con este protocolo que puede evitarse con la práctica. Al principio, puede haber problemas con el ratón en el microscopio de posicionamiento y calidad de la imagen puede sufrir en estas circunstancias. Otro punto crítico es la inyección de la vena de la cola. Sólo se observan monocitos en las venas si se inyecta correctamente. Por lo tanto, se recomienda practicar la inyección antes de colocar el ratón.
Aislamiento de monocitos es también crítico. Monocitos pueden ser aislados de diferentes especies con múltiples protocolos, que a menudo conducen a diversos resultados y célula rendimientos12,13,14. Es necesario trabajar en condiciones estériles para evitar la contaminación. Debe evitarse el daño celular por Pipetear cuidadosamente y mantener temperaturas constantes.
A pesar de estos inconvenientes, este método es práctico y fácil de realizar, permitiendo a los usuarios arrojar luz sobre la angiogénesis tumoral y los mecanismos básicos detrás de la enfermedad arterial periférica.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Este trabajo fue apoyado por el ELSE-Kröner-Stiftung y el DFG (Deutsche Forschungsgemeinschaft, DFG) SFB 854 (Sonderforschungsbereich, centro de investigación colaborativa). Agradecimiento especial a Hans-Holger Gärtner, Audiovisuelles Medienzentrum, Otto-von-Guericke University Magdeburg, Magdeburg, Alemania, para el soporte técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| 10% fetal calf serum (FCS) | Sigma Aldrich, Hamburg, Germany | ||
| 1% penicillin/streptomycin | Sigma Aldrich, Hamburg, Germany | ||
| 1mL Omnifix -F insuline syringe | B. Braun, Melsungen AG, Melsungen, Germany | ||
| 50 ml syringe | Fresenius Kabi AG, Bad Homburg, Germany | Injectomat- syringe 50 ml with canule | |
| 6-well-ultra-low-attachement-plates | Corning Incorporated, NY, USA | ||
| 8- 12 week old, male, C57BL/6, BalbC mice | Charles River, Sulzfeld, Germany | ||
| Adhesive tape | TESA SE, Hamburg, Germany | ||
| Acquisition Software | Leica, Wetzlar, Deutschland | Leica Application Suite Advanced Fluorescence (LAS AF); Version: 2.7.3.9723 | |
| Canules | B. Braun, Melsungen AG, Melsungen, Germany | 29G, 30G | |
| Cell culture dish | Greiner Bio-One GmbH, Frickenhausen, Germany | ||
| Cell culture medium | Manufactured by our group with single components | Medium199, 10% Fetal calf serum, 1% Antibiotic (penicillin/streptomycin) | |
| Centrifuge | Beckman Coulter GmbH, Krefeld, Germany | Allegra X-15R centrifuge | |
| Depilatory cream | Veet, Mannheim, Germany | ||
| DiO | Invitrogen Eugene, Oregon, USA | ||
| Disinfection agent | Schülke&Mayr GmbH, Norderstedt, Germany | ||
| Disposable scalpel No.10 | Feather safety razor Co.Ltd, Osaka, Japan | ||
| EDTA | Sigma Aldrich, Hamburg, Germany | ||
| Erlenmeyer flask | GVB, Herzogenrath, Germany | ||
| Ethanol 70% | Otto Fischar GmbH und Co KG, Saarbrücken, Germany | ||
| Fetal Calf Serum | Sigma Aldrich, Hamburg, Germany | ||
| Fine Forceps | Rubis, Stabio, Switzerland | ||
| Flurophor/Rhodamindextran | Thermo Fischer Scientific, Waltham, MA USA | Katalognummer: D-1819 | |
| Gloves | Rösner-Matby Meditrade GmbH, Kiefersfelden, Germany | ||
| Heating pad | Labotect GmbH, Göttingen, Germany | Hot Plate 062 | |
| Human macrophage-colony stimulating factor | Sigma Aldrich, Hamburg, Germany | SRP3110 | |
| Humane leucocyte filters | Blood preservation | ||
| Incubator | Ewald Innovationstechnik GmbH, Bad Nenndorf, Germany | ||
| Isoflurane | Baxter Deutschland GmbH, Unterschleißheim, Germany | ||
| Ketamine (10%) | Ketavet, Pfizer Deutschland GmbH, Berlin , Germany | ||
| Leukocyte separation tubes (tubes with filter) | Bio one GmbH, Frickenhausen, Germany | ||
| Light microscope | Carl Zeiss SMT GmbH, Oberkochen, Germany | Axiovert 40 C | |
| Lymphocyte separation medium LSM1077 | GE Healthcare, Pasching, Austria | ||
| Matrigel | Becton, Dickinson and Company, Franklyn Lakes, New Jersey, USA | ||
| Medium M199 | PAA Laboratories GmbH, Pasching, Austria | ||
| Microbiological work bench | Thermo Electron, LED GmbH, Langenselbold, Germany | Hera safe | |
| Microscope slide | Carl Roth GmbH + Co. KG, Karlsruhe | Art. Nr. 1879 | |
| Microscope stand with incubator and heating unit | Leica DMI 6000, Pecon, Germany | ||
| Monocyte wash buffer | Manufactured by our group with single components | PBS, 0,5% BSA, 2mM EDTA | |
| Mouse restrainer | Various | ||
| Multi-photon microscope | Leica, Wetzlar, Deutschland | Leica SP5 Confocal microscope, Cameleon, Coherent | |
| NaCl (0,9%) | Berlin Chemie AG, Berlin, Germany | ||
| Neubauer counting chamber | Paul Marienfeld GmbH und Co.KG, Lauda-Königshofen, Germany | ||
| Objective | Leica, Wetzlar, Deutschland | Leica HC PL APO 10x/0.4 CS | |
| PBS | Life technologies GmbH, Darmstadt, Germany | ph 7,4 sterile | |
| Penicillin/Streptomycin | Sigma Aldrich, Hamburg, Germany | ||
| Percoll | Manufactured by our group with single components | 90 % Percoll, 10% 1,5M NaCl, ρ= 1,064 g cm-3 | |
| Percoll solution | GE Healthcare, Bio-Science AB, Uppsala, Sweden | ||
| Pipettes | Eppendorf AG, Hamburg, Germany | 10µL/100µL/200µL/1000µL | |
| Pipettes serological | Greiner Bio-One GmbH, Frickenhausen, Germany | Cellstar2ml, 5ml, 10ml | |
| Pipetting heads | Eppendorf AG, Hamburg, Germany | ||
| Pipetus | Eppendorf AG, Hamburg, Germany | ||
| Polystyrol tube | Cellstar, Greiner Bio-One GmbH, Frickenhausen, Germany | ||
| Scissor | Word Precision Instruments, Inc., Sarasota, USA | ||
| Scale | Mettler PM4800 Delta Range, Mettler-Toledo GmbH, Gießen, Germany | ||
| Suction unit | Integra bioscience, Fernwald, Germany | Vacusafe comfort | |
| Surgical scissors | Word Precision Instruments, Inc., Sarasota, USA | ||
| Trypan blue solution 0,4 % | Sigma Aldrich, Hamburg, Germany | ||
| Tubes with cap | Greiner Bio-One GmbH, Frickenhausen, Germany | 15ml, 50ml Cellstar | |
| Xylazine (2 %) | Ceva Tiergesundheit GmbH, Düsseldorf, Germany |
Referencias
- Volz, K. S., Miljan, E., Khoo, A., Cooke, J. P. Development of pluripotent stem cells for vascular therapy. Vascular pharmacology. 56 (5-6), 288-296 (2012).
- Henry, T. D., et al. The VIVA trial: Vascular endothelial growth factor in Ischemia for Vascular Angiogenesis. Circulation. 107 (10), 1359-1365 (2003).
- Wagner, M., et al. Isolation and intravenous injection of murine bone marrow derived monocytes. Journal of visualized experiments JoVE. (94), (2014).
- Herold, J., et al. Transplantation of monocytes: a novel strategy for in vivo augmentation of collateral vessel growth. Human gene therapy. 15 (1), 1-12 (2004).
- Ito, W. D., Arras, M., Scholz, D., Winkler, B., Htun, P., Schaper, W. Angiogenesis but not collateral growth is associated with ischemia after femoral artery occlusion. The American journal of physiology. 273 (3 Pt 2), H1255-H1265 (1997).
- Herold, J., et al. Tetanus toxoid-pulsed monocyte vaccination for augmentation of collateral vessel growth. Journal of the American Heart Association. 3 (2), e000611 (2014).
- . Matrigel Matrix Available from: https://www.corning.com/au/en/products/life-sciences/products/surfaces/matrigel-matrix.html (2017)
- Eubank, T. D., Galloway, M., Montague, C. M., Waldman, W. J., Marsh, C. B. M-CSF induces vascular endothelial growth factor production and angiogenic activity from human monocytes. Journal of immunology (Baltimore, Md. 1950). 171 (5), 2637-2643 (2003).
- Fridman, R., et al. Enhanced tumor growth of both primary and established human and murine tumor cells in athymic mice after coinjection with Matrigel. Journal of the National Cancer Institute. 83 (11), 769-774 (1991).
- Woodman, S. E., et al. Caveolin-1 knockout mice show an impaired angiogenic response to exogenous stimuli. The American journal of pathology. 162 (6), 2059-2068 (2003).
- Francke, A., Weinert, S., Strasser, R. H., Braun-Dullaeus, R. C., Herold, J. Transplantation of bone marrow derived monocytes: a novel approach for augmentation of arteriogenesis in a murine model of femoral artery ligation. American journal of translational research. 5 (2), 155-169 (2013).
- Houthuys, E., Movahedi, K., Baetselier, P., de Van Ginderachter, J. o. A., Brouckaert, P. A method for the isolation and purification of mouse peripheral blood monocytes. J. Immunol. Methods. 359 (1-2), 1-10 (2010).
- Berthold, F. Isolation of human monocytes by Ficoll density gradient centrifugation. Blut. 43 (6), 367-371 (1981).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados