Method Article
細胞外マトリックスのグライコ:質量分析法を用いて無傷の糖ペプチドの分析のための方法
要約
本稿では、ECMタンパク質組成物の(1)分析、グリコシル化部位の(2)識別、およびグリカン形態の(3)組成の特徴付けを可能にするMS分析のために心臓血管組織サンプルを調製する方法を記載しています。この方法は、他の組織におけるECMの研究に、軽微な修正を適用することができます。
要約
線維症は、多くの心血管疾患の顕著な特徴であり、細胞外マトリックス(ECM)の悪化分泌および堆積に関連しています。プロテオミクスを使用して、我々は以前に、心血管組織における150以上のECMとECM関連タンパク質を同定しました。特に、多くのECMタンパク質は、グリコシル化されています。この翻訳後修飾は、タンパク質の折り畳み、溶解性、結合、および劣化に影響を与えます。我々は、無傷の糖ペプチドのその後の液体クロマトグラフィータンデム質量分析(LC-MS / MS)分析に対応しているECMタンパク質に対する逐次抽出及び濃縮方法を開発しました。戦略は、組織の脱細胞化、およびECMタンパク質の可溶化のための塩酸グアニジンのためにNaClを、SDSによる逐次インキュベーションに基づいています。 LC-MS / MSにおける最近の進歩はを可能にするような、より高いエネルギーの衝突解離(HCD)および電子移動解離(ETD)の組み合わせのような断片化方法を、含みますECMタンパク質の糖ペプチドの直接の組成分析。本論文では、組織サンプルからECMを調製する方法を記載します。この方法は、タンパク質プロファイリングもMS分析による評価およびグリコシル化の特徴付けのためにできるだけでなく。
概要
線維症は、多くの疾患の特徴です。線維芽細胞が増殖し、細胞外マトリックス(ECM)1の悪化分泌および沈着に関連している高度に合成表現型に向かって分化します。過剰なECM沈着は、機能障害につながる、最初の損傷が弱まった後でも、続けることができます。プロテオミクスを使用して、我々は以前に心臓組織2、3で150以上のECMとECM関連タンパク質を同定しました。彼らは唯一の構造タンパク質ではなく、また、継続的な改造や心臓のダイナミックな適応に貢献マトリックス細胞タンパク質およびプロテアーゼ。特に、多くのECMタンパク質が4グリコシル化されています。この翻訳後修飾(PTM)は、特定のアミノ酸位置への糖残基の付加を伴い、それが結合、タンパク質の折り畳み、溶解度に影響を与え、劣化5 アップ。
哺乳類で発生する二つの主要なグリコシル化のタイプがあります。 (1)N-グリコシル化は、Xaaは、プロリンを除く任意のアミノ酸であり、コンセンサス配列はAsn-Xaaは、Thrで/ SER内のアスパラギン残基(ASN)のカルボキサミド窒素で起こります。 (2)O-グリコシル化において、糖残基ヒドロキシプロリンとヒドロキシリシンするために、はるかに少ない程度に、セリンおよびトレオニン残基(セリン、Thrで)に付着又は。 O-グリコシル化は、タンパク質グループの様々な起こり得るが、N-グリコシル化は、分泌タンパク質または膜タンパク質5の細胞外ドメインに制限されています。 ECMを勉強するときに、N-グリコシル化に魅力的な標的になります。
プロテオミクスは、疾患におけるタンパク質の変化を分析するための新しい標準を設定します。これまでのところ、ほとんどのプロテオミクス研究では、細胞内タンパク質6に焦点を当ててきました。これは、主に次のような理由によるものです。まず、豊富な細胞内タンパク質は、同定を妨げます希少なECM成分の品名。これは、ミトコンドリア及び筋フィラメントタンパク質は、タンパク質含有量7の大きな割合を占めた心臓組織において特に重要です。第二に、一体型ECMタンパク質が重く架橋および可溶化することは困難です。最後に、豊富のPTM( すなわち、グリコシル化)の存在は、液体クロマトグラフィータンデム質量分析(LC-MS / MS)による分離及び同定の両方に影響を与える、分子量、電荷、及びペプチドの電気泳動特性を変化させます。ここ数年、私たちは、その後の質量分析(MS)分析と互換性のあるECMタンパク質のための逐次抽出および濃縮法を開発し、改善しています。戦略は、順次インキュベーションに基づいています。
最初のステップをNaCl、ECM関連し、緩く結合したECMタンパク質、ならびに新たに合成されたECMタンパク質の抽出を容易にイオン緩衝液を用いて行われます。それは私S洗剤フリー、非変性、細胞膜の無停止、およびさらに生化学的アッセイのために8やすいです。次いで、脱細胞化は、ドデシル硫酸ナトリウム(SDS)を用いて達成されます。この段階で、低いSDSの濃度は、膜不安定化及びより可溶性非整数ECM成分の破壊を防止しながら、細胞内タンパク質の放出を確実にします。最後に、ECMタンパク質をグアニジン塩酸塩緩衝液(のGuHCl)で抽出します。 GuHClは、腱9、軟骨10、容器11、12、13及び心臓2、3のような組織から高濃度架橋タンパク質およびプロテオグリカンを抽出するのに有効です。私たちは、心血管疾患2にECMリモデリングを探るために、LC-MS / MSとの組み合わせで、この生化学的分別を適用しました>、3、11、12、13、14。 MSの最近の進歩は、無傷の糖ペプチド3、15の直接分析を可能にするより高いエネルギーの衝突解離(HCD)および電子移動解離(ETD)の組み合わせ、などの新規な断片化方法が挙げられます。
ここでは、タンパク質組成物、グリコシル化部位の同定、およびグリカン形態の特性の分析を可能にするMS分析のためにECMを調製する方法を記載しています。 ECMのグリコシル化16の以前の分析と比較すると、この方法論は、MSを用いた部位特異的にグリコシル化プロファイルの組成変化を直接評価することができます。私たちは、心血管組織にこの方法論を適用しています。しかし、それができアルので、他の組織標本におけるECMの研究に、わずかな変更で、適用されるとECMの生物学に前例のない洞察を提供することができます。
プロトコル
研究では、ウォンズワース地域研究倫理委員会によって承認された(参照番号:06 / Q0803 / 37)して、研究開発事務所から制度の承認を受けました。すべての患者は書面によるインフォームドコンセントを与えました。
細胞外マトリックスタンパク質の1の抽出
注:これらの実験に使用したヒトの心房組織は、単に心の心臓麻痺逮捕後、心肺バイパス中に心耳から得ました。すべてのサンプルは、セント・ジョージ病院、ロンドン、英国で収集しました。すべての組織サンプルは、-80℃で凍結されなければなりません。架橋タンパク質ことを、パラホルムアルデヒドのような固定剤、保存したサンプルを使用しないでください。
- 抽出工程間の時間を最小限に抑えるために、 表1の通り、実験の前に全ての抽出バッファーを準備します。温度制御された環境で、室温(RT)で、すべてのインキュベーションを行います( すなわち、〜20℃)で抽出間の整合性を確保します。
- 組織の20〜50 mgの計量。いくつかのサンプルを抽出する場合は、一つ一つが、組織の完全な融解を避けるためにそれらをカットし、重量を量ります。メスを用いて、3-4小さな断片( すなわち2-3 mm)の中に組織をダイシングし、1.5mLのチューブにそれらを一緒に置きます。
- (PBS; 表1および材料の表を参照) を氷冷リン酸緩衝生理食塩水500μLを加え、血液汚染を最小限にするために5回の洗浄を行います。
- 抽出ステップ1:NaClの緩衝液とのインキュベーション
- PBSで洗浄した後、スクリューキャップ付き1.5mLのチューブにサンプルを置きます。 NaCl緩衝液を追加 組織重量:10回(W V)である( 表1を参照されたいです)。ボルテックス最小速度( すなわち、600 rpm)で1時間室温でチューブ。
注:低渦速度は、このステップの間に組織の機械的破壊を避けるために重要です。抽出時にすべてのチューブを配置するフォームアダプターを使用してください。 - 4℃で10分間16,000×gで新しいチューブと遠心分離機の抽出物を移します。使用するまで-20℃で抽出物を保管してください。簡単に述べると、新鮮な食塩緩衝液で残りの組織ペレットを洗浄します。バッファの同じタイプを使用する( すなわち、NaCl緩衝液100μL)洗浄のためには、異なる溶解度(NaClで抽出しない、すなわち、タンパク質)を有する他のタンパク質の抽出を防止します。
- 洗浄した後、その後の抽出工程を有するタンパク質含有量のオーバーラップを最小化するためのバッファの完全な除去を保証します。洗浄に使用されるNaCl緩衝液を捨てます。
注:バッファボリュームと組織重量の比が再現可能な抽出のために重要です。 10:1の比(V:w)のNaClおよびSDS抽出および5:1のGuHClステップのためのバッファを飽和させることなく、タンパク質の十分な量を提供します。タンパク質濃度がext後、約1〜2μgの/μLですraction。
- PBSで洗浄した後、スクリューキャップ付き1.5mLのチューブにサンプルを置きます。 NaCl緩衝液を追加 組織重量:10回(W V)である( 表1を参照されたいです)。ボルテックス最小速度( すなわち、600 rpm)で1時間室温でチューブ。
- 抽出ステップ2:SDSバッファーで脱細胞化
- 10倍(V:W)でのSDS緩衝液( 表1)を追加組織重量。低いSDS濃度( すなわち、0.1%)を使用することは、脱細胞化中にECMタンパク質の損失を避けるために重要です。ボルテックス最小速度( すなわち、600 rpm)で16時間室温でチューブ。
注:低渦速度はECMの機械的破壊を最小限に抑えることができます。 - 新しいチューブに抽出を転送します。 4℃で10分間16,000×gで遠心。使用するまで-20℃で保存します。簡潔に述べると、SDSを除去するためにDD H 2 Oと残りの組織ペレットを洗浄します。洗浄後の液体の完全な除去を確認してください。
- 10倍(V:W)でのSDS緩衝液( 表1)を追加組織重量。低いSDS濃度( すなわち、0.1%)を使用することは、脱細胞化中にECMタンパク質の損失を避けるために重要です。ボルテックス最小速度( すなわち、600 rpm)で16時間室温でチューブ。
- 抽出ステップ3:のGuHClバッファーとのインキュベーション
- 組織重量:5回(W V)でのGuHCl緩衝液( 表1)を加えます。渦最高速度で72時間、室温で管( すなわち、 の3,200 rpm)で。激しいボルテックスは、ECMの機械的破壊を促進します。
- 新しいチューブに抽出を転送します。 10 4°Cで分、使用するまで-20℃で保存のために16,000×gで遠心。
2.タンパク質定量と降水量
注:界面活性剤の存在に起因し、SDSバッファーが280 nmの吸光度の測定値に基づいて、直接タンパク質定量と互換性がありません。再現性の定量化を確実にするために、すべてのタンパク質抽出物17のための比色アッセイを使用しています。
- 定量。
- 直列適切な抽出緩衝液( すなわち、NaClを、SDS、またはのGuHCl)17で希釈したウシ血清アルブミン(BSA)を用いて検量線用標準液を調製。この間に、サンプル抽出物を解凍します。
- 内濃度を得るために、抽出緩衝液中の試料を希釈吸光度の直線範囲。 1:10希釈(V:V)は、満足のいく結果が得られます。比色アッセイは、> 4 MのGuHCl濃度と互換性がないように、定量のためのddH 2 Oの等量のGuHClサンプルを希釈します。
- ビシンコニン酸(BCA)を使用して96ウェルプレート中のアッセイのために、製造業者の説明書に従って、比色アッセイ17( 材料の表を参照)ベース。少なくとも重複測定を実行することをお勧めします。
- 30分間インキュベートした後、BSA標準較正曲線17を用いてタンパク質濃度を計算するために、570ナノメートルの波長での吸光度の読みを取ります。
- タンパク質沈殿
- 雪解けのGuHClをRTで抽出します。アリコートを新しいチューブに各サンプルについて10μgのタンパク質。直接糖ペプチドの分析のために、一定分量の50μg。エタノールとincuの10倍のボリュームを追加BATE一晩-20℃。
注:のGuHClは、さらに酵素反応とほとんどの電気泳動のアプリケーションとの互換性はありません。 GuHClの除去は、脱グリコシル化およびトリプシン消化の前に必要とされます。タンパク質18の約98%の回収率を得ながら、エタノール中のGuHClの溶解度と、逆に、タンパク質の低溶解度は、のGuHClの効果的な除去を可能にします。 - 4℃で30分間16,000×gでサンプルを遠心分離し、上清を吸引します。沈殿したペレットを乱さないように注意してください。 RTで真空濃縮し( 材料の表を参照)を用いて15分間、ペレットを乾燥させます。
注:プロトコルはここで停止することができ、乾燥したペレットを使用するまで-20℃で保存しました。 - 必要に応じて、品質管理として、ゲル電気泳動を実行する(QC、 補足の方法を参照のこと)。
- 雪解けのGuHClをRTで抽出します。アリコートを新しいチューブに各サンプルについて10μgのタンパク質。直接糖ペプチドの分析のために、一定分量の50μg。エタノールとincuの10倍のボリュームを追加BATE一晩-20℃。
3.シーケンシャル脱グリコシル化N-グリコシル化部位占有の評価
- 試料乾燥(ステップ2.2.2を参照)の間に、 表1のとおり、枝切り脱グリコシル化酵素を含有する脱グリコシル化緩衝液を調製します。製品の詳細については、 資料の表を参照してください。
- 各サンプルに酵素を含む脱グリコシル化緩衝液10μLを追加します。サンプルの迅速な渦とスピンダウンを実行することにより、適切なペレットの再懸濁を確認してください。
注:脱分枝酵素を用いて糖モノマーの除去は、O結合型複合糖質の後続と完全に除去するために必須であり、PNGアーゼFによってN結合型糖の後の切断を容易にします。 - 37°Cまで温度II.Increaseヘパリナーゼによるヘパラン硫酸の除去を可能にし、穏やかに撹拌しながら36時間インキュベートし、25℃で2時間インキュベートします。
注:、低反応体積および長期のインキュベーション時間を考えるとインキュベーターシェーカーを使用し、しっかりと、複数の1.5mLの浴槽を詰めます約45℃のインキュベータの内側に傾いて50mLのコニカルチューブ内部ES。 - 36時間後、16,000×gで1分間サンプルを遠心分離 そして蒸発 約45分間、RTで真空濃縮器を用いて試料からH 2 O。
- 50 U / mLのPNGアーゼFを含有するH 2 18 Oの10μLで乾燥試料を再懸濁し、切断する脱アミド化反応における全てのアスパラギン結合グリカン。
注:得られたアスパラギン酸は、MS分析中のN-グリコシル化の存在を示す2.98ダの過剰量を、運びます。 - インキュベーターシェーカーで一定の攪拌下、37℃で36時間インキュベートします。
4.溶液内トリプシン消化
注:この手順は、非脱グリコシル化の両方のために行う( すなわち、直接糖ペプチドの分析に使用)および脱グリコシル化されたサンプルされなければならない( すなわち、グリカンOCの評価のために使用cupancy)。
- (前の手順で示されるように)N-グリコシル化部位占有の評価のための総タンパク質10μgのを使用。直接グリコペプチド解析のために意図されたサンプルについて、開始量として50μgのタンパク質を使用します。
注:次の手順は、10μgのタンパク質のために記載されています。必要に応じて第evolumes( すなわち、5回50μgのための)スケールアップ。 - それぞれ6 M尿素および2 Mチオ尿素の最終濃度で、9 M尿素および3 Mチオ尿素を使用して、各サンプルのアリコートにタンパク質を変性(10μLの試料について、例えば 、尿素/チオ尿素の20μL)。
- 100mMのジチオトレイトール(:10mMのDTT、3.33μL、最終濃度)を添加することによってタンパク質を減少させます。 240rpmで攪拌しながら1時間37℃でインキュベートします。
- 0.5 Mヨードアセトアミド(50mMの3.7μL、最終濃度)を加えることによってアルキル化を行う前にRTにサンプルを冷却します。 1時間暗所でインキュベートします。
- -20(予備冷却に使用°C)をアセトン(サンプルの6倍体積)を-20℃で一晩試料をインキュベートします。 4℃で25分間14,000×gでの遠心分離によって沈殿します。
- 上清を吸引除去します。沈殿したペレットを乱さないように注意してください。 RTで30分間真空濃縮器を用いてタンパク質ペレットを乾燥させます。
- 0.1 M重炭酸トリエチルアンモニウム(TEAB)緩衝液、pH 8.2の20μLに再懸濁し、含有トリプシン(0.01μgの/μL)、37℃および240 rpmで一晩消化します。
- 10%トリフルオロ酢酸(TFA、1%TFAの最終濃度のために2μL)を用いてサンプルを酸性化することによって消化を停止します。
C18カラムを用いて5ペプチドのクリーンアップ
注:消化後、ペプチド混合物から汚染物質を干渉の除去はイオン抑制を低減し、信号対雑音比及び配列カバー率を向上させることができます。このステップは、両方の非脱グリコシル化および脱グリコシル化SAの行われるべきですmples。
- 1分間1000×gで遠心分離ウェル当たりメタノール200μLを用いて、C18スピンプレート上に樹脂を( 材料の表を参照) を活性化します。
- 1分間1000×gで遠心H 2 O中80%アセトニトリル(ACN)と、0.1%TFAのウェル当たり200μLを添加することによって洗浄します。
- 1分間1000×gで遠心H 2 O中1%ACN、0.1%TFAのウェル当たり200μLを添加することによって平衡化。このステップをさらに2回繰り返します。
- 1分間1,500×gで樹脂と遠心分離機を含むウェルにステップ4からのサンプル(全体積)を読み込みます。フロースルー二度目をリロードし、遠心分離を繰り返します。
- 1分間1500×gで遠心H 2 O中1%ACN、0.1%TFAのウェル当たり200μLを添加することによって洗浄します。このステップをさらに2回繰り返します。
- 1分間1500×gで遠心H 2 O中の50%ACN、0.1%TFAのウェル当たり170μLの試料を溶出します。前の手順を繰り返しますそして回収した溶出液を兼ね備えています。
- RTで2時間、真空濃縮器を使用して溶出液を乾燥させます。それはすぐに使用されていない場合は、使用するまで-80℃で乾燥させたサンプルを保ちます。
注:タンパク質同定のために意図脱グリコシル化サンプルは、このステップの後にLC-MS / MSのために使用する準備ができています。ステップ6および7は、これらのサンプルには必要ありません。 - 0.5μg/μLの最終タンパク質濃度になるようにH 2 O中の2%ACN及び0.05%TFAで脱グリコシル化されたサンプルを解凍し、再懸濁します。非脱グリコシル化サンプルの直接糖ペプチド解析のためのステップ6に進みます。
- 必要に応じて、前タンデム質量タグ(TMT)で標識したペプチドをフィルタリングします。ペプチドfitrationのための補助メソッドを参照してください。
TMT 6.標識化(ダイレクト糖ペプチド分析用のみ)
- 1μg/μLの濃度を得るために、50mMのTEABの50μLで乾燥したペレットを解凍し、再懸濁します。
- ResusPED TMTゼロの0.8 mgのバイアルACNの41μLで試薬(TMT 0は 、 材料の表を参照のこと)。再懸濁のために、メーカーのrecommendantionsに従ってください。
- 0.4mgのTMT 0〜50のμgのペプチドの割合(TMT 0の20.5μLのペプチドの、すなわち、50μL)でのペプチドサンプルを標識します。室温で1時間インキュベートします。
- 比6で5%のヒドロキシルアミンを添加することにより、標識反応をクエンチ:100(5%のヒドロキシルアミン、すなわち、4.23μL)。室温で15分間インキュベートします。
- 真空濃縮器を用いて、RTで1時間TMT 0 -標識ペプチドサンプルを乾燥させます。 ddH 2 O10μlに再懸濁
注:原因グリカン残基に、糖ペプチドは、非グリコシル化ペプチドよりも高い分子量を表示します。 TMT 0は、糖ペプチドの電荷状態を増加させます。これは、(M / Z)比を充電するためにそれらの相対質量を減少させ、ETDフラグメンテーションを容易にします。
7。糖ペプチド濃縮
- キット( 材料の表を参照)内に設けられた反応緩衝液を使用します。
- ステップ6.5からの各10μLのサンプルへの結合緩衝液50μLを加えます。それが均一になるまでglycocapture樹脂溶液をボルテックス。 15を捕捉系両性イオン性親水性相互作用液体クロマトグラフィー(ZIC-HILIC)を使用します。
- 新しい1.5 mLチューブに樹脂懸濁液のアリコートを50μL。 2,500×gで1分間スピンし、上清を除去します。樹脂ペレットを含むチューブに試料の60μL( すなわち、結合緩衝液で試料)を加えます。ピペットを用いて混合し、1,200rpmで攪拌しながら20分間室温でインキュベート。
- 2,000×gで2分間遠心し、新しいチューブに上清を移します。チューブを保管してください。樹脂チューブを洗浄緩衝液150μLを加えます。ピペットを用いて混合し、1,200rpmで攪拌しながら10分間室温でインキュベート。
- 2,500×gで2分間スピン。転送(ステップ7.4からの)は、同じチューブに上清。洗浄は2回ステップを繰り返します。
- 溶出バッファーの75μLを加え、ピペットを用いて混ぜます。 RTで5分間1,200rpmで攪拌し、次いで2,500×gで2分間チューブを遠心します。新しい1.5 mLチューブに上清を移します。洗浄工程を繰り返した後、同じチューブに溶出液上清を移します。
- 遠心2,500×gで2分間の溶出液( すなわち、糖ペプチド)を含有するチューブ。前のステップからの残りの樹脂の除去を確実にするために、新しいチューブに上清を移します。
- 室温で約2時間、真空濃縮器を用いて、溶出物の合計150μLを乾燥させます。 ddH 2 O中の2%ACN及び0.05%TFAの15μLで乾燥ダウン糖ペプチドを再懸濁
- 糖ペプチドの特徴付けのためのHCDとETDフラグメンテーションを用いてECMタンパク質組成物を分析するHCDフラグメンテーションを使用し、そしてLC-MS / MS、LC-MS / MSを実行するように進みます。セクション8を参照してください。
8.質量分析
- ECMタンパク質組成物を分析するHCDフラグメンテーションを使用してLC-MS / MSを行います。詳細については、 補足メソッドを参照してください。
- (詳細は補足の方法を参照)、糖ペプチドの特徴付けのためのHCDとETDフラグメンテーションを用いたLC-MS / MSを行います。濃縮された試料は非濃縮入力材15と比較されるべきです。
注:間接的な糖ペプチドの分析、直接糖ペプチドの分析、およびデータベース検索のためのLC-MS / MS法の詳細な説明は補足方法で提供されています。質量分析法を用いてECMタンパク質およびグリカン組成物を特徴づけることに興味の研究者は、以前の刊行物3、11、15を参照することが奨励されます。
結果
プロトコルの概略的なワークフローを図1に提供されます。
ECM抽出プロトコル
抽出の効率は、アリコートを実行することによってモニターすることができるビス - トリスアクリルアミドゲル上の各抽出物を形成し、視覚化のために銀染色を用いました。 図2Aは、逐次抽出後のNaCl、SDSとのGuHCl抽出物の相補性を示します。このQCは、過剰なタンパク質分解などのサンプル品質の潜在的な問題の識別を可能にします。抽出後、ECM糖タンパク質は、のGuHCl抽出物( 図2B)において豊富です。
脱グリコシル化
脱グリコシル化の効率を評価するために、非脱グリコシル化制御は、PAで実行する必要がありますrallel。脱グリコシル化時間は、図3(a)に例示したように、糖残基の完全かつ均質な除去を達成するために適していることがあります。 図3Bは、効率的に小さくN-およびO-結合オリゴ糖を標的化GAGの除去および脱グリコシル化酵素の酵素の添加によって脱グリコシル化試料の代表的な例を示しています。
グライコプロテオミクス
NXT / Sのセクオンの占有率を評価するためのプロトコルは、MS( 図3C)の後ECM糖タンパク質についてのタンパク質配列カバー率を改善し、糖タンパク質の存在の最初のスクリーニングを可能にします。データベースが以前に同定された糖タンパク質を含むようにカスタマイズすることができ、これは、糖ペプチドのための検索時間を短縮するのに役立ちます。 HCD-ETDフラグメンテーションは、ECM gに取り付けられたオリゴ糖の同定および組成特徴付けのために使用されています lycoproteins。 図4Aは、脱グリコシル化(間接的な糖ペプチド分析)の後に18 Oで標識されたペプチドについて得られた代表的なスペクトルを表示します。 図4Bは、ECM抽出物から無傷の糖ペプチド(直接糖ペプチド分析)の分析後に得られたスペクトルの代表例です。

図1:メソッドの概要。 (A)ECMタンパク質について順次濃縮した後、LC-MS / MS分析は、脱グリコシル化された抽出物に対して行われます。 (B)あるいは、非脱グリコシル化されたECM抽出物をさらに糖ペプチドについて濃縮されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
2" SRC = "/ファイル/ ftp_upload / 55674 / 55674fig2.jpg" />
図2:ECMタンパク質の抽出。 (A)逐次抽出手順(「英語クイックステップ」)から、3つの異なる抽出物は、それらのタンパク質含有量に相補的です。 SDS抽出物は、細胞内タンパク質に富んでいるが、のGuHCl抽出物は、ECMタンパク質の大部分を含んでいます。成功した分別は異なる銀染色パターンにより可視化されます。 (B)ECMタンパク質は、小ロイシンリッチプロテオグリカンのデコリン、バイグリカン及びmimecanとして主SDSおよびNaCl抽出物中のほとんど存在と、のGuHCl抽出物中で検出されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
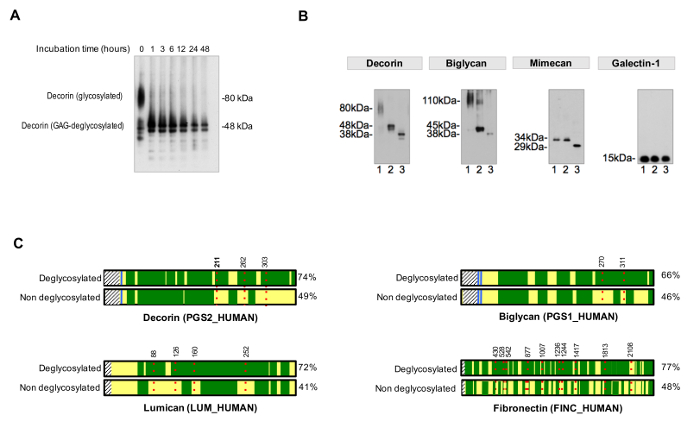
図3. Glycの分析osylation。 (A)は、適切なインキュベーション時間は、完全な脱グリコシル化のために必要とされます。例は、糖タンパク質デコリンからのグリコサミノグリカン鎖の除去の間インキュベーション時間の効果を示しています。 (B)ECM糖タンパク質は、大規模で繰り返しグリコサミノグリカン鎖と短い多様なN-およびO-結合オリゴ糖が施されています。イムノブロットの各々の上のレーン1は、未処理の心臓抽出物を表します。レーン2は、グリコサミノグリカンを消化する酵素で処理した抽出物を含んでいます。レーン3のサンプルは、加えて、N-およびO-結合oligossacharidesを除去するための酵素を含みます。ガレクチン-1は、したがって、タンパク質の大きさには変化がない、グリコシル化されていません。リンチM、 らから適応。 図4(C)LC-MS / MS分析では、H 2 18 Oの存在下でPNGアーゼFで処理した試料は、非脱グリコシル化されたサンプルと比較して(右側%)より良好な配列カバレッジを達成します。 DLC-MS / MSによって配列カバレッジを表す緑色領域をアーク。赤い点線は、それらのアミノ酸の位置を示す数字と、glycositesを表します。位置におけるデコリンのグリコシル化の検出211のAsn(N、太字で強調)は、図4に一例として詳細に示されている。この図のより大きなバージョンを表示するにはここをクリックしてください。
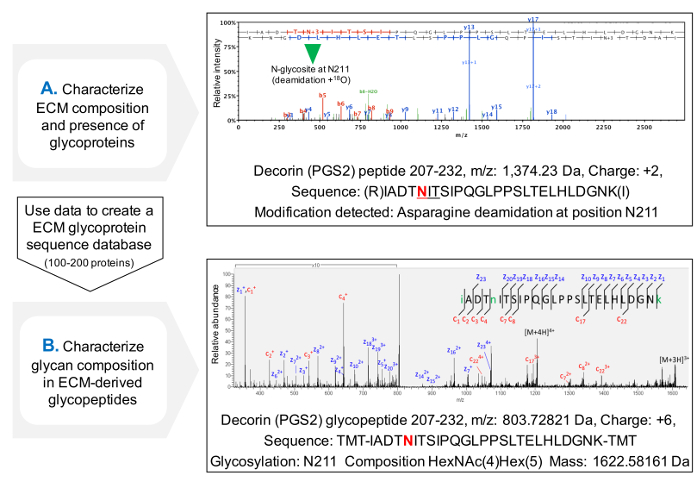
図4. MSによる糖ペプチドの分析。 (A)ECM富化された抽出物にショットガンプロテオミクスアプローチを用いて、糖ペプチドをNXT / Sのセクオン内の脱アミド化アスパラギンの存在によって同定され、18 Oで標識することができる例は、含有デコリンのペプチドに対するHCD MS / MSスペクトルを示します以前のAsn 211にグリコシル化。得られたデータを使用することができますECM糖タンパク質のカスタマイズされたデータベースを作成します。 (B)HCD-ETDフラグメンテーションは、グリコペプチド富化ECM抽出物を分析するために使用されます。 ETD MS / MSスペクトルは、グリカン組成の特徴付けを可能にします。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| A.ストック溶液 | |
| DTT(ジチオトレイトール、C 4 H 10 O 2 S 2) | 100のddH 2 Oで1 mMのDTT |
| EDTA(エチレンジアミン四酢酸、C 10 H 16 N 2 O 8) | ddH 2 O、pH8.0中の250mM EDTA。 |
| GuHCl(塩酸グアニジン、CH 6 CLN 3) | 8 MのGuHCl中ddH 2 O. |
| IAA(ヨードアセトアミド、C 2 H 4 INO) | ddH 2 O 1,2における500mMのIAA |
| 酢酸ナトリウム(酢酸ナトリウム、C 2 H 3 NaOが2) | ddH 2 O中1M酢酸Na、pHは5.8。 |
| NaCl(塩化ナトリウム、NaCl)で | ddH 2 O中1MのNaCl |
| リン酸ナトリウム二塩基(リン酸二ナトリウムのNa 2 H 2 PO 4) | DD H 2 O、pHを6.8に1 Mリン酸ナトリウム二塩基。 |
| SDS(ドデシル硫酸ナトリウム、のNaC 12 H 25 SO 4) | ddH 2 O 3 1%SDS(35ミリモル) |
| TFA(トリフルオロ酢酸、C 2 HF 3 O 2) | ddH 2 O中の10%TFA(1.2 M) |
| TEAB(重炭酸トリエチルアンモニウム、C 7 H 17 NO 3) | ddH 2 O、pH8.5の中での1M TEAB |
| チオ尿素(チオ尿素、CH 4 N 2 S) | ddH 2 Oで3 Mチオウレア |
| トリス-HCl(トリス-塩酸(NH 11 C 4 O 3 [塩酸]) | ddH 2 O、pH7.5中の100mMのTris-HCl。 |
| 尿素(尿素、CH 4 N 2 O) | ddH 2 O 9 M尿素 |
| B.反応バッファー | |
| C18クリーンアップ平衡緩衝液 | ddH 2 O中1%ACN、0.1%TFA |
| C18クリーンアップカラム洗浄バッファー | H 2 O中80%ACN、0.1%TFA |
| C18のクリーンアップの溶出バッファー | ddH 2 O中の50%アセトニトリル、0.1%TFA |
| 脱グリコシル化バッファー(4×) | 600mMのNaClおよびのddH 2 O、pHは6.8で200mMのリン酸Na。 |
| GuHClバッファ4 | 4 M塩酸グアニジン、50mMの酢酸ナトリウムとのddH 2 O中に25mMのEDTA、pHは5.8。使用前にプロテアーゼ阻害剤のカクテル:100(V V:1)を追加します。 |
| NaCl緩衝液4 | 0.5MのNaCl、10mMのトリス-HClとのddH 2 O中に25mMのEDTA、pHは7.5。使用前にプロテアーゼ阻害剤のカクテル:100(V V:1)を追加します。 |
| PBS(1×) | 1.7 mMのKH 2 PO 4、5mMののNa 2 HPO 4、150mMのNaCl、pH7.4中。使用前にプロテイナーゼ阻害剤カクテル:100(V V:)、25mMのEDTA及び1を加えます。 |
| サンプルバッファー(4×) | 100mMのTris、2%SDS、のddH 2 O、pH6.8の中40%グリセロール、0.02%ブロモフェノールブルー。使用前に10%のβメルカプトエタノールを追加します。 |
| SDSバッファー4 | O. 1の追加のddH 2中0.1%SDSおよび25mM EDTA:100(V:V)プロテイナーゼインヒビターBEFのカクテル鉱石の使用。 |
| C.酵素 | |
| コンドロイチナーゼABCの5 | 0.5脱グリコシル化緩衝液(1×)でU / mLの |
| ケラタナーゼ5 | 0.1脱グリコシル化緩衝液(1×)でU / mLの |
| ヘパリナーゼII 5 | 0.1脱グリコシル化緩衝液(1×)でU / mLの |
| α2-3,6,8,9 -ノイラミニダーゼ(シアリダーゼ)5 | 脱グリコシル化緩衝液(1×)で0.025 U / mLの |
| β1,4ガラクトシダーゼ5 | 脱グリコシル化緩衝液(1×)で0.015 U / mLの |
| β-N-アセチルグルコサミニダーゼ5 | 脱グリコシル化緩衝液(1×)で0.25 U / mLの |
| エンドα-N-アセチルガラクトサミニダーゼ(O-グリコシダーゼ)5 | 脱グリコシル化緩衝液(1×)で0.013 U / mLの |
| PNGアーゼF(N-グリコシダーゼF)6 | 5H 2 18 O中0 U / mLの |
| トリプシン | TEABバッファーで0.01μgの/μL |
| テーブルNOTES。 | |
| 1 -20℃で凍結保存溶液を保管してください。 | |
| 2 IAAは、光から保護し維持しなければなりません。 | |
| 3 SDS容易に<20℃で結晶化します。 1%SDS(原液)の可溶化を促進するために、熱い水道水で緩衝液を温めます。 | |
| 4つの抽出バッファは室温で保存することができます。使用前に示されるように、プロテアーゼ阻害剤の広域スペクトルのカクテルを追加します。 | |
| 5これらの酵素は、第一脱グリコシル化工程の間に添加されるべきです。 | |
| 6 PNGアーゼFは、第二の脱グリコシル化工程の間に添加されるべきです。 | |
表1:株価ソリューション、反応緩衝液および酵素。このテーブルは、MS分析の前に心臓ECMタンパク質の抽出、(酵素的消化を含む)以降の処理に必要な各ストック溶液を、反応緩衝液の組成を示しています。
ディスカッション
このプロテオミクスプロトコルは、我々の研究室で過去数年間に最適化されています。ここでは、心臓組織を使用したが、わずかな調整は、他の組織への適用のために必要となる場合があります。例えば、抽出プロトコルを考慮に組織の細胞性を取る必要があります。心臓組織、血管組織と比較して高い細胞です。血管組織を使用する場合、SDS濃度が低い( すなわち、0.08%)であることができ、脱細胞化時間が短い( すなわち 4時間)11、12、13です。脱グリコシル化酵素の使用は、ECM組成物のLC-MS / MS分析のために重要です。しかし、インキュベーション時間は、異なる組織タイプのために調整する必要があります。 (データは示していない)( 例えば、アグリン、パールカン)基底膜タンパク質が豊富で皮膚などのサンプルを使用する場合、例えば、25℃でII必要拡張インキュベーション時間をヘパリナーゼ。直接糖ペプチド解析は、培養液15中の細胞からの馴化培地上で実行することができます。濃縮手順は、この単純化されたsubproteomeの分析のために必要とされない場合があります。 GuHCl抽出物と同様に、NaClの抽出物はまた、小さな変更を有するグライコプロテオミクス分析のために適しています。 ECMタンパク質の濃縮のための他の抽出プロトコルは、ECM糖ペプチド19、20を特徴付けるために適合させることができます。
グリコシル化は、最も複雑なPTM 5です。糖ペプチドの間接的な同定は、NXT / Sのシークオンに組み込ま18 Oで脱アミド化Asnでの検出によって達成されます。他の位置で脱アミド化Asnが偽陽性を表すことができます。同様に、Nグリコシル化は、タンパク質オントロジーの文脈で考慮されなければならない:NXT / Sのシークオンを含む細胞内タンパク質はグリコシル化されることはありませんが、偽陽性を生じる可能性があります。現在searcとして、Hアルゴリズムは所定の配列のみ(NXT / Sで、すなわち ASN)でのPTMのスクリーニングを可能にしない、データの手動フィルタリングが必要とされます。これらの位置でのグリコシル化の存在/非存在の同定は、疾患と対照試料間で比較することができます。 O-脱グリコシル化のためのPNGアーゼFへの酵素と同等( すなわち、トレオニンまたはセリンに質量シフトを導入する)が存在しません。従って、O-グリコシル化の同定は、直接糖ペプチドの分析に限定されます。直接グリコペプチド解析は、タンパク質に付着した糖の組成情報を得るために使用されるが、グリカンの構造的な情報を提供しません。また、グリカン組成物は、分泌後のグリカン合成およびプロセシングの結果です。
ECMタンパク質のための私達の3段階抽出法(「英語クイックステップ」)6は、心臓血管組織の様々なECMを特徴付ける可能にしました。組織の分別他所6論じたように、いくつかの抽出に簡略化されたECMプロテオームを得るために必要とされます。細胞内タンパク質は、そうでなければあまり豊富ECMタンパク質の同定を妨げる抽出物中のタンパク質の存在量の過剰なダイナミックレンジに貢献します。また、細胞内タンパク質は、ECM糖ペプチドの濃縮及びその後のMS分析を複雑になるO -グリコシル化5を運びます。他の著者は、しかし、彼らはグリコシル化の分析を追求していなかった、例の肺21と軟骨組織10のために特徴付けるために同様の抽出方法論を適用します。 glycositesの識別に焦点を当てたグリコシル化の前の分析は、タンパク質コアからのグリカンの除去を必要とし、O-グリコシル化22、23を評価することはできません。レクチンアレイと化学濃縮は、グリカン標準の評価のために用意されてい生物学的サンプルのESは、それらの結合特異性に基づいて、これらの技術は、特定のタンパク質24にグリカンタイプを割り当てることができないも、彼らは、グリコシル化部位を評価することができます。
最初に、我々は、従来のECMタンパク質のLC-MS / MSにゲル電気泳動を使用します。ゲル分離は、LC-MS / MS分析に適し簡略化されたタンパク質画分を得る上で有用であるが、最新の機器は、より速いスキャン速度を提供します。このように、電気泳動分離工程を省略することができます。ゲルの上に保持されている大型のECMタンパク質は、より効率的に分析され、これは付加的な利点を提供します。しかし、完全なタンパク質のMwに関する情報が失われます。 PNGアーゼF脱グリコシル化前に蒸発工程は、偽陰性を最小限に抑えるために、通常のH 2 Oの完全な除去を保証します。糖残基( すなわち、可変グリカン質量)LCによる分離に干渉し、MS / MSによって後続ペプチド同定を損ないます。 P- 脱グリコシル化プロトコルはまた、グリコシル化に焦点を当てていないECMタンパク質のプロテオミクス解析のために推奨されます。
プロテオミクスはECMに前例のない洞察を提供することができます。構造的な支持を超えて、ECMに添付グリカンは、臓器移植後の同種移植片拒絶反応、 すなわち宿主-病原体相互作用、細胞間コミュニケーションと免疫応答25のために不可欠です。グライコプロテオミクスは糖鎖生物学に不可欠なツールとなるでしょう。
開示事項
なし。
謝辞
JBBは王の英国心臓財団センターでのキャリア構築フェローです。 MMは、英国心臓財団(FS / 13/29892分の2)のシニアフェローです。研究は優秀イニシアティブ(優れた技術のためのコンピテンス・センター - COMET)によってサポートされていましたオーストリアの研究振興事業FFGの「血管における優秀研究センターエイジング - チロル、VASCage」(K-プロジェクト番号843536)とNIHR生物医学研究をキングスカレッジ病院との提携でガイさんとセントトーマスの国民保健サービス財団トラストとキングス・カレッジ・ロンドンを拠点センター。
資料
| Name | Company | Catalog Number | Comments |
| A. Chemicals | |||
| Acetonitrile, MS-grade (ACN, C2H3N) | Thermo Scientific | 51101 | 5.2-5.8, 6.2, 7.11, Supp 2, 3, 4 |
| Cocktail of proteinase inhibitors | Sigma-Aldrich | P8340 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Disodium phosphate (Na2H2PO4) | Sigma-Aldrich | S7907 | 3.1 |
| Dithiotreitol (DTT, C4H10O2S2) | Sigma-Aldrich | D0632 | 4.3 |
| Ethylenediaminetetraacetic acid (EDTA, C10H16N2O8) | Sigma-Aldrich | E9884 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Ethanol (C2H6O) | VWR | 437433T | 2.2.1 |
| Guanidine hydrochloride (GuHCl, CH6ClN3) | Sigma-Aldrich | G3272 | 1.6.1 |
| Glycerol (C3H8O3) | Acros organics | 158920025 | Suppl 1.1 |
| H2O LC-MS Cromasolv | Sigma-Aldrich | 39253-1L-R | Throughout the protocol |
| H218O | Taiyo Nippon Sanso | FO3-0027 | 3.5 |
| Hydroxylamine (HA, H3NO) | Sigma-Aldrich | 467804 | 6.4 |
| Iodoacetamide (IAA, C2H4INO) | Sigma-Aldrich | A3221 | 4.4 |
| Phosphate-buffered Saline (PBS), 10X | Lonza | 51226 | 1.3 |
| Sodium acetate (C2H3NaO2) | Sigma-Aldrich | S7545 | 1.6.1 |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | 1.4.1, 3.2 |
| Sodium dodecyl sulfate (SDS, NaC12H25SO4) | Sigma-Aldrich | 466143 | 1.5.1 |
| Triethylammonium bicarbonate (TEAB, C7H17NO3) | Sigma-Aldrich | 11268 | 4.7, 6.1 |
| Trifluoroacetic acid (TFA, C2HF3O2) | Sigma-Aldrich | T62200 | 4.8, 5.2-5.8, 7.11, Supp 2, 3 |
| Thiourea (CH4N2S) | Sigma-Aldrich | T8656 | 4.2 |
| Tris-hydrochloride (Tris-HCl, NH11C4O3[HCl]) | Sigma-Aldrich | T3253 | 1.4.1, Suppl 1. |
| Urea (CH4N2O) | Sigma-Aldrich | U1250 | 4.2 |
| Name | Company | Catalog Number | Comments |
| B. Enzymes | |||
| α2-3,6,8,9-Neuraminidase (Sialidase) | EDM Millipore | 362280 (KP0012) | 3.1 |
| β1,4-Galactosidase | EDM Millipore | 362280 (KP0004) | 3.1 |
| β-N-Acetylglucosaminidase | EDM Millipore | 362280 (KP0013) | 3.1 |
| Chondroitinase ABC | Sigma-Aldrich | C3667 | 3.1 |
| Endo-α-N-acetylgalactosaminidase (O-glycosidase) | EDM Millipore | 362280 (KP0011) | 3.1 |
| Heparinase II | Sigma-Aldrich | H6512 | 3.1 |
| Keratanase | Sigma-Aldrich | G6920 | 3.1 |
| PNGase-F (N-Glycosidase F) | EDM Millipore | 362280 (KP0001) | 3.5 |
| Trypsin | Thermo Scientific | 90057 | 4.7 |
| Name | Company | Catalog Number | Comments |
| C. Reagent kits | |||
| 30 kDa MWCO spin filters | Amicon, Millipore | 10256744 | 5.9, Suppl 2 |
| Macro SpinColumn C-18, 96-Well Plate | Harvard Apparatus | 74-5657 | 5.1 |
| NuPAGE Novex BisTris Acrylamide Gels | Thermo-Scientific | NP0322PK2 | Suppl 1 |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | 2.1.3 |
| ProteoExtract Glycopeptide Enrichment Kit | Merk Millipore | 72103 | 7 |
| Tandem mass tag 0 (TMT0) | Thermo Scientific | 900067 | 6.2, 6.3 |
| Name | Company | Catalog Number | Comments |
| D. Equipment and software | |||
| Acclaim PepMap100 C18 Trap, 5mm x 300µm, 5µm, 100Å | Thermo Scientific | 160454 | Suppl 3, 4 |
| Acclaim PepMap100 C18, 50cm x 75µm, 3µm, 100Å | Thermo Scientific | 164570 | Suppl 3 |
| Byonic Search Engine | Protein Metrics | Version 2.9.30 | Suppl 5 |
| Dionex UltiMate 3000 RSLCnano | Thermo Scientific | n/a | Suppl 3, 4 |
| EASY-Spray Ion Source | Thermo Scientific | ES081 | Suppl 4 |
| EASY-Spray PepMap RSLC C18, 50cm x 75µm, 2μm, 100Å | Thermo Scientific | ES803 | Suppl 4 |
| Mascot Search Engine | Matrix Science | Version 2.3.01 | Suppl 3 |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFADBMBHQ | Suppl 4 |
| Proteome Discoverer Software | Thermo Scientific | Version 2.1.1.21 | Suppl 3, 5 |
| Picoview Nanospray Source | New Objective | 550 | Suppl 3 |
| Q Exactive HF Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFALGMBFZ | Suppl 3 |
| Savant SpeedVac Concentrator | Thermo Scientific | SPD131DDA | 2.2.2, 3.4, 4.6, 5.7, 6.5, 7.11 |
| Scaffold Software | Proteome Software | Version 4.3.2 | Suppl 3 |
参考文献
- Porter, K. E., Turner, N. A. Cardiac fibroblasts: at the heart of myocardial remodeling. Pharmacol. Ther. 123 (2), 255-278 (2009).
- Barallobre-Barreiro, J., et al. Proteomics analysis of cardiac extracellular matrix remodeling in a porcine model of ischemia/reperfusion injury. Circulation. 125 (6), 789-802 (2012).
- Barallobre-Barreiro, J., et al. Glycoproteomics reveals decorin peptides with anti-myostatin activity in human atrial fibrillation. Circulation. 134 (11), 817-832 (2016).
- Lynch, M., Barallobre-Barreiro, J., Jahangiri, M., Mayr, M. Vascular proteomics in metabolic and cardiovascular diseases. J. Intern. Med. 280 (4), 325-338 (2016).
- Varki, A., Lowe, J. B., Varki, A. Biological Roles of Glycans. Essentials of glycobiology. 2nd ed. , (2009).
- Barallobre-Barreiro, J., Lynch, M., Yin, X., Mayr, M. Systems biology - opportunities and challenges: The application of proteomics to study the cardiovascular extracellular matrix. Cardiovasc. Res. , (2016).
- Agnetti, G., Husberg, C., Van Eyk, J. E. Divide and conquer: the application of organelle proteomics to heart failure. Circ. Res. 108 (4), 512-526 (2011).
- Mason, R. M., Mayes, R. W. Extraction of cartilage protein-polysaccharides with inorganic salt solutions. Biochem. J. 131 (13), 535-540 (1973).
- Vogel, K. G., Peters, J. A. Isolation of proteoglycans from tendon. Methods. Mol. Biol. 171, 9-17 (2001).
- Wilson, R., et al. Comprehensive profiling of cartilage extracellular matrix formation and maturation using sequential extraction and label-free quantitative proteomics. Mol. Cell. Proteomics. 9 (6), 1296-1313 (2010).
- Barallobre-Barreiro, J., et al. Extracellular matrix remodeling in response to venous hypertension: proteomics of human varicose veins. Cardiovasc. Res. 110 (3), 419-430 (2016).
- Didangelos, A., Yin, X., Mandal, K., Baumert, M., Jahangiri, M., Mayr, M. Proteomics characterization of extracellular space components in the human aorta. Mol. Cell. Proteomics. 9 (9), 2048-2062 (2010).
- Didangelos, A., et al. Extracellular matrix composition and remodeling in human abdominal aortic aneurysms: a proteomics approach. Mol. Cell. Proteomics. 10 (8), (2011).
- Grandoch, M., et al. Loss of biglycan enhances thrombin generation in apolipoprotein E-deficient mice: Implications for inflammation and atherosclerosis. Arterioscler Thromb. Vasc. Biol. 36 (5), e41-e50 (2016).
- Yin, X., Bern, M., Xing, Q., Ho, J., Viner, R., Mayr, M. Glycoproteomic analysis of the secretome of human endothelial cells. Mol. Cell. Proteomics. 12 (4), 956-978 (2013).
- Parker, B. L., et al. Quantitative N-linked glycoproteomics of myocardial ischemia and reperfusion injury reveals early remodeling in the extracellular environment. Mol. Cell. Proteomics. 10 (8), (2011).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal. Biochem. 150 (1), 76-85 (1985).
- Pepinsky, R. B. Selective precipitation of proteins from guanidine hydrochloride-containing solutions with ethanol. Anal. Biochem. 195 (1), 177-181 (1991).
- de Castro-Brás, L. E., et al. Texas 3-step decellularization protocol: looking at the cardiac extracellular matrix. J. Proteomics. 86, 43-52 (2013).
- Naba, A., Clauser, K. R., Hynes, R. O. Enrichment of extracellular matrix proteins from tissues and digestion into peptides for mass spectrometry analysis. J Vis Exp. (101), e53057 (2015).
- Decaris, M. L., et al. Proteomic analysis of altered extracellular matrix turnover in bleomycin-induced pulmonary fibrosis. Mol. Cell. Proteomics. 13 (7), 1741-1752 (2014).
- Zhang, H., Li, X. J., Martin, D. B., Aebersold, R. Identification and quantification of N-linked glycoproteins using hydrazide chemistry, stable isotope labeling and mass spectrometry. Nat. Biotechnol. 21 (6), 660-666 (2003).
- Parker, B. L., et al. Site-specific glycan-peptide analysis for determination of N-glycoproteome heterogeneity. J. Proteome Res. 12 (12), 5791-5800 (2013).
- Li, Y., et al. Simultaneous analysis of glycosylated and sialylated prostate-specific antigen revealing differential distribution of glycosylated prostate-specific antigen isoforms in prostate cancer tissues. Anal. Chem. 83 (1), 240-245 (2011).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix: an ever-changing and diverse entity. Circ. Res. 114 (5), 872-888 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved