Method Article
単離、分化、および血液からヒト抗体を分泌するB細胞の定量化:体液性免疫の機能読み出しなどのELISpot
要約
Human peripheral blood is commonly used for the assessment of the humoral immune response. Here, the methods for isolating human B cells from peripheral blood, differentiating human B cells into antibody (Ab)-secreting B cells (ASCs) in culture, and enumerating the total IgM- and IgG-ASCs via an ELISpot assay are described.
要約
体液性免疫の特徴は、合成し、そのような病原体としての抗原(Ag)から、固有の腹筋を分泌し、宿主防御のために使用される機能のASCを、生成することです。個体の体液性免疫応答の機能状態を定量的に決意するために、血清のAb及び循環のASCの両方は、一般的に機能的な読み出しとして測定されます。ヒトにおいては、末梢血は、宿主B細胞によって誘発される体液性免疫応答を決意するために使用することができる最も便利で容易にアクセス可能な試料です。 ASCを含む異なるB細胞サブセットは、系統特異的抗体コンジュゲートビーズまたはフローサイトメトリーで細胞選別を介して選択を介して、末梢血から直接単離することができます。また、精製されたナイーブ及びメモリーB細胞を活性化し、培養中のASCに分化させることができます。抗体分泌に貢献するのASCの機能活性は、酵素を収束するアッセイであるエリスポットによって定量することができます- 結合immunoabsorbanceアッセイ(ELISA)およびウエスタンブロッティング技術は、単一細胞レベルでの個々のASCの列挙を有効にします。実際には、ELISpotアッセイは、ますますために血液試料の多数の取り扱いの容易さのワクチンの有効性を評価するために使用されています。末梢血からのヒトB細胞を単離する方法は、 インビトロでのASCへのB細胞の分化、および総IgM-およびIgG-ASCを定量化するためのELISpotの使用は、ここで説明します。
概要
B細胞は、体液性免疫の発達において中心的な役割を果たしています。彼らは当初、骨髄で開発し、さらなる発展のために、ナイーブ脾臓などのリンパ組織へと移動することができるB細胞、リンパ節、および扁桃として血流を入力してください。銀遭遇すると、いくつかのナイーブB細胞が胚中心B細胞は、記憶B細胞および形質(PBS)/プラズマ細胞(パソコン)に分化することができるリンパ濾胞へ移行します。ほとんどのPB / PCが血流に発信されているが、いくつかは、最終的には長寿命のパソコン1に最終的に分化するために骨髄に存在します。循環中のB細胞は不均一であり、かつ定常状態で、PBS / PCは、末梢血2で稀です。系統特異的表面マーカーの利用可能性の結果として、フローサイトメトリー末梢血中のB細胞サブセットの同定および特徴付けのための一般的な方法となっています。フローcytometrの拡張アプリケーションYは、高純度で分離し、B細胞の個々のサブセットの単離を可能にするセルソーター機能の追加です。異なる発生段階の特定の表面受容体の発現に基づいて、人間の循環B細胞は一般的に3つの主要な亜集団に分類される、記憶B細胞(CD19 + CD27 + CD38 - )、ナイーブB細胞( - - CD38 CD19 + CD27)、およびPBS /パソコン(CD19 + CD27 + CD38 +)3-4( 図1)。本質的にナイーブB細胞はのAgに遭遇していません。しかし、それらはIgM抗体+ CD27 +メモリーB細胞に分化することができます。ナイーブB細胞(BCR)関連分子( 例えば、CD19、CD20およびCD22)、B細胞抗原受容体を発現に均質であるが、それらは、免疫グロブリンレパートリー5に不均質です。 CD27 +メモリーB細胞の大部分はCD27に分化することができます+ /ハイCD38 + PBS /パソコン6。また、メモリーB細胞およびPBS / PCはポリクローナルであり、発達および機能異質4-7を示します。循環中のPB / PCは、通常短命であり、CD138を発現しないが、骨髄に落ち着くために作られたものは、末端分化し、長寿命となります。最終的に分化したPCは、CD138を発現し、その表面8上にCD27分子をダウンレギュレートします。 PBSおよびPCの両方が腹筋を分泌することができるので、多くの場面では、それらを総称したASCと表記されています。対照的に、ナイーブB細胞や記憶B細胞のいずれもは、ABS 9-10のかなりの量を生成することができます。適切な培養条件6、11-15に置かれたとき、10日-単離された場合、それにもかかわらず、両方のナイーブ及びメモリーB細胞は、3でのASCに分化させることができます。実際には、ASCを、それらの直接分離されたFRとCD27とCD38のインビトロ分化を共有同様の表面式から導出しますオム末梢血6。また、in vitroで分化したASCは、PBS /パソコン6の循環同様の表面CD20の低レベルを発現します。文化由来のASCは、すべての短命ですが、彼らは機能的に有能で、体液性免疫に貢献することが可能であることを示す、ABS樹脂を分泌することができます。
遠くで最も一般的に適用される方法は、体液性免疫応答の機能情報を取得することにより、ELISAおよびエリスポットの両方があります。 ELISAは、96ウェルプレートに基づくアッセイであり、しばしば血清Ag特異ABSおよび他の検体( 例えば、サイトカイン)の力価を測定するために使用されます。これは、便利かつスケーラブルです。 ELISAは、液体試料16中、ABS又は血清のような他の物質の存在を検出するための固相酵素アッセイを使用するように設計されています。血清のELISAからの読み出しが広く体の免疫応答を表すために使用されてきました。再取得のために必要なツールELISAアッセイからadoutsは、分光光度マイクロプレートリーダーです。リーダは、典型的には、西洋ワサビペルオキシダーゼ(HRP)共役検出ABSおよびその特異的な基質17の反応から得られる最終生成物の光学密度(OD)を決定することができます。体液性免疫応答の報告に関して、ELISAによって決定した血清抗体レベルは、体内でのASCの集団ではなく、個々の性能を示します。また、ELISAは、アカウントに腹筋を分泌しない記憶B細胞による参加を取ることができません。
ELISAのように、エリスポットは、末梢血サンプル17-18で免疫応答を検出し、監視するための広く用いられている方法です。 ELISpotは、サンドイッチELISAに関連する技術です。その中で、細胞をポリビニリデンジフルオリド(PVDF)短期培養のためのマイクロプレートの96ウェルの膜・バックウェルに配置されています。 ELISpotアッセイは、マイクロプレートとdevelopinにウェスタンブロッティングを行うに類似していますグラム各ウェルのPVDF膜上のスポット。自動ELISPOTリーダーシステムやマニュアルの計数のための実体顕微鏡が必要です。免疫応答を検出するのELISpotの主な利点は、ASCにおよびサイトカイン分泌細胞の定量化におけるその優れた感度です。それは、それぞれ、体液性および細胞性免疫におけるそれらの機能の活動を報告します。体液性免疫機能の測定では、ELISAおよびELISPOTによって列挙されたASCの数によって決定される血清抗体レベルは、しばしば相関しているが、これらの2つのアッセイからのデータ読み出しは、機能的意味19-20でいくつかの違いがあります。エリスポットの主な利点は、この方法の感度です。 Abの適切なアイソタイプの既知量を参考のために含まれている場合に、ELISAによって報告されているように、血清抗体力価のレベルは、濃度の読み出しとして、より定量的に相対的な抗体のレベルを示す、ODの読み出しとして半定量的に提示、またはされています。対照的に、のELISpotの結果はpresenteあります関心対象の細胞プールでのASCの絶対数としてD( 例えば、未分画の末梢血単核細胞(PBMC)及びPBMCから精製したB細胞)。エリスポットは、単一のASCを検出することができますが、ELISAは、測定前に最適化されたアッセイに依存する濃度に到達するのASCからのAbの量を必要とします。したがって、エリスポットは、定量化の感度のELISAに明らかに優れています。また、エリスポットはまた、活性化された記憶B細胞のインビトロ分化のASCを定量化するのに適しています。記憶B細胞は、ABSを分泌しないが、活性化の際のASCに分化することができます。彼らは、したがって、ELISAによって検出された血清のAbsへの貢献を持っていません。従って、エリスポットは、培養中の活性化した後、記憶B細胞の循環の免疫応答の測定で選択する方法です。これは、長期的な体液性免疫の維持の監視を可能にします。
プロトコル
ヒト末梢血は、インフォームドコンセントの下で健康なドナーから得なければならない、と血液サンプルの使用は、個々の治験審査委員会によって確立され承認されたガイドラインに準拠する必要があります。本研究では、フローサイトメトリーの結果のデモンストレーションでは、ヒトの血液を使用するプロトコル( 図1)およびELISPOTアッセイ( 図3)は、国立台湾大学病院(プロトコル番号201307019RINB)の内部審査委員会によって承認されました。
ヒト末梢血B細胞の1単離および精製
- K 2 EDTA(1.5〜2.0ミリグラム/ mLの血液)を含む15-mLのチューブに(肘に肘窩の前方で)肘正中皮静脈から血液の〜10mLのを描画し、すぐに凝血塊を防止するために、チューブを数回転倒形成。
- P;(121℃、15分)、オートクレーブ処理の35 mLを加え、赤血球(RBC)溶解バッファー(150mMのNH 4 Cl を 、10mMのKHCO 3、および1mM EDTA新鮮な血液サンプル(≥3を含有するチューブにH 7.4):1体積/体積)をし、もはやより5分間室温(RT)でインキュベート。
注:管を通る光の透過の外観は、RBC溶解が完了したことを示しています。 - 室温で5分間600×gで遠心分離します。ペレットの色が白であることを確認してください。
- ステップ1.3のように遠心分離器;オートクレーブしたリン酸緩衝生理食塩水(pH7.4のPBS、137mMの塩化ナトリウム、2.7のKCl、4.3 mMののNa 2 HPO 4、および1.47 mMのKH 2 PO 4)10mLでペレットを再懸濁。
- 、その後プレート:上清を捨てRPMI 1640培地(10%ウシ胎児血清、100 U / mLのペニシリン/ストレプトマイシン、0.25 / mlのアンホテリシンB、および2mM L-グルタミンサプリメント)10mLでペレットを再懸濁10 cmの培養皿(皿当たり10mlの血液)への細胞。 30分間、5%CO 2で37℃のインキュベーターに皿を置きます。
- 静かに培養皿を数回旋回し、配置15-mLのプラスチック製コニカルチューブに培地(浮遊細胞)。培養皿に接着細胞(主にマクロファージ)を捨てます。
- 室温で5分間600×gで遠心分離します。上清を捨てます。
- RPMI 1640培地1mLでペレットを再懸濁します。血球計数器または自動細胞カウンターで細胞数をカウントします。
注:分離された白血球の生存率は、通常、トリパンブルー排除によって90%以上です。 - 10×10 6細胞/ mL - 5の濃度で工程1.7と同様に遠心分離し、冷PBS緩衝液〜200μL(0.5%ウシ血清アルブミン(BSA)および2mM EDTA)中で細胞を再懸濁します。
- 10 6個の細胞あたり(B細胞の負の選択のための)血液細胞に特異的なビオチン化抗ヒト抗体カクテルの5μLを加え、30分間21氷上でインキュベートします。
注:抗ヒト抗体カクテルは、少なくともCD2(またはCD3)、CD14、およびCD16に特異的な腹筋を含める必要があります。 - 10倍過剰量を追加滅菌PBSの細胞、5分間600×gで遠心分離し、上清を廃棄します。
- ペレットにストレプトアビジン結合マイクロビーズ(10 6細胞あたり5μL)の等量を加え、よく混ぜます。
- 15-mLのプラスチック円錐管中で30分間氷上でインキュベートします。
- チューブにPBS緩衝液2mLのを追加します。
- 磁気スタンドにチューブを置き、8分間RTでインキュベートします。茶色のマイクロビーズは徐々に次の磁石22に管壁に付着します。
- チューブを磁気スタンドに残っていると、慎重に新しい滅菌15 mLチューブ22に上清を移します。
- 繰り返しは、1.16から1.14までを段階的に説明し、手つかずのB細胞を含む2つの上清を兼ね備えています。マイクロビーズを捨てます。
- 室温で5分間600×gで遠心分離します。上清を捨てます。
- 下流の実験のためにRPMI 1640培地中でペレットを再懸濁。
注:一般的に、1から5×10 5 B細胞のウィットHA末梢血10mLの95%を超える純度が23を単離することができます。
2.精製および単離されたB細胞からのメモリとナイーブB細胞の分離
- ステップ1から精製された細胞を使用し、血球計または自動セルカウンターを用いて細胞数を決定します。
- 5分間600×gで遠心分離し、RT後の冷PBS緩衝液100μLで細胞を再懸濁します。
- 10 6個の細胞あたりビオチン化CD27 mAbを2μgの氷上で30分間インキュベート- 1を追加します。
- 5分間、600×gでチューブと遠心分離機にPBS緩衝液の10 mLを加え。
- 上清を捨て、PBS緩衝液の50μLで細胞を懸濁します。
- 15 mLのプラスチックコニカルチューブ中の細胞に- (2μgの/ 10 6細胞1)ストレプトアビジン磁性マイクロビーズの等量を追加します。
- 穏やかによく混合し、氷上で30分間インキュベートします。
- チューブにPBS緩衝液3mLの - 2を追加します。
- 置き磁気スタンドにチューブとは、茶色のマイクロビーズが磁石に近い側に取り付けることができるように、8分間RTでインキュベートします。
- 磁気スタンドでの管で、慎重に新しい滅菌チューブに上清画分を転送します。ナイーブB細胞-この画分は、濃縮されたCD27が含まれています。
- マイクロビーズを含むチューブに5 mLを加え、穏やかにマイクロビーズを再懸濁( すなわち、CD27 +メモリーB細胞の濃縮分画)24-25。
- 室温で5分間600×gで遠心分離します。下流の実験のためのRPMI 1640培地でペレットを再懸濁します。
注:典型的には、約30 - B細胞の60%が健康なドナー7、25-26のPBMCからCD27 +記憶細胞として精製することができます。
ナイーブB細胞、メモリーB細胞、およびPBS /パソコンのコレクションのソート3.セル
- ステップ1から精製された細胞を用いて、hemocytomeを用いて細胞数を決定しますターまたは自動セルカウンター。
- 5-mLのポリスチレンチューブ中で、mL当たり10 7の濃度で冷PBS緩衝液中で細胞を再懸濁します。
- 10 6個の細胞当たりのヒトIgGを2μgおよびFcブロックのために10分間氷上でインキュベート- 1を追加します。
- 1μgの抗CD19-APC(クローン:HIB19)のそれぞれを追加し、抗CD27-eFluor450(クローン:O323)、および抗CD38-PE(クローン:HIT2)10 6細胞あたり。よく混ぜ、30分4、27氷上でインキュベートします。
- ステップ3.4の最後の5分で、商業7-アミノD(7-AAD)の5μLを追加します。
- 5分間、600×gでチューブ、ボルテックスし、遠心分離機にPBSの2ミリリットルを追加します。
- 15 mLチューブに、mL当たり5×10 7細胞- 1の濃度で(2%BSAおよび2mMのEDTAを含む滅菌PBS)バッファーを並べ替え中に細胞を再懸濁します。
- 細胞塊を除去するためにナイロンメッシュセルストレーナー(40μmの孔サイズ)を介して細胞をフィルタリングします。
- フローサイトメトリーソートして細胞を分離紫色(405 nm)と、青(488 nm)で、赤色(640nmの):えー3つのレーザを搭載しました。
注:単独の青色レーザーは、27-28サイトメトリー3色のフローのために十分です。 - ナイーブB細胞(CD19 + CD27 - )を同時に収集するための3つの15 mLチューブ(RPMI培地5mlを含有する)にソート細胞、記憶B細胞(CD19 + CD27 +)、およびPBS /パソコン(CD19 + CD27 + /ハイ CD38 +)3-4、28。
注:ステップ4で説明したようにソートさナイーブおよびメモリーB細胞を培養することができます。
ナイーブB細胞-単離されたヒトCD19 + B細胞、CD19 + CD27 +メモリーB細胞、およびCD19 + CD27のインビトロ分化4.
- 手順1.19、2.10、2.11および3.10で精製された細胞を用いて、血球計または自動セルカウンターで細胞数を決定します。
- RPMI 1640培地で細胞を再懸濁1の濃度- 、mL当たり10×10 5、12ウェルプレートのウェルにそれらをアリコート。
- 5μgの/ 10 6細胞/ mLの18、29でのCpG(ODN 2006)を追加します。
- 5日間培養し、5%CO 2、37℃インキュベーターで細胞。
- 各ウェルから細胞を採取、15-mLのチューブに別々に配置し、各チューブにPBSの5 mLを加え、5分間600×gで、室温でそれらを遠心分離します。
- 血球計数器または自動細胞カウンターを用いて細胞を数えます。 RPMI 1640培地で、mL当たり10×10 5から1までの濃度で細胞を再懸濁します。
5.エリスポットアッセイ
- 30秒間ELISPOTプレートの各ウェルに蒸留水に35%エタノールの30μLを加えます。
注:ピペッティングすると、すべての回でウェル中の膜には触れないでください。 - エタノールを除去したELISpotプレートを反転。
- 各ウェルにオートクレーブ滅菌のddH 2 Oの150μLを入れ、インキュベート室温で5分間、それらは、残留エタノールをオフにフラッシュします。 3分間室温で滅菌PBSの洗浄に従ってください。
注:5.3から5.1までは、プレートの製造に応じて、任意であるステップ。 - ELISPOTプレートの各ウェルに(PBS中)抗ヒトIg抗体(IgG + IgM抗体+型IgA)の5μg/ mlのポリクローナルF(ab ')2フラグメントの50μLを入れ、4℃で一晩(好ましい)でそれらをインキュベートまたは2時間11 37℃です。
注:使用するまでパラフィルムでプレートの端をシール。 - たびに、未結合のAbを除去し、各ウェルに200μlのPBSを追加し、3分間室温で二度、それらをインキュベートし、プレートを反転。
- 遮断するための各ウェルに5%BSA(またはRPMI 1640培地)を含むPBSを200μLを追加し、室温で2時間、それらをインキュベートします。
- ブロッキングバッファーを除去するためにプレートを反転。ステップ5.5のように、PBS200μlで各ウェルを二回洗浄します。
- 各ウェルにRPMI 1640培地100μLを加え、37℃でそれらをインキュベートします。
- 準備ができた細胞をシードするときは、RPMI 1640培地を除去するためにプレートを反転。
- シード100μL(5×10 4)、50μL(2.5×10 4)、および(ステップ1.19、2.10、2.11、3.10から、および4.6)細胞の25μL(1.25×10 4)のウェルにELISPOTプレート。 RPMI 1640培地で、/だけでなく150μLにボリュームをもたらします。
注:細胞をプレーティングするための1つまたは2つの2倍連続希釈の最小値が推奨されます。 - 14時間18から8のために、5%CO 2で37℃インキュベーターで培養します。インキュベーション中にプレートを移動しないでください。
- 細胞およびRPMI 1640培地を除去するためにプレートを反転。
- 3分間、室温で毎回5回(0.05%のTween 20を含むPBS)を200μL/ウェルのPBS-Tのを追加し、それらをインキュベートします。 5回の洗浄との間に洗浄バッファーを除去するためにプレートを反転。
- IgGの検出、1のFcγ特異的、ヤギ抗ヒトIgGアルカリホスファターゼ(AP)のいずれかを追加するABS(:PBS-Tで5,000)またはヤギ抗ヒトIgM-AP、Fcμフラグメント固有のAbs(IgM抗体検出、1:PBS-Tで5,000)指定されたウェルに、暗所で室温で2時間インキュベートします。
- ステップ5.5のように、PBS200μlで各ウェルを二回洗浄します。
- 50μL/ウェルのブロモクロロインドリルリン酸ニトロブルーテトラゾリウム(BCIP / NBT)基質溶液を追加します。 15分 - 紫色の斑点は、通常5に表示されます。
- スポットの過剰発生を防止するために、100μL/ウェルのddH 2のOを追加します。
- すべてのスポットの完全な開発後に水道水でプレートを洗浄します。
- プレートの暗渠を削除し、それらは暗闇の中で空気乾燥することができます。
- 画像取得/解析部( 例えば、自動スキャナまたは手動で解剖顕微鏡を介して)で自動化プレートリーダーを使用してスポットをカウントします。
注意:プレートを暗所で室温で保存し、後で分析することができます。
結果
PBMCを赤血球および接着細胞(1.7から1.2ステップ)の枯渇させました。細胞のアリコート(2×10 6)を 、ナイーブB細胞、メモリーB細胞、及びPBS /末梢血中のPC( 図1)の集団を説明するためにフローサイトメトリー分析に供しました。このドナーのPBMCにおける、リンパ球の約10%がCD19 + B細胞でした。 B細胞区画において、CD19 + CD27の百分率-ナイーブB細胞は約50%でした。一方、CD19 + B細胞の約50%がCD27 +メモリーB細胞7、25-26ました。注目すべきは、CD27 +メモリーB細胞は、さらに、IgDの4を含めて分離することができます。 2、30-31 -のPB循環の表現型は、より良い低または無表面CD20の発現(CD19 + CD27 + /ハイ CD38 + CD20 LO /)で定義することができます。死細胞、7-AADを除外するには細胞染色(ステップ3.5)に含まれ、及び7-AAD 対 FSCためのプロットは、生細胞(7-AAD - )集団をゲーティングを可能にすることができます。
ELISpotアッセイの重要なステップは、 図2に示されています。精製されたヒトB細胞およびCD19 + CD27 +記憶B細胞の両方は、5日間のRPMI 1640培地でのCpGの存在下で培養しました。細胞は、新たに出現したASCを定量するためのELISpotアッセイのために回収しました。存在する場合、既存のPBは、48時間11で出て死んでしまう末梢血から単離しました。 ELISpotアッセイを行い、自動プレートスキャナにより取得されたスポット像を図3に示されます。 10 4個の細胞11に50 -のIgG-たASCの数は10であるのに対し、5日間のCpGで処置した10 4 B細胞から200のIgM-のASC -のELISpotの結果は、典型的には50が表示されます。
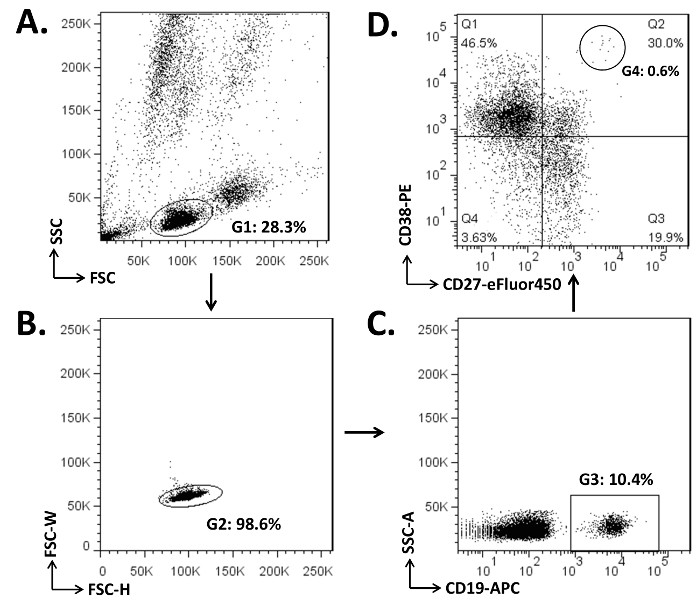
ナイーブB細胞、メモリーB細胞、及びPBMC中のPBを分離するためのゲーティング戦略の 図1. イラスト。 (A)細胞(2×10 6)は、CD19-APC、CD27-eFluor450、およびCD38-PEモノクローナル抗体(ステップ3.4)の各2μgで染色しました。リンパ球コンパートメントは、側散乱(SSC)対前方散乱(FSC)のドットプロットに(G1)にゲートされました。貼り合わせ2細胞によって形成されている(B)細胞ダブレットは、FSC-H(高さ)対FSC-W(幅)についてのプロットに(それらの外G2)は除外しました。 (C)CD19 + B細胞は、SSC-A(面積)およびCD19-APCのためのプロット上G3としてゲートしました。 CD19 +細胞の(D)、CD27およびCD38のパラメータのドットプロットは、ナイーブB細胞(CD19 + CD27 - ; Q1およびQ4)を示し、記憶B細胞(CD19 + CD27 +を 、Q2とQ3)、およびPBS(CD19 + CD27 + /ハイ CD38 +、G4、Q2の0.6%)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
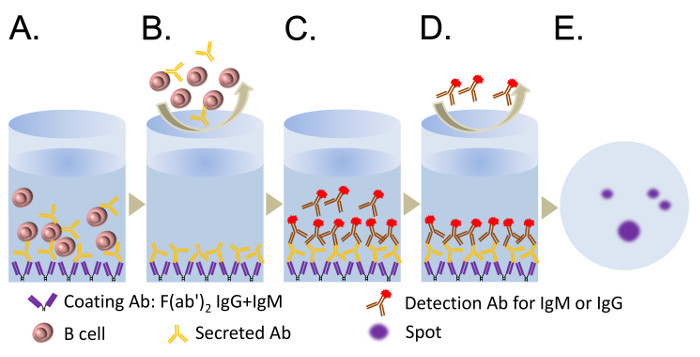
エリスポットアッセイの重要なステップの 2. イラスト図 。 (A)は 、37℃で、または一晩4℃で2時間のELISpotプレートに抗ヒトIg抗体(IgG + IgM抗体+型IgA)のF(ab ')2断片の50μL/ウェル(5μg/ ml)を入れてC(優先)(ステップ5.4)。 ELISPOTプレートのウェルに細胞を播種します。 14時間(ステップ5.11) - ASCには、PVDF膜に付着し、8のために腹筋を分泌することができます。 (B)は (0.05%Tween 20で)PBSで細胞を洗い流します。 (C)AP-あるいはHRP-CONJを追加ugated検出は、IgGまたはIgMのいずれかに特異的なABS。 (D)未結合している検出腹筋を洗い流します。 (E)検出腹筋と一致するように、APまたはHRPの基質溶液とスポットを開発します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
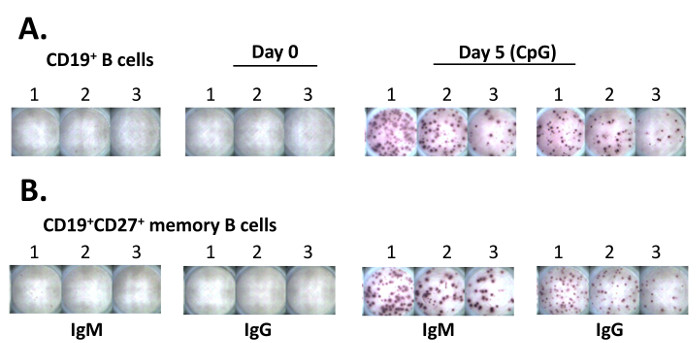
代表プレートから 3 のELISpot結果を 図 。 (A)精製されたCD19 + B細胞を、ELISPOTプレートの(それぞれウェル#3によく#1において50,000細胞を、ウェル#2で25,000細胞および12,500細胞)は、3つの隣接するウェルに入れました。細胞を、RPMI 1640培地で一晩(〜14時間)で培養しました。 ELISpotアッセイは、培養(5.18に5.12ステップ)を完了した後に行きました。アナライザーへE結果、ELISPOTプレートは、スキャナとソフトウェアを備えた自動分析装置を介して画像を取得するためにスキャンしました。 (B)精製されたCD19 + CD27 +記憶細胞(10 6 / mL)を5日間のCpGの5μg/ mlの存在下で培養しました。細胞を、ELISpotアッセイのための(A)のように処理しました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ヒト末梢血B細胞の単離および精製
通常、RBCが効率的に破裂し、溶解バッファー(ステップ1.2)でクリアすることができます。細胞生存率は、塩化アンモニウムによって影響を受ける可能性があるように、5分より長いRBC溶解緩衝液でのPBMCをインキュベートしないことが重要です。また、赤血球と血小板は同時に以下のプロトコルによって除去することができます。
1血液にバッファ:9の体積比で、酸 - クエン酸 - デキストロース(ACD)緩衝液(pH 7.4 39 mMのクエン酸、75 mMクエン酸ナトリウム、および135mMのデキストロース)新鮮な全血を混合します。 RTで10分間、250×gで遠心分離します。分離を示す、層の形成に注意してください。血小板および多血小板血漿(黄色)が含まれている上層を、吸引し、廃棄します。 PBMCが含まれている界面で薄い中間層、(iは .E。、軟膜)を取り外します。 D(底層でRBCの汚染を避けます)赤色をARK。残留赤血球を除去し、その後1.19にステップ1.2に従うようにしたPBMCに溶解バッファーを追加します。
正および負の選択21:2つの方法がPBMCからB細胞を単離することができます。負の選択の方法は、(1.19 1.1ステップ)下流の実験のために、ノーバウンドABS又はマイクロビーズと、そのまま、機能的B細胞を得るために使用されます。活性化および/または精製されたB細胞の分化は、培養物中で発生した場合にこれを考慮することが重要です。懸念は、正の選択により精製された細胞が誤ったmAbコンジュゲートマイクロビーズ(直径0.2〜5ミクロン)によって影響される可能性があることです。 mAbはB細胞上の特異的受容体に結合することができ、したがって、活性化レセプターを架橋する可能性があります。また、マイクロビーズを結合した受容体を介してB細胞によってエンドサイトーシスされ得ます。生分解性が、マイクロビーズは一週間よりも長く細胞内に滞在することができます。マイクロビーズの保持はexperiに影響を与えるかどうか精神的な結果は、経験的に決定される必要があります。正の選択を介したヒトB細胞の精製においては、抗CD19(クローン:4G7またはHIB19)CD19が広く、B細胞の発達段階を通して発現されているため、マイクロビーズは、一般的に使用されています。抗CD19マイクロビーズとは異なるエピトープを認識する:(SJ25C1またはLT19クローン)、分離後のB細胞の純度は、抗CD19 mAbで、フローサイトメトリーによって決定することができます。
単離されたB細胞からの精製とメモリとナイーブB細胞の分離
CD27は、人間の記憶とナイーブB細胞の区別24のために広く受け入れられた表面マーカーです。 CD27分子は、腫瘍壊死因子受容体(TNFR)ファミリーに属します。ナイーブB細胞- CD27はほとんどのヒト記憶B細胞上で発現されるので、一般にCD27からそれらを区別するために使用されます。しかし、CD27はまた、T細胞およびNK細胞を、抗CD27 microbeaの使用上で発現されるのでDS(クローン:O323)積極的記憶B細胞を選択する際には、B細胞の精製前を(1.19から1.1ステップ)が必要です。分離後の純度チェック、ヒトCD27に対する特異的モノクローナル抗体(クローン:L128またはLG.3A10)は(ステップ2.12)を推奨しています。 CD27 +メモリーB細胞は不均一であるので、そのようなIgDおよびFCRL4などの付加的な表面マーカーは、細胞は、4、7並べ替えでさらに分離するために考慮することができます。
ナイーブB細胞、メモリーB細胞、およびPBS / PCを入手するために細胞選別
B細胞がFcγRIIBと表現しているので、のFcブロック(ステップ3.3)は、フローサイトメトリーのためのモノクローナル抗体で細胞を染色する前にお勧めします。単独でヒトIgGのFc断片を、1μg/ 10 6個の細胞で、全体のヒトIgGとして同様にうまくブロックすることができます。抗ヒトCD32モノクローナル抗体(クローン:3D3またはAT10は)のFcブロックのための別のオプションです。注目すべきは、FcγRIIBは、精製されたB細胞に染色される表面マーカー、蛍光団結合抗CD32モノクローナル抗体のshのであればPBS洗浄することなく、他のmAbで染色したFcブロックを、放棄するために添加されウルド。
三色フローサイトメトリーのために、CD38-FITC(フルオレセイン)、CD27-PE(フィコエリトリン)、およびCD19-APC(アロフィコシアニン)は、蛍光体の典型的な組み合わせです。フローサイトメトリー選別機は、例えば、405nmで、488 nmおよび640 nmでのもののような3つのレーザ、装備されている場合はそれにもかかわらず、研究者はその後、細胞選別のための異なるレーザーによって励起された蛍光団を選択する贅沢を持っています。 、CD27-eFluor450(パシフィックブルー、クローンに相当:O323)、およびCD38-PE(クローン:HB7)を図 1に示すように、細胞は、CD19-APC(HIB19クローン)で染色したナイーブB細胞を分離するために、メモリB細胞、そしてPBS。 CD45 + CD19 +集団として白血球系統マーカーとゲートB細胞など:注目すべきは、いくつかの研究者は、CD45(HI30クローン)を含めることを好みます。定常状態での循環中のPBの検出は稀前夜であるため実証彼らの善意の存在2、30-31 - ntの健康低い個人、またはPBS(CD19 + CD27 + /ハイ CD38 + CD20 LO /)上のCD20のなくても表面発現インチELISPOTアッセイによる表面表現型とのASCによってのPBの定量結果が比較されている場合に便利です。前のセルソーティングまでの期間中は、7-AADは、その狭い発光スペクトルと多色フローサイトメトリーの下位スピルオーバーに、死細胞を排除するためにヨウ化プロピジウムに好ましいです。
インビトロ刺激し、単離されたヒトB細胞の分化には
タイプBのCpG(2006 ODN)は、単独で記憶B細胞からIgM-およびIgG-ASCを両方の制限された分化を誘導することができます。また、ナイーブB細胞のみのCpGに弱く応答すると、主にIgMの-ASCは6、11を生じさせます。文化におけるCpGの濃度が2.5の範囲である-を5μg/ mLの10 6 B細胞あたりまたはPBMCを11、18。 CpG以外の、精製されたB細胞およびPBMCを(ステップ4.3)、マイトジェン、サイトカイン、およびBCRアゴニストとのCpGの組合せの存在下で培養することができる培養物中のASCにヒトB細胞を区別します。例えば、一般的に、mL当たり10 6個の細胞のためのレシピを使用としては、(a)のCpG(5μg/ mlの)、組換えヒトIL-2(10ng / mLの)、および組換えヒトIL-10(10ng / mLの)15、 34; (B)のCpG(5μg/ mlの)およびF(ab ')抗ヒトIg抗体(IgG + IgM抗体+型IgA)2フラグメント(20μgの/ mL)を11。 (C)のCpG(5μg/ mlの)、 黄色ブドウ球菌コーワン(SAC)からのタンパク質A(1:10,000希釈)、およびヤマゴボウマイトジェン(PWM)(1 100,000希釈)18。 (d)の組換えヒトIL-21(100ng / mlの)及び組み換えのsCD40L(を1μg/ mL)を12、15、33。及び(e)の組換えヒトIL-2(10ng / ml)及びR848(を1μg/ mL)を、アゴニストTLR7 33-34。 B細胞は、三日間11のASCに分化することができるが、細胞は一般にプレSであります前のASC 11、18の定量のためのELISpotプレートに添加される、5〜6日間timulated。培養期間中、開始分化剤のない補充は通常存在しません。
CpG含有培養物にIL-2およびIL-10の添加は、有意に分化IgM-およびIgG-ASCを15、35の数を増やすことができます。培養物中のIL-2の存在は、CpGによって分化B細胞の増殖を促進するために、分裂促進刺激を与えることができます。 IL-10 10から25 ngの範囲内/ mLを大きくするCpG 35の存在下でのASCの生産(〜3〜10倍)を大きくすることができます。抗BCRおよびSAC、およびPWMを含むBCRアゴニストは、一次ヒトB細胞18の増殖を刺激することができます。 CpGおよびポリクローナル抗BCRと記憶B細胞をインキュベートすると、主にIgMを-ASCを増加ではなくたIgG-ASCを28をもたらします。 FcγRIIBによりBCRを介したシグナル伝達の阻害の防止、のF(ab&ための#39;)抗Igの2断片(10から20μgのBCR 11架橋時に推奨されます)10 6細胞当たり/ mLです。代わりに、ポリクローナル抗Igの、いずれかのIgM +またはIgG + B細胞に特異的な抗BCR mAbはASCに分化するためのアイソタイプ特異的B細胞サブセットを標的とするように考慮されるべきです。 (:10,000希釈1)、およびPWM(1 100,000希釈)のCpG、SACの組み合わせが効率的IgM-およびIgG-ASCは18、24に分化する記憶B細胞を活性化することができます。また、CpGが適度に試験管 28-29 で Igのクラススイッチを誘導することができます。対照的に、IL-21(100ng / mlの)とのsCD40L(1μg/ ml)を効果的に切り替えたIgG-ASCを12、30に排他的に記憶B細胞の分化を誘導します。 sCD40Lは、in vivoでのPCへの分化に影響を与え、B細胞上のCD40を介してT細胞の助けを模倣することによってB細胞を活性化することができます。注目すべきは、抗CD40(クローン:89またはG28.5)を培養15でのsCD40Lのために置き換えることができます。 HowevER、単独でのsCD40Lも抗CD40のいずれも、記憶B細胞の分化を誘導することができます。従って、培養されたB細胞のCD40の活性化は、多くの場合、IL-4は、CpG、R848、またはIL-21のIgクラススイッチを促進することができる任意のそれらのように、分化剤と組み合わされます。 IL-4はほとんどのIgM + B細胞の誘導は、培養物中のIgG1 + B細胞への切り替えを可能にするのTh2 CD4細胞の分化に重要な役割を果たしています。同様に、IL-21の存在下では、両方のメモリーB細胞及びナイーブB細胞は、クラススイッチのASC 12、32に排他的に分化します。 CpGのように、R848は、B細胞34の限界クラススイッチを誘導することができます。最後に、リポ多糖(LPS)は、効果的にのASCにマウスB細胞の分化を誘導することができるが、ヒトB細胞は、TLR4とCD14 29の低レベルを発現することを言及する価値があります。培養中の分化剤の添加を切り替えるB細胞の発生を促進するため、この添加は避けるべきです既存のPBS / PCやスイッチングなしの記憶B細胞であるときに測定されます。
ELISpotアッセイ
ELISpotアッセイは、単一のB細胞18によって分泌されるAbの検出を可能に、膜ベースのウェスタンブロッティング技術とプレートベースのELISAを兼ね備えています。エリスポットはまた、サイトカイン17、36を分泌する Ag特異的T細胞を定量するように適合されています。 ELISpotアッセイでは、精製された細胞または未分画のPBMC(RBCの自由)のいずれかを使用することができます。しかし、約10倍以上のPBMCを、ELISPOTアッセイで一貫性のある結果を得るために精製された細胞よりも、必要とされます。 PBMCにおける循環のASCを検出するためのウェルあたり2×10 5細胞-良い出発点は1です。 Ag特異のASCの検出は、抗Igは、通常、銀で置き換えられる(5から10μgのPBS中/ mL)をAg特異のACS(ステップ5.4)をキャプチャします。アイソタイプ特異的検出Abの使用は、Ag特異的IgM抗体-のASCおよびIgGアイソタイプのASCとの間の区別を可能にする(ステップ5.14)。注目すべきは、関係なく、抗IgまたはAgがのASCを捕捉するために使用されているかどうかを、ELISAのために使用される検出Abは常にエリスポットには適していない可能性があります。同様に、ELISAのためのすべての色の基質はエリスポットで正常に機能しません。 AP-およびHRPコンジュゲートのAbは、最も一般的エリスポットのスポットの検出のために使用されます。 3,3 '、5,5'-テトラメチルベンジジン(TMB)および3-アミノ-9-エチルカルバゾール(AEC)溶液は、HRPのための一般的な基質である一方、BCIP / NBT基質溶液は、APベースの検出のための一般的な選択でありますエリスポットインチAPまたはHRPを直接検出腹筋にコンジュゲートされている場合は、プロトコル(ステップ5.14)で説明したように、1つのステップだけは、検出のために必要とされています。対照的に、検出Abを、ビオチン化され、二段階法で基質と反応する前に、AP-またはHRP結合ストレプトアビジンとのその後のインキュベーションを必要とします。一段階及び二段階法の両方を、ELISPOTでスポットを検出するために効率的に働きます。
ELISpotアッセイだけでなくcirculat定量化することができまするだけでなく、文化の中でのASC(4.6対ステップ1.19)を分化しました。存在する場合、通常は培養2日より、もはや生きるのASCを、循環、またはPBMCを11から精製することなく、ELISPOTプレートで直接培養することができます。対照的に、メモリーB細胞の分化は、5日を要します。したがって、細胞の単離後のELISpotプレートで直接培養する(ステップ1.19)は推奨されません。拡張された培養期間に起因する死細胞の残骸は、スポット検出のバックグラウンドを増加させることができます。代わりに、精製されたB細胞および全PBMCを両方とも最初マイトジェンおよび分化剤(ステップ4.3)の存在下で6ウェルまたは12ウェルプレート中で培養することができます。培養プロセスの間、刺激薬の反復添加は不要(ステップ4.3)です。プレートはインキュベーターであるが、培養器の扉を静かに彼らが移動するトラックに沿って分泌腹筋を拡散することができるためのスポットを生成し、移動がシードされたのASCを防止するために開閉する必要があります尾(いわゆる「彗星のような「スポット)(ステップ5.11)を持ちます。 ELISPOTプレートでのインキュベーション期間は、スポットカウントの困難を作成し、細胞が分裂することなくAbの検出可能な量を分泌する細胞のために必要な時間によって決定されます。したがって、細胞は一晩に8時間(ステップ5.11)の範囲で、通常培養されます。
ELISpotアッセイは、記憶B細胞応答を定量化するために最も広く用いられている方法です。これは、体液性免疫応答および免疫記憶の人気の、独立した読み出しとなっています。実際には、前述の分裂促進文化がASCを(ステップ4.3)への分化のための記憶B細胞を活性化するために必要とされます。しかし、上述したようにメモリーB細胞が拡張したASCに分化する周波数は、異なる培養環境で変化します。コンセンサスなしているが、ほとんどの研究者はのASCの生産を最大化することができる誘導条件を採用しています。スポットdetectioのために使用される薬剤の面ではnは、可溶性ビオチン化Agが感度37を損なうことなく、不満足な検出抗体を置き換えることができます。銀の非常に低い量は、プレートをコーティングするよりも検出に必要とされるので、銀の利用可能性が限られている場合、これは特に重要です。最後に、エリスポットは、細胞の不均一性の表現型解析を可能にし、それによって細胞亜集団の前分別を必要としません。最近、検出Abを、異なるフルオロフォアで標識された多色ELISpotアッセイは、単一のウェル38-39におけるサイトカイン分泌細胞の複数のタイプを検出するために開発されました。この新技術は、PBMCにおける低周波細胞の検出のためのおよびワクチンによって誘導されるB細胞応答の大規模な分析のために特に興味深いであろう。
ELISpotアッセイでのASCおよびサイトカイン分泌細胞の定量に迅速かつ効率的であるので、それだけではないcircuの機能を測定するために拡張されていますlatingリンパ球、だけでなく、肝内白血球40等の組織の免疫細胞。 1つでもASCを検出するレベルに達し、その感度のため、ELISpotアッセイは、ますます既存の新興病原体に対するワクチン効力に対するヒトの免疫応答を測定するために使用されています。 ELISpotアッセイの高スループット性能とロバスト性がのPBMCを使用して、免疫応答の大規模な評価のために優れているが、アッセイの結果は、細胞が新鮮または凍結しているかどうか、このような試料の処理遅延等の様々な要因によって影響され得ます、血清培地中の成分、およびELISPOTプレート41に加え、細胞の数。このように、正規化手順は、大規模かつ縦フォローアップ調査( 例えば、ワクチン試験)における内およびアッセイ間の変動を最小限に抑えるためのELISpotプロトコルに含まれるべきです。プレートの読み取りの正規化方法は、線形性、精度、および短所のために重要ですアッセイにおけるistencyは41から42になります。プレート読み取り正規化を実行するための一つの方法は、ELISPOTプレート(ステップ5.10)に播種した細胞の段階希釈の手順を拡張することです。基準板を作成することにより、より多くの連続希釈液をウェルあたりの細胞数およびウェルあたりのスポット数との間の直線的関係を証明する必要があります。 ELISPOTプレートを繰り返しスキャンは両方自動、手動、スポットカウントのテンプレートを検証するために使用することができます。スポット数の最小のイントラウェルの変動は、これらの標準化手順43の後に予想されます。最後に、のELISpotのアプリケーションは、感染を有する患者の治療応答のモニタリングおよび癌の免疫療法を取るだけでなく、免疫毒性の評価( 例えば、免疫抑制および薬物誘発性自己免疫)のような多くの方法で拡張することができます。
開示事項
The author declares no competing financial interests.
謝辞
This study was supported by a research grant from the Ministry of Science and Technology of the Executive Yuan of Taiwan (NSC99-2320-B-002-011). I would like to acknowledge the excellent service provided by the Flow Cytometric Analyzing and Sorting Core of the First Core Laboratory in College of Medicine of National Taiwan University.
資料
| Name | Company | Catalog Number | Comments |
| BD Vacutainer K2E | BD Biosciences | 367525 | 10 mL tube |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-02 | endotoxin-free |
| Trypan blue 0.5% solution | Biological Industries | 03-102-1B | |
| IMag Human B lymphocyte enrichment set | BD Biosciences | 558007 | |
| Biotinylated CD27 mAb | Biolegend | 302804 | clone O323 |
| Streptavidin magnetic microbeads | BD Biosciences | 9000810 | |
| 15 mL Falcon tubes | BD Falcon | 352196 | |
| Blue nylon mesh cell strainer, 40 μm | BD Falcon | 352340 | |
| Anti-human CD19-APC | Biolegend | 302212 | clone HIB19 |
| Anti-human CD27-eFluor 450 | eBioscience | 48-0279-42 | clone O323 |
| Anti-human CD38-PE-Cy7 | Biolegend | 303516 | clone HIT2 |
| Anti-human CD38-PE-Cy7 | BD Biosciences | 560677 | clone HIT2 |
| Anti-human CD45-FITC | Biolegend | 304006 | clone HI30 |
| Anti-human CD45-FITC | BD Biosciences | 555482 | clone HI30 |
| Anti-mouse/rat/human CD27-PerCP Cy5.5 | Biolegend | 124213 | clone LG.3A10 |
| Anti-human CD27-PerCP Cy5.5 | BD Biosciences | 65429 | clone L128 |
| Anti-human CD19-FITC | Miltenyi Biotec | 130-098-064 | clone LT19 |
| Anti-human CD19-FITC | GeneTex | GTX75599 | clone LT19 |
| Anti-human CD20-FITC | BD Biosciences | 555622 | clone 2H7 |
| biotinylated anti-human CD27 | Biolegend | 302804 | clone O323 |
| biotinylated anti-human CD27 | eBioscience | 13-0279-80 | clone O323 |
| 7-aminoactinomycin D (7-AAD) | BD Biosciences | 559925 | |
| CpG (ODN 2006) | InvivoGen | tlrl-2006 | type B CpG |
| Recombinant human IL-2 | PeproTech | 200-02 | |
| Recombinant human IL-10 | PeproTech | 200-10 | |
| Recombinant human IL-21 | PeproTech | 200-21 | |
| Recombinant human sCD40L | PeproTech | 310-02 | |
| Protein A of S. aureus Cowan (SAC) | Sigma-Aldrich | 82526 | |
| Pokeweed mitogen (PWM) | Sigma-Aldrich | L9379 | |
| MultiScreen filter plates, 0.45 µm pore size | Merck Millipore | MSIPS4510 | sterile, clear 96-well filter plate with hydrophobic PVDF membrane |
| BCIP/NBT solution | Sigma-Aldrich | B6404 | |
| BCIP/NBT single reagent, alkaline phosphatase substrate | Merck Millipore | ES006 | |
| Human IgG | Jackson ImmunoResearch | 009-000-003 | |
| Human IgG, Fc fragment | Jackson ImmunoResearch | 009-000-008 | |
| F(ab')2 fragment of goat anti-human Ig (IgG + IgM + IgA) | Jackson ImmunoResearch | 109-006-127 | |
| Goat anti-human IgG-alkaline phosphatase, Fcγ fragment specific | Jackson ImmunoResearch | 109-055-008 | |
| Goat anti-human IgM-alkaline phosphatase, Fcµ fragment specific | Jackson ImmunoResearch | 109-055-043 | |
| Goat anti-human IgG-peroxidase, Fcγ fragment specific | Jackson ImmunoResearch | 109-035-008 | |
| Goat anti-human IgM-peroxidase, Fcµ fragment specific | Jackson ImmunoResearch | 109-035-095 | |
| BD ELISPOT AEC substrate kit | BD Biosciences | 551951 | |
| C.T.L. ImmunoSpot analyzer | C.T.L. |
参考文献
- Bemark, M. Translating transitions - how to decipher peripheral human B cell development. J. Biomed. Res. 29 (4), 264-284 (2015).
- Odendahl, M., et al. Generation of migratory antigen-specific plasmablasts and mobilization of resident plasma cells in a secondary immune response. Blood. 105 (4), 1614-1621 (2005).
- Jackson, S. M., Wilson, P. C., James, J. A., Capra, J. D. Human B cell subsets. Adv. Immunol. 98, 151-224 (2008).
- Sanz, I., Wei, C., Lee, F. E., Anolik, J. Phenotypic and functional heterogeneity of human memory B cells. Semin. Immunol. 20 (1), 67-82 (2008).
- Perez-Andres, M., et al. Human peripheral blood B-cell compartments: A crossroad in B-cell traffic. Cytometry B Clin. Cytom. 78 (Suppl 1), S47-S60 (2010).
- Huggins, J., et al. CpG DNA activation and plasma-cell differentiation of CD27- naïve human B cells. Blood. 109 (4), 1611-1619 (2007).
- Wu, Y. C., Kipling, D., Dunn-Walters, D. K. The relationship between CD27 negative and positive B cell populations in human peripheral blood. Front. Immunol. 2, 81(2011).
- Maïga, R. I., Bonnaure, G., Rochette, J. T., Néron, S. Human CD38hiCD138⁺ plasma cells can be generated in vitro from CD40-activated switched-memory B lymphocytes. J. Immunol. Res. 2014, 635108(2014).
- Wienands, J., Engels, N. The memory function of the B cell antigen receptor. Curr. Top. Microbiol. Immunol. 393, 107-121 (2016).
- Kurosaki, T., Kometani, K., Ise, W. Memory B cells. Nat. Rev. Immunol. 15 (3), 149-159 (2015).
- Tzeng, S. J., Li, W. Y., Wang, H. Y. FcγRIIB mediates antigen-independent inhibition on human B lymphocytes through Btk and p38 MAPK . J. Biomed. Sci. 22, 87-98 (2015).
- Ettinger, R., et al. IL-21 induces differentiation of human naïve and memory B cells into antibody-secreting plasma cells. J. Immunol. 175 (12), 7867-7879 (2005).
- Bekeredjian-Ding, I., Foermer, S., Kirschning, C. J., Parcina, M., Heeg, K. Poke weed mitogen requires Toll-like receptor ligands for proliferative activity in human and murine B lymphocytes. PLoS One. 7 (1), e29806(2012).
- Bernasconi, N. L., Traggiai, E., Lanzavecchia, A. Maintenance of serological memory by polyclonal activation of human memory B cells. Science. 298 (5601), 2199-2202 (2002).
- Defrance, T., Vanbervliet, B., Brière, F., Durand, I., Rousset, F., Banchereau, J. Interleukin 10 and transforming growth factor beta cooperate to induce anti-CD40-activated naive human B cells to secrete immunoglobulin A. J. Exp. Med. 175 (3), 671-682 (1992).
- Hornbeck, P., Fleisher, T. A., Papadopoulos, N. M., et al. Chapter 2, Unit 2.2, Isotype determination of antibodies. Current Protocols in Immunology. Coligan, J. E., et al. , (2001).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Crotty, S., Aubert, R. D., Glidewell, J., Ahmed, R. Tracking human antigen-specific memory B cells: a sensitive and generalized ELISPOT system. J. Immunol. Methods. 286 (1-2), 111-122 (2004).
- Zhang, Y., Wang, Y., Zhang, M., Liu, L., Mbawuike, I. N. Restoration of retarded influenza virus-specific immunoglobulin class switch in aged mice. J. Clin. Cell. Immunol. 7 (2), 403(2016).
- Doedée, A. M., Kannegieter, N., Öztürk, K., van Loveren, H., Janssen, R., Buisman, A. M. Higher numbers of memory B-cells and Th2-cytokine skewing in high responders to hepatitis B vaccination. Vaccine. 34 (19), 2281-2289 (2016).
- Coligan, J. E., et al. Chapter 7, Unit 7.5, Isolation of human B cell populations. Current Protocols in Immunology. , (2011).
- Safarík, I., Safaríková, M. Use of magnetic techniques for the isolation of cells. J. Chromatogr. B Biomed. Sci. Appl. 722 (1-2), 33-53 (1999).
- Morbach, H., Eichhorn, E. M., Liesem, J. G., Girschickm, H. J. Reference values for B cell subpopulations from infancy to adulthood. Clin. Exp. Immunol. 162 (2), 271-279 (2010).
- Thornton, A. M., et al. Chapter 3, Unit 3.5A, Fractionation of T and B cells using magnetic beads. Current Protocols in Immunology. Coligan, J. E., et al. , (2003).
- Klein, U., Rajewsky, K., Küppers, R. Human immunoglobulin (Ig)M+IgD+ peripheral blood B cells expressing the CD27 cell surface antigen carry somatically mutated variable region genes: CD27 as a general marker for somatically mutated memory)Bcells. J.Exp. Med. 188 (9), 1679-1689 (1998).
- Bohnhorst, J. Ø, Bjørgan, M. B., Thoen, J. E., Natvig, J. B., Thompson, K. M. Bm1-Bm5 classification of peripheral blood B cells reveals circulating germinal center founder cells in healthy individuals and disturbance in the B cell subpopulations in patients with primary Sjögren's syndrome. J. Immunol. 167 (7), 3610-3618 (2001).
- Bleesing, J. J., et al. Chapter 7, Unit 7.35, Assays for B cell and germinal center development. Current Protocols in Immunology. Coligan, J. E., et al. , (2003).
- Horvatinovich, J. M., Sparks, S. D., Mann, K. P. Establishing a pure lymphocyte gate for subset analysis by flow cytometry. Cytometry. 26 (2), 172-177 (1996).
- Ruprecht, C. R., Lanzavecchia, A. Toll-like receptor stimulation as a third signal required for activation of human naive B cells. Eur. J. Immunol. 36 (4), 810-816 (2006).
- Smith, K., et al. Rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen. Nat. Protoc. 4 (3), 372-384 (2009).
- Caraux, A., et al. Circulating human B and plasma cells. Age-associated changes in counts and detailed characterization of circulating normal CD138- and CD138+ plasma cells. Haematologica. 95 (6), 1016-1020 (2010).
- Kuchen, S., Robbins, R., Sims, G. P., Sheng, C., Phillips, T. M., Lipsky, P. E., Ettinger, R. Essential role of IL-21 in B cell activation, expansion, and plasma cell generation during CD4+ T cell-B cell collaboration. J. Immunol. 179 (9), 5886-5896 (2007).
- Pinna, D., Corti, D., Jarrossay, D., Sallusto, F., Lanzavecchia, A. Clonal dissection of the human memory B-cell repertoire following infection and vaccination. Eur. J. Immunol. 39 (5), 1260-1270 (2009).
- Jahnmatz, M., et al. Optimization of a human IgG B-cell ELISpot assay for the analysis of vaccine-induced B-cell responses. J. Immunol. Methods. 391 (1-2), 50-59 (2013).
- Weiss, G. E., et al. High efficiency human memory B cell assay and its application to studying Plasmodium falciparum-specific memory B cells in natural infections. J. Immunol. Methods. 375 (1-2), 68-74 (2012).
- Leehan, K. M., Koelsch, K. A. T Cell ELISPOT: For the identification of specific cytokine-secreting T cells. Methods. Mol. Biol. 1312, 427-434 (2015).
- Karahan, G. E., et al. Quantification of HLA class II-specific memory B cells in HLA-sensitized individuals. Hum. Immunol. 76 (2-3), 129-136 (2015).
- Hadjilaou, A., Green, A. M., Coloma, J., Harris, E. Single-cell analysis of B cell/antibody cross-reactivity using a novel multicolor FluoroSpot assay. J. Immunol. 195 (7), 3490-3496 (2015).
- Janetzki, S., Rueger, M., Dillenbeck, T. Stepping up ELISpot: multi-level analysis in FluoroSpot assays. Cells. 3 (4), 1102-1115 (2014).
- Alatrakchi, N., Graham, C. S., He, Q., Sherman, K. E., Koziel, M. J. CD8+ cell responses to hepatitis C virus (HCV) in the liver of persons with HCV-HIV coinfection versus HCV monoinfection. J. Infect. Dis. 191 (5), 702-709 (2005).
- Smith, S. G., et al. Identification of major factors influencing ELISpot-based monitoring of cellular responses to antigens from Mycobacterium tuberculosis. PLoS. One. 4 (11), e7972(2009).
- Sundararaman, S., et al. High reproducibility of ELISPOT counts from nine different laboratories. Cells. 4 (1), 21-39 (2015).
- Janetzki, S., et al. Guidelines for the automated evaluation of Elispot assays. Nat. Protoc. 10 (7), 1098-1115 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved