Method Article
El aislamiento, diferenciación y cuantificación de Human secretoras de anticuerpos células B de sangre: ELISpot como una lectura funcional de la inmunidad humoral
En este artículo
Resumen
Human peripheral blood is commonly used for the assessment of the humoral immune response. Here, the methods for isolating human B cells from peripheral blood, differentiating human B cells into antibody (Ab)-secreting B cells (ASCs) in culture, and enumerating the total IgM- and IgG-ASCs via an ELISpot assay are described.
Resumen
El sello distintivo de la inmunidad humoral es generar ASCs funcionales, que sintetizan y secretan Abs específica a un antígeno (Ag), tal como un patógeno, y se utilizan para la defensa del huésped. Para la determinación cuantitativa del estado funcional de la respuesta inmune humoral de un individuo, tanto Abs suero y ASC circulantes se miden comúnmente como lecturas funcionales. En los seres humanos, la sangre periférica es la muestra más conveniente y fácilmente accesible que se puede utilizar para la determinación de la respuesta inmune humoral provocada por células B de acogida. subconjuntos de células B distintos, incluyendo ASC, se pueden aislar directamente a partir de sangre periférica a través de la selección con microperlas Ab-conjugados específicos de linaje o mediante clasificación de células con citometría de flujo. Además, las células B vírgenes y de memoria purificadas se pueden activar y diferenciar en ASCs en cultivo. Las actividades funcionales de ASC para contribuir a la secreción de Ab se pueden cuantificar por ELISpot, que es un ensayo que converge enzima-vinculada ensayo de inmunoabsorbancia (ELISA) y tecnologías de Western Blot para permitir la enumeración de las ASC individuales a nivel de una sola célula. En la práctica, el ensayo ELISPOT se ha utilizado cada vez más para evaluar la eficacia de la vacuna debido a la facilidad de manejo de un gran número de muestras de sangre. Los métodos de aislamiento de células B humanas de sangre periférica, se describirán aquí la diferenciación de células B en ASCs in vitro, y el empleo de ELISpot para la cuantificación del total de IgM e IgG-ASC.
Introducción
las células B juegan un papel central en el desarrollo de la inmunidad humoral. En un principio se desarrollan en la médula ósea y entran en el torrente sanguíneo como ingenuo células B, que pueden migrar hacia los tejidos linfoides, tales como el bazo, los ganglios linfáticos, las amígdalas, para un mayor desarrollo. Al Ag encuentro, algunas células B vírgenes migran hacia los folículos linfoides, donde los centros germinales células B pueden diferenciarse en células B de memoria y plasmablastos (PBS) / células plasmáticas (PC). Aunque la mayoría de PBS / PCs de salida en la corriente de la sangre, unos pocos, finalmente, residen en la médula ósea para experimentar diferenciación terminal en PCs de larga vida 1. Las células B en circulación son heterogéneas, y en el estado estacionario, PBS / PC son raros en la sangre periférica 2. Como resultado de la disponibilidad de marcadores de superficie específicos de linaje, citometría de flujo se ha convertido en un método popular para la identificación y caracterización de los subconjuntos de células B en sangre periférica. Una aplicación extendida de flujo cytometry es la adición de una función de clasificación de células, lo que permite la separación y el aislamiento de subconjuntos individuales de células B con una alta pureza. Sobre la base de la expresión de receptores de superficie específicos en diferentes etapas de desarrollo, las células B circulantes humanos se clasifican generalmente en tres subpoblaciones principales: células B vírgenes (CD19 + CD27 - CD38 -), las células B de memoria (CD19 + CD27 + CD38 -), y PBS / PC (CD19 + CD27 + CD38 +) 3-4 (Figura 1). células B vírgenes, por naturaleza, no se han encontrado con Ags. Sin embargo, pueden ser diferenciadas en células IgM + CD27 + B de memoria. Aunque las células B vírgenes son homogéneos en la expresión del receptor de antígeno de células B (BCR) -asociado moléculas (por ejemplo, CD19, CD20 y CD22) que son heterogéneos en su repertorio de inmunoglobulina 5. La mayoría de las células CD27 + B de memoria se puede diferenciar en CD27+ / CD38 + hi PBS / PC 6. Además, las células B de memoria y PBS / PCs son policlonales y exhiben heterogeneidad desarrollo y funcional 4-7. PBS / PC en la circulación son normalmente de corta duración y no expresan CD138, pero los realizados para establecerse en la médula ósea se terminalmente diferenciarse y convertirse larga vida. Terminalmente diferenciadas PC expresan CD138 y regulan por disminución moléculas CD27 en su superficie 8. Dado que tanto el PBS y PCs son capaces de secretar Abs, en muchas ocasiones se designan colectivamente como ASC. En cambio, ni las células B vírgenes ni las células B de memoria pueden producir cantidades apreciables de Abs 9-10. Sin embargo, cuando se aíslan, tanto las células B vírgenes y de memoria pueden diferenciarse en ASCs en 3 - 10 días cuando se coloca en las condiciones de cultivo apropiadas 6, 11-15. De hecho, las ASC derivadas de la diferenciación in vitro de acciones expresiones similares en la superficie de CD27 y CD38 con los fr aislados directamentesangre periférica om 6. Además, las ASC diferenciadas in vitro expresan un bajo nivel de CD20 de superficie, similar al de circulación de PBS / PCs 6. A pesar de las ASC derivados de cultivos de todo son de corta duración, que pueden secretar Abs, indicando que son funcionalmente competente y capaz de contribuir a la inmunidad humoral.
Ambos ELISA y ELISPOT son con mucho los métodos más comúnmente aplicado con los que obtener información funcional sobre la respuesta inmune humoral. ELISA es un ensayo basado en placa de 96 pocillos, y se utiliza frecuentemente para medir los títulos de Abs Ag-específica suero y otros analitos (por ejemplo, citoquinas). Es conveniente y escalable. ELISA está diseñado para utilizar un ensayo enzimático en fase sólida para detectar la presencia de ABS o de otras sustancias, tales como suero, en una muestra líquida 16. Las lecturas de ELISA en suero han sido ampliamente utilizados para representar la respuesta inmune del cuerpo. Una herramienta necesaria para la adquisición de la readouts de ensayos ELISA es un lector de microplacas espectrofotométrico. El lector puede determinar la densidad óptica (OD) de los productos finales típicamente resultantes de la reacción de la peroxidasa de rábano picante (HRP) Abs detección conjugado y sus sustratos específicos 17. Con respecto a la información de la respuesta inmune humoral, los niveles de suero AB determinados por ELISA denotan el colectivo, pero no individual, el rendimiento de ASC en el cuerpo. Además, ELISA no tiene en cuenta la participación de las células B de memoria, que no secretan Abs.
Como ELISA, ELISPOT es un método ampliamente utilizado para la detección y el seguimiento de la respuesta inmune en muestras de sangre periférica 17-18. ELISpot es una técnica relacionada con un sándwich ELISA. En ella, las células se colocan en el difluoruro de polivinilideno (PVDF) membrana pozos con respaldo de microplacas de 96 pocillos para un cultivo a corto plazo. El ensayo ELISPOT es análoga a la realización de Western Blot en una microplaca y developing las manchas en la membrana de PVDF en cada pocillo. Se requiere un sistema lector de ELISPOT automatizado o un estereomicroscopio para el recuento manual. La principal ventaja de ELISPOT en la detección de una respuesta inmune es su excelente sensibilidad en la cuantificación de las ASC y células secretoras de citocinas. Se informa de sus actividades funcionales en la inmunidad humoral y celular, respectivamente. En la medición de la función inmune humoral, los niveles de suero AB determinados por ELISA y el número de ASC enumerados por ELISPOT son a menudo correlacionados, pero las lecturas de datos de estos dos ensayos tienen algunas diferencias en implicaciones funcionales 19-20. La principal ventaja de ELISpot es su sensibilidad de método. El nivel de los títulos de suero AB según lo informado por ELISA se presenta semi-cuantitativamente como lecturas de DO, que indica el nivel de Ab relativa, o más cuantitativamente, como las lecturas de concentración cuando se incluye una cantidad conocida de los isotipos apropiados de Abs para referencia. En contraste, los resultados de ELISPOT son Presented como el número absoluto de ASC en una piscina de célula de interés (por ejemplo, células no fraccionadas mononucleares de sangre periférica (PBMCs) y células B purificadas de PBMCs). ELISpot puede detectar una sola ASC, pero ELISA requiere cantidades Ab de ASC para llegar a concentraciones de ensayo dependiente optimizados antes de la medición. Por lo tanto, ELISpot es obviamente superior a ELISA en la sensibilidad de la cuantificación. Por otra parte, ELISpot también es adecuado para la cuantificación de las ASC diferenciadas in vitro a partir de células B de memoria activados. células B de memoria no secretan Abs, pero pueden diferenciarse en ASC tras la activación; por lo tanto no tienen ninguna contribución a Abs suero detectados por ELISA. Por lo tanto, ELISpot es el método de elección en la medición de la respuesta inmune de las células B de memoria que circula después de la activación en cultivo. Permite la supervisión del mantenimiento de la inmunidad humoral a largo plazo.
Protocolo
sangre periférica humana debe ser obtenida de donantes sanos en el consentimiento informado, y el uso de muestras de sangre deben ajustarse a las directrices aprobadas establecidos por las juntas de revisión institucionales individuales. En este estudio, el protocolo a utilizar la sangre humana en una demostración de los resultados de la citometría de flujo (Figura 1) y ensayos de ELISPOT (Figura 3) fue aprobado por la Junta de Revisión Interna del Hospital de la Universidad Nacional de Taiwán (número de protocolo 201307019RINB).
1. Aislamiento y purificación de células B de sangre periférica humana
- Dibuje ~ 10 ml de sangre de la vena cubital media (en el anterior fosa cubital hasta el codo) en un tubo de 15 ml que contenía K 2 EDTA (1,5 a 2,0 mg / ml de sangre) y se invierte inmediatamente el tubo varias veces para prevenir coágulos formación.
- Añadir 35 ml de autoclave (121 ° C, 15 min) de glóbulos rojos (RBC) tampón (150 mM NH 4 Cl, 10 mM de KHCO3, y EDTA 1 mM de lisis; pH 7,4) al tubo que contiene la muestra de sangre fresca (≥ 3: 1 vol / vol) y se incuba a temperatura ambiente (RT) durante no más de 5 min.
Nota: El aspecto de transmisión de la luz a través del tubo indica la finalización de RBC lisis. - Centrifugar a 600 xg a TA durante 5 min. Asegúrese de que la pastilla es de color blanco.
- Resuspender el precipitado con 10 ml de solución salina tamponada con fosfato autoclave (PBS, NaCl 137 mM, KCl 2,7 mM, 4,3 mM Na 2 HPO 4, y 1,47 mM KH 2 PO 4; pH 7,4) y se centrifuga como en el paso 1.3.
- Descartar el sobrenadante, resuspender el precipitado con 10 ml de medio RPMI 1640 (suplementos: suero de ternera fetal al 10%, 100 U / ml de penicilina / estreptomicina, 0,25 mg / ml de anfotericina B, y 2 mM L-glutamina), y luego la placa de las células en una placa de cultivo de 10 cm (10 ml de sangre por placa). Coloque el plato en una incubadora a 37 ° con 5% de CO2 durante 30 min.
- Hacer girar suavemente la placa de cultivo unas cuantas veces y colocar elmedio de cultivo (células en suspensión) en tubos cónicos de plástico 15-mL. Desechar las células adherentes (principalmente macrófagos) en las placas de cultivo.
- Centrifugar a 600 xg a TA durante 5 min. Descartar el sobrenadante.
- Resuspender el sedimento con 1 ml de medio RPMI 1640. Contar el número de células con un hemocitómetro o un contador de células automatizado.
NOTA: La viabilidad de los leucocitos aislados es normalmente mayor que 90% por exclusión de azul de tripano. - Centrifugar como en el paso 1.7 y resuspender las células en ~ 200 l de tampón de PBS frío (0,5% de albúmina de suero bovino (BSA) y EDTA 2 mM) a la concentración de 5 a 10 x 10 6 células / ml.
- Añadir 5 l de Ab biotinilado cóctel anti-humano específico para células de la sangre (para la selección negativa de células B) por cada 10 6 células y se incuba en hielo durante 30 min 21.
NOTA: El Ab cóctel anti-humano debería incluir al menos Abs específicos para CD2 (o CD3), CD14, y CD16. - Añadir un exceso de volumen de 10 vecesde PBS estéril a las células, se centrifuga a 600 xg durante 5 min, y descartar el sobrenadante.
- Añadir la misma cantidad de microperlas de estreptavidina conjugada (5 l por 10 6 células) al sedimento y mezclar bien.
- Incubar en hielo durante 30 min en un tubo cónico de 15 ml de plástico.
- Añadir 2 ml de tampón PBS en el tubo.
- Se coloca el tubo en un soporte magnético y se incuba a temperatura ambiente durante 8 min. Las microperlas de color marrón se unirán gradualmente a la pared del tubo próxima al imán 22.
- Con el tubo que queda en el soporte magnético, transferir cuidadosamente el sobrenadante en un nuevo tubo estéril de 15 ml 22.
- Repita los pasos 1.14 a 1.16, y combinar los dos sobrenadantes que contienen las células B vírgenes. Desechar las microperlas.
- Centrifugar a 600 xg a TA durante 5 min. Descartar el sobrenadante.
- Resuspender el sedimento en medio RPMI 1640 para los experimentos posteriores.
NOTA: Por lo general, 1 - 5 x 10 5 células B ingenioha pureza superior al 95% a partir de 10 ml de sangre periférica puede ser aislado 23.
2. purificación y separación de la Memoria y Naïve B a partir de células B aisladas
- Utilice células purificadas de la etapa 1 y determinar el número de células utilizando un hemocitómetro o un contador de células automático.
- Resuspender las células en 100 l de tampón de PBS frío después de centrifugación a 600 xg y RT durante 5 min.
- Añadir 1 - 2 g de mAb CD27 biotinilado por cada 10 6 células y se incuba en hielo durante 30 min.
- Añadir 10 ml de tampón de PBS al tubo y centrifugar a 600 xg durante 5 min.
- Eliminar el sobrenadante y resuspender las células en 50 l de tampón de PBS.
- Añadir cantidades iguales de microperlas magnéticas de estreptavidina (1 - / 10 6 células 2 g) a células en un tubo cónico de plástico 15-mL.
- Mezclar suavemente pocillo e incubar en hielo durante 30 min.
- Añadir 2 - 3 ml de tampón de PBS al tubo.
- Colocar eltubo en un soporte magnético y se incuba a temperatura ambiente durante 8 min para permitir que las microperlas de color marrón para insertarse en el lado más próximo al imán.
- Con el tubo en el soporte magnético, transferir cuidadosamente la fracción sobrenadante en un nuevo tubo estéril. Esta fracción contiene el CD27 enriquecido - células B vírgenes.
- Añadir 5 ml al tubo que contiene las microperlas y resuspender suavemente las microperlas (es decir, la fracción enriquecida de células CD27 + B de memoria) 24-25.
- Centrifugar a 600 xg a TA durante 5 min. Resuspender los pellets con medio RPMI 1640 para los experimentos posteriores.
NOTA: Por lo general, ~ 30 - 60% de las células B puede ser purificado como células de memoria CD27 + a partir de las PBMCs de un donante sano 7, 25-26.
3. clasificación de células para la recolección de células B, Naïve células B de memoria, y PBS / PC
- El uso de las células purificadas de la etapa 1, determinar el número de células usando un hemocytometer o un contador de células automático.
- Resuspender las células en tampón PBS frío a la concentración de 10 7 por ml en un tubo de poliestireno de 5 ml.
- Añadir 1 - 2 g de IgG humana por 10 6 células y se incuba en hielo durante 10 min para el bloque de Fc.
- Añadir 1 g cada uno de anti-CD19-APC (clon: HIB19), anti-CD27-eFluor450 (clon: O323), y anti-CD38-PE (clon: hit2) por 10 6 células; mezclar bien e incubar en hielo durante 30 min 4, 27.
- En los últimos 5 minutos en el paso 3.4, añadir 5 l de la 7-aminoactinomicina comercial D (7-AAD).
- Añadir 2 ml de PBS al tubo, vórtice, y se centrifuga a 600 g durante 5 min.
- Resuspender las células en tampón de clasificación (estéril PBS con BSA al 2% y EDTA 2 mM) a una concentración de 1 - 5 x 10 7 células por ml en un tubo de 15 ml.
- Filtrar las células a través de un filtro de células de malla de nylon (40 micras de tamaño de poro) para eliminar grupos de células.
- Separar las células con un flujo de citometría especieer equipado con tres láseres: violeta (405 nm), azul (488 nm) y rojo (640 nm).
NOTA: El láser azul sola es suficiente para 27-28 de citometría de flujo de 3 colores. - Ordenar las células en tres tubos de 15 mL (que contienen 5 ml de medio RPMI) para la recolección simultánea de las células B vírgenes (CD19 + CD27 -), células B de memoria (CD19 + CD27 +), y PBS / PC (CD19 + CD27 + / CD38 + hi) 3-4, 28.
NOTA: Ordenado células B vírgenes y de memoria pueden ser cultivadas como se describe en el paso 4.
4. diferenciación in vitro de células aisladas CD19 humano + B, CD19 + CD27 + células B de memoria, y CD19 + CD27 - ingenuo células B
- El uso de las células purificadas en pasos de 1.19, 2.10, 2.11 y 3.10, determinar el número de células con un hemocitómetro o un contador de células automático.
- Resuspender las células con medio RPMI 1640a una concentración de 1 - 10 x 10 5 por ml y alícuota ellos en los pocillos de una placa de 12 pocillos.
- Añadir CpG (ODN 2006) a los 5 mg / 10 6 células / ml 18, 29.
- Cultivar las células en una incubadora a 37 ° con 5% de CO 2 durante 5 días.
- Recoger las células de cada pocillo, colocarlos por separado en tubos de 15 ml, añadir 5 ml de PBS a cada tubo y centrifugar a 600 xg ellos y RT durante 5 min.
- Contar las células utilizando un hemocitómetro o un contador de células automático. Resuspender las células a una concentración de 1 - 10 x 10 5 por ml con medio RPMI 1640.
5. Ensayo ELISPOT
- Añadir 30 l de 35% de etanol en agua destilada a cada pocillo de las placas de ELISPOT durante 30 s.
NOTA: Al pipetear, evite tocar la membrana en los pozos en todo momento. - Invertir las placas de ELISPOT para eliminar el etanol.
- Ponga 150 l de ddH autoclave 2 O en cada pocillo e incubarellos a TA durante 5 min para enjuagar el etanol residual; seguir con un lavado de PBS estéril a temperatura ambiente durante 3 min.
NOTA: Los pasos 5.1 a 5.3 pueden ser opcionales, dependiendo de la fabricación de las placas. - Ponga 50 l de 5 mg / ml policlonal F (ab ') 2 fragmento de anti-Ig humana (IgG + IgM + IgA) (en PBS) en cada pocillo de las placas de ELISPOT y incubarlos a 4 ° C durante la noche (preferido) o 37 ° C durante 2 h 11.
NOTA: Sellar los bordes de las placas con Parafilm hasta su uso. - Invertir las placas para eliminar Abs sin unir, añadir 200 l de PBS a cada pocillo, y se incuban dos veces a temperatura ambiente durante 3 min cada vez.
- Añadir 200 l de PBS con 5% de BSA (o RPMI 1640) a cada pocillo para bloquear, y incubarlos a temperatura ambiente durante 2 h.
- Invertir las placas para eliminar el tampón de bloqueo. Lavar cada pocillo dos veces con 200 l de PBS, como en el paso 5.5.
- Añadir 100 ml de medio RPMI 1640 a cada pocillo y se incuba ellos en 37 ° C.
- Cuando esté listo para sembrar las células, invertir las placas para eliminar el medio RPMI 1640.
- Seed 100 l (5 x 10 4), 50 l (2,5 x 10 4), y 25 l (1,25 x 10 4) de las células (de medidas 1.19, 2.10, 2.11, 3.10 y 4.6) en los pocillos de una placa de ELISPOT. Con medio RPMI 1640, llevar el volumen a 150 l / pocillo.
NOTA: Un mínimo de una o dos diluciones en serie de 2 veces para el recubrimiento de las células se recomienda. - Se incuban las placas en una incubadora a 37 ° con 5% de CO2 durante 8 a 14 h 18. Evite mover las placas durante la incubación.
- Invertir las placas para eliminar las células y el medio RPMI 1640.
- Añadir 200 l / pocillo de PBS-T (PBS con 0,05% de Tween 20) y se incuba a 5 veces a temperatura ambiente, cada vez durante 3 min. Invertir la placa para eliminar el tampón de lavado entre cada uno de los 5 lavados.
- Añadir o bien fosfatasa alcalina IgG-cabra anti-humano (AP), Abs Fc gamma-específico (para la detección de IgG, 1: 5000 en PBS-T) O de cabra anti-IgM humana-AP, Fcμ Abs-fragmento específico (para la detección de IgM, 1: 5000 en PBS-T) en los pocillos designados y se incuba a RT durante 2 horas en la oscuridad.
- Lavar cada pocillo dos veces con 200 l de PBS, como en el paso 5.5.
- Añadir 50 l de solución de sustrato / pocillo de bromochloroindolyl-nitro azul tetrazolio fosfato (BCIP / NBT). manchas de color violeta aparecen normalmente en el 5 - 15 min.
- Añadir 100 ml / pocillo de ddH2O para evitar el sobre-desarrollo de las manchas.
- Se lavan las placas con agua corriente del grifo después del desarrollo completo de todos los puntos.
- Retire el drenaje inferior de las placas y permitir que se sequen al aire en la oscuridad.
- Contar las manchas usando un lector de placas automatizado con una unidad de adquisición de imágenes / análisis (por ejemplo, un escáner automático o manual a través de un microscopio de disección).
NOTA: Las placas pueden almacenarse a temperatura ambiente en la oscuridad y se analizan más adelante.
Resultados
PBMCs se agotaron de eritrocitos y las células adherentes (pasos 1.2 a 1.7). Una alícuota (2 x 10 6) de las células se sometieron a un análisis de citometría de flujo para ilustrar las poblaciones de células naïve B, células B de memoria, y PBS / PCs en la sangre periférica (Figura 1). En PBMCs de este donante, aproximadamente 10% de los linfocitos eran células B CD19 +. En el compartimiento de células B, el porcentaje de CD19 + CD27 - células B naive fue de alrededor de 50%. Por otro lado, alrededor de 50% de las células CD19 + B eran células CD27 + B de memoria 7, 25-26. Es de destacar que las células CD27 + B de memoria se pueden separar aún más con la inclusión de IgD 4. El fenotipo de hacer circular PB puede ser mejor definido con la expresión baja o ninguna superficie CD20 (CD19 + CD27 + / CD38 + CD20 hi lo / -) 2, 30-31. Para excluir las células muertas, el 7-AADse pueden incluir en la tinción de células (paso 3.5), y una parcela de FSC frente a un 7-AAD permite conmutar la población de células vivas (7-AAD -).
Los pasos clave del ensayo ELISPOT se representan en la Figura 2. Tanto las células B purificadas humanas y células B de memoria CD19 + CD27 + se cultivaron en presencia de CpG con medio RPMI 1640 durante 5 días. Las células se recogieron para el ensayo ELISPOT para cuantificar las ASC recién emergidas. Si está presente, el preexistente PB aislados de la sangre periférica morirán en 48 h 11. El ensayo ELISPOT se llevó a cabo, y las imágenes in situ adquiridas por un escáner automático de placas se demuestra en la Figura 3. Los resultados de ELISpot típicamente muestran 50 - 200 IgM ASCs de 10 4 B células tratadas con CpG durante 5 días, mientras que el número de IgG-ASC es de 10 - 50 en 10 4 células 11.
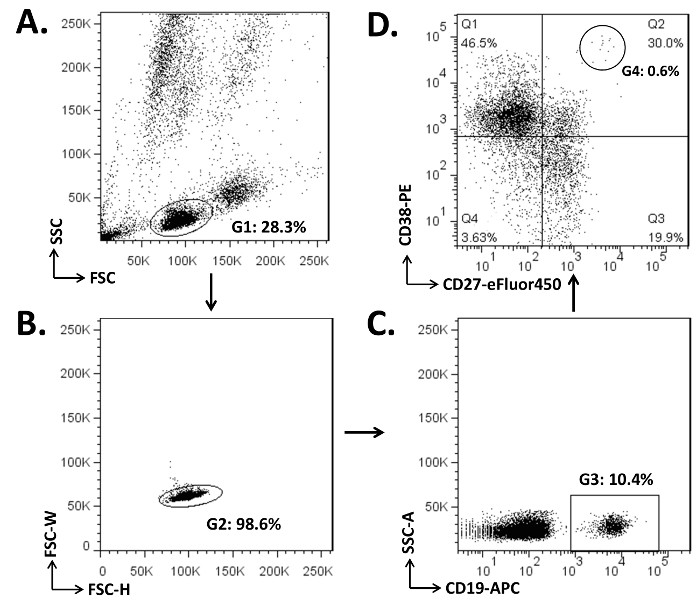
La figura 1. Ejemplo de la estrategia de apertura de puerta para separar las células de los animales B, células B de memoria, y PP en el CMSP. (A) Las células (2 x 10 6) se tiñeron con 2 g de cada uno de CD19-APC, CD27-eFluor450, y mAbs CD38-PE (paso 3.4). El compartimento de linfocitos estaba cerrado (G1) en el diagrama de puntos de dispersión frontal (FSC) frente a la dispersión lateral (SSC). (B) dobletes celulares, que se forman por dos celdas pegadas, fueron excluidos (los G2 exterior) en la parcela de FSC-W (ancho) frente a FSC-H (altura). Las células CD19 + B (C) fueron cerrada como G3 en la parcela para la CSS-A (área) y CD19-APC. (D) de las células CD19 +, el gráfico de puntos de los parámetros de CD27 y CD38 mostraron ingenuo células B (CD19 + CD27 -; Q1 y Q4), células B de memoria (CD19 + CD27 +;Q2 y Q3), y PP (CD19 + CD27 + / CD38 + hi; G4, 0,6% de Q2). Haga clic aquí para ver una versión más grande de esta figura.
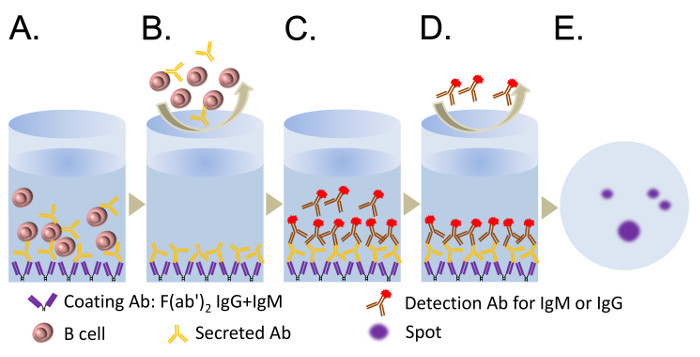
Figura 2. Ejemplos de los pasos clave del ensayo ELISPOT. (A) Colocar 50 l / pocillo (5 mg / ml) de F (ab ') 2 fragmento de anti-Ig humana (IgG + IgM + IgA) en una placa de ELISPOT durante 2 horas a 37 ° C o durante la noche a 4 ° C (preferido) (paso 5.4). Sembrar las células en los pocillos de la placa de ELISPOT. Permitir que las ASC para insertarse en la membrana de PVDF y secreten Abs durante 8 - 14 h (paso 5.11). (B) Lavar las células con PBS (con 0,05% de Tween 20). (C) Añadir la AP o HRP-conjdetección ugated Abs específicos de IgG o IgM. (D) Lavar el Abs de detección que están sin consolidar. (E) Desarrollar las manchas con una solución de sustrato de AP o HRP para que coincida con la detección de Abs. Haga clic aquí para ver una versión más grande de esta figura.
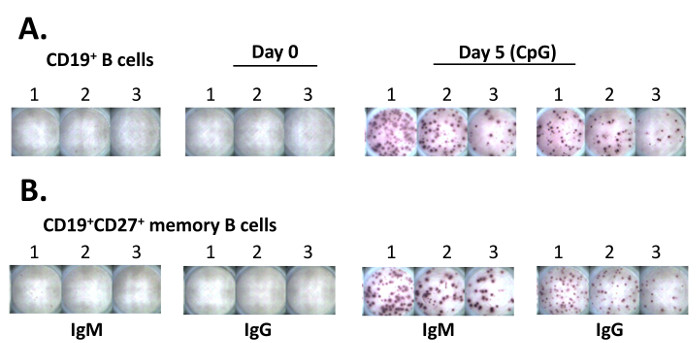
Figura 3. Los resultados de ELISPOT una placa Representante. Células (A) purificada B CD19 + fueron colocados en tres pozos adyacentes (50.000 células en el pozo # 1, 25.000 células en el pozo # 2, y 12.500 células en el pozo # 3, respectivamente) de la placa de ELISPOT. Las células fueron cultivadas en medio RPMI 1640 durante la noche medio (~ 14 h). El ensayo ELISPOT se realizó después de completar la cultura (pasos 5.12 a 5.18). para ANALYZe los resultados, la placa de ELISPOT se escaneó para adquirir imágenes a través de un analizador automático equipado con el escáner y el software. Células de memoria (B) purificada CD19 + CD27 + (10 6 / ml) se cultivaron en presencia de 5 mg / ml de CpG durante 5 días. Las células se trataron como en (A) para el ensayo ELISPOT. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El aislamiento y la purificación de células B de sangre periférica humana
Normalmente, los glóbulos rojos se pueden romper de manera eficiente y borrar por tampón de lisis (paso 1.2). Es importante no incubar PBMCs con el tampón de lisis RBC más de 5 min, como la viabilidad celular puede verse afectado por el cloruro de amonio. Alternativamente, los glóbulos rojos y las plaquetas se pueden eliminar simultáneamente por el siguiente protocolo.
Mezclar la sangre entera fresca con (ACD) tampón de ácido-citrato-dextrosa (ácido cítrico 39 mM, citrato de sodio 75 mM, y dextrosa 135 mM; pH 7,4) en una relación en volumen de 9: 1, la sangre-to-buffer. Centrifugar a 250 xg durante 10 min a TA. Prestar atención a la formación de capas, indicativo de la separación. Aspirar y descartar la capa superior, que contiene plaquetas y plasma rico en plaquetas (color amarillo). Retire la capa intermedia delgada en la interfaz, que contiene las PBMC (i .e., La capa leucocitaria). Evitar la contaminación de glóbulos rojos en la capa inferior (darca de color rojo). Añadir tampón de lisis a la CMSP para eliminar los glóbulos rojos residuales, y luego siga los pasos 1.2 a 1.19.
Dos enfoques se pueden utilizar para aislar células B de PBMC: selección positiva y negativa 21. El método de selección negativa (pasos 1.1 a 1.19) se utiliza para obtener las células B vírgenes, funcionales, sin Abs o microperlas de encuadernado, para los experimentos posteriores. Es crucial tener esto en cuenta a la hora de activación y / o la diferenciación de células B purificadas se produce en la cultura. La preocupación es que las células purificadas por selección positiva pueden ser inadvertidamente influenciados por las microperlas mAb conjugados (0,2 a 5 micras de diámetro). mAbs pueden unirse a los receptores específicos en las células B y por lo tanto podría reticular receptores para la activación. Por otra parte, microperlas pueden ser endocitosis por las células B a través de receptores unidos. Aunque son biodegradables, las microperlas pueden permanecer dentro de las células durante más de una semana. Si la retención de microperlas influirán experesultados mentales necesita ser determinado empíricamente. En la purificación de las células B humanas a través de la selección positiva, anti-CD19 (clones: 4G7 o HIB19) microperlas se utilizan comúnmente porque CD19 se expresa ampliamente en las etapas de desarrollo de células B. La pureza de las células B después de la separación se puede determinar mediante citometría de flujo con anti-CD19 mAb (clones: SJ25C1 o LT19), que reconocen epítopos distintos de microperlas anti-CD19.
La separación y purificación de la memoria y Naïve células B a partir de células B aisladas
CD27 es un marcador de superficie ampliamente aceptado para la memoria humana y la distinción de células B ingenuo 24. La molécula de CD27 pertenece a la familia de receptores del factor de necrosis tumoral (TNFR). Debido a que CD27 se expresa en la mayoría de las células B de memoria humanos, se utiliza comúnmente para discriminar ellos de CD27 - células B vírgenes. Sin embargo, debido CD27 también se expresa en células T y células NK, el uso de microbea anti-CD27ds (clon: O323) en la selección positiva de células B de memoria requiere una previa purificación de las células B (pasos 1.1 a 1.19). Para un control de pureza después de la separación, anticuerpos monoclonales específicos para CD27 humana: se recomiendan (clones L128 o LG.3A10) (etapa 2.12). Dado que las células CD27 + B de memoria son heterogéneos, marcadores de superficie adicionales, tales como IgD y FCRL4, pueden ser considerados para una separación adicional en la clasificación celular 4, 7.
Clasificación de células para obtener células Naïve B, células B de memoria, y PBS / PC
Dado que las células B expresan Fc? RIIB, se recomienda un bloque de Fc (paso 3.3) antes de la tinción de las células con mAbs para citometría de flujo. Los fragmentos Fc de la IgG humana solo pueden bloquear igualmente bien como a toda la IgG humana a 1 g / 10 6 células. Anti-CD32 mAb humanos (clones: 3D3 o AT10) es otra opción para el bloque Fc. Es de destacar que, si Fc? RIIB es un marcador de superficie para ser teñido en las células B purificadas, el anti-CD32 mAb sh fluoróforo conjugadoOuld ser añadido a renunciar al bloque Fc, seguido de tinción con otros mAbs sin un lavado PBS.
Por tres colores citometría de flujo, CD38-FITC (fluoresceína), CD27-PE (ficoeritrina) y CD19-APC (Allophycocyanin) son una combinación típica de fluoróforos. Sin embargo, si el clasificador de citometría de flujo está equipado con tres láseres, tales como las de 405 nm, 488 nm y 640 nm, los investigadores tienen el lujo de elegir fluoróforos excitados por diferentes láseres para la clasificación de células. Como se ilustra en la Figura 1, las células se tiñeron con CD19-APC (clon: HIB19), CD27-eFluor450 (equivalente a azul pacífico, clon: O323), y CD38-PE (clon: HB7) para separar las células B vírgenes, la memoria células B, y PBS. Es de destacar que algunos investigadores prefieren la inclusión de CD45 (clon: HI30) como un marcador de leucocitos y las células de linaje puerta B como CD45 + CD19 + población. Debido a la detección de PBS en circulación en el estado estacionario es una rara vísperant en individuos sanos, bajos o incluso sin expresión superficial de CD20 en la PBS (CD19 + CD27 + / CD38 + CD20 hi lo / -) respalda su bona fide existencia 2, 30-31. Esto es útil cuando se comparan los resultados de la cuantificación de PBS por fenotipos de superficie y ASC por ELISPOT. Durante el período previo a la celda de clasificar, 7-AAD se prefiere yoduro de propidio para la exclusión de las células muertas, debido a su espectro de emisión estrecho y más bajo desbordamiento en multicolor citometría de flujo.
Estimulación in vitro y diferenciación de células B humanas aisladas
El tipo B CpG (ODN 2006) por sí sola puede inducir la diferenciación limitado de ambas IgM e IgG-ASC a partir de células B de memoria. Además, las células B vírgenes son sólo débilmente sensible a CpG y principalmente dan lugar a IgM-ASCs 6, 11. La concentración de CpG en cultivo está en el intervalo de 2,5 a 5 mg / ml por cada 10 6 B célulaso PBMCs 11, 18. Aparte de CpG, las células y los PBMCs B purificadas pueden ser cultivadas en presencia de combinaciones de CpG con mitógenos, citoquinas, y agonistas del BCR, para diferenciar las células B humanas en ASCs en cultivo (paso 4.3). Por ejemplo, se utiliza comúnmente recetas para 10 6 células por ml incluir (a) CpG (5 mg / ml), recombinante humano IL-2 (10 ng / ml), y recombinante humano IL-10 (10 ng / ml) 15, 34; (b) CpG (5 mg / ml) y F (ab ') 2 de Ig anti-humana (IgG + IgM + IgA) (20 mg / ml) 11; (c) CpG (5 mg / mL), proteína A de S. aureus Cowan (SAC) (dilución 1: 10.000), y mitógeno de hierba carmín (PWM) (1: 100.000 de dilución) 18; (d) recombinante humano IL-21 (100 ng / ml) y sCD40L recombinante (1 mg / ml) 12, 15, 33; y (e) recombinante humano IL-2 (10 ng / ml) y R848 (1 mg / ml), un agonista de TLR7 33-34. Aunque las células B pueden ser diferenciadas en ASCs en tres días 11, las células son generalmente pre-stimulated durante 5 a 6 días antes de ser añadido a la placa de ELISPOT para la cuantificación de ASC 11, 18. Durante el período de cultivo, generalmente no hay reposición de los agentes de diferenciación de partida.
La adición de IL-2 e IL-10 a los cultivos que contienen CpG puede aumentar significativamente el número de diferenciado IgM e IgG-ASC 15, 35. La presencia de IL-2 en cultivo puede proporcionar la estimulación mitogénica para facilitar la expansión de las células B diferenciadas por CpG. IL-10 en el intervalo de 10 a 25 ng / ml puede aumentar en gran medida la producción de ASC (~ 3 a 10 veces) en la presencia de CpG 35. Agonistas del BCR, incluyendo anti-BCR y el SAC, y PWM también pueden estimular la proliferación de células B humanas primarias 18. La incubación de las células B de memoria con CpG y policlonal anti-BCR principalmente resultado en un aumento de IgM-ASC pero no en IgG-ASC 28. Para la prevención de la inhibición de la señalización a través de BCR por Fc? RIIB, un F (ab# 39;) 2 fragmento de anti-Ig (10 - 20 mg / ml se recomienda por 10 6 células) cuando reticulación BCR 11. En lugar de anticuerpos policlonales anti-Ig, se deben considerar mAbs anti-BCR específicos para cualquiera de las células IgM + IgG + o B para apuntar subconjuntos de células B específicos de isotipo para la diferenciación en ASC. Una combinación de CpG, SAC (dilución 1: 10.000), y PWM (1: 100.000 de dilución) puede activar eficazmente las células B de memoria de diferenciarse en IgM e IgG-ASC 18, 24. Además, CpG puede inducir moderadamente el cambio de clase de Ig in vitro 28-29. Por el contrario, IL-21 (100 ng / ml) y sCD40L (1 mg / ml) induce eficazmente la diferenciación de células B de memoria exclusivamente a conmutación de IgG-ASC 12, 30. El sCD40L puede activar las células B mediante la imitación de ayuda de células T a través de CD40 en las células B, que influyen en su diferenciación en PC en vivo. Es de destacar, anti-CD40 (clones: 89 o G28.5) puede sustituir a sCD40L en la cultura 15. however, ni sCD40L ni anti-CD40 por sí sola es capaz de inducir la diferenciación de las células B de memoria. Por lo tanto, la activación de CD40 de las células B cultivadas se combina a menudo con un agente de diferenciación, tales como IL-4, CpG, R848, o IL-21, cualquiera de los cuales puede promover el cambio de clase de Ig. IL-4 juega un papel clave en la diferenciación de las células Th2 CD4, lo que permite la inducción de la mayoría de las células IgM + B para cambiar a células IgG1 + B en cultivo. Del mismo modo, en presencia de IL-21, tanto en las células B de memoria y células B vírgenes se diferencian exclusivamente en ASCs cambio de clase 12, 32. Al igual que con CpG, R848 puede inducir un cambio de clase marginal de células B 34. Finalmente, es importante mencionar que aunque lipopolisacárido (LPS) puede inducir eficazmente la diferenciación de células B de ratón en ASC, células B humanas expresan niveles bajos de TLR4 y CD14 29. Debido a que la adición de un agente de diferenciación en cultivo promueve la generación de células B de conmutación, esta adición se debe evitarcuando PBS / PC preexistentes o células B de memoria no conmutados se van a medir.
Ensayo ELISPOT
El ensayo ELISPOT combina ELISA basado en placa con las tecnologías de transferencia de Western basada en la membrana, lo que permite la detección de Abs secretada por una sola célula B 18. El ELISPOT también se ha adaptado para cuantificar las células T Ag-específicas que secretan citoquinas 17, 36. En un ensayo ELISPOT, cualquiera de las células purificadas o PBMC no fraccionadas (libres de RBCs) se pueden utilizar. Sin embargo, ~ 10 veces se requieren más PBMCs que las células se purificó para obtener resultados consistentes en ensayos de ELISPOT. Un buen punto de partida es de 1 - 2 x 10 5 células por pocillo para detectar las ASC que circulan en PBMCs. En la detección de Ag-específica ASC, anti-Ig generalmente se sustituye por Ag (5-10 g / ml en PBS) para capturar-Ag específico ACSs (paso 5.4). El uso de Abs detección específica de isotipo permite la distinción entre IgM-ASC Ag-específicas y de IgG de isotipo-ASC (paso 5.14). Es de destacar que, independientemente de si anti-Ig o Ag se utilizan para capturar las ASC, los Abs de detección utilizados para ELISA puede no siempre ser adecuada para ELISPOT. Del mismo modo, no todos los sustratos de color para ELISA funcionan correctamente en ELISPOT. AP-Abs y HRP-conjugados son los más utilizados para la detección de puntos de ELISPOT. La solución de sustrato BCIP / NBT es una opción popular para la detección basada en AP, mientras que el 3,3 ', 5,5'-tetrametil-bencidina (TMB) y 3-amino-9-etilcarbazol (AEC) soluciones son sustratos comunes para HRP en ELISPOT. Si el AP o HRP se conjuga directamente a la Abs de detección, sólo se necesita un paso para la detección, como se describe en el protocolo (paso 5,14). En contraste, el Abs detección están biotinilados y requieren que siguió la incubación con AP- o estreptavidina conjugada con HRP antes de reaccionar con los sustratos en un método de dos pasos. Ambos métodos de un solo paso y de dos pasos funcionan de manera eficiente para detectar manchas en ELISPOT.
El ensayo ELISPOT puede cuantificar no sólo de circulanteing sino también diferenciado ASC en cultivo (paso 1,19 frente a 4,6). Si está presente, ASC, que normalmente no más de dos días en cultivo vivo de circulación, puede ser directamente cultivadas en la placa de ELISPOT, con o sin purificación a partir de PBMCs 11. En contraste, la diferenciación de las células B de memoria requiere 5 días. Por lo tanto, no se recomienda el cultivo directo en placas ELISPOT después del aislamiento de células (paso 1,19); los restos de células muertas que resulta de la cultura período prolongado puede aumentar el fondo en la detección in situ. En cambio, tanto las células B purificadas y PBMCs totales primero pueden ser cultivadas en una placa de 6 pocillos o de 12 pocillos en presencia de mitógenos y agentes de diferenciación (paso 4.3). Durante el proceso de cultivo, la adición repetida de agentes de estimulación no es necesario (paso 4.3). Mientras que las placas están en la incubadora, la puerta de la incubadora se debe abrir suavemente y cerrada para evitar ASCs cabezas de serie se mueva, porque ellos pueden difundir Abs secretadas a lo largo de las pistas en movimiento, la generación de manchascon las colas (las denominadas "manchas en forma de cometa") (paso 5.11). El período de incubación en placas de ELISPOT se determina por el tiempo necesario para que las células para secretar cantidades detectables de Abs sin permitir que las células se dividen, lo que crearía dificultades en el conteo punto. Así, las células son generalmente cultivadas en el intervalo de 8 h a toda la noche (paso 5,11).
El ensayo ELISPOT es el método más ampliamente utilizado para la cuantificación de las respuestas de células B de memoria. Se ha convertido en un popular de lectura, independientemente de la respuesta inmune humoral y la memoria inmunológica. En la práctica, se requiere la cultura mitogénica anterior para activar las células B de memoria para la diferenciación en ASC (paso 4.3). Sin embargo, la frecuencia a la que las células B de memoria se expanden y se diferencian en ASCs varía en diferentes medio de cultivo, como se describe anteriormente. Aunque sin consenso, la mayoría de los investigadores adoptan la condición de inducción que puede maximizar la producción de ASC. En términos del agente utilizado para detectio punton, a soluble biotinilado Ag puede sustituir a la detección satisfactoria Ab sin comprometer la sensibilidad 37. Esto es de particular importancia cuando la disponibilidad de Ag es limitada porque se requiere una cantidad mucho menor de Ag para la detección de para el recubrimiento de las placas. Por último, ELISpot no permite el análisis fenotípico de la heterogeneidad celular, y por lo tanto requiere el fraccionamiento previo de las subpoblaciones de células. Recientemente, un ensayo ELISPOT multicolor, en el que la detección Abs están etiquetados con diferentes fluoróforos, ha sido desarrollado para la detección de múltiples tipos de células secretoras de citoquinas en un solo pozo 38-39. Esta nueva tecnología será de particular interés para la detección de células de baja frecuencia en PBMCs y para un análisis a gran escala de las respuestas de las células B inducidos por la vacuna.
Debido a que el ensayo ELISPOT es rápido y eficiente en la cuantificación de las ASC y células secretoras de citocinas, se ha extendido para medir la funcionalidad de no sólo circuLating linfocitos, pero también las células inmunes tejido tales como leucocitos intrahepáticos 40. Debido a su sensibilidad alcanzando el nivel de la detección de incluso un solo ASC, el ensayo ELISPOT se ha utilizado cada vez más para medir las respuestas inmunes humanas a eficacias de vacunas contra los patógenos existentes y emergentes. Aunque el rendimiento de alto rendimiento y la solidez de ensayo ELISPOT son excelentes para las evaluaciones a gran escala de las respuestas inmunes utilizando PBMCs, los resultados de los ensayos pueden ser influenciados por varios factores, tales como el retardo de procesamiento de muestras, si las células son frescas o congeladas , componentes del suero en el medio de cultivo, y el número de células añadidas a la placa de ELISPOT 41. Por lo tanto, los procedimientos de normalización deben ser incluidos en el protocolo ELISPOT para minimizar las variaciones intra e inter-ensayo en gran escala y los estudios longitudinales de seguimiento (por ejemplo, los ensayos de vacunas). El método de normalización de lectura de placas también es fundamental para la linealidad, exactitud, y los contrasistency en el ensayo da como resultado 41-42. Una forma de llevar a cabo la normalización de lectura de placas es de ampliar el procedimiento de la dilución en serie de células sembradas en placas de ELISPOT (paso 5.10). Mediante la creación de una placa de referencia, las diluciones en serie más deben demostrar una relación lineal entre el número de células por pocillo chapados y los recuentos de punto por pocillo. exploraciones repetidas de la placa de ELISPOT se pueden utilizar para validar la plantilla de conteo punto, tanto automática como manualmente. Mínima variabilidad intra-bien en los recuentos puntuales se anticipa después de estos procedimientos de normalización 43. Por último, la aplicación de ELISPOT se puede extender de muchas maneras, tales como para el seguimiento de las respuestas al tratamiento de pacientes con infecciones y teniendo inmunoterapias de cáncer, así como a la evaluación de inmunotoxicidad (por ejemplo, la inmunosupresión y la autoinmunidad inducida por fármacos).
Divulgaciones
The author declares no competing financial interests.
Agradecimientos
This study was supported by a research grant from the Ministry of Science and Technology of the Executive Yuan of Taiwan (NSC99-2320-B-002-011). I would like to acknowledge the excellent service provided by the Flow Cytometric Analyzing and Sorting Core of the First Core Laboratory in College of Medicine of National Taiwan University.
Materiales
| Name | Company | Catalog Number | Comments |
| BD Vacutainer K2E | BD Biosciences | 367525 | 10 mL tube |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-02 | endotoxin-free |
| Trypan blue 0.5% solution | Biological Industries | 03-102-1B | |
| IMag Human B lymphocyte enrichment set | BD Biosciences | 558007 | |
| Biotinylated CD27 mAb | Biolegend | 302804 | clone O323 |
| Streptavidin magnetic microbeads | BD Biosciences | 9000810 | |
| 15 mL Falcon tubes | BD Falcon | 352196 | |
| Blue nylon mesh cell strainer, 40 μm | BD Falcon | 352340 | |
| Anti-human CD19-APC | Biolegend | 302212 | clone HIB19 |
| Anti-human CD27-eFluor 450 | eBioscience | 48-0279-42 | clone O323 |
| Anti-human CD38-PE-Cy7 | Biolegend | 303516 | clone HIT2 |
| Anti-human CD38-PE-Cy7 | BD Biosciences | 560677 | clone HIT2 |
| Anti-human CD45-FITC | Biolegend | 304006 | clone HI30 |
| Anti-human CD45-FITC | BD Biosciences | 555482 | clone HI30 |
| Anti-mouse/rat/human CD27-PerCP Cy5.5 | Biolegend | 124213 | clone LG.3A10 |
| Anti-human CD27-PerCP Cy5.5 | BD Biosciences | 65429 | clone L128 |
| Anti-human CD19-FITC | Miltenyi Biotec | 130-098-064 | clone LT19 |
| Anti-human CD19-FITC | GeneTex | GTX75599 | clone LT19 |
| Anti-human CD20-FITC | BD Biosciences | 555622 | clone 2H7 |
| biotinylated anti-human CD27 | Biolegend | 302804 | clone O323 |
| biotinylated anti-human CD27 | eBioscience | 13-0279-80 | clone O323 |
| 7-aminoactinomycin D (7-AAD) | BD Biosciences | 559925 | |
| CpG (ODN 2006) | InvivoGen | tlrl-2006 | type B CpG |
| Recombinant human IL-2 | PeproTech | 200-02 | |
| Recombinant human IL-10 | PeproTech | 200-10 | |
| Recombinant human IL-21 | PeproTech | 200-21 | |
| Recombinant human sCD40L | PeproTech | 310-02 | |
| Protein A of S. aureus Cowan (SAC) | Sigma-Aldrich | 82526 | |
| Pokeweed mitogen (PWM) | Sigma-Aldrich | L9379 | |
| MultiScreen filter plates, 0.45 µm pore size | Merck Millipore | MSIPS4510 | sterile, clear 96-well filter plate with hydrophobic PVDF membrane |
| BCIP/NBT solution | Sigma-Aldrich | B6404 | |
| BCIP/NBT single reagent, alkaline phosphatase substrate | Merck Millipore | ES006 | |
| Human IgG | Jackson ImmunoResearch | 009-000-003 | |
| Human IgG, Fc fragment | Jackson ImmunoResearch | 009-000-008 | |
| F(ab')2 fragment of goat anti-human Ig (IgG + IgM + IgA) | Jackson ImmunoResearch | 109-006-127 | |
| Goat anti-human IgG-alkaline phosphatase, Fcγ fragment specific | Jackson ImmunoResearch | 109-055-008 | |
| Goat anti-human IgM-alkaline phosphatase, Fcµ fragment specific | Jackson ImmunoResearch | 109-055-043 | |
| Goat anti-human IgG-peroxidase, Fcγ fragment specific | Jackson ImmunoResearch | 109-035-008 | |
| Goat anti-human IgM-peroxidase, Fcµ fragment specific | Jackson ImmunoResearch | 109-035-095 | |
| BD ELISPOT AEC substrate kit | BD Biosciences | 551951 | |
| C.T.L. ImmunoSpot analyzer | C.T.L. |
Referencias
- Bemark, M. Translating transitions - how to decipher peripheral human B cell development. J. Biomed. Res. 29 (4), 264-284 (2015).
- Odendahl, M., et al. Generation of migratory antigen-specific plasmablasts and mobilization of resident plasma cells in a secondary immune response. Blood. 105 (4), 1614-1621 (2005).
- Jackson, S. M., Wilson, P. C., James, J. A., Capra, J. D. Human B cell subsets. Adv. Immunol. 98, 151-224 (2008).
- Sanz, I., Wei, C., Lee, F. E., Anolik, J. Phenotypic and functional heterogeneity of human memory B cells. Semin. Immunol. 20 (1), 67-82 (2008).
- Perez-Andres, M., et al. Human peripheral blood B-cell compartments: A crossroad in B-cell traffic. Cytometry B Clin. Cytom. 78 (Suppl 1), S47-S60 (2010).
- Huggins, J., et al. CpG DNA activation and plasma-cell differentiation of CD27- naïve human B cells. Blood. 109 (4), 1611-1619 (2007).
- Wu, Y. C., Kipling, D., Dunn-Walters, D. K. The relationship between CD27 negative and positive B cell populations in human peripheral blood. Front. Immunol. 2, 81(2011).
- Maïga, R. I., Bonnaure, G., Rochette, J. T., Néron, S. Human CD38hiCD138⁺ plasma cells can be generated in vitro from CD40-activated switched-memory B lymphocytes. J. Immunol. Res. 2014, 635108(2014).
- Wienands, J., Engels, N. The memory function of the B cell antigen receptor. Curr. Top. Microbiol. Immunol. 393, 107-121 (2016).
- Kurosaki, T., Kometani, K., Ise, W. Memory B cells. Nat. Rev. Immunol. 15 (3), 149-159 (2015).
- Tzeng, S. J., Li, W. Y., Wang, H. Y. FcγRIIB mediates antigen-independent inhibition on human B lymphocytes through Btk and p38 MAPK . J. Biomed. Sci. 22, 87-98 (2015).
- Ettinger, R., et al. IL-21 induces differentiation of human naïve and memory B cells into antibody-secreting plasma cells. J. Immunol. 175 (12), 7867-7879 (2005).
- Bekeredjian-Ding, I., Foermer, S., Kirschning, C. J., Parcina, M., Heeg, K. Poke weed mitogen requires Toll-like receptor ligands for proliferative activity in human and murine B lymphocytes. PLoS One. 7 (1), e29806(2012).
- Bernasconi, N. L., Traggiai, E., Lanzavecchia, A. Maintenance of serological memory by polyclonal activation of human memory B cells. Science. 298 (5601), 2199-2202 (2002).
- Defrance, T., Vanbervliet, B., Brière, F., Durand, I., Rousset, F., Banchereau, J. Interleukin 10 and transforming growth factor beta cooperate to induce anti-CD40-activated naive human B cells to secrete immunoglobulin A. J. Exp. Med. 175 (3), 671-682 (1992).
- Hornbeck, P., Fleisher, T. A., Papadopoulos, N. M., et al. Chapter 2, Unit 2.2, Isotype determination of antibodies. Current Protocols in Immunology. Coligan, J. E., et al. , (2001).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Crotty, S., Aubert, R. D., Glidewell, J., Ahmed, R. Tracking human antigen-specific memory B cells: a sensitive and generalized ELISPOT system. J. Immunol. Methods. 286 (1-2), 111-122 (2004).
- Zhang, Y., Wang, Y., Zhang, M., Liu, L., Mbawuike, I. N. Restoration of retarded influenza virus-specific immunoglobulin class switch in aged mice. J. Clin. Cell. Immunol. 7 (2), 403(2016).
- Doedée, A. M., Kannegieter, N., Öztürk, K., van Loveren, H., Janssen, R., Buisman, A. M. Higher numbers of memory B-cells and Th2-cytokine skewing in high responders to hepatitis B vaccination. Vaccine. 34 (19), 2281-2289 (2016).
- Coligan, J. E., et al. Chapter 7, Unit 7.5, Isolation of human B cell populations. Current Protocols in Immunology. , (2011).
- Safarík, I., Safaríková, M. Use of magnetic techniques for the isolation of cells. J. Chromatogr. B Biomed. Sci. Appl. 722 (1-2), 33-53 (1999).
- Morbach, H., Eichhorn, E. M., Liesem, J. G., Girschickm, H. J. Reference values for B cell subpopulations from infancy to adulthood. Clin. Exp. Immunol. 162 (2), 271-279 (2010).
- Thornton, A. M., et al. Chapter 3, Unit 3.5A, Fractionation of T and B cells using magnetic beads. Current Protocols in Immunology. Coligan, J. E., et al. , (2003).
- Klein, U., Rajewsky, K., Küppers, R. Human immunoglobulin (Ig)M+IgD+ peripheral blood B cells expressing the CD27 cell surface antigen carry somatically mutated variable region genes: CD27 as a general marker for somatically mutated memory)Bcells. J.Exp. Med. 188 (9), 1679-1689 (1998).
- Bohnhorst, J. Ø, Bjørgan, M. B., Thoen, J. E., Natvig, J. B., Thompson, K. M. Bm1-Bm5 classification of peripheral blood B cells reveals circulating germinal center founder cells in healthy individuals and disturbance in the B cell subpopulations in patients with primary Sjögren's syndrome. J. Immunol. 167 (7), 3610-3618 (2001).
- Bleesing, J. J., et al. Chapter 7, Unit 7.35, Assays for B cell and germinal center development. Current Protocols in Immunology. Coligan, J. E., et al. , (2003).
- Horvatinovich, J. M., Sparks, S. D., Mann, K. P. Establishing a pure lymphocyte gate for subset analysis by flow cytometry. Cytometry. 26 (2), 172-177 (1996).
- Ruprecht, C. R., Lanzavecchia, A. Toll-like receptor stimulation as a third signal required for activation of human naive B cells. Eur. J. Immunol. 36 (4), 810-816 (2006).
- Smith, K., et al. Rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen. Nat. Protoc. 4 (3), 372-384 (2009).
- Caraux, A., et al. Circulating human B and plasma cells. Age-associated changes in counts and detailed characterization of circulating normal CD138- and CD138+ plasma cells. Haematologica. 95 (6), 1016-1020 (2010).
- Kuchen, S., Robbins, R., Sims, G. P., Sheng, C., Phillips, T. M., Lipsky, P. E., Ettinger, R. Essential role of IL-21 in B cell activation, expansion, and plasma cell generation during CD4+ T cell-B cell collaboration. J. Immunol. 179 (9), 5886-5896 (2007).
- Pinna, D., Corti, D., Jarrossay, D., Sallusto, F., Lanzavecchia, A. Clonal dissection of the human memory B-cell repertoire following infection and vaccination. Eur. J. Immunol. 39 (5), 1260-1270 (2009).
- Jahnmatz, M., et al. Optimization of a human IgG B-cell ELISpot assay for the analysis of vaccine-induced B-cell responses. J. Immunol. Methods. 391 (1-2), 50-59 (2013).
- Weiss, G. E., et al. High efficiency human memory B cell assay and its application to studying Plasmodium falciparum-specific memory B cells in natural infections. J. Immunol. Methods. 375 (1-2), 68-74 (2012).
- Leehan, K. M., Koelsch, K. A. T Cell ELISPOT: For the identification of specific cytokine-secreting T cells. Methods. Mol. Biol. 1312, 427-434 (2015).
- Karahan, G. E., et al. Quantification of HLA class II-specific memory B cells in HLA-sensitized individuals. Hum. Immunol. 76 (2-3), 129-136 (2015).
- Hadjilaou, A., Green, A. M., Coloma, J., Harris, E. Single-cell analysis of B cell/antibody cross-reactivity using a novel multicolor FluoroSpot assay. J. Immunol. 195 (7), 3490-3496 (2015).
- Janetzki, S., Rueger, M., Dillenbeck, T. Stepping up ELISpot: multi-level analysis in FluoroSpot assays. Cells. 3 (4), 1102-1115 (2014).
- Alatrakchi, N., Graham, C. S., He, Q., Sherman, K. E., Koziel, M. J. CD8+ cell responses to hepatitis C virus (HCV) in the liver of persons with HCV-HIV coinfection versus HCV monoinfection. J. Infect. Dis. 191 (5), 702-709 (2005).
- Smith, S. G., et al. Identification of major factors influencing ELISpot-based monitoring of cellular responses to antigens from Mycobacterium tuberculosis. PLoS. One. 4 (11), e7972(2009).
- Sundararaman, S., et al. High reproducibility of ELISPOT counts from nine different laboratories. Cells. 4 (1), 21-39 (2015).
- Janetzki, S., et al. Guidelines for the automated evaluation of Elispot assays. Nat. Protoc. 10 (7), 1098-1115 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados