Method Article
L'isolamento, la differenziazione e quantificazione di Human anticorpo-secernenti cellule B da sanguigno: ELISpot come una lettura funzionale del umorale immunità
In questo articolo
Riepilogo
Human peripheral blood is commonly used for the assessment of the humoral immune response. Here, the methods for isolating human B cells from peripheral blood, differentiating human B cells into antibody (Ab)-secreting B cells (ASCs) in culture, and enumerating the total IgM- and IgG-ASCs via an ELISpot assay are described.
Abstract
Il segno distintivo dell'immunità umorale è generare ASC funzionali, che sintetizzano e secernono Abs specifici per un antigene (Ag), come un agente patogeno, e sono utilizzati per difesa dell'ospite. Per la determinazione quantitativa dello stato funzionale della risposta immunitaria umorale di un individuo, sia Abs siero e ASC circolanti sono comunemente misurati come letture funzionali. Negli esseri umani, sangue periferico è il campione più conveniente e facilmente accessibile che può essere utilizzato per la determinazione della risposta immunitaria umorale indotta da cellule ospiti B. sottoinsiemi delle cellule B distinte, tra cui ASC, possono essere isolate direttamente dal sangue periferico mediante selezione con microsfere Ab-coniugati specifici lineage o tramite cella di smistamento con citometria a flusso. Inoltre, purificato le cellule B naive e memoria possono essere attivati e differenziate in ASC nella cultura. Le attività funzionali di ASC per contribuire alla Ab secrezione può essere quantificata ELISpot, che è un metodo che converge enzimasaggio linked immunoabsorbance (ELISA) e le tecnologie di Western blotting per consentire l'enumerazione dei singoli ASC a livello di singola cellula. In pratica, il saggio ELISPOT è stato usato sempre per valutare l'efficacia del vaccino a causa della facilità di trattamento di un gran numero di campioni di sangue. I metodi di isolare cellule B umane da sangue periferico, la differenziazione delle cellule B in ASC in vitro, e l'impiego di ELISpot per la quantificazione del totale IgM e IgG-ASC verranno descritte qui.
Introduzione
cellule B svolgono un ruolo centrale nello sviluppo di immunità umorale. Inizialmente si sviluppano nel midollo osseo ed entrano nel flusso sanguigno come cellule naive B, che possono migrare nei tessuti linfoidi, come la milza, i linfonodi, tonsille e, per un ulteriore sviluppo. Su Ag incontro, alcune cellule B naïve migrano in follicoli linfoidi, dove il centro germinale cellule B possono differenziarsi in cellule di memoria B e plasmablasts (PBS) / plasmacellule (PC). Mentre la maggior parte dei PC PBS / uscita nel flusso sanguigno, alcuni infine risiedono nel midollo osseo di sottoporsi a differenziazione terminale nei PC di lunga durata 1. Cellule B in circolazione sono eterogenei, e allo stato stazionario, PBS / PC sono rari nel sangue periferico 2. Come risultato della disponibilità di marcatori di superficie specifici lineage, citometria a flusso è diventato un metodo popolare per l'identificazione e la caratterizzazione dei sottoinsiemi B-cellule nel sangue periferico. Un'applicazione estesa di cytometr flussoy è l'aggiunta di una funzione cell sorter, che permette la separazione e l'isolamento di singoli sottogruppi di cellule B con elevata purezza. Sulla base della espressione dei recettori di superficie specifici a diversi stadi di sviluppo, che circolano cellule B umane sono generalmente classificati in tre sottopopolazioni principali: le cellule B naive (CD19 + CD27 - CD38 -), le cellule B di memoria (CD19 + CD27 + CD38 -), e PBS / PC (CD19 + CD27 + CD38 +) 3-4 (Figura 1). le cellule B naïve per natura non hanno incontrato Ags. Tuttavia, possono essere differenziate in cellule IgM + CD27 + B di memoria. Anche se le cellule B naïve sono omogenei nell'esprimere recettore per l'antigene delle cellule B (BCR) molecole -associated (ad esempio, CD19, CD20 e CD22) siano eterogenei nella loro immunoglobuline repertorio 5. La maggior parte delle cellule CD27 + B di memoria può essere differenziato in CD27+ / hi CD38 + PBS / PC 6. Inoltre, le cellule B di memoria e PBS / PC sono policlonali ed esibiscono evolutiva e funzionale l'eterogeneità 4-7. PBS / PC in circolazione sono normalmente di breve durata e non esprimono CD138, ma quelli fatti di stabilirsi nel midollo osseo saranno terminali differenziare e diventare di lunga durata. Terminalmente differenziate PC esprimono CD138 e giù-regolano le molecole CD27 sulla loro superficie 8. Dal momento che sia PB e PC sono in grado di secernere Abs, in molte occasioni sono collettivamente indicati come ASC. Al contrario, né le cellule B naïve né cellule B di memoria in grado di produrre quantità apprezzabili di Abs 9-10. Tuttavia, quando isolato, entrambe le cellule B naive e memoria possono essere differenziati in ASC in 3 - 10 giorni, quando sono immessi nelle condizioni di coltura appropriate 6, 11-15. Infatti, ASC derivati da in vitro la differenziazione delle azioni simili espressioni superficiali di CD27 e CD38 con i diretti isolato frsangue periferico om 6. Inoltre, le ASC differenziate in vitro esprimono un basso livello di CD20 superficie, simile quella di PBS / PC 6 in circolazione. Anche se le ASC cultura di derivazione sono tutti di breve durata, possono secernono Abs, che indica che essi sono funzionalmente competenti e in grado di contribuire alla immunità umorale.
Sia ELISA e ELISpot sono di gran lunga i metodi più comunemente applicato con cui ottenere informazioni funzionali sulla risposta immunitaria umorale. ELISA è un test piastra base 96 pozzetti, ed è utilizzato frequentemente per misurare i titoli di siero Abs Ag-specifica ed altri analiti (ad esempio, citochine). E 'conveniente e scalabile. ELISA è progettato per utilizzare un saggio enzimatico in fase solida per rilevare la presenza di Abs o altre sostanze, quali siero, in un campione liquido 16. Le letture da ELISA siero sono stati ampiamente utilizzati per rappresentare la risposta immunitaria del corpo. Uno strumento necessario per l'acquisizione di riadouts da ELISA test è un lettore spettrofotometrico. Il lettore può determinare la densità ottica (OD) dei prodotti finali tipicamente risultanti dalla reazione di perossidasi di rafano (HRP) coniugata Abs rilevamento e loro substrati specifici 17. Per quanto riguarda la segnalazione della risposta immunitaria umorale, livelli sierici Ab determinati mediante ELISA denotano collettivo, ma non individuale, prestazioni di ASC nel corpo. Inoltre, ELISA non tiene conto della partecipazione dalle cellule B di memoria, che non secernono Abs.
Come ELISA, ELISpot è un metodo ampiamente utilizzato per la rilevazione e il monitoraggio della risposta immunitaria nei campioni di sangue periferico 17-18. ELISpot è una tecnica relativa a un sandwich ELISA. In esso, le cellule vengono inseriti nella difluoruro di polivinilidene (PVDF) pozzi membrana-backed di 96 pozzetti per una cultura a breve termine. Il saggio ELISPOT è analogo all'esecuzione di western blotting su una micropiastra e developing le macchie sulla membrana PVDF in ogni pozzetto. è richiesto un sistema di lettore ELISpot automatico o uno stereomicroscopio per il conteggio manuale. Il vantaggio principale di ELISpot nel rilevare una risposta immunitaria è la sua eccezionale sensibilità nella quantificazione di ASC e cellule secernenti citochine. Riporta le loro attività funzionali in immunità umorale e cellulare, rispettivamente. Nella misurazione della funzione immunitaria umorale, livelli sierici Ab determinati mediante ELISA e il numero di ASC enumerate da ELISpot sono spesso correlati, ma le letture dati da questi due saggi hanno alcune differenze nelle implicazioni funzionali 19-20. Il vantaggio principale di ELISpot è la sua sensibilità del metodo. Il livello di siero titoli Ab come riportato da ELISA è presentato semi-quantitativamente come letture OD, che indica il livello Ab relativa, o più quantitativamente, come letture di concentrazione quando una quantità nota dei propri isotipi di Abs è incluso per riferimento. Al contrario, i risultati di ELISpot sono Presented come il numero assoluto di ASC in un pool di cellule di interesse (ad esempio, le cellule mononucleate del sangue periferico non frazionate (PBMC) e le cellule B purificate da PBMC). ELISpot può rilevare una singola ASC, ma ELISA richiede quantità Ab da ASC raggiungere concentrazioni dosaggio-dipendente ottimizzate prima della misura. Quindi, ELISpot è ovviamente superiore a ELISA nella sensibilità di quantificazione. Inoltre, ELISpot è adatto anche per quantificare le ASC differenziate in vitro da cellule B di memoria attivate. le cellule B di memoria non secernono Abs ma possono differenziarsi in ASC al momento di attivazione; non hanno quindi alcun contributo di Abs siero rilevati da ELISA. Così, ELISpot è il metodo di scelta nella misurazione della risposta immunitaria delle cellule B della memoria circolanti dopo l'attivazione in coltura. Esso consente il monitoraggio del mantenimento dell'immunità umorale a lungo termine.
Protocollo
sangue periferico umano deve essere ottenuto da donatori sani sotto il consenso informato, e l'uso di campioni di sangue deve essere conforme alle linee guida approvate stabiliti dalle singole schede di revisione istituzionale. In questo studio, il protocollo da utilizzare sangue umano in una dimostrazione dei risultati di citometria a flusso (Figura 1) e saggi ELISPOT (Figura 3) è stato approvato dal Consiglio riesame interno della National Taiwan University Hospital (numero di protocollo 201307019RINB).
1. isolamento e la purificazione delle cellule del sangue umano periferico B
- Draw ~ 10 ml di sangue dalla vena mediana cubitale (nella fossa anterior cubitale al gomito) in una provetta da 15 ml contenente K 2 EDTA (da 1,5 a 2,0 mg / ml di sangue) e immediatamente invertire la provetta diverse volte per impedire coagulo formazione.
- Aggiungere 35 ml di autoclave (121 ° C, 15 min) di globuli rossi (RBC) tampone di lisi (150 mm NH 4 Cl, 10 mM KHCO 3, e 1 mM EDTA; pH 7.4) per il tubo contenente il campione di sangue fresco (≥ 3: 1 vol / vol) e incubare a temperatura ambiente (RT) per non più di 5 min.
NOTA: L'aspetto della trasmissione della luce attraverso il tubo indica il completamento di RBC lisi. - Centrifugare a 600 xg a temperatura ambiente per 5 min. Assicurarsi che il pellet è di colore bianco.
- Risospendere il pellet con 10 ml di autoclavato PBS (PBS, 137 mM NaCl, 2,7 mM KCl, 4,3 mM Na 2 HPO 4, e 1,47 mM KH 2 PO 4, pH 7.4) e centrifugare come al punto 1.3.
- Eliminare il surnatante, risospendere il pellet con 10 ml di terreno RPMI 1640 (integratori: 10% di siero fetale di vitello, 100 U / mL di penicillina / streptomicina, 0,25 mg / ml di amfotericina B, e 2 mM L-glutammina), e poi piastra del le cellule in una capsula di Petri di 10 cm (10 ml di sangue per ogni piatto). Posizionare il piatto in un incubatore a 37 ° con 5% di CO 2 per 30 min.
- Agitare delicatamente il piatto cultura un paio di volte e posizionare ilterreno di coltura (cellule in sospensione) in tubi conici di plastica da 15 ml. Eliminare le cellule aderenti (per lo più macrofagi) sulle piastre di coltura.
- Centrifugare a 600 xg a temperatura ambiente per 5 min. Eliminare il surnatante.
- Risospendere il pellet con 1 ml di RPMI 1640 medium. Contare il numero di cellule con un emocitometro o un contatore di cellule automatizzato.
NOTA: La vitalità dei leucociti isolati è normalmente superiore al 90% per esclusione trypan blu. - Centrifugare come al punto 1.7 e risospendere le cellule in ~ 200 ml di tampone PBS freddo (0,5% di siero albumina bovina (BSA) e 2 mM EDTA) alla concentrazione di 5 - 10 x 10 6 cellule / ml.
- Aggiungere 5 ml di biotinilato Ab cocktail anti-umano specifico per le cellule del sangue (per la selezione negativa di cellule B) per 10 6 cellule e incubare su ghiaccio per 30 min 21.
NOTA: L'Ab cocktail anti-umano dovrebbe includere almeno Abs specifico per CD2 (o CD3), CD14, CD16 e. - Aggiungere un volume in eccesso di 10 voltedi PBS sterile per le cellule, centrifugare a 600 xg per 5 min, e scartare il surnatante.
- Aggiungere la stessa quantità di microperle streptavidina coniugato (5 ml per 10 6 cellule) al pellet e mescolare accuratamente.
- Incubare in ghiaccio per 30 min in una provetta conica da 15 ml in plastica.
- Aggiungere 2 ml di tampone PBS nella provetta.
- Posizionare il tubo in un supporto magnetico e incubare a temperatura ambiente per 8 min. Le microsfere marrone gradualmente allegare alla parete del tubo accanto al magnete 22.
- Con il tubo rimanente nel supporto magnetico, trasferire accuratamente il surnatante in una nuova provetta sterile da 15 mL 22.
- Ripetere i passaggi 1,14-1,16, e combinare le due surnatanti che contengono le cellule B incontaminati. Eliminare le microsfere.
- Centrifugare a 600 xg a temperatura ambiente per 5 min. Eliminare il surnatante.
- Risospendere il pellet in terreno RPMI 1640 per esperimenti a valle.
NOTA: in genere, 1 - 5 x 10 5 B cellule ingegnoah purezza superiore al 95% da 10 mL di sangue periferico può essere isolata 23.
2. Le cellule purificazione e separazione della Memoria e della Naïve B da cellule B isolate
- Utilizzare le cellule purificate dal punto 1 e determinare il numero di cellule utilizzando un emocitometro o un contatore di cellule automatica.
- Risospendere le cellule in 100 microlitri di tampone PBS freddo dopo centrifugazione a 600 xg ed RT per 5 min.
- Aggiungere 1 - 2 mg di biotinilato mAb CD27 per 10 6 cellule e incubare su ghiaccio per 30 min.
- Aggiungere 10 ml di tampone PBS nella provetta e centrifugare a 600 xg per 5 min.
- Eliminare il surnatante e risospendere le cellule in 50 ml di tampone PBS.
- Aggiungere la stessa quantità di microsfere magnetiche streptavidina (1 - 2 mg / 10 6 celle) alle cellule in una provetta di plastica conico da 15 ml.
- Delicatamente mescolare bene e incubare in ghiaccio per 30 min.
- Aggiungere 2 - 3 mL di tampone PBS al tubo.
- Posiziona iltubo in un supporto magnetico e incubare a temperatura ambiente per 8 minuti per consentire le microsfere marrone da allegare al lato più vicino al magnete.
- Con il tubo nel supporto magnetico, trasferire accuratamente il surnatante in una nuova provetta sterile. Questa frazione contiene il CD27 arricchito - le cellule B naïve.
- Aggiungere 5 mL alla provetta contenente le microsfere e risospendere delicatamente le microsfere (cioè, la frazione arricchita di cellule CD27 + B memoria) 24-25.
- Centrifugare a 600 xg a temperatura ambiente per 5 min. Risospendere il pellet con RPMI 1640 medium per gli esperimenti a valle.
NOTA: Tipicamente, ~ 30 - 60% della cellule B può essere purificato come celle di memoria CD27 + dalle PBMC di un donatore sano 7, 25-26.
3. separazione delle cellule per la raccolta di cellule naive B, cellule B di memoria, e PBS / PC
- Utilizzando le cellule purificate dal punto 1, determinare il numero di cellule utilizzando un hemocytometer o un contatore di cellule automatica.
- Risospendere le cellule in tampone PBS freddo alla concentrazione di 10 7 per ml in provette di polistirene da 5 mL.
- Aggiungere 1 - 2 mg di IgG umana per 10 6 cellule e incubare su ghiaccio per 10 min per il blocco Fc.
- Aggiungere 1 mg ciascuno di anti-CD19-APC (clone: HIB19), anti-CD27-eFluor450 (clone: O323), e anti-CD38-PE (clone: HIT2) per 10 6 cellule; mescolare bene e incubare in ghiaccio per 30 min 4, 27.
- Negli ultimi 5 minuti al punto 3.4, aggiungere 5 ml di 7-aminoactinomycin commerciale D (7-AAD).
- Aggiungere 2 ml di PBS al tubo, vortex e centrifugare a 600 xg per 5 min.
- Risospendere le cellule in classificare tampone (PBS sterile con 2% BSA e 2 mM EDTA) ad una concentrazione di 1 - 5 x 10 7 cellule per ml in un tubo da 15 ml.
- Filtrare le cellule attraverso un colino cella di rete di nylon (40 micron dimensione dei pori) per eliminare grumi di cellule.
- Separare le cellule con un flusso citometria sortaER dotato di tre laser: viola (405 nm), blu (488 nm), e rosso (640 nm).
NOTA: il solo laser blu è sufficiente per 3 colori citometria a flusso 27-28. - Ordina le cellule in tre tubi da 15 ml (contenenti 5 ml di terreno RPMI) per la raccolta simultanea di cellule B naive (CD19 + CD27 -), celle di memoria B (CD19 + CD27 +), e PBS / PC (CD19 + CD27 + / hi CD38 +) 3-4, 28.
NOTA: Ordinati cellule B naive e della memoria possono essere coltivate come descritto al punto 4.
4. La differenziazione in vitro di cellule CD19 isolati umana + B, CD19 + CD27 + cellule B di memoria, e CD19 + CD27 - cellule naive B
- Utilizzando le cellule purificate nei passaggi 1.19, 2.10, 2.11 e 3.10, determinare il numero di cellule con un emocitometro o un contatore di cellule automatica.
- Risospendere le cellule con RPMI 1640 mediumad una concentrazione di 1 - 10 x 10 5 per mL e Aliquotare nei pozzetti di una piastra 12 pozzetti.
- Aggiungere CpG (ODN 2006) a 5 mg / 10 6 cellule / ml 18, 29.
- Cultura le cellule in un incubatore a 37 ° con 5% di CO 2 per 5 giorni.
- Raccogliere le cellule di ogni bene, metterli separatamente in provette da 15 ml, aggiungere 5 ml di PBS in ogni provetta, e centrifugare a 600 xg e RT per 5 min.
- Contare le cellule utilizzando un emocitometro o un contatore di cellule automatica. Risospendere le cellule a una concentrazione di 1 - 10 x 10 5 per ml con RPMI 1640 medium.
5. ELISpot Assay
- Aggiungere 30 ml di 35% di etanolo in acqua distillata a ciascun pozzetto di piastre ELISPOT per 30 s.
NOTA: quando pipettando, evitare di toccare la membrana nei pozzetti in ogni momento. - Capovolgere le piastre ELISPOT per rimuovere l'etanolo.
- Mettere 150 ml di DDH autoclave 2 O in ciascun pozzetto e incubareli a temperatura ambiente per 5 minuti per lavare via l'etanolo residuo; seguire con un lavaggio di PBS sterile a temperatura ambiente per 3 min.
NOTA: I passaggi da 5.1 a 5.3 possono essere opzionali, a seconda della fabbricazione delle piastre. - Mettere 50 ml di 5 mg / mL policlonale (ab ') F 2 frammento di antiumano Ig (IgG + IgM + IgA) (in PBS) in ciascun pozzetto delle piastre ELISPOT e incubare a 4 ° C per una notte (preferito) o 37 ° C per 2 h 11.
NOTA: Sigillare i bordi delle piastre con parafilm fino al momento dell'uso. - Capovolgere le piastre per rimuovere Abs non legato, aggiungere 200 ml di soluzione salina in ogni pozzetto e incubare per due volte a temperatura ambiente per 3 minuti ogni volta.
- Aggiungere 200 ml di PBS con 5% BSA (o RPMI 1640 medium) a ciascun pozzetto per il blocco, e incubare a temperatura ambiente per 2 h.
- Capovolgere le piastre per rimuovere il tampone di bloccaggio. Lavare ogni pozzetto due volte con 200 ml di PBS, come al punto 5.5.
- Aggiungere 100 ml di RPMI 1640 medium ciascun pozzetto ed incubare a 37 ° C.
- Quando si è pronti a seminare le cellule, capovolgere le piastre per rimuovere il supporto RPMI 1640.
- Seme 100 microlitri (5 x 10 4), 50 ml (2,5 x 10 4), e 25 ml (1,25 x 10 4) delle celle (dai passi 1.19, 2.10, 2.11, 3.10 e 4.6) nei pozzetti di una piatto ELISpot. Con terreno RPMI 1640, portare il volume a 150 ml / pozzetto.
NOTA: Un minimo di uno o due diluizioni seriali di 2 volte per la placcatura le cellule è raccomandato. - Incubare le piastre in un incubatore a 37 ° con 5% di CO 2 per 8 - 14 h 18. Evitare di spostare le piastre durante l'incubazione.
- Capovolgere le piastre per rimuovere le cellule e RPMI 1640 medium.
- Aggiungere 200 microlitri / pozzetto di PBS-T (PBS con 0,05% Tween 20) e incubate a temperatura ambiente per 5 volte, ogni volta per 3 min. Capovolgere la piastra per rimuovere il tampone di lavaggio tra ciascuna delle 5 lavaggi.
- Aggiungere o fosfatasi alcalina IgG di capra anti-umano (AP), Abs Fcy-specifico (per il rilevamento IgG, 1: 5000 in PBS-T) O di capra anti-IgM umane-AP, Fcμ specifico frammento Abs (per il rilevamento IgM, 1: 5000 in PBS-T) nei pozzetti ed incubare a temperatura ambiente per 2 ore al buio.
- Lavare ogni pozzetto due volte con 200 ml di PBS, come al punto 5.5.
- Aggiungere 50 ml bromochloroindolyl soluzione di substrato / pozzetto di fosfato-nitro blu tetrazolio (BCIP / NBT). macchie viola-colorati appaiono normalmente in 5 - 15 min.
- Aggiungere 100 microlitri / pozzetto di DDH 2 O per evitare l'eccessivo sviluppo di macchie.
- Lavare i piatti con acqua corrente dopo lo sviluppo completo di tutti i punti.
- Rimuovere la underdrain delle piastre e consentire loro di aria secca nella scura.
- Contare le macchie utilizzando un lettore di piastre automatizzato con una unità di immagine di acquisizione / analisi (ad esempio, uno scanner automatico o manualmente tramite un microscopio da dissezione).
NOTA: Le piastre possono essere conservati a RT al buio e analizzati in seguito.
Risultati
PBMC sono state esaurite di globuli rossi e cellule aderenti (passi 1,2-1,7). Una aliquota (2 x 10 6) di cellule sono stati sottoposti ad analisi citofluorimetrica per illustrare le popolazioni di cellule naive B, cellule B di memoria, e PBS / PC nel sangue periferico (Figura 1). In PBMC di questo donatore, circa il 10% dei linfociti erano cellule CD19 + B. Nel vano B-cell, la percentuale di CD19 + CD27 - cellule B naive era di circa 50%. D'altra parte, circa il 50% delle cellule CD19 + B erano cellule CD27 + B memoria 7, 25-26. Da segnalare, le cellule CD27 + B di memoria possono essere ulteriormente separati con l'inserimento di IGD 4. Il fenotipo di circolazione PB può essere meglio definito con l'espressione bassa o nessuna superficie CD20 (CD19 + CD27 + / CD38 + CD20 hi lo / -) 2, 30-31. Per escludere le cellule morte, il 7-AADpossono essere inclusi nella colorazione delle cellule (passo 3,5), e una trama per FSC contro il 7-AAD permette di gating la popolazione di cellule vive (7-AAD -).
Le fasi principali del saggio ELISPOT sono descritte nella Figura 2. Sia le cellule B umane purificate e cellule B memoria CD19 + CD27 + sono state coltivate in presenza di CpG con RPMI 1640 medium per 5 giorni. Le cellule sono state raccolte per il saggio ELISPOT per quantificare le ASC nuovi emersi. Se presente, il preesistente PB isolati dal sangue periferico moriranno in 48 h 11. Il saggio ELISPOT è stato eseguito, e le immagini Spot acquisite da uno scanner automatico di targa sono dimostrato nella figura 3. I risultati di ELISpot tipicamente mostreranno 50 - 200 IgM ASC da 10 4 B cellule trattate con CpG per 5 giorni, mentre il numero di IgG-ASC è 10 - 50 a 10 4 cellule 11.
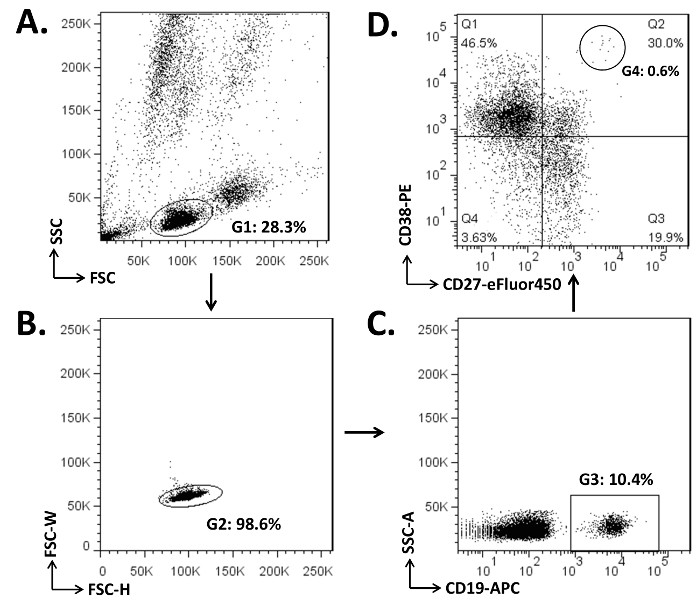
Figura 1. Illustrazione della strategia di gating per separare le cellule Naïve B, cellule B di memoria, e PBS nel PBMC. (A) Cellule (2 x 10 6) sono state colorate con 2 mg ciascuna delle CD19-APC, CD27-eFluor450, e anticorpi monoclonali CD38-PE (punto 3.4). Il compartimento dei linfociti è stato recintato (G1) sul dot-plot per la dispersione in avanti (FSC) contro la dispersione laterale (SSC). (B) doppietti cellulare, che sono formate da due cellule attaccate insieme, sono stati esclusi (quelli G2 esterno) del terreno per FSC-W (larghezza) rispetto FSC-H (altezza). (C), le cellule B CD19 + sono stati gated come G3 sulla trama per SSC-A (area) e CD19-APC. (D) delle cellule CD19 +, il dot plot dei parametri CD27 e CD38 mostravano cellule naive B (CD19 + CD27 -, Q1 e Q4), le cellule B di memoria (CD19 + CD27 +;Q2 e Q3), e PBS (CD19 + CD27 + / CD38 + hi; G4, 0,6% del Q2). Clicca qui per vedere una versione più grande di questa figura.
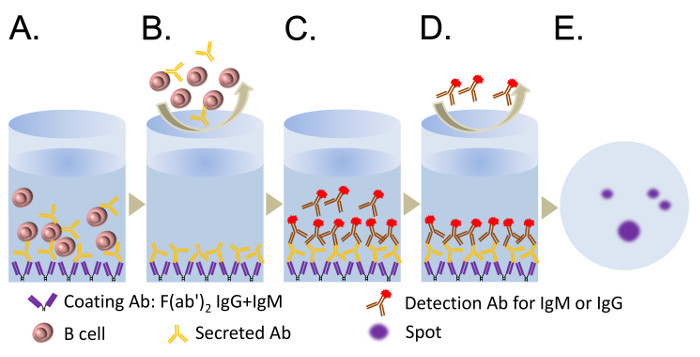
Figura 2. illustrazioni dei passaggi chiave del ELISpot Assay. (A) Mettere 50 microlitri / pozzetto (5 mg / ml) di F (ab ') 2 frammento di antiumano Ig (IgG + IgM + IgA) in una piastra ELISpot per 2 ore a 37 ° C o per una notte a 4 ° C (preferito) (passo 5.4). Seme le cellule nei pozzetti della piastra ELISpot. Lasciare le ASC da allegare alla membrana PVDF ed a secernere Abs per 8 - 14 h (passo 5.11). (B) Lavare le cellule con PBS (con 0,05% Tween 20). (C) Aggiungere l'AP-o HRP-conjrilevamento ugated Abs specifico sia IgG o IgM. (D) Lavare l'Abs di rilevamento che sono legato. (E) Sviluppare le macchie con una soluzione di substrato di AP o HRP per abbinare il Abs rilevamento. Clicca qui per vedere una versione più grande di questa figura.
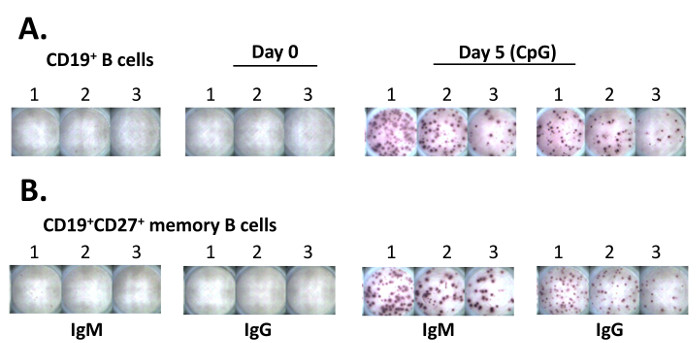
Figura 3. ELISPOT I risultati di una piastra rappresentante. (A) cellule purificata CD19 + B sono stati collocati in tre pozzi adiacenti (50.000 cellule in 1 e #, 25.000 cellule in ben # 2, e 12.500 cellule in ben # 3, rispettivamente) della piastra ELISpot. Le cellule sono state poi coltivate in RPMI 1640 medium overnight (~ 14 h). Il saggio ELISPOT è stata eseguita dopo aver completato la cultura (passi 5,12-5,18). per Analyze i risultati, la piastra ELISpot stato scansionato per acquisire immagini mediante un analizzatore automatico dotato lo scanner e software. Celle di memoria (B) purificata CD19 + CD27 + (10 6 / ml) sono state coltivate in presenza di 5 mg / ml di CpG per 5 giorni. Le cellule sono state trattate come in (A) per il saggio ELISPOT. Clicca qui per vedere una versione più grande di questa figura.
Discussione
Isolamento e la purificazione delle cellule del sangue umano periferico B
Normalmente, globuli rossi possono essere efficacemente rotti e liquidati con tampone di lisi (passo 1,2). È importante non incubare PBMC con il tampone di lisi RBC più di 5 minuti, come vitalità cellulare può essere influenzata dal cloruro di ammonio. In alternativa, globuli rossi e piastrine possono essere contemporaneamente rimossi dalla seguente protocollo.
Mescolare sangue intero fresco con (ACD) tampone acido-citrato-destrosio (acido citrico 39 mM, 75 mM citrato di sodio e 135 mM di destrosio; pH 7,4) in un rapporto in volume di 9: 1, sangue-buffer. Centrifugare a 250 xg per 10 min a RT. Prestare attenzione alla formazione di strati, indicativi della separazione. Aspirare e scartare lo strato superiore, che contiene piastrine e plasma ricco di piastrine (colore giallo). Rimuovere lo strato centrale sottile a livello di interfaccia, che contiene PBMC (i .E., Il buffy coat). Evitare la contaminazione dei GR nello strato inferiore (darca di colore rosso). Aggiungere tampone di lisi alla PBMC per rimuovere i globuli rossi residui, e quindi seguire i passaggi 1,2-1,19.
Due approcci possono essere utilizzati per isolare cellule B da PBMC: selezione positiva e negativa 21. Il metodo di selezione negativa (passaggi 1,1-1,19) viene utilizzato per ottenere incontaminate, le cellule B funzionali, senza Abs o microsfere legato, per esperimenti a valle. È fondamentale tenerne conto quando l'attivazione e / o differenziazione delle cellule B purificate avviene nella cultura. La preoccupazione è che le cellule purificate per selezione positiva potrebbero essere inavvertitamente influenzati dalle microperle mAb-coniugati (da 0,2 a 5 um di diametro). anticorpi monoclonali possono legarsi a recettori specifici sulle cellule B e quindi potrebbe reticolare recettori per l'attivazione. Inoltre, microsfere possono essere endocitosi dalle cellule B attraverso i recettori legati. Sebbene biodegradabili, le microsfere possono rimanere all'interno delle cellule per più di una settimana. Sia il mantenimento di microsfere influenzeranno esperimentirisultati mentali deve essere empiricamente determinato. Nella purificazione delle cellule B umane mediante selezione positiva, anti-CD19 (cloni: 4G7 o HIB19) microsfere sono comunemente utilizzati perché CD19 è ampiamente espresso in tutte le fasi di sviluppo delle cellule B. La purezza delle cellule B dopo la separazione può essere determinata mediante citometria di flusso con anticorpi monoclonali anti-CD19 (cloni: SJ25C1 o LT19), che riconoscono epitopi distinti da microsfere anti-CD19.
Purificazione e separazione della memoria e ingenuo B cellule da cellule B isolate
CD27 è un marcatore di superficie ampiamente accettato per la memoria umana e ingenuo B distinzione cella 24. La molecola CD27 appartiene alla famiglia dei recettori del fattore di necrosi tumorale (TNFR). Perché CD27 è espressa sulla maggior parte delle cellule B della memoria umana, è comunemente utilizzato per discriminare loro di CD27 - cellule B naïve. Tuttavia, poiché CD27 viene espresso anche sulle cellule T e cellule NK, l'uso di microbea anti-CD27ds (clone: O323) nella selezione positivamente cellule B di memoria richiede la previa purificazione delle cellule B (passi 1,1-1,19). Per un controllo della purezza dopo la separazione, anticorpi monoclonali specifici per CD27 umano (cloni: L128 o LG.3A10) sono raccomandati (passo 2.12). Poiché le cellule CD27 + B della memoria sono eterogenei, marcatori di superficie aggiuntivi, come IGD e FCRL4, possono essere considerate per un'ulteriore separazione di smistamento delle cellule 4, 7.
Separazione delle cellule per ottenere cellule Naïve B, cellule B di memoria, e PBS / PC
Poiché le cellule B esprimono FcγRIIB, un blocco Fc (passo 3,3) è consigliato prima di colorazione delle cellule con anticorpi monoclonali per la citometria a flusso. I frammenti Fc delle IgG umane sola possono bloccare altrettanto bene come tutta IgG umana a 1 mg / 10 6 cellule. Anti-CD32 umani Mab (cloni: 3D3 o AT10) è un'altra opzione per il blocco Fc. Da segnalare, se FcγRIIB è un marcatore di superficie essere macchiato nelle cellule B purificate, il fluoroforo coniugato contro CD32-mAb should essere aggiunti a rinunciare al blocco Fc, seguita da colorazione con altri anticorpi monoclonali, senza un lavaggio PBS.
Per tre colori citometria a flusso, CD38-FITC (fluoresceina), CD27-PE (ficoeritrina), e CD19-APC (Allophycocyanin) sono una tipica combinazione di fluorofori. Tuttavia, se il sorter citometria a flusso è dotato di tre laser, come quelli di 405 nm, 488 nm e 640 nm, i ricercatori quindi hanno il lusso di scegliere fluorofori eccitati da diversi laser per la separazione delle cellule. Come illustrato in figura 1, le cellule sono state colorate con CD19-APC (clone: HIB19), CD27-eFluor450 (equivalente a Pacific Blue, clone: O323) e CD38-PE (clone: HB7) per separare le cellule B naive, memory le cellule B, e PBS. Da segnalare, alcuni ricercatori preferiscono l'inserimento di CD45 (clone: HI30) come marcatore di leucociti lignaggio e cellule B porta come CD45 + CD19 + popolazione. Poiché il rilevamento di PBS in circolazione allo stato stazionario è un eve rarant in individui sani, basso o addirittura nessuna espressione superficie CD20 su PBS (CD19 + CD27 + / CD38 + CD20 hi lo / -) sostanzia la loro bona fide esistenza 2, 30-31. Questo è utile quando i risultati di quantificazione di PBS di fenotipi di superficie e ASC mediante saggi ELISPOT vengono confrontati. Durante il periodo precedente alla cella-ordinamento, 7-AAD è preferito ioduro di propidio per l'esclusione di cellule morte, a causa del suo spettro di emissione più stretta e più bassa di ricaduta in multicolore citometria a flusso.
In vitro stimolazione e la differenziazione delle cellule umane isolate B
Il tipo B CpG (ODN 2006) da solo può indurre la differenziazione limitata sia di IgM e IgG-ASC dalle cellule B di memoria. Inoltre, le cellule B naïve sono solo debolmente sensibili alle CPG e soprattutto danno luogo a IgM-ASC 6, 11. La concentrazione di CpG in cultura è nel range 2,5 - 5 mg / mL per 10 6 cellule Bo PBMC 11, 18. Altro che CpG, le cellule B purificate e PBMC possono essere coltivate in presenza di combinazioni di CpG con mitogeni, citochine e agonisti BCR, di differenziare le cellule B umane in ASC in coltura (fase 4.3). Per esempio, le ricette comunemente usato per 10 6 cellule per ml include (a) CpG (5 mg / mL), ricombinante IL-2 (10 ng / mL), e umano ricombinante IL-10 (10 ng / mL) 15, 34; (b) CpG (5 mg / ml) e F (ab ') 2 frammenti di Ig anti-umano (IgG + IgM + IgA) (20 mg / mL) 11; (c) CpG (5 mg / mL), proteina A da S. aureus Cowan (SAC) (1: 10.000 diluizione), e Pokeweed mitogeno (PWM) (1: 100.000 diluizione) 18; (d) umana ricombinante IL-21 (100 ng / mL) e sCD40L ricombinante (1 mg / mL) 12, 15, 33; e (e) umana ricombinante IL-2 (10 ng / mL) e R848 (1 mg / mL), un agonista del TLR7 33-34. Anche se le cellule B possono essere differenziate in ASC in tre giorni 11, le cellule sono in genere pre-stimulated per 5 a 6 giorni prima di essere aggiunto alla piastra ELISpot per la quantificazione di ASC 11, 18. Durante il periodo di coltura, di solito non c'è rifornimento degli agenti di partenza di differenziazione.
L'aggiunta di IL-2 e IL-10 a culture CpG contenenti può aumentare significativamente il numero di IgM e IgG differenziata-ASC 15, 35. La presenza di IL-2 in coltura può fornire stimolazione mitogenica per facilitare l'espansione delle cellule B differenziate per CpG. IL-10 nella gamma di 10-25 ng / mL può aumentare notevolmente la produzione di ASC (~ 3 a 10 volte) in presenza di CpG 35. Agonisti BCR, tra cui anti-BCR e SAC, e PWM possono anche stimolare la proliferazione delle cellule di 18 B umani primari. Incubando le cellule B di memoria con CPG e policlonale anti-BCR principalmente si traduce in un aumento delle IgM-ASC ma non in IgG-ASC 28. Per la prevenzione della inibizione della segnalazione attraverso BCR da FcγRIIB, un F (ab &# 39;) 2 frammento di anti-Ig (10-20 mg / ml per 10 6 cellule) è consigliato quando reticolazione BCR 11. Invece di policlonale anti-Ig, anticorpi monoclonali anti-BCR specifici per entrambi cellule IgM o IgG + + B devono essere considerati a bersaglio sottoinsiemi di cellule B specifiche isotipo di differenziazione in ASC. Una combinazione di CpG, SAC (1: 10.000 diluizione), e PWM (1: 100.000 diluizione) in grado di attivare in modo efficiente celle di memoria B a differenziarsi in IgM e IgG-ASC 18, 24. Inoltre, CPG possono moderatamente indurre il passaggio di classe di Ig in vitro 28-29. Al contrario, IL-21 (100 ng / mL) e sCD40L (1 mg / mL) indurre efficacemente la differenziazione delle cellule memoria B esclusivamente commutato IgG-ASC 12, 30. La sCD40L può attivare le cellule B imitando l'aiuto delle cellule T attraverso CD40 sulle cellule B, influenzando la loro differenziazione in PC in vivo. Da segnalare, anti-CD40 (cloni: 89 o G28.5) può sostituire sCD40L nella cultura 15. Carner, né sCD40L né anti-CD40 solo è in grado di indurre la differenziazione delle cellule B memoria. Così, l'attivazione CD40 delle cellule B coltura è spesso combinato con un agente di differenziazione, quali IL-4, CpG, R848, o IL-21, ognuno dei quali può promuovere passaggio di classe Ig. IL-4 svolge un ruolo chiave nella differenziazione delle cellule Th2 CD4, che consente l'induzione di maggior parte delle cellule IgM + B per passare alle cellule IgG1 + B nella cultura. Analogamente, in presenza di IL-21, entrambe le cellule B di memoria e cellule B naive differenziano esclusivamente verso ASC classe commutazione 12, 32. Come CpG, R848 può indurre uno switch di classe marginale di cellule B 34. Infine, è da segnalare che sebbene lipopolisaccaride (LPS) può indurre efficacemente la differenziazione delle cellule del mouse B in ASC, cellule B umane esprimono bassi livelli di TLR4 e CD14 29. Poiché l'aggiunta di un agente differenziazione nella cultura promuove la generazione di cellule B commutate, questa aggiunta dovrebbe essere evitatoquando PBS / PC o cellule B di memoria non commutate pre-esistenti devono essere misurate.
ELISpot Assay
Il saggio ELISPOT combina ELISA piastriformi based con tecnologie Western blotting membrana a base, permettendo la rilevazione di Abs secreta da una singola cellula B 18. Il ELISpot è stato anche adattato per quantificare le cellule T Ag-specifici che secernono citochine 17, 36. In un saggio ELISPOT, sia le cellule purificate o PBMC non frazionata (gratuitamente globuli rossi) può essere utilizzato. Tuttavia, ~ 10 volte più PBMC sono necessari rispetto alle cellule purificate per ottenere risultati coerenti nei saggi ELISPOT. Un buon punto di partenza è di 1 - 2 x 10 5 cellule per pozzetto per rilevare le ASC che circolano nelle PBMC. Nella rilevazione di Ag-specifici ASC, anti-Ig è di solito sostituito da Ag (5 - 10 mg / ml in PBS) per catturare Ag-specifica ACSS (passo 5.4). L'uso di Abs rilevazione specifici isotipo permette la distinzione tra Ag-specifici IgM-ASC e IgG isotipo-ASC (passo 5.14). Da segnalare, a prescindere dal fatto anti-Ig o Ag vengono utilizzati per catturare ASC, le Abs di rilevazione utilizzati per ELISA potrebbero non essere sempre adatto per ELISpot. Allo stesso modo, non tutti i supporti colore per ELISA funzionare correttamente in ELISpot. AP-Abs e HRP-coniugati sono più comunemente utilizzati per il rilevamento posto in ELISpot. La soluzione di substrato BCIP / NBT è una scelta popolare per il rilevamento di AP-based, mentre il 3,3 ', 5,5'-tetrametil-benzidina (TMB) e 3-ammino-9-etilcarbazolo soluzioni (AEC) sono substrati comuni per HRP in ELISpot. Se l'AP o HRP è direttamente coniugati al Abs rilevamento, è necessario un unico passo per il rilevamento, come descritto nel protocollo (passo 5.14). Al contrario, l'Abs rilevamento sono biotinilato e richiedono conseguente incubazione con AP- o streptavidina HRP-coniugato prima di reagire con i substrati in un metodo in due fasi. Entrambi i metodi ad un passo o due step lavorare in modo efficiente per rilevare i punti di ELISpot.
Il saggio ELISPOT in grado di quantificare non solo circulating ma anche differenziata ASC nella cultura (passo 1.19 contro 4.6). Se presente, ASC, che normalmente non più di due giorni in coltura vivono circolanti, può essere direttamente coltivate in piastra ELISpot, con o senza purificazione da PBMC 11. Al contrario, la differenziazione delle cellule B di memoria richiede 5 giorni. Quindi, la coltura diretta in piastre ELISPOT dopo l'isolamento delle cellule (passo 1.19) non è raccomandato; i detriti delle cellule morte derivante dal periodo di coltura prolungato può aumentare il fondo di rilevazione posto. Invece, entrambe le cellule B purificate e PBMC totali possono prima essere coltivate in un 6-ben o 12 pozzetti in presenza di mitogeni e agenti di differenziazione (passo 4.3). Durante il processo di cultura, la ripetuta aggiunta di agenti di stimolazione non è necessaria (passo 4.3). Mentre piastre sono in incubatrice, la porta dell'incubatore deve essere aperto delicatamente e chiuso per evitare ASC seminate di muoversi, per poter diffondere Abs secreti lungo i binari mobili, generando macchiecon code (le cosiddette macchie "Comet-like") (passo 5.11). Il periodo di incubazione in piastre ELISPOT è determinato dal tempo necessario per le celle a secernere quantità rilevabili di Abs senza consentire alle cellule di dividersi, che creerebbe difficoltà nella conta degli spot. Così, le cellule sono coltivate in genere nell'intervallo di 8 h per tutta la notte (passo 5.11).
Il saggio ELISPOT è il metodo più utilizzato per quantificare le risposte delle cellule B di memoria. E 'diventato un popolare, lettura indipendente dalla risposta immunitaria umorale e memoria immunologica. In pratica, la cultura mitogenica precedente è necessario per attivare le cellule B di memoria per la differenziazione in ASC (punto 4.3). Tuttavia, la frequenza di cellule B memoria espandono e si differenziano in ASC varia nei diversi ambiente coltura, come descritto sopra. Anche se senza il consenso, la maggior parte dei ricercatori adottano la condizione di induzione in grado di massimizzare la produzione di ASC. In termini di agente utilizzato per detectio poston, solubile biotinilato Ag può sostituire la insoddisfacenti rilevamento Ab senza compromettere la sensibilità 37. Questo è particolarmente importante quando la disponibilità di Ag è limitata poiché è richiesta una quantità molto minore di Ag per la rilevazione di per rivestire i piatti. Infine, ELISpot non consente l'analisi fenotipica di eterogeneità cellulare, e richiede quindi prima frazionamento di sottopopolazioni di cellule. Recentemente, un saggio ELISPOT multicolore, in cui rilevazione Abs sono etichettati con diversi fluorofori, è stata sviluppata per rilevare più tipi di cellule che secernono citochine in un singolo pozzo 38-39. Questa nuova tecnologia sarà di particolare interesse per la rilevazione di cellule a bassa frequenza in PBMC e per una analisi su larga scala delle risposte delle cellule B vaccino-indotta.
Poiché il saggio ELISPOT è veloce ed efficiente nella quantificazione ASCs e cellule secernenti citochine, è stato esteso per misurare la funzionalità non solo circuLating linfociti, ma anche le cellule immunitarie dei tessuti come leucociti intraepatici 40. A causa della sua sensibilità raggiungere il livello di rilevare anche una sola ASC, il saggio ELISPOT è stato utilizzato sempre più per misurare le risposte immunitarie umane per dell'efficacia dei vaccini contro agenti patogeni esistenti ed emergenti. Anche se le prestazioni ad alta produttività e robustezza del saggio ELISPOT sono adatte per le valutazioni su larga scala di risposte immunitarie utilizzando PBMC, i risultati dei test possono essere influenzate da vari fattori, come il ritardo di elaborazione dei campioni, se le cellule sono freschi o congelati , componenti del siero nel mezzo di coltura, e il numero di cellule aggiunti alla piastra ELISpot 41. Così, le procedure di normalizzazione dovrebbero essere inclusi nel protocollo ELISpot per ridurre al minimo le variazioni intra e inter-test in larga scala e studi di follow-up longitudinale (ad esempio, prove di vaccino). Il metodo di normalizzazione di lettura targhe è essenziale anche per linearità, precisione, e controistency nel test risultati 41-42. Un modo per eseguire la lettura targhe normalizzazione è quello di estendere la procedura di diluizione in serie di cellule seminate a piastre ELISPOT (passo 5.10). Con la creazione di una piastra di riferimento, diluizioni più seriali devono dare prova di una relazione lineare tra il numero di cellule placcato per pozzetto e la conta pronti per bene. scansioni ripetute della piastra ELISpot possono essere utilizzati per validare il modello di conteggio spot, sia automaticamente che manualmente. Minimal intra-bene variabilità della conta a pronti è previsto dopo le procedure di normalizzazione 43. Infine, l'applicazione di ELISpot può essere esteso in molti modi, ad esempio per il monitoraggio delle risposte trattamento di pazienti con infezioni e tenendo immunoterapie cancro, nonché alla valutazione di immunotossicità (ad esempio, immunosoppressione e autoimmunità indotta da farmaci).
Divulgazioni
The author declares no competing financial interests.
Riconoscimenti
This study was supported by a research grant from the Ministry of Science and Technology of the Executive Yuan of Taiwan (NSC99-2320-B-002-011). I would like to acknowledge the excellent service provided by the Flow Cytometric Analyzing and Sorting Core of the First Core Laboratory in College of Medicine of National Taiwan University.
Materiali
| Name | Company | Catalog Number | Comments |
| BD Vacutainer K2E | BD Biosciences | 367525 | 10 mL tube |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-02 | endotoxin-free |
| Trypan blue 0.5% solution | Biological Industries | 03-102-1B | |
| IMag Human B lymphocyte enrichment set | BD Biosciences | 558007 | |
| Biotinylated CD27 mAb | Biolegend | 302804 | clone O323 |
| Streptavidin magnetic microbeads | BD Biosciences | 9000810 | |
| 15 mL Falcon tubes | BD Falcon | 352196 | |
| Blue nylon mesh cell strainer, 40 μm | BD Falcon | 352340 | |
| Anti-human CD19-APC | Biolegend | 302212 | clone HIB19 |
| Anti-human CD27-eFluor 450 | eBioscience | 48-0279-42 | clone O323 |
| Anti-human CD38-PE-Cy7 | Biolegend | 303516 | clone HIT2 |
| Anti-human CD38-PE-Cy7 | BD Biosciences | 560677 | clone HIT2 |
| Anti-human CD45-FITC | Biolegend | 304006 | clone HI30 |
| Anti-human CD45-FITC | BD Biosciences | 555482 | clone HI30 |
| Anti-mouse/rat/human CD27-PerCP Cy5.5 | Biolegend | 124213 | clone LG.3A10 |
| Anti-human CD27-PerCP Cy5.5 | BD Biosciences | 65429 | clone L128 |
| Anti-human CD19-FITC | Miltenyi Biotec | 130-098-064 | clone LT19 |
| Anti-human CD19-FITC | GeneTex | GTX75599 | clone LT19 |
| Anti-human CD20-FITC | BD Biosciences | 555622 | clone 2H7 |
| biotinylated anti-human CD27 | Biolegend | 302804 | clone O323 |
| biotinylated anti-human CD27 | eBioscience | 13-0279-80 | clone O323 |
| 7-aminoactinomycin D (7-AAD) | BD Biosciences | 559925 | |
| CpG (ODN 2006) | InvivoGen | tlrl-2006 | type B CpG |
| Recombinant human IL-2 | PeproTech | 200-02 | |
| Recombinant human IL-10 | PeproTech | 200-10 | |
| Recombinant human IL-21 | PeproTech | 200-21 | |
| Recombinant human sCD40L | PeproTech | 310-02 | |
| Protein A of S. aureus Cowan (SAC) | Sigma-Aldrich | 82526 | |
| Pokeweed mitogen (PWM) | Sigma-Aldrich | L9379 | |
| MultiScreen filter plates, 0.45 µm pore size | Merck Millipore | MSIPS4510 | sterile, clear 96-well filter plate with hydrophobic PVDF membrane |
| BCIP/NBT solution | Sigma-Aldrich | B6404 | |
| BCIP/NBT single reagent, alkaline phosphatase substrate | Merck Millipore | ES006 | |
| Human IgG | Jackson ImmunoResearch | 009-000-003 | |
| Human IgG, Fc fragment | Jackson ImmunoResearch | 009-000-008 | |
| F(ab')2 fragment of goat anti-human Ig (IgG + IgM + IgA) | Jackson ImmunoResearch | 109-006-127 | |
| Goat anti-human IgG-alkaline phosphatase, Fcγ fragment specific | Jackson ImmunoResearch | 109-055-008 | |
| Goat anti-human IgM-alkaline phosphatase, Fcµ fragment specific | Jackson ImmunoResearch | 109-055-043 | |
| Goat anti-human IgG-peroxidase, Fcγ fragment specific | Jackson ImmunoResearch | 109-035-008 | |
| Goat anti-human IgM-peroxidase, Fcµ fragment specific | Jackson ImmunoResearch | 109-035-095 | |
| BD ELISPOT AEC substrate kit | BD Biosciences | 551951 | |
| C.T.L. ImmunoSpot analyzer | C.T.L. |
Riferimenti
- Bemark, M. Translating transitions - how to decipher peripheral human B cell development. J. Biomed. Res. 29 (4), 264-284 (2015).
- Odendahl, M., et al. Generation of migratory antigen-specific plasmablasts and mobilization of resident plasma cells in a secondary immune response. Blood. 105 (4), 1614-1621 (2005).
- Jackson, S. M., Wilson, P. C., James, J. A., Capra, J. D. Human B cell subsets. Adv. Immunol. 98, 151-224 (2008).
- Sanz, I., Wei, C., Lee, F. E., Anolik, J. Phenotypic and functional heterogeneity of human memory B cells. Semin. Immunol. 20 (1), 67-82 (2008).
- Perez-Andres, M., et al. Human peripheral blood B-cell compartments: A crossroad in B-cell traffic. Cytometry B Clin. Cytom. 78 (Suppl 1), S47-S60 (2010).
- Huggins, J., et al. CpG DNA activation and plasma-cell differentiation of CD27- naïve human B cells. Blood. 109 (4), 1611-1619 (2007).
- Wu, Y. C., Kipling, D., Dunn-Walters, D. K. The relationship between CD27 negative and positive B cell populations in human peripheral blood. Front. Immunol. 2, 81(2011).
- Maïga, R. I., Bonnaure, G., Rochette, J. T., Néron, S. Human CD38hiCD138⁺ plasma cells can be generated in vitro from CD40-activated switched-memory B lymphocytes. J. Immunol. Res. 2014, 635108(2014).
- Wienands, J., Engels, N. The memory function of the B cell antigen receptor. Curr. Top. Microbiol. Immunol. 393, 107-121 (2016).
- Kurosaki, T., Kometani, K., Ise, W. Memory B cells. Nat. Rev. Immunol. 15 (3), 149-159 (2015).
- Tzeng, S. J., Li, W. Y., Wang, H. Y. FcγRIIB mediates antigen-independent inhibition on human B lymphocytes through Btk and p38 MAPK . J. Biomed. Sci. 22, 87-98 (2015).
- Ettinger, R., et al. IL-21 induces differentiation of human naïve and memory B cells into antibody-secreting plasma cells. J. Immunol. 175 (12), 7867-7879 (2005).
- Bekeredjian-Ding, I., Foermer, S., Kirschning, C. J., Parcina, M., Heeg, K. Poke weed mitogen requires Toll-like receptor ligands for proliferative activity in human and murine B lymphocytes. PLoS One. 7 (1), e29806(2012).
- Bernasconi, N. L., Traggiai, E., Lanzavecchia, A. Maintenance of serological memory by polyclonal activation of human memory B cells. Science. 298 (5601), 2199-2202 (2002).
- Defrance, T., Vanbervliet, B., Brière, F., Durand, I., Rousset, F., Banchereau, J. Interleukin 10 and transforming growth factor beta cooperate to induce anti-CD40-activated naive human B cells to secrete immunoglobulin A. J. Exp. Med. 175 (3), 671-682 (1992).
- Hornbeck, P., Fleisher, T. A., Papadopoulos, N. M., et al. Chapter 2, Unit 2.2, Isotype determination of antibodies. Current Protocols in Immunology. Coligan, J. E., et al. , (2001).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Crotty, S., Aubert, R. D., Glidewell, J., Ahmed, R. Tracking human antigen-specific memory B cells: a sensitive and generalized ELISPOT system. J. Immunol. Methods. 286 (1-2), 111-122 (2004).
- Zhang, Y., Wang, Y., Zhang, M., Liu, L., Mbawuike, I. N. Restoration of retarded influenza virus-specific immunoglobulin class switch in aged mice. J. Clin. Cell. Immunol. 7 (2), 403(2016).
- Doedée, A. M., Kannegieter, N., Öztürk, K., van Loveren, H., Janssen, R., Buisman, A. M. Higher numbers of memory B-cells and Th2-cytokine skewing in high responders to hepatitis B vaccination. Vaccine. 34 (19), 2281-2289 (2016).
- Coligan, J. E., et al. Chapter 7, Unit 7.5, Isolation of human B cell populations. Current Protocols in Immunology. , (2011).
- Safarík, I., Safaríková, M. Use of magnetic techniques for the isolation of cells. J. Chromatogr. B Biomed. Sci. Appl. 722 (1-2), 33-53 (1999).
- Morbach, H., Eichhorn, E. M., Liesem, J. G., Girschickm, H. J. Reference values for B cell subpopulations from infancy to adulthood. Clin. Exp. Immunol. 162 (2), 271-279 (2010).
- Thornton, A. M., et al. Chapter 3, Unit 3.5A, Fractionation of T and B cells using magnetic beads. Current Protocols in Immunology. Coligan, J. E., et al. , (2003).
- Klein, U., Rajewsky, K., Küppers, R. Human immunoglobulin (Ig)M+IgD+ peripheral blood B cells expressing the CD27 cell surface antigen carry somatically mutated variable region genes: CD27 as a general marker for somatically mutated memory)Bcells. J.Exp. Med. 188 (9), 1679-1689 (1998).
- Bohnhorst, J. Ø, Bjørgan, M. B., Thoen, J. E., Natvig, J. B., Thompson, K. M. Bm1-Bm5 classification of peripheral blood B cells reveals circulating germinal center founder cells in healthy individuals and disturbance in the B cell subpopulations in patients with primary Sjögren's syndrome. J. Immunol. 167 (7), 3610-3618 (2001).
- Bleesing, J. J., et al. Chapter 7, Unit 7.35, Assays for B cell and germinal center development. Current Protocols in Immunology. Coligan, J. E., et al. , (2003).
- Horvatinovich, J. M., Sparks, S. D., Mann, K. P. Establishing a pure lymphocyte gate for subset analysis by flow cytometry. Cytometry. 26 (2), 172-177 (1996).
- Ruprecht, C. R., Lanzavecchia, A. Toll-like receptor stimulation as a third signal required for activation of human naive B cells. Eur. J. Immunol. 36 (4), 810-816 (2006).
- Smith, K., et al. Rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen. Nat. Protoc. 4 (3), 372-384 (2009).
- Caraux, A., et al. Circulating human B and plasma cells. Age-associated changes in counts and detailed characterization of circulating normal CD138- and CD138+ plasma cells. Haematologica. 95 (6), 1016-1020 (2010).
- Kuchen, S., Robbins, R., Sims, G. P., Sheng, C., Phillips, T. M., Lipsky, P. E., Ettinger, R. Essential role of IL-21 in B cell activation, expansion, and plasma cell generation during CD4+ T cell-B cell collaboration. J. Immunol. 179 (9), 5886-5896 (2007).
- Pinna, D., Corti, D., Jarrossay, D., Sallusto, F., Lanzavecchia, A. Clonal dissection of the human memory B-cell repertoire following infection and vaccination. Eur. J. Immunol. 39 (5), 1260-1270 (2009).
- Jahnmatz, M., et al. Optimization of a human IgG B-cell ELISpot assay for the analysis of vaccine-induced B-cell responses. J. Immunol. Methods. 391 (1-2), 50-59 (2013).
- Weiss, G. E., et al. High efficiency human memory B cell assay and its application to studying Plasmodium falciparum-specific memory B cells in natural infections. J. Immunol. Methods. 375 (1-2), 68-74 (2012).
- Leehan, K. M., Koelsch, K. A. T Cell ELISPOT: For the identification of specific cytokine-secreting T cells. Methods. Mol. Biol. 1312, 427-434 (2015).
- Karahan, G. E., et al. Quantification of HLA class II-specific memory B cells in HLA-sensitized individuals. Hum. Immunol. 76 (2-3), 129-136 (2015).
- Hadjilaou, A., Green, A. M., Coloma, J., Harris, E. Single-cell analysis of B cell/antibody cross-reactivity using a novel multicolor FluoroSpot assay. J. Immunol. 195 (7), 3490-3496 (2015).
- Janetzki, S., Rueger, M., Dillenbeck, T. Stepping up ELISpot: multi-level analysis in FluoroSpot assays. Cells. 3 (4), 1102-1115 (2014).
- Alatrakchi, N., Graham, C. S., He, Q., Sherman, K. E., Koziel, M. J. CD8+ cell responses to hepatitis C virus (HCV) in the liver of persons with HCV-HIV coinfection versus HCV monoinfection. J. Infect. Dis. 191 (5), 702-709 (2005).
- Smith, S. G., et al. Identification of major factors influencing ELISpot-based monitoring of cellular responses to antigens from Mycobacterium tuberculosis. PLoS. One. 4 (11), e7972(2009).
- Sundararaman, S., et al. High reproducibility of ELISPOT counts from nine different laboratories. Cells. 4 (1), 21-39 (2015).
- Janetzki, S., et al. Guidelines for the automated evaluation of Elispot assays. Nat. Protoc. 10 (7), 1098-1115 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon