Method Article
ゼブラフィッシュにおける腎毒素マイクロインジェクションは急性腎障害をモデルに
要約
抗生物質から化学療法に至るまで薬物が含まnephrotoxinsから発生腎損傷は、その病因が完全には理解のまま、複雑な障害をもたらすことができます。このプロトコルは、ゼブラフィッシュの腎臓保護措置の同定に適用することができ、これらの条件、疾患のモデリングのために使用することができる方法を示します。
要約
腎臓は、それらが血流からフィルターの化学物質への曝露から害の影響を受けやすいです。これは、急性腎障害(AKI)として知られている臨床症候群の腎機能と開発の急速な減少に関連した臓器損傷につながることができます。薬剤は、単独または他の薬剤と組み合わせて投与した場合、AKIを開始することができ、細菌感染から癌までの医療状況を治療するために使用されます。ゼブラフィッシュ彼らは人間を含む高等脊椎動物で保存されているネフロン機能単位で構成される胚腎臓を形成するように、in vivoでの腎機能に対する化学的影響を研究するための有用な動物モデルです。さらに、ゼブラフィッシュは、AKIの細胞および分子面を解明し、そのような腎保護分子の同定などの治療戦略を開発するための機会を与える遺伝的および化学的なスクリーニングを行うために利用することができます。ここでは、中にどのようにマイクロインジェクションを実証しますゼブラフィッシュ胚は、腎毒素の研究のためのパラダイムとして利用することができます。
概要
AKIは壊滅的な健康影響1につながる可能性が腎臓機能の突然の喪失です。 AKIはさらに高いクリティカルケアの例30〜50%に金利や高齢者、および50から70までパーセント1-3の死亡率で、起因する入院患者のうち、約20%の高い発生率に世界的な重大な医療問題です。残念ながら、AKIの有病率は増加しており、今後10年間でさらにエスカレートすると予測され、一部起因でAKIを誘導することができる要因の多様性、術後ストレス、虚血、および抗生物質などnephrotoxinsへの曝露が含まれると化学療法薬4。
AKIは、一般的に本質的な機能単位であるネフロン、で発生した、腎臓内の急激な細胞の損傷を伴う、および血液フィルタと中央集合管1内に尿を排出セグメント化された尿細管で構成されています。ネフロンのかなりの数がある場合AKI中に破損し、即時の効果は循環からの廃棄物のクリアランスの中断を含み、そして死んだと死細胞1から障害物に起因するネフロンを通る流体の流れを減少または廃止します。時間が経つにつれて、管状閉塞が永久的に腎機能1を減少させる、全体ネフロンの変性につながることができます。 AKI以下の腎臓における生理的な変化はまた、慢性瘢痕1につながることができ、複雑な炎症性事象を伴います。
これらの成果にもかかわらず、ネフロンは、尿細管上皮の5,6を再構成AKI後に再生を受けるためにいくつかの能力を持っています。ネフロン再生の増加分子的理解があったが、メカニズムは多くの点でとらえどころのないままにし、継続的な調査7を必要とします 。 AKIは永久的な腎障害をもたらすの程度も不明のまま。現在の研究は、腎臓のための再生能力がであることを示唆していますより顕著または反復エピソードが慢性腎臓病(CKD)につながり、救命移植または透析8,9を必要とする末期腎疾患(ESRD)に絶頂に達する一方で、最高、AKIの重症度の低い例を以下に示します。また、すでにCKDに罹患している個体は、AKI 8,9の重度のエピソードを収縮のより高い危険にさらされています。まとめると、AKIを、理解し治療および予防するために不可欠である基礎および臨床研究を続けていることは明らかです。
動物モデルでの研究は、AKI 10中に発生する地域や環境変化の進行を鑑賞してきました。この理解を広げるだけでなく、新しい治療法を開発するには、ゼブラフィッシュ動物モデルは、さまざまな方法11,12の様々な使用されています。ゼブラフィッシュ腎臓のネフロンは、胚および成体の両方において、哺乳類13-16と保全の高度を表示します。 ZEでさらに、ネフロン上皮傷害brafishは、尿細管細胞の局所的破壊がネフロンアーキテクチャ17-19の管内増殖および再構築が続いていることにより、高等脊椎動物におけるプロセスに似ています。胚では、しかし、シスプラチンのようなnephrotoxinsから大規模な細管損傷は致死20,21と関連しています。比較すると、ゼブラフィッシュ大人のAKIを生き残るためには、腎臓における実質的な回生機能を発揮します。例えば、アミノグリコシド系抗生物質ゲンタマイシンへの曝露後に、ゼブラフィッシュは、尿細管上皮の損傷を再生成し、新しいネフロン単位だけでなく22-24を成長させます。これらのゲンタマイシン誘発性AKIの研究は、多様なnephrotoxinsから腎障害を理解し、貴重な情報を提供してきたが効果や損傷25の異なるタイプへの応答を理解することが重要で残っています。
その大きさ、透明性、および遺伝的取り扱いやすさのためにゼブラフィッシュの胚は、腎毒素の研究のための多くの利点があります<マイクロインジェクション20,21の方法は、調査のための分子を投与するために使用されるSUP> 25、。ネフロンは、24時間後に受精(HPF)により形成され、約48 HPF 26,27により血液をフィルタリングするために始めています。このように、胚性腎臓の急速な形成と機能は実験的な分析を容易にします。しかし、マイクロインジェクションのプロセスは、技術的な課題があり、技術の習得に急な学習曲線が存在することができます。このビデオの記事では、我々はマイクロインジェクションを行い、成功した注射の速度を高めるために、トラブルシューティングのヒントを提供する方法について説明します。
プロトコル
このプロトコルで説明ゼブラフィッシュ胚を操作するための手順は、ノートルダム大学の施設内動物管理使用委員会によって承認されました。
ソリューションの調製
- 73.0グラムのNaClを混合することにより、E3胚メディアの50倍原液を作成し、3.15グラムのKCl、9.15グラムの塩化カルシウム、および蒸留水5リットル中に9.95グラムのMgSO 4、および室温で保存してください。
- ゼブラフィッシュ胚の培養のために、殺菌剤として作用するように、1×E3のすべての1 Lに0.05%メチレンブルー200μlのを追加し、蒸留水で1×作業溶液にE3胚のメディアの株式の50倍ストック溶液を希釈し、そして店RT。
- 0.06ミリグラムPTUで50倍E3株式の40ミリリットルを組み合わせることにより、0.003%の1-フェニル-2-チオ尿素(PTU)とのE3胚メディアの色素沈着ブロッキング溶液を作ります。その後、蒸留水で2 Lの合計にボリュームをもたらします。
- 溶液中にPTU粉末を得るために、室温でE3 / PTU O / Nをかき混ぜます。その後でE3 / PTUを保存RT。
注:E3 / PTUは、約1週間の貯蔵寿命を持っており、古いソリューションは、ゼブラフィッシュの幼虫に色素沈着の開発を阻止ではあまり効果的であろう。 - 500mlの蒸留水にトリカインの1グラムを追加することにより、0.2%トリカイン(MS-222)の麻酔液を作成し、1 Mトリス、pHを9.5と7.2にpHを調整します。
- 1X E3(NOメチレンブルー)の溶液を配置することによって、撮像のために2%メチルセルロース溶液を作るために準備する、0.2%の1/10容量のトリカインを4℃で加えました。
注:メチルセルロース溶液を穏やかに顕微鏡用生胚を安定化するために使用される厚さ、透明な溶液です。操作が行われた後、胚は、動物を傷つけると同じ試料の後続段階で顕微鏡検査を可能にすることなく、メチルセルロースを溶解させるために1×E3で洗浄することができます。 - 4℃に冷却したときに、攪拌プレート上で激しく1×E3 /トリカイン溶液を攪拌し、徐々にメチルの適切な量を加えます激しく攪拌しながらセルロース粉末。徐々に不溶性メチルセルロース凝集体の形成を防止するために、溶液に粉末を加えます。
- 全ての粉末は2%メチルセルロース/ E3 /トリカイン溶液に混合した後、4℃のコールドルームO / N複合溶液をかき混ぜます。
注:冷たい温度が完全に粉末を溶解するための最善の方法です。解決策は、1泊分後に明らかになっていない場合は、追加の稼働日および/または第2のO / N撹拌します。 - 30分間または2時間まで4℃で高速(12,000 XG)で1.5 mlチューブやスピンに2%メチルセルロース/ E3 /トリカイン溶液を、一定分量の混合物から気泡を除去するには。
- 長期保存のために4℃で2%メチルセルロース/ E3 /トリカインソリューションを配置します。
注:使用前に、アリコートは、ゼブラフィッシュの試料を操作するためのRTに予め温めなければなりません。
ツールの作製
- 経口投与のために使用される胚マニピュレータツールを準備します5「ストレート解剖針の端部にゲルローディングチップを取り付けることによって、マイクロインジェクションのための胚をsitioning、およびテープまたは瞬間接着剤で固定します。
- 第1の器具の中にフィラメントと10cmのホウケイ酸ガラスを研磨し、ハンドルを締めて、ホウケイ酸ガラスを固定して火を置くことによって、ニードルプラーを使用して、マイクロインジェクション針を準備します。
- ファインテーパー針を形作るためにホウケイ酸ガラスを引き出します。熱540、245を引っ張って、速度200、および時間125:次の設定を使用します。
- 粘土のストリップにそれらを中断するペトリ皿の内側置き針は、針の先端を保護し、埃の蓄積を防ぐために覆われた皿を維持します。
- マイクロインジェクション用の針を準備完了するには、約0.05〜0.1ミリメートルの直径を有する鋭い角度の噴射口を作成するために、針の引っ張ら終わりをカットするかみそりの刃や細かい鉗子エッジを使用しています。
- マイクロインジェクショントレイを作成するには、10で1.5%アガロース/ E3液を調製0 mlの三角フラスコ、電子レンジで沸騰するE3を加熱してアガロースを溶解は、その後、約10分間室温で冷却します。
- 約0.5センチメートルの深さに基礎を作るためにペトリ皿に冷却し、アガロース/ E3ソリューションを注ぎます。場合、これは約0.3センチメートルの深さを有する第2の層を注ぎ、プレハブ胚ウェル金型を挿入し、アガロースは室温で固化することを可能に固化しました。
注:気泡の数を減少させる角度で寒天に金型を配置し、トップアガー/ E3層に金型を挿入します。 - 全体のマイクロインジェクショントレイが設定されている場合には、その後、4℃でのE3ソリューションとストアで皿を埋める、ゆっくりと慎重に薬匙を用いて成形するだけでなくプレハブ胚を持ち上げます。
3.胚の準備
- 交配室に分周器を配置することにより、ゼブラフィッシュの交配タンクを設定し、システムの水で満たします。
- 分周器Sの両側に1つずつの魚を置きますUCH各嵌合室は、一女性と男性1魚を含み、各嵌合室をカバーします。
- 翌朝、産卵を有効にするには、仕切りを取り外します。
- 約30分後に魚を確認し、水槽に大人に戻した後、細いワイヤメッシュストレーナツールを使用して、相手の水槽の水を通過させることによって、それらの胚を収集します。
- ペトリ皿の上にストレーナーを反転し、胚を収集するためにE3で洗い流してください。
- 28.5°CO / Nで胚を培養します。
- 胚が24-26体節ステージ26に達したときに、胚の各皿に50 mg / mlでプロナーゼの100μLを添加し、約15のためにRTでディッシュ(23°C)をインキュベートすることによってdechorionateその後E3メディアのほとんどとをデカント分。
注:彼らは方法で収集された場合に胚が24-26体節の段階に到達することが受精の時から約24-25時間がかかります28.5℃でO / Nを説明し、インキュベートしました。 - で皿を埋めますE3、その後胚から絨毛膜を取り除くために、穏やかに旋回。
- E3 /プロナーゼをデカントし、新鮮なE3 25mlで皿をすすぎます。すべてのプロナーゼを除去するためのステップをすすぎ繰り返します。
- 色素沈着の開発をブロックするには、E3をデカントし、胚は24時間後の受精に達したときに新鮮なE3 / PTUの25ミリリットルと交換してください。
注:数日に及ぶ実験のために、きれいな皿を保つために一日一回新鮮な培地でE3 / PTU液を交換してください。
腎毒素ソリューションの4マイクロインジェクション
- 注射の日に、適切な車両制御を持つに沿って所望の腎毒素溶液を調製。
- ボルテックスまたは薬剤(複数可)を保証するために穏やかに混合は水柱のチューブとトップの側面を確認、/は溶液中にあります。
注:腎毒素のソリューションは、マイクロインジェクション効率を監視し、また、subseqで腎クリアランスを評価するために、蛍光共役デキストランの微量を含むように調製することができますuent時間は20,28ポイント 。 - 針の背面に微細なゲルローディングチップをねじ込むことによって腎毒素の〜2-3μlのでトリミングされたマイクロインジェクションの針をロードし、溶液が重力によってトリミングされた針の先端を埋めることができるように、テープの切れ端で垂直に針を一時停止します。
- 針先がいっぱいになると、マイクロマニピュレーターでロードされた針を固定します。
- マイクロスライド上に鉱物油の滴を配置することによって、マイクロインジェクションボリュームをテストし、液滴の大きさを評価するために、油に注入します。 500 PLの注入量は、0.1mmの直径を有します。
- インキュベーターから胚の皿を外し、胚ディッシュに0.2%トリカインの約5ミリリットルを添加することにより、麻酔。
- 完全な麻酔を確実にするために、静かに胚マニピュレータツールの先端で胚をタッチします。運動の欠如は、十分な麻酔を示しています。
- 成功した麻酔後、TRANSFで射出成形金型に胚を転送えーピペット。
- トランクがうつ病に沿って置かれ、尾は、うつ病の外にまでこだわったように、ウェルの最も深い領域にヘッドを配置し、金型の異なるウェルに各胚を操縦。
- マイクロマニピュレーターに充填された注射針を挿入し、次の胚への針の先端を配置します。
- 軽く前方ジョイスティックを動かすことにより、テール容器に針を挿入し、マイクロインジェクションを提供するためにフットペダルを押し下げます。
注:成功した注射は、液体が循環に入る見によって評価することができます。また、蛍光共役デキストランと腎毒性の同時注射は、手順の後に成功した注入を確認するために研究者を可能にします。 - 静かに胚から針を除去するために、ジョイスティックに引き戻します。
- 注入後、きれいな皿に胚を転送し、トリカインを除去し、新鮮なE3 / PTUに置き換えるすすぎます。
- ロバに所望の時点に胚をインキュベート所望のように実験的な分析のためメチルセルロース取り付けメディア、またはプロセスに写真撮影によって文書化することができるの形態、。
注:胚の回収は、浮腫を有する個体の割合を決定するために評価されるべきであり、一般に腎障害を示しています。
結果
セットアップマイクロインジェクション局は実体顕微鏡、マイクロマニピュレータと圧力調整器( 図1A)が含まれています。噴射プレートの透照この手順( 図1B)の間に試験片を表示することが好ましいです。注射針の製造は、切断し、最後にバックロード針を用いてエッジを調製し、続いて適切なホウケイ酸ガラスを、引っ張る伴います。最適には、針の先端は、切断手順の間( 図1C)、このような微細な鉗子として急激に切断器具の縁部に角度を付けることにより行われるカットを鈍らのではなく、面取りされています ( 図1D)。この面取りエッジが重要であり、非常に静かにゼブラフィッシュに針を挿入する能力に影響を与えます。
注射の日に、胚を頑丈しかし柔軟な胚を使用して配置しました操作ツール( 図1E)。注射のために、胚は、胴体がその後の射出工程( 図1F)のためのレバレッジを提供するために、注射トレイの側面に沿って休養するように操作されました。注入しながら、1は、針挿入のための血管先を視覚化した後、注入された物質が循環( 図1G)を入力観察するために、胚胴体にビューの平面を焦点を当てるべきです。
ゼブラフィッシュ胚の透明度は、マイクロインジェクションの手順を容易にし、そしてさらに典型的な実験の時間経過( 図2A)中に色素沈着の発生を少なくするために24 HPFでPTUの化学的処理によって向上させることができます。ここでは、胚標本は、その後、注入された模擬生理食塩水ビヒクルを微量注入、または2.5 mg / mlでのゲンタマイシン( 図2A)を微量注入のいずれかであった、72 HPF段階を経て発達させました。その後のライブ観察は実体顕微鏡( 図2B)と徹照照明を使用して、注射後1および2日目に行われました。モックまたは生理食塩水を注入した胚と比較すると、唯一のゲンタマイシン注入個体は以前に発表された観測11,20,21と一致して正常な腎臓機能の廃止を示唆し、この場合、心膜浮腫、浮腫の開発( 図2B)を示しました。
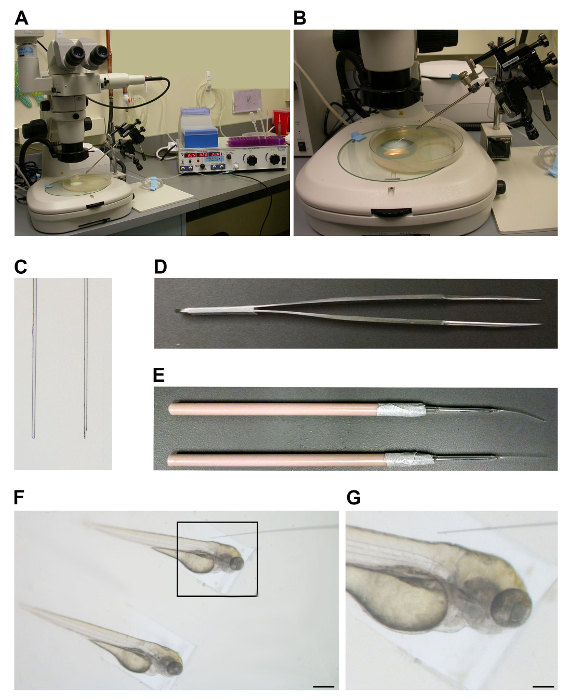
図1. マイクロインジェクション装置とツール。実体顕微鏡(左)と設定(A)注入ステーション、マイクロマニピュレータと針ホルダ(中央)と圧力調整器(右)。 (B)注入プレートの透照。 (C)左:ブラントカット針。右:ベベルカット針。 (D)F伊根鉗子は、針の先端を切断するために使用されます。 (E)を挿入し、射出成形金型内に検体を位置決めするために使用される操作ツール。 (F)胚をマイクロインジェクション金型に配列されました。スケールバー= 0.5ミリメートル。注射のための胚の隣の針の(G)ポジショニング。スケールバー= 0.15ミリメートル。 この図の拡大版をご覧になるにはこちらをクリックしてください。

ゼブラフィッシュにおける実験のタイムライン腎毒素図2.実験のタイムラインとポスト噴射浮腫アッセイ。(A)の例は、ここにゲンタマイシン研究に適用されます。胚を24時間後に受精(HPF)でdechorionatedとPTU溶液で処理しました。 smalleによって示されるように毎日、PTUの溶液をデカントし、新鮮な培地と交換しました緑の矢印rを。 72 HPFでは、胚を、麻酔した射出成形金型に移し、次のように扱わ:モックは、生理食塩水(車両制御)またはゲンタマイシンのいずれかを注入または注射さ。新鮮な培地に胚を回復した後、胚を分析し、画像取得のために(それぞれ96及び120 HPF)1および2日後に注射で観察されました。 (B)トップ:未注射ゼブラフィッシュ胚。ミドル:生理食塩水で72 HPFで注入した胚。下:2.5ミリグラム/ mlのゲンタマイシンを注入した胚。スケールバー= 0.5ミリメートル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
治療薬の多様な数はAKI 29と関連しています。アミノグリコシドゲンタマイシン30と広く使われている化学療法シスプラチン31,32のような多くの個々の化合物によって誘発された損傷を理解する上で重要な研究の進歩がありました。これらの条件に関わるいくつかの病理学的変化は、しかし、現在進行中の研究の対象残ります。一つの緊急の課題は、このような重要な医療環境と高齢者の29のもののような高リスク集団で特に、悪患者にどのように影響するかを複数の薬物理解まま。したがって、薬剤誘発性AKIの効果についてさらにセルラーベースの研究を可能にするモデルは、この状態の検出を改善し、ダイナミックな薬物相互作用を鑑賞する上で重要な役割を果たし。
マウスやラットなどの哺乳動物モデルでの作業は、AKI、府次の腎臓における細胞の変化を確立するために不可欠なされていますこれらのシステムとのトン1の制限は、直接、リアルタイム観察が原因で建築の複雑さや器官の内部の場所に制限されることです。簡単に言えば、腎臓は、個人が腎臓を分析するために犠牲にされていることが必要で直接観察、利用できません。これらの制限は、ヒト33を含む他の脊椎動物で保存されたセグメント構造を有する2つのネフロンの単純な腎臓を形成ゼブラフィッシュ胚を用いて対抗することができます。ゼブラフィッシュの開発は外部の手がかり34に対する応答の腎臓の器官形成とモニタリングの直接観察を可能にする、 子宮外とマイナー色素沈着で発生します。このような遺伝子発現35-37、などの分子解析のためのツールは、腎形成38-40の特徴を決定するために、高解像度で利用されています。化学遺伝学を通して小分子を試験するための実験操作は、十分にゼブラフィッシュに設立され、kidnに適用されていますEY 41-43。実際、近年では、ゼブラフィッシュは、アセトアミノフェンからマイコトキシンとアリストロキン酸44-48までの薬剤の腎毒性をモデル化するために適用されています。重大な制限があるため、開発のこの段階での腎構造の非常に単純で、ゼブラフィッシュ胚におけるAKIのモデリングにもあることに留意することが重要です。げっ歯類またはヒト後腎の場合のように、例えば、ゼブラフィッシュは、密に複数の間質細胞型を含む複雑な間質に囲まれているネフロンが充填されている腎組織内の多因子の相互作用に対処することには適していません。したがって、ゼブラフィッシュは、AKI中のネフロンにおける自律的な細胞および分子変化を視覚化に最適です。
急な学習曲線を持ちながら、ここで説明するマイクロインジェクションの方法は、nephrotoxins含む両方の発達および疾患状態を研究するために非常に有用です。この技術は、TEに使用することができます目の薬物単独または組み合わせて用いることができます。また、注射剤は、開発時点の広い範囲内に行うことができます。ゼブラフィッシュの幼生において静脈内マイクロインジェクションを行うための類似の、同様に実行可能な方法は、以前に、 ら。21 Cosentinoさんによって記載されています。その方法論における一つの重要な違いは、ここで説明する方法に比べ、胚はホールディングピペット21を利用して固定化されて注入することです。ホールディングピペットの使用は、射出成形用金型の実行可能な代替案です。胚を傷つけないようにホールディングピペットを操作するために学ぶことの練習が参加するよう腎毒性薬剤の送達方法として、マイクロインジェクションを実装しようとする研究者は、この代替を認識すべきであり、個人的に好適であるかを識別するための方法を比較したい場合がありそれが成功しEMBRのためのうつ病の空洞を持つ単純な射出成形金型を使用して操縦し、顕微注入するために練習が必要と同じようにヨーヨー。
この手順を実行する場合には、適切なサイズの注射針を準備するために、胚性循環への滑らかな入口と出口を最適化するために、針の先端の角を切断するために重要です。注入手順中に、サンプル間の腎毒素送達の一貫性を評価するために注入量を監視することが重要です。研究者が実験を行いながら、ボリュームの変更に関する不確実である場合には、マイクロメートルと注入量の定期的な評価を行うことができます。例えば、原因技術の性質のために、針の先端は、部分的にまたは完全に細胞残屑で詰まることができます。この合併症は、噴射される流体の一貫性を確保するために定期的に針をクリアすることで相殺することができます。また、フェノールレッドのような生体色素注射の視覚マーカーとして作用し、流体分散49,50を監視するのを助けるために混合物に添加することができます。さらに、トレーサー分子の注射は助けることができます注射後、特定の細胞集団を可視化します。蛍光デキストラン部分、具体的には10 kDaのデキストランコンジュゲートの同時注入のために、アプリケーション16,17の数を持っています。この場合には、蛍光強度の評価は、最小限の漏れで成功したマイクロインジェクションを確認する手順の直後に行うことができます。強度は、腎クリアランス51を測定するために、蛍光強度の変化を測定するために、その後の時点で再検討し、適切な画像キャプチャ写真を用いて測定することができます。さらに、近位尿細管におけるデキストランの再吸収は、このネフロンセグメント16,17の機能のためのプロキシを提供します。
まとめると、マイクロインジェクション、このモデルは、in vivoでの薬物動態に対処する機会を提供し、特にとして、ゼブラフィッシュでAKIを調査するために利用することができる多くの方法があります。このように、一度、nephrotoxinsのマイクロインジェクションを習得ゼブラフィッシュ胚に腎研究に有用なパラダイムを提供します。
開示事項
The authors have nothing to disclose.
謝辞
この作品は、NIHの助成金DP2OD008470によって部分的にサポートされていました。また、RAMはノートルダム大学院の大学によって提供される資金によって部分的にサポートされていました。私たちは、ノートルダム大学で生物科学科、ゼブラフィッシュ研究センター、および幹細胞のためのセンターと再生医療のスタッフに感謝します。我々は、特に腎臓の生物学とこの仕事上での有用なフィードバックについての議論を係合するための研究室のメンバーに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Sodium Chloride | American Bioanalytical | AB01915 | |
| Potassium Chloride | American Bioanalytical | AB01652 | |
| Calcium Chloride | American Bioanalytical | AB00366 | |
| N-Phenylthiourea (PTU) | Aldrich Chemistry | P7629 | |
| Ethyl 3-aminobenzoate (Tricaine) | Fluka Analytical | A5040 | |
| Borosilicate glass | Sutter Instruments Co. | BF100-50-10 | |
| Flaming/Brown Micropipette puller | Sutter Instruments Co. | Mo. P097 | |
| UltraPure Agarose | Invitrogen | 15510-027 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Blue | Sigma-Aldrich | M9140 | |
| Falcon Diposable Petri Dishes, Sterile, Corning: | |||
| 60mm x 15mm | VWR | 25373-085 | |
| 100mm x 15mm | VWR | 25373-100 | |
| (microinjection tray) 150mm x 15mm | VWR | 25373-187 | |
| Low Temperature Incubator | Fischer Scientific | 11 690 516DQ | |
| Micro Dissecting Tweezer | Roboz Surgical Instruments Co. | RS-5010 | |
| Micrometer | Ted Pella, Inc. | 2280-24 |
参考文献
- Basile, D. P., Anderson, M. D., Sutton, T. A. Pathophysiology of acute kidney injury. Compr. Physiol. 2, 1303-1353 (2012).
- Ostermann, M. Diagnosis of acute kidney injury: kidney disease improving global outcomes criteria and beyond. Curr. Opin. Crit. Care. 20, 581-587 (2014).
- Fluck, R. J. Acute kidney: improving the pathway of care for patients and across healthcare. Curr. Opin. Nephrol. Hypertens. 24, 511-516 (2015).
- Silver, S. A., Cardinal, H., Colwell, K., Burger, D., Dickhout, J. G. Acute kidney injury: preclinical innovations, challenges, and opportunities for translation. Can. J Kidney Health Dis. 2, 30 (2015).
- McCampbell, K. K., Wingert, R. A. Renal stem cells: fact or science fiction?. Biochem. J. 444, 153-168 (2012).
- Li, Y., Wingert, R. A. Regenerative medicine for the kidney: stem cell prospects and challenges. Clin. Transl. Med. 2, 11 (2013).
- Romagani, P., Lasagni, L., Remuzzi, G. Renal progenitors: an evolutionary conserved strategy for kidney regeneration. Nat. Rev. Nephrol. 9, 137-146 (2013).
- Kline, J., Rachoin, J. S. Acute kidney injury and chronic kidney disease: it's a two-way street. Ren. Fail. 35, 452-455 (2013).
- Chawla, L. S., Kimmel, P. L. Acute kidney injury and chronic kidney disease: an integrated clinical syndrome. Kidney Int. 82, 516-524 (2012).
- Sanz, A. B., Sanchez-Niño, M. D., Martìn-Cleary, C., Ortiz, A., Ramos, A. M. Progress in the development of animal models of acute kidney injury and its impact on drug discovery. Expert Opin. Drug Discov. 8, 879-895 (2013).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Transl Res. 163, 109-122 (2014).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: emerging models of acute kidney injury. Curr. Pathobiol. Rep. 3, 171-181 (2015).
- Wingert, R. A., et al. The cdx genes and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, 1922-1938 (2007).
- Wingert, R. A., Davidson, A. J. The zebrafish pronephros: a model to study nephron segmentation. Kidney Int. 73, 1120-1127 (2008).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Analysis of nephron composition and function in the adult zebrafish kidney. J. Vis. Exp. (90), e51644 (2014).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J. Vis. Exp. (54), e2845 (2011).
- Palmyre, A., et al. Collective epithelial migration drives kidney repair after acute injury. PLoS One. 9, e101304 (2014).
- Fogelgren, B., et al. Exocyst Sec10 protects renal tubule cells from injury by EGFR/MAPK activation and effects on endocytosis. Am. J. Physiol. Renal Physiol. 307, F1334-F1341 (2014).
- Hentschel, D. M., Park, K. M., Cilenti, L., Zervox, A. S., Drummond, I. A., Bonventre, J. V. Acute renal failure in zebrafish: a novel system to study a complex disease. Am. J. Physiol. Renal. Physiol. 288, F923-F929 (2005).
- Cosentino, C. C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous microinjections of zebrafish larvae to study acute kidney injury. J. Vis. Exp. (42), e2079 (2010).
- Zhou, W., Boucher, R. C., Bollig, F., Englert, C., Hildebrandt, F. Characterization of mesonephric development and regeneration using transgenic zebrafish. Am. J. Physiol. Renal. Physiol. 299, F1040-F1047 (2010).
- Diep, C. Q., et al. Identification of adult nephron progenitors capable of kidney regeneration in zebrafish. Nature. 470, 95-101 (2011).
- McCampbell, K. M., Springer, K. N., Wingert, R. A. Atlas of cellular dynamics during zebrafish adult kidney regeneration. Stem Cell Int. , 547636 (2015).
- Sharma, P., Sharma, S., Patial, V., Singh, D., Padwad, Y. S. Zebrafish (Danio rerio): a potential model for nephroprotective drug screening. Clinical Queries: Nephrol. 3, 97-105 (2014).
- Gerlach, G. F., Wingert, R. A. Kidney organogenesis in the zebrafish: insights into vertebrate nephrogenesis and regeneration. Wiley Interdiscip Rev Dev Biol. 2, 559-585 (2013).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Hanke, N., et al. 'Zebrafishing' for novel genes relevant to the glomerular filtration barrier. Biomed. Res. Int. 2013, 658270 (2013).
- Kane-Gill, S. L., Goldstein, S. L. Drug-induced acute kidney injury: a focus on risk assessment for prevention. Crit. Care Clin. 31, 675-684 (2015).
- Lopez-Novoa, J. M., Quiros, Y., Vicente, L., Morales, A. I., Lopez-Hernandez, F. J. New insights into the mechanism of aminoglycoside nephrotoxicity: an integrative point of view. Kidney Int. 79, 33-45 (2010).
- Ozkok, A., Edelstein, C. L. Pathophysiology of cisplatin-induced acute kidney injury. Biomed. Res. Int. 2014, 967826 (2014).
- Perazella, M. A., Moeckel, G. W. Nephrotoxicity from chemotherapeutic agents: clinical manifestations, pathobiology, and prevention/therapy. Semin. Nephrol. 30, 570-581 (2010).
- Cheng, C. N., Verdun, V. A., Wingert, R. A. Recent advances in elucidating the genetic mechanisms of nephrogenesis using zebrafish. Cells. 4, 218-233 (2015).
- Pickart, M. A., Klee, E. W. Zebrafish approaches enhance the translational research tackle box. Transl. Res. 163, 65-78 (2014).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat mount preparation for observation and analysis of zebrafish embryo specimens stained by whole mount in situ hybridization. J. Vis. Exp. (89), e51604 (2014).
- Galloway, J. L., Wingert, R. A., Thisse, C., Thisse, B., Zon, L. I. Combinatorial regulation of novel erythroid gene expression in zebrafish. Exp. Hematol. 36, 424-432 (2008).
- McKee, R., Gerlach, G. F., Jou, J., Cheng, C. N., Wingert, R. A. Temporal and spatial expression of tight junction genes during zebrafish pronephros development. Gene Expr. Patterns. 16, 104-113 (2014).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom, and Notch signaling. Dev. Biol. 386, 111-122 (2014).
- Gerlach, G. F., Wingert, R. A. Zebrafish pronephros tubulogenesis and epithelial identity maintenance are reliant on the polarity proteins Prkc iota and zeta. Dev. Biol. 396, 183-200 (2014).
- Cheng, C. N., Wingert, R. A. Nephron proximal tubule patterning and corpuscles of Stannius formation are regulated by the sim1a transcription factor and retinoic acid in the zebrafish. Dev. Biol. 399, 100-116 (2015).
- Lessman, C. A. The developing zebrafish (Danio rerio): A vertebrate model for high-throughput screening of chemical libraries. Birth Defects Res. C Embryo Today. 93, 268-280 (2011).
- Poureetezadi, S. J., Wingert, R. A. Congenital and acute kidney disease: translational research insights from zebrafish chemical genetics. Gen. Med. 1, 112 (2013).
- Poureetezadi, S. J., Donahue, E. K., Wingert, R. A. A manual small molecule screen approaching high-throughput using zebrafish embryos. J. Vis. Exp. (93), e52063 (2014).
- Peng, H. C., Wang, Y. H., Wen, C. C., Wang, W. H., Cheng, C. C., Chen, Y. H. Nephrotoxicity assessments of acetaminophen during zebrafish embryogenesis. Comp. Biochem. Physiol. C Toxicol. Pharmacol. 151, 480-586 (2010).
- Wu, T. S., Yang, J. J., Yu, F. Y., Liu, B. H. Evaluation of nephrotoxic effects of mycotoxins, citrinin and patulin, on zebrafish (Danio rerio) embryos. Food Chem. Toxicol. 50, 4398-4404 (2012).
- Ding, Y. J., Chen, Y. H. Developmental nephrotoxicity of aristolochic acid in a zebrafish model. Toxicol. Appl. Pharmacol. 261, 59-65 (2012).
- Zennaro, C., et al. Podocyte developmental defects caused by adriamycin in zebrafish embryos and larvae: a novel model of glomerular damage. PLoS One. 9, e98131 (2014).
- Ding, Y. J., Sun, C. Y., Wen, C. C., Chen, Y. H. Nephroprotective role of resveratrol and ursolic acid in aristolochic acid intoxicated zebrafish. Toxins. 7, 97-109 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J. Vis. Exp. (27), e1115 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. J. Vis. Exp. (27), e1113 (2009).
- Christou-Savina, S., Beales, P. L., Osborn, D. P. Evaluation of zebrafish kidney function using a fluorescent clearance assay. J. Vis. Exp. (96), e52540 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved