Method Article
Nephrotoxin Microinjection דג הזברה למודל אי-ספיקת כליות חריפה
In This Article
Summary
פציעות כליות הנגרמות nephrotoxins, הכולל תרופות החל אנטיביוטיקה כימותרפיות, שיכולות לגרום להפרעות מורכבות בפתוגנזה ששרידיו מובנים. פרוטוקול זה מדגים כיצד דג הזברה יכול לשמש בסיס לפיתוח מודלים למחלות של תנאים אלה, אשר יכול להיות מיושם על זיהוי של צעדים renoprotective.
Abstract
הכליות הן רגישות לפגוע מחשיפה לכימיקלים שהם לסנן ממחזור הדם. זה יכול להוביל לפציעת איבר הקשורים ירידה מהירה בתפקוד הכלייתי ופיתוח של התסמונת הקלינית המכונית אי-ספיקת כליות חריפה (AKI). סוכנים תרופתיים המשמשים לטיפול נסיבות רפואיות החל זיהום חיידקים לסרטן, כאשר מנוהלים בנפרד או בשילוב עם תרופות אחרות, יכולים ליזום AKI. דג זברה היא מודל חיה כדאי ללמוד את ההשפעות הכימיות על תפקוד כלייתי in vivo, כפי שהם יוצרים כליה עוברית המורכבת מיחידות פונקציונליות נפרון כי הם משומרים עם חוליות גבוהות, כולל בני אדם. יתר על כן, דג זברה יכול להיות מנוצל כדי לבצע מסך גנטי וכימי, המספק הזדמנויות להבהיר את ההיבטים התאיים ומולקולריים של AKI ולפתח אסטרטגיות טיפוליות כגון זיהוי של מולקולות כליה. הנה, אנחנו מדגימים microinjection איך לתוךעובר דג זברה יכול להיות מנוצל כפרדיגמה מחקרי nephrotoxin.
Introduction
AKI הוא אובדן פתאומי של בתפקוד הכליות, אשר יכול להוביל לתוצאות הרסניות לבריאות 1. AKI הוא נושא בריאות משמעותי ברחבי העולם בשל שכיחותה הגבוהה של כ -20% בקרב חולים מאושפזים, עם אף גבוהים יותר שיעורים 30-50% במקרים בטיפול נמרצים והקשישים, ושיעורי תמותה של 50-70% 1-3. למרבה הצער, השכיחות של AKI גדלה והוא צפוי להסלים עוד יותר בעשור הקרוב, בין שאר כתוצאת המגוון של גורמים שיכולים לגרום AKI, הכולל שלאחר ניתוח מתח, איסכמיה, וחשיפת nephrotoxins כגון אנטיביוטיקה תרופות כימותרפיות 4.
AKI כרוך ניזק לתאים פתאומי בתוך הכליה, שכיח ב nephrons, שהן היחידות הפונקציונליות החיוניות, והם מורכבים של מסנן דם וכן אבובית מפולחת המנקזת שתנו לתוך צינוריות איסוף מרכזיות 1. כאשר מספר לא מבוטל של nephrons הואניזוק במהלך AKI, ההשפעות המיידיות כוללות הפרעה בסילוק פסולת מהמחזור, ואת זרימת נוזל מופחת או בוטלו באמצעות nephrons עקב חסימה מתאי מתים וגוססים 1. במשך הזמן, חסימה צינורי יכול להוביל לניוון של nephrons כולו, אשר מפחית 1 תפקוד כלייתי לצמיתות. שינויים פיסיולוגיים הכליה הבאה AKI גם הקשורות בתופעות דלקתיות מורכבות שיכולים להוביל צלקות כרוניות 1.
למרות התוצאות הללו, nephrons יש כמה היכולת לעבור התחדשות לאחר AKI כי reconstitutes 5,6 אפיתל צינורי. אמנם יש כבר הבנה מולקולרית גדל והולך של התחדשות נפרון, המנגנונים להישאר חמקמקה לגבי רבים מחייבים המשך חקירה 7. המידה שבה AKI גורם לנזק כלייתי קבע גם נותר עלום. המחקר הנוכחי מצביע על פוטנציאל ההתחדשות עבור הכליה הואגבוה ביותר בעקבות מקרים חמורים פחות של AKI, בעוד יותר פרקים בולטים או חוזרים להוביל מחלת כליות כרונית (CKD) ותסתיים ב סופנית מחלת כליות (ESRD) הדורש השתלת מצילות חיים או דיאליזה 8,9. בנוסף, אנשים שכבר סובלים CKD נמצאים בסיכון גבוה עוד יותר להידבקות פרק חמור של AKI 8,9. יחדיו, ברור שהמשך מחקר בסיסי וקליני חיוני להבין, לטפל ולמנוע AKI.
מחקר במודלים של בעלי חיים כבר סייע להעריך את ההתקדמות של שינויים מקומיים וסביבתיים המתרחשים במהלך AKI 10. כדי להרחיב את ההבנה הזאת, כמו גם לפתח טיפולים חדשים, במודל חיה דג הזברה כבר המועסקים במגוון דרכים 11,12. Nephrons של הכליה דג הזברה, בשני העובר מבוגר, להציג רמה גבוהה של שימור עם יונקים 13-16. יתר על כן, פגיעה אפיתל נפרון ב zebrafish דומה לתהליך חוליות גבוהות, לפיה ההרס המקומי של תאים צינורי ואחריו התפשטות intratubular ואת הקמתה מחדש של נפרון אדריכלות 17-19. בעובר, אולם ניזק אבובית נרחב מן nephrotoxins כמו ציספלטין קשור קטלני 20,21. לשם השוואה, מבוגרי דג זברה לשרוד AKI ולהציג יכולות משובים מהותיות הכליות. כך למשל, בעקבות החשיפה גנטמיצין אנטיביוטי aminoglycoside, דג הזברה להתחדש נזק אפיתל אבובית ולגדול יחידות נפרון חדשים וכן 22-24. בעוד גנטמיצין הנגרמת אלה מחקרים AKI סיפקו מידע שלא יסולא בפז, להבנת נזק כלייתי מ nephrotoxins מגוונים נותר קריטי להעריך את ההשפעות בתגובה סוגים שונים של נזק 25.
עובר דג הזברה, בשל גודלו, שקיפות עקיבות גנטיות, יש יתרונות רבים ללימודי nephrotoxin 25, שבהם השיטה של microinjection 20,21 משמשת לניהול המולקולה (ים) לחקירה. Nephrons נוצרות על ידי הפריה 24 שעות שלאחר (hpf) ומתחילים לסנן דם בכ 48 hpf 26,27. לפיכך, ההיווצרות המהירה והתפקוד של הכליה העוברית מאפשרים ניתוח הניסיון. עם זאת, תהליך של microinjection יש אתגרים טכניים ויש יכול להיות עקומת למידה תלולה מאסטרינג טכניקה. במאמר זה וידאו, אנו מתארים כיצד לבצע microinjections ולספק עצות לפתרון בעיות כדי להגביר את שיעור זריקות מוצלחות.
Protocol
הנהלים לעבודה עם עוברי דג הזברה המתוארת פרוטוקול זה אושרו על ידי ועדת טיפול בבעלי חיים מוסדיים השתמש באוניברסיטת נוטרדאם.
1. הכנת פתרונות
- הכן פתרון מניות 50x של התקשורת העובר E3 על ידי ערבוב 73.0 גרם NaCl, 3.15 גרם KCl, 9.15 גרם CaCl 2, ו 9.95 גרם MgSO 4 ב 5 ליטר של מים מזוקקים, ולאחסן ב RT.
- עבור culturing של עוברי דג זברה, לדלל את תמיסת 50x המלאה של תקשורת עובר E3 לפתרון עובד 1x עם מים מזוקקים, ולאחר מכן להוסיף 200 μl של מתילן כחול 0.05% לכל 1 ליטר של 1x E3 לפעול כמו פטריות, ולאחסן ב RT.
- בצע פתרון חסימת פיגמנטציה של התקשורת העובר E3 עם 0.003% 1-פניל-2-thiourea (PTU) על ידי שילוב 40 מ"ל של המניה 50x E3 עם 0.06 מ"ג PTU. ואז להביא את הנפח לסך של 2 ליטר עם מים מזוקקים.
- מערבבים את O E3 / PTU / N ב RT כדי לקבל את אבקת PTU אל הפתרון. ואז לאחסן את E3 / PTU בRT.
הערה: E3 / PTU יש חיי מדף של כשבוע, ופתרונות ישנים יהיו פחות יעילים חסימת פיתוח פיגמנטציה זחלי דג זברה. - תן ההרדמה של 0.2% Tricaine (MS-222) על ידי הוספת 1 גרם של Tricaine 500 מ"ל מים מזוקקים ולהתאים את ה- pH ל 7.2 עם 1 M טריס, pH 9.5.
- הכן לבצע פתרון methylcellulose 2% עבור הדמיה על ידי הצבת פתרון של E3 1x (לא מתילן כחול), עם 1/10 נפח ה של 0.2% Tricaine הוסיף ב 4 ° C..
הערה: פתרון methylcellulose הוא פתרון עבה, ברור כי משמש כדי לייצב עובר לחיות בעדינות במיקרוסקופ. לאחר המניפולציות מבוצעות העוברים ניתן לכבס ב 1x E3 לפזר את methylcellulose מבלי לפצוע את החיה ולאפשר מיקרוסקופיה בשלבים הבאים באותה הדגימה. - כאשר מקורר 4 ° C, ומערבבים הפתרון 1x E3 / Tricaine במרץ בצלחת ומערבבים ומוסיפים בהדרגה את הכמות המתאימה של מתילאבקת תאית תוך המשך לבחוש במרץ. מוסיפים בהדרגה את אבקת הפתרון למנוע היווצרות של אגרגטים methylcellulose מסיס.
- אחרי הכל את האבקה מערבבת לתוך תמיסת 2% methylcellulose / E3 / tricaine, מערבבי הפתרון המשולב בחדר הקר ° C 4 O / N.
ההערה: הטמפרטורה הקרה היא טובה ביותר עבור המסת האבקה מלאה. אם הפתרון אינו ברור לאחר לילה אחד, ומערבבים במשך יום עבודה נוסף ו / או O השני / N. - כדי להסיר בועות אוויר מן methylcellulose 2% / E3 / tricaine פתרון, aliquot את התערובת לתוך צינורות 1.5 מ"ל ספין במהירות גבוהה (12,000 XG) בשעה 4 מעלות צלזיוס במשך 30 דקות או עד 2 שעות.
- מניחים את פתרון 2% methylcellulose / E3 / Tricaine ב 4 ° C עבור אחסון לטווח ארוך.
הערה: לפני השימוש, aliquots צריך להיות מחומם מראש ל RT לעבודה עם דגימות דג הזברה.
2. הכנת כלים
- כן כלי מניפולטור העובר, המשמש positioning עובר microinjection, על ידי הצמדת טיפ טעינת ג'ל על קצה מחט לנתח 5 "ישר, ובטוח עם קלטת או דבק מגע.
- כן מחטי microinjection באמצעות חולץ מחט, על ידי הנחת ראשון אש מלוטשת 10 זכוכית בורוסיליקט סנטימטר עם נימה לתוך המכשיר ולאבטח את הזכוכית בורוסיליקט ידי הידוק הידיות.
- משוך את זכוכית בורוסיליקט לעצב מחטים דקות-מחודדות. השתמש בהגדרות הבאות: מחממים 540, למשוך 245, מהירות 200, וזמן 125.
- מחטי מקום בתוך צלחת פטרי, השעיית אותם על רצועת פלסטלינה כדי להגן על טיפי מחט, ולשמור את הכלי הסגור למניעת הצטברות אבק.
- כדי לסיים להכין את המחט עבור microinjections, להשתמש בסכין גילוח או מלקחיים בסדר קצה לחתוך את קצה משך של המחט כדי ליצור טיפ הזרקת זוויתי חד בקוטר של כ 0.05-0.1 מ"מ.
- כדי להפוך את מגש microinjection, להכין פתרון 1.5% agarose / E3 בתוך 100 מ"ל בבקבוק Erlenmeyer ו לפזר את agarose על ידי חימום E3 לרתיחה במיקרוגל ואז להתקרר ב RT במשך כ -10 דקות.
- יוצקים את הפתרון agarose / E3 מקורר לתוך צלחת פטרי כדי להפוך בסיס עם עומק של כ -0.5 ס"מ. כאשר זה יש הקרושה לשפוך שכבה שנייה עם עומק של כ 0.3 סנטימטרים ולהכניס את התבנית היטב עובר הטרומית ולאפשר agarose כדי לחזק ב RT.
הערה: כאשר מכניסים את התבנית לתוך השכבה אגר העליון / E3, הצבת את התבנית לתוך אגר בזווית כדי להקטין את מספר בועות אוויר. - כאשר מגש microinjection כולו קבע, להרים את העובר הטרומי גם לעצב לאט ובזהירות באמצעות scoopula, ולאחר מכן למלא את המנה עם פתרון ולאחסן E3 על 4 מעלות צלזיוס.
3. עובר כנה
- הגדרת טנקי הזדווגות דג זברה על ידי הצבת מחיצות לתאי הזדווגות וממלאת במי מערכת.
- מניחים דג אחד בכל צד של המחיצה שלuch כי כל תא מכיל הזדווגות נקבה אחד ודגי זכר אחד, ומכסה כל תא הזדווגות.
- למחרת בבוקר, להסיר את המחיצות כדי לאפשר השרצה.
- בדוק את הדגים לאחר כ -30 דקות, ולאחר חזרת המבוגרים לאקווריום, לאסוף העוברים שלהם על ידי העברת מי טנק הזדווגות באמצעות כלי מסננת מתכת-רשת בסדר.
- הפוך את המסננת מעל צלחת פטרי ולשטוף עם E3 לאסוף את העוברים.
- דגירה עוברים על 28.5 ° CO / N.
- כאשר עוברים הגיעו 24-26 somite שלב 26, למזוג רוב כלי התקשורת E3 ואז dechorionate על ידי הוספת 100 μl של 50 מ"ג / מ"ל pronase על כל מנה של עוברים דוגרים צלחת ב RT (23 מעלות צלזיוס) במשך כ 15 דקות.
הערה: זה ייקח כ 24-25 שעות מרגע הפריה כלפי העובר להגיע לשלב 24-26 somite אם הם נאספים באופן מתואר וטופח O / N ב 28.5 מעלות צלזיוס. - מלאו את הצלחת עםE3 ולאחר מכן מערבולת בעדינות כדי לסלק את chorions מן העוברים.
- למזוג E3 / pronase ולשטוף את המנה עם 25 מיליליטר של E3 הטרי. צעד לשטוף חזור להסיר את כל pronase.
- כדי לעצור התפתחות פיגמנטציה, למזוג E3 ולהחליף עם 25 מ"ל של טרי E3 / PTU כאשר עוברים הגיעו 24 שעות שלאחר ההפריה.
הערה: בניסויים פורשים כמה ימים, להחליף את פתרון E3 / PTU עם תקשורת טריה פעם ביום כדי לשמור על הצלחת נקיה.
4. Microinjection של פתרון Nephrotoxin
- ביום הזרקה, להכין את פתרון nephrotoxin הרצויה יחד עם השליטה ברכב המתאימה.
- וורטקס או ומערבבים בעדינות כדי להבטיח את התרופה (ים) הוא / הם בתמיסה, בדיקת צידי הצינור העליון של עמודת המים.
הערה: פתרונות Nephrotoxin ניתן להכין להכיל כמויות זעירות של dextran מצומדות fluorescently לפקח יעילות microinjection וגם להעריך פינוי כלייתי ב subseqזמן uent מצביע 20,28. - טען מחט microinjection גזוז עם ~ 2-3 μl של nephrotoxin ידי השחלה טיפ טעינת ג'ל בסדר לחלק האחורי של המחט להשעות את המחט בצורה אנכית עם חתיכת סרט לאפשר הפתרון למלא את קצה המחט גזוז על ידי כוח הכבידה.
- ברגע שקצה המחט מלא, לאבטח את המחט הטעונה micromanipulator.
- בדוק את נפח microinjection ידי הצבת טיפה של שמן מינרלי לשקופית מיקרומטר ולהזריק לתוך השמן כדי להעריך את גודל טיפה. נפח הזרקה של 500 pl בעל קוטר של 0.1 מ"מ.
- מוציאים את המאפה של עוברים מן החממה, להרדים ידי הוספת כ 5 מ"ל של Tricaine 0.2% כדי בצלחת העובר.
- כדי להבטיח הרדמה מלאה, לגעת העובר בעדינות עם קצה של כלי מניפולטור העובר. חוסר התנועה מצביע הרדמה מספיק.
- לאחר הרדמה מוצלחת, להעביר עובר אל עובש ההזרקה עם transfפיפטה אה.
- לתמרן כל עובר לתוך באר שונה של עובש נחת הראש באזור העמוק ביותר של כאלה היטב כי המטען נח לאורך השקע ואת הזנב מזדקר אל מחוץ למיתון.
- הכנס את המחט המלאה לתוך micromanipulator ומקם את קצה המחט ליד עובר.
- הכנס בעדינות את המחט לתוך כלי הזנב על ידי הזזת הג'ויסטיק קדימה על דוושת הרגל כדי לספק את microinjection.
הערה: זריקה מוצלחת תעיד על ידי צפייה הנוזל להיכנס במחזור. יתר על כן, שיתוף הזרקה של nephrotoxicant עם dextran מצומדות fluorescently מאפשרת לחוקר לאמת זריקה מוצלחת לאחר ההליך. - משוך בעדינות בחזרה על הג'ויסטיק כדי להוציא את המחט מן העובר.
- לאחר הזרקה, להעביר את העוברים כדי בצלחת נקיה ולשטוף להסיר את Tricaine ולהחליף עם E3 טרי / PTU.
- דגירה העובר לנקודת הזמן הרצוי כדי ישבניםמורפולוגיה של, אשר יכול להיות מתועד על ידי צילום תקשורת הרכבת methylcellulose, או תהליך לניתוח הניסיון כרצונכם.
הערה: שחזור של עוברים יש לבחון כדי לקבוע את אחוז האנשים עם בצקת, אשר מציינת פגיעת כלייתית נפוצה.
תוצאות
תחנת microinjection להגדיר כולל סטראו, micromanipulator ו ווסת לחץ (איור 1 א). שקוף של צלחת ההזרקה עדיפה להציג דגימות במהלך הליך זה (איור 1 ב). הכנת מחט הזריקה כרוכה משייכת הזכוכית בורוסיליקט המתאימה, ולאחריו הכנת הקצה עם חיתוך ולבסוף חזרה טעינה את המחט. באופן אופטימלי, קצה המחט הוא משופע ולא להקהות (התרשים 1C), חתך כי נעשה על ידי לדוג הקצה חד של מכשיר החיתוך, כגון מלקחיים בסדר, במהלך הליך החיתוך (איור 1D). הקצה המחודד הזה הוא חיוני מאוד ישפיע על היכולת להכניס את המחט בעדינות לתוך דג הזברה.
ביום הזרקה, עובר מוקמו באמצעות עובר חסון אבל וגמישמניפולציה כלים (1E איור). עבור הזריקה, עובר היו תמרן, כך הגוף נח לאורך הצד של מגש ההזרקה לספק מנוף צעד ההזרקה הבא (האיור 1F). בעוד הזרקה, יש למקד את מטוס מבט על הטורסו העוברי כדי להמחיש את היעד וסקולרית עבור החדרת מחט ואז לבחון את החומר המוזרק להיכנס במחזור (האיור 1G).
השקיפות של העובר דג הזברה הופך לפשוט יותר את ההליך microinjection, ויכול להיות עוד יותר משופר על ידי טיפול כימי PTU ב 24 hpf כדי להפחית את התפתחות פיגמנטציה במהלך קורס זמן הניסוי טיפוסי (איור 2 א). כאן, דגימות העובר הורשו לפתח דרך שלב 72 hpf, אז היו או מדומה מוזרק, microinjected עם הרכב מלוחים, או microinjected עם 2.5 מ"ג / מ"ל גנטמיצין (איור 2 א).תצפית חיים לאחר נערכה אחד ושני ימים לאחר הזרקה, באמצעות תאורה שקופה עם סטראו (איור 2 ב). לעומת עוברי מדומה או מלוחים מוזרק, רק אנשים מוזרק גנטמיצין הראה התפתחות בצקת (איור 2 ב), בצקת קרום הלב במקרה זה, כנראה בגלל ביטול של פונקציונליות כלייתי תקין בקנה אחד עם תצפיות שפורסמו בעבר 11,20,21.
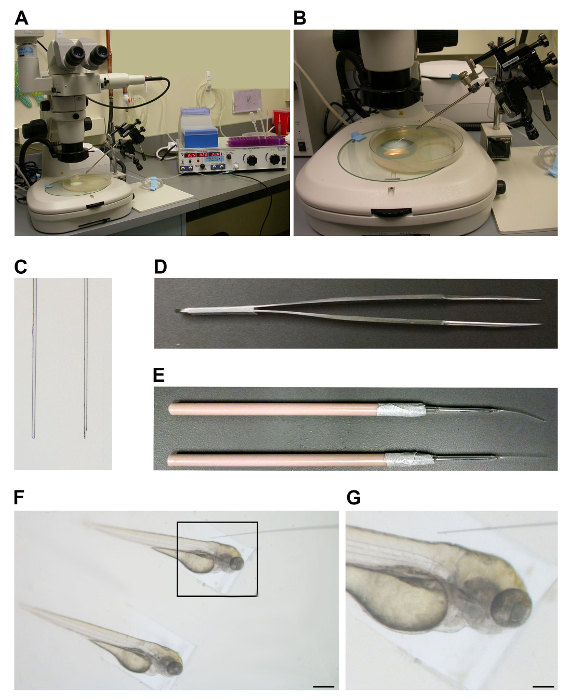
איור 1. מנגנון וכלי Microinjection. (א) תחנת הזרקה להגדיר עם סטראו (משמאל), micromanipulator ו בעל מחט (באמצע) ווסת לחץ (מימין). (ב) שקוף של צלחת ההזרקה. (C) משמאל: מחט לחתוך בלאנט. מימין: מחט לחתוך משופעים. (ד) Fמלקחי ine משמשים לחיתוך טיפי מחט. (E) כלי מניפולציה המשמשים להכנסה ומקם את הדגימות לתוך תבנית ההזרקה. (F) עוברים ערוכים במתכונת microinjection. סרגל קנה מידה = 0.5 מ"מ. (G) מיצוב של מחט ליד העובר להזרקה. סרגל קנה מידה = 0.15 מ"מ. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. בצקת הזרקת ציר זמן ופוסט ניסיוני assay. (א) דוגמא nephrotoxin ציר זמן ניסיוני דג זברה, כאן להחיל מחקר גנטמיצין. העוברים היו dechorionated ומטופל עם פתרון PTU ב 24 שעות שלאחר ההפריה (hpf). כל יום, פתרון PTU היה יצק ומחליף עם תקשורת טריה כפי שצוין על ידי smaller חצים ירוקים. ב 72 hpf, עובר היו מורדמים, עברו עובש הזרקה ומאז הם ראו כדלקמן: מוזרק מדומה או מוזרק או מלוח (שליטה ברכב) או גנטמיצין. לאחר להחיות את העוברים בתקשורת טריה, העוברים נצפו לאחר הזרקת 1 ו -2 ימים (96 ו -120 hpf, בהתאמה) לניתוח רכישת תמונה. (ב) למעלה: העובר דג הזברה uninjected. תיכון: עובר מוזרק 72 hpf עם מי מלח. תחתונה: העובר מוזרק עם 2.5 מ"ג / מ"ל גנטמיצין. סרגל קנה מידה = 0.5 מ"מ. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
מספר רחב של סוכנים טיפוליים קושר עם AKI 29. היו מקדמות מחקר משמעותי בהבנת הנזק הנגרמת על ידי תרכובות בודדים רבים, כגון גנטמיצין aminoglycoside 30 ו ציספלטין כימותרפיות בשימוש נרחב 31,32. שינויים פתולוגיים מסוימים מעורבים בתנאים אלה, עם זאת, להישאר בנושא של מחקר מתמשך. אתגר המתהווה אחת נותר הבנה כיצד תרופות מרובות להשפיע לרעה חולה, במיוחד אלה באוכלוסיות בסיכון גבוה כגון אלה במסגרות טיפול נמרצות ואת 29 הקשישים. לפיכך, מודלים המאפשרים מחקרים המבוססים הסלולר נוספים אודות ההשפעות של AKI-סמים משמשים תפקיד חשוב בשיפור זיהוי של מצב זה ולהעריך תרופתיות דינמיות.
עבודה עם מודלים יונקים כמו העכבר והחולדה הייתה בלתי נפרדת להקים שינויים תאיים בכליות הבאות AKI, buהגבלת t אחד עם מערכות אלה היא כי ישירה, תצפית בזמן אמת מוגבלת בשל המורכבות האדריכלית והמיקום הפנימי של האיבר. במילים פשוטות, הכליה אינה זמינה עבור תצפית ישירה, אשר מחייבת כי אנשים להקריב כדי לנתח את הכליה. ניתן יהיה להתמודד מגבלות אלה באמצעות עוברי דג הזברה, אשר יוצרים כליות פשוטה של שני nephrons שיש להם מבנה מגזר משומר עם חוליות אחרים, כולל בני אדם 33. פיתוח דג זברה מתרחש ברחם לשעבר ועם פיגמנטציה קטין, המאפשר תצפית ישירה של organogenesis כליות וניטור של תגובות לגירויים חיצוניים 34. כלים לניתוח מולקולרי, כגון ביטוי גני 35-37, כבר נוצל עם ברזולוציה גבוהה על מנת לקבוע את התכונות של nephrogenesis 38-40. מניפולציות ניסוייות לבדיקה של מולקולות קטנות באמצעות גנטיקה כימית מבוססות היטב דג זברה החלים על kidnEY 41-43. ואכן, בשנים האחרונות, דג הזברה הוחלו מודל כלייתית של סוכנים החל acetominophen כדי mycotoxins וחומצה aristolochic 44-48. חשוב לציין כי יש גם מגבלות משמעותיות על דוגמנות AKI בעובר דג הזברה, בגלל הפשטות מאוד של מבנה כליות בשלב זה בפיתוח. לדוגמא, דג זברה אינן מתאימה לטיפול אינטראקציות multifactorial בתוך רקמת כליה כי הוא ארוז בצפיפות עם nephrons כי מוקפי stroma מורכב המכיל סוגי תאי ביניים מרובים, כפי שנהוג המכרסם או metanephros אדם. לכן, דג הזברה הן מתאים ביותר להמחשת שינויים תאיים ומולקולריים אוטונומיים נפרון במהלך AKI.
השיטה של microinjection שתוארו כאן, בזמן שיש עקומת למידה תלולה, הוא מאוד שימושי לחקר שתי המדינות התפתחותיות ומחלות כולל nephrotoxins. טכניקה זו יכולה לשמש כדי teתרופות רח בנפרד או במשולב. בנוסף, זריקות יכולות להתבצע במהלך מגוון רחב של נקודות זמן פיתוח. שיטה דומה, מעשית לא פחות לביצוע microinjections תוך ורידי הזחלים דג הזברה תוארה בעבר על ידי Cosentino, et al. 21. אחת הבחנה משמעותית המתודולוגיה שלהם, לעומת השיטות שתוארו כאן, היא כי העובר להיות מוזרקת הוא משותק ניצול פיפטה מחזיק 21. שימוש פיפטה החזקה הנו חלופת עובש ההזרקה. חוקרים המבקשים ליישם microinjection כשיטה משלוח לסוכני nephrotoxicant צריכה להיות מודעת חלופה זו מומלצת להשוות את השיטות לזיהוי אשר עדיף באופן אישי, כמו ללמוד לתפעל את פיפטה מחזיק כדי לא לפגוע בעובר יהיה כרוך בפועל בדיוק כפי שהוא דורש תרגול לתמרן microinject באמצעות עובש הזרקה פשוט בהצלחה עם חלל דיכאון עבור embryos.
בעת ביצוע הליך זה, חשוב להכין מחטי הזרקה בגודל המתאים, וכדי לחתוך את הזווית על קצה המחט כדי לייעל כניסה חלקה ויציאה לתוך המחזור העוברי. במהלך הליך ההזרקה, זה קריטי כדי לנטר את עוצמת הזריקה להעריך עקביות של משלוח nephrotoxin בין דגימות. הערכה תקופתית של נפח הזרקה עם מיקרומטר יכולה להתבצע אם החוקר אינו בטוח לגבי שינויים בהיקף גדול, תוך ביצוע ניסוי. לדוגמה, בשל האופי של הטכניקה, קצה המחט יכול חלקית או לחלוטין לסתום עם פסולת הסלולר. סיבוך זה ניתן לסתור ידי ניקוי מחט מעת לעת על מנת להבטיח עקביות של הנוזל נפלט. בנוסף, חיוני לצבוע כמו פנול אדום ניתן להוסיף לתערובת לפעול כסמן חזותי של ההזרקה ולסייע ניטור פיזור נוזל 49,50. יתר על כן, זריקות של מולקולות נותבו יכולות לסייעביטוי חזותי אוכלוסיות תאים ספציפיים, בעקבות ההזרקה. עבור שיתוף הזרקת moieties dextran ניאון, במיוחד 10 conjugates dextran kDa, יש מספר יישומים 16,17. במקרה זה, ההערכה של עוצמת פלורסנט יכול להתבצע מיד לאחר ההליך כדי לאשר microinjection מוצלח עם דליפה מינימלית. עוצמת ניתן למדוד באמצעות הצילום לכידת תמונה מתאימה מחדש ואז בנקודות זמן לאחר למדוד את השינוי בעוצמת פלורסנט כדי למדוד פינוי כלייתי 51. יתר על כן, את הספיגה של dextran ב אבובית הפרוקסימלי מספק proxy עבור פונקציונליות של מגזר נפרון זה 16,17.
יחדיו, ישנן דרכים רבות כי microinjection יכול להיות מנוצל כדי לחקור AKI עם דג הזברה, במיוחד כמודל זו מספקת את ההזדמנות כדי להתייחס הפרמקוקינטיקה in vivo. לכן, פעם אחת משתלט עליו, microinjection של nephrotoxinsאל עובר דג הזברה מספק פרדיגמה שימושי עבור מחקרי כליות.
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי DP2OD008470 מענק NIH. בנוסף, זיכרון RAM נתמך בחלקו על ידי קרנות הניתנים על ידי אוניברסיטת בית הספר למוסמכים נוטרדאם. אנו מודים לצוות המחלקה למדעי הביולוגיה, המרכז הזברה מחקר, והמרכז בתאי גזע משובי רפואה באוניברסיטת נוטרדאם. תודה מיוחדת לחברי מעבדה לעיסוק דיונים על ביולוגית כליות ומשוב המועילות על עבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| Sodium Chloride | American Bioanalytical | AB01915 | |
| Potassium Chloride | American Bioanalytical | AB01652 | |
| Calcium Chloride | American Bioanalytical | AB00366 | |
| N-Phenylthiourea (PTU) | Aldrich Chemistry | P7629 | |
| Ethyl 3-aminobenzoate (Tricaine) | Fluka Analytical | A5040 | |
| Borosilicate glass | Sutter Instruments Co. | BF100-50-10 | |
| Flaming/Brown Micropipette puller | Sutter Instruments Co. | Mo. P097 | |
| UltraPure Agarose | Invitrogen | 15510-027 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Blue | Sigma-Aldrich | M9140 | |
| Falcon Diposable Petri Dishes, Sterile, Corning: | |||
| 60mm x 15mm | VWR | 25373-085 | |
| 100mm x 15mm | VWR | 25373-100 | |
| (microinjection tray) 150mm x 15mm | VWR | 25373-187 | |
| Low Temperature Incubator | Fischer Scientific | 11 690 516DQ | |
| Micro Dissecting Tweezer | Roboz Surgical Instruments Co. | RS-5010 | |
| Micrometer | Ted Pella, Inc. | 2280-24 |
References
- Basile, D. P., Anderson, M. D., Sutton, T. A. Pathophysiology of acute kidney injury. Compr. Physiol. 2, 1303-1353 (2012).
- Ostermann, M. Diagnosis of acute kidney injury: kidney disease improving global outcomes criteria and beyond. Curr. Opin. Crit. Care. 20, 581-587 (2014).
- Fluck, R. J. Acute kidney: improving the pathway of care for patients and across healthcare. Curr. Opin. Nephrol. Hypertens. 24, 511-516 (2015).
- Silver, S. A., Cardinal, H., Colwell, K., Burger, D., Dickhout, J. G. Acute kidney injury: preclinical innovations, challenges, and opportunities for translation. Can. J Kidney Health Dis. 2, 30 (2015).
- McCampbell, K. K., Wingert, R. A. Renal stem cells: fact or science fiction?. Biochem. J. 444, 153-168 (2012).
- Li, Y., Wingert, R. A. Regenerative medicine for the kidney: stem cell prospects and challenges. Clin. Transl. Med. 2, 11 (2013).
- Romagani, P., Lasagni, L., Remuzzi, G. Renal progenitors: an evolutionary conserved strategy for kidney regeneration. Nat. Rev. Nephrol. 9, 137-146 (2013).
- Kline, J., Rachoin, J. S. Acute kidney injury and chronic kidney disease: it's a two-way street. Ren. Fail. 35, 452-455 (2013).
- Chawla, L. S., Kimmel, P. L. Acute kidney injury and chronic kidney disease: an integrated clinical syndrome. Kidney Int. 82, 516-524 (2012).
- Sanz, A. B., Sanchez-Niño, M. D., Martìn-Cleary, C., Ortiz, A., Ramos, A. M. Progress in the development of animal models of acute kidney injury and its impact on drug discovery. Expert Opin. Drug Discov. 8, 879-895 (2013).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Transl Res. 163, 109-122 (2014).
- McKee, R. A., Wingert, R. A. Zebrafish renal pathology: emerging models of acute kidney injury. Curr. Pathobiol. Rep. 3, 171-181 (2015).
- Wingert, R. A., et al. The cdx genes and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, 1922-1938 (2007).
- Wingert, R. A., Davidson, A. J. The zebrafish pronephros: a model to study nephron segmentation. Kidney Int. 73, 1120-1127 (2008).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Analysis of nephron composition and function in the adult zebrafish kidney. J. Vis. Exp. (90), e51644 (2014).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J. Vis. Exp. (54), e2845 (2011).
- Palmyre, A., et al. Collective epithelial migration drives kidney repair after acute injury. PLoS One. 9, e101304 (2014).
- Fogelgren, B., et al. Exocyst Sec10 protects renal tubule cells from injury by EGFR/MAPK activation and effects on endocytosis. Am. J. Physiol. Renal Physiol. 307, F1334-F1341 (2014).
- Hentschel, D. M., Park, K. M., Cilenti, L., Zervox, A. S., Drummond, I. A., Bonventre, J. V. Acute renal failure in zebrafish: a novel system to study a complex disease. Am. J. Physiol. Renal. Physiol. 288, F923-F929 (2005).
- Cosentino, C. C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous microinjections of zebrafish larvae to study acute kidney injury. J. Vis. Exp. (42), e2079 (2010).
- Zhou, W., Boucher, R. C., Bollig, F., Englert, C., Hildebrandt, F. Characterization of mesonephric development and regeneration using transgenic zebrafish. Am. J. Physiol. Renal. Physiol. 299, F1040-F1047 (2010).
- Diep, C. Q., et al. Identification of adult nephron progenitors capable of kidney regeneration in zebrafish. Nature. 470, 95-101 (2011).
- McCampbell, K. M., Springer, K. N., Wingert, R. A. Atlas of cellular dynamics during zebrafish adult kidney regeneration. Stem Cell Int. , 547636 (2015).
- Sharma, P., Sharma, S., Patial, V., Singh, D., Padwad, Y. S. Zebrafish (Danio rerio): a potential model for nephroprotective drug screening. Clinical Queries: Nephrol. 3, 97-105 (2014).
- Gerlach, G. F., Wingert, R. A. Kidney organogenesis in the zebrafish: insights into vertebrate nephrogenesis and regeneration. Wiley Interdiscip Rev Dev Biol. 2, 559-585 (2013).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Hanke, N., et al. 'Zebrafishing' for novel genes relevant to the glomerular filtration barrier. Biomed. Res. Int. 2013, 658270 (2013).
- Kane-Gill, S. L., Goldstein, S. L. Drug-induced acute kidney injury: a focus on risk assessment for prevention. Crit. Care Clin. 31, 675-684 (2015).
- Lopez-Novoa, J. M., Quiros, Y., Vicente, L., Morales, A. I., Lopez-Hernandez, F. J. New insights into the mechanism of aminoglycoside nephrotoxicity: an integrative point of view. Kidney Int. 79, 33-45 (2010).
- Ozkok, A., Edelstein, C. L. Pathophysiology of cisplatin-induced acute kidney injury. Biomed. Res. Int. 2014, 967826 (2014).
- Perazella, M. A., Moeckel, G. W. Nephrotoxicity from chemotherapeutic agents: clinical manifestations, pathobiology, and prevention/therapy. Semin. Nephrol. 30, 570-581 (2010).
- Cheng, C. N., Verdun, V. A., Wingert, R. A. Recent advances in elucidating the genetic mechanisms of nephrogenesis using zebrafish. Cells. 4, 218-233 (2015).
- Pickart, M. A., Klee, E. W. Zebrafish approaches enhance the translational research tackle box. Transl. Res. 163, 65-78 (2014).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat mount preparation for observation and analysis of zebrafish embryo specimens stained by whole mount in situ hybridization. J. Vis. Exp. (89), e51604 (2014).
- Galloway, J. L., Wingert, R. A., Thisse, C., Thisse, B., Zon, L. I. Combinatorial regulation of novel erythroid gene expression in zebrafish. Exp. Hematol. 36, 424-432 (2008).
- McKee, R., Gerlach, G. F., Jou, J., Cheng, C. N., Wingert, R. A. Temporal and spatial expression of tight junction genes during zebrafish pronephros development. Gene Expr. Patterns. 16, 104-113 (2014).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom, and Notch signaling. Dev. Biol. 386, 111-122 (2014).
- Gerlach, G. F., Wingert, R. A. Zebrafish pronephros tubulogenesis and epithelial identity maintenance are reliant on the polarity proteins Prkc iota and zeta. Dev. Biol. 396, 183-200 (2014).
- Cheng, C. N., Wingert, R. A. Nephron proximal tubule patterning and corpuscles of Stannius formation are regulated by the sim1a transcription factor and retinoic acid in the zebrafish. Dev. Biol. 399, 100-116 (2015).
- Lessman, C. A. The developing zebrafish (Danio rerio): A vertebrate model for high-throughput screening of chemical libraries. Birth Defects Res. C Embryo Today. 93, 268-280 (2011).
- Poureetezadi, S. J., Wingert, R. A. Congenital and acute kidney disease: translational research insights from zebrafish chemical genetics. Gen. Med. 1, 112 (2013).
- Poureetezadi, S. J., Donahue, E. K., Wingert, R. A. A manual small molecule screen approaching high-throughput using zebrafish embryos. J. Vis. Exp. (93), e52063 (2014).
- Peng, H. C., Wang, Y. H., Wen, C. C., Wang, W. H., Cheng, C. C., Chen, Y. H. Nephrotoxicity assessments of acetaminophen during zebrafish embryogenesis. Comp. Biochem. Physiol. C Toxicol. Pharmacol. 151, 480-586 (2010).
- Wu, T. S., Yang, J. J., Yu, F. Y., Liu, B. H. Evaluation of nephrotoxic effects of mycotoxins, citrinin and patulin, on zebrafish (Danio rerio) embryos. Food Chem. Toxicol. 50, 4398-4404 (2012).
- Ding, Y. J., Chen, Y. H. Developmental nephrotoxicity of aristolochic acid in a zebrafish model. Toxicol. Appl. Pharmacol. 261, 59-65 (2012).
- Zennaro, C., et al. Podocyte developmental defects caused by adriamycin in zebrafish embryos and larvae: a novel model of glomerular damage. PLoS One. 9, e98131 (2014).
- Ding, Y. J., Sun, C. Y., Wen, C. C., Chen, Y. H. Nephroprotective role of resveratrol and ursolic acid in aristolochic acid intoxicated zebrafish. Toxins. 7, 97-109 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J. Vis. Exp. (27), e1115 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and morpholino antisense oligonucleotides in zebrafish embryos. J. Vis. Exp. (27), e1113 (2009).
- Christou-Savina, S., Beales, P. L., Osborn, D. P. Evaluation of zebrafish kidney function using a fluorescent clearance assay. J. Vis. Exp. (96), e52540 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved