Method Article
脱細胞肺足場を使用してESC由来のマウス気道上皮細胞の生成
要約
このプロトコルは、効率的に気道上皮細胞を成熟するために、マウスの胚性幹細胞由来の胚体内胚葉を指示します。この分化技術は、定義された、無血清培養の設定において、肺系統の仕様を指示するために3次元の脱細胞化肺足場を使用します。
要約
肺系統への分化は、増殖因子シグナル伝達、細胞 - 細胞相互作用および細胞 - マトリックス相互作用を含む複雑な環境手がかりの統合を必要とします。これにより、複雑に、肺上皮細胞への幹細胞の分化を促進するために、インビトロで肺の発達の要約は、困難でした。このプロトコルでは、脱細胞化肺足場は、肺の3次元環境を模倣し、幹細胞由来の気道上皮細胞を生成するために使用されます。マウス胚性幹細胞を、まず脱細胞化の足場上に播種されたアクチビンA内胚葉細胞と胚様体(EB)培養法を用いて内胚葉系統に分化し、最大21日間、空気 - 液体界面で培養します。この技術は、追加の増殖因子を補充せずに機能的気道上皮細胞(繊毛細胞、クラブ細胞、および基底細胞)に播種した細胞の分化を促進します。この培養の設定が定義されている、SERUメートルのない、安価で、かつ再現可能。文化の中で非肺内胚葉系統からの限られた汚染があるが、このプロトコルは、気道上皮集団を生成し、肺胞上皮細胞に上昇を与えるものではありません。このプロトコルを用いて生成された気道上皮、肺器官中および疾患モデルまたは嚢胞性線維症などの気道に関連した病態の創薬プラットフォームの細胞 - マトリックス相互作用を研究するために使用することができます。
概要
肺系統への多能性細胞の監督分化は、微小環境1,2で正確なシグナル伝達事象に依存しています。これにより、プロセスの動的な性質のために、in vitroで肺器官の正確なイベントを模倣するために挑戦されています。最近の報告は、肺分化3-8を達成するために、二次元培養物の可溶性増殖因子の補充と段階的系統制限戦略を使用しています。段階的な分化プロトコルにおいて、多能性細胞は、胚性幹細胞(ESC)または人工多能性幹細胞かどうかを、まず胚体内胚葉胚葉に分化させました。ホメオドメイン含有転写因子NKX2-1の表現によって識別されるように内胚葉細胞は、その後、前方内胚葉の運命に、その後、肺前駆細胞にプッシュされました。これらの肺前駆細胞はさらに、近位(気道)または遠位(肺胞)肺上皮細胞のwiに分化させました継続的な成長因子補充番目。このような2次元の戦略が肺上皮細胞を生成する際に、いくつかの成功を収めている、しかし、そこに不明瞭効率、他の内胚葉系統からの汚染の可能性、3次元(3D)構造の欠如を含むいくつかの制限があり、場合によっては、未定義の培地の使用血清補充を持ちます。脱細胞肺足場上の多能性又は分化した細胞の培養は、ますます肺上皮構造3,5,6,8,9を形成する際に播種した細胞の再生可能性を評価するためのアッセイとして使用されています。このようなレポートの文化は継続的な成長因子または血清補充と足場に細胞を播種しました。
肺の開発は、環境の合図に応答して個々の細胞の分裂、遊走、遺伝子発現および分化を含みます。細胞外マトリックス(ECM)は、構造的支持を提供することに加えて、TISSUを指示する糖タンパク質の格子でありますこれらのプロセス10,11を統合し、調節することにより、電子形態形成。優れたin vivoでの肺の発達環境を模倣するために内胚葉培養のために自然なプラットフォームとしての肺のECMスキャフォールドを使用することにより、我々は、高効率と再現性で設定定義された3D-培養中の細胞由来の気道上皮幹細胞生成しています。
ラット肺のECMスキャフォールドは、脱細胞化によって生成されただけでなく、マウスESC由来の内胚葉細胞が生成され、その後、これらの足場に播種しました。 CXCR4&C-KITタンパク質の二重発現は、気道(近位肺)前駆細胞として同定されるSOX2&NKX2-1発現の両方に陽性胚体内胚葉細胞のアイデンティティと細胞を示します。胚体内胚葉細胞は、 インビトロでの機能的気道上皮細胞を生成するために、最大3週間、空気液体界面(ALI)で培養しました。
このプロトコルは、definiの肺系統への分化を促進します早ければ7日のような的な内胚葉、NKX2-1 + / SOX2 +早期近位肺前駆細胞の出現で観察しました。日によって14と文化の21成熟した気道上皮細胞集団は、ネイティブマウス気道への形態学的および機能的類似性を持つ繊毛(TUBB4Aの+)、クラブ(SCGB1A1の+)、および基底(TRP63 +、KRT5 +)細胞を含む出現します。このプロトコルは、上皮細胞を気道する堅牢な差別化を実現するための3次元マトリックスの微小環境の重要性を示しています。
プロトコル
動物実験は、病気の子供の研究所用の病院の動物ケア委員会のガイドラインに従って行いました。
1.足場の準備
- 肺の脱細胞化
- CO 2チャンバーを用いて大人Wistarラットを安楽死させます。チャンバー内に動物を置き、毎分室容積の10から30パーセントの充填率で100%のCO 2露光を開始。
- 無意識のために動物を観察します。これは、約2〜3分後に発生します。無意識は、この期間中に発生しない場合は、速度とチャンバシールを埋めるチェック。無意識に続いて、色あせた目の色や呼吸の不足のために動物を観察。両方が認められた場合、1-2分間CO 2の充填性を維持し、その後手続きのためにチャンバーから動物を削除します。
- 前足と後ろ足を固定することにより、表面を解剖する動物を固定し、70%エタノールで胸と腹部領域を下にスプレー。心臓やLUにアクセス胸骨に沿って縦切開を使用して胸腔を開いてNGS。
- 肺を穿刺の可能性を低減、肺が撤回させるために第一ダイヤフラムを通して小さな切開を行います。縫合糸と下大静脈を結紮し、小さな解剖ハサミで左心房に小さな切開部を置きます。
- ヘパリン処理したハンクス平衡塩溶液(HBSS)(HBSS中で10 U / mlのヘパリン)を充填した25 G針を準備し10ミリリットル注射器を用いて、肺循環を介してバッファをプッシュするために右心室に針を挿入することにより、肺灌流を開始(2 ml /分の速度)。肺が白く、左心房から流れる流体が透明に実行されるまで、この手順を続行します。
- 灌流後、甲状軟骨に近いプラスチックカテーテルを気管カニューレを挿入するとを露出させ、縫合糸で所定の位置に固定します。
- セットアップレトルトスタンドとクランプに10ミリリットル注射器を固定することで、重力の灌流システム。削除およびdiscardシリンジプランジャ。肺上記20センチメートルでシリンジバレル上の最大充填点を固定します。カニューレを挿入し、気管に脱細胞化ソリューションを提供するための活栓の他端にシリンジの最後に2方コック、と長いプラスチックチューブを取り付けます。シリンジにソリューションを注ぎ、溶液が付着したプラスチックチューブ及びカテーテルを埋めることができます。
- 1分間の総肺容量(約12ミリリットル)に充填することによって肺を洗浄し、流体が肺の外に流れることを可能にするために気管からプラスチック製のカテーテルを削除します。 H 2 O 20cmの下に圧力を保つために、肺をlavagingとき、シリンジ以上の10ミリリットルを記入しないでください。
- リン酸緩衝生理食塩水(PBS)で10回洗浄、続いて脱細胞化溶液で8倍に肺の洗浄を繰り返します。
- 首と胸の空洞から無料で気管と肺を解剖し、動物から取り除きます。ビブラトームSEのための準備まで4℃で冷PBSで組織を保ちますctioning。
- CO 2チャンバーを用いて大人Wistarラットを安楽死させます。チャンバー内に動物を置き、毎分室容積の10から30パーセントの充填率で100%のCO 2露光を開始。
- 肉厚部の生成
- 小さな長方形のブロックにすべてのローブを埋め込むための約15ミリリットルの2%と4%の(w / v)のアガロース、および十分な6%(w / v)のアガロースを準備します。電子レンジによってPBS中の低融点アガロース粉末を溶解します。ヒートブロック上で50ミリリットルチューブにアガロースを移し、ゲル化を避けるために40℃以上の温度を維持します。
- 小さなハサミを使用して、各葉(頭蓋、ミドル、付属品、および尾右葉と左葉)を切り離すために、各葉気管支の最後に脱細胞化肺を解剖。パットは、アガロース加熱ブロック上にある間(w / v)の2%の内側に過剰のPBSと場所を削除するには、吸収性シートを使用して、各葉を乾燥させます。
- ペトリ皿に置き、アガロースでコーティングの5分後に各葉を取り出して、表面がコールドプレートに1分間ゲル化することができます。
- 穏やかに5分後に、戻って、4%(w / v)のアガロースにクールローブを置き、6%(w / v)アガロースで一回以上のコーティングを繰り返します。
- シーケンシャル共同後各ローブのatingは、縁からの組織を囲むアガロース少なくとも3 mmの金属ベースモールドを使用して、6%(w / v)のアガロースで別々に各ローブを埋め込みます。オリエント実験者が直面している金型の表面に葉の最大の平らなエッジを配置することによって、鉗子を用いて、各葉。このエッジはビブラトーム切片用試料板に固定された側になります。
- ブロックは前ビブラトームで切片に少なくとも30分間冷却板にゲル化することを可能にします。 4℃で最大12時間、加湿チャンバー内のストアブロック切片ビブラトームの前に。
- セットアップ冷PBS 12で切片室を充填することによりビブラ。周囲の氷浴で切片全体に冷たい温度を維持します。組織のエッジから約3ミリメートルを維持しながら、金型からブロックを削除し、ローブを周囲の過剰なアガロースを切り詰めるためにカミソリの刃を使用します。
- 接着剤を使用して試料プレートの中央に組織を固定し、そしてトンにプレートを沈めます彼セクショニング室をPBSで満たされました。 0.2ミリメートル/秒、1.85ミリメートル、および350μmで:それぞれ以下の速度、振幅、および厚さの値を選択することにより、ビブラトーム上の境界をセクショニングセットアップ。
注:葉の向きの縦方向と横方向の両方のセクションでは、許容可能です。 - 項各葉完全に。セクションが完全に部分シーケンスの最後にブレードによって分離されていない場合は、手動カットのセクションでは、小さなはさみを使用して自由に。優しく足場セクションを収集し、次のステップまで氷上でPBSに保ちます。
注:生成されたセクションは、近位および遠位の肺区域及び再細胞化に使用することができ、両方のソースの両方を含むことになります。しかしながら、表面の大部分は、遠位肺を含むであろう。
- 足場部の除染
- マイクロ遠心チューブ(最大30セクション/チューブ)にPBSから350ミクロンの厚さの足場部分を転送し、ヌクレアーゼで処理(PBS中90 U / ml)を(材料のリストを参照してください)12 - 上でRTで24時間、回転子。
- ヌクレアーゼ処理に続いて、新しいマイクロチューブに鉗子を使用し、回転子に室温で6時間滅菌条件下(PBS中の200 U / mlのペニシリンストレプトマイシンおよび25μg/ mlのアンホテリシンB)抗菌溶液で扱う転送部。
注:足場は、使用前に4℃で最大1週間の抗菌剤溶液中に保存することができます。 - 抗菌溶液で除染工程に続いて、滅菌条件下でPBSで2回足場をすすぎ、細胞を播種する前に自由分化培地(SFDMを)血清への転送。
2.内胚葉細胞の調製
- 胚体内胚葉誘導
- 2iの条件13を使用した無フィーダー、無血清培養下でのマウスESCのラインを維持します。トリプシン処理により接着性多能性培養物から細胞を除去することによって、内胚葉誘導を開始します。
- 20,000密度でSFDMと種子中の細胞を再懸濁EB形成を可能にするメディア変更せずに3日間の低接着性プレート中の細胞/ mlです。
- 3日後、静かに10ミリリットルピペットを用いて50ミリリットルコニカルチューブをしたEBを転送し、それらを室温で3分間の底に収集することができます。
- 慎重に培地を吸引し、50 ngの/ mlのアクチビンAを補った新鮮なSFDMメディアを追加
- 胚体内胚葉分化を達成するための3つの追加日間2密度と文化:バック1での低接着性プレート上に種子細胞。
- 胚体内胚葉の濃縮
- 、6日目のEBを収集し、トリプシンで解離し、共役蛍光抗体14を使用してC-KITおよびCXCR4発現のためにラベルを付けます。
- 両方のマーカーの発現のための蛍光活性化細胞選別(FACS)を使用してソート標識された細胞は、濃縮された胚体内胚葉集団15を得ました。
3.再細胞化のセットアップ
- 気液界面文化のセットアップ
- 滅菌ピンセットを用いた疎水性浮遊膜(8μmの細孔サイズ)にSFDMから各脱細胞足場セクション(ステップ1.2.9)を転送します。足場を確認のセクションでは、膜上に均一に広がっています。
- それぞれ、SFDMの1または0.5ミリリットルでウェルを充填することにより、6-または12ウェルプレートを準備します。ゆっくり膜は、空気 - 液体培養セットアップを作成、メディアの上に浮いているようにできるように、ウェルに膜を配置します。
- 3D足場の播種
- 胚体内胚葉マーカーのための次のFACS(ステップ2.2.2)はSFDM中で5分間再懸濁し、400×gでスピンダウンし、血球計数器を使用して選別された細胞を数えます。約100,000細胞/10μlの/足場を含むボリュームを得るために細胞を再懸濁します。
- そのままステップ3.1.2から各準備セクションの上に足場、細胞のピペット10μLを再細胞化するには。
- 培養物中に48時間ごとにSFDMメディアを交換してください。わずかな傾斜でプレートを保持することによって、古いメディアを吸引文化の中断を避けるため。ゆっくりと浮遊膜の沈没を防ぐために、ウェルの側面に沿って培養液に新鮮なSFDMを追加します。
- 成熟した気道上皮にに播種された細胞の分化を達成するために、最大21日間の空気 - 液体培養を維持します。
注:再細胞化のセクションでは、細胞培養物16中の任意の時点で組織染色および免疫蛍光(IF)顕微鏡検査のために処理することができます。
結果
このプロトコルで概説したように、胚体内胚葉の堅牢な分化は上皮細胞が脱細胞化肺足場セクションに播種した細胞の拡張文化を使用して達成することができる気道を成熟します。脱細胞化スカフォールドは、(1)宿主細胞が完全に除去されているを確保するために特徴付けられ、および(2)は、細胞外マトリックスタンパク質は、分化のための足場を使用する前に保存されることをお勧めします。 図1Aに示されるように脱細胞化は、ヘマトキシリンおよびエオシン(H&E)および4 '、6-ジアミジノ-2-フェニルインドール(DAPI)を用いて組織染色を用いて評価することができます。足場の高倍率走査型電子顕微鏡(SEM)分析は、 図1Bに示されるように、宿主細胞と無傷の基質のアーキテクチャが存在しないことを確認します。マトリックスタンパク質のための引張試験および免疫染色によって残りの足場のさらなる特徴付けはpreservatを確実にするために行うことができます脱細胞化16以下ECMのイオン。
細胞凝集体(EBS)の形成における6日間の結果を得るためSFDM培地におけるESCの非接着培養、図2Aに示すように。胚体内胚葉誘導で治療結果をアクチビンの三日間。胚体内胚葉へのESCの系統限定はアップレギュレーションおよび内胚葉系統関連遺伝子やタンパク質17の発現により確認することができ、形態学的にアサートすることはできません。内胚葉誘導効率は、使用されるESCラインに応じて百分の50から70までの範囲です。この原稿に示されるすべてのデータはR1セルを使用している間、R1(Nkx2-1 mCherryを )、G4(DsRedを -MST)、および129 /オラ( ブリ-GFP / FOXA2-hCD4):実験は、マウスESC株で行われましたライン。二重陽性CXCR4 + / C-KIT +胚体内胚葉集団は、図2(b)に示すように 、ソートシードされ3D肺足場の上に、そしてSFDMで気液界面に最大21日間培養しました。 図2Cに示すように制限され、組織と分化は異種の日からソートされていないセル6 EBの文化で達成されるようにソートし、胚体内胚葉を富化することが重要です。足場にソートされた細胞によって形成された構造は、 図2C-Dに示すように、肺(胚日13.5)の開発を連想させます。我々の経験では10万選別された細胞/足場の播種密度は、最高の足場の再増殖をもたらしました。
肺系統への分化は、足場の培養後7日早けれとして観察されます。 NKX2-1およびSOX2のための陽性気道上皮前駆細胞は、 図3Aに示すように、IF共焦点分析を用いて検出されます。 SOX2正、NKX2-1陰性細胞は、肺李に分化していない可能性が高い多能性内胚葉細胞でありますneage。長い文化にこれらの細胞はNKX2-1を表現または微小環境における十分なサポートなしでアポトーシスを受けるように起動することがあります。 21日目の培養物の分析は、 図3(b)に示すように TUBB4A +繊毛細胞、SCGB1A1 +クラブ細胞、およびTRP63 + / KRT5 +基底細胞を含む成熟した気道上皮集団を明らかになった場合。 21日目の培養物の表面のSEM分析は、マウスの気道への幹細胞由来培養物の形態学的類似性を明らかにする。
16上記のように胚体内胚葉を接種し、同じ条件下で培養する際、両方の分離されたマトリックスタンパク質(コラーゲンI、コラーゲンIV、フィブロネクチン、ラミニン)および脱細胞化ラット腎足場は肺系統の分化を促進することができませんでした。これは、肺由来の足場によって作成された3D微小環境がseedeの肺系統の分化を促進するその能力において腎臓由来の足場とは区別されることを実証していますD内胚葉細胞。

図1.脱細胞化技術は、細胞成分を除去し、ECMを保持します。(A)H&E(上のパネル)およびDAPI脱細胞化以下の核が存在しないことを示す自然と脱細胞化肺組織の(下のパネル)染色。右側のパネルは、最適な脱細胞化することなく、肺からの組織切片の例を示しています。矢頭は、再細胞化の前に技術を最適化することの重要性を強調し、不完全な脱細胞化による足場の残りの核を示しています。 =25μmのスケールバー。 (B)細胞および脱細胞化スカフォールド上のマトリックス構造の保存がないことを示す天然及び脱細胞化肺のSEM像。スケールバー=10μmである。 こちらをクリックしてくださいこの図の拡大版を表示します。

図2.ソート最適な再細胞化に体内胚葉結果をESC由来。胚体内胚葉分化を促進するための治療をアクチビンの3日後(A)6日目胚様体(EB)。 (B)EBを胚体内胚葉集団を単離するために表面マーカーCXCR4およびc-KITの二重発現についてFACSでソートされます。この集団は、脱細胞化スカフォールド上に播種されます。 7日目と文化の21日目の再細胞化足場の(はC)H&E染色。左側のパネルにはソートされた細胞で播種し、右側のパネル以下の編成、気道様構造を表し前に再細胞化への細胞の選別の重要性を強調した足場上の無秩序な、増殖性の高いソートされていない細胞を表します。規模バー=30μmです。胎生13.5マウス肺の(D)H&E染色。 この図の拡大版をご覧になるにはこちらをクリックしてください。
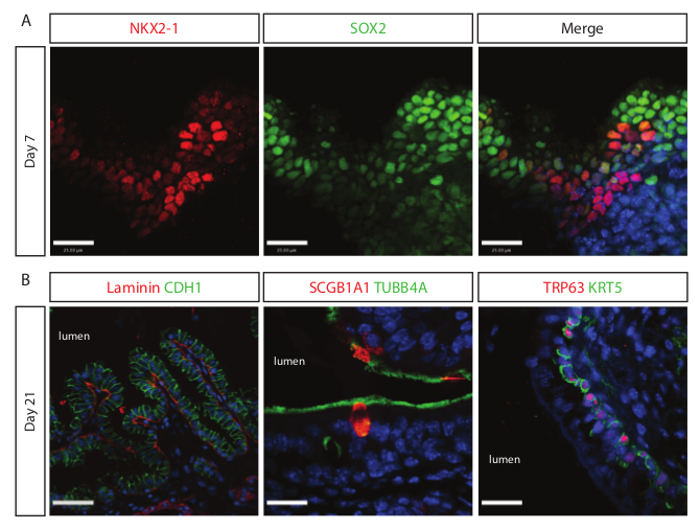
自然肺足場上の胚体内胚葉の図3.拡張文化が上皮細胞を気道への分化を指示します。(A)近位肺前駆細胞(NKX2-1 + / SOX2 +は )脱細胞化スカフォールド上での培養の7日後に検出されています。 =15μmのスケールバー。 (B)左画像のショーは、構造体の基底側の基底膜タンパク質ラミニンが並ん多列上皮細胞(CDH1 +)の構造を成熟します。センターと繊毛細胞(TUBB4A +)との完全な右画像ショー成熟した気道上皮、CLUB細胞(SCGB1A1 +)と基底細胞(KRT5 + / TRP63 +)。左画像のスケールバー=30μmの。中央と右画像のスケールバー=15μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ここで説明するプロトコルは他の補充との差別化を指示するために唯一の天然の肺足場を使用して、成熟したESC由来の気道上皮を生成します。この培養のセットアップは、無血清、安価で、かつ再現性の定義されています。ベース分化培地のない成長因子の補充が必要とされません。幹細胞由来の肺上皮細胞を生成するための、以前に公表された方法は、系統限定3,4,8,18,19を促進する成長因子の補充と2次元の戦略を使用しています。定義された培養条件、機能性気道細胞、他の内胚葉系統(甲状腺、肝臓、膵臓)から限定された汚染への高い分化効率、および3D分化微小環境:ここに記載された技術は、以下を含むいくつかの理由のためにこれらの方法よりも有利です。この技術は、マウス由来のECMと同様の結果が得られ、したがって、マウス肺を用いて脱細胞化スカフォールドを生成するように修飾することができます。ラット由来のESCは、胚体内胚葉に分化し、また、気道上皮に分化このプロトコルを使用して足場に播種しました。
脱細胞化された足場は、前再細胞化に最大7日間、4℃で汚染除去溶液中に保存することができます。足場は、しかし、我々はこれを確認するためにテストしていませんが、機能的であり得るより長い時間保持しました。 6日目のEBにおけるアクチビンA非内胚葉細胞を用いたFACS以下の誘導によって胚体内胚葉を濃縮するために必要とされる効率的な組織と差別化を達成するために、多くの場合、多能性マーカーのOct4を発現し、足場に播種した場合に、組織と指定せずに増殖していきます肺系統。播種密度はまた、骨格の完全な再細胞化を達成するために、細胞株特異性に基づいて調整することができます。
このプロトコルの制限は、肺胞上皮細胞への分化を促進することができないことです。 NKXが、2-1 + / SOX9 +遠位前駆細胞は足場上での培養の7日後に検出され、この集団は14日目に存在せず、その日の成熟型の21.マーカーは、私は、上皮細胞(AQP5)とII型肺胞上皮細胞を肺胞(SFTPB、SFTPC)は、足場の培養の間の任意の段階で検出されていません。これは、追加の成長因子の補充のために必要とここで記載されるようにしながら、歯槽系統の仕様を促進する培養条件を沈め、マトリックスタンパク質および脱細胞化スカフォールド上の残留マトリックスに結合した成長因子であってよい気道系統の分化を促進するのに十分です。
肺足場を使用して上皮細胞を気道する胚体内胚葉の分化を促進するための重要なステップは、脱細胞化プロセスの最適化です。マトリックス成分は保存されたままの細胞成分を完全に除去しなければなりません。 DAPI、超構造体を用いた核物質のための組織染色ウラル走査透過電子顕微鏡による足場の分析、およびDNAアッセイは、全細胞成分の除去を確認するために使用することができます。足場のECMタンパク質組成物は、染色及びIF用いて評価することができる基質タンパク質のイムノブロット分析:コラーゲンI、コラーゲンIV、エラスチン、フィブロネクチン、ヘパリン硫酸プロテオグリカン、およびラミニン16。
これらの幹細胞由来の肺上皮は、嚢胞性線維症などの気道に関連する病状の疾患モデル及び薬物発見プラットフォームで使用することができます。このような組織の修復および細胞療法などの再生アプリケーションでこれらの細胞-マトリックス構築物の電位は、種々のマウスモデルにおける工学構築物のin vivoでの移植によって調べることができます。また、気道への分化のためのインビトロの方法で 、この3Dは容易に成長因子の利用可能性及び細胞-マトリックスシグナル伝達を操作することによって、肺系統の仕様に影響を与える種々のパラメータを研究するために適合させることができます足場上の分化の異なる段階中の文化の。
開示事項
宣言しない競合する金融利害関係はありません。
謝辞
我々は、 図1〜図3に示した実験で使用したNkx2-1のmCherryをEscキー博士Rossant博士Bilodeauに感謝したいです。 FACSはSickKids-UHNフローサイトメトリーの施設で行いました。この作品は、ヘルスリサーチのためのカナダの研究所とイノベーションのカナダの財団からインフラ助成金(CSCCD)からの助成金を操作することによってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Perfusion solution | Sigma | H0777 | 10 U/ml heparin |
| Perfusion solution | Gibco | 14170112 | dissolved in Hank's balanced salt solution (HBSS-) |
| Decellularization solution | BioShop | CHA003 | 8 mM CHAPS |
| Decellularization solution | Sigma | E9884 | 25 mM EDTA |
| Decellularization solution | BioShop | SOD002 | 1 M NaCl |
| Decellularization solution | Gibco | 14190-144 | dissolved in PBS |
| Benzonase nuclease | Novagen | 70664-3 | 90 U/ml Benzonase nuclease |
| Benzonase nuclease | Gibco | 14190-144 | diluted in PBS |
| Antimicrobial solution | Gibco | 15140 | 200 U/ml penicillin streptomycin |
| Antimicrobial solution | Gibco | 15290 | 25 μg/ml amphotericin B |
| Antimicrobial solution | Gibco | 14190-144 | diluted in PBS |
| Trypsinization | Gibco | 12605-028 | TrypLE |
| Serum free differentiation media (SFDM) | Gibco | IMDM 2440-053, F12 11765-054 | 3:1 ratio of IMDM and Ham’s modified F12 medium |
| Serum free differentiation media (SFDM) | Gibco | 12587-010 | B27 supplement (50x dilution) |
| Serum free differentiation media (SFDM) | Gibco | 17502-048 | N2 supplement (100x dilution) |
| Serum free differentiation media (SFDM) | Gibco | 15260-037 | 0.05% (Fraction V) bovine serum albumin |
| Serum free differentiation media (SFDM) | Gibco | 35050-061 | 200 mM Glutamax |
| Serum free differentiation media (SFDM) | Sigma | M6145 | 4 μM monothioglycerol |
| Serum free differentiation media (SFDM) | Sigma | A4403 | 0.05 mg/ml ascobic acid |
| Endoderm induction | R&D | 338-AC/CF | Activin A |
| Antibodies | |||
| CDH1 | BD Biosciences | 610181 | Mouse, non-conjugated, 1:100 |
| C-KIT | BD Biosciences | 558163 | Rat, PE-Cy7, 1:100 |
| CXCR4 | BD Biosciences | 558644 | Rat, APC, 1:100 |
| KRT5 | Abcam | ab24647 | Rabbit, non-conjugated, 1:1,000 |
| NKX2-1 | Abcam | ab76013 | Rabbit, non-conjugated, 1:200 |
| Laminin | Novus Biologicals | NB300-144 | Rabbit, non-conjugated, 1:200 |
| SCGB1A1 | Santa Cruz | sc-9772 | Goat, non-conjugated, 1:1,000 |
| SOX2 | R&D Systems | AF2018 | Goat, non-conjugated, 1:400 |
| TRP63 | Santa Cruz | sc-8431 | Mouse, non-conjugated, 1:200 |
| TUBB4A | BioGenex | MU178-UC | Mouse, non-conjugated, 1:500 |
| Goat IgG | Invitrogen | A-11055 | Donkey, Alexa Fluor 488, 1:200 |
| Mouse IgG | Invitrogen | A-21202 | Donkey, Alexa Fluor 488, 1:200 |
| Mouse IgG | Invitrogen | A-31571 | Donkey, Alexa Fluor 647, 1:200 |
| Rabbit IgG | Invitrogen | A-21206 | Donkey, Alexa Fluor 488, 1:200 |
| Rabbit IgG | Invitrogen | A-31573 | Donkey, Alexa Fluor 647, 1:200 |
| Other Materials | |||
| Low adherent plates | Nunc | Z721050 | Low cell binding plates, 6 wells |
| Air-liquid interface membranes | Whatman | 110614 | Hydrophobic Nucleopore membrane, 8 μm pore size |
| Vibratome | Leica | VT1200S | Leica Vibratome |
| Tissue Adhesive | Ted Pella | 10033 | Pelco tissue adhesive |
参考文献
- Discher, D. E., Mooney, D. J., Zandstra, P. W. Growth Factors, Matrices, and Forces Combine and Control Stem Cells. Science. 324 (5935), 1673-1677 (2009).
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. J. Cell Sci. 121 (3), 255-264 (2008).
- Ghaedi, M., et al. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J. Clin. Invest. 123 (11), 4950-4962 (2013).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nat. Biotechnol. 32 (1), 84-91 (2014).
- Jensen, T., et al. A rapid lung de-cellularization protocol supports embryonic stem cell differentiation in vitro and following implantation. Tissue Eng. Part C: Methods. 18 (8), 632-646 (2012).
- Longmire, T. A., et al. Efficient derivation of purified lung and thyroid progenitors from embryonic stem cells. Cell stem cell. 10 (4), 398-411 (2012).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nat. Biotechnol. 30 (9), 876-882 (2012).
- Gilpin, S. E., et al. Enhanced Lung Epithelial Specification of Human Induced Pluripotent Stem Cells on Decellularized Lung Matrix. Annal. Thorac. Surg. 98, 1721-1729 (2014).
- Cortiella, J., et al. Influence of Acellular Natural Lung Matrix on Murine Embryonic Stem Cell Differentiation and Tissue Formation. Tissue Eng. Part A. 16 (8), 2565-2580 (2010).
- Princivalle, M., De Agostini, A. Developmental roles of heparan sulfate proteoglycans: a comparative review in Drosophila, mouse and human. Int. J. Dev. Biol. 46, 267-278 (2002).
- Thompson, S. M., Jesudason, E. C., Turnbull, J. E., Fernig, D. G. Heparan sulfate in lung morphogenesis: The elephant in the room. Birth Defects Res. Part C, Embryo Today. 90 (1), 32-44 (2010).
- Zimmermann, M., et al. Improved reproducibility in preparing precision-cut liver tissue slices. Cytotechnology. 61 (3), 145-152 (2009).
- Ying, Q. -L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Fox, E., et al. Three-Dimensional Culture and FGF Signaling Drive Differentiation of Murine Pluripotent Cells to Distal Lung Epithelial Cells. Stem Cells Dev. 24 (1), 21-35 (2014).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of Specific Cell Population by Fluorescence Activated Cell Sorting (FACS). J. Vis. Exp. (41), e1546(2010).
- Shojaie, S., et al. Acellular lung scaffolds direct differentiation of endoderm to functional airway epithelial cells: requirement of matrix-bound HS proteoglycans. Stem Cell Reports. 4, 1-12 (2015).
- Kubo, A., et al. Development of definitive endoderm from embryonic stem cells in culture. Development. 131 (7), 1651-1662 (2004).
- Longmire, T. A., et al. Efficient Derivation of Purified Lung and Thyroid Progenitors from Embryonic Stem Cells. Cell stem cell. 10 (4), 398-411 (2012).
- Wong, M. D., Dorr, A. E., Walls, J. R., Lerch, J. P., Henkelman, R. M. A novel 3D mouse embryo atlas based on micro-CT. Development. 139 (17), 3248-3256 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved