Method Article
Generación de células epiteliales de las vías respiratorias del ratón ESC-Obtenido usando Descelularizado pulmón andamios
En este artículo
Resumen
Este protocolo dirige eficientemente madre embrionarias de ratón endodermo definitivo derivado de las células de las vías respiratorias para madurar las células epiteliales. Esta técnica utiliza la diferenciación 3 dimensiones andamios pulmonares descelularizados para dirigir especificación linaje de pulmón, en un entorno de cultivo definido, libre de suero.
Resumen
Pulmón diferenciación linaje requiere la integración de las señales ambientales complejos que incluyen el factor de crecimiento de señalización, las interacciones célula-célula y las interacciones célula-matriz. Debido a esta complejidad, la recapitulación del desarrollo del pulmón in vitro para promover la diferenciación de las células madre a las células epiteliales del pulmón ha sido un reto. En este protocolo, los andamios de pulmón descelularizados se utilizan para imitar el entorno de 3 dimensiones del pulmón y generar células epiteliales de las vías respiratorias derivadas de células madre. células madre embrionarias de ratón se diferencian en primer lugar al linaje endodermo utilizando un método de cultivo cuerpo embrioides (EB) con las células del endodermo activina A. continuación, se siembran en los andamios descelularizado y se cultivaron a la interfaz aire-líquido hasta por 21 días. Esta técnica promueve la diferenciación de las células sembradas a las células epiteliales de las vías respiratorias funcional (células ciliadas, células club, y células basales) sin suplementación adicional del factor de crecimiento. Esta configuración se define la cultura, Seru-M libre, barato y reproducible. Aunque no existe una contaminación limitada de linajes endodermo no pulmonares en la cultura, este protocolo sólo genera poblaciones epiteliales de las vías respiratorias y no da lugar a las células del epitelio alveolar. epitelios de las vías respiratorias generados con este protocolo se pueden utilizar para estudiar las interacciones célula-matriz durante la organogénesis de pulmón y para el modelado de la enfermedad o plataformas de descubrimiento de medicamentos de patologías relacionadas con las vías respiratorias, tales como fibrosis quística.
Introducción
Diferenciación dirigida de células pluripotentes a la estirpe de pulmón depende de eventos de señalización precisos en el microambiente 1,2. Debido a la naturaleza dinámica de este proceso que ha sido un reto para imitar los acontecimientos precisos de la organogénesis de pulmón in vitro. Los informes recientes han utilizado estrategias de restricción de linaje por etapas con el factor de crecimiento soluble suplementación de los cultivos de dos dimensiones para lograr la diferenciación de pulmón 3-8. En protocolos de diferenciación por etapas, las células pluripotentes, si las células madre embrionarias (ESC) o células madre pluripotentes inducidas, se diferenciaron primero en la capa de germen de endodermo definitivo. células endodérmicas fueron empujados posteriormente a un destino endodermo anterior y, posteriormente, a las células progenitoras de pulmón, como se identifica por la expresión del factor de transcripción que contiene homeodominio-NKX2-1. Estos progenitores de pulmón se diferenciaron adicionalmente a proximal (vía aérea) o células epiteliales de pulmón distales (alveolares) wiTH continuó suplementos de factores de crecimiento. Tales estrategias de 2 dimensiones han tenido cierto éxito en la generación de las células epiteliales del pulmón, sin embargo, hay varias limitaciones, incluyendo las eficiencias poco claros, la posible contaminación de otros de origen endodérmico, la falta de una estructura de 3 dimensiones (3D), y en algunos casos uso de cultivos indefinidos con suplementos de suero. Cultura de pluripotentes células diferenciadas o en andamios pulmonares descelularizados se utiliza cada vez más como un ensayo para evaluar el potencial regenerativo de las células sembradas en la formación de estructuras epiteliales del pulmón 3,5,6,8,9. Tales informes cultura células sembradas en andamios con factor de crecimiento continuo o de suplementos de suero.
desarrollo de pulmón implica la división, migración, la expresión génica y la diferenciación de las células individuales en respuesta a señales ambientales. La matriz extracelular (ECM) es un entramado de glicoproteínas que además de proporcionar soporte estructural, dirige tissue morfogénesis mediante la integración y la regulación de estos procesos 10,11. Al utilizar el andamio ECM de pulmón como una plataforma natural para la cultura endodermo para imitar mejor el entorno de desarrollo de pulmón in vivo, hemos generado células madre epiteliales de las vías respiratorias derivadas de células en un cultivo definido 3D-ajuste con alta eficiencia y reproducibilidad.
Rata andamios ECM pulmonares fueron generados por descelularización, así como células endodérmicas derivados de ESC de ratón fueron generados y posteriormente sembradas en estos andamios. expresión dual de CXCR4 y proteínas c-KIT indica una identidad celular endodermo definitivo y células positivas tanto para Sox2 y expresión NKX2-1 son identificadas como células de las vías respiratorias (pulmonares proximales) progenitoras. Las células del endodermo definitivo se cultivaron en la interfase aire-líquido (ALI) para un máximo de tres semanas para generar células epiteliales de las vías respiratorias funcional in vitro.
Este protocolo promueve la diferenciación de pulmón linaje de definitiva endodermo a los 7 días, observados con la aparición de NKX2-1 + / + Sox2 progenitores tempranos pulmonares proximales. Para el día 14 y 21 de las poblaciones de células epiteliales de las vías respiratorias maduros cultivo emergen incluyendo ciliadas (TUBB4A +), club (SCGB1A1 +) y células basales con semejanza morfológica y funcional de las vías respiratorias de ratones nativos (+ TRP63, KRT5 +). Este protocolo demuestra la importancia del microambiente 3D de matriz para lograr la diferenciación robusto a las vías respiratorias células epiteliales.
Protocolo
Los experimentos con animales se llevaron a cabo de acuerdo con las directrices del Comité de Cuidado de Animales del Hospital for Sick Children Research Institute.
1. Preparación Andamios
- Descelularización de pulmones
- La eutanasia a las ratas Wistar adultas utilizando cámara de CO 2. Lugar de los animales en la cámara y empezar a 100% la exposición al CO 2 a una velocidad de llenado del 10-30% del volumen de la cámara por minuto.
- Observar animales de la inconsciencia; esto ocurrirá después de aproximadamente 2-3 minutos. Si la inconsciencia no se produce en este período de tiempo, comprobar la tasa y el sello de la cámara de llenado. Después de la inconsciencia, observar animales de color de los ojos se desvaneció y la falta de respiración. Si se observan tanto, mantener el CO 2 de llenado durante 1-2 minutos y luego retirar los animales de la cámara para el procedimiento.
- Asegure animal para la disección de la superficie mediante la fijación de las patas delanteras y patas traseras, y rocíe el pecho y la zona del abdomen con 70% de etanol. Acceder al corazón y luNGS mediante la apertura de la cavidad torácica mediante una incisión vertical a lo largo del esternón.
- Hacer pequeñas incisiones a través de diafragma primero para hacer que los pulmones se retraigan, reduciendo la posibilidad de perforar los pulmones. Ligar la vena cava inferior con una sutura y colocar una pequeña incisión en la aurícula izquierda con pequeñas tijeras de disección.
- Usando una jeringa de 10 ml preparada con una aguja 25 G lleno de solución salina equilibrada heparinizada de Hank (HBSS) (10 U / ml de heparina en HBSS), iniciar la perfusión pulmonar mediante la inserción de la aguja en el ventrículo derecho para empujar el tampón a través de la circulación pulmonar (velocidad de 2 ml / min). Continuar este procedimiento hasta que los pulmones se vuelven blancos y el fluido que fluye desde la aurícula izquierda salga clara.
- Tras la perfusión, exponer la tráquea y canular con un catéter de plástico cerca del cartílago tiroides y seguro en su lugar con una sutura.
- Configuración de un sistema de perfusión por gravedad mediante la fijación de una jeringa de 10 ml a un soporte vertical y la abrazadera. Retire y démbolo de la jeringa iscard. Protección del punto máximo de llenado de cilindro de la jeringa a 20 cm por encima de los pulmones. Coloque una llave de paso de dos vías para el extremo de la jeringa, y un largo tubo de plástico para el otro extremo de la llave de paso para la entrega de solución de descelularización a la tráquea canulado. Verter la solución en la jeringa y permita que la solución para llenar tubo de plástico unido y el catéter.
- Lavado de los pulmones llenando a capacidad pulmonar total (aproximadamente 12 ml) durante 1 min y retirar el catéter de plástico de la tráquea para permitir que el fluido fluya fuera de los pulmones. No llenar jeringas más de 10 ml cuando lavaging pulmones para mantener la presión por debajo de 20 cm de H2O
- Repetir el lavado de pulmones ocho veces con solución de descelularización, seguido de 10 lavados con solución salina tamponada con fosfato (PBS).
- Diseccionar la tráquea y los pulmones libre de la cavidad del cuello y el pecho y retirar del animal. Mantener el tejido en PBS frío a 4 ° C hasta su preparación para sí vibratomectioning.
- La eutanasia a las ratas Wistar adultas utilizando cámara de CO 2. Lugar de los animales en la cámara y empezar a 100% la exposición al CO 2 a una velocidad de llenado del 10-30% del volumen de la cámara por minuto.
- generación de sección gruesa
- Preparar aproximadamente 15 ml de 2% y 4% (w / v) de agarosa, y lo suficientemente 6% (w / v) de agarosa para incrustar todos los lóbulos en pequeños bloques rectangulares. Disuelva el polvo de agarosa de bajo punto de fusión en PBS en el microondas. La transferencia de la agarosa para tubos de 50 ml en un bloque de calor y mantener la temperatura por encima de 40 ° C para evitar la gelificación.
- Diseccionar pulmonar descelularizado al final de cada bronquio lobar para separar cada lóbulo (craneal, medio, accesorio, y los lóbulos caudal derecho y el lóbulo izquierdo) usando unas tijeras pequeñas. Pat secar cada lóbulo usando hojas absorbentes para eliminar el exceso de PBS y colocar dentro de 2% (w / v) de agarosa, mientras que en el bloque de calentamiento.
- Retire cada lóbulo después de 5 minutos de recubrimiento de agarosa, colocar en una placa de Petri y dejar que la superficie del gel por 1 min en un plato frío.
- colocar suavemente lóbulos de nuevo en 4% (w / v) de agarosa, fresco después de 5 min, y repetir recubrimiento una vez más con el 6% (w / v) de agarosa.
- Después de co secuencialIONES de cada lóbulo, incrustar cada lóbulo separado en 6% (w / v) de agarosa usando moldes de base de metal con al menos 3 mm de agarosa que rodea el tejido de los bordes. Orient cada lóbulo usando fórceps mediante el posicionamiento más grande borde plano del lóbulo en la superficie del molde de metal hacia el experimentador. Este borde será el lado fijo a la placa de muestra para vibratome seccionamiento.
- Permitir a los bloques de gel en placa fría durante al menos 30 minutos antes de seccionar con vibratome. Guarde los bloques en una cámara húmeda durante un máximo de 12 horas a 4 ° C antes de seccionar vibratome.
- Configuración del vibrátomo llenando la cámara de seccionamiento con PBS frío 12. Mantener la temperatura fría a lo largo de seccionamiento con el baño de hielo circundante. Retire los bloques de moldes de metal y el uso de una hoja de afeitar para cortar el exceso de agarosa que rodea lóbulos, mientras se mantiene aproximadamente 3 mm desde el borde del tejido.
- Fijar tejido al centro de la placa de muestra usando un adhesivo, y sumergir la placa en tél PBS-llenado cámara de seccionamiento. Configuración de seccionamiento límites en vibratome mediante la selección de los siguientes valores de la velocidad, amplitud, y espesor respectivamente: 0,2 mm / seg, 1,85 mm, y 350 micras.
Nota: Tanto la sección longitudinal y transversal de la orientación del lóbulo son aceptables. - Sección cada lóbulo completamente. Manualmente secciones cortadas gratis con pequeñas tijeras si un tramo no está separado por hoja al final de la secuencia de la sección. Recoger las secciones de andamios con cuidado y mantenerse en PBS en hielo hasta el siguiente paso.
Nota: Secciones generados incluirán tanto en las zonas proximal y distal del pulmón y ambas fuentes se pueden utilizar para recelularización; sin embargo, la mayor parte de la superficie abarcará pulmón distal.
- Descontaminación de las secciones de andamios
- Transferir las secciones de andamios de espesor 350 micrones de PBS para tubos de microcentrífuga (hasta 30 secciones / tubo) y se trata con nucleasa (90 U / ml en PBS) (ver Lista de Materiales) por 12 - 24 horas a temperatura ambiente, enun rotador.
- Después del tratamiento con nucleasa, las secciones de transferencia utilizando fórceps para nuevos tubos de microcentrífuga y se trata con solución antimicrobiana (200 U / ml de penicilina estreptomicina y 25 mg / ml de anfotericina B en PBS) en condiciones estériles durante 6 horas a temperatura ambiente, en un rotador.
Nota: Los andamios se pueden almacenar en solución antimicrobiana durante un máximo de una semana a 4 ° C antes de su uso. - Después de la etapa de descontaminación con solución antimicrobiana, enjuague andamios dos veces con PBS en condiciones estériles y transferir a suero libre de medio de diferenciación (SFDM) antes de la siembra con células.
2. Preparación de células Endodérmico
- El endodermo definitivo de inducción
- Mantener las líneas de ratón ESC menores, cultivo libre de suero sin alimentador usando condiciones 2i 13. Iniciar la inducción endodermo mediante la eliminación de las células pluripotentes a partir de la cultura adherentes mediante tripsinización.
- Resuspender las células en SFDM y las semillas a una densidad de 20.000células / ml en placas adherentes bajas durante tres días sin cambio de medio para permitir la formación de EB.
- Después de tres días transfieren suavemente las EB en 50 ml tubos cónicos con una pipeta de 10 ml y dejar que se recogen en la parte inferior durante 3 minutos a temperatura ambiente.
- Adecuadamente el material aspirado y añadir medios SFDM fresco suplementado con 50 ng / ml de activina A.
- Se siembran las células posterior en las placas adherentes bajas en una proporción 1: 2 densidad y la cultura durante tres días adicionales para alcanzar una diferenciación endodermo definitivo.
- enriquecimiento de endodermo definitivo
- Recoger el día 6 EBS, disociar con tripsina y la etiqueta de c-KIT y la expresión de CXCR4 utilizando anticuerpos conjugados fluorescentes 14.
- Ordenar las células marcadas utilizando la clasificación de células activadas por fluorescencia (FACS) para la expresión de ambos marcadores para obtener una población enriquecida endodermo definitivo 15.
3. Configuración recelularización
- interfase aire-líquidoconfiguración de la cultura
- Transferir cada sección de esqueleto descelularizado (paso 1.2.9) de SFDM a una membrana flotante hidrófobo (8 micras de tamaño de poro) usando pinzas estériles. Asegurar andamio secciones se distribuyen de manera uniforme en la membrana.
- Preparar 6- o placas de 12 pocillos, llenando los pocillos con 1 o 0,5 ml de SFDM, respectivamente. Con cuidado, coloque las membranas en los pozos, lo que permite la membrana flote en la parte superior de los medios de comunicación, la creación de una configuración de la cultura aire-líquido.
- La siembra de los andamios 3D
- FACS siguientes marcadores de endodermo definitivo (paso 2.2.2) cuentan células clasificadas utilizando un hemocitómetro, dejen de girar a 400 xg durante 5 minutos y se vuelve a suspender en SFDM. Resuspender las células para obtener un volumen que contiene aproximadamente 100.000 células / 10 l / andamios.
- Para recellularize andamios, pipeta de 10 l de células directamente en cada sección preparada desde el paso 3.1.2.
- Sustitución de los medios SFDM en cultivos cada 48 horas. Aspirar los viejos medios de comunicación mediante la celebración de la placa con una ligera inclinacióna fin de no perturbar la cultura. Añadir lentamente SFDM fresco a la cultura a lo largo del lado del pozo para evitar el hundimiento de la membrana flotante.
- Mantener los cultivos al aire líquido hasta por 21 días para lograr la diferenciación de las células sembradas en los epitelios de las vías respiratorias madura.
Nota: recelularizado secciones pueden ser procesadas para la tinción de tejidos y de inmunofluorescencia microscopía (IF) en cualquier punto de tiempo durante el cultivo celular 16.
Resultados
Como se describe en este protocolo, la diferenciación robusta del endodermo definitivo para madurar las vías respiratorias células epiteliales, se pueden obtener mediante el cultivo prolongado de células sembradas en las secciones de andamios de pulmón descelularizados. Se recomienda que los andamios descelularizados caracterizarse para asegurar (1) células huésped se eliminan por completo, y (2) proteínas de la matriz extracelular se conservan antes de utilizar andamios para la diferenciación. Descelularización puede evaluarse usando tinción de tejidos con hematoxilina y eosina (H & E) y 4 ', 6-diamidino-2-fenilindol (DAPI), como se ilustra en la Figura 1A. De alta magnificación microscopio electrónico de barrido (SEM) el análisis de los andamios confirma la ausencia de células huésped y la arquitectura de la matriz intacta, como se ilustra en la Figura 1B. caracterización adicional del andamio restante por ensayos de tracción y la inmunotinción para proteínas de la matriz puede llevarse a cabo para asegurar preservation de la ECM siguiente descelularización 16.
Cultura no adherentes de los CES en medios SFDM durante seis días como resultado la formación de agregados de células (EBS), como se ilustra en la Figura 2A. Tres días de activina A tratamiento da como resultado la inducción de endodermo definitivo. Lineage restricción de ESC para endodermo definitivo se puede confirmar mediante la regulación positiva y la expresión de genes y proteínas endodermo 17 linaje asociado, y no se puede afirmar morfológicamente. eficiencia endodermo de inducción 50 a 70% dependiendo de la línea ESC utilizado. Los experimentos se llevaron a cabo en las líneas de ESC de ratón: R1 (NKX2-1 mCherry), G4 (dsRed -MST), y 129 / Ola (Bry-GFP / Foxa2-hCD4), mientras que todos los datos ilustrados en este manuscrito está utilizando la célula R1 línea. La doble CXCR4 + / población endodermo definitivo c-KIT positivo + se ordenan como se ilustra en la Figura 2B, sembraronen andamios 3D de pulmón, y se cultivaron durante hasta 21 días en la interfaz aire-líquido en SFDM. Es importante para ordenar y enriquecer de endodermo definitivo como organización limitado y la diferenciación se logra con la cultura de células no clasificadas de días heterogénea 6 EBs como se ilustra en la Figura 2C. Las estructuras formadas por células clasificadas en los andamios son reminiscencias de desarrollo pulmonar (día embrionario 13,5) como se ilustra en la Figura 2C-D. En nuestra experiencia, una densidad de siembra de 100.000 células clasificadas / andamio ha dado la mejor repoblación andamio.
La diferenciación al linaje de pulmón se observó tan pronto como 7 días después del cultivo andamio. Células progenitoras epiteliales respiratorias positivas para NKX2-1 y SOX2 se detectan usando IF análisis confocal como se ilustra en la Figura 3A. Sox2 positivos, negativos células NKX2-1 son probables las células del endodermo pluripotentes que no se han diferenciado a la li pulmonarneage. Con la cultura ya que estas células pueden comenzar a expresar NKX2-1 o someterse a la apoptosis sin el apoyo adecuado en el microambiente. Si el análisis de día 21 culturas revela una población epitelial de las vías respiratorias madura que contiene las células ciliadas TUBB4A +, las células SCGB1A1 + club, y las células TRP63 + / + KRT5 basales como se ilustra en la Figura 3B. El análisis SEM de la superficie del día 21 culturas revela similitud morfológica de las culturas derivadas de células madre de ratón a las vías respiratorias.
Ambas proteínas de la matriz aislados (colágeno I, colágeno IV, fibronectina, laminina) y andamios de riñón de rata descelularizados fueron incapaces de promover la diferenciación de pulmón de linaje cuando se siembra con endodermo definitivo y se cultivaron en las mismas condiciones como se describe anteriormente 16. Esto demuestra que el microambiente 3D creado por los andamios de pulmón derivado es distinta de andamios derivadas de riñón en su capacidad para promover la diferenciación de pulmón de linaje de simiented células del endodermo.

Figura 1. Técnica descelularización elimina componentes celulares y preserva ECM. (A) H & E (panel superior) y DAPI (panel inferior) tinción del tejido pulmonar descelularizado natural y que muestra la ausencia de núcleos siguiente descelularización. El panel derecho muestra ejemplos de secciones de tejido de los pulmones sin descelularización óptima. Las puntas de flecha indican los núcleos restantes en los andamios debido a descelularización incompleta, poniendo de relieve la importancia de optimizar la técnica antes de recelularización. Barra de escala = 25 micras. Imágenes (B) de SEM de pulmón natural y descelularizado, mostrando ausencia de células y preservación de la arquitectura de matriz en andamios descelularizados. Barra de escala = 10 micras. Por favor, haga clic aquípara ver una versión más grande de esta figura.

Figura 2. Ordenada CES derivados de los resultados de endodermo definitivo en recelularización óptima. Cuerpos (A) Día 6 embrioides (EBS) después de tres días de activina Un tratamiento para la promoción de la diferenciación del endodermo definitivo. (B) Los EBs están ordenados por FACS para la expresión dual de marcadores de superficie CXCR4 y c-KIT para aislar la población endodermo definitivo. Esta población será cabeza de serie en los andamios descelularizados. (C) H & E tinción de andamios recelularizado en el día 7 y el día 21 de la cultura. El panel izquierdo representa organizado, las estructuras de las vías respiratorias-como después de la siembra con células clasificadas, y el panel de la derecha representa células no clasificadas desorganizados, altamente proliferativas en los andamios que destacan la importancia de la clasificación de las células antes de la recelularización. Escalabar = 30 micras. (D) H & E tinción de embriones día 13.5 pulmones del ratón. Haga clic aquí para ver una versión más grande de esta figura.
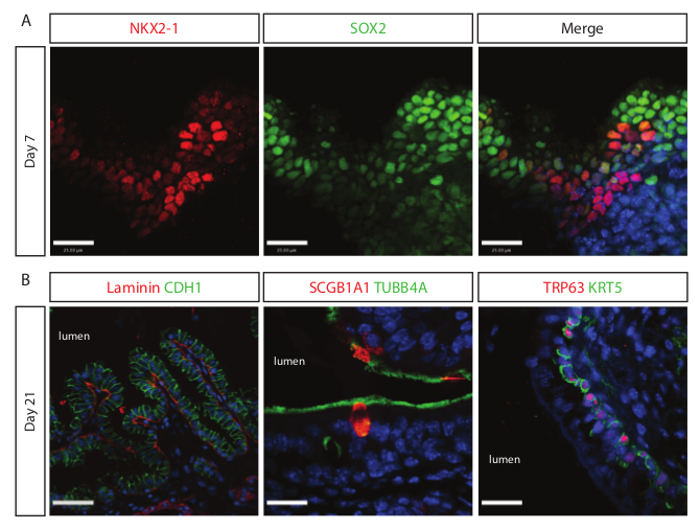
Figura 3. La cultura extendida de endodermo definitivo en andamios pulmonares naturales dirige la diferenciación de las células epiteliales de las vías respiratorias. (A) células progenitoras pulmonares proximales (NKX2-1 + / +) Sox2 se detectan después de siete días de cultivo en los andamios descelularizados. Barra de escala = 15 micras. (B) muestra imagen de la izquierda maduran pseudostratified estructuras de células epiteliales (+) CDH1 revestidos por membrana basal laminina proteína en la parte basal de las estructuras. Centro y mostrar imagen de la derecha epitelios de las vías respiratorias maduras completas con las células ciliadas (TUBB4A +), club células (SCGB1A1 +) y células basales (KRT5 + / + TRP63). barra de escala de la imagen izquierda = 30 m; centro y barra de escala de la imagen derecha = 15 micras. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo descrito aquí genera epitelios de las vías respiratorias derivadas de CES maduros utilizando sólo los andamios pulmón natural para dirigir la diferenciación con ningún otro suplementación. Esta configuración se define la cultura, y barato, y reproducible libre de suero. No se requiere un factor de crecimiento de la suplementación del medio de diferenciación base. Métodos publicados anteriormente para la generación de células epiteliales de pulmón de células madre derivadas han utilizado estrategias de 2 dimensiones con suplementos de factores de crecimiento para promover la restricción de linaje 3,4,8,18,19. La técnica descrita aquí es ventajoso con respecto a estos métodos por varias razones, entre ellas: condiciones de cultivo definido, de alta eficiencia para la diferenciación de las células de las vías respiratorias funcionales, contaminación limitada de otros de origen endodérmico (tiroides, hígado, páncreas), y un microambiente 3D diferenciación. Esta técnica da resultados similares con ECM derivado de ratón y por lo tanto puede ser modificado para generar andamios descelularizados utilizando los pulmones del ratón. CES derivada de rata diferenciados de endodermo definitivo y se sembraron sobre andamios utilizando este protocolo también se diferencian en los epitelios de las vías respiratorias.
andamios descelularizados se pueden almacenar en una solución descontaminante a 4 ° C por hasta 7 días antes de la recelularización. Los andamios mantienen durante más tiempo pueden ser funcionales, sin embargo no hemos probado para confirmar esto. Para lograr una organización eficiente y diferenciación se requiere para enriquecer en endodermo definitivo por FACS después de la inducción con activina A. Las células no endodermo en día 6 EBs a menudo expresan marcador de pluripotencia Oct4 y si sembrada en los andamios continuará a proliferar sin organización y la especificación a la linaje de pulmón. La densidad de siembra también puede ser ajustado basado en célula de la línea-especificidad para lograr recelularización completa de andamios.
Una limitación de este protocolo es en su incapacidad para promover la diferenciación de las células epiteliales alveolares. Aunque NKXSe detectan células progenitoras distales 2-1 + / + SOX9 después de siete días de cultivo en los andamios, esta población no está presente en el día 14 y el día 21. Los marcadores de tipo I madura células epiteliales alveolares (AQP5) y II de las células epiteliales alveolares de tipo (SFTPB, SFTPC) no se detectó en ningún momento durante el cultivo andamio. Esto puede ser debido a un requisito de suplementos de factores de crecimiento adicional y las condiciones de cultivo sumergido para promover la especificación de linaje alveolar, mientras que como se describe aquí, proteínas de la matriz y la matriz unida remanente factores de crecimiento en los andamios descelularizados es suficiente para promover la vía aérea diferenciación de linaje.
El paso crítico para la promoción de la diferenciación de endodermo definitivo para las vías respiratorias células epiteliales usando andamios de pulmón es la optimización del proceso de descelularización. componentes celulares deben ser eliminados por completo, mientras componentes de la matriz se conservan. tinción de tejidos para el material nuclear utilizando DAPI, ultra-structanálisis ural de andamios con escaneado y microscopía electrónica de transmisión, y los ensayos de ADN se puede utilizar para confirmar la eliminación de todos los componentes celulares. ECM composición de proteínas de andamios puede evaluarse usando si la tinción y análisis de inmunoblot para proteínas de la matriz: colágeno I, colágeno IV, elastina, fibronectina, proteoglicanos de sulfato de heparina, y laminina 16.
Estos epitelios de pulmón derivada de células madre puede ser utilizado en las plataformas de modelado de la enfermedad y de descubrimiento de fármacos de las patologías relacionadas con las vías respiratorias, tales como la fibrosis quística. El potencial de estos constructos célula-matriz en aplicaciones regenerativas, tales como la reparación de tejidos y la terapia celular puede ser examinado por el trasplante in vivo de construcciones de ingeniería en diversos modelos de ratón. Además, este 3D método in vitro para la diferenciación de las vías respiratorias se puede adaptar fácilmente para estudiar diversos parámetros que afectan especificación linaje pulmonar mediante la manipulación de la disponibilidad del factor de crecimiento y célula-matriz de señalizaciónde los cultivos durante las diferentes etapas de la diferenciación en los andamios.
Divulgaciones
No hay intereses financieros en competencia para declarar.
Agradecimientos
Deseamos agradecer al Dr. Rossant y el Dr. Bilodeau para el CES mCherry NKX2-1 utilizado en los experimentos representados en las figuras 1-3. FACS se realizó en las instalaciones de SickKids-UHN Citometría de Flujo. Este trabajo fue apoyado por las subvenciones de funcionamiento de los Institutos Canadienses de Investigación en Salud y una subvención de la infraestructura (CSCCD) de la Fundación Canadiense de la Innovación.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Perfusion solution | Sigma | H0777 | 10 U/ml heparin |
| Perfusion solution | Gibco | 14170112 | dissolved in Hank's balanced salt solution (HBSS-) |
| Decellularization solution | BioShop | CHA003 | 8 mM CHAPS |
| Decellularization solution | Sigma | E9884 | 25 mM EDTA |
| Decellularization solution | BioShop | SOD002 | 1 M NaCl |
| Decellularization solution | Gibco | 14190-144 | dissolved in PBS |
| Benzonase nuclease | Novagen | 70664-3 | 90 U/ml Benzonase nuclease |
| Benzonase nuclease | Gibco | 14190-144 | diluted in PBS |
| Antimicrobial solution | Gibco | 15140 | 200 U/ml penicillin streptomycin |
| Antimicrobial solution | Gibco | 15290 | 25 μg/ml amphotericin B |
| Antimicrobial solution | Gibco | 14190-144 | diluted in PBS |
| Trypsinization | Gibco | 12605-028 | TrypLE |
| Serum free differentiation media (SFDM) | Gibco | IMDM 2440-053, F12 11765-054 | 3:1 ratio of IMDM and Ham’s modified F12 medium |
| Serum free differentiation media (SFDM) | Gibco | 12587-010 | B27 supplement (50x dilution) |
| Serum free differentiation media (SFDM) | Gibco | 17502-048 | N2 supplement (100x dilution) |
| Serum free differentiation media (SFDM) | Gibco | 15260-037 | 0.05% (Fraction V) bovine serum albumin |
| Serum free differentiation media (SFDM) | Gibco | 35050-061 | 200 mM Glutamax |
| Serum free differentiation media (SFDM) | Sigma | M6145 | 4 μM monothioglycerol |
| Serum free differentiation media (SFDM) | Sigma | A4403 | 0.05 mg/ml ascobic acid |
| Endoderm induction | R&D | 338-AC/CF | Activin A |
| Antibodies | |||
| CDH1 | BD Biosciences | 610181 | Mouse, non-conjugated, 1:100 |
| C-KIT | BD Biosciences | 558163 | Rat, PE-Cy7, 1:100 |
| CXCR4 | BD Biosciences | 558644 | Rat, APC, 1:100 |
| KRT5 | Abcam | ab24647 | Rabbit, non-conjugated, 1:1,000 |
| NKX2-1 | Abcam | ab76013 | Rabbit, non-conjugated, 1:200 |
| Laminin | Novus Biologicals | NB300-144 | Rabbit, non-conjugated, 1:200 |
| SCGB1A1 | Santa Cruz | sc-9772 | Goat, non-conjugated, 1:1,000 |
| SOX2 | R&D Systems | AF2018 | Goat, non-conjugated, 1:400 |
| TRP63 | Santa Cruz | sc-8431 | Mouse, non-conjugated, 1:200 |
| TUBB4A | BioGenex | MU178-UC | Mouse, non-conjugated, 1:500 |
| Goat IgG | Invitrogen | A-11055 | Donkey, Alexa Fluor 488, 1:200 |
| Mouse IgG | Invitrogen | A-21202 | Donkey, Alexa Fluor 488, 1:200 |
| Mouse IgG | Invitrogen | A-31571 | Donkey, Alexa Fluor 647, 1:200 |
| Rabbit IgG | Invitrogen | A-21206 | Donkey, Alexa Fluor 488, 1:200 |
| Rabbit IgG | Invitrogen | A-31573 | Donkey, Alexa Fluor 647, 1:200 |
| Other Materials | |||
| Low adherent plates | Nunc | Z721050 | Low cell binding plates, 6 wells |
| Air-liquid interface membranes | Whatman | 110614 | Hydrophobic Nucleopore membrane, 8 μm pore size |
| Vibratome | Leica | VT1200S | Leica Vibratome |
| Tissue Adhesive | Ted Pella | 10033 | Pelco tissue adhesive |
Referencias
- Discher, D. E., Mooney, D. J., Zandstra, P. W. Growth Factors, Matrices, and Forces Combine and Control Stem Cells. Science. 324 (5935), 1673-1677 (2009).
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. J. Cell Sci. 121 (3), 255-264 (2008).
- Ghaedi, M., et al. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J. Clin. Invest. 123 (11), 4950-4962 (2013).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nat. Biotechnol. 32 (1), 84-91 (2014).
- Jensen, T., et al. A rapid lung de-cellularization protocol supports embryonic stem cell differentiation in vitro and following implantation. Tissue Eng. Part C: Methods. 18 (8), 632-646 (2012).
- Longmire, T. A., et al. Efficient derivation of purified lung and thyroid progenitors from embryonic stem cells. Cell stem cell. 10 (4), 398-411 (2012).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nat. Biotechnol. 30 (9), 876-882 (2012).
- Gilpin, S. E., et al. Enhanced Lung Epithelial Specification of Human Induced Pluripotent Stem Cells on Decellularized Lung Matrix. Annal. Thorac. Surg. 98, 1721-1729 (2014).
- Cortiella, J., et al. Influence of Acellular Natural Lung Matrix on Murine Embryonic Stem Cell Differentiation and Tissue Formation. Tissue Eng. Part A. 16 (8), 2565-2580 (2010).
- Princivalle, M., De Agostini, A. Developmental roles of heparan sulfate proteoglycans: a comparative review in Drosophila, mouse and human. Int. J. Dev. Biol. 46, 267-278 (2002).
- Thompson, S. M., Jesudason, E. C., Turnbull, J. E., Fernig, D. G. Heparan sulfate in lung morphogenesis: The elephant in the room. Birth Defects Res. Part C, Embryo Today. 90 (1), 32-44 (2010).
- Zimmermann, M., et al. Improved reproducibility in preparing precision-cut liver tissue slices. Cytotechnology. 61 (3), 145-152 (2009).
- Ying, Q. -L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Fox, E., et al. Three-Dimensional Culture and FGF Signaling Drive Differentiation of Murine Pluripotent Cells to Distal Lung Epithelial Cells. Stem Cells Dev. 24 (1), 21-35 (2014).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of Specific Cell Population by Fluorescence Activated Cell Sorting (FACS). J. Vis. Exp. (41), e1546(2010).
- Shojaie, S., et al. Acellular lung scaffolds direct differentiation of endoderm to functional airway epithelial cells: requirement of matrix-bound HS proteoglycans. Stem Cell Reports. 4, 1-12 (2015).
- Kubo, A., et al. Development of definitive endoderm from embryonic stem cells in culture. Development. 131 (7), 1651-1662 (2004).
- Longmire, T. A., et al. Efficient Derivation of Purified Lung and Thyroid Progenitors from Embryonic Stem Cells. Cell stem cell. 10 (4), 398-411 (2012).
- Wong, M. D., Dorr, A. E., Walls, J. R., Lerch, J. P., Henkelman, R. M. A novel 3D mouse embryo atlas based on micro-CT. Development. 139 (17), 3248-3256 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados