Method Article
Generazione di cellule di topo Airway epiteliali ESC-derivati dall'uso di decellularized Lung Ponteggi
In questo articolo
Riepilogo
Questo protocollo dirige in modo efficiente topo staminali embrionali derivato dalle cellule endoderma definitivo per maturare delle vie aeree cellule epiteliali. Questa tecnica utilizza differenziazione 3-dimensionale impalcature polmone decellularized di indirizzare specifiche lignaggio del polmone, in un ambiente culturale privo di siero definito.
Abstract
Lung differenziazione stirpe richiede l'integrazione di stimoli ambientali complesse che includono la crescita di segnalazione fattore, interazioni cellula-cellula e le interazioni cellula-matrice. A causa di questa complessità, la ricapitolazione di sviluppo del polmone in vitro per promuovere la differenziazione delle cellule staminali alle cellule epiteliali del polmone è stato impegnativo. In questo protocollo, ponteggi polmonari decellularized sono usati per simulare l'ambiente 3-dimensionale del polmone e generare cellule delle vie respiratorie epiteliali derivati da cellule staminali. Mouse sulle cellule staminali embrionali vengono prima differenziato al lignaggio endoderma utilizzando un metodo di cultura del corpo embrioide (EB) con le cellule endoderma activin A. sono poi seminate su impalcature decellularized e colta all'interfaccia aria-liquido per un massimo di 21 giorni. Questa tecnica favorisce la differenziazione delle cellule seminate alle cellule epiteliali delle vie aeree funzionale (cellule ciliate, cellule club, e le cellule basali) senza ulteriore integrazione del fattore di crescita. Questa configurazione viene definita la cultura, Seru-M libera, poco costoso, e riproducibile. Sebbene non vi sia contaminazione limitata dalla non-polmone linee endoderma nella cultura, questo protocollo genera solo delle vie aeree popolazioni epiteliali e non dà origine a cellule epiteliali alveolari. epiteli delle vie aeree generate con questo protocollo può essere utilizzato per studiare le interazioni cellula-matrice durante l'organogenesi polmonare e per la modellazione malattie o piattaforme di droga-scoperta di patologie delle vie respiratorie legate come la fibrosi cistica.
Introduzione
Differenziazione diretta delle cellule pluripotenti al lignaggio polmone dipende da eventi di segnalazione precisi nel microambiente 1,2. A causa della natura dinamica di questo processo è stato impegnativo per simulare gli eventi precise di organogenesi polmone in vitro. Recenti studi hanno utilizzato strategie di restrizione lignaggio graduale con fattore di crescita solubili integrazione di culture bidimensionali per raggiungere la differenziazione del polmone 3-8. Nei protocolli di differenziazione graduale, cellule pluripotenti, se le cellule staminali embrionali (ESC) o di cellule staminali pluripotenti indotte, sono stati differenziati per lo strato di endoderma germe definitiva. cellule endodermico sono stati successivamente spinti a un destino endoderma anteriori e, successivamente, di cellule progenitrici del polmone, come identificato con l'espressione del fattore di trascrizione homeodomain contenenti NKX2-1. Questi progenitori polmonari sono stati ulteriormente differenziati a prossimale (via aerea) o distali (alveolari), le cellule epiteliali del polmone wiesimo continuato l'integrazione del fattore di crescita. Tali strategie 2-dimensionali hanno avuto un certo successo nel generare cellule epiteliali del polmone, tuttavia ci sono diverse limitazioni, tra cui l'efficienza poco chiare, la possibile contaminazione da altre stirpi endodermico, la mancanza di una struttura (3D) a 3 dimensioni, e in alcuni casi uso di colture indefiniti con l'integrazione di siero. Cultura della pluripotenti o cellule differenziate su ponteggi polmonari decellularized è sempre più utilizzato come un test per valutare il potenziale di rigenerazione delle cellule seminate nella formazione del polmone strutture epiteliali 3,5,6,8,9. cultura Tali relazioni cellule seminate su scaffold con fattore di crescita continua o supplementazione siero.
lo sviluppo del polmone comporta la divisione, la migrazione, l'espressione genica e la differenziazione delle singole cellule in risposta a stimoli ambientali. La matrice extracellulare (ECM) è un reticolo di glicoproteine che, oltre a fornire supporto strutturale, dirige tissue morfogenesi integrando e regolando questi processi 10,11. Usando il patibolo ECM polmone come una piattaforma naturale per la cultura endoderma per simulare meglio il polmone ambiente di sviluppo in vivo, abbiamo generato staminali vie aeree cellule epiteliali cellule derivate in un 3D-cultura definita impostazione con alta efficienza e riproducibilità.
Polmone Rat ponteggi ECM sono stati generati da decellularization così come le cellule endodermico del mouse ESC-derivati sono stati generati e successivamente seminate su questi ponteggi. Duplice espressione di CXCR4 e proteine c-kit indica una identità delle cellule endoderma definitivo e cellule positive per entrambi SOX2 & espressione NKX2-1 sono identificati come cellule delle vie respiratorie (polmoni prossimale) progenitrici. Cellule endoderma definitive sono state coltivate a interfaccia Liquid Air (ALI) per un massimo di tre settimane per generare cellule epiteliali delle vie aeree funzionale in vitro.
Questo protocollo promuove polmone lignaggio differenziazione delle definitiva endoderma fin da 7 giorni, osservate con l'emergere di NKX2-1 + / + SOX2 primi progenitori polmonari prossimali. Entro il giorno 14 e 21 di cultura maturi popolazioni di cellule delle vie respiratorie epiteliali emergere compresi ciliato (TUBB4A +), club (SCGB1A1 +), e basale (TRP63 +, KRT5 +) cellule con somiglianza morfologica e funzionale di topo vie aeree nativi. Questo protocollo dimostra l'importanza del microambiente 3D-matrice per ottenere una differenziazione robusta Airway cellule epiteliali.
Protocollo
Gli esperimenti sugli animali sono stati eseguiti in conformità con le linee guida del Comitato cura degli animali del Hospital for Sick Children Research Institute.
1. Preparazione Ponteggio
- Decellularization dei polmoni
- Euthanize ratti Wistar adulti utilizzando CO 2 da camera. Mettere animali nella camera e iniziare il 100% dell'esposizione di CO 2 ad un tasso di riempimento del 10-30% del volume della camera per minuto.
- Osservare animale per incoscienza; questo si verifica dopo circa 2-3 min. Se incoscienza non si verifica in questo periodo di tempo, controllare il tasso di riempimento e di tenuta della camera. A seguito di perdita di coscienza, osservare animali per il colore degli occhi sbiaditi e la mancanza di respiro. Se si osservano entrambi, mantenere la CO 2 di riempimento per 1-2 minuti e poi rimuovere animale dalla camera per la procedura.
- Fissare animale superficie dissezione fissando zampe anteriori e le zampe posteriori, e spruzzare lungo il torace e la zona addominale con il 70% di etanolo. Accedi al cuore e lungs aprendo la cavità toracica mediante un'incisione verticale lungo lo sterno.
- Fare piccole incisioni attraverso il diaframma prima di causare i polmoni a ritrattare, riducendo la possibilità di pungere i polmoni. Legare la vena cava inferiore con una sutura e mettere una piccola incisione in atrio sinistro con piccole forbici dissezione.
- Utilizzando un preparato siringa da 10 ml con un ago 25 G riempito con soluzione salina bilanciata eparinizzata di Hank (HBSS) (10 U / eparina ml in HBSS), avviare perfusione polmonare inserendo l'ago nel ventricolo destro per spingere il buffer attraverso la circolazione polmonare (tasso di 2 ml / min). Continuare questa procedura fino a quando i polmoni diventano bianchi e il fluido che scorre dal dell'atrio sinistro è pulita.
- A seguito di perfusione, esporre la trachea e cannulate con un catetere di plastica vicino alla cartilagine tiroidea e fissarlo in posizione con una sutura.
- Installazione di un sistema di perfusione a gravità fissando una siringa da 10 ml di una posizione storta e morsetto. Rimuovere e discard stantuffo della siringa. Fissare il punto massimo di riempimento sulla siringa a 20 cm sopra i polmoni. Attaccare un rubinetto a due vie alla fine della siringa, e un lungo tubo di plastica per l'altra estremità del rubinetto per l'erogazione soluzione decellularization alla trachea cannulata. Versare la soluzione nella siringa e consentire la soluzione di riempire tubi di plastica attaccato e il catetere.
- LAVAGGIO polmoni riempiendo alla capacità polmonare totale (circa 12 ml) per 1 min e rimuovere il catetere di plastica dalla trachea per permettere il passaggio del fluido in uscita dei polmoni. Non riempire siringa più di 10 ml quando lavaging polmoni per mantenere la pressione sotto i 20 cm di H 2 O.
- Ripetere il lavaggio dei polmoni otto volte con soluzione decellularization, seguito da 10 risciacqui con soluzione salina tamponata con fosfato (PBS).
- Sezionare la trachea e polmoni libera dalla cavità collo e al torace e rimuovere dall'animale. Mantenere il tessuto in PBS freddo a 4 ° C fino preparazione vibratome sectioning.
- Euthanize ratti Wistar adulti utilizzando CO 2 da camera. Mettere animali nella camera e iniziare il 100% dell'esposizione di CO 2 ad un tasso di riempimento del 10-30% del volume della camera per minuto.
- generazione sezione di spessore
- Preparare circa 15 ml di 2% e il 4% (w / v) di agarosio, e abbastanza 6% (w / v) di agarosio per l'incorporamento tutti lobi in piccoli blocchi rettangolari. Sciogliere punto di fusione agarosio in polvere a basso contenuto di PBS per microonde. Trasferire il agarosio a 50 ml provette su un blocco di calore e mantenere la temperatura superiore a 40 ° C per evitare la gelificazione.
- Dissect polmone decellularized alla fine di ogni bronco lobare staccare ogni lobo (craniale, centrale, accessorio, e lobi caudali destro e il lobo sinistro) utilizzando piccole forbici. Pat asciugare ciascun lobo utilizzando fogli assorbenti per rimuovere l'eccesso di PBS e posto interno 2% (w / v) agarosio mentre sul blocco riscaldante.
- Rimuovere ciascun lobo dopo 5 min di rivestimento in agarosio, posto in una piastra di Petri e lasciare che la superficie di gel per 1 minuto su un piatto freddo.
- Posizionare delicatamente lobi indietro nel 4% (w / v) agarosio, fresco dopo 5 minuti, e ripetere il rivestimento ancora una volta con il 6% (w / v) di agarosio.
- Dopo aver co sequenzialeDELL'INDICE DI di ciascun lobo, incorporare ciascun lobo separatamente 6% (w / v) di agarosio con stampi a base di metallo con almeno 3 mm di agarosio che circonda il tessuto dai bordi. Orient ciascun lobo usando pinze posizionando grande bordo piatto del lobo sulla superficie di stampo metallico rivolto sperimentatore. Questo bordo sarà il lato fissato alla piastra provino per vibratome sezionamento.
- Consentire blocchi di gel sulla piastra fredda per almeno 30 minuti prima di sezionamento con vibratome. blocchi Conservare in una camera umidificata per 12 ore a 4 ° C prima vibratome sezionamento.
- Impostazione vibratome riempiendo la camera di sezionamento con PBS freddo 12. Mantenere la temperatura fredda per tutto il sezionamento con il bagno di ghiaccio circostante. Rimuovere isolati da stampi metallici e utilizzare una lama di rasoio per tagliare le eccesso di agarosio lobi circostante, mantenendo circa 3 mm dal bordo del tessuto.
- Fissare il tessuto al centro del piatto portacampione con adesivo, e sommergere piatto in tegli PBS pieno di camera di sezionamento. Setup sezionamento confini su vibratomo selezionando i seguenti valori di velocità, ampiezza e spessore rispettivamente: 0.2 mm / sec, 1,85 mm, e 350 micron.
Nota: sezioni Sia longitudinali e trasversali del lobo orientamento sono accettabili. - Sezione ciascun lobo completamente. Manualmente sezioni tagliate libera utilizzando piccole forbici se una sezione non è completamente separata dalla lama al termine della sequenza di sezione. Raccogliere sezioni impalcatura delicatamente e tenere in PBS in ghiaccio fino alla fase successiva.
Nota: Le sezioni generati includeranno sia le aree prossimali e distali del polmone e entrambe le fonti possono essere utilizzate per Recellularization; Tuttavia, la maggior parte della superficie comprenderà polmone distale.
- Decontaminazione delle sezioni ponteggio
- Trasferire i 350 micron di spessore sezioni impalcatura da PBS per provette da microcentrifuga (fino a 30 sezioni / tubo) e trattare con nucleasi (90 U / ml in PBS) (vedi elenco dei materiali) per 12 - 24 ore a temperatura ambiente, inun rotatore.
- Dopo il trattamento nucleasi, sezioni di trasferimento con pinze a nuove provette da microcentrifuga e trattare con la soluzione antimicrobica (200 U / ml di streptomicina penicillina e 25 mg / ml di amfotericina B in PBS) in condizioni sterili per 6 ore a temperatura ambiente, su un rotatore.
Nota: Scaffolds possono essere memorizzati in soluzione antimicrobica fino ad una settimana a 4 ° C prima dell'uso. - Dopo la fase di decontaminazione con una soluzione antimicrobica, lavare ponteggi due volte con PBS in condizioni sterili e trasferire al siero dei media differenziazione gratuito (SFDM) prima della semina con le cellule.
2. endodermico cellulare Preparazione
- Definitiva endoderma induzione
- Mantenere le linee del mouse ESC sotto, cultura libera siero senza alimentatore utilizzando condizioni 2i 13. Inizia l'induzione endoderma eliminando le cellule pluripotenti da cultura aderente da tripsinizzazione.
- Risospendere le cellule in SFDM e sementi ad una densità di 20.000cellule / ml a basse piastre aderenti per tre giorni senza cambiare supporto per consentire la formazione di EB.
- Dopo tre giorni il trasferimento delicatamente EBS in 50 ml provette coniche con una pipetta 10 ml e permettono loro di raccogliere in fondo per 3 minuti a temperatura ambiente.
- Attentamente i media aspirare e di mezzi aggiunga SFDM freschi integrato con 50 ng / ml activin A.
- cellule seme di nuovo sul basso piastre aderenti ad un 1: Densità 2 e cultura per tre giorni aggiuntivi per raggiungere la differenziazione endoderma definitivo.
- Definitiva arricchimento endoderma
- Raccogliere giorno 6 EBS, dissociarsi con tripsina e l'etichetta per il c-kit e l'espressione CXCR4 utilizzando anticorpi fluorescenti coniugati 14.
- Ordina cellule marcate utilizzando la fluorescenza-attivato l'ordinamento delle cellule (FACS) per l'espressione di entrambi i marcatori per ottenere un arricchito popolazione endoderma definitivo 15.
3. Installazione Recellularization
- interfaccia aria-liquidoinstallazione di cultura
- Trasferire ogni sezione impalcatura decellularized (fase 1.2.9) da SFDM su una membrana galleggiante idrofobica (8 micron dimensioni dei pori) con pinza sterile. Assicurarsi impalcatura sezioni sono distribuite in modo uniforme sulla membrana.
- Preparare 6 o 12 pozzetti riempiendo i pozzi con 1 o 0,5 ml di SFDM, rispettivamente. Posizionare delicatamente membrane in pozzi, permettendo la membrana di galleggiare sulla cima di supporto, creando una configurazione coltura aria-liquido.
- Semina di ponteggi 3D
- A seguito di FACS per i marcatori endoderma definitivo (punto 2.2.2) contano cellule ordinati utilizzando un emocitometro, centrifugare a 400 xg per 5 minuti e risospendere in SFDM. Risospendere le cellule per ottenere un volume contenente circa 100.000 cellule / 10 microlitri / ponteggi.
- Per recellularize ponteggi, pipetta 10 ml di cellule direttamente su ogni sezione preparata dal punto 3.1.2.
- Sostituire i media SFDM culture ogni 48 ore. Aspirare i vecchi media tenendo il piatto con una leggera pendenzaper evitare di interrompere la cultura. Aggiungere lentamente SFDM fresco alla cultura lungo il lato del pozzo per impedire affondamento della membrana galleggiante.
- Mantenere le culture aria-liquido per un massimo di 21 giorni per raggiungere la differenziazione di cellule seminate a epiteli delle vie aeree maturo.
Nota: Recellularized sezioni possono essere trattati per la colorazione dei tessuti e immunofluorescenza microscopia (IF) in un punto qualsiasi momento durante la coltura cellulare 16.
Risultati
Come indicato in questo protocollo, robusto differenziazione endoderma definitivo di maturare cellule epiteliali delle vie aeree può essere realizzato utilizzando la cultura estesa di cellule seminate su sezioni impalcatura polmone decellularized. Si raccomanda di impalcature decellularized essere caratterizzati per garantire (1) cellule ospiti vengono completamente rimossi, e (2) proteine della matrice extracellulare sono conservati prima di utilizzare ponteggi per la differenziazione. Decellularization può essere valutata mediante colorazione del tessuto con ematossilina ed eosina (H & E) e 4 ', 6-diamidino-2-fenilindolo (DAPI), come illustrato nella Figura 1A. -Alto ingrandimento microscopio elettronico a scansione (SEM) di scaffold conferma l'assenza di cellule ospiti e l'architettura di matrice intatta, come illustrato in Figura 1B. Ulteriori caratterizzazione del ponteggio rimanente prove di trazione e immunocolorazione per proteine della matrice può essere effettuata per assicurare corrioni di ECM seguente decellularization 16.
Cultura non aderente CES SFDM mezzi per sei giorni porta alla formazione di aggregati di cellule (EBS) come illustrato nella Figura 2A. Tre giorni di activina A risultati del trattamento a induzione endoderma definitivo. Restrizione Lineage di ESC per endoderma definitivo può essere confermata da upregulation e l'espressione di geni e proteine endoderma 17 lignaggio-associato, e non si può affermare morfologicamente. efficienza endoderma-induzione varia dal 50-70% a seconda della linea ESC utilizzato. Gli esperimenti sono stati condotti in linee ESC del mouse: R1 (NKX2-1 mCherry), G4 (DsRed -MST), e 129 / Ola (Bry-GFP / Foxa2-hCD4), mentre tutti i dati illustrati in questo manoscritto sta usando il cellulare R1 linea. Il doppio positivo CXCR4 + / c-KIT + popolazione endoderma definitivo è ordinato come illustrato nella figura 2B, testa di seriesu impalcature polmone 3D, e coltivate per un massimo di 21 giorni a interfaccia aria-liquido in SFDM. È importante ordinare e arricchire per endoderma definitivo limitato organizzazione e differenziazione è ottenuta con la cultura di cellule separate dal giorno eterogenea 6 EBs come illustrato in Figura 2C. Strutture formate da cellule ordinati su ponteggi ricordano sviluppo del polmone (giorno embrionale 13,5), come illustrato nella figura 2C-D. Nella nostra esperienza, una densità di semina di 100.000 cellule ordinati / impalcatura ha ceduto il migliore ripopolamento patibolo.
Differenziazione per il lignaggio del polmone è stato osservato già nel 7 giorni dopo la cultura patibolo. Cellule progenitrici epiteliali delle vie aeree positivi per NKX2-1 e SOX2 vengono rilevati utilizzando se l'analisi confocale come illustrato in Figura 3A. SOX2 positivo, cellule negative NKX2-1 sono probabilmente cellule pluripotenti endodermico che non sono differenziati al polmone lineage. Con la cultura più queste cellule possono iniziare a esprimere NKX2-1 o apoptosi, senza un adeguato supporto nel microambiente. Se l'analisi del giorno 21 culture rivela una popolazione vie aeree epiteliale maturo contenente TRP63 + / + KRT5 cellule basali cellule ciliate TUBB4A +, le cellule SCGB1A1 + del club, e come illustrato in figura 3B. analisi SEM della superficie di giorno 21 culture rivela similitudine morfologica di colture cellulari derivate staminali MOUSE vie respiratorie.
Entrambe le proteine della matrice isolate (collagene I, collagene IV, fibronectina, laminina) e decellularized ponteggi rene di ratto erano in grado di promuovere la differenziazione del polmone-lignaggio quando seminato con endoderma definitivo e coltivate nelle stesse condizioni sopra descritte 16. Questo dimostra che il microambiente 3D creato da impalcature polmonari derivato è distinto da impalcature renali derivato nella sua capacità di promuovere polmone lineage differenziazione seeded cellule endodermico.

Figura 1. tecnica Decellularization rimuove componenti cellulari e conserva ECM. (A) H & E (pannello superiore) e DAPI (pannello inferiore) colorazione del tessuto polmonare naturale e decellularized che mostra l'assenza di nuclei seguente decellularization. pannello di destra mostra esempi di sezioni di tessuto dai polmoni senza decellularization ottimale. Punte di freccia mostrano nuclei rimanenti su impalcature a causa di decellularization incompleta, mettendo in evidenza l'importanza di ottimizzare tecnica prima Recellularization. Barra di scala = 25 micron. Immagini (B) SEM del polmone naturale e decellularized, mostrando assenza di cellule e la conservazione dell'architettura di matrice su impalcature decellularized. Barra di scala = 10 micron. Cliccate quiper visualizzare una versione più grande di questa figura.

Figura 2. Ordinati ESC-derivato risultati endoderma definitivo in Recellularization ottimale. Corpi (A) Giorno 6 embrionali (EBS) tre giorni di activina Un trattamento per promuovere la differenziazione endoderma definitivo. (B) EBS sono ordinati per FACS per duplice espressione di marcatori di superficie CXCR4 e c-kit per isolare la popolazione endoderma definitivo. Questa popolazione saranno teste di serie su impalcature decellularized. (C) colorazione H & E di ponteggi recellularized al giorno 7 e il giorno 21 di cultura. Pannello sinistra rappresenta organizzato, strutture delle vie aeree, come seguire semina con le cellule ordinati, e il pannello di destra rappresenta disorganizzata, le cellule non ordinati altamente proliferative su impalcature evidenziando l'importanza della selezione delle cellule prima Recellularization. Scalabar = 30 micron. (D) colorazione H & E di giorno embrionale 13,5 polmoni del mouse. Fai clic qui per vedere una versione più grande di questa figura.
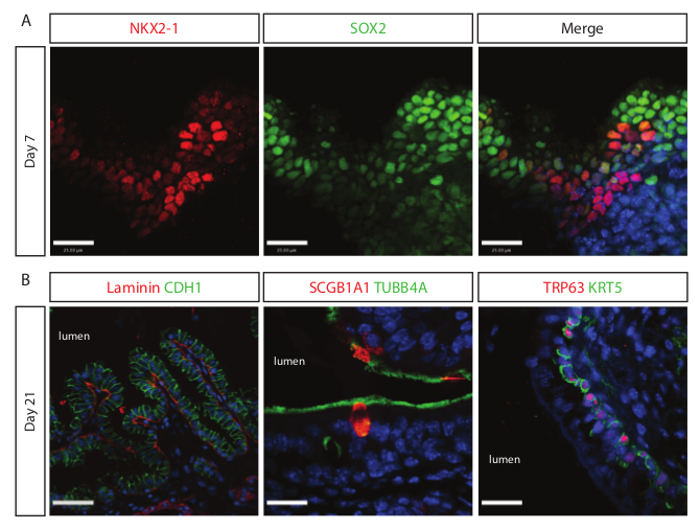
Figura 3. cultura estesa di endoderma definitivo sulle impalcature del polmone naturale dirige la differenziazione alle vie aeree cellule epiteliali. (A), le cellule progenitrici del polmone prossimale (NKX2-1 + / SOX2 +) vengono rilevati dopo sette giorni di coltura su ponteggi decellularized. Barra di scala = 15 micron. (B) a sinistra mostra immagine matura pseudostratificato strutture cellulari epiteliali (CDH1 +) fiancheggiate da laminina proteina di membrana basale sul lato basale delle strutture. Centro e mostrare l'immagine a destra maturi epiteli delle vie respiratorie complete di cellule ciliate (TUBB4A +), club cellule (SCGB1A1 +) e cellule basali (KRT5 + / TRP63 +). bar scala dell'immagine Sinistra = 30 micron; Centro e barra di scala immagine a destra = 15 micron. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Il protocollo qui descritto genera epiteli delle vie aeree ESC-derivato maturi utilizzando solo impalcature polmone naturale indirizzare la differenziazione con nessun altro supplementazione. Questa configurazione viene definita la cultura,, poco costoso, e riproducibile privo di siero. Non è richiesto alcun fattore di crescita integrazione dei media differenziazione di base. Metodi precedentemente pubblicati per la generazione di cellule epiteliali del polmone di cellule derivate da staminali hanno usato strategie 2-dimensionali con il completamento del fattore di crescita per promuovere restrizione lignaggio 3,4,8,18,19. La tecnica qui descritta è vantaggiosa nel corso di questi metodi per diversi motivi, tra cui: condizioni di coltura definito, ad alta efficienza differenziazione di cellule delle vie aeree funzionali, la contaminazione limitata da altre stirpi endodermico (tiroide, fegato, pancreas), e un microambiente differenziazione 3D. Questa tecnica fornisce risultati simili con ECM mouse derivati e può quindi essere modificato per generare scaffold decellularized utilizzando polmoni del mouse. CES Rat-derivati differenziati per endoderma definitivo e seminate su scaffold usando questo protocollo differenziare anche per epiteli delle vie aeree.
ponteggi decellularized possono essere memorizzati in una soluzione di decontaminazione a 4 ° C fino a 7 giorni prima Recellularization. Ponteggi conservati per periodi più lunghi possono essere funzionali, ma non abbiamo testato per confermare questo. Per ottenere l'organizzazione e la differenziazione efficiente è necessario per arricchire per endoderma definitivo da FACS dopo induzione con activin A. cellule non-endoderma in giorno 6 EBs spesso esprimono marcatore pluripotenza Oct4 e se seminato su impalcature continuerà a proliferare senza organizzazione e le specifiche per la lignaggio polmone. La densità di semina può essere regolata in base alla cella linea di specificità per ottenere la completa Recellularization di ponteggi.
Una limitazione di questo protocollo è nella sua incapacità di promuovere la differenziazione di cellule epiteliali alveolari. Anche se NKX2-1 + / + SOX9 cellule progenitrici distali vengono rilevati dopo sette giorni di coltura su ponteggi, questa popolazione non è presente al giorno 14 e il giorno 21. I marcatori di tipo maturo I alveolare cellule epiteliali (AQP5) e tipo II cellule epiteliali alveolari (SFTPB, SFTPC) non vengono rilevati in qualsiasi momento durante la coltura patibolo. Ciò può essere dovuto a un requisito per ulteriore integrazione del fattore di crescita e condizioni di coltura sommerse per promuovere specifiche lignaggio alveolare, mentre come descritto qui, proteine della matrice ei fattori di crescita matrice-bound residuo su impalcature decellularized è sufficiente per promuovere vie aeree differenziazione lignaggio.
Il passo fondamentale per promuovere la differenziazione dei endoderma definitivo alle vie aeree che utilizzano le cellule epiteliali polmonari ponteggi è l'ottimizzazione del processo di decellularization. componenti cellulari devono essere completamente rimossi mentre i componenti della matrice sono conservati. Tissue colorazione per il materiale nucleare con DAPI, ultra-structanalisi Ural di ponteggi con la scansione e la microscopia elettronica a trasmissione e analisi del DNA può essere usato per confermare la rimozione di tutti i componenti cellulari. ECM composizione proteica del ponteggio può essere valutata utilizzando se la colorazione e l'analisi immunoblot per proteine della matrice: I collagene, collagene IV, elastina, fibronectina, proteoglicani eparina solfato, e laminina 16.
Questi epiteli del polmone cellule staminali di derivazione può essere utilizzata nella modellazione della malattia e della droga-discovery piattaforme di patologie delle vie respiratorie legate come la fibrosi cistica. Il potenziale di questi costrutti cellula-matrice in applicazioni rigenerative come la riparazione dei tessuti e terapia cellulare può essere esaminato da trapianto in vivo di costrutti ingegnerizzati in vari modelli murini. Inoltre, questo 3D metodo in vitro per la differenziazione delle vie aeree può essere facilmente adattato per studiare vari parametri che influenzano specifica lineage polmone manipolando crescita disponibilità fattore e cellula-matrice segnalazionedi culture durante le diverse fasi di differenziazione su ponteggi.
Divulgazioni
Non ci sono concorrenti interessi finanziari da dichiarare.
Riconoscimenti
Desideriamo ringraziare il Dr. Rossant e il Dr. Bilodeau per il mCherry CES NKX2-1 utilizzati in esperimenti illustrati nelle figure 1-3. FACS è stata eseguita in SickKids-UHN citometria a flusso strumento. Questo lavoro è stato sostenuto da sovvenzioni di funzionamento degli Istituti canadesi di ricerca di salute e una borsa di infrastrutture (CSCCD) dalla Fondazione canadese per l'innovazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Perfusion solution | Sigma | H0777 | 10 U/ml heparin |
| Perfusion solution | Gibco | 14170112 | dissolved in Hank's balanced salt solution (HBSS-) |
| Decellularization solution | BioShop | CHA003 | 8 mM CHAPS |
| Decellularization solution | Sigma | E9884 | 25 mM EDTA |
| Decellularization solution | BioShop | SOD002 | 1 M NaCl |
| Decellularization solution | Gibco | 14190-144 | dissolved in PBS |
| Benzonase nuclease | Novagen | 70664-3 | 90 U/ml Benzonase nuclease |
| Benzonase nuclease | Gibco | 14190-144 | diluted in PBS |
| Antimicrobial solution | Gibco | 15140 | 200 U/ml penicillin streptomycin |
| Antimicrobial solution | Gibco | 15290 | 25 μg/ml amphotericin B |
| Antimicrobial solution | Gibco | 14190-144 | diluted in PBS |
| Trypsinization | Gibco | 12605-028 | TrypLE |
| Serum free differentiation media (SFDM) | Gibco | IMDM 2440-053, F12 11765-054 | 3:1 ratio of IMDM and Ham’s modified F12 medium |
| Serum free differentiation media (SFDM) | Gibco | 12587-010 | B27 supplement (50x dilution) |
| Serum free differentiation media (SFDM) | Gibco | 17502-048 | N2 supplement (100x dilution) |
| Serum free differentiation media (SFDM) | Gibco | 15260-037 | 0.05% (Fraction V) bovine serum albumin |
| Serum free differentiation media (SFDM) | Gibco | 35050-061 | 200 mM Glutamax |
| Serum free differentiation media (SFDM) | Sigma | M6145 | 4 μM monothioglycerol |
| Serum free differentiation media (SFDM) | Sigma | A4403 | 0.05 mg/ml ascobic acid |
| Endoderm induction | R&D | 338-AC/CF | Activin A |
| Antibodies | |||
| CDH1 | BD Biosciences | 610181 | Mouse, non-conjugated, 1:100 |
| C-KIT | BD Biosciences | 558163 | Rat, PE-Cy7, 1:100 |
| CXCR4 | BD Biosciences | 558644 | Rat, APC, 1:100 |
| KRT5 | Abcam | ab24647 | Rabbit, non-conjugated, 1:1,000 |
| NKX2-1 | Abcam | ab76013 | Rabbit, non-conjugated, 1:200 |
| Laminin | Novus Biologicals | NB300-144 | Rabbit, non-conjugated, 1:200 |
| SCGB1A1 | Santa Cruz | sc-9772 | Goat, non-conjugated, 1:1,000 |
| SOX2 | R&D Systems | AF2018 | Goat, non-conjugated, 1:400 |
| TRP63 | Santa Cruz | sc-8431 | Mouse, non-conjugated, 1:200 |
| TUBB4A | BioGenex | MU178-UC | Mouse, non-conjugated, 1:500 |
| Goat IgG | Invitrogen | A-11055 | Donkey, Alexa Fluor 488, 1:200 |
| Mouse IgG | Invitrogen | A-21202 | Donkey, Alexa Fluor 488, 1:200 |
| Mouse IgG | Invitrogen | A-31571 | Donkey, Alexa Fluor 647, 1:200 |
| Rabbit IgG | Invitrogen | A-21206 | Donkey, Alexa Fluor 488, 1:200 |
| Rabbit IgG | Invitrogen | A-31573 | Donkey, Alexa Fluor 647, 1:200 |
| Other Materials | |||
| Low adherent plates | Nunc | Z721050 | Low cell binding plates, 6 wells |
| Air-liquid interface membranes | Whatman | 110614 | Hydrophobic Nucleopore membrane, 8 μm pore size |
| Vibratome | Leica | VT1200S | Leica Vibratome |
| Tissue Adhesive | Ted Pella | 10033 | Pelco tissue adhesive |
Riferimenti
- Discher, D. E., Mooney, D. J., Zandstra, P. W. Growth Factors, Matrices, and Forces Combine and Control Stem Cells. Science. 324 (5935), 1673-1677 (2009).
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. J. Cell Sci. 121 (3), 255-264 (2008).
- Ghaedi, M., et al. Human iPS cell-derived alveolar epithelium repopulates lung extracellular matrix. J. Clin. Invest. 123 (11), 4950-4962 (2013).
- Huang, S. X. L., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nat. Biotechnol. 32 (1), 84-91 (2014).
- Jensen, T., et al. A rapid lung de-cellularization protocol supports embryonic stem cell differentiation in vitro and following implantation. Tissue Eng. Part C: Methods. 18 (8), 632-646 (2012).
- Longmire, T. A., et al. Efficient derivation of purified lung and thyroid progenitors from embryonic stem cells. Cell stem cell. 10 (4), 398-411 (2012).
- Wong, A. P., et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein. Nat. Biotechnol. 30 (9), 876-882 (2012).
- Gilpin, S. E., et al. Enhanced Lung Epithelial Specification of Human Induced Pluripotent Stem Cells on Decellularized Lung Matrix. Annal. Thorac. Surg. 98, 1721-1729 (2014).
- Cortiella, J., et al. Influence of Acellular Natural Lung Matrix on Murine Embryonic Stem Cell Differentiation and Tissue Formation. Tissue Eng. Part A. 16 (8), 2565-2580 (2010).
- Princivalle, M., De Agostini, A. Developmental roles of heparan sulfate proteoglycans: a comparative review in Drosophila, mouse and human. Int. J. Dev. Biol. 46, 267-278 (2002).
- Thompson, S. M., Jesudason, E. C., Turnbull, J. E., Fernig, D. G. Heparan sulfate in lung morphogenesis: The elephant in the room. Birth Defects Res. Part C, Embryo Today. 90 (1), 32-44 (2010).
- Zimmermann, M., et al. Improved reproducibility in preparing precision-cut liver tissue slices. Cytotechnology. 61 (3), 145-152 (2009).
- Ying, Q. -L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453 (7194), 519-523 (2008).
- Fox, E., et al. Three-Dimensional Culture and FGF Signaling Drive Differentiation of Murine Pluripotent Cells to Distal Lung Epithelial Cells. Stem Cells Dev. 24 (1), 21-35 (2014).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of Specific Cell Population by Fluorescence Activated Cell Sorting (FACS). J. Vis. Exp. (41), e1546(2010).
- Shojaie, S., et al. Acellular lung scaffolds direct differentiation of endoderm to functional airway epithelial cells: requirement of matrix-bound HS proteoglycans. Stem Cell Reports. 4, 1-12 (2015).
- Kubo, A., et al. Development of definitive endoderm from embryonic stem cells in culture. Development. 131 (7), 1651-1662 (2004).
- Longmire, T. A., et al. Efficient Derivation of Purified Lung and Thyroid Progenitors from Embryonic Stem Cells. Cell stem cell. 10 (4), 398-411 (2012).
- Wong, M. D., Dorr, A. E., Walls, J. R., Lerch, J. P., Henkelman, R. M. A novel 3D mouse embryo atlas based on micro-CT. Development. 139 (17), 3248-3256 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon