Method Article
経鼻吸入医薬品エアロゾルのパッシブとアクティブコントロールを使用した嗅覚ドラッグデリバリーのモデリングとシミュレーション
要約
This manuscript reviews the modeling and simulations of different protocols to deliver medications to the olfactory region in image-based nasal airway models. Multiple software modules are used to develop the anatomically accurate nose model, generate computational mesh, simulate nasal airflows, and predict particle deposition at the olfactory region.
要約
神経障害の治療における直接鼻から脳への薬物送達の多くの利点があります。しかし、そのアプリケーションが直接脳を結ぶ嗅粘膜への非常に低い送達効率(<1%)によって制限されます。嗅覚領域に、より効果的に神経学的薬剤を送達するための新たな技術を開発することが重要です。本研究の目的は、シミュレートおよび鼻腔の嗅覚薬物送達を改善するための数値プラットフォームを開発することです。結合画像CFD方法は、画像ベースのモデル開発、品質噛み合い、流体シミュレーション、及び磁性粒子追跡を合成し、その提示されました。この方法で三鼻腔内送達プロトコルの性能を数値的に評価し、比較しました。呼吸操縦、磁石配置、磁界強度、薬物放出位置、及び嗅覚用量の粒子サイズの影響も数値的に調べました。
Sからimulations、我々は(45%まで)臨床的に有意な嗅覚投与量は、磁石のレイアウトと選択的薬物放出の組み合わせを用いて実現可能であることがわかりました。投与量の64倍高い配信は、それがない場合に比べて磁気泳動指導の場合に予測されました。しかし、嗅覚の領域に経鼻吸入エアロゾルの正確な指導が原因磁気泳動の不安定な性質だけでなく、嗅覚patient-する用量、デバイス - 、および粒子関連因子の高感度に依然として厳しいです。
概要
嗅覚領域に送達される薬物は、血液脳関門をバイパスし、直接脳に入る、効率的な取り込みおよび薬物1,2の迅速な行動の発症につながることができます。しかし、このような鼻ポンプやスプレーなどの従来の鼻のデバイスは、鼻経路3,4を介して(<1%)嗅覚領域に非常に低用量を提供します。これは主に狭い、入り組んだ通路( 図1)から構成されているヒトの鼻の複雑な構造に起因します。嗅覚領域は、吸入空気のごく小さな部分が5,6に到達することができ、優れた道、上に位置します。また、従来の吸入装置は、対象領域7に治療薬を輸送する空気力学的な力に依存します。それらの放出後の粒子の動きに対して何らさらなる制御はありません。したがって、これらの粒子の輸送と沈着は主に彼らの初期の速度とリリース位置に依存します。原因入り組ん鼻通路だけでなく、粒子制御の不足のために、薬物粒子の大部分は、前鼻の中に閉じ込められ、嗅覚領域8に到達することはできません。
鼻のデバイスの多くの選択肢がありますが、特異的に標的嗅覚送達のために設計されたものはほとんど7,9を報告されていません。唯一の例外は、嗅覚-優先送達デバイスを開発し、鼻ドロップを使用するのではなく、ラットで高い皮質対血液薬物レベルを実証しフークマンとホー10です。しかし、人間にラットにおける成膜結果をスケーリングすることは、これらの2種11との間の広大な解剖学的および生理学的な違いを考慮し、簡単ではありません。嗅覚配達のための標準的な鼻デバイスの適応バージョンを使用すると、多くの制限が存在します。一つの主要な後退は、薬のごく小さな部分が薬が入ることがあり、それを通して鼻粘膜に送達することができるということです脳。数値モデリングは、鼻腔内投与したナノ粒子の0.5%未満が嗅覚領域3,5に堆積することができると予測しました。堆積速度は、マイクロ粒子の12(0.007%)も低いです。鼻から脳への送達は、臨床的に実行可能にするために、嗅覚の堆積速度を大幅に改善する必要があります。
嗅覚送達を改善するためのいくつかの可能なアプローチが存在します。一つのアプローチは、一つの領域に堆積した粒子は、主に入口の一つの特定の領域からのものであるようにKleinstreuer ら 13によって提案されたスマートな吸入器のアイデアですが、入口で特定の領域からのみ、それらを解放することにより、標的部位に粒子を送達することが可能です。スマートデリバリー技術は、従来の方法よりもはるかに効率的な肺送達を生成することが示されている。13,14なお、このスマートデリバリーアイデアもIに鼻腔内薬物送達に適用することができると仮定されます嗅粘膜へのmprove用量。鼻孔の開口部に及び鼻腔内の異なる深さから別の位置に粒子を放出することによって、嗅覚配信効率を改善し、前方の鼻の中に薬物の廃棄物を減少することが可能です。
別の可能な方法は、積極的に、電気や磁気力、フィールド力のさまざまな方法を使って、鼻腔内の粒子の動きを制御することです。荷電粒子の電気的制御は、ヒトの鼻や肺15-17への標的薬物送達のために示唆されています。西ら 18は、数値的に荷電粒子の電気指導の性能をテストし、大幅に改善された嗅覚投与量を予測しました。同様に、適切な磁場を持つ強磁性薬物粒子のガイダンスはまた、鼻粘膜への粒子を対象とする可能性を秘めています。吸入薬の挙動は、強磁性場合、適切な磁力を課すことによって変更することができます 19。ダムら 20は 、マウス肺内の特定の領域に強磁性粒子を標的化するために実用的であることを実証しました。超常磁性酸化鉄ナノ粒子で治療薬を包装することにより、強磁場の影響下でのマウスの肺における沈着はかなり他の肺20と比較して増加しました。
粒子は球状であると仮定し、直径が150ナノメートル〜30μmの範囲でした。支配方程式は21です。
(1) 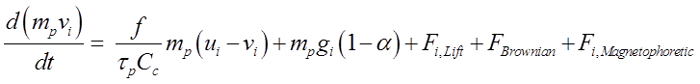
上記の式は、磁場中に置かれた場合にドラグ力、重力、サフマン揚力22、ナノ粒子のためのブラウン力、および磁気泳動力によって支配粒子の動きを説明しています。ここで、vがiは 、τpは 、流速で、uの粒子速度であります粒子の応答時間は、C cはカニンガム補正係数であり、αは、空気/粒子密度の比です。効果的に嗅覚領域に鼻腔内投与された薬物を導くために、適用される磁気泳動力が粒子の慣性と重力の両方を克服するために必要です。この研究では、20%のマグヘマイト(γ-Fe 2 O 3 4.9グラム/ cm 3)を、80%の活性薬剤を仮定した、おおよそ1.78グラム/ cm 3の密度及び50の相対的な透過性を与えているの合成。 γ-Fe系2 O 3の選択は、その低細胞毒性によるものでした。鉄(3+)イオンが広く人体中に見出され、わずかに高いイオン濃度は有意な副作用23が発生することはありません。
プロトコル
健康科学のためのHamner研究所およびこれらの画像の使用によって提供されたMRI画像は、バージニア・コモンウェルス大学施設内倫理委員会によって承認されました。
1.イメージベース鼻気道の準備
- 磁気共鳴(MR)72冠状断面で構成され、健康な非喫煙53歳の男性(体重73キロ、高さ173センチメートル)の画像を離れて鼻咽頭4に鼻孔にまたがる1.5ミリメートルの間隔を置いて配置を取得します。
- オープンイメージングプログラム( 例えば 、MIMICS)
- 画像をインポートするには、「ファイル」、「インポート・イメージ」をクリックします。 MR画像を選択し、「OK」をクリックします。
- 3-Dモデルを構築するために、-1020と-500の間のグレースケール範囲を設定し、次に「しきい値」、「分割」をクリックします。 「セグメンテーション」、「計算3D」をクリックしてください。
- 「セグメンテーション」と「ポリラインを計算」をクリックしてください。 3を選択-D体、およびソリッドジオメトリを定義するポリラインを生成するために、「OK」をクリックします。 IGESファイルとしてポリラインをエクスポートします。
- オープンモデル開発ソフトウェア( 例えば 、ギャンビット)
- プログラムにIGESファイルをインポートする「インポート」、「IGES」、「ファイル」をクリックしてください。右側のパネルの「エッジコマンドボタン」をクリックしてください。滑らかな輪郭を再構築するために「エッジを作成」を選択し、「NURBS」をクリックします。
- 「顔のコマンドボタン」をクリックし、「フォームの顔」をクリックします。エッジから面を構築するために、「ワイヤーフレーム」を選択します。全体の気道をカバーするすべての表面を構築し続けています。このような口蓋垂、喉頭蓋倍、喉頭洞( 図1)のような鼻の解剖学的詳細を保持します。鼻気道モデルをエクスポートするには、「ファイル」、「エクスポート」「IGES」をクリックしてください。
- オープンメッシュソフトウェア( 例えば 、ICEM CFD)
- 「[ファイル]をクリックします"、"インポートジオメトリ」、「レガシー」と「STEP / IES「鼻気道モデルをインポートする]をクリックします。「五つの異なる領域に気道表面を分割する「パーツを作成します:鼻前庭、鼻腔バルブ、甲介地域、嗅覚、および鼻咽頭。
- 気道内部の計算メッシュを生成するには、「メッシュ」、「グローバルメッシュ設定」をクリックします。 0.1ミリメートル、最大メッシュサイズを指定し、「適用」をクリックします。
- 壁近傍領域にボディフィットメッシュを追加するには、「計算メッシュ」、「プリズムメッシュ」をクリックします。 5としての層数や1.25などの拡大率を指定し、「適用」をクリックします。
粒子の2パッシブコントロール
- 前庭挿管: 対フロント。バック
- フロント前庭挿管と鼻のモデルを開発するためのモデル開発ソフトウェアを開きます。 n個の場所を変更する「音量」、次に「移動/コピー」をクリックしてください鼻孔の先端から前庭にebulizerカテーテル5ミリメートル。鼻孔に60,000粒子(150 nm)を解放するために「注入」をクリックしてください。
- 鼻の内部に粒子堆積速度を計算するために流体シミュレーションソフトウェア( 例えば 、ANSYS流暢)を開きます。気道内のエアフローのフィールドを計算するには、「粘性」、「定義」、「モデル」をクリックすることで、層流モデルを選択します。 「粘性モデル」の下の「層流」を選択しました。
- 粒子の動きを追跡するために、「離散フェーズモデル」を選択します。 「離散フェーズモデル」の下に「サフマン揚力」を確認してください。 「報告書」は、「サンプルの軌跡 "を選択します]をクリックします。 「境界」の「鼻」を選択し、事前に定義された嗅覚地域に堆積した粒子の数を見つけるために「計算」をクリックします。鼻孔に入る粒子の量に付着した粒子の量の比率としての堆積速度を計算します。
- 手順を繰り返し1μmの粒子について2.1.2。
- ステップ2.1.1に従って、鼻孔の奥から前庭に噴霧ノズルに5ミリメートルを挿入します。繰り返しは、150 nmの粒子の堆積速度を計算するために、2.1.2、および2.1.3を繰り返します。 1μmの粒子(バック挿管)のための手順を繰り返し2.1.4。
- ディープ挿管
- 右嗅部の下噴霧器カテーテルを挿入するための手順2.1.1に従ってください。ネブライザーから60,000サブミクロン粒子(150 nm)をリリース。
- 2.1.2に記載されているのと同様の手順を実行することで、合計とローカルの両方に基づいて、鼻の内部に粒子堆積速度を計算するために、流体シミュレーションソフトウェアを使用してください。 1μmの粒子について、この手順を繰り返します。
- それぞれ、呼吸保持および呼気を行使しながら、上記の手順を繰り返します。 「定義」をクリックし、次に「境界条件」とは、境界条件のパネルを開きます。呼吸保持のための2つの鼻孔にゼロ速度を指定します。。真空鼻孔の圧力(200 Pa)で呼気のための出口の圧力ゼロを指定します。
3.アクティブコントロール:磁気泳動ガイダンス
- 2枚板のチャンネルでテスト
- 磁性粒子トラッキングソフトウェア( 例えば 、COMSOL)を開きます。 2板のチャネルを構築する「ジオメトリ」、および「長方形」をクリックしてください。 2板チャネルの周りに磁石を構築するために、「長方形」をクリックしてください。
- 粒子軌道及び堆積速度を計算します。 「モデル1」、「層流」と「インレット1」をクリックしてください。 0.5メートル/秒などの流入速度を指定します。 「モデル1」、「磁場」をクリックし、「磁束保全」、3の磁石(1×10 5 A / m)での強さを指定します。
- 「モデル1」、「流体の流れのための粒子追跡」、および「パーティクルプロパティ」をクリックしてください。粒子径(15μm)を指定し、密度(1.78グラム/ cm 3以下)。 3000粒子を解放するために、「入口」をクリックしてください。粒子比透磁率(50)を指定し、「磁気泳動力」をクリックしてください。 「計算」をクリックしてください。
- 選択した領域に堆積させる方法を多くの粒子検索するには、「結果」、「1Dプロットグループ」と「プロット」をクリックします。ジオメトリに入る粒子の量を特定の領域に堆積した粒子の量の比率としての堆積速度を計算します。
- 磁石の強さを調整するには、「モデル1」、その後「磁場」をクリックしてください。 「磁束の保全」を選択し、「磁化」の下に磁石の強さを変更します。 1×10 4 A / mで増加により、磁石の強さを高め、「計算」をクリックします。
- 適切な磁石の配置は、嗅覚領域に対する効果的な薬物送達のために得られるまで、この手順を繰り返します。
- 2-D理想化鼻モデルでテスト
- 3磁石鼻上記1ミリメートルを置くことによって2次元鼻のモデルに3.1で得られた磁性強みを適用します。磁石のサイズと位置を指定するには、「モデル1」、「ジオメトリ1」をクリックしてください。左の鼻孔に3000粒子を解放するために「モデル1」、「流体の流れのための粒子追跡」、「入口」をクリックしてください。 15ミクロンとして粒子サイズを指定するには、「粒子のプロパティ」をクリックしてください。
- 3.1.2に記載されているのと同様の手順を実行することで、粒子軌跡とその後の嗅覚配信効率をシミュレートします。
- 嗅覚送達効率を改善するために、磁石のレイアウト及び強度を調整します。磁石のサイズと位置を調整するには、「モデル1」、それから「ジオメトリ1」をクリックしてください。 、関心の磁石を選択し、幅、奥行き、高さまたはX、Y、Zの値を変更します。磁石の強さを調整するために3.1.5に従ってください。
- 3-D解剖学的に正確な鼻のモデルでテスト
- インプ磁性粒子トラッキングソフトウェアに3-D鼻腔モデルをORT。手順3.2.1に従って、1ミリメートルの鼻の上に4つの磁石を入れて、一つだけ選択した点から、直径15ミクロンの3000粒子を放出します。
- 3.2.3 - 粒子軌跡を追跡し、3.2.1に記載されているのと同様の手順を実行することで、嗅覚の配信効率を計算するために、磁性粒子トラッキングソフトウェアを使用してください。
- 3.2.3以下、嗅覚領域への標的化送達を改善するために3Dモデルに磁石のレイアウト及び強度を調整します。
- 嗅覚の領域に最適な磁気泳動指導のための右の粒子サイズを見つけるために、30ミクロン - 1の範囲のテスト粒子サイズ。
結果
コントロールケース:
図3に、標準的な鼻のデバイスと鼻気道内の気流場と粒子堆積。これは明らかに、フロント鼻孔からの気流が鼻床( 図3A)に向けられているバック鼻孔から上の通路とエアフローに換気されていることを示しています。エアロゾル粒子は、平均流れ方向にエアロゾル前面を形成する、壁近くメジアン通路と遅くに速く移動することが観察されています。エアロゾル粒子は、通常の呼吸条件(20 L /分)( 図3B)の下で鼻孔を入力した後0.03秒に0.02で嗅覚領域に到達することができます。上部の鼻(優れた道)で非常に少数の粒子(0.22%)預金;さらに少ない粒子(0.007パーセント)は、最上位の嗅粘膜( 図3C)に達します。堆積の広い範囲で示されるように非常に不均一堆積パターンは、予測されました図3Cの増強因子(DEF)。ここでDEF、ローカル粒子蓄積のレベルを示し、鼻24の地域平均堆積速度を超える局所堆積速度の比として計算されます。本研究では数値モデルにも匹敵する、鼻気道レプリカで得られた実験データに照らして検証しました。良い一致を数値予測と実験測定( 図3D)との間で達成されました。
パッシブコントロールI:前庭挿管
前庭挿管プロトコルのシミュレーション結果が図4に示されている。表裏挿管の場合の両方の場合、ノズル( 図4A)のすぐ下流に強力なジェット効果があります。粒子が正面玄関であろう可能性が高い預金私の中に放出することを期待されています他の領域よりも嗅覚領域をn個。バック挿管場合を考えると、メインフローは、ジェット効果( 図4B)によって誘発される真空によって下方に吸引されます。予想されるように、より多くの薬物粒子がバックプロトコルと比較してフロント挿管プロトコルに嗅覚部位に送達されます。また、より焦点を絞った堆積は、フロントのリリースと嗅覚領域で観察されます。最大DEF値は約戻ってリリースの2.5倍です。
図4Cから、堆積速度の差が3例(コントロール、フロント、バック)の間で軽微であります。しかし、劇的な違いは約2倍のバックリリースケースと10倍の制御例ことを、有意に高い嗅覚用量を与えるフロントリリースと嗅覚沈着に存在します。
パッシブコントロールII:異なる呼吸マニューバディープ挿管
このプロトコルでは、スプレーノズルは、嗅粘膜の近くに挿入しました。この位置決めが正常に鼻バルブ、鼻の主要な流れ領域制限をバイパスします。三つの呼吸条件(吸入、呼吸停止、および呼気)は嗅覚薬物送達上のそれらの影響について考慮されました。通常の呼吸速度(20L /分)吸入および呼気の状態の両方で使用されました。濃縮された嗅覚堆積( 図5A)で表示されるように3つの呼吸条件の中で、吸入は最高用量を与えました。これとは対照的に、両方の息止め及び呼気条件がフォーカスされた堆積物の生成に失敗しました。気流の小さな部分だけが魔女ながら嗅覚領域に進み、拡散蒸着パターンの手がかりは、 図5(b)&(c)に示す鼻の空気力学で得ることができますキュリティは、いずれかの肺( 図5B)、または終了に周囲の空気( 図5C)に下方に移動します。具体的には、呼気場合の粒子は、明白な堆積ホットスポットで鼻腔全体に分散されています。その代わりに、吸入ケースのために、高DEFの値が甲介地域で観察された低DEF値で、唯一の嗅覚領域に制限されています。他の領域での副作用を最小限に抑えつつ、標的嗅覚領域における治療結果を最大にするように、これは、理想的な堆積パターンです。
(前庭対深挿管)は、2つの配信方法との間の性能はさらに、図5Dにおける単位面積(%/ cm 2)をあたりの堆積速度の関数として比較しました。嗅覚領域の面積は、この研究6.8 cm 2でした。単位面積当たりのより高い嗅覚の投与量は、Cの深い挿管で配信されました前庭挿管にomparison。具体的には、吸入条件の下で深い挿管は、最初のプロトコルで推奨正面玄関のリリースに比べて2.5倍高い用量を送達しました。堆積投与量がまだ脳脊髄液に入る前に、嗅上皮を横切って拡散する必要があることに留意すべきです。
アクティブコントロール:磁気泳動ガイダンス
ベースライン磁石のレイアウトを見つける作業磁石強度、理想的な2-Dの鼻のモデルを見つけるために、2つのプレートのチャネル、およびイメージベースの3次元鼻モデル:三ジオメトリは、活性粒子制御の数値実験で使用しました性能をテストし、磁気泳動誘導プロトコルの動作パラメータを調整します。 図6Aは、2つのプレートのチャネルで2つの試験のシミュレーション結果を示しています。最初の試験では、我々は目をテスト粒子が落下するのではなく、水平方向に移動できるように、重力に対抗する磁気泳動力を用いて粒子の動きを制御する電子の可能性。この目的のために、我々は、チャネル( 図6Aの上パネル)の上部にある3つの磁石を適用しました。結果として生じる磁界は、底板に上部プレートに強く、弱かったです。強磁性粒子は重力に逆らって行動し、より強い磁場に上向きに魅了されました。すべての3つの磁石が1×10 5 A /メートルの体積磁化を有しており、所定の粒径は15μmであった場合には、磁気泳動力は、チャネル( 図6Aの上パネル)の中心線で重力と平衡状態にありました。
二審は、より強力な磁石が( 図6Aの下部パネル)を適用した場合、粒子軌跡がどのように変化するかをテストしました。この試験では、左側の二つの磁石は、KEPました1×10 5 A / mにおけるトン、右の磁石が1×10 6 A / mまで増加しました。磁界が右側にずっと強かったので、チャンネルの左半分を通過した全ての粒子が上向き彼らの方向を向いて第三の磁石の近傍に堆積します。この試験は、磁気泳動力が十分に強力であった場合、粒子の運動は、標的部位に到達するように操作することができることを実証しました。
磁気泳動ガイダンスのパフォーマンスは、さらに理想的な2次元鼻モデルで評価しました。磁石の一方の列が嗅覚領域へ上向きに強磁性粒子を引き付けるために、鼻気道の上部に塗布した。 図4Cは、異なる磁石配置で鼻孔の先端の一点からの粒子を放出した後の粒子の輸送及び堆積を示します。粒子軌跡が原因で存在に上向きに外れることが示されています鼻( 図6B)上記磁石の。さらに、適切な磁石の強さ(ケース3で1×10 6 A / m)で、嗅覚地域のこの時点預金から磁気泳動駆動型粒子の大部分(〜92%)を持ちます。これとは対照的に、不十分な磁界はあまり顕著で、磁気応答性(ケース1&2)が得られます。嗅覚領域に磁石が存在しない場合、ほぼ無粒子の堆積物中の粒子は嗅部( 図6B)によって通過するにもかかわらず。
磁気泳動指導の下で3-D鼻モデルのシミュレーション結果が図7に示されている2-D鼻モデルで得られたパラメータの後、体積磁化1×10 6 A / mの磁石は、最初に使用しました。しかし、この最初の試験では嗅覚配信はトンを逆におそらく不十分な上向きの磁気泳動力に、有望な結果を示しませんでした彼は動きを粒子。効果的な嗅覚の配達のための適切な磁石の強さを特定するには、ボリュームの磁化の様々な漸進的に1×10 5 A /メートルの増分によって1×10 6 A /メートルから増加させることにより試験しました。これは、7.1×10 7 A / mで、嗅覚領域に堆積投与される粒子の約33%、及び8.1×10 7 A /嗅覚におけるM、約45%のデポジットを増加によって最大磁化を増加させることによりことが観察されました領域。磁石の強さだけでなく、得られた粒子軌跡などの推奨される磁石のレイアウトは、 図7Aに示されています。
推奨される磁石の配置を有する3次元鼻モデルで予測された嗅覚投与量は図7Bに示されています。 2次元の場合と同様に、磁気泳動ガイダンスが大幅に嗅覚投与量を向上させ、その時点-リリースはconventioに優れています全体の鼻孔からの最終リリース。適切な磁気泳動指導で、配信嗅覚用量は磁気泳動ガイダンス( 図7B対< 図3で0.1%で45%)なしに比べて大きさ以上の1あるいは2注文することができます。 図7Bはまた、3の変化を示していますキャリア液滴サイズの関数として-D嗅覚用量。 Dのため無視できる嗅覚堆積は「P <10ミクロンまたはd 'P'>20μmであり、後者は前方鼻に高い慣性損失に起因している前者は、微弱な磁気応答性に起因しています。 15ミクロンのメジアン径と、17ミクロン - 最適な嗅覚堆積は13の範囲内のエアロゾルから来ています。

その図1.ヒトの鼻のモデルと嗅部鼻腔の最上部に位置しています。鼻の複雑な構造は、標準的な鼻のデバイスと嗅覚地域への効果的な薬物送達を防ぐことができます。堆積分布を研究するために、MRIベースのノーズモデルが異なるセクションに分割しました。 LP:下側通路、UP:上通路、MM:中鼻道、SM:優れた道、OR:嗅部。 この図の拡大版をご覧になるにはこちらをクリックしてください。
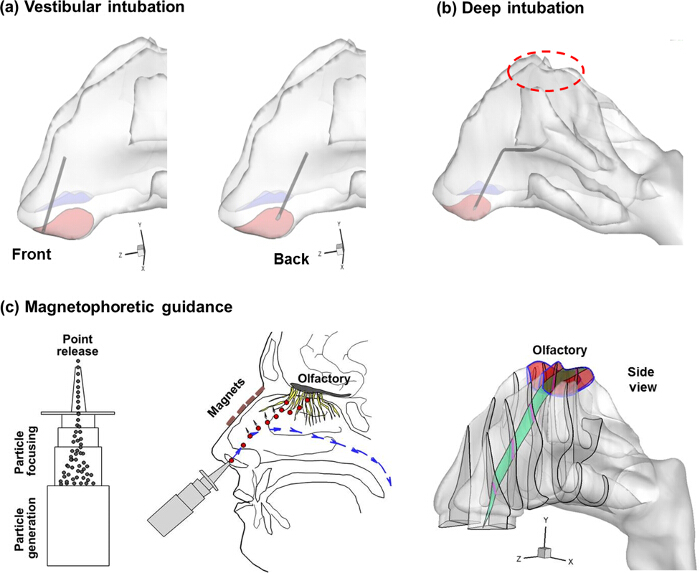
図2. 三つの嗅覚配信プロトコル。(A)前庭挿管(B)深い挿管、および(C)強磁性粒子の磁気泳動指導。最適な嗅覚薬物送達のために、粒子が鼻パスの中央平面に沿って移動すべきです年齢。 この図の拡大版をご覧になるにはこちらをクリックしてください。

。。 図3. コントロールケース (A)気流流線と様々な瞬間に粒子の運動の(B)スナップショット(C)蒸着パターン前方の鼻の中に高い粒子の蓄積で、 非常に不均一であり、(D)は、良好な合意が間に達成され、数値的に予測し、実験測定。 NP:上咽頭この図の拡大版をご覧になるにはこちらをクリックしてください。
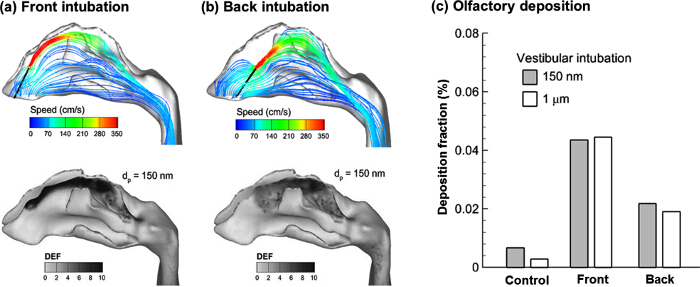
前庭挿管プロトコル図 4. エアフロー合理化と粒子の堆積。(A)フロント挿管(B)バック挿管。嗅覚用量の比較は、150 nmおよび1μmの粒子のための(C)に示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
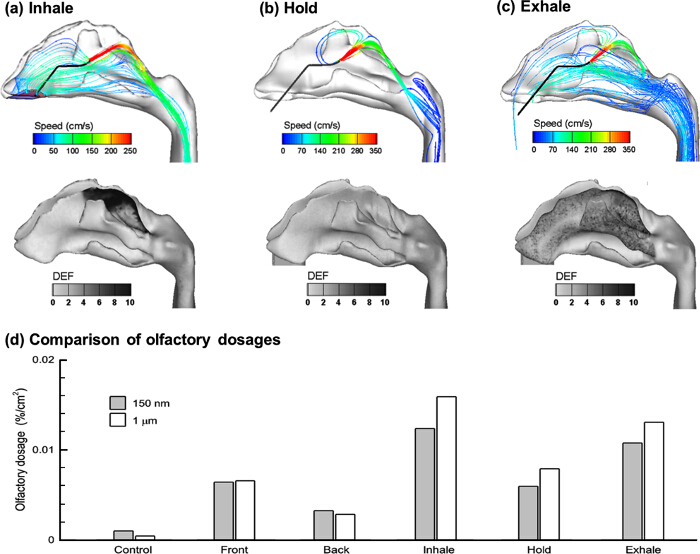
図5. エアフローを合理化し、三つの呼吸条件の下で深い挿管と粒子沈着。 (A)吸入(B)息止め、及び(C)呼気。異なるプロトコル間で正規化された嗅覚用量(1cm 2当たりの質量分率)の比較は、(D)に示されています。S / ftp_upload / 53902 / 53902fig5large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

図6 磁場と (A)は、2つのプレートのチャネル及び(B) における粒子軌道理想的な2次元鼻モデル。磁石の近傍にある暗い色はより強い磁場を表している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
(A)磁石のレイアウトと粒子軌跡、およびoの(B)バリエーション:3-Dノーズモデル図 7. Magnetophoretcガイダンス粒子サイズの関数としてlfactory投与量。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
結合された画像CFD方法は、画像ベースのモデルの開発、品質噛み合い、気流シミュレーション、および磁性粒子追跡を組み込ま本研究で提示されました。複数のソフトウェア・モジュールは、医用画像、再構成/解剖学的に正確な気道モデルの噛み合い、及びフロー粒子シミュレーションの分割の機能が含まれ、この目的に実施されました。この数値的方法を使用して、3つの鼻腔内送達プロトコルの性能を試験し、比較しました。 インビトロ実験と比較して、この方法は、コストと時間でより効率的です。従って数値試験の多くは、最適な配信プロトコル25,26を同定するために実施することができます。具体的には、結合された画像CFD法により前部鼻内薬物損失を低減し、標的への薬剤投与量を増加させるの深い洞察を提供し、薬物粒子の挙動と運命に関する詳細情報を生成します。また、結合された画像CFD本研究で開発された方法は、容易にそのような副鼻腔24と他の領域への鼻腔内薬物送達のために修飾することができます。次の2つの手順以外のプロトコルで概説したように同様の手順に従うことができます。 (1)2.1.3で事前定義された関心領域は、プロトコル1.4に従うことによって達成することができる洞に変更されるべきです。 (2)磁石構成と強度の範囲は、副鼻腔薬物送達のために調整する必要があります。洞への鼻孔からの薬物粒子の経路は、鼻孔からの嗅覚へのものとは大幅に異なっています。粒子は、予め定義されたパスに従うように導くことができるように、磁場は、それに応じて変更する必要があります。このタスクは、プロトコル3.2.1に従うことによって達成することができます。
この画像CFD法による嗅覚薬物送達をモデル化における2つの重要なステップがあります。まず、画像ベースの鼻のモデルを開発することは、フローパーティクル・シミュレーションソフトウェアに許容されるその( 例えば 、流暢およびCOMSOL)まだ課題のまま残されています。これは、現在の鼻モデル(プロトコル1.3)の表面形状を再構築するために60以上の時間を要しました。第二に、シミュレーション結果は、磁性粒子は、磁場と粒子放出位置に非常に敏感であることを示しています。磁石のレイアウトの広範なテストは、最適な配信設計(プロトコル3.2.3および3.3.2)に到達する前に必要とされます。
3つ全ての薬物送達プロトコルが改善さ嗅覚用量を与えると予測されました。しかし、改善の3つの方法の間で異なっていました。 2つのパッシブ制御プロトコル(前庭と深い挿管)が鼻の中に他の地域に重大な薬物損失を発生させることなく、十分なCNSの投与量を達成するには不十分で表示されます。でも、最適なパッシブ制御プロトコル(吸入条件下で、すなわち 、深い挿管)のために、嗅覚の投与量は依然として低すぎる(<0.1%)が直接鼻から脳への送達の目的のために実際には必要になります。アクティブ続き鼻腔内薬物粒子のrolsが不可欠です。この研究の限界は、定常流れの仮定、剛性気道壁、唯一の数値モデリング、および1鼻気道ジオメトリの使用を含みます。したがって、この研究の結果は、間主観的変動を考慮することはできません。別の人への薬物送達のために、本明細書で提案された設計は、より低い性能を有することが期待されます。その特定の患者に最適な送達を達成するために、パーソナライズされたデザインは、患者の鼻の形状に基づいて処方されるべきです。
提案された嗅覚配信プロトコルは、直接鼻から脳への薬物送達における重要な意味を持ちます。標準鼻デバイスは、アルツハイマー病および脳腫瘍1,9などのCNS 障害を治療するための多くの新しい遺伝子操作薬物の使用を未然た嗅覚領域に非常に低用量(<1%)を配信します。提案された磁気泳動嗅覚配信がdelivに有望ですER臨床的に有意な嗅覚領域への投与量とは、血液脳関門をバイパスする非侵襲的な実用的な方法を提供します。この送達システムは、容易に異なるノーズモデルにおいて、または異なる物理的特性を有する薬物のために、例えば副鼻腔のような鼻の他の領域に薬物を送達するために適合させることができます。
開示事項
作者はこの仕事に興味の競合を報告しません。
謝辞
この研究は、中央ミシガン大学の革新的な研究助成P421071と初期のキャリアグラントP622911によって賄われていました。
資料
| Name | Company | Catalog Number | Comments |
| MIMICS 13 | Materialise Inc, Ann Arbor, MI | MR image segmentation | |
| Gambit | ANSYS Inc, Canonsburg, PA | Model development | |
| ANSYS ICEMCFD | ANSYS Inc, Canonsburg, PA | Meshing | |
| ANSYS Fluent | ANSYS Inc, Canonsburg, PA | Fluid and particle simulation | |
| COMSOL Multiphsics | COMSOL Inc, Burlington, MA | Magnetic particle tracing |
参考文献
- Mistry, A., Stolnik, S., Illum, L. Nanoparticles for direct nose-to-brain delivery of drugs. Int. J. Pharm. 379 (1), 146-157 (2009).
- Alam, S., et al. Development and evaluation of thymoquinone-encapsulated chitosan nanoparticles for nose-to-brain targeting: a pharmacoscintigraphic study. Int. J. Nanomedicine. 7 (11), 5705-5718 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Laminar airflow and nanoparticle or vapor deposition in a human nasal cavity model. J. Biomech. Eng. 128 (5), 697-706 (2006).
- Si, X., Xi, J., Kim, J., Zhou, Y., Zhong, H. Modeling of release position and ventilation effects on olfactory aerosol drug delivery. Respir. Physiol. Neurobiol. 186 (1), 22-32 (2013).
- Si, X., Xi, J., Kim, J. Effect of laryngopharyngeal anatomy on expiratory airflow and submicrometer particle deposition in human extrathoracic airways. Open J. Fluid D. 3 (4), 286-301 (2013).
- Xi, J., Longest, P. W. Numerical predictions of submicrometer aerosol deposition in the nasal cavity using a novel drift flux approach. Int. J. Heat Mass Transfer. 51 (23), 5562-5577 (2008).
- Illum, L. Nasal drug delivery: new developments and strategies. Drug Discov. Today. 7 (23), 1184-1189 (2002).
- El Taoum, K. K., Xi, J., Kim, J. W., Berlinski, A. In vitro evaluation of aerosols delivered via the nasal route. Respir. Care. 60 (7), 1015-1025 (2015).
- Misra, A., Kher, G. Drug delivery systems from nose to brain. Curr. Pharm. Biotechnol. 13 (12), 2355-2379 (2012).
- Hoekman, J. D., Ho, R. J. Y. Effects of Localized Hydrophilic Mannitol and Hydrophobic Nelfinavir Administration Targeted to Olfactory Epithelium on Brain Distribution. Aaps Pharmscitech. 12 (2), 534-543 (2011).
- Corley, R. A., et al. Comparative Computational Modeling of Airflows and Vapor Dosimetry in the Respiratory Tracts of Rat, Monkey, and Human. Toxicol. Sci. 128 (2), 500-516 (2012).
- Shi, H., Kleinstreuer, C., Zhang, Z. Modeling of inertial particle transport and deposition in human nasal cavities with wall roughness. J. Aerosol Sci. 38 (4), 398-419 (2007).
- Kleinstreuer, C., Zhang, Z., Donohue, J. F. Targeted drug-aerosol delivery in human respiratory system. Annu. Rev. Biomed. Eng. 10 (4), 195-220 (2008).
- Kleinstreuer, C., Zhang, Z., Li, Z., Roberts, W. L., Rojas, C. A new methodology for targeting drug-aerosols in the human respiratory system. Int. J. Heat Mass Transfer. 51 (23), 5578-5589 (2008).
- Wilson, I. B. The deposition of charged particles in tubes, with reference to the retention of therapeutic aerosols in the human lung. J. Colloid Sci. 2 (2), 271-276 (1947).
- Wong, J., Chan, H. -. K., Kwok, P. C. L. Electrostatics in pharmaceutical aerosols for inhalation. Ther Deliv. 4 (8), 981-1002 (2013).
- Bailey, A. G. The inhalation and deposition of charged particles within the human lung. Journal of Electrostatics. 42 (1), 25-32 (1997).
- Xi, J., Si, X. A., Gaide, R. Electrophoretic particle guidance significantly enhances olfactory drug delivery: a feasibility study. PLoS ONE. 9 (1), e86593 (2014).
- Martin, A., Finlay, W. Alignment of magnetite-loaded high aspect ratio aerosol drug particles with magnetic fields. Aerosol Sci. Technol. 42 (4), 295-298 (2008).
- Dames, P., et al. Targeted delivery of magnetic aerosol droplets to the lung. Nature Nanotechnology. 2 (8), 495-499 (2007).
- Xi, J., Longest, P. W. Transport and deposition of micro-aerosols in realistic and simplified models of the oral airway. Ann. Biomed. Eng. 35 (4), 560-581 (2007).
- Longest, P. W., Xi, J. Effectiveness of direct Lagrangian tracking models for simulating nanoparticle deposition in the upper airways. Aerosol Sci. Technol. 41 (4), 380-397 (2007).
- Xi, J., Zhang, Z., Si, X. A., Yang, J., Deng, W. Optimization of magnetophoretic-guided drug delivery to the olfactory region in a human nose model. Biomech. Model. Mechanobiol. In. , (2015).
- Longest, P. W., Hindle, M., Das Choudhuri, S., Xi, J. X. Comparison of ambient and spray aerosol deposition in a standard induction port and more realistic mouth-throat geometry. J. Aerosol Sci. 39 (7), 572-591 (2008).
- Xi, J., et al. Design and Testing of Electric-Guided Delivery of Charged Particles to the Olfactory Region: Experimental and Numerical Studies. Curr. Drug Deliv. 13 (9), 1-15 (2015).
- Zhou, Y., Guo, M., Xi, J., Irshad, H., Cheng, Y. -. S. Nasal deposition in infants and children. Journal of aerosol medicine and pulmonary drug delivery. 27 (2), 110-116 (2014).
- Xi, J., Yuan, J. E., Si, X. A., Hasbany, J. Numerical optimization of targeted delivery of charged nanoparticles to the ostiomeatal complex for treatment of rhinosinusitis. Int. J. Nanomedicine. 10 (7), 4847-4861 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved