Method Article
フロースルーマイクロリアクターとMS検出のためのタンパク質の高速酵素処理
要約
A quick protocol for proteolytic digestion with an in-house built flow-through tryptic microreactor coupled to an electrospray ionization (ESI) mass spectrometer is presented. The fabrication of the microreactor, the experimental setup and the data acquisition process are described.
要約
質量分析(MS)の大部分は、タンパク質分析方法は、典型的にはトリプシン、検出前に酵素消化工程を含むベース。この工程は、質量分析計測器の有効走査範囲内MW <3,000-4,000ダで一般に、低分子量ペプチドの生成のために必要です。従来のプロトコルは、37ºCでO / N酵素消化を伴います。最近の進歩は、典型的には、例えば 、マイクロ波または高固定化酵素または数分にタンパク質分解消化に必要な時間を短縮する相補的な物理的プロセス(の範囲のマイクロリアクターの使用を含む様々な戦略の開発につながっています圧力)。この研究では、タンパク質の迅速な酵素消化を達成するための任意の実験室で実施することができる簡単で費用効果的なアプローチを記載します。タンパク質(またはタンパク質の混合物)は、C18結合逆相高速PERFに吸着されていますキャピラリーカラムにプリロード液体クロマトグラフィー(HPLC)、シリカ粒子をormance、そして水性緩衝液中のトリプシンを短時間で粒子上に注入されます。オンラインのMS検出を有効にするには、トリプシンペプチドは、MSイオン源で直接増加有機含有量の溶媒系で溶出されています。このアプローチは、高価な固定化酵素粒子の使用を回避し、プロセスを完了するための任意の援助を必要としません。タンパク質消化および完全なサンプルの分析は、それぞれ、2〜3分と約30分未満で達成することができます。
概要
精製タンパク質の同定および特徴付けは、しばしばMS技術を使用することによって達成されます。タンパク質が酵素で消化され、そのペプチドは、さらに単純な注入実験を用いてMSによって分析します。タンパク質分解性消化は、ほとんどのMS分析器の有用な質量範囲に小さいペプチド断片を生成するために必要であり、それは容易に、アミノ酸配列情報を生成する低エネルギー衝突誘起解離を介して断片化することができます。単離されたタンパク質または単純なタンパク質混合物のために、MS検出の前に、ペプチドのクロマトグラフ分離のための更なる必要はありません。 25-50ペプチドの混合物は、容易にMSのイオン源に直接シリンジポンプを用いてサンプルを注入することによって分析することができます。
質量分析計は、分析を実行し、短い時間枠内でタンパク質の配列を確認することができます。現代のデータ取得方法と、この方法は、wを実現することができます数分あるいは秒をithin。短い時間スケールで全体のプロセスを完了するの制限要因は、タンパク質分解消化ステップです。 (50-100)の酵素比:一般的に、これは、基板を使用して、37ºCでは、溶液中で、数時間(またはO / N)を介して実行される1。分または秒に酵素消化時間を短縮するために、固定化酵素マイクロリアクタ、マイクロ流体リアクターまたは市販のカートリッジの形で記載されている。1-6一般的に、酵素は、共有結合、非共有結合的/物理吸着、錯体によって固定されています形成またはカプセル化、大規模な対体積表面と酵素-基板の比率によって有効にされている酵素プロセスの3,6効率化。固定化された反応器のさらなる利点は、MS分析における酵素の自己消化との干渉を低減した酵素安定性および再利用性を向上させることを含みます。様々なアプローチ、ガラスを使用して、またはポリマーの微細加工装置が記載されており、抗体-抗原相互作用によって磁気ビーズ上に固定化酵素を使用して、7,8 9 は 、チタニア-アルミナゾル-ゲル10とnanozeolites 11の中に封入又はNi-NTAまたはHisタグ複合体形成を介して捕捉され、金ナノ粒子のネットワーク中に取り込ま。6あるいは固定化酵素を用いたオープン管状キャピラリーは同様に、開発されてきた。12また、強化されたタンパク質分解的切断が30-120に反応時間を減少させるために制御マイクロ波照射13または圧力補助または圧力循環技術(PCT)を使用して実証されています分。14
固定化酵素リアクターの複数の利点にもかかわらず、商業的なカートリッジのコストが高く、日常的な使用のためのマイクロ流体デバイスの利用可能性は制限され、そして追加の計測のために必要とするマイクロ波またはPCT技術の結果を使用します。この作業の目的は、circumve方法を開発することでしたこれらの欠点をNTS、それは容易に分以内MS分析のための調製物中のタンパク質の酵素的切断を行うための簡単かつ効果的なアプローチの研究に力を与えるために、すべての実験室で実施することができます。アプローチは、疎水性、キャピラリーまたはマイクロ流体デバイスにあらかじめロードされているC18-粒子、及び以上の酵素の注入の間に酵素消化に続いて、これらの粒子上の目的のタンパク質の吸着の使用に依存しています充填床と撮影したタンパク質(複数可)。このアプローチでは、基板は、非共有結合相互作用を介して固定化され、酵素を固定化されたタンパク質上に注入されます。タンパク質分解消化効率は、酵素処理、還元および粒子の表面からの距離と拡散時間の蛋白質を露出大きな粒子表面積増加物質移動、酵素の活性に影響を与える可能性がない共有結合、能力を向上させることが迅速にevaluat異なる酵素、廃棄、および多重化の電子の組み合わせ処理は、マイクロ流体形式で実行された場合。このアプローチは、標準的なタンパク質およびESI-MS検出の前にタンパク質分解消化のためのトリプシン最も一般的に使用される酵素の混合物を使用して実証されています。この研究において検出のために使用される質量分析計は、線形トラップ四重極(LTQ)装置でした。
プロトコル
キャピラリーマイクロリアクターの調製
- 100μmの内径(ID)が360μmの外径(OD)7〜8センチメートルの長さに毛細血管、およびガラスキャピラリー包丁で3〜5センチメートル〜20μmでID×90ミクロンのODキャピラリーをxはカット。任意の突出バリなし、両方のキャピラリー端がきれい、ストレートカットを持って、顕微鏡下で確認してください。
- 〜6mmの長さのために、100μmのIDのx 360μmの外径キャピラリーの一端には20μmID×90ミクロンのODキャピラリを挿入します。必要な場合には、顕微鏡下でこの動作を観察します。
- Q-チップの先端と90μmのOD / 100μmのIDを毛細血管の接合の周りに接着剤E6000の小滴を適用し、室温で接着剤の硬化O / Nをしましょう。
- 10~15ミリの長さまで挿入さ20μmID×90ミクロンのODキャピラリーをカット。これは、エレクトロスプレーイオン化エミッタとなります。
- 1/32 "OD PEEK、1/16" OD PEEKと1/16 "OD PTFE浴槽カット済み長さ4-5センチの作品でる。これらは、漏れのない接続を提供するためのキャピラリー組合で使用袖になります。
- PEEK組合に100μmのIDのx 360μmの外径キャピラリーの反対側の端を接続します。漏れのない接続を提供するための1/32 "PEEKスリーブを使用します。
- 挿入/労働組合の反対側の端に〜の片5 cmの長さ1/16 "PTFEチューブを締めます。
- C18の約4 mgの(5μm)と粒子が予備洗浄乾燥/ 2mLのガラスバイアルで計量します。 、0.5ミリリットルのイソプロパノールを追加バイアルを閉じ、超音波処理槽内のスラリーを分散させます。
- 250μlの注射器で撤退約200μlのスラリー、PEEK組合の1/16 "PTFEチューブに注射針を挿入し、100ミクロンのIDのx 360μmの外径キャピラリーにゆっくりスラリーを分配;のように顕微鏡下で観察しますこれは、マイクロリアクター( 図1)となります20μ; 2-3ミリメートルパッキングの長さが達成されるまで、毛細管は粒子で満たさm個のIDキャピラリーは、キーストーン効果によりマイクロリアクター中の粒子を保持している。15
- H 2 O / CH 3 CN 50:50 V / Vの50μlの溶液を〜とマイクロリアクターをすすぎ、その後、H 2 O / CH 3 CN 98の50μlのソリューション〜と:2(v / v)です。
サンプル溶液の調製
注:有機溶媒および酸の取り扱いを伴う操作および溶液調製をヒュームフード内で行われるべきです。ゴーグル、手袋、防護服を着用してください。
- CH 3 OHで洗浄し、いくつかのガラスバイアル(4ミリリットル)とポリプロピレンチューブ(15ミリリットル)を乾燥させます。
- 200μlのCH 3 CN 9.8 mlのH 2 Oを混合して15mlのポリプロピレンチューブ中で、H 2 O / CH 3 CN(2 V / V 98)の溶液10mlを調製超音波処理によって混ぜます。
- 溶液10mlを調製し、H 2 O / CH 3 CN(50:50 v / v)の15mlのポリプロピレンチューブ中の5mLのH 2を混合して</サブ> Oと5ミリリットルのCH 3 CN;超音波処理によって混ぜます。
- 4 mLのH 2 O / CH 3 CNに4μlのTFA(10%)を加えることにより酸性化した水性溶液4ml(TFA 0.01%V / V)を調製する:4 mLのガラスバイアル中(98 2 V / V)超音波処理によって混ぜます。
- 4 mLのガラスバイアルに4 mLのH 2 O / CH 3 CN(50:50 v / v)に4μlのTFA(10%)を加えることにより酸性化し、有機溶液4ml(TFA 0.01%V / V)を調製します。超音波処理によって混ぜます。
- 16 mgのNH 4 HCO 3を計量 4ミリリットルのガラスバイアルにおける分析天秤を持ちます。 (2 V / V 98)溶液を超音波処理によって分散させる; H 2 Oを4ml / CH 3 CNを加えますこれは、水性緩衝液中のNH 4 HCO 3(pH約7.8)の50 mM溶液をもたらします。
- 4ミリリットルのガラスバイアルにおける分析天秤で、標準的なタンパク質( 例えば 、ウシ血清アルブミン、ヘモグロビンα/β、チトクロームC、炭酸脱水酵素、α-2-HS糖タンパク質、)5mgを計量します。 4ミリリットルのDIウォートを追加rと超音波処理により分散させます。これは、典型的には、高μMレベルの濃度の溶液をもたらします。
- NH 4 HCO 3(50 mM)の水性緩衝液の適切な量で高μMレベルの濃度の溶液を希釈することにより1ミリリットルタンパク質溶液(1-2μM)を準備。超音波処理によって混ぜます。
- NH 4 HCO 3(50 mM)の水性緩衝液μlの170で20μgのシーケンシンググレードのトリプシンを溶解することによりトリプシン溶液(5μM)を準備。超音波処理によって分散させます。
3.実験のセットアップ
注:LTQ-MSシステムは、様々なサンプル入力アプローチに質量分析計のインターフェースを可能に自作XYZステージを含んで修正されたESI源が装備されています。
- PEEK組合から毛細管マイクロリアクターを外し、PEEKティーに接続します。
- PEEKティーのサイドアームに約2センチPt線を挿入します。提供するための1/32 "PEEKスリーブを使用漏れのない接続とPt線を絶縁するため。
- 50ミクロンのIDのx 360μmの外径(〜0.5メートルの長さ)サンプル移送毛細管は、PEEKティーの反対側の端部に接続します。漏れのない接続を提供するための1/32 "PEEKスリーブを使用します。
- XYZステージ上PEEKティーを確保し、離れて質量分析計の入口キャピラリーから〜2ミリメートルESIエミッタを配置します。
- 質量分析計のESIの電力供給源に白金線を接続します。
- ステンレス鋼の組合へのサンプル移送毛細管の反対側の端を接続します。漏れのない接続を提供するための1/16 "PEEKスリーブを使用します。
- 、ポンプをオンにして所望の値に流量を設定する( 例えば 、ステンレス鋼労働組合の反対側の端部4〜5 cmの長さ1/16 "PTFEチューブを接続し、PTFEチューブ内の250μlの注射針を挿入2μL/分)。
- MS機器ANを制御するソフトウェアパッケージに入力タンデムMSデータ収集パラメータ分析を行うための準備セットアップにメソッドファイルとして保存しますdは、 LTQ-MSシステムのために、以下のデータ依存解析パラメータを使用します。除外質量幅180秒間有効ダイナミック除外を1.5メートル/ zの±; 1 MSは、トップ5最も強いピークに1ズームとMS 2のスキャンに続いてスキャンし、スキャン幅±5のm / zをズーム。衝突誘起解離分離幅3メートル/ zの、正規化衝突エネルギー35%、活性化Q 0.25、および活性化時間30ミリ秒に設定(CID)パラメータ。
4.マイクロ流体セットアップ
- (1)マイクロリアクターからなる、デバイスの16-18レイアウトは、 図2Aに設けられている。(0.13ミリメートル幅×2ミリの長さ×50ミクロンの深)の入口に接続された(2;ガラスまたはポリマー基板からマイクロ流体デバイスを準備します)、出口(3)およびサイドポート(4)。流体操作のための相互接続チャネルである〜110ミクロン、幅〜50μmの深いです。マルチチャネル構造は、(5)、からなる〜1.5〜2ミクロンの深×10ミクロン幅×置か100μmの長いマイクロチャネル25ミクロン離れて、マイクロリアクター中の粒子を保持するためのフィルタとして機能します。
- 入口ポートに専用コネクタを接着することによって、または流体送達( 図2B)用の金具を収容したポリマースタンドを工夫することにより、チップへの流体送達接続を有効にします。16
- ステップ1.8で説明したようにC18粒子(5ミクロン)のスラリーを準備します。チップ側ポートに接続された1/16 "PTFEチューブ(4)を用いて注射器でマイクロリアクターにスラリーを送達; 90ºCのオーブン中で1時間、エポキシ接着剤と硬化と、粒子のロード後にポートをシール16。
- 、出口ポートにキャピラリー(20μmのID×90μmの外径×10ミリの長さ)を挿入E6000接着剤で封止し、そしてキュアO / Nをしましょう。これは、(ESIエミッターとなります 6)。
- 50μmのIDのx 360μmの外径(〜0.5メートルの長さ)サンプル移送キャピラリーはチップ入口ポート(2)に接続します。 3.6から3.7に記載されているように、250μlのシリンジとシリンジポンプにキャピラリーの反対側の端を接続します。
- 直前の入口ポートへのサンプル移送ライン(2)上の軽量PEEKティーコネクタを配置し、3.2で説明したように、ティーのサイドアームにPt線を挿入します。これは、ESI電極となります。
- 質量分析計の入口キャピラリーから〜2ミリメートル離れて配置さESIエミッタとXYZステージ上にマイクロ流体デバイスを固定します。 3.8で説明したように、分析のためのMSを準備します。
5.サンプルのロード、MS分析のためのタンパク質分解消化および溶出
注:すべての溶液/試料移送ステップは、シリンジポンプの助けを借りて行われ、完了するためにいくつかの追加分を可能にすべきである、デッドvolumを補償するために、マイクロリアクターへとからの転送ラインに関連したエス。必要な時間は、関与の流量に依存します。
- 5分間2μL/ minで:(2 V / V 98)、マイクロリアクターを洗浄し、分析の準備をし、H 2 O中のNH 4 HCO 3(50ミリモル)の水溶液を注入することによって/ CH 3 CN 250μlの注射器を使用しています。
- 5分間、2μL/分で試料溶液を注入することによりマイクロリアクターのタンパク質試料(1μM)を読み込みます。 250μlの注射器を使用しています。
- 1-3分間2μL/ minでマイクロリアクターに吸着されたタンパク質の上にトリプシン溶液(5μM)を注入します。
- TFAの酸性化水溶液でマイクロリアクターをすすぐことによって、タンパク質分解消化プロセスを停止(0.01%v / v)のH 2 O / CH 3 CN中の(98:2 v / v)で2μL/分で5分間。 250μlの注射器を使用しています。
- TFAの酸性化有機溶液(0.01%を注入することによりマイクロリアクターからタンパク質消化物を溶出開始v / v)のH 2 O / CH 3 CN(50:50 v / v)の300 NL /分。
- MSデータ取得処理とESI電圧(〜2000 V)をオンにします。ステップ3.8において提供されたデータ収集パラメータを使用して、MSデータを取得します。トリプシンペプチドの溶出を観察します。
6.データ処理
- 生のMSデータフォーマットと互換性のある検索エンジンでタンデムMSデータを処理します。
- 生物の特定の最小限の冗長タンパク質データベースを使用して、LTQ-MS RAWファイルを処理します。検索のための切断を逃した、検索エンジンで生データをアップロードし、それぞれ2および1ダに親とフラグメントイオン質量許容範囲を設定し、最大2つので唯一の完全にトリプシンフラグメントを使用します。翻訳後修飾のために許可されていません。それぞれ、1%、3%に高、中、自信偽発見率(FDR)を設定し、翻訳後修飾することができません。
- 唯一の高自信を選択するために、データをフィルタペプチドは、データベース内のタンパク質にマッチします。タンパク質およびペプチドレベルの結果を評価します。
結果
タンパク質分解性消化プロセスの代表的な結果は、上述したマイクロリアクター( 図1または2)、 表1に提供されて、タンパク質の混合物を同時に行う。テーブルは、特定のタンパク質を同定する独特のペプチド配列を含み、クロス切れ残りの相関スコア(XCORR)( すなわち 、対応するタンデム質量スペクトルの実験対理論上のマッチの品質を特徴付けるスコア)、数字、ペプチドの荷電状態(Z)、および質量/電荷(プロトン化ペプチドののm / z)。タンパク質レベルでは、テーブルは、UniProtのタンパク質ID、タンパク質、タンパク質スコアおよびタンパク質カバレッジの説明(名前)を提供します。タンパク質分解消化を90秒間行った後、全てのタンパク質は、多数のペプチドによって同定しました。
ために必要な時間全てのペプチドの溶出は、ナノESI最適な動作と互換性の流量300 NL / minで酸性化し、有機溶液を配信移送毛細管の長さに依存していました。では、キャピラリー水性および有機酸性溶液の混合は、いくつかのペプチドの初期の溶出をもたらしたが、大多数は、有機溶液中で数分間かけて溶出しました。毛細管マイクロリアクターを用いて生成された5タンパク質のいくつかのペプチドを表す、の共溶出を表示マススペクトルは、 図3に設けられています。
毛細管マイクロリアクター及びO / N消化プロトコルを使用して5タンパク質のタンパク質分解性消化を介して生成されたトリプシンペプチドの表1にリスト 。唯一のユニークな配列は、最高XCORRで、示されている。 このファイルをダウンロードするにはこちらをクリックしてください。

図1.キャピラリーマイクロリアクター。マイクロリアクターの製造のための(A)実験のセットアップ。 (B)MSイオン源内に配置キャピラリーマイクロリアクタ。マイクロリアクターはC18結合シリカ粒子を手動でロードし、ESI-MS源に適切な位置決めを容易にXYZステージ上に置かれている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
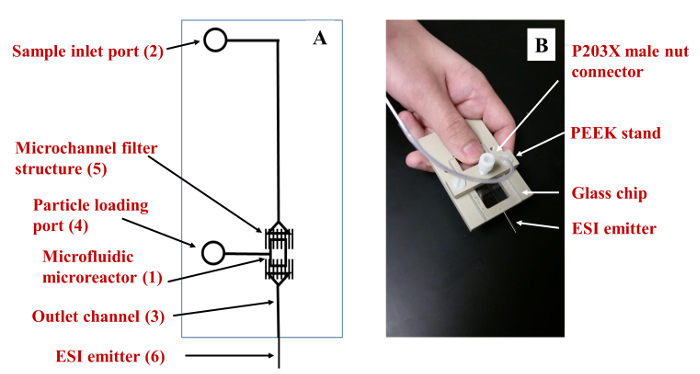
図2.マイクロ流体マイクロリアクター。(A)マイクロ流体反応装置の模式図。 (B)PEEKスタンドに固定マイクロ流体リアクタ。マイクロ流体反応器AND移送ラインは、自家製のポリマーPEEK XYZステージでMSのソースでさらに位置決めのためにスタンドに固定することができるガラス基板で製作されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。

マイクロリアクターでタンパク質分解を施したタンパク質混合物から生成されたトリプシンペプチドを含む図3.質量スペクトル。最も強いトリプシンペプチドイオンはアミノ酸の配列および対応するタンパク質の識別子が付されている。 の拡大版をご覧になるにはこちらをクリックしてください。この図。
ディスカッション
この研究に記載のマイクロリアクターは、簡単に実装する30分未満でMS分析と識別を可能にするために、タンパク質の酵素消化を実施するための実験を提供します。このシステムの明確な利点は、従来の手法と比較して、簡単、高速、低試薬消費と低コストが含まれます。特に、高価な固定化トリプシンビーズおよびカートリッジを必要としません。毛細管マイクロリアクターの製造は簡単な( 図1A)であり、一般にクロマトグラフィー実験室で見られる標準供給、から数分以内に達成することができます。逆相C18粒子が吸着されたタンパク質またはペプチドを完全に除去するための高有機含量溶媒(CH 3 CNまたはCH 3 OH)でリンスすることができ、マイクロリアクターを再使用することができ、簡単かつ費用対効果の高い製造工程ながらシングルユースAPPLICための使い捨てユニットを製造するための招待状ations。毛細管マイクロリアクターは、 図1(b)に示すように 、自作ESI源に取り付けることができ、または標準的な市販のイオン源に挿入することができます。サンプル捕捉および消化のための粒子床がMSによって最適な検出のための十分な材料を捕捉するのに十分なだけ〜1〜2ミリメートル、より長くする必要はありませんが、毛細管自体の長さは、任意の特定のサイズに合わせて調整することができますイオン源。
マイクロ流体デバイスを製造する能力を持っている研究室では、MS検出( 図2B)とのインタフェース容易にするためのスタンドに固定することができるシンプルなデザイン( 図2A)が設けられています。マイクロリアクタ転送チャネルの寸法は、特定の用途の要件に合わせることができ、装置は、単一又は多重形式に展開することができます。ほとんどの市販の質量分析計については、しかしながら、イオン源は、目を可能にするために修飾を必要としますソース内のデバイスの電子配置。チップ製造用のフォトマスクの描画は、AutoCADのソフトウェアで実行されたフォトマスクは、HTAフォトマスクにより調製しました。マイクロチップの製造は先に記載のプロトコールに従って行った:UV光(360 nm)を、照射し、フォトレジストと下地クロム層を除去し、緩衝液を用いてチャネルの湿式化学エッチングのマスク露光で基板17,18のアライメント酸化物エッチング、残りのクロム層、アクセス穴の穿孔、マイクロチップの表面の洗浄、加水分解(NH 4 OH + H 2 O 2)、および550ºCまで徐々に加熱することにより、カバープレートに対する基板の熱結合を除去します。基板とカバープレートの両方が浅いマイクロチャネルフィルタ要素(1.5〜2ミクロンの深)のために、(〜20-50μm)をサンプル処理のために、深いチャネルのための1つのエッチング、およびその他た。16
上記MIで生成された結果(50-100)の酵素比:1、MS検出(300 NL /分、Hに溶解したペプチドとペプチドの注入実験続いcroreactorは、基板を使用する19の従 来の消化プロトコルO / Nから得られた結果と同等です2 O / CH 3 CN(50:50 v / v)のCH 3 COOH、0.1%v / v)を用いて酸性化しました。マイクロリアクター従来のプロトコルの両方は、複数の固有のペプチド( 表1)により、すべてのタンパク質の同定を可能にしました。一般的に、タンパク質あたりのユニークなペプチドの幾分大きい数は、従来の設定よりもマイクロリアクターで観察しました。これは、特定の部位での不完全な酵素的切断の結果でした。タンパク質消化のいくつかの追加分は、この結果を低減または排除します。また、マイクロリアクターを用いて生成されたいくつかの酵素ペプチドを伴うC18粒子の異なる部位に吸着したタンパク質を酵素tにさらされたという事実のために、溶液中で生成されたものと異なっ均質溶液中ハン20 XCORRスコアは、マイクロリアクターで生成タンデム質量スペクトルの品質が高品質であったことが、証明、および十分なタンパク質配列カバー率(11から75%)は、明白なタンパク質同定のために達成可能であること。
技術は、記載されているように、単純な注入実験によって分析することができ、それはMS分析の前に液体クロマトグラフィー分離を必要としない〜最も25-50ペプチドで発生むしろ単純なタンパク質混合物の分析に限定されています。成功へのクリティカル軽減またはマイクロリアクターの運用pHでタンパク質分解酵素の活性を失わないために、新鮮に解凍し、準備トリプシン溶液の使用である( すなわち 、pH約8)。また、適切なバランスは、エレクトロスプレーイオン化(150-300 NL /分)のための最適な流量及び実験によって許容され、それが可能にすることができ、最大流量の間に発見されなければなりませんマイクロリアクター(2-3μL/分)からの高速ペプチド溶出。最適ESI流量よりも高い感度損失および不十分な検出限界をもたらします。その結果、転写キャピラリーの長さ≤300NL /分で作動するマイクロリアクターからのペプチドの溶出のために必要な時間を短縮することが可能な限り短く維持されるべきです。実験に使用した全ての構成要素は、同様の機能を実行する他の製造業者からの構成要素で置き換えることができます。これらの構成要素の寸法特性は、(長さ、直径、体積)が異なる場合、溶離液流量の最適化、試料濃度は、特定のステップを実行すると、ESI電圧の時間は、同様の結果を得るために必要であり得ます。
マイクロ流体セットアップで有効になってユニークな利点は、電気浸透流がスタンドアルを可能にするためのポンプ、21,22を駆動し、 例えば 、さらにチップ上のポンプシステムを組み込む能力でありますプラットフォームおよび追加の分離工程の統合の操作。タンパク質分解性消化を介して生成されたペプチドのオンチップ分離を行う能力は、改善された検出限界をもたらす、および細胞抽出物から、複雑なタンパク質混合物の分析を容易にします。これは、さらに微細加工プラットフォームおよび生物医学的用途のための高速MS検出を利用するワークフローで技術の統合を可能にします。23
開示事項
The authors declare no competing financial interests.
謝辞
This work was supported by NSF/DBI-1255991 grant to IML.
資料
| Name | Company | Catalog Number | Comments |
| Ion trap ESI-MS | Thermo Electron | LTQ | The LTQ mass spectrometer is used for acquiring tandem MS data |
| XYZ stage | Newport | Multiple parts | The home-built XYZ stage is used to adapt the commercial LTQ nano-ESI source to receive input from various sample delivery systems |
| Stereo microscope | Edmund optics | G81-278 | The microscope is used to observe the microreactor packing process |
| Analytical balance/Metler | VWR | 46600-204 | The balance is used to weigh the protein samples |
| Ultrasonic bath/Branson | VWR | 33995-540 | The sonic bath is used for mixing/homogenizing the samples and dispersing the C18 particle slurry |
| Syringe pump 22 | Harvard Apparatus | 552222 | The micropump is used for loading, rinsing and eluting the sample and the enzyme on and from the packed capillary microreactor |
| Milli-Q ultrapure water system | EMD Millipore | ZD5311595 | The MilliQ water system is used to prepare purified DI water |
| Pipettor/Eppendorf (1,000 µl) | VWR | 53513-410 | The pipettor is used to measure small volumes of sample solutions |
| Pipettor/Eppendorf (100 µl) | VWR | 53513-406 | The pipettor is used to measure small volumes of sample solutions |
| Pipettor/Eppendorf (10 µl) | VWR | 53513-402 | The pipettor is used to measure small volumes of sample solutions |
| Fused silica capillary (100 µm ID x 360 µm OD) | Polymicro Technologies | TSP100375 | This capillary is used for the fabrication of the microreactor |
| Fused silica capillary (20 µm ID x 100 µm OD) | Polymicro Technologies | TSP020090 | This capillary is used for the fabrication of the ESI emitter |
| Fused silica capillary (50 µm ID x 360 µm OD) | Polymicro Technologies | TSP050375 | This capillary is used to transfer the samples and the eluent from the syringe pump to the capillary microreactor |
| Glass capillary cleaver | Supelco | 23740-U | This is a tool for cutting fused silica capillaries at the desired length |
| Glue | Eclectic Products | E6000 Craft | This glue is used for securing the ESI emitter into the capillary microreactor or the microfluidic chip |
| Epoxy glue | Epo-Tek | 353NDT | This glue is used to seal the microfluidic inlet hole through which the C18 particles are loaded |
| Reversed phase C18 particles (5 µm) | Agilent Technologies | Zorbax 300SB-C18 | These are C18 particles on which the proteins are adsorbed; the particles were extracted from a 4 mm x 20 cm C18 LC column from Agilent |
| Syringe/glass (250 µl) | Hamilton | 81130-1725RN | The glass syringes are used to load the C18 particle slurry in the capillary microreactor and to deliver the sample and eluents to the microreactor |
| Internal reducing PEEK Union (1/16” to 1/32”) | Valco | ZRU1.5FPK | This union is used to connect the 250 µl syringe to the microreactor for loading the 5 µm particle slurry |
| Stainless steel union (1/16”) | Valco | ZU1XC | The stainless steel union is used to connect the glass syringe needle to the infusion capillary |
| Microvolume PEEK Tee connector (1/32”) | Valco | MT.5XCPK | The Peek tee is used to connect the sample transfer capillary to the capillary microreactor; on its side arm, it enables the insertion of the Pt wire |
| Tee connector (light weight) | Valco | C-NTXFPK | This Tee connector is used to apply ESI voltage to the microfluidic chip through the sample transfer line |
| Pt wire (0.404 mm) | VWR | 66260-126 | The Pt wire provides electrical connection for ESI generation and is connected to the mass spectrometer ESI power supply |
| PTFE tubing (1/16” OD) | Valco | TTF115-10FT | The Teflon tubing is used to enable an air-tight connection between the syringe needle and the stainless steel union |
| PEEK tubing (0.015” ID x 1/16” OD) | Upchurch Scientific | 1565 | The Peek tubing is used as a sleeve to enable an air-tight connection between the stainless steel union and the 50 µm ID transfer capillary |
| PEEK tubing (0.015” ID x 1/32” OD) | Valco | TPK.515-25 | The Peek tubing is used as a sleeve to enable a leak-free connection between the fused silica capillaries and the Peek Tee |
| Clean-cut polymer tubing cutter | Valco | JR-797 | This cutter is used to pre-cut the 1/16” and 1/32’ Peek polymer tubing that is used as sleeve for leak-free connections in pieces of ~4-5 cm in length |
| Amber vial (2 ml) | Agilent | HP-5183-2069 | The vials are used to prepare sample solutions and the C18 particle slurry |
| Amber vial (4 ml) | VWR | 66011-948 | The vials are used to prepare sample solutions |
| Polypropylene tube (15 ml) | Fisher | 12-565-286D | The vials are used to prepare buffer solutions |
| Cylinder (100 ml) | VWR | 24710-463 | The cylinder is used to measure volumes of solvent |
| Cylinder (10 ml) | VWR | 24710-441 | The cylinder is used to measure volumes of solvent |
| Pipette tips (1,000 µl) | VWR | 83007-386 | The pipette tips are used to measure small volumes of sample solutions |
| Pipette tips (100 µl) | VWR | 53503-781 | The pipette tips are used to measure small volumes of sample solutions |
| Pipette tips (10 µl) | VWR | 53511-681 | The pipette tips are used to measure small volumes of sample solutions |
| Glass substrates | Nanofilm | B270 white crown, 3” x 3” | These are glass substrates for microchip fabrication |
| Male nut fitting (1/16”) | Upchurch | P203X | This fitting is used for connecting transfer capillaries to the microfluidic chip |
| Nanoport assembly | Upchurch | N-122H | This fitting is used for connecting transfer capillaries to the microfluidic chip |
| Protein standards | Sigma | Multiple # | |
| Acetonitrile, HPLC grade | Fisher | A955 | |
| Methanol, HPLC grade | Fisher | A452 | |
| Isopropanol, HPLC grade | Sigma | 650447 | |
| Trifluoroacetic acid | Sigma | 302031 | |
| Ammonium bicarbonate | Aldrich | A6141 | |
| Trypsin, sequencing grade | Promega | V5111 |
参考文献
- Petersen, D. H. Microfluidic Bioreactors. Encyclopedia of Microfluidics and Nanofluidics. , Springer Science+Business Media. New York. (2014).
- Matosevic, S., Szita, N., Baganz, F. Fundamentals and applications of immobilized microfluidic enzymatic reactors. J. Chem. Technol. Biotechnol. 86 (3), 325-334 (2011).
- Liu, Y., Liu, B., Yang, P., Girault, H. H. Microfluidic enzymatic reactors for proteome research. Anal. Bioanal. Chem. 390 (1), 227-229 (2008).
- Wu, H., Zhai, J., Tian, Y., Lu, H., Wang, X., Jia, W., Liu, B., Yang, P., Xu, Y., Wang, H. Microfluidic enzymatic-reactors for peptide mapping: strategy, characterization, and performance. LabChip. 4 (6), 588-597 (2004).
- Jin, L. J., Ferrance, J., Sanders, J. C., Landers, J. P. A microchip-based proteolytic digestion system driven by electroosmotic pumping. LabChip. 3 (1), 11-18 (2003).
- Asanomi, Y., Yamaguchi, H., Miyazaki, M., Maeda, H. Enzyme-immobilized microfluidic process reactors. Molecules. 7 (16), 6041-6059 (2011).
- Aravamudhan, S., Joseph, P. J., Kuklenyik, Z., Boyer, A. E., Barr, J. R. Integrated microfluidic enzyme reactor mass spectrometry platform for detection of anthrax lethal factor. 31.st. Annual International Conference of the IEEE EMBS, , 1071-1074 (2009).
- Liu, X., Lo, R. C., Gomez, F. A. Fabrication of a microfluidic enzyme reactor utilizing magnetic beads. Electrophoresis. 30 (12), 2129-2133 (2009).
- Liu, Y., Xue, Y., Ji, J., Chen, X., Kong, J., Yang, P., Girault, H. H., Liu, B. Gold nanoparticle assembly microfluidic reactor for efficient on-line proteolysis. Mol. Cell. Proteomics. 6 (8), 1428-1436 (2007).
- Wu, H., Tian, Y., Liu, B., Lu, H., Wang, X., Zhai, J., Jin, H., Yang, P., Xu, Y., Wang, H. Titania and alumina sol-gel-derived microfluidics enzymatic-reactors for peptide mapping: design, characterization, and performance. J. Proteome Res. 3 (6), 1201-1209 (2004).
- Ji, J., Zhang, Y., Zhou, X., Kong, J., Tang, Y., Liu, B. Enhanced protein digestion through the confinement of nanozeolite-assembled microchip reactors. Anal. Chem. 80 (7), 2457-2463 (2008).
- Hustoft, H. K., Brandtzaeg, O. K., Rogeberg, M., Misaghian, D., Torsetnes, S. B., Greibrokk, T., Reubsaet, L., Wilson, S. R., Lundanes, E. Integrated enzyme reactor and high resolving chromatography in "sub-chip" dimensions for sensitive protein mass spectrometry. Scientific Reports. 3 (3511), 1-7 (2013).
- Pramanik, B. N., Mirza, U. A., Ing, Y. H., Liu, Y. H., Bartner, P. L., Weber, P. C., Bose, A. K. Microwave-enhanced enzyme reaction for protein mapping by mass spectrometry: A new approach to protein digestion in minutes. Protein Sci. 11 (11), 2676-2687 (2002).
- Olszowy, P. P., Burns, A., Ciborowski, P. S. Pressure-assisted sample preparation for proteomic analysis. Anal. Biochem. 438 (1), 67-72 (2013).
- Lord, G. A., Gordon, D. B., Myers, P., King, B. W. Tapers and restrictors for capillary electrochromatography and capillary electrochromatography-mass spectrometry. J. Chromatogr. A. 768, 9-16 (1997).
- Lazar, I. M., Kabulski, J. L. Microfluidic LC Device with Orthogonal Sample Extraction for On-Chip MALDI-MS Detection. Lab Chip. 13 (11), 2055-2065 (2013).
- Harrison, D. J., Manz, A., Fan, Z. H., Ludi, H., Widmer, H. M. Capillary electrophoresis and sample injection systems on a planar glass chip. Anal. Chem. 64 (17), 1926-1932 (1992).
- Jacobson, S. C., Hergenroder, R., Koutny, L. B., Warmack, R. J., Ramsey, J. M. Effects of Injection Schemes and Column Geometry on the Performance of Microchip Electrophoresis Devices. Anal. Chem. 66 (7), 1107-1113 (1994).
- Armenta, J. M., Perez, M. J., Yang, X., Shapiro, D., Reed, D., Tuli, L., Finkielstein, C. V., Lazar, I. M. Fast Proteomic Protocol for Biomarker Fingerprinting in Cancerous Cells. J. Chromatogr. A. 1217, 2862-2870 (2010).
- Doucette, A., Craft, D., Li, L. Mass Spectrometric Study of the Effects of Hydrophobic Surface Chemistry and Morphology on the Digestion of Surface-Bound Proteins. J. Am. Soc. Mass Spectrom. 14, 203-214 (2003).
- Lazar, I. M., Trisiripisal, P., Sarvaiya, H. A. Microfluidic Liquid Chromatography System for Proteomic Applications and Biomarker Screening. Anal. Chem. 78 (15), 5513-5524 (2006).
- Lazar, I. M., Karger, B. L. Multiple Open-Channel Electroosmotic Pumping System for Microfluidic Sample Handling,". Anal. Chem. 74 (24), 6259-6268 (2002).
- Lazar, I. M., Rockwood, A. L., Lee, E. D., Sin, J. C. H., Lee, M. L. High-speed TOFMS Detection for Capillary Electrophoresis. Anal. Chem. 71 (13), 2578-2581 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved