Method Article
עיבוד אנזימתי תענית חלבונים עבור איתור MS עם microreactor זרימה דרך
In This Article
Summary
A quick protocol for proteolytic digestion with an in-house built flow-through tryptic microreactor coupled to an electrospray ionization (ESI) mass spectrometer is presented. The fabrication of the microreactor, the experimental setup and the data acquisition process are described.
Abstract
הרוב המכריע של ספקטרומטריית מסה (MS) מבוסס שיטות ניתוח חלבון בה התקדמות עיכול אנזימטי לפני הגילוי, בדרך כלל עם טריפסין. שלב זה הכרחי עבור הדור של פפטידים בעלי משקל מולקולרי קטן, בדרך כלל עם MW <3,000-4,000 Da, כי ליפול בתוך טווח סריקה יעילה של מכשור ספקטרומטריית מסה. פרוטוקולים קונבנציונליים לערב עיכול אנזימטי O / N ב 37 ºC. ההתקדמות שחלה באחרונה הוביל לפיתוח של מגוון רחב של אסטרטגיות, בדרך כלל בתחום השימוש של microreactor עם קיבוע אנזימים או של מגוון רחב של תהליכים פיזיקליים משלימים המפחיתים את הזמן הדרוש לעיכול פרוטאוליטים לכמה דקות (למשל, מיקרוגל או גבוהה לַחַץ). בעבודה זו, אנו מתארים גישה פשוטה וחסכונית שיכול להיות מיושמת בכל מעבדה להשגת עיכול אנזימטי מהיר של חלבון. החלבון (או תערובת החלבונים) היא adsorbed על Perf הגבוהה C18-בונדד התהפכו פאזייםormance כרומטוגרפיה נוזלי (HPLC) חלקיקי סיליקה נטענו מראש טור נימים, טריפסין חיץ מימי הוא החדיר מעל החלקיקים לתקופה קצרה של זמן. כדי לאפשר on-line זיהוי MS, פפטידים tryptic הם eluted עם מערכת ממס עם תוכן אורגני גדל ישירות למקור MS יון. גישה זו תמנע את השימוש של חלקיקי קיבוע אנזימים יקרן ואינו מצריכה כל עזרה שתגיע להשלמת התהליך. עיכול חלבון וניתוח מדגם מלא ניתן להשיג בפחות מ ~ 3 דקות ו ~ 30 דקות, בהתאמה.
Introduction
זיהוי ואפיון של חלבונים מטוהרים מושגת לעתים קרובות על ידי שימוש בטכניקות MS. החלבון מתעכל עם אנזים ופפטידים שלה מנותחים עוד יותר על ידי MS באמצעות התקנה ניסיונית עירוי פשוט. עיכול פרוטאוליטים הכרחי להפקה שברי פפטיד קטנים שנופלים הטווח המוני השימושי של רוב מנתחי MS, וזה יכול להיות מקוטע בקלות דרך התנתקות מושרה התנגשות אנרגיה נמוכה להפקת מידע רצף חומצות האמיניות. עבור חלבונים מבודדים או תערובות חלבון פשוט, אין צורך עוד הפרדה chromatographic של פפטידים לפני גילוי MS. תערובת של פפטידים 25-50 להיות יכולה לנתח בקלות על ידי יציקת המדגם עם משאבת מזרק ישירות מקור יון MS.
ספקטרומטר המסה יכול לבצע את הניתוח ולאשר את הרצף של חלבון בתוך מסגרת זמן קצרה. בעזרת שיטות איסוף הנתונים מודרניות, תהליך זה יכול להתבצע within כמה דקות או אפילו שניות. הגורם המגביל בהשלמת התהליך על בקנה מידת זמן קצר הוא צעד העיכול פרוטאוליטים. בדרך כלל, זה מתבצע על פני כמה שעות (או O / N), בתמיסה, ב 37 ºC, באמצעות מצע: יחסי אנזים של (50-100): 1. כדי לצמצם את זמן עיכול אנזימטי לדקות או שניות, microreactors אנזים משותק, בצורה של כורי microfluidic או מחסניות זמינות מסחרי, תוארו. 1-6 בדרך כלל, האנזים הוא משותק על ידי קוולנטיים, הלא קוולנטיים / ספיחה פיזית, מורכב היווצרות או אנקפסולציה, 3,6 יעילות משופרת של תהליך אנזימטי מתאפשר בזכות יחסי קרקע-נפח האנזים אל המצע גדול. יתרונות נוספים של כורים משותקים כוללים מופחת autolysis והתערבות של האנזים בניתוח MS, שיפור יציבות אנזים ויכולת שימוש חוזר. מגוון של גישות, באמצעות זכוכית או מכשירי microfabricated פולימריים תואר,באמצעות אנזימים משותקים על חרוזים מגנטיים ידי אינטראקציות נוגדן-אנטיגן, 7,8 הלכוד רשתות ננו-חלקיקים מזהב, 9 גלומים סול ג'ל טיטניה-אלומינה 10 ו nanozeolites, 11 או נתפסו באמצעות Ni-נ.ת.ע או ההיווצרות המורכבת-Tag שלו. 6 לחלופין נימים, פתוח צינורי עם קיבוע אנזימים פותחו, כמו גם. 12 יתר על כן, מחשוף פרוטאוליטים משופר הודגם באמצעות הקרנת מיקרוגל מבוקר 13 או לחץ בסיוע או לחץ טכנולוגית אופניים (PCT) לצמצום זמני התגובה ל 30-120 דקות. 14
למרות היתרונות המרובים של כורי אנזים משותקים, העלויות של מחסניות מסחריות היא גבוהות, הזמין של מכשירי microfluidic לשימוש שיגרתי מוגבל, ושימוש תוצאות טכנולוגיות מיקרוגל או PCT ב צורך במכשור נוסף. מטרת המחקר הנוכחי הייתה לפתח שיטה כי circumveNTS החסרונות האלה, וזה יכול להיות מיושם בקלות בכל מעבדה להעצים חוקרים עם גישה פשוטה ויעילה לביצוע מחשוף אנזימטי של חלבונים כהכנה לניתוח MS בתוך דקות. הגישה מתבססת על השימוש הידרופובי, C18-חלקיקים שהם שנטענו מראש נימים או מכשיר microfluidic, ואת הספיחה של החלבון (ים) של עניין על חלקיקים אלה ואחריו עיכול אנזימטי במהלך העירוי של האנזים על מיטה וחלבון שנתפס ארוז (ים). לפי גישה זו, המצע הוא משותק באמצעות קישור לא קוולנטי, ואת האנזים הוא החדיר מעל החלבון ההמום. יעילות עיכול פרוטאוליטים מוגברת על-ידי אזורים פני החלקיקים גדולים החושפים את חלבון לעיבוד האנזימטית, מרחקים וזמני דיפוזיה אל מפני השטח של חלקיקים, שיפור העברת המוני, לא מצורף קוולנטיים שעשויים להשפיע על פעילותו של האנזים, היכולת במהירות evaluatשילובי דואר של אנזימים שונים, disposability, ריבוב אם התהליך מבוצע במתכונת microfluidic. גישה זו באה לידי ביטוי עם השימוש תערובת של חלבונים סטנדרטיים טריפסין-האנזים הנפוץ ביותר לעיכול פרוטאוליטים לפני גילוי ESI-MS. ספקטרומטר מסה משמש לגילוי במחקר זה היה quadrupole מלכודת ליניארי המכשיר (LTQ).
Protocol
1. הכנה של נימי microreactor
- חותכים את 100 מיקרומטר קוטר פנימי (ID) x 360 מיקרומטר קוטר חיצוני (OD) נימי באורך של 7-8 ס"מ, ואת נימי 20 מיקרומטר מזהה x 90 מיקרומטר OD 3-5 ס"מ עם קופיץ נימי זכוכית; לאמת תחת מיקרוסקופ כי בשני הקצוות נימי יש חתך נקי, ישר, ללא כל קוצים בולטים.
- הכנס את 20 מיקרומטר מזהה x 90 מיקרומטר OD נימי לתוך קצה אחד של נימי OD 100 מיקרומטר מזהה x 360 מיקרומטר, למשך פרק ~ 6 מ"מ; במקרה הצורך, יש למלא אחר המבצע הזה תחת מיקרוסקופ.
- החל טיפה קטנה של E6000 הדבק סביב צומת של הנימים מזהים 90 מיקרומטר OD / 100 מיקרומטר עם סופו של Q-Tip, ולתת את התרופה הדבקה O / N ב RT.
- חותכים את 20 מוכנס מיקרומטר מזהה x 90 מיקרומטר OD נימי באורך של ~ 10-15 מ"מ; זה יהיה פולט יינון electrospray.
- טרום לחתוך באמבטיה "OD הצצה, 1/16" הצצה OD ו 1/16 "OD PTFE 1/32ing לחתיכות של 4-5 ס"מ אורך; אלה יהיו השרוולים המשמשים איגודים נימי למתן חיבור חופשי דליפה.
- חבר את הקצה השני של נימי OD 100 מיקרומטר מזהה x 360 מיקרומטר לאיחוד הצצה; להשתמש שרוול 1/32 "הצצה למתן חיבור דליפה חינם.
- הכנס / להדק פיסת ~ 5 ס"מ 1/16 "צינורות PTFE אל הקצה השני של האיגוד.
- לשקול ~ 4 מ"ג של C18 (5 מיקרומטר) חלקיקים בתוך מראש לנקות / יבשים 2 בקבוקון זכוכית מ"ל; להוסיף 0.5 מ"ל isopropanol, לסגור את הבקבוקון לפזר את התערובת הדלילה באמבטיה ultrasonicator.
- משיכה עם מזרק 250 μl כ 200 סלארי μl, הכנס את מחט המזרק בצינור 1/16 "PTFE של האיגוד הצצה, ולחלק את התערובת הדלילה לאט לתוך נימי OD 100 מיקרומטר מזהה x 360 מיקרומטר; להתבונן תחת מיקרוסקופ כמו נימים מתמלאות חלקיקים עד אורך של אריזת 2-3 מ"מ מושגת; זה יהיה microreactor (איור 1) 20 μ.נימים מ מזהה שומרות על חלקיקי microreactor דרך שפעת Keystone. 15
- שוטפים את microreactor עם ~ 50 μl פתרון של H 2 O / CH 3 CN 50:50 v / v, ולאחר מכן עם ~ 50 μl פתרון של H 2 O / CH 3 CN 98: 2 V / V.
2. הכנת פתרונות לדוגמא
הערה: תפעול הכרוכות בטיפול של ממיסים אורגניים וחומצות והכנת הפתרון הם להתבצע במנדף. תלבש משקפי מגן, כפפות וביגוד מגן.
- לשטוף עם CH 3 OH ולייבש כמה צלוחיות זכוכית (4 מ"ל) צינורות פוליפרופילן (15 מ"ל).
- הכן 10 מ"ל של פתרון של H 2 O / CH 3 CN (98: 2 V / V) בתוך צינור פוליפרופילן 15 מ"ל ידי ערבוב 9.8 מ"ל H 2 O עם 200 μl CH 3 CN; ומערבבים על ידי sonication.
- הכן 10 מ"ל של פתרון של H 2 O / CH 3 CN (50:50 v / v) בתוך צינור פוליפרופילן 15 מ"ל על ידי ערבוב 5 מ"ל H 2 </ sub> O עם 5 מ"ל CH 3 CN; ומערבבים על ידי sonication.
- הכן 4 מ"ל של תמיסה מימית acidified (נ 0.01% TFA / v) על ידי הוספת 4 μl TFA (10%) ל -4 מ"ל H 2 O / CH 3 CN (98: 2 V / V) בבקבוקון זכוכית 4 מ"ל; ומערבבים על ידי sonication.
- הכן 4 מ"ל של פתרון אורגני acidified (נ 0.01% TFA / v) על ידי הוספת 4 μl TFA (10%) ל -4 מ"ל H 2 O / CH 3 CN (50:50 v / v) בקבוקון זכוכית 4 מ"ל; ומערבבים על ידי sonication.
- לשקול 16 מ"ג NH 4 HCO 3 עם microbalance אנליטיות בקבוקון זכוכית 4 מ"ל; להוסיף 4 מ"ל של H 2 O / CH 3 CN (98: 2 v / v) פתרון ולפזר על ידי sonication; הדבר גורם פתרון 50 מ"מימ של NH 4 HCO 3 (pH ~ 7.8) במאגר מימי.
- לשקול 5 מ"ג של חלבון סטנדרטי (למשל, אלבומין בסרום שור, המוגלובין α / β, ציטוכרום C, anhydrase פחמתית, α-2-HS-גליקופרוטאין, וכו ') עם microbalance אנליטיות בקבוקון זכוכית 4 מ"ל; להוסיף שתייה DI 4 מ"לr ולפזר על ידי sonication; זה בדרך כלל תוצאות פתרון ריכוז גבוהה מיקרומטר-רמה.
- הכן 1 מ"ל פתרון חלבון (1-2 מיקרומטר) על ידי דילול פתרון ריכוז מיקרומטר ברמה גבוהה עם נפח מתאים של NH 4 HCO 3 (50 מ"מ) חיץ מימית; ומערבבים על ידי sonication.
- הכן את הפתרון טריפסין (5 מיקרומטר) על ידי המסת טריפסין 20 מיקרוגרם רצף כיתה ב 170 μl NH 4 HCO 3 (50 מ"מ) חיץ מימית; לפזר על ידי sonication.
3. הגדרת ניסוי
הערה: מערכת LTQ-MS מצויד מקור ESI שונה הכוללת XYZ שלבית מובנה הביתה המאפשר התממשקות של ספקטרומטר מסה לגישות קלט מדגם שונים.
- ניתקתי את microreactor הנימים מהאיגוד הצץ ולהתחבר טי הצץ.
- הכנס ~ 2 ס"מ חוט Pt בזרוע בצד של טי הצצה; להשתמש שרוול הצצה "1/32 למתןדליפה ללא חיבור עבור בידוד חוט Pt.
- חבר OD 50 מיקרומטר מזהה x 360 מיקרומטר (~ 0.5 מ 'אורך) נימי מדגם העברה לקצה השני של טי הצצה; להשתמש שרוול 1/32 "הצצה למתן חיבור דליפה חינם.
- אבטח את טי הצצה על הבמה-XYZ ומקם את מ"מ ESI פולט ~ 2 הרחק נימי מפרצון ספקטרומטר מסה.
- חבר את הכבל Pt למקור אספקת החשמל ESI של ספקטרומטר מסה.
- חבר את הקצה השני של נימי העברת מדגם לאיחוד נירוסטה; להשתמש שרוול 1/16 "הצצה למתן חיבור דליפה חינם.
- חבר צינורות PTFE 1/16 "4-5 ס"מ עד הסוף השני של האיחוד נירוסטה להכניס את המחט במזרק 250 μl בצינור PTFE; להפעיל את המשאבה ולהגדיר את קצב הזרימה לפי השווי הרצוי (למשל, 2 μl / min).
- פרמטרי רכישת נתוני הקלט טנדם MS לתוך חבילת התוכנה שולטת מכשיר MSd לשמור כקובץ שיטה ולהכין את ההתקנה לביצוע הניתוח; עבור מערכת LTQ-MS, השתמש בפרמטרי ניתוח הנתונים התלויים הבאים: הדרה דינמית הופעל עבור 180 שניות עם רוחב המוני הדרת ± 1.5 מ '/ z; אחד MS סריקה ואחריו זום אחד ו- MS 2 סריקות על 5 הפסגות האינטנסיביות ביותר העליונות, זום רוחב סריקת ± 5 מ '/ z; דיסוציאציה התנגשות מושרה (CID) פרמטרים שנקבעו ברוחב בידוד 3 מ '/ z, אנרגית התנגשות מנורמלת 35%, ש הפעלת 0.25, וזמן הפעלה של 30 מילים-שניות.
4. הגדרת Microfluidic
- כן מכשיר microfluidic זכוכית או מצעים פולימריים; 16-18 הפריסה של המכשיר מסופקת 2A איור, מורכב microreactor (1) (אורך רוחב 0.13 מ"מ x 2 מ"מ x 50 מיקרומטר עמוקים) מחוברים כניסה (2 ), מוצא (3) וכן יציאה בצד (4); ערוצי מקשרות מניפולציות fluidic הם ~110 מיקרומטר רחב ו ~ 50 מיקרומטר עמוק; מבנה רב (5), מורכב ~ 1.5-2 מיקרומטר עמוק x 10 מיקרומטר x הרחב 100 מיקרומטר microchannels הארוך להציב 25 מיקרומטר בנפרד, יפעל כמסנן עבור שמירה על חלקיקי microreactor.
- הפעל חיבורים נוזלים למסירת השבב על ידי הדבקת מחברים מיוחדים ליציאות המפרצון, או על ידי המצאת עמדת פולימריים המתאימה אבזרים למסירת נוזל (איור 2 ב). 16
- הכינו תרחיף של חלקיקים C18 (5 מיקרומטר) כמתואר בשלב 1.8; לספק את התערובת הדלילה אל microreactor עם מזרק באמצעות צינורות 1/16 "PTFE המחובר ליציאת שבב הצד (4); לאטום את הנמל לאחר טעינת חלקיק עם דבק אפוקסי תרופה עבור שעה 1 בתנור ב 90 ºC 16.
- הכנס נימי (20 מיקרומטר מזהה x 90 מיקרומטר OD x 10 מ"מ אורך) בנמל לשקע, חותם עם דבק E6000, ולתת תרופה O / N; זה יהפוך את פולט ESI ( 6).
- חבר OD 50 מיקרומטר מזהה x 360 מיקרומטר (~ 0.5 מ 'אורך) נימי מדגם העברה לנמל כניסת שבב (2); חבר את הקצה השני של נימי מזרק μl 250 ואת משאבת מזרק, כמתואר 3.6-3.7.
- מניח מחבר הצצה טי קל משקל על קו העברת מדגם קצר לפני יציאת הכניסה (2) והכניס תיל Pt על הזרוע בצד של טי, כמתואר 3.2; זה יהיה האלקטרודה ESI.
- אבטח את המכשיר microfluidic על הבמה XYZ עם פולט ESI ממוצבת ~ 2 מ"מ מן נימי מפרצון ספקטרומטר מסה; להכין את MS לניתוח כמתואר 3.8.
5. טוען לדוגמא, פרוטאוליטים עיכול Elution עבור ניתוח MS
הערה: כל השלבים העברה פתרון / מדגם מבוצעים בעזרת משאבת מזרק וצריך לאפשר לכמה דקות נוספות כדי להשלים, כדי לפצות על-volum מתes הקשורים קווי העברה ומן microreactor; את הזמן הדרוש יהיה תלוי את הספיקות מעורבות.
- שוטפים את microreactor ולהכינו ניתוח על ידי יציקת בתמיסה מימית של NH 4 HCO 3 (50 מ"מ) H 2 O / CH 3 CN (98: 2 V / V) בשעה 2 μl / דקה 5 דקות; להשתמש במזרק 250 μl.
- טענו מדגם החלבון (1 מיקרומטר) על microreactor ידי יציקת הפתרון המדגם ב 2 μl / דקה 5 דקות; להשתמש במזרק 250 μl.
- להשרות את הפתרון טריפסין (5 מיקרומטר) על חלבון adsorbed על microreactor ב 2 μl / דקה במשך 1-3 דקות.
- להרוות את תהליך העיכול פרוטאוליטים על ידי שטיפת microreactor עם בתמיסה מימית acidified של TFA (0.01% v / v) H 2 O / CH 3 CN (98: 2 V / V) בשעה 2 μl / דקה 5 דקות; להשתמש במזרק 250 μl.
- התחל משחררי החלבון לעכל מן microreactor על ידי יציקת פתרון אורגני acidified של TFA (0.01%v / v) H 2 O / CH 3 CN (50:50 v / v) ב 300 NL / min.
- הפעל את תהליך רכישת נתונים MS ואת מתח ESI (~ 2,000 V); לרכוש נתונים MS באמצעות הפרמטרים רכישת נתונים הניתנים בשלב 3.8; להתבונן elution של פפטידים tryptic.
6. עיבוד נתונים
- לעבד את הנתונים MS טנדם עם מנוע חיפוש תואם לפורמט נתונים MS גלם.
- לעבד את קבצי גלם LTQ-MS באמצעות אורגניזם ספציפי מינימאלי מסד נתוני חלבון מיותר; להעלות את הנתונים הגולמיים של מנוע החיפוש, להגדיר את העמידות המוני הורה שבר יון ל Da 2 ו -1, בהתאמה, ולהשתמש רק שברי tryptic מלא עם עד שני החמיץ שסעים עבור החיפוש; אינו מאפשר שינויי posttranslational; להגדיר את שיעורי גילוי הגבוהים וביטחון בינוני שווא (FDR) עד 1% ו -3%, בהתאמה, אינו מאפשר שינויי posttranslational.
- לסנן את הנתונים כדי לבחור ברמת ודאות גבוהה רקפפטיד תואם את החלבונים המופיע במאגר; להעריך את תוצאות חלבון פפטיד-רמה.
תוצאות
תוצאת נציג של תהליך עיכול פרוטאוליטים בצעה בו זמנית על תערובת של חלבונים, עם microreactors המתואר לעיל (איורי 1 או 2), מופיע בלוח 1. הטבלה כוללת רצף הפפטידים הייחודי לזהות חלבון מסוים, הצלב מתאם ציון (Xcorr) (כלומר, ציון המאפיין את איכות המשחק הניסיון אל התיאורטי הספקטרום ההמוני טנדם המקביל), מספר שסעים החמיצו, על המדינה לגבות פפטיד (z), ואת המסה / תשלום ( מ '/ z) של פפטידים protonated. ברמת החלבון, השולחן מופיע מזהה חלבון UniProt, התיאור (השם) של החלבון, תוצאת החלבון וכיסוי החלבון. כל החלבונים היו לזיהוי על ידי פפטידים מרובים, לאחר עיכול פרוטאוליטים בצע במשך 90 שניות.
את הזמן הדרוש עבורelution של כל פפטידים היה תלוי באורך של נימי ההעברה נמסרה כי הפתרון האורגני acidified ב 300 NL / min, קצב זרימה תואם פעולה אופטימלית ננו-ESI. In-נימי ערבוב של פתרונות acidified המימיים ואורגניים הביא elution מוקדם של כמה פפטידים, אבל הרוב הגדול eluted במשך כמה דקות בלבד בתמיסה האורגנית. ספקטרום המוני מוצג שיתוף elution של נציג פפטידים כמה מחמשת החלבונים, שנוצרו עם microreactor הנימים, מסופק באיור 3.
רשימת טבלת 1. פפטידים tryptic שנוצרו דרך עיכול החלבונים של חמישה חלבונים באמצעות microreactor הנימים ופרוטוקולי עיכול O / N. רק רצפים ייחודיים, עם Xcorr הגבוהה ביותר, מוצגים. אנא לחצו כאן כדי להוריד את הקובץ.

איור 1. microreactor נימים. (א) התקנה ניסיונית עבור הייצור של microreactor. (ב) microreactor נימי מיקומו של מקור יון MS. Microreactor נטען ידני עם חלקיקי סיליקה C18-בונדד והניח על XYZ שלבית המאפשר מיצוב הולם במקור ESI-MS. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
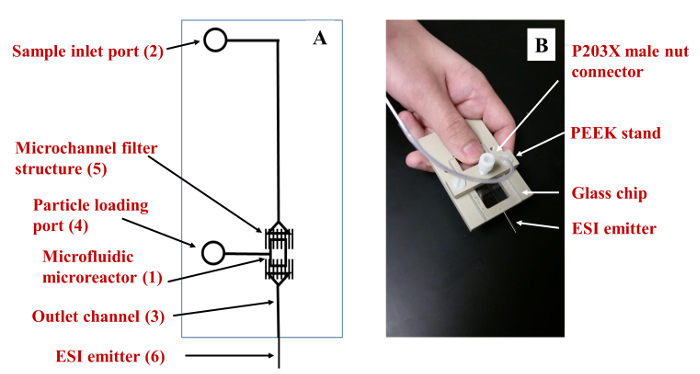
איור 2. microreactor Microfluidic. (א) תרשים סכמטי של הכור microfluidic. (ב) הכור Microfluidic המאובטח עמדה צצה. א הכור microfluidicnd קווי העברה מפוברקים מצע זכוכית אשר יכול להיות מאובטח בתוך צצת פולימרי תוצרת בית לעמוד על מיקום נוסף מקור MS עם במת XYZ. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. ספקטרום המוני המהווה פפטידים tryptic שנוצרו מתערובת החלבון הנתונה proteolysis ב microreactor. היונים האינטנסיביים ביותר פפטיד tryptic מסומנים עם הרצף של חומצות אמינו מזהה החלבון המתאים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
Microreactor המתואר בעבודה זו מספק קל ליישם התקנה ניסיונית לביצוע עיכול אנזימטי של חלבונים כדי לאפשר ניתוח MS והזדהות תוך פחות מ -30 דקות. היתרונות הברורים של מערכת זו, בהשוואת גישות קונבנציונליות, כוללים פשטות, מהירות, צריכת מגיב נמוכה ועלויות נמוכות. בפרט, אין צורך חרוזי מחסניות טריפסין משותקים יקרים. הכנת microreactor הנימים היא פשוט (איור 1 א), והוא יכול להיות מושלם בתוך דקות מחומרים סטנדרטיים, נפוצים במעבדה כרומטוגרפיה. בעוד חלקיקים C18 שלב התהפכה ניתן לשטוף עם ממיס אורגני-תכולה גבוהה (CH 3 CN או CH 3 OH) עבור הסרה מלאה של חלבונים adsorbed או פפטידים, ואת microreactor ניתן להשתמש בהן שוב ושוב, את תהליך ייצור קל וחסכוני מזמין לייצור יחידות הפנויה ישים לשימוש חד-פעמיations. Microreactor הנימים יכול להיות מותקן בתוך מקור ESI שנבנה באופן עצמאי, כפי שמוצג באיור 1 ב, או יכול להיות מוכנס מקור יון מסחרי רגיל. בעוד מיטת החלקיקים עבור לכידה ועיכול מדגם לא צריכה להיות יותר מ ~ 1-2 מ"מ, רק מספיק כדי ללכוד חומר מספיק לגילוי אופטימלי על ידי MS, האורך של הנימים עצמו יכול להיות מותאם כדי להתאים את הגודל כל פרט מקור יון.
למעבדות בעלי יכולות לפברק מכשירים microfluidic, עיצוב פשוט (איור 2 א) כי יכול להיות מאובטח לתוך עמדה על מנת להקל התממשקות זיהוי MS (תרשים 2B) מסופק. הממדים של ערוצי microreactor והעברה יכולים להיות מותאמים לדרישות של יישום מסוים, וההתקן ניתן לפתח לפורמט יחיד או מרובב. עבור רוב ספקטרומטרים המוני מסחריים, עם זאת, מקור היון יזדקק שינויים להתיר המיקום הדואר של המכשיר במקור. ציור photomask עבור ייצור שבבים הוצא להורג עם תוכנת AutoCAD ואת photomask הוכנה על ידי Photomask HTA. הייצור של השבבים בוצע על פי פרוטוקולים שתוארו קודם לכן: 17,18 יישור של המצע עם photomask, חשיפה לאור UV (360 ננומטר), הסרת photoresist המוקרן שכבת כרום בסיסית, תחריט כימי רטוב ערוצים עם חיץ תחמוצת לחרוט, הסרת שכבת כרום הנותרים, קידוח חורי גישה, ניקוי, הידרוליזה של פני שטח השבב (NH 4 OH + H 2 O 2), ו מגע תרמי של המצע לצלחת הכיסוי ידי חימום הדרגתי ל -550 ºC. צלחת המצע לכסות הן נחרטו, אחד עבור ערוצי עמוקה מדגם טיפול (~ 20-50 מיקרומטר), והשני עבור אלמנטים מסנן ערוץ מיקרו רדוד (1.5-2 מיקרומטר עמוק). 16
התוצאות שנוצר עם המתואר לעיל מילcroreactor ניתן להשוואה עם התוצאות שהושגו O / N, 19 פרוטוקולי עיכול קונבנציונליים המשתמשות מצע: יחסי אנזים של (50-100): 1, ואחריו ניסוי עירוי פפטיד עם זיהוי MS (300 NL / min, פפטידים מומס H 2 O / CH 3 CN (50:50 v / v) acidified עם CH 3 COOH, 0.1% v / v). Microreactor שני ופרוטוקולים קונבנציונליים לאפשר זיהוי של כל החלבונים על ידי פפטידים ייחודיים מרובים (טבלה 1). בדרך כלל, מספר אשר בבעלותן של פפטידים ייחודיים לכל חלבון היה ניתן לצפות עם microreactor מאשר עם ההתקנה הקונבנציונלית. זו היתה תוצאה של מחשוף האנזימטית שלם באתרים מסוימים. אחרי כמה דקות נוספות של עיכול פרוטאוליטים צומצמו או בוטלו תוצאה זו. כמו כן, כמה פפטידים האנזימטית שנוצרו עם microreactor שונים מאלה שנוצרו בתמיסה, בשל העובדה כי עבור החלבונים adsorbed על האתרים שונים חלקיקי C18 נחשפו האנזים tהאן בפתרונות הומוגנית. 20 הניקוד Xcorr להדגים, עם זאת, כי האיכות של ספקטרה המונית טנדם שנוצר עם microreactor היה של באיכות גבוהה, וכי כיסוי רצף מספיק חלבון (11-75%) הוא בר השגה עבור ההזדהויות חלבון שאינה משתמעת לשתי פנים .
הטכניקה, כמתואר, מוגבל בניתוח תערובות חלבון פשוטה למדי שיוצרים לכל היותר ~ 25-50 פפטידים כי ניתן לנתח על ידי ניסויים עירוי פשוט כי לא מחייבים הפרדה chromatographic נוזלי לפני ניתוח MS. קריטי להצלחה הוא השימוש פתרונות טריפסין מופשר טרי והכינו, כדי לא להפחית או לאבד את פעילותו של האנזים פרוטאוליטים על pH המבצעית של microreactor (כלומר, pH ~ 8). בנוסף, איזון ראוי חייב להימצא בין הספיקות האופטימליות עבור יינון electrospray (150-300 nl / min) ואת הספיקות המקסימליים שניתן נסבלת על ידי הגדרת הניסוי וכי לאפשרelution פפטיד מהר מן microreactor (2-3 μl / min). גבוה מ ספיקות ESI אופטימליות לגרום להפסדים רגישים לתחום גילוי עני. כתוצאה מכך, אורך הנימים ההעברה צריכה להישמר קצר ככל האפשר כדי להפחית את הזמן הדרוש עבור elution של פפטידים מן microreactor כשהוא פועל ≤300 NL / min. כל הרכיבים ששימשו בהגדרת הניסוי יכול להיות מוחלף על ידי רכיבים של יצרנים אחרים המבצעים פונקציות דומות. אם המאפיינים ממדי של רכיבים אלה שונים (אורך, קוטר, נפח), אופטימיזציה של ספיקות eluent, ריכוז מדגם, מועד עשייתה צעדים מסוימים של מתח ESI עשוי להיות נחוץ כדי להשיג תוצאות דומות.
יתרון ייחודי מופעל על ידי הגדרת microfluidic הוא היכולת נוספת לשלב על שבב מערכת שאיבה, למשל, משאבה electroosmotic זרימה מונעת, 21,22 אשר תאפשר את הסטנד-אלפעולה אחת מהפלטפורמות ושילוב צעד הפרדה נוספת. היכולת לבצע על-שבב הפרדות של פפטידים שנוצרו באמצעות עיכול פרוטאוליטים תגרום מגבלות זיהוי משופרות, תקל על הניתוח של תערובות חלבון מורכבות מתמציות הסלולר. עוד דבר זה יאפשר השתלבותם של טכניקת זרימות עבודה העושות שימוש פלטפורמות microfabricated וזיהוי MS במהירות גבוהה עבור יישומים ביו. 23
Disclosures
The authors declare no competing financial interests.
Acknowledgements
This work was supported by NSF/DBI-1255991 grant to IML.
Materials
| Name | Company | Catalog Number | Comments |
| Ion trap ESI-MS | Thermo Electron | LTQ | The LTQ mass spectrometer is used for acquiring tandem MS data |
| XYZ stage | Newport | Multiple parts | The home-built XYZ stage is used to adapt the commercial LTQ nano-ESI source to receive input from various sample delivery systems |
| Stereo microscope | Edmund optics | G81-278 | The microscope is used to observe the microreactor packing process |
| Analytical balance/Metler | VWR | 46600-204 | The balance is used to weigh the protein samples |
| Ultrasonic bath/Branson | VWR | 33995-540 | The sonic bath is used for mixing/homogenizing the samples and dispersing the C18 particle slurry |
| Syringe pump 22 | Harvard Apparatus | 552222 | The micropump is used for loading, rinsing and eluting the sample and the enzyme on and from the packed capillary microreactor |
| Milli-Q ultrapure water system | EMD Millipore | ZD5311595 | The MilliQ water system is used to prepare purified DI water |
| Pipettor/Eppendorf (1,000 µl) | VWR | 53513-410 | The pipettor is used to measure small volumes of sample solutions |
| Pipettor/Eppendorf (100 µl) | VWR | 53513-406 | The pipettor is used to measure small volumes of sample solutions |
| Pipettor/Eppendorf (10 µl) | VWR | 53513-402 | The pipettor is used to measure small volumes of sample solutions |
| Fused silica capillary (100 µm ID x 360 µm OD) | Polymicro Technologies | TSP100375 | This capillary is used for the fabrication of the microreactor |
| Fused silica capillary (20 µm ID x 100 µm OD) | Polymicro Technologies | TSP020090 | This capillary is used for the fabrication of the ESI emitter |
| Fused silica capillary (50 µm ID x 360 µm OD) | Polymicro Technologies | TSP050375 | This capillary is used to transfer the samples and the eluent from the syringe pump to the capillary microreactor |
| Glass capillary cleaver | Supelco | 23740-U | This is a tool for cutting fused silica capillaries at the desired length |
| Glue | Eclectic Products | E6000 Craft | This glue is used for securing the ESI emitter into the capillary microreactor or the microfluidic chip |
| Epoxy glue | Epo-Tek | 353NDT | This glue is used to seal the microfluidic inlet hole through which the C18 particles are loaded |
| Reversed phase C18 particles (5 µm) | Agilent Technologies | Zorbax 300SB-C18 | These are C18 particles on which the proteins are adsorbed; the particles were extracted from a 4 mm x 20 cm C18 LC column from Agilent |
| Syringe/glass (250 µl) | Hamilton | 81130-1725RN | The glass syringes are used to load the C18 particle slurry in the capillary microreactor and to deliver the sample and eluents to the microreactor |
| Internal reducing PEEK Union (1/16” to 1/32”) | Valco | ZRU1.5FPK | This union is used to connect the 250 µl syringe to the microreactor for loading the 5 µm particle slurry |
| Stainless steel union (1/16”) | Valco | ZU1XC | The stainless steel union is used to connect the glass syringe needle to the infusion capillary |
| Microvolume PEEK Tee connector (1/32”) | Valco | MT.5XCPK | The Peek tee is used to connect the sample transfer capillary to the capillary microreactor; on its side arm, it enables the insertion of the Pt wire |
| Tee connector (light weight) | Valco | C-NTXFPK | This Tee connector is used to apply ESI voltage to the microfluidic chip through the sample transfer line |
| Pt wire (0.404 mm) | VWR | 66260-126 | The Pt wire provides electrical connection for ESI generation and is connected to the mass spectrometer ESI power supply |
| PTFE tubing (1/16” OD) | Valco | TTF115-10FT | The Teflon tubing is used to enable an air-tight connection between the syringe needle and the stainless steel union |
| PEEK tubing (0.015” ID x 1/16” OD) | Upchurch Scientific | 1565 | The Peek tubing is used as a sleeve to enable an air-tight connection between the stainless steel union and the 50 µm ID transfer capillary |
| PEEK tubing (0.015” ID x 1/32” OD) | Valco | TPK.515-25 | The Peek tubing is used as a sleeve to enable a leak-free connection between the fused silica capillaries and the Peek Tee |
| Clean-cut polymer tubing cutter | Valco | JR-797 | This cutter is used to pre-cut the 1/16” and 1/32’ Peek polymer tubing that is used as sleeve for leak-free connections in pieces of ~4-5 cm in length |
| Amber vial (2 ml) | Agilent | HP-5183-2069 | The vials are used to prepare sample solutions and the C18 particle slurry |
| Amber vial (4 ml) | VWR | 66011-948 | The vials are used to prepare sample solutions |
| Polypropylene tube (15 ml) | Fisher | 12-565-286D | The vials are used to prepare buffer solutions |
| Cylinder (100 ml) | VWR | 24710-463 | The cylinder is used to measure volumes of solvent |
| Cylinder (10 ml) | VWR | 24710-441 | The cylinder is used to measure volumes of solvent |
| Pipette tips (1,000 µl) | VWR | 83007-386 | The pipette tips are used to measure small volumes of sample solutions |
| Pipette tips (100 µl) | VWR | 53503-781 | The pipette tips are used to measure small volumes of sample solutions |
| Pipette tips (10 µl) | VWR | 53511-681 | The pipette tips are used to measure small volumes of sample solutions |
| Glass substrates | Nanofilm | B270 white crown, 3” x 3” | These are glass substrates for microchip fabrication |
| Male nut fitting (1/16”) | Upchurch | P203X | This fitting is used for connecting transfer capillaries to the microfluidic chip |
| Nanoport assembly | Upchurch | N-122H | This fitting is used for connecting transfer capillaries to the microfluidic chip |
| Protein standards | Sigma | Multiple # | |
| Acetonitrile, HPLC grade | Fisher | A955 | |
| Methanol, HPLC grade | Fisher | A452 | |
| Isopropanol, HPLC grade | Sigma | 650447 | |
| Trifluoroacetic acid | Sigma | 302031 | |
| Ammonium bicarbonate | Aldrich | A6141 | |
| Trypsin, sequencing grade | Promega | V5111 |
References
- Petersen, D. H. Microfluidic Bioreactors. Encyclopedia of Microfluidics and Nanofluidics. , Springer Science+Business Media. New York. (2014).
- Matosevic, S., Szita, N., Baganz, F. Fundamentals and applications of immobilized microfluidic enzymatic reactors. J. Chem. Technol. Biotechnol. 86 (3), 325-334 (2011).
- Liu, Y., Liu, B., Yang, P., Girault, H. H. Microfluidic enzymatic reactors for proteome research. Anal. Bioanal. Chem. 390 (1), 227-229 (2008).
- Wu, H., Zhai, J., Tian, Y., Lu, H., Wang, X., Jia, W., Liu, B., Yang, P., Xu, Y., Wang, H. Microfluidic enzymatic-reactors for peptide mapping: strategy, characterization, and performance. LabChip. 4 (6), 588-597 (2004).
- Jin, L. J., Ferrance, J., Sanders, J. C., Landers, J. P. A microchip-based proteolytic digestion system driven by electroosmotic pumping. LabChip. 3 (1), 11-18 (2003).
- Asanomi, Y., Yamaguchi, H., Miyazaki, M., Maeda, H. Enzyme-immobilized microfluidic process reactors. Molecules. 7 (16), 6041-6059 (2011).
- Aravamudhan, S., Joseph, P. J., Kuklenyik, Z., Boyer, A. E., Barr, J. R. Integrated microfluidic enzyme reactor mass spectrometry platform for detection of anthrax lethal factor. 31.st. Annual International Conference of the IEEE EMBS, , 1071-1074 (2009).
- Liu, X., Lo, R. C., Gomez, F. A. Fabrication of a microfluidic enzyme reactor utilizing magnetic beads. Electrophoresis. 30 (12), 2129-2133 (2009).
- Liu, Y., Xue, Y., Ji, J., Chen, X., Kong, J., Yang, P., Girault, H. H., Liu, B. Gold nanoparticle assembly microfluidic reactor for efficient on-line proteolysis. Mol. Cell. Proteomics. 6 (8), 1428-1436 (2007).
- Wu, H., Tian, Y., Liu, B., Lu, H., Wang, X., Zhai, J., Jin, H., Yang, P., Xu, Y., Wang, H. Titania and alumina sol-gel-derived microfluidics enzymatic-reactors for peptide mapping: design, characterization, and performance. J. Proteome Res. 3 (6), 1201-1209 (2004).
- Ji, J., Zhang, Y., Zhou, X., Kong, J., Tang, Y., Liu, B. Enhanced protein digestion through the confinement of nanozeolite-assembled microchip reactors. Anal. Chem. 80 (7), 2457-2463 (2008).
- Hustoft, H. K., Brandtzaeg, O. K., Rogeberg, M., Misaghian, D., Torsetnes, S. B., Greibrokk, T., Reubsaet, L., Wilson, S. R., Lundanes, E. Integrated enzyme reactor and high resolving chromatography in "sub-chip" dimensions for sensitive protein mass spectrometry. Scientific Reports. 3 (3511), 1-7 (2013).
- Pramanik, B. N., Mirza, U. A., Ing, Y. H., Liu, Y. H., Bartner, P. L., Weber, P. C., Bose, A. K. Microwave-enhanced enzyme reaction for protein mapping by mass spectrometry: A new approach to protein digestion in minutes. Protein Sci. 11 (11), 2676-2687 (2002).
- Olszowy, P. P., Burns, A., Ciborowski, P. S. Pressure-assisted sample preparation for proteomic analysis. Anal. Biochem. 438 (1), 67-72 (2013).
- Lord, G. A., Gordon, D. B., Myers, P., King, B. W. Tapers and restrictors for capillary electrochromatography and capillary electrochromatography-mass spectrometry. J. Chromatogr. A. 768, 9-16 (1997).
- Lazar, I. M., Kabulski, J. L. Microfluidic LC Device with Orthogonal Sample Extraction for On-Chip MALDI-MS Detection. Lab Chip. 13 (11), 2055-2065 (2013).
- Harrison, D. J., Manz, A., Fan, Z. H., Ludi, H., Widmer, H. M. Capillary electrophoresis and sample injection systems on a planar glass chip. Anal. Chem. 64 (17), 1926-1932 (1992).
- Jacobson, S. C., Hergenroder, R., Koutny, L. B., Warmack, R. J., Ramsey, J. M. Effects of Injection Schemes and Column Geometry on the Performance of Microchip Electrophoresis Devices. Anal. Chem. 66 (7), 1107-1113 (1994).
- Armenta, J. M., Perez, M. J., Yang, X., Shapiro, D., Reed, D., Tuli, L., Finkielstein, C. V., Lazar, I. M. Fast Proteomic Protocol for Biomarker Fingerprinting in Cancerous Cells. J. Chromatogr. A. 1217, 2862-2870 (2010).
- Doucette, A., Craft, D., Li, L. Mass Spectrometric Study of the Effects of Hydrophobic Surface Chemistry and Morphology on the Digestion of Surface-Bound Proteins. J. Am. Soc. Mass Spectrom. 14, 203-214 (2003).
- Lazar, I. M., Trisiripisal, P., Sarvaiya, H. A. Microfluidic Liquid Chromatography System for Proteomic Applications and Biomarker Screening. Anal. Chem. 78 (15), 5513-5524 (2006).
- Lazar, I. M., Karger, B. L. Multiple Open-Channel Electroosmotic Pumping System for Microfluidic Sample Handling,". Anal. Chem. 74 (24), 6259-6268 (2002).
- Lazar, I. M., Rockwood, A. L., Lee, E. D., Sin, J. C. H., Lee, M. L. High-speed TOFMS Detection for Capillary Electrophoresis. Anal. Chem. 71 (13), 2578-2581 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved