Method Article
単離とマウス大動脈の切除。心血管疾患の研究で多彩なテクニック
要約
Pathology of the aorta can lead to severe morbidity and mortality, therefore research of disease progression and potential therapies is warranted. Here, we present a protocol to isolate and excise the murine aorta to aid researchers in their investigation of cardiovascular disease.
要約
Cardiovascular disease is a broad term describing disease of the heart and/or blood vessels. The main blood vessel supplying the body with oxygenated blood is the aorta. The aorta may become affected in diseases such as atherosclerosis and aneurysm. Researchers investigating these diseases would benefit from direct observation of the aorta to characterize disease progression as well as to evaluate efficacy of potential therapeutics. The goal of this protocol is to describe proper isolation and excision of the aorta to aid investigators researching cardiovascular disease. Isolation and excision of the aorta allows investigators to look at gross morphometric changes as wells as allowing them to preserve and stain the tissue to look at histologic changes if desired. The aorta may be used for molecular studies to evaluate protein and gene expression to discover targets of interest and mechanisms of action. This technique is superior to imaging modalities as they have inherent limitations in technology and cost. Additionally, primary isolated cells from a freshly isolated and excised aorta can allowing researchers to perform further in situ and in vitro assays. The isolation and excision of the aorta has the limitation of having to sacrifice the animal however, in this case the benefits outweigh the harm as it is the most versatile technique in the study of aortic disease.
概要
大動脈は、酸素化された血液及び身体の他の同様の部分とボディを供給する血管機能において重要な役割を果たしている疾患に感受性である。一般的な大動脈疾患は、食事、喫煙と座りがちな生活1を含む、遺伝的要因と環境要因の結果であるアテローム性動脈硬化症や動脈瘤が含まれる。アテローム性動脈硬化症は、一般的に、慢性高脂血症2の患者で見つかった大動脈壁にカルシウムおよび脂質ベースのプラークの沈着である。動脈瘤は、最終的に3を破裂させる可能性があり拡径続い大動脈血管壁の菲薄化の構造成分の分解によって特徴付けられる。
動物モデルは、病気や潜在的な治療法の有効性のメカニズムを研究するために使用される重要なツールである。心血管の研究に使用される一般的な動物モデルは、特に、血管および代謝障害を調査研究そのようなアポリポタンパク質E遺伝子ノックアウトおよび低密度リポタンパク質受容体遺伝子ノックアウトマウス4などの脂質レベルを変化させる遺伝的に改変されたマウスを含む。疾患及び治療の有効性の機構を評価するための方法の大部分は大動脈の単離および切除を含むであろう。
大動脈は、ローカライズされ単離されると、形態学的分析は、このような動脈瘤の存在、典型的には、直径5で50%以上の増加として定義されるように、決定することができる。 in situ分析必要が完了したら、大動脈を、さらなる分析のために切り出すことができる。切除された大動脈は、タンパク質および/または遺伝子発現アッセイまたは分子的研究を行うために急速冷凍することができ、4%パラホルムアルデヒドを用いて固定し、後で、包埋し、組織学的分析のために染色した。大動脈の組織学的分析は、そのような構造劣化、プラーク形成、および白血球の浸潤として大動脈疾患の共通の特徴を示すことができる 6,7。さらに、切除された大動脈は、その後in vitro試験7のさまざまな目的で使用することができ、内皮細胞および平滑筋細胞を含む初代細胞株を単離することができる。
現在、大動脈疾患のこの深いキャラクタリゼーションを提供するだけでなく、さらなる心臓血管疾患を研究するためのツールを研究者に提供するための他の方法はない。例えば、磁気共鳴画像のような画像診断法は、コンピュータ断層撮影および超音波検査は、形態学的に大動脈を評価するための最も近い方法であるが、これは、小動物では困難であり、適切な技術と装置を得ることが8に高価である。不死化細胞株は、しかしながら、これらの細胞の人工的な性質は、細胞のライフサイクルおよびアポトーシス9への影響を研究に制限されている疾患および治療 の有効性の潜在的なメカニズムを調査するために購入することができる。
の全体的な目標この原稿は、心血管疾患の調査にマウス大動脈の無菌分離および切除を実証することである。
プロトコル
全ての動物手順は、シンシナティ大学の制度的動物実験委員会の承認を得て、および国立衛生研究所(NIH公開番号85から23から実験動物の管理と使用に関する指針に従って行った)1996年改訂。
1.マウスの準備
- 麻酔薬のsupratherapeutic線量に動物を暴露することにより安楽死させる、イソフルランは効果に吸入さ。侵害刺激としてつま先のピンチを経由して第一の安楽死を確認してください。安楽死、ダイヤフラム切断の二の方法は、今後のステップで発生します。代替方法が安楽死が得られる付与に使用することができる。
- Sanitizie水分のポイントに70%エタノールで、最初のカットが行われる腹部に沿って毛皮を噴霧することにより、マウスの外面は、そのように毛皮は、エタノールで濡れていると緩ん/ドライ毛は入力しないでください地域。
- シュール上でマウスをレイアウト上下の付属と仰臥位での外科ボードは、外側に延長した。
- サージカルテープを使用してボードへの安全な付属。
ハートと大動脈の2の分離
- マウスの適切な位置決めした後、検索し、胸骨の剣状突起のすぐ下腹部の皮膚を隔離するために鉗子を使用しています。
- まっすぐに肌を持ち上げて緊張を作成し、腹膜や胸腔の劣る部分の優れた部分を露出させ、表面的な皮膚を除去するためにハサミを使用しています。
- 剣状突起を持ち上げると肋骨下の余白に沿ってプロセスのすぐ下の横切開を行うことで、腹腔を入力します。
- 心臓や大きな血管をlacerateしないように注意してくださいという、横隔膜を経由、胸腔内にアップ解剖。
- 胸郭の前方部分を除去するためのステップ2.3頭側で行われた横方向の切開を拡張します。もし必要に応じて、鈍的切開を使用して前胸壁から心臓を解放。
- 材料を吸収するために滅菌ガーゼを使用して余分な血液や体液の胸腔を清掃してください。エリアをより見やすくしたら、より良い心と大動脈を露出させ、肺を削除します。
ハートと大動脈の3灌流
注:このステップにとても直前に行い、心穿刺によって血液を入手します。
- 無菌の氷冷1×リン酸緩衝溶液(PBS)10mlで10 1ccシリンジに充填し、シリンジに25ゲージの針を取り付ける。
- 静かに心臓の左心室に針を挿入します。
- 灌流からの圧力の蓄積を軽減するために右心房をカット。 3分 - 2の上にマウスに注射器の内容物を灌流。
- 灌流液を吸収するために右心房の開口部で滅菌ガーゼを使用してください。
大動脈の4.絶縁と切除
- ペーが完了するとrfusion、胸腔内の視野を曇り、残りの流体を吸収するために滅菌ガーゼを使用しています。
- 恥骨の領域に切開を延長、腹壁を通して尾側に切断することによって胃腸の内容を公開します。二国間釘付けまたは削除することができ、皮膚のフラップを作成するために下肢に向けてさらなる切開を拡張します。
- より良い大動脈を可視化するために、肝臓、膵臓、胃、脾臓、および腸のローブを削除します。大動脈は、腎動脈の枝で表面的であるように、腎周囲領域の近く解剖ときは注意してください。
注:正確な中で、このステップを実行し、消化管の汚染の傾向を増加させ、細菌に富んでいるような方法を入学。 - 1×PBSで領域をすすぎ、滅菌ガーゼで吸収して、すべての流体を除去。
- 無菌microscissorsとマイクロピンセットを使用して、背骨の背側と腹側に食道から大動脈を分離する。それは、鈍的切開し、このための解剖顕微鏡を利用した使用するのが最適です。
注:大動脈を単離する際に、腸骨分岐部に尾開始し、尾側に解剖頸動脈と腕頭動脈の頭側頭側の洗浄とキャビティの背側表面から大動脈を分離移動したり、開始します。どちらの方法が適切であると研究者の快適性に任されています。 - 大動脈壁の一部を除去しないように注意してくださいという細かいmicroscissorsを使用して血管周囲の脂肪組織を削除します。これは、大動脈平滑筋細胞を培養する際に、線維芽細胞の混入の可能性を最小限に抑えることが不可欠である。
結果
手続きが完了すると、まだ添付腎動脈と胸部と腹部の空洞( 図1A)に下降、心から発信無傷で大動脈があるでしょう。ここからは、大動脈は、腹部大動脈瘤( 図1Bおよび1C)の研究での診断である形態学的変化を定量化するために、その場で画像化することができる。その後、大動脈を取り出し、固定し、組織学的変化を見るために染色することができる。大動脈の一般的な共通染色はヘマトキシリンおよびエオシン染色( 図2Aおよび2B)である。加えて、大動脈の構造的完全性を定性的エラスチンバンド( 図2C及び2D)を見てVerhoffバンGeison染色を用いて定量することができる。代わりに、組織学的分析を得るための、点滅することが研究者は、その後のタンパク質とリボ核酸expreための大動脈を凍結するssion。研究者のための最後のオプションは、初代細胞分離を得るために、大動脈を使用することである。これらの細胞は、培養物( 図3A)中で増殖および生存研究( 図3B)、およびタンパク質局在化( 図3C)を含む、 インビトロでの様々な研究のために使用することができる。

マウス大動脈のその場の代表的な画像で、図1。副腎における動脈瘤と病気の腹部大動脈の(A)心臓や腎臓などの大動脈の単離後の正常マウス解剖の描写。通常の無傷のマウス腹部大動脈の(B)拡大画像。(C)拡大画像地域。 番目の拡大版を表示するには、こちらをクリックしてください図である。
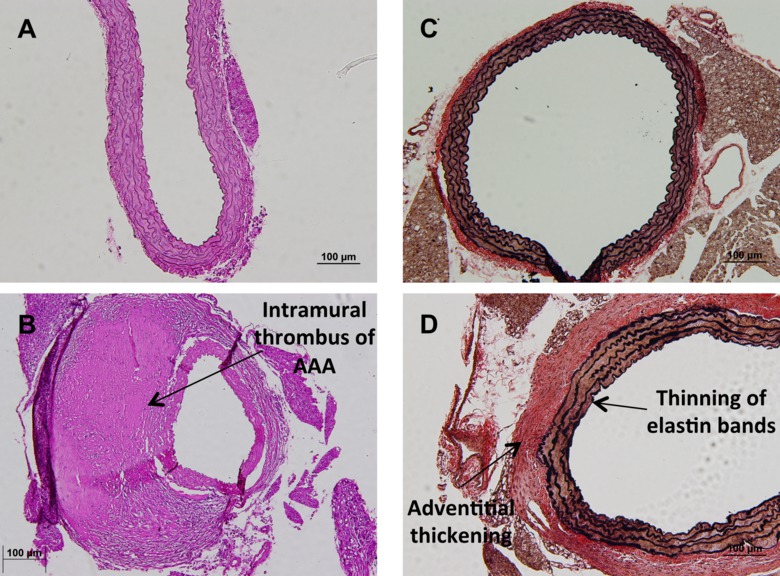
マウス大動脈の2組織学的分析図。 20X倍率で(A)健康副腎大動脈の通常のヘマトキシリン及びエオシン汚れの代表画像。(B)20X倍率でヘマトキシリン及びエオシン染色後に学内血栓と動脈瘤副腎大動脈の代表画像。(C)の代表的な画像VerhoffバンGeisonステイン、10倍の倍率で正常な副腎大動脈のエラスチンのバンドを強調している。(D)エラスチンバンドや肥厚の間伐とstriatingによって注意副腎大動脈開発疾患のエラスチンバンドを強調VerhoffバンGeison染色の代表的な画像外膜層の。 してくださいCLIこの図の拡大版をご覧になるにはこちらをCK。

図3.プライマリ大動脈筋細胞は、大動脈から培養。 (A)腹部大動脈から得た20倍の倍率で、培養中の主要動脈の筋細胞の代表的画像。(B)から得られた20倍の倍率でのH 2 O 2の500μM処理後、トリパンブルー排除アッセイ中の主要動脈の筋細胞の代表的な画像腹部大動脈。(C)腹部大動脈からの一次分離株大動脈平滑筋細胞におけるアルファアクチンのための免疫組織化学染色の代表的なイメージ。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
Aortic disease can lead to significant systemic pathology and possibly death in severe cases. Treatment options are currently limited therefore continued research in the field is necessary10. Murine models are ideal to further study disease progression and potentially therapeutic options4. Therefore, the successful completion of the method described in this manuscript will provide investigators with the tools to measure disease progression and drug efficacy.
This technique can be modified in several ways in order to optimize the results. The use of surgical loupes or a dissecting microscope can aid in the visualization of the murine anatomy and vasculature details and when removing surrounding adipose tissue from the aorta. Additionally, the use of dedicated surgical utensils for specific tasks can increase the longevity of tools; for example, the use of scissors for cutting skin and separate scissors to cut through the ribs would be ideal. The use of a small gauged needle when perfusing the heart is preferred as this will allow the tissue to close around the puncture as opposed to a larger gauge needle where a hole will remain.
After the aorta is successfully removed, it can be utilized for a variety of assays. The aorta can be used for molecular studies such as enzyme activity, protein expression and gene expression profiles. Additionally, the aorta can be fixed for histologic analysis where in situ assays can be utilized as well as characterization of the aortic morphology. Finally, one can isolate smooth muscle and/or endothelial cells from a freshly harvest aorta for in vitro studies with these primary isolated cells.
The major limitation to isolation and excision of the aorta is that the animal must be sacrificed, especially in the cases of longitudinal studies. Currently, there is no single technique comparable to isolation and excision of the murine aorta. Small animal imaging technologies is becoming more advanced and approaching characterization capabilities of direct observation however it continues to have limitations including cost8. Immortalized cells lines can be used for in vitro studies however immortal cells are not as useful as primary isolated cells for in vitro assays especially for viability studies9. Isolation and excision of the murine aorta is currently the most versatile technique that can be used in the study of aortic disease.
開示事項
著者らは、開示することは何もない。
謝辞
著者は全く確認応答がありません。
資料
| Name | Company | Catalog Number | Comments |
| Isoflurane | Med-Vet International | #RXISO-250 | |
| 70% ethanol | Fisher | 07-678-001 | |
| Phosphate buffered saline | Sigma Aldrich | P5368-10PAK | |
| Surgical tape | 3M | 1527-1 | |
| Sterile gauze | Dukal Corporations | 1312 | |
| 25 gauge needle | BD | 305122 | |
| 10 ml syringe | BD | 309604 |
参考文献
- Go, A. S., et al. Heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129 (3), 28-292 (2014).
- Ross, R., Harker, L. Hyperlipidemia and atherosclerosis. Science. 193 (4258), 1094-1100 (1976).
- Clouse, W. D., et al. Acute aortic dissection: population-based incidence compared with degenerative aortic aneurysm rupture. Mayo Clin Proc. 79 (2), 176-180 (2004).
- Daugherty, A., Cassis, L. A. Mouse models of abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 24 (3), 429-434 (2004).
- Pleumeekers, H. J., et al. Aneurysms of the abdominal aorta in older adults. The Rotterdam Study. Am J Epidemiol. 142 (12), 1291-1299 (1995).
- Brophy, C. M., Reilly, J. M., Smit, G. J., Tilson, M. D. The role of inflammation in nonspecific abdominal aortic aneurysm disease. Ann Vasc Surg. 5 (3), 229-233 (1991).
- Ray, J. L., Leach, R., Herbert, J. M., Benson, M. Isolation of vascular smooth muscle cells from a single murine aorta. Methods Cell Sci. 23 (4), 185-188 (2001).
- Weiss, R. G. Imaging the murine cardiovascular system with magnetic resonance. Circ Res. 88 (6), 550-551 (2001).
- Graham, E. L., Balla, C., Franchino, H., Melman, Y., del Monte, F., Das, S. Isolation culture, and functional characterization of adult mouse cardiomyoctyes. J Vis Exp. (79), 50289 (2013).
- Wassef, M., Upchurch, G. R., Kuivaniemi, H., Thompson, R. W., Tilson, M. D. 3. r. d. Challenges and opportunities in abdominal aortic aneurysm research. J Vasc Surg. 45 (1), 192-198 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。