Method Article
בידוד וכריתה של אב העורקים Murine; טכניקה רב-תכליתית בחקר לב וכלי דם מחלות
In This Article
Summary
Pathology of the aorta can lead to severe morbidity and mortality, therefore research of disease progression and potential therapies is warranted. Here, we present a protocol to isolate and excise the murine aorta to aid researchers in their investigation of cardiovascular disease.
Abstract
Cardiovascular disease is a broad term describing disease of the heart and/or blood vessels. The main blood vessel supplying the body with oxygenated blood is the aorta. The aorta may become affected in diseases such as atherosclerosis and aneurysm. Researchers investigating these diseases would benefit from direct observation of the aorta to characterize disease progression as well as to evaluate efficacy of potential therapeutics. The goal of this protocol is to describe proper isolation and excision of the aorta to aid investigators researching cardiovascular disease. Isolation and excision of the aorta allows investigators to look at gross morphometric changes as wells as allowing them to preserve and stain the tissue to look at histologic changes if desired. The aorta may be used for molecular studies to evaluate protein and gene expression to discover targets of interest and mechanisms of action. This technique is superior to imaging modalities as they have inherent limitations in technology and cost. Additionally, primary isolated cells from a freshly isolated and excised aorta can allowing researchers to perform further in situ and in vitro assays. The isolation and excision of the aorta has the limitation of having to sacrifice the animal however, in this case the benefits outweigh the harm as it is the most versatile technique in the study of aortic disease.
Introduction
אב העורקים ממלאים תפקיד מרכזי בתפקוד לב וכלי דם מספק לגוף את הדם מחומצן וחלקים דומים לאחרים בגוף, הוא רגיש למחלות. מחלות אב העורקים נפוצות כוללות טרשת עורקים ופרצה, שהן התוצאה של גורמים גנטיים וסביבתיים הכוללים תזונה, עישון ואורח חיים בלתי פעיל 1. טרשת עורקים היא בתצהיר של סידן ורובד שומנים מבוסס לקיר אב העורקים נמצא בדרך כלל בחולים עם היפרליפידמיה כרונית 2. מפרצת מתאפיינת השפלה של הרכיבים המבניים של אב העורקים והדילול של קיר הכלי, ואחריו עלה שקוטר סופו של דבר עלול להוביל לקרע 3.
מודלים של בעלי החיים הם כלים חשובים המשמשים ללמוד את המנגנון של מחלה ויעילות של טיפולים אפשריים. מודלים של בעלי חיים נפוצים בשימוש במחקר לב וכלי דם, המחקר ספציפי חוקרים הפרעות כלי דם וחילוף חומריםכוללים עכברים מהונדסים גנטי כדי לשנות את רמות שומנים בדם כגון נוקאאוט גן E אפוליפופרוטאין ועכברים נוקאאוט גן קולט ליפופרוטאין בצפיפות נמוך 4. רוב השיטות להערכת מנגנונים של מחלה ויעילות של טיפול יכלול בידוד וכריתה של אב העורקים.
ברגע שהאב העורקים הוא מקומי ומבודד, ניתן לקבוע ניתוח morphometric, כגון נוכחות של מפרצת, בדרך כלל מוגדרת כעלייה של יותר מ 50% בקוטר 5. לאחר הצורך בניתוח אתרו הוא מוחלט, אב העורקים ניתן נכרת לניתוח נוסף. אב העורקים נכרתו ניתן פלאש קפוא לערוך מחקרים מולקולריים כגון חלבון ו / או מבחני ביטוי גנים או קבוע באמצעות paraformaldehyde 4% ולאחר מכן משובץ, מחולק ומוכתם לניתוח היסטולוגית. ניתוח היסטולוגית של אב העורקים יכול להדגים תכונות נפוצות של מחלת אב העורקים כגון השפלה מבנית, היווצרות רובד, וחדירה של לויקוציטים 6,7. בנוסף, אב העורקים נכרתו יכולים לשמש כדי לבודד שורות תאים עיקריות כוללים תאי שריר אנדותל וחלק אשר לאחר מכן יכול לשמש למגוון רחב של מחקרים במבחנת 7.
נכון לעכשיו, אין שיטות אחרות כדי לספק אפיון מעמיק זה של מחלה באב עורקים, כמו גם לספק לחוקרי כלים ללמוד מחלות לב נוספת. שיטות הדמיה כמו הדמיה בתהודה מגנטית, טומוגרפיה ממוחשבת ובדיקה אולטרה סאונד הן השיטות הכי קרובה כדי להעריך את אב העורקים מורפולוגית, אולם זה קשה בבעלי חיים קטנים וקבלת מכשיר עם הטכנולוגיה מתאימה היא יקרה 8. ניתן לרכוש שורות תאים הונצחו לחקור מנגנונים אפשריים של מחלה ויעילות של טיפולים, אולם הטבע המלאכותי של תאים אלה מגבילים בחקר ההשפעות על מחזור החיים של התאים ואפופטוזיס 9.
המטרה הכוללת שלכתב יד זה הוא להדגים את הבידוד וכריתת סטרילי של אב העורקים העכבריים בחקירה של מחלת לב וכלי דם.
Protocol
נהלי כל החיה בוצעו באישורה של ועדת הטיפול ושימוש בבעלי חיים המוסדיים של אוניברסיטת סינסינטי ובהתאם למדריך לטיפול והשימוש בחי מעבדה מהמכון הלאומי לבריאות (NIH פרסום מס '85-23, מתוקן 1996).
1. הכנת העכבר
- להרדים על ידי חשיפת בעלי החיים למנת supratherapeutic של הרדמה, isoflurane בשאיפה להשפעה. ודא המתת חסד ראשונית באמצעות קמצוץ הבוהן כגירוי מזיק. שיטה משנית של המתת חסד, חיתוך סרעפת, תתרחש בשלב הקרוב. שיטות חלופיות ניתן להשתמש בהמתת חסד שהוענק מתקבלת.
- Sanitizie פני השטח החיצוני של העכבר על ידי ריסוס הפרווה לאורך אזור הבטן, שבו הקיצוצים הראשוניים ייעשו, עם 70% אתנול לנקודה של לחות, כך שהפרווה היא רטובה עם אתנול וכל שערות שנשר / יבשות לא נכנסות האזור.
- הנח את העכבר על surלוח gical במצב שכיבה עם נספחים העליונים ותחתונים מורחב כלפי חוץ.
- נספחים מאובטחים ללוח באמצעות קלטת כירורגית.
2. בידוד של הלב ואב העורקים
- לאחר מיצוב נכון של העכבר, להשתמש במלקחיים כדי לאתר ולבודד עור בטן רק נחותה לתהליך xiphoid של עצם החזה.
- ליצור מתח על ידי ההרמה ישר את העור ולהשתמש במספריים כדי להסיר את העור השטחי, חושף את החלק העליון של הצפק והחלק נחות של חלל בית החזה.
- הזן את חלל הצפק על ידי הרמת תהליך xiphoid וביצוע חתכים רוחב פשוט נחותים לתהליך בשולי subcostal.
- לנתח לתוך חלל בית החזה, הולך דרך הסרעפת, להיות בטוח שלא לקרוע את הלב או כל כלי דם גדולים.
- להאריך את החתכים הרוחב שנעשו בשלב 2.3 cranially כדי להסיר את החלק הקדמי של בית החזה. אםהכרחי, לשחרר את הלב מהחזה הקדמי באמצעות לנתיחה בוטה.
- נקה את חלל החזה של דם ונוזל זרים באמצעות גזה סטרילית לקלוט חומר. ברגע שהאזור הוא גלוי יותר, להסיר את הריאות כדי לחשוף את הלב ואב עורקים טוב יותר.
3. זלוף של לב ואב עורקים
הערה: לקבלת דם באמצעות לנקב לב, לעשות זאת רק לפני שלב זה.
- ממלאי מזרק 10 סמ"ק עם 10 מיליליטר של תמיסת חיץ פוספט 1x הקר כקרח סטרילי (PBS), ולצרף מחט 25 מד למזרק.
- הכנס בעדינות את המחט לתוך החדר השמאלי של הלב.
- חותך את אטריום הזכות להקל הצטברות לחץ מזלוף. Perfuse את תוכן המזרק לתוך העכבר מעל 2-3 דקות.
- השתמש בגזה סטרילית בפתיחה בעלייה הימנית לקלוט זלוף נוזל.
4. בידוד וכריתה של אב העורקים
- עם השלמת PErfusion, להשתמש גזה סטרילית על מנת לספוג את נוזלים שנותרו מעיבים על שדה הראייה בחלל בית החזה.
- לחשוף את התוכן של מערכת העיכול על ידי חיתוך caudally דרך דופן הבטן, הארכת החתך לאזור suprapubic. להאריך את החתך נוסף לקראת הגפיים התחתונים דו-צדדי ליצירת דשי עור אשר יכול להיות מרותק או נכרת.
- הסר את האונות של הכבד, לבלב, קיבה, טחול, מעי ולדמיין את אב העורקים טוב יותר. היזהר בעת לנתח ליד אזור perirenal, כאב העורקים הוא שטחי בסניפים של עורקי הכליה.
הערה: בצע פעולה זו באופן מדויק ותעודה בגרות כמערכת העיכול עשירה בחיידקים אשר מגביר את הנטייה לזיהום. - יש לשטוף את האזור עם 1x PBS ולהסיר את כל הנוזל על ידי קליטה עם גזה סטרילית.
- שימוש microscissors וmicroforceps סטרילי, להפריד את אב העורקים מdorsally עמוד השדרה והוושט ventrally.עדיף להשתמש בנתיחה בוטה וניצול מיקרוסקופ לנתיחה לזה.
הערה: בבידוד אב העורקים, להתחיל caudally בהסתעפות הכסל ולעבור cranially ניקוי והפרדת אב העורקים מפני השטח הגבי של החלל או להתחיל cranially בעורקי הצוואר ועורקי brachiocephalic לנתח caudally. שתי השיטות מתאימה ועד לנוחות החוקרים. - הסר את רקמת שומן perivascular באמצעות microscissors בסדר להיות בטוח שלא להסיר חלק מהקיר של אב העורקים. זה חיוני כדי לצמצם את הסיכון לזיהום פיברובלסטים כאשר culturing תאי שריר חלק באב עורקים.
תוצאות
עם השלמת ההליך, יהיו אב העורקים שלמים שמקורם בלב, יורדים לתוך חללי בית החזה ובטן עם עורקי הכליות עדיין מחוברים (איור 1 א). מכאן, אב העורקים ניתן הדמיה באתר לכמת שינויי morphometric שאבחון במחקר של פרצות אב העורקים בבטן (איור 1 ו1C). בהמשך לכך, ניתן להסיר את אב העורקים, קבוע ומוכתמים להסתכל על שינויים היסטולוגית. כתם כללי ונפוץ של אב העורקים הוא hematoxylin וכתם eosin (איור 2 א ו -2 ב). בנוסף, את השלמות המבנית של אב העורקים ניתן לכמת באופן איכותי באמצעות מכתים Verhoff אן Geison להסתכל על להקות אלסטין (איור 2 ג ו 2 ד). במקום קבלת ניתוח היסטולוגית, החוקר עשוי להבהב להקפיא את אב העורקים לחלבון שלאחר מכן וexpre חומצה ריבונוקלאיתssion. האפשרות האחרונה לחוקר היא להשתמש באב העורקים להשיג בידוד תא ראשוני. ניתן לגדל תאים אלה בתרבות (איור 3 א) ומשמשים למגוון רחב של מחקרים במבחנה כולל מחקרי כדאיות (איור 3) ולוקליזציה חלבון (איור 3 ג).

איור 1. בתמונות באתרו של נציג אב העורקים עכבריים. (א) תיאור של האנטומיה של העכבר הרגיל לאחר הבידוד של אב העורקים כולל הלב והכליות. (B) מוגדל תמונה של אב העורקים בבטן עכברי שלם נורמלי. (ג) מוגדל תמונה של אב העורקים בבטן חולה עם מפרצת בsuprarenal אזור. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של ההוא דמות.
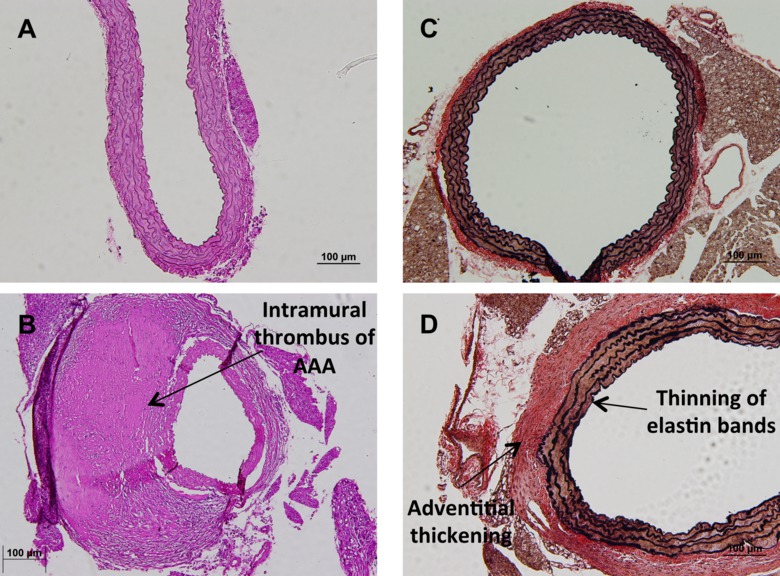
איור 2. ניתוח היסטולוגית של אב העורקים עכבריים. (א) תמונת נציג של כתם hematoxylin ו eosin נורמלי של אב העורקים suprarenal בריא בהגדלה 20X. תמונת נציג אב העורקים suprarenal aneurismal עם פקיק ביצוע עצמי לאחר hematoxylin וכתם eosin בהגדלה 20X (B). תמונת נציג (C) כתם Verhoff אן Geison, המדגיש את להקות אלסטין של אב העורקים suprarenal נורמלי בהגדלה 10x. תמונת נציג כתם Verhoff אן Geison מדגיש את להקות אלסטין של מחלה אב העורקים פיתוח suprarenal שצוין על ידי הדילול וחורץ את להקות ועיבוי אלסטין (D) של שכבת adventitial. אנא CLICK כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

3. myocytes אב העורקים הראשי איור תרבית מאב העורקים. תמונה מייצגת של myocytes אב העורקים המרכזי בתרבות בהגדלה 20X מתקבלת מאב העורקים בבטן (). תמונת נציג myocytes אב העורקים הראשי במהלך assay Trypan הכחול הדרה לאחר טיפול 500 מיקרומטר של H 2 O 2 בהגדלה 20X מתקבל מ( B) אב העורקים בבטן. (C) תמונת נציג כתם אימונוהיסטוכימיה ליקטין אלפא בתאים ראשוניים לבודד אב העורקים שריר חלק מאב העורקים בבטן. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
Aortic disease can lead to significant systemic pathology and possibly death in severe cases. Treatment options are currently limited therefore continued research in the field is necessary10. Murine models are ideal to further study disease progression and potentially therapeutic options4. Therefore, the successful completion of the method described in this manuscript will provide investigators with the tools to measure disease progression and drug efficacy.
This technique can be modified in several ways in order to optimize the results. The use of surgical loupes or a dissecting microscope can aid in the visualization of the murine anatomy and vasculature details and when removing surrounding adipose tissue from the aorta. Additionally, the use of dedicated surgical utensils for specific tasks can increase the longevity of tools; for example, the use of scissors for cutting skin and separate scissors to cut through the ribs would be ideal. The use of a small gauged needle when perfusing the heart is preferred as this will allow the tissue to close around the puncture as opposed to a larger gauge needle where a hole will remain.
After the aorta is successfully removed, it can be utilized for a variety of assays. The aorta can be used for molecular studies such as enzyme activity, protein expression and gene expression profiles. Additionally, the aorta can be fixed for histologic analysis where in situ assays can be utilized as well as characterization of the aortic morphology. Finally, one can isolate smooth muscle and/or endothelial cells from a freshly harvest aorta for in vitro studies with these primary isolated cells.
The major limitation to isolation and excision of the aorta is that the animal must be sacrificed, especially in the cases of longitudinal studies. Currently, there is no single technique comparable to isolation and excision of the murine aorta. Small animal imaging technologies is becoming more advanced and approaching characterization capabilities of direct observation however it continues to have limitations including cost8. Immortalized cells lines can be used for in vitro studies however immortal cells are not as useful as primary isolated cells for in vitro assays especially for viability studies9. Isolation and excision of the murine aorta is currently the most versatile technique that can be used in the study of aortic disease.
Disclosures
יש לי המחברים אין לחשוף.
Acknowledgements
אי לנו תודות.
Materials
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| Isoflurane | Med-Vet International | #RXISO-250 | |
| 70% Ethanol | Fisher | 07-678-001 | |
| Phosphate buffered saline | Sigma Aldrich | P5368-10PAK | |
| Surgical Tape | 3M | 1527-1 | |
| Sterile Gauze | Dukal Corporations | 1312 | |
| 25 Gauge Needle | BD | 305122 | |
| 10ml Syringe | BD | 309604 |
References
- Go, A. S., et al. Heart disease and stroke statistics--2014 update: a report from the American Heart Association. Circulation. 129 (3), 28-292 (2014).
- Ross, R., Harker, L. Hyperlipidemia and atherosclerosis. Science. 193 (4258), 1094-1100 (1976).
- Clouse, W. D., et al. Acute aortic dissection: population-based incidence compared with degenerative aortic aneurysm rupture. Mayo Clin Proc. 79 (2), 176-180 (2004).
- Daugherty, A., Cassis, L. A. Mouse models of abdominal aortic aneurysms. Arterioscler Thromb Vasc Biol. 24 (3), 429-434 (2004).
- Pleumeekers, H. J., et al. Aneurysms of the abdominal aorta in older adults. The Rotterdam Study. Am J Epidemiol. 142 (12), 1291-1299 (1995).
- Brophy, C. M., Reilly, J. M., Smit, G. J., Tilson, M. D. The role of inflammation in nonspecific abdominal aortic aneurysm disease. Ann Vasc Surg. 5 (3), 229-233 (1991).
- Ray, J. L., Leach, R., Herbert, J. M., Benson, M. Isolation of vascular smooth muscle cells from a single murine aorta. Methods Cell Sci. 23 (4), 185-188 (2001).
- Weiss, R. G. Imaging the murine cardiovascular system with magnetic resonance. Circ Res. 88 (6), 550-551 (2001).
- Graham, E. L., Balla, C., Franchino, H., Melman, Y., del Monte, F., Das, S. Isolation culture, and functional characterization of adult mouse cardiomyoctyes. J Vis Exp. (79), 50289 (2013).
- Wassef, M., Upchurch, G. R., Kuivaniemi, H., Thompson, R. W., Tilson, M. D. 3. r. d. Challenges and opportunities in abdominal aortic aneurysm research. J Vasc Surg. 45 (1), 192-198 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved