Method Article
CA1錐体ニューロンにおけるグルタミン酸のUV媒介焦点アンケージングと組み合わせることで、多光子細胞内ナトリウムイメージング
要約
私たちは、全細胞パッチクランプおよびマウス脳の急性組織切片における樹状突起および海馬ニューロンのスパインにおける細胞内ナトリウム過渡の多光子イメージングによる神経活性化合物の焦点UV誘導光活性化の組合せを記載。
要約
多光子蛍光顕微鏡は、高い空間および時間分解能で無傷組織における脳細胞の形態学的および生理学的パラメータの分析を可能にした。電気生理学と組み合わせることで、それは広く、樹状突起と樹状突起棘のような小さな細胞内コンパートメントでの活動に関連したカルシウムシグナルを研究するために使用されている。カルシウムトランジェントに加えて、シナプス活性はまた、シナプス後ナトリウム信号を誘導する、の特性がわずかに理解されている。ここでは、組み合わせたホールセルパッチクランプおよび中枢ニューロンの細胞ミクロドメインにおける多光子ナトリウムイメージングのための方法を記載する。さらに、私たちは組織内のグルタミン酸受容体の信頼性が高く、焦点活性化を可能にする、グルタミン酸の紫外線(UV)-LIGHT誘発性アンケージングのために変更された手順を紹介します。この目的のために、全細胞記録は、 アンモン角細分1(CA1)の急性組織切片における錐体ニューロンで行ったマウスの海馬。ニューロンは、パッチピペットを介してナトリウム感受性蛍光色素SBFIで満たされ、SBFIの多光子励起は樹状突起と隣接する棘の可視化を可能にしました。 UV誘発焦点アンケージングを確立するために、光強度、UVアンケージングビームの影響を受け、ボリューム、ビームの位置だけでなく、ケージド化合物の濃度を含むいくつかのパラメータがテストされ、最適化された。らの結果は、ケージドグルタミン酸(MNI-グルタミン酸)とそのローカル灌流及び樹状突起と棘内向き電流およびナトリウムトランジェントにおいてその焦点紫外線アンケージング結果を示す。時間経過と内向き電流およびナトリウム信号の両方の振幅はアンケージングパルスの持続時間と相関する。さらに、本発明者らの結果は、彼らがこの経路しかしナトリウム流入によって媒介されることを実証し、細胞内ナトリウム信号は、イオンチャネル型グルタミン酸受容体に対するブロッカーの存在下でブロックされていることを示している。要約すると、私たちの方法は、信頼性の高いツールを提供しています無傷の脳組織における焦点受容体活性化によって誘導される細胞内ナトリウム信号の調査。
概要
このような多光子顕微鏡などの光顕微鏡技術における最近の改善は、高い空間および時間分解能で無傷の組織中の脳細胞の形態学的および生理学的パラメータの研究を可能にした。電気と組み合わされ、これらの技術は、現在広くすなわち微細な樹状突起と樹状突起棘に、小さい細胞内コンパートメントにおけるニューロン上の活動に関連する電気信号、ならびに付随するカルシウムシグナルを分析するために使用される。カルシウムトランジェントに加えて、シナプス活性はまた、樹状突起と棘ナトリウム信号を誘導する、の特性が大幅に未調査である。このような信号は、iが有意な色素漂白または光損傷1,2なし長期間トランジェント( 私の[Na +])の[Na +]のオンライン測定を可能にする細胞内ナトリウムの二光子イメージングにより分析することができる。
の[Na +] iの画像化のためのサブ、わずか化学指示色素には、 例えば 、コロナグリーンまたはアサンテナトリウム-グリーン3,4用意されています。のNa +イメージングのための最も一般的に使用される蛍光プローブは、ナトリウム-結合ベンゾフランイソフタレート(SBFI)である。これは、よく知られているカルシウム感受性色素のfura-2と同様のレシオメトリック、UV励起色素であり、多くの細胞型( 例えば、5,6)従来のNa +イメージングのために使用されている。刺激的な色素およびその蛍光を収集する異なる可能性がある。高い時間分解能( すなわち高い撮像フレームレート)、空間情報との組み合わせで必要とされる場合、SBFI、高速電荷検出キセノンアークランプ、または高出力発光ダイオード(LED)素子とその発光によって励起することができ共役型デバイス(CCD)カメラ7,8。深部組織の最大の空間分解能のために、多光子レーザー走査顕微鏡は、選択9の方法である。比較的低い量子efficie( - 2mMの0.5)、そして鋭い微小電極10またはパッチピペット1を介してSBFIの膜不透過形の直接読み込みSBFIのNCYは、比較的高い染料濃度を必要とする。
SBFIを使用して、げっ歯類の海馬の急性組織切片で行わ以前の仕事は主に1,2受容体、イオンチャネル型NMDAを通してナトリウムの流入によって引き起こされるCA1錐体ニューロンの樹状突起と棘での活動に関連したナトリウムトランジェントを実証した。より詳細には、ローカルナトリウム信号の特性の研究のために、受容体アゴニストを適用することによって、シナプス後受容体の特異的活性化は、任意の適し方法である。シナプス前活動と伝達物質の放出を模倣するには、アプリケーションが比較的短いこと、地域的刺激を可能にするために集中しなければならない。しかし、これは、無傷の組織において非常に困難であることが分かる。先の細いピペットを用いて受容体アゴニストの局所加圧は非常に焦点のpを可能にひだが、( 例えば、樹状突起、または樹状突起棘のような)関心構造の運動を生成するための潜在的なリスクをホストし、かつ、高分解能イメージングを妨げる。神経活性物質のイオントフォレーシスの適合性は、それらの電気的性質に依存し、高電流振幅は、同様に細胞のアーティファクトを生成することができる。
これらの障害を回避する一つの方法は、光活性化化合物およびそれらの閃光光分解の採用である。基本的には、二つの異なる原理ケージ物質の光活性化のために使用されている:私は)広い視野閃光光分解11およびII)レーザ12と組み合わせて、スキャンモジュールを採用し、焦点アンケージング。広視野閃光光分解が関心の大きな領域を活性化するために使用されているが、 例えば、セル全体は、焦点アンケージングは、特に小細胞区画を刺激するために使用される。本研究では、全細胞パッチクランプおよびマルチpに対する手順を実証組織内のグルタミン酸受容体の信頼性が高く、焦点活性化を可能にする、グルタミン酸の紫外線光誘導アンケージングのための修正された手順と組み合わせた中枢ニューロンの樹状突起と棘におけるhotonナトリウムイメージング、。
プロトコル
この研究は、ハインリッヒ·ハイネ大学デュッセルドルフ、ドイツだけでなく、欧州共同体理事会指令(609分の86 / EEC)の施設のガイドラインに厳密に従って行った。全ての実験はに伝達し、ハインリッヒ·ハイネ大学デュッセルドルフ、ドイツ(制度的行動番号:Ø52/ 05)の動物管理使用施設で動物福祉事務所によって承認された。ドイツの動物保護法(Tierschutzgesetz記事4,7)によると、脳組織の死後を除去するための正式な追加の承認が必要ではなかった。
実験動物の安楽死、ルクセンブルグ:急性スライスの世代のために、マウスに公開された欧州委員会の勧告下記(断頭すぐにCO 2で麻酔し、そして欧州共同体1997の公式出版物のためのオフィス、ISBN 92-827-9694 -9)。
の調製ソリューション
- 95%のO 2を通気し125のNaCl、2.5のKCl、0.5のCaCl 2、6のMgCl 2、1.25のNaH 2 PO 4、26 NaHCO 3、および20グルコース、および:(単位はmM)を含む解剖用の人工脳脊髄液(ACSF)を調製5%CO 2、7.4のpHが得られる。
- (単位はmM)を含有する実験用ACSFを準備する:125のNaCl、2.5のKCl、2のCaCl 2、1mMのMgCl 2、1.25のNaH 2 PO 4、26 NaHCO 3、および20グルコース、得られた、95%O 2および5%CO2でバブリング7.4のpHの。
- 150 KMeSO 3、12.5ヒドロキシエチルピペラジンエタンスルホン酸(HEPES)、40のKCl、5のNaCl、1.25エチレングリコール四酢酸(EGTA)、5のMg-ATP、0.5 Na塩:細胞内液(ICS)(単位はmM)を含有する準備GTP。 7.3にpHを調整する。 -20℃で1ミリリットルの店舗分量。
- 二回蒸留水にナトリウム - 結合ベンゾフランイソフタレート(SBFI) - 塩を希釈し、5μlのアリコートを準備10 mMのストック溶液。
- 融解ICSおよび1mMの最終濃度でSBFIストック溶液を加える。ボルテックスとマイクロ濾過液(0.22μm)で。実験に使用するまで4℃で保管してください。再凍結と1日だけ使用しないでください。
- 二重蒸留水に化合物を溶解することにより50mMにMNIグルタミン酸ストック溶液を調製する。通常のACSF中の5mMの最終濃度までMNIグルタミン酸原液を希釈する。実験に使用するまで4℃で保管してください。再凍結と1日だけ使用しないでください。すぐに-20℃で、実験で使用されていない店舗分量、。
組織の2解剖
NOTE:齧歯類の脳の急性海馬スライスの調製は、以前13,14について詳細に説明した。簡単に説明すると、以下のプロトコルを本研究で使用した。
- 断頭後、速やかに頭蓋骨から脳を削除します。
- すぐにペトリ皿に脳を配置氷のように冷たい解剖ACSFで正中線に沿って矢状カットを実行することにより、半球を解剖。
- ブロッキング面として所望の向きに第二の切り込みを行い、瞬間接着剤でビブラトームの切断段階にこれを添付してください。
- チャンバーを切断し、チャンバー内の脳切片でのステージを切断冷凍庫と場違いビブラトームの要素を(いずれも-20℃に保たれ)冷却ください。その後、チャンバー内に冷却要素を入れて、氷のように冷たい解剖ACSFにおける組織水没。準備を安定させるためには、寒天ゲルと組織ブロックに対抗することができます。
- ビブラトームと海馬の厚さ250μm、矢状スライスをカット。すべてのACSの流体が常時バブリングされていることを確認。
- スライスした後、通常のACSFでビーカーにメッシュ上に組織を維持し、30分間34℃でインキュベートする。その後、室温で保管してください。
ハードウェアの調製
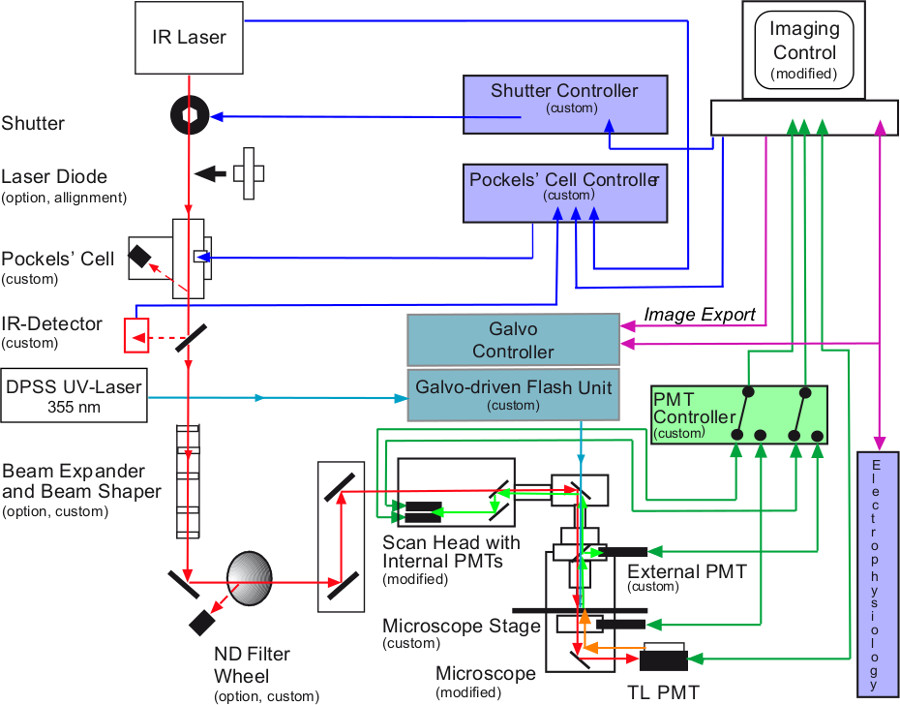
光路と多光子イメージング、レーザー走査UV閃光光分解、および電気生理学からなるリグの実験的制御を示す。多光子ビーム(赤)は、パルス、調整可能な赤外線(IR)レーザーにより生成される図1のスキーム (TISA)。これは、レーザパワーとその投与期間の制御を可能に全てが、メカニカルシャッター、ポッケルス、およびIR検出器(ビーム強度の検出)を通過する。フリップイン/フリップアウトオプションのレーザダイオードは、レーザ光の基本的な位置合わせのために使用される。ビームエキスパンダは極めて広く、バック焦点面での目標と組み合わせて使用することができる。遠隔制御NDフィルタホイールは、レーザビームのパワーを制御することに加えてまたはその代わりにポッケルス '細胞を用いてもよい。走査ヘッドを通過した後、パルス状のIR光は、試料に導かれる。発するテッド蛍光ライト(ライトグリーン)は、外部または内部の光電子増倍管検出器(光電子増倍管)のいずれかによって収集されます。外部検出器は、完全に高周波スイッチ(PMTコントローラ)を介して内部のPMTと同期される。アンケージングビーム(水色)は、UV固体レーザ(DPSS UV-レーザー)によって製造される。次いで、それをライトガイドによる落射蛍光凝縮器の最背面にガルボ駆動型走査ユニットに向けられている。アンケージングスポットやエリアの正確な位置決め(イメージングとアンケージングビーム間の色収差)がイメージングソフトウェアから画像をエクスポートすると有効になります。イメージング、電気生理学、および閃光光分解を同期するためのタイミング管理は、電子的に制御される。透視検出器(TL-PMT)は、組織内のピペットの位置の文書化の必要性である。制御ユニット及び変更されている撮像システムのソフトウェアは、他のすべてのデバイスを制御し、同期させるために使用さシステムを実行する必要がありました。 「カスタム」と表示システムコンポーネントを設計し、および/著者によって適応ビルド。一部のコンポーネントは、カスタム·ビルド多光子システムの要件を満たすように適合させたと「修飾」と表示されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 多光子システムのコンポーネントに切り替えます。赤外レーザ光の整列をテストおよび調整します。
- 代わりに、対物レンズの中心としたプリズムで反転させることで、制御ビーム位置決め。ビームがずれている場合は、潜望鏡内のミラーでそれを再調整します。イメージングながらプリズムのセンタリング面は、対物レンズの後焦点面と同じレベルでなければならないことに注意してください。
- 分光計で切り替えて、光の多光子の特性を確認してください。
- 次の値にイメージングソフトウェアのパラメータを設定します。選択してくださいセルの概観画像のための512×512ピクセルのフレームサイズ(高フレームレート及び高空間分解能2.5のズーム倍率より小さなクリップボックス、それぞれ)。 XYTへの高速モードとスキャンモードにイメージング速度を設定します。 Z-ステッピングの概要スタックと、後のデコンボリューションのための空間サンプリング要件に合わせて詳細なスタックのために0.2μmのための1以下である必要があります。
- そして、フォトマルチプライヤ(光電子増倍管) - (16μW≈14客観下、最終的なパワー)ポッケルス」セルの設定を変更することにより、多光子レーザー(790 nm)の強度を調整します。
- スイッチを入れると、対物レンズの下に蛍光試料スライドを配置することによってアンケージングシステムを較正。
- 双眼鏡を使用して、紫外線光学系の焦点を調整し、空間的にUGAスキャンヘッドでフォーカスユニットを採用することで、最大で直径2ミクロンの大きさにUVレーザスポットを制限する。
- アンケージングユニット制御softwarのキャリブレーション·ルーチンを起動します。メール。
- 蛍光は、CCDカメラで撮影している間に、その走査範囲内のいくつかのポイントにUVレーザーを設定します。各点でのUVレーザスポットをクリックすることによって、ソフトウェアで、特定の座標に対応するガルバノスキャンミラーの位置を調整する。
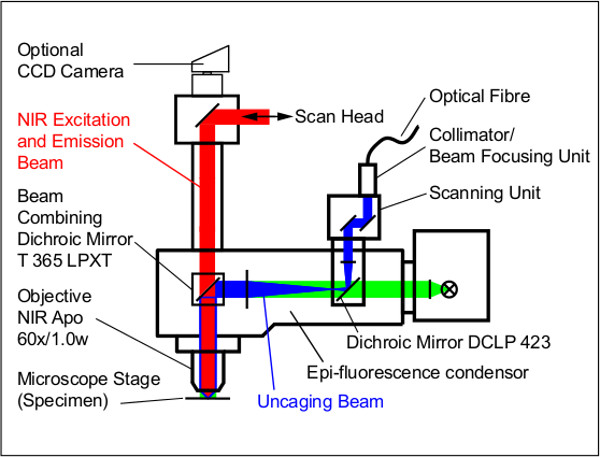
図2の詳細なスキームは、励起、発光およびアンケージングビーム経路の特性を示す。IR励起ビーム(赤)は、顕微鏡の落射蛍光凝縮器におけるファイラタレットと対物へのレベルで、ダイクロイックミラーを組み合わせた光を通過さ標本に達する。アンケージング光(青)コリメーション及びビーム集束ユニットに石英系光光ファイバを介して配信され、その後、スキャンマイルに導かれる走査ユニットにおけるrrorsは、ダイクロイックミラービーム結合するダイクロイックミラーを通過する。ここでは、励起走査ビームと結合される。試料から放出された光は、イメージングスキャンヘッドに向かって反対向きに励起走査ビーム経路の経路をたどる。カメラは、パッチピペットの視覚的制御のために、共焦点レーザー走査顕微鏡(図示せず)と組み合わせたアンケージングビームの位置決めに使用される。緑色の光路は、他のアプリケーションで有用であり得る任意の落射蛍光照明を表す。
- 焦点のアプリケーションを得るために、スポットモードでフラッシュ光分解システムを使用してください。のものに対応するzレベルに位置する蛍光スライドで、直径1.5μmのスポットサイズ(XY拡張子)で結果が明らかになったとおりアンケージング光(0.55 mWの目的の下に、平均電力)の焦点調整がいることを確認してください組織スライス(図示せず)。
- アンケージングスポットの正確な位置決めはuncaging-とイメージング·コンピュータ間のネットワーク接続を介して撮像システムの画像をインポートすることによって達成される。
- 画面グラバーソフトウェアを使用して、連続して画像化ソフトウェア(の代わりに、カメラフィード)のフレームを読み出し、合同イメージングとアンケージングのフレームを調整します。実験全体の間に適切な調整を確実にするために、フラッシュユニットに参照画像としてイメージングソフトウェアから毎10 番目のフレームをエクスポートします。

アンケージングスポットの図3。調整:正確にアンケージングスポットを配置するために、イメージングソフトウェア(黄色の枠)のスクリーンショットは、アンケージングソフトウェア(緑枠)にインポートされます。ザ·全体CA1錐体細胞の(飽和画素:黒色画素は、赤、青)を黄色枠内の左画像はハイローコード化された画像を表す。イメージはアンケージングソフトウェア(緑 "X"可)のキャリブレーショングリッドによってオーバーレイされます。右側には、セルの拡大部分は重ねてアンケージングスポット(赤い十字)で示されている。黄色のスポットがアンケージングビームの自動的に重ね合わせた画像である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- マニピュレーター、電気生理学コンポーネント、および標的領域ケージド化合物を送達するための圧力印加装置の電源をオンにします。
- ケージド化合物の局所灌流のための焦点の圧力印加装置を取り付けます。これらの物質の浴灌流と比較して、これは非常にコストを削減する。 ACの抗力を防止するために、与えられた大気圧に保持圧力を調整中にSFやアプリケーションピペットからケージ物質の漏出。
注:圧力印加装置は、ピペットホルダーに高精度かつ超高速マイクロバルブを開催しています。これは、最小限のアプリケーション圧力を採用することが可能になり、したがって、ケージド化合物を持つローカル灌流の間、最小限にモーションアーチファクトを低減します。 - 熱加工ホウケイ酸ガラスキャピラリーを用いて、全細胞パッチクランプし、ローカル灌流ピペットを引き出します。ピペットは〜1μmの先端径とR≈3MΩ(K -メソ3系ICSで測定値)の抵抗値を持つ必要があります。
- 置き実験槽のスライスとグリッドとそれを貼り付ける( 図4A、B)(厚さ250μmのプラチナ枠、40ミクロンを作ろ、外科用フィラメントとスパン)。スライス転送のために反転、先端壊れた、とファイアーポリッシュパスツールピペット(壊れた先端側の吸引ボール)を使用します。曲げやスライスの任意の他の過酷な取り扱いは避けてください。

図顕微鏡ステージでの浴の実験槽と位置決めの4成分(A)実験槽は、磁性金属リングに囲まれて入浴室自体(青い四角)、から構成されています。チュービングは、生理食塩水(ACSF)と一緒にお風呂の連続灌流を保証します。押しながら、スライスを修正するためのグリッドを浴室に入れられる。浴槽チャンバ内に配置(B)急性スライス標本。スライスは、グリッドのスレッドによって固定されている。顕微鏡ステージにおける(C)位置決め及び実験槽の幾何学実験中。
- 顕微鏡ステージの浴を置き、永久にACSFでスライスを灌流。
4。全細胞パッチクランプ
- SBFIを含有し、ケージド化合物とローカル灌流ピペットをロードし、ICSを使用したロードパッチピペット。対応するマイクロマニピュレーターにピペットを取り付けます。浴中に参照電極を配置します。あなたはヘッドステージ(CF 図4C)の損傷を避けるために、恒久的に接地されていることを確認してください。
- 浴中に両方のピペットを下げて、海馬CA1領域の上に配置します。 ACSFとICSの希釈を避けるためにパッチピペット(40ミリバール)に静かに押し込みます。
- 電気生理学ソフトウェアを使用して、パッチピペットのオフセット電位を補償する。
- IR-DICビデオ顕微鏡を用いたパッチピペットとCA1錐体細胞アプローチ。ギガシールが得られるまで穏やかな吸引を適用します。細胞を一手元側の無傷の細胞形態及び他方側のアンケージングビームの低散乱や減衰を確保するために30 -70ミクロンスライスの表面の下に配置されたソーマを選択してください。
- 高速の容量を補う。ブレークmembran全細胞構成を得るために、電子及びオープンセル。
- 遅い容量および直列抵抗を補償する。
- セルはイメージング実験を開始する前に、少なくとも30分間、SBFI-ICSで透析することができます。
5マルチフォトンイメージング及び刺激
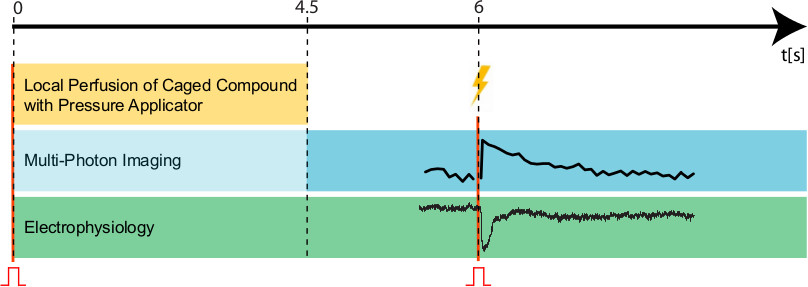
図5実験プロトコール。実験を初期化するために、(赤記号(ᴨ)と赤い線で示される)トリガパルスを同時にイメージング(青)、電気生理学(緑)、リテーナの管理を開始するように設定されている時点0秒での化合物(黄色)。この最初の期間中、結像ビームは、完全に(青色光)淡色表示されるべきである。 4.5秒(破線)の後に、ケージド化合物の局所灌流を終了し、画像形成ビームは、そのWORに設定する必要がありますデータ収集(青)について、王の強さ。黄色フラッシュで示さ; 300ミリ秒:紫外線フラッシュユニット(フラッシュの継続時間を初期化し、その後1.5秒(時間点6秒)、第2トリガパルスが与えられている(赤記号(ᴨ)と赤い線で示されている)、 )と、電気生理学とイメージングプロトコルにマーカーを設定します。
- 電位依存性ナトリウムチャネルの活性化および活動電位の発生を防止するACSFにテトロドトキシン(TTX、500 nM)を添加する。
- 多光子励起を使用し、SBFI蛍光を生じた細胞形態を視覚化し、実験のためのとげのデンドライトを選択します。より高い解像度で画像にズームインし、樹状突起の周りにクリップボックスを配置します。
- ケージのグルタミン酸を含む10μlのACSFに標準パッチピペットを埋める。加圧システムにピペットを接続し、マイクロマニピュレータに取り付けます。
- 樹状突起付近のケージド化合物(〜30ミクロン)でピペットを置きます。許可するようにピペットを置き希望の樹状突起の効率的なローカル灌流。アンケージングレーザーを調整します:閉じるアンケージングスポットを配置する - 興味のある構造に(〜1〜2ミクロン)。
- イメージングソフトウェアを使用して選択デンドライトと、隣接する棘上の関心領域を設定します。
- 関心領域に近づき、限局的に低圧(<3 PSI)を用いて数秒間、ケージド化合物を注入する。トリガ信号を介して(790 nmの多光子励起で)パッチクランプと蛍光録音を開始します。
注:ケージド化合物の局所灌流の間に、励起ビームが完全に退色を防止するために薄く表示されている。 - ケージド化合物の局所灌流を停止します。 SBFIの効率的な励起を可能にし、アンケージング(アンケージング期間300ミリ秒)を初期化するために、紫外線フラッシュを適用するために二光子レーザーの強度を大きくしてください。
- SBFIの蛍光の変化を監視します。 SBFI蛍光がベースラインに戻る回復した後に記録を停止します。
6。薬理学
- ケージグルタミン酸のUVフラッシュ光分解によって誘発電流および/またはナトリウム信号の生成におけるイオンチャネル型グルタミン酸受容体の関与を試験するために、受容体遮断薬を用いる。
- AMPA受容体遮断薬のシアノキノキサリンジオン(CNQX、10μM)およびTTX(上記参照)に加えて、NMDA受容体遮断薬のアミノホスホノ(APV、50μM)を含むACSFに切り替えて、少なくとも10のためのスライスを灌流分。
- 繰り返し刺激手順(5.4および5.5を参照してください。)
- 阻害剤」の効果の可逆性
- 唯一のTTXを含む通常のACSFに切り替えます。
- 20分間のスライスを灌流。
- 刺激手順を繰り返し(5.4および5.5を参照してください。)。
7モルフォロジー
- 実行される測定用クリップボックス領域セットのXYZ-スタックを記録します。このスタックがオーバーサンプリングであることを確認してください空間的に(ピクセルごとに少なくとも0.2μm)は、最適な画像復元を可能にするdは、画質と解像度を増加させる。
- 細胞形態を評価するためにセル全体のXYZ-スタックを記録します。
- デコンボリューションアルゴリズムを実行します。
結果
本研究では、急性マウス海馬組織切片のCA1錐体ニューロンにおけるナトリウム依存性蛍光色素SBFI付き携帯ナトリウムダイナミクスの多光子顕微鏡法のための手順を示す。また、私たちは神経活性化合物のレーザー走査系のアンケージング( 例えばケージグルタミン酸)で、このイメージング技術を組み合わせて、携帯のマイクロドメインへのターゲティング、その正確な方法を示しています。
パッチピペットを通してSBFIでニューロンをロードすると、多光子励起( 図6A、B、D及び図7A)を用いて微細な樹状突起と隣接する棘を含むセル全体の可視化を可能にした。
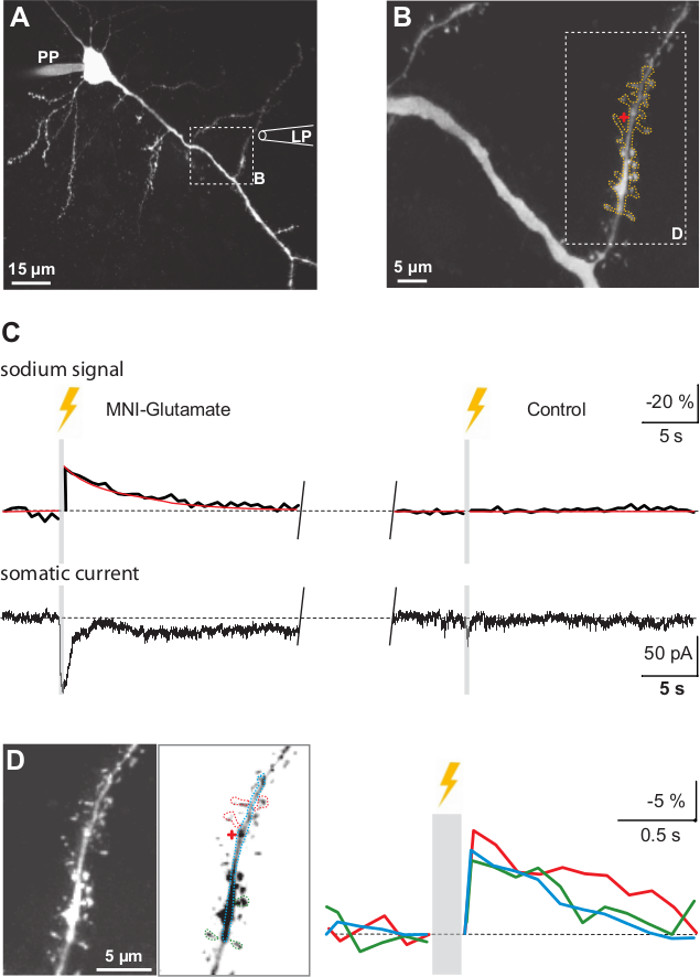
図6ナトリウム信号やケージグルタミン酸の閃光光分解により誘導されたシナプス電流(A)マキシムパッチピペット(PP)を介してSBFIを搭載したCA1錐体ニューロンのアル投影像。ボックスは、B、LPに拡大して示す領域がケージグルタミン酸のローカル灌流のためのピペットの位置と方向を示していることを示します。(B)は 、隣接する樹状突起棘と樹状突起の光学切片のスタックの高出力の最大投影。光学切片のスタックは、Zアライメントとデコンボリューションを受けた。赤い十字はアンケージングビームの標的領域を示している。オレンジ色の点線は、蛍光発光を記録し、そこから関心領域の輪郭を描く。 (黄色フラッシュで示される)ケージドグルタミン酸のフラッシュ光分解によって誘導される電流( 下段 )内向きナトリウム信号( 上段 )および体細胞:ボックスは左D.(C)に拡大して示す領域を示している。赤線は実験データのフィットを表す。灰色の領域は、内アンケージングフラッシュ(300期間を表しミリ秒)SBFI蛍光のイメージングを妨げ右:ケージグルタミン酸による事前灌流なしでは、同じUV-フラッシュがSBFI発光の変化、また内向き電流を誘発でもない(D)左 :。ハイパワーデンドライトのイメージと隣接と並んでBに描写されるように、反転したグレー値と同じ画像をスパイン。点線は、蛍光発光が記録された関心領域を示している。赤い十字はアンケージングビームの局在を示している右:ケージグルタミン酸の紫外線フラッシュ光分解によって誘導されたナトリウムトランジェント。ブルートレース:樹状突起中のナトリウムシグナル;赤線:アンケージングスポットに隣接する3つのスパインからの応答を平均化し、緑のトレース:3遠い棘からの応答を平均した。 この図の拡大版についてはこちらをご覧ください。
リテーナ入りローカル灌流した後、グルタミン酸、デンドライトに近い紫外線フラッシュを適用すると、細胞内のナトリウム濃度( 図6C、Dおよび図7B)の増加を反映し、SBFIの蛍光発光の過渡的な減少をもたらした。同時に、内向き電流は、体細胞( 図6Cおよび図7B)で記録した。 UVフラッシュの持続時間を増やすと、システムがよく、そのダイナミックレンジ内とアンケージングも細胞性いずれの応答が飽和したことであったことを示し、両方の電流およびナトリウム信号(データは示していない)内向きの誘発の振幅の増加をもたらした。ケージグルタミン酸で前灌流されていなかったスライスと同じ又はより長い持続時間の紫外線フラッシュの適用は、これらの信号は、グルタミン酸のアンケージング( 図6C)によるものであることを示す、SBFI蛍光も内向き電流の変化を誘発したことはありません。さらに、これらの結果はimaging-とアンケージング成分のない相互依存性がuで観察されないことを示して私たちの実験条件ファインダー。ナトリウムは信号も樹状突起棘( 図6D)で検出することができた。私たちが唯一のグルタミン酸アンケージングを持つ単一の背骨の刺激を達成しようとしなかったが、ピーク振幅は棘がさらに離れ、親樹状突起( 図6D)とほぼ同一の蛍光変化を示したのに対し、アンケージングスポットに近い棘がやや高い傾向にあった。
最後に、グルタミン酸のアンケージングに応じて、樹状突起と棘にナトリウム流入のための経路を検討した。この目的のために、私たちはそれぞれAMPA-およびNMDAサブタイプのナトリウム透過性、イオンチャネル型グルタミン酸受容体に選択的なブロッカーであるCNQXとAPVを採用。本発明者らの結果は、グルタミン酸誘導性細胞内ナトリウム信号と誘発された体細胞電流は、これらのブロッカー( 図7B)の存在下で省略されたことを示している。ブロッカーのウォッシュアウトすると、信号が回復している。これは股関節を実証グルタミン酸のTアンケージングは、細胞内のナトリウムの過渡現象と内向き電流で、その結果、樹状突起と棘へのナトリウムの流入を仲介するCA1錐体ニューロン、上のイオンチャネル型グルタミン酸受容体を活性化する。

誘発ナトリウム信号と内向き電流の図7の薬理学的プロファイル。 (A)細胞体に取り付けられたパッチピペット(PP)とのSBFIで満たされたCA1錐体ニューロン(B)左:樹状突起と棘添付でのケージのグルタミン酸の光活性化によって誘導されたナトリウムの過渡および体細胞の電流センター:灌流イオンチャネル型グルタミン酸受容体遮断薬CNQXとAPVは、ナトリウム信号とアンケージングによって誘発される内向き電流の両方を阻害する右:ブロッカーのウォッシュアウトすると、信号が復元されます。赤いラインrepresen実験データの適合のts。灰色の領域は、アンケージングフラッシュ(300ミリ秒)がSBFI蛍光のイメージングを妨げている期間を表します。 この図の拡大版についてはこちらをご覧ください。
ディスカッション
本研究は、SBFI、小さな細胞区画内の細胞内ナトリウム過渡の二光子イメージングのために適していることを示している。これは、SBFIの量子効率が15かなり低く、ナトリウム濃度の相対変化は、生理活性を有する非常に小さいことが、念頭に置かなければならない。このように、微細プロセス中のNa +トランジェントの高分解能測定は、比較的面倒な作業であり、いくつかの試験のビニングまたは平均化は満足なシグナルを得るために必要であり得る。また、ナトリウム過渡の動力学は長期間にわたって記録することが義務付けこと、驚くほど遅い。この観察結果は、ニューロンの樹状突起とアストロサイト中のナトリウム過渡の単一指数減衰を室温1,2,6で10秒の範囲で、大きな減衰時間定数を特徴とした以前の研究、のものに対応しています。ナトリウムは過渡は、このようにはるかに遅い時間の共同を発揮すると思われるURSEカルシウムトランジェント16と比較してはるかに大きい減衰時間定数。
これらの欠点を脇に置き、ナトリウムイメージングは、ニューロンのサブドメインの生理学的特性の調査のための貴重なツールであることが分かる。例えば、ナトリウムイメージングは大気圧または近いアクティブなシナプスの興奮性シナプス活性をモニターするために役立つことができる。ナトリウムは、本質的に8,17にバッファリングされていないので、活性誘発性ナトリウムトランジェントが直線的シナプスのグルタミン酸放出の広い範囲に関連するか、または外因的にグルタミン酸を適用する。彼らは、それゆえ、ニューロンのグルタミン酸作動性活性を直接かつ公平な指標を表す。また、ナトリウム指示色素は、高いK dをのを示す(SBFIのK dは 25 mMの1の範囲である)。 ( - 1mMの通常0.5)、高K d ' は sは、染料自体が複数のバッファとして作用しないことを意味するものであっても十分な明るさを達成するために使用される比較的高い細胞内の色素濃度で憎悪。その結果、彼らは常にカルシウム感受性色素が細胞18内に導入される懸念である、ナトリウムトランジェントの振幅も、時間経過を歪めていない。したがって、検出された信号が細胞内ナトリウムで「本当の」変化の良好な尺度を表すと仮定することができる。彼らの遅い時間のコースは、その後ニューロンにおけるナトリウムのための細胞内拡散に速度が以前に19を想定よりもはるかに小さいことを意味します。
スパインと樹状突起への興奮性シナプス伝達とナトリウム流入経路の性質に対処した実験の実行が成功するための重要な要件は、シナプス後の構造の迅速かつ高度に局在活性化の誘導である。これは背骨のすぐ近くやケージド化合物の閃光光分解によるデンドライトグルタミン酸またはグルタミン酸アゴニストの迅速かつ局所適用することによって得ることができる。フラッシュ光分解は、機械的にDAMAないGE組織は、モーションアーチファクトを含まず、同様に関連の質問の調査( 例えば 、ローカルカルシウムシグナル伝達)のために確立されています。アンケージングスポットの直径は、xy平面で1.5μmであった。棘と親樹状突起の両方にナトリウム信号を誘起伊勢デンドライトに近いアンケージング。信号がアンケージングスポットに近い棘で最大の傾向にあったのに対し、親樹状突起での振幅と棘遠くにはまだアンケージングスポットのすぐ近くのものにかなり類似していた。アンケージングは、内向き電流の振幅が増大し、その間に300ミリ秒を行った。アンケージドグルタミン酸は、さらに離れアンケージングスポットから樹状突起領域および棘上イオンチャネル型グルタミン酸受容体およびナトリウム流入を活性化し、同じ期間中に組織内に拡散した可能性があります。
細胞入浴液を通して投与ケージド化合物の光分解のためのUVレーザーを使用したときに発生する本質的な問題「内側のフィルタリングは 'です。そのためケージの高吸収率の、UV光は刺激部位20,21対物から道に沿って強く減衰される。これを回避する実現可能な方法は、さらに最小限に必要なケージド化合物の量を減少させる刺激部位に制限されているケージを持つローカル灌流である。 UVレーザー走査媒介アンケージング、近赤外二光子アンケージング22と比較して、刺激の精度が、z軸が増加する主な理由は、空間的に、より正確である。による二光子励起に用いられるようなより長い波長のために一般的に使用されるケージの小さな断面と、一方、高ケージド化合物の濃度または非常に高いのいずれか、潜在的に毒性の光強度が必要とされる。また、二光子アンケージング機器はるかに高い投資が必要となる。とりわけ、追加のIRレーザーに加えて必要な光学部品は、必要とされている。
SBFIおよびMNI-グルタミン酸の両方が同一の波長範囲で励起可能である。これはアンケージングフラッシュ、および/またはIRビームによるグルタミン酸の連続アンケージングによってSBFIの漂白で、その結果、紫外線アンケージングレーザーおよびSBFIまたはIRイメージングレーザとMNI-グルタミン酸の意図しない相互依存性につながる可能性があります。 図6(c)に示すようにしかし、それだけで紫外線フラッシュも多光子イメージングどちらも私たちの実験条件下でそのような相互的な効果をもたらした。
ここに記載したものと同様のUVフラッシュシステムは、多くの他の研究室で日常的に使用され、比較的容易に既存の多光子イメージング顕微鏡に組み込むことができる。これは、光分解のためにレーザビームを視野内に自由に配置することができるという利点を提供する。さらに、システムは、実験中の視野内に、それぞれ、レーザビームと放出量の迅速かつ自動化された再配置を可能にする。王イメージングソフトウェアのフレームが合同イメージングとアンケージングフレームを調整するために役立つことができるように、r個の修飾は、アンケージングスポットの正確な位置決めを簡素化し、改善する。
まとめると、全細胞パッチクランプおよび中枢神経細胞の樹状突起と棘での多光子ナトリウムイメージング、グルタミン酸の紫外線光誘起アンケージングための修正された手順と組み合わせることで、組織内のグルタミン酸受容体の信頼性が高く、焦点の活性化を可能にします。従って、無傷組織におけるニューロンにおける興奮性シナプス伝達およびシナプス後ナトリウム信号の特性を分析するために役立つことができる。
開示事項
著者らは、競合する利害を宣言しません。著者らは、ビデオの記事で使用した機器を生産ラップ光電子(ヴェーデル、ドイツ)でオープンアクセス出版を可能にする財政支援を受けた。同社は、実験でも、データの取り扱いにも、原稿執筆に関与でもなかった。
謝辞
この研究は、著者らはS. DurryとC. Roderigo専門家の技術支援のために、とM.Dübbert(電子技術研究所、動物学研究所に感謝したいCRRするドイツ科学財団(DFG、Ro2327 / 6-1)の助成金によってサポートされていましたポッケルスセルコントローラとHFスイッチを実装する助けをケルン、大学、ドイツ)。
資料
| Name | Company | Catalog Number | Comments |
| Borosilicate-glass capillaries | Hilgenberg | 1405059 | 75 x 2 mm, wall thickness 0.3 mm |
| Camera | Jenoptik | ProgRes MF | IR-DIC compatible camera |
| Deconvolution software | SVI | Huygens Pofessional X11 | |
| Fiber optic spectrometer | Ocean Optics | USB 4000 | Miniature fiber optic spectrometer |
| Filter tubes | VWR | cenrifugal filter, 0.2 µm | |
| Imaging software | Olympus Europe | Flowview Ver 5.0c, Tiempo | |
| IR beam power controller | Custom built | Laser beam intensity control + fast switch to zero on flyback via pockels cell | |
| IR laser | SpectraPhysics | Mai-Tai | fs-pulsed Ti:Sa tunable laser (710 - 990 nm); CAUTION |
| IR power monitor | Custom built | ||
| Micromanipulator | Burleigh | PCS 5000 | |
| Microscope/Imaging System | Olympus Europe | BX51WI/FV300 | Both, the microscope and the imaging systems were strongly modified |
| ND filter wheel | Newport | 50Q04AV.2 | UV fused silica, optical density 0.05 - 2.0 |
| Objective | Nikon Instruments Europe | NIR Apo 60x/1.0w | |
| Patch clamp amplifier | HEKA | EPC-10 | |
| Pipette puller | Narishige | Model PP-830 | |
| Pneumatic drug ejection system | NPI Electronic | PDES-DXH | |
| Pockels cell | Conoptics | 350-80 LA-BK | EOM, used as fast switch and for power adjustment |
| Pockels cell driver | Conoptics | M302-RM | High voltage differential amplifier |
| Shutter | Vincent Associates | LS6ZM2 | ALMgF2-coated BeCu blades |
| Shutter controller | Custom built | ||
| Shutter driver | Vincent Associates | Uniblitz VCM D1 | |
| Slicer/Vibratome | Thermo Scientific | Microm HM 650 V | |
| Uncaging software | Rapp OptoElectronic | UGA40 1.1.2.6 + NetCam | |
| UV laser | Rapp OptoElectronic | DL-355/10 | cw DPSSL Laser, 355 nm; 10 mW; CAUTION |
| UV laser scanning system | Rapp OptoElectronic | UGA 40 | Galvanometric scanning system |
| Name of Compound | Company | Catalog Number | Comments/ Description |
| CNQX | Sigma Aldrich | C-127 | AMPA receptor antagonist; CAUTION |
| DL-AP5 | Alfa Aesar | J64210 | NMDA receptor antagonist; CAUTION |
| SBFI K+ salt | Teflabs | OO32 | |
| TTX | Ascent Scientific | Asc-055 | Inhibitor of voltage-dependent Na+ channels; CAUTION |
| NMI-caged-L-Glutamate | Torcis | 1490 | Caged glutamate released upon UV absobtion |
参考文献
- Rose, C. R., Kovalchuk, Y., Eilers, J., Konnerth, A. Two-photon Na+ imaging in spines and fine dendrites of central neurons. Pflueg. Arch., Eur. J. Phy. 439, 201-207 (1999).
- Rose, C. R., Konnerth, A. NMDA receptor-mediated Na+ signals in spines and dendrites. J. Neurosci. 21, 4207-4214 (2001).
- Meier, S. D., Kovalchuk, Y., Rose, C. R. Properties of the new fluorescent Na+ indicator CoroNa Green: comparison with SBFI and confocal Na+ imaging. J. Neurosci. Meth. 155, 251-259 (2006).
- Lamy, C., Chatton, J. Y. Optical probing of sodium dynamics in neurons and astrocytes. NeuroImage. 58, 572-578 (2011).
- Lasser-Ross, N., Ross, W. Imaging voltage and synaptically activated sodium transients in cerebellar Purkinje cells. Proc. Roy. Soc. B-Biol. Sci. 247, 35-39 (1992).
- Bennay, M., Langer, J., Meier, S. D., Kafitz, K. W., Rose, C. R. Sodium signals in cerebellar Purkinje neurons and Bergmann glial cells evoked by glutamatergic synaptic transmission. Glia. 56, 1138-1149 (2008).
- Baranauskas, G., David, Y., Fleidervish, I. Spatial mismatch between the Na+ flux and spike initiation in axon initial segment. Proc. Natl. Acad. Sci. 110, 4051-4056 (2013).
- Fleidervish, I., Lasser-Ross, N., Gutnick, M., Ross, W. Na+ imaging reveals little difference in action potential-evoked Na+ influx between axon and soma. Nat. Neurosci. , 852-860 (2010).
- Denk, W., Piston, D., Webb, W. Handbook of Biological Confocal Microscopy. Pawley, J. B. , Plenum Press. 445-458 (1995).
- Jaffe, D., et al. The spread of Na+ spikes determines the pattern of dendritic Ca2+ entry into hippocampal neurons. Nature. 357, 244-246 (1992).
- Boccaccio, A., Sagheddu, C., Menini, A. Flash photolysis of caged compounds in the cilia of olfactory sensory neurons. J. Vis. Exp. , (2011).
- Ikrar, T., Olivas, N., Shi, Y., Xu, X. Mapping inhibitory neuronal circuits by laser scanning photostimulation. J. Vis. Exp. , (2011).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid. J. Vis. Exp. , (2011).
- Pannasch, U., Sibille, J., Rouach, N. Dual electrophysiological recordings of synaptically-evoked astroglial and neuronal responses in acute hippocampal slices. J. Vis. Exp. , (2012).
- Minta, A., Tsien, R. Fluorescent indicators for cytosolic sodium. J. Biol. Chem. 264, 19449-19457 (1989).
- Kuruma, A., Inoue, T., Mikoshiba, K. Dynamics of Ca(2+) and Na(+) in the dendrites of mouse cerebellar Purkinje cells evoked by parallel fibre stimulation. Eur. J. Neurosci. 18, 2677-2689 (2003).
- Despa, S., Bers, D. M. Na/K pump current and [Na](i) in rabbit ventricular myocytes: Local [Na](i) depletion and Na buffering. Biophys. 84, 4157-4166 (2003).
- Regehr, W., Tank, D. Calcium concentration dynamics produced by synaptic activation of CA1 hippocampal pyramidal cells. J. Neurosci. 12, 4202-4223 (1992).
- Kushmerick, M. J., Podolsky, R. J. Ionic mobility in muscle cells. Science. 166, 1297-1298 (1969).
- Palma-Cerda, F., et al. New caged neurotransmitter analogs selective for glutamate receptor sub-types based on methoxynitroindoline and nitrophenylethoxycarbonyl caging groups. Neuropharmacology. 63, 624-634 (2012).
- Trigo, F., Corrie, J., Ogden, D. Laser photolysis of caged compounds at 405 nm: photochemical advantages, localisation, phototoxicity and methods for calibration. J. Neurosci. Meth. 180, 9-21 (2009).
- Nikolenko, V., Peterka, D., Araya, R., Woodruff, A., Yuste, R. Spatial light modulator microscopy. Cold Spring Harbor protocols. , 1132-1141 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved