Method Article
マウス後脳
要約
胚性ニューロンは、神経管の脳室帯に生まれたが、適切な目標を達成するために移行している。顔面branchiomotor(FBM)ニューロンは、ニューロンの移動を研究するための有用なモデルである。このプロトコルは、FBMの移行を制御するメカニズムを調べるためにマウス胚hindbrainsのホールマウントex vivoでの文化について説明します。
要約
胚の神経細胞は、脳の脳室帯で生まれ、その後、適切な目標を達成するために、新しい目的地に移行している。協働して、胚の脳内神経細胞移動を導く分子シグナルを解読することは、複雑な神経回路網が後出生後の生活をサポートする構成方法を理解することが重要である。顔面branchiomotor(FBM)マウス胚の後脳内のニューロンは後脳のR6由来領域でペア顔面神経核を形成するためにrhombomere(R)4尾側から移行する。ここでは、FBMの移動を調節するシグナル伝達経路を調査するのに適したマウス胚hindbrainsのホールマウントex vivoでの培養のための詳細なプロトコルを提供する。この方法では、E11.5マウス胚のhindbrainsで24時間、細胞培養インサート上で開いた本の調製に解剖し、培養する。この間、FBMニューロンは、r6が尾側に向かって移動し、機能ブロッキング抗体及び小moleculに暴露することができるニューロン移動をガイドに関与するシグナル伝達経路のための役割を調べるために、組換えタンパク質を搭載した培養培地またはヘパリンビーズ中のES。
概要
胚の神経細胞は、脳の脳室帯に生まれたが、その後大きな距離に位置して、適切な標的領域に到達するための新しい目的地に移行している。発達中の脳の背腹側と前後軸に沿った適切な場所に、神経細胞体の正確な位置決めは、渡り鳥のステージ1-4後に正しい配線、生存、およびこれらのニューロンの機能に必須である。軸索ガイダンス5-7を制御する分子メカニズムと同様に、引力とキューの組み合わせセットがニューロン1,8を移行案内すると考えられている。しかしながら、複数の細胞型の相互作用、神経細胞の遊走を制御する信号は、以下で広範に自律的に細胞を研究することができる軸索誘導に関与するものよりも研究されている。脊椎動物の後脳現像は、分子および細胞のメカニズムを理解するためにいくつかの最近の研究で使用されているひよこ、マウス、ゼブラフィッシュ1-4,9の例では、神経細胞移動の。この器官はprecerebellarおよび運動ニューロン5,7,10,11のいくつかのサブタイプを含む神経細胞のいくつかの異なる種類が含まれています。
後脳運動ニューロンは、底板に近い脳室帯で生まれ、彼らは起源1,12の彼らrhombomereに応じて特定のサブセットに分化している。顔面branchiomotor(FBM)ニューロンは後脳にrhombomere(R)4で生成され、顔の筋肉2,9,13を刺激するために第二鰓弓に背R4出口ポイントを介してその軸索を拡張している。ゼブラフィッシュとマウスのFBMニューロンは、これらのニューロンが再現可能に時空明確に定義されたプロセスで、その細胞体を移動されるため、容易に可視化される過程で神経細胞移動の分子·細胞メカニズムを研究するための優れたモデルを提供します。マウスでは、FBMニューロンは最初CAUを移行ダリーR5経由し、両方の尾側と腹側に、彼らはVIIth脳神経(VIIn)10,11,14の対になった核を形成R6の領土における後脳の軟膜側の最終位置に到達する。ゼブラフィッシュでは、FBMニューロンは、最初は腹側に移行した後、ラミニン依存的4,12,15,16に軟膜表面に向かって移動を継続するR4-R5の境界で方向を変える。この移行は、開発中の数日間の期間にわたって進行し、これらの二つの別個のプロセスを媒介する分子の同定を可能にする、接線方向及び半径方向の移動のフェーズに分けることができる。これとは対照的に、ニワトリ胚の後脳のFBMニューロンはR4 3,13,17-19に残ります。
彼らの移行時には、FBMニューロンはhomoeodomain転写因子膵島1(ISL1)14の発現を通じて、他のタイプまたは運動ニューロンと同様に、識別することができます。このように、Wholおよび異なる発達段階でのこのマーカーのためのemountの免疫蛍光染色やin situハイブリダイゼーションは、ゼブラフィッシュやマウス4,15,16にR4からR6まで延びるFBM細胞体の明確な渡り鳥流れを明らかにする。また、このようなISL1-GFPなどの蛍光トランスジェニックレポーターはゼブラフィッシュ3,17-19でFBMニューロンの移行可視化するために、適切なツールとして使用されてきた。それらの自由生活胚細胞移植技術および水槽の水に直接塗布薬理学的化合物を用いて容易に操作することができるので、画像化のための適合性に加えて、多くの研究者らは、ゼブラフィッシュの開発におけるFBMニューロンの遊走を研究した。これとは対照的に、マウス胚は、指導の手がかりや胎盤関門を通過しない機能阻害抗体の投与を運ぶビーズの注入を排除、子宮内に同封開発しています。また、妊娠中の母親に投与された薬理学的化合物は、国連を持っている可能性間接的に胚形成を損なうことができ、副作用を希望する。この制限を回避する、私達は7,16の外植後24時間FBMニューロンの遊走と生存と互換性のある全マウス後脳のためのex vivo培養法を開発した。この方法は簡単に薬理学的操作、指導の手がかりまたは機能遮断抗体の投与を運ぶビーズの注入を可能にし、また、異なる発達段階で後脳内の他のニューロンサブタイプの遊走を研究するために適合させることができる。
プロトコル
1。オプション:FBMの観光アッセイのためのアフィゲルヘパリンビーズ(ジェルビーズ)を準備
注:外植手順を開始する前に、少なくとも1日ゲルビーズを準備します。
- 室温(RT)にてローラー上で20分間滅菌したPBSで100μlのゲルヘパリンビーズ懸濁液を洗浄する。
- 13,000×gで5分間テーブルトップ遠心機でペレットビーズ。滅菌PBSを追加し、洗浄操作4Xを繰り返します。
- 最終洗浄後、PBSを除去し、溶液でビーズを被覆するように注意しながら、選択した組換えタンパク質を含有する滅菌溶液を少量のビーズを浸す。このプロトコルは、以前に発表された実験16を再現するために、PBS中に100μl/ NG組換えヒトVEGF 165を使用しています。
- 4℃でローラー上で12時間の最小値のための組換えタンパク質溶液と1週間、最大でゲルヘパリンビーズをインキュベート
2。カルチャーインサートのコーティングS
後脳の外植片は8μm孔径、または同等のインサートコーニング培養インサート上で培養する。培養インサートは、それらが、蒸留水で洗浄し、エタノールで滅菌し、必要になるまで、70%エタノール中で保存されて設けられ、プロトコルの完了後に再利用することができる。
注:以下の手順は、無菌条件下で流フード中で実施されるべきである。
- B27(20μL/ ml)を、グルコース(6ミリグラム/ ml)およびペニシリン/ストレプトマイシン(/μL5μg)を補充した神経基本培地からなる外植片培養培地を準備します。
- 洗浄文化が流フードの下で5〜10分間、5分間、乾燥のために滅菌PBSで挿入されます。
- 12wellプレートの個々のウェルに1カルチャーインサートを配置します。注意:インサートがウェルにしっかりとフィットする小型のプッシュが必要な場合があります。
- Neurobasal培地中で10〜20μg/ mlのマウスラミニンで挿入し、組織培養インキュベーター(37℃、5%COに配置し培養を覆う 2)1時間。注:コーティングは、外植の日に行われるべきである。
3。 E11.5マウス胚からHindbrainsの解剖
- 胎生日に倫理的に承認された手順(E)11.5となりまし妊娠雌マウスを淘汰し、氷冷L15培地と100ミリメートルのプラスチック皿に胚を含む子宮を置く。
注:すべての解剖の手順を氷冷L15で実行する必要があります。 - 解剖顕微鏡を使用し、デュモンの時計職人は、胚を露出させ、子宮の筋肉の壁が破れ各胚を離し、臍帯を切断し、慎重に卵黄嚢を削除、番号5鉗子。
- 広口径の開口部を有するプラスチック製パスツールピペットを用いて、氷のように冷たいL15できれいなプラスチック皿に各胚を移す。
- デュモンの鉗子を使用して、ただ前肢上記の胚を首を切る。実験は胚の遺伝子型判定を必要とする場合は、ゲノムDNAを単離するための組織サンプルを採取( 例えば 、小PIEC卵黄嚢や尾の先端16,20のE)。
- アップヘッド背側の電源を入れ、薄い組織層( 図2B)で覆われている4 番目の心室を、識別します。慎重にroofplateを貫通し、後部後脳と脊髄の上、および吻側中脳の上に尾側正中線に沿って剥がす始める。後脳になりました( 図2C)が露出されるべきである。
- 慎重に残りの頭部間葉と後脳( 図2D)の軟膜側に接続されているすべての髄膜を離れていじめる。
- 後脳をフルに発揮するように、中脳と脊髄組織を除去し、開いた本の準備( 図2E)に平らにすることができます。
- ワイドボアプラスチックパスツールピペットを用いて、氷のように冷たいL15を含む12ウェルプレートに各解剖し後脳を転送し、すべてのhindbrainsを解剖されるまで氷上で保管してください。
- ワイドボアプラスチックパスツールピペットを用いて、罪を転送空の皿にGLE後脳、おおよそ100μlのL15の液滴中の開いた本の準備、心室側を上にし、それを維持。
- 同液滴に培養したゲルのヘパリンビーズの数マイクロリットルを移す。注:ビーズのサイズは可変であるので、約10ビーズを転送してから後脳への移植のための最適なサイズを選択することをお勧めします。
- 後脳組織中の小さな涙を行い、慎重にR5 / 6のレベルで後脳組織の中に1-3ゲルビーズを挿入し、正中線と後脳の側縁間の半分の方法について、そのような組織にそれらを下げるビーズはちょうど後脳の表面の下に配置されている。
注:解剖の手順は、経験に応じて、5から20分/後脳の間で取ることができ、リットルが大きい場合、長期間にわたってストレッチがあり、いずれにしても、hindbrainsは永久になくなっ3時間後に死後よりも文化にする必要があります結果。
4。後脳外植片培養
- インキュベーターから培養インサートを含むプレートを外し、ラミニンコーティング液を吸引除去する。
- 氷のように冷たいL15で満たされた別々の培養皿に挿入して、ワイドボアプラスチックパスツールピペットを用いて、カルチャーインサート( 図2G)に巻き、各後脳腹側を転送一つの文化を置きます。後脳は、挿入膜上で完全に平らになる必要があります。
- 注意深く皿から培養インサートを持ち上げて過剰の液体を除去するために清浄なティッシュペーパー上で数回軽くたたく。このプロセスは、後脳が平ら、開いた本製剤中のカルチャーインサートに接着することが保証されます。後脳が丸くした場合、その組織は不可逆的に一緒に成長することができる。
- 培養培地を予め温め500μlのオリジナル12ウェルプレートを満たし、十分に戻って、このへの挿入を置く。慎重に後脳が浮いていないことを保証するだけ後脳をカバーするために、メディアの別の400〜600μLで音量を調節するメンブレンオフ。それが浮く場合は、4.4に進み、後脳が膜に付着したままになるまで繰り返すように戻ります。
- この段階では、FBMニューロンの遊走に対する効果を研究するために培地に目的の生物学的阻害剤を添加することができる。
注:ビーズを移植するか、他の治療を投与した場合、それは実験が正常に設定されていることを確認するため、実験ごとに通常の成長条件下で少なくとも2制御外植片を維持することをお勧めします。 - 組織培養インキュベーター(37℃、5%CO 2)で24〜30時間、外植片をインキュベートする。
5。後脳外植片のホールマウント免疫蛍光染色
- を吸引し、各ウェルから培地を、PBSでリンスし、氷冷した4%ホルムアルデヒド(PBS中に溶解し、新たに調製した、または新たに解凍した4%パラホルムアルデヒド)中で穏やかに撹拌しながら4℃で2時間固定する。注意:固定前に培養挿入から後脳を削除しようとしないでください完了しました。
- PBSで3回洗浄します。慎重にデュモンの鉗子を用いて培養インサートからhindbrainsの皮をむく。いくつかの外植片が剥離するのが困難であるが、通常、繰り返しピペットからPBSを放出を通して穏やかな圧力を適用することによって持ち上げることができる。
- 免疫蛍光標識用の2.0ミリリットルの丸底チューブにhindbrainsを転送します。穏やかなローリング、0.1%トリトンX-100(PBT)を含むPBS中で室温(RT)で30分間hindbrainsを透過性。
- 穏やかなローリング、10%熱不活性化正常ヤギ血清を含有するPBTでRTで1時間インキュベートする。
- ISL1に特異的な一次抗体と共に5日間、4℃で穏やかに巻き付き外植片をインキュベートし、1%の熱不活化正常ヤギ血清を含有するPBTで1:100に希釈した。
- 15分ごとにPBTを用いてRT 4Xで外植片を洗ってください。
- フルオロフォア結合ヤギ抗マウス抗体とともに室温で3時間穏やかに巻き付き外植片をインキュベートする( 例えば、アレクサフルーア488ヤギ抗マウスは、1%の熱不活化正常ヤギ血清を含有するPBTに)1:200に希釈した。
- 外植片を穏やかローリングで15分間ずつ、PBT、RTで4倍洗う。
- Postfixの室温で30分間4%ホルムアルデヒド中で外植片。
- 外植片のためのポケットを作成するためにメスで黒い絶縁テープおよび物品税の3層の積層テープの小さな正方形で、スライドガラスをカバーする、あるいは、うつ病ガラススライドを使用しています。
- 1ポケットにのSlowFade試薬中の各後脳をマウントして、慎重にレーザー走査型共焦点顕微鏡を使用してトラップ気泡や画像を避けて、ガラスカバースリップでカバーしています。
NOTE:免疫染色の代替として、FBMS(すなわち、ISL1又はPhox2b)を認識リボプローブとのインサイチュハイブリダイゼーションFBMニューロン16,21を可視化するために使用することができる。
ステップとタイミングのまとめ
〜14日:E11.25妊娠を取得するために時限交配
オプション:ビーズ準備(ProtocoL 1):〜2時間、胚の分離前日
培養インサートとメディア(プロトコル2)を準備します。〜30分前の胚の分離
胚の分離と後脳解剖(3.1から3.4ステップ):〜10分/胚
後脳解剖(3.5から3.7ステップ):〜5月10日分/後脳
外植手順(3.8から3.9ステップ):〜5月10日分/後脳
オプション:ビーズ注入(3.10から3.11ステップ):〜5月10日分/後脳
移植片培養(ステップ4.7):24時間
抗体染色のための固定(ステップ5.1):2時間
染色手順およびイメージング(プロトコール5):5日
結果
このセクションでは、ex vivoで培養を介して、マウスの後脳におけるFBMニューロン遊走を研究することによって得られる結果の例を示す図である。私たちは、11日目のマウス胚から外植hindbrainsにおけるFBMニューロンは最初の接線方向移動( 図3A)を受けると、その後子宮内でそれらの挙動に類似顔面運動核( 図3B)、(図1参照)を構築し始めることを示している。我々はさらに、以前に16に示すようにVEGF 165に浸したビーズの注入は、FBMニューロン( 図3Cおよび3D)を引き付けることを示している。重要なのは、このプロトコルは、血管やかん流されない、血管系は、培養16に退化するため、 子宮内で FBM移行に影響を与える可能性のある血管由来因子の非存在下でFBMの移行を検討することができます。新たにISL1にマウス抗体を使用した場合、従って、非特異的な血液細胞の標識は観察され単離したマウスhindbrains( 図1)文化( 図3A-F)での24時間後にはもう後脳組織中に存在しない。後脳の胚の分離( 図3E)の後、または十分にすぐに外植されていないため、最終的に、我々はどちらか、正しく外植ので、異常分布にFBMニューロンが含まれていませんでしたhindbrainsの2つの例を示しているため(トランスウェルに折り畳んだ後脳組織図3F)。

図1。 FBMニューロン ISL1ホールマウント免疫標識した後、移行野生型マウスhindbrainsの共焦点zスタックおよびflatmounting;。後脳正中は、すべてのパネルのアスタリスクで示されている(A)中のE11.5の後脳の脳室面。 R4、R5およびR6の位置が示されている(A ')原基を含む領域における同一の後脳の半分の軟膜表面を;、ISL1陽性のFBMニューロン(矢印)を含有する[4から[6への接線方向の移動を実証する領域。ペアFBM核(VIInで示されている)の1だけでなく、他のISL1陽性ニューロン集団(B)接線方向に移行しているFBMニューロン(矢印)を含む12.5日後脳の脳室表面が、矢印の例を示しているISL1非特異的マウスIgG抗体を検出するために使用した抗マウス二次抗体の交差反応により標識される循環細胞を含有する血管の(B ')を含有する同一のE12.5の後脳の半分の軟膜表面ペアFBM核の1。正中線は、各パネル内のアスタリスクで示されます。スケールバー(全パネル):200μmである。 V、腹、P、軟膜。/ 51397fig1highres.jpg "ターゲット=" _blank ">拡大画像を表示するにはここをクリックしてください。

図2。 E11.5マウス後脳解剖とex vivo培養。 (A〜E)E11.5の後脳の解剖プロトコルにおける重要なステップ、スケールバー:それは離れて前肢レベルでの胚の残りの部分から切断した後の胚の1ミリメートル(A)ヘッド(B)の吻側部分。心室第 4(矢印)が配向したように、ヘッドが上方を除去し、頭部組織の残りの部分は、配置された。(C) 第 4脳室の屋根を剥離し、後脳離れる後脳の下の組織を剥離することにより露出した吻側と尾側(D) 軟膜膜を除去した(このEXなお十分な、いくつかの頸髄(SC)は、組織が )後脳に添付推移している。(E)の過剰中脳(MB)と脊髄(SC)組織は、単に後脳を維持するために削除されました。(F)培養インサートがで被覆したラミニンおよび12ウェル組織培養プレートに入れた。(G)の各後脳が1のインサート上に置き、メディアで覆われていた。(H)文化の24時間の間、FBMニューロン(青)を移行することで、撮影したパスの模式図。 こちらをクリック拡大画像を表示します。
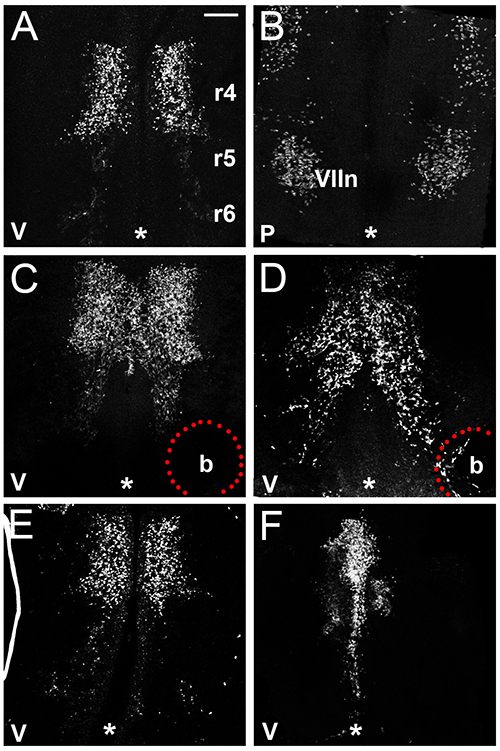
図3。マウス後脳ex vivoでの文化。 (A、B)E11.5の後脳は、24時間およびimmunofluoresc培養した本来的植片におけるFBMニューロン遊走を説明するISL1ために標識;心室(A)および軟膜後脳の(B)側の両方が示されている(C、D)E11.5同腹子hindbrainsを浸した移植さヘパリンビーズの存在下で培養した。 PBS(C)またはVEGF 165(D)に、FBMニューロンが向かい、VEGF 165ビーズ上に移行し、移行の流れは、したがって同じ後脳またはコントロールビーズを含んだ後脳の未処理側に比べて、さらに尾側に延長していることに注意してください(E。 FBMSはR4(E)から移住していないするか、後脳組織が 培養中に折り畳まれた不十分E11.5の後脳の外植片の、F)の例(F)。正中線は、各パネル内のアスタリスクで示されます。 (すべてのパネルの場合)スケールバー:200μmである。 V、腹、P、軟膜。">拡大画像を表示するにはここをクリックしてください。
ディスカッション
このプロトコルは、FBMニューロンの移行を研究するためのトランスウェルシステムにおいてE11.5マウスhindbrainsのホールマウント文化を説明します。このプロトコルは、マウスの後脳の運動ニューロンは、ex vivoでの操作を可能にする、24時間の間、生きていると移行に保つことができます。この方法では、神経細胞移動の分子·細胞メカニズムを特定しようとしている研究者のための多数の実験の利点があります。従来の遊走アッセイは、培養皿上にマトリックス中に小神経組織片を外植し、それらが外部刺激に応答するように、個々のニューロンの観察を可能にする一方で、トランスウェルアッセイの主な利点は、宿主の器官環境内移行ニューロンを操作するための適合性であり、したがって、より生理的な文脈。重要なのは、物質が容易にadministeに関連する可能性のある副作用を回避し、神経細胞移動への影響をテストするためにex vivoで後脳の外植片に適用することができ妊娠中のマウスにこれらの物質を鳴らす。最後に、ex vivoでのモデルはまた、このような機能阻害抗体として、胎盤関門を通過しない物質のテストを行うことができます。これらの利点により、ex vivoで培養後脳は、水槽の水に水溶性の小分子で治療することができるゼブラフィッシュ胚を用いて、または特殊化の使用を必要とする脳の胚の子宮内エレクトロポレーションでの代替と相補的な方法を提供するここで説明する培養技術よりマスター機器がより困難となる。ここに記載されたプロトコルの別の利点は、したがって、ニューロン遊走のマウスモデルへのニワトリ胚を操作するために開発された標準的な発生学的方法の適用を可能にする、組換えタンパク質または他の試薬に浸したビーズを移植への従順である。具体的には、ex vivoで培養モデルは、遺伝子改変マウスのhindbrainsに適用することができる欠陥品このような成長や指導因子受容体などの神経細胞移動に関与する特定の分子にTIVE、およびリガンドに対する反応性が失われたかどうかをテストするために、ビーズのインプラントと組み合わせる。薬理学的操作に加えて、ex vivoで培養プロトコルは、目的の遺伝子の発現を操作することができる発現ベクターをエレクトロポレーションするように適合され得る;エレクトロポレーションのための適切な方法は、以前22,23に記載されている。 Rosa26Yfp 21;また、このプロトコルは、蛍光標識されたFBMニューロン、 例えばISL1-Creをを含むトランスジェニックマウスの後脳の外植片の経時顕微鏡で神経細胞の移動を視覚化するために適合させることができる。これは、古い胚段階でhindbrainsの使用を必要とし、最大48時間の培養を必要とし得るが、最終的に、このプロトコルはまた、下オリーブを形成するものとして後脳におけるニューロンの移行他の種類を研究するために使用することができる、神経細胞の生存能力に応じて、 ex vivoで。
重要なステップとトラブル
このプロトコルの成功のためには、胚がFBMニューロンの移行が始まったばかりE11.25、に近い日のE11.5、早期収集されることが重要です。しかし、それは、マウスの自然交配の変動には、この発達段階の胚をキャッチし、それに応じて、異なる実験間のFBM移動の延長に多少のばらつきがある可能性があり、常に可能ではない。実験は、 図3Eから分かるように、割り当てられた時間枠内で約3時間後に完了しない場合FBM遊走における変動も観察することができる。 E11.25マウス胚から後脳組織はデリケートです。解剖し、外植手順ではときに、FBMニューロンが配置されているR4-R6から地域に後脳組織を引き裂くしないことが重要です。ディスの繊細な性質のためにhindbrainsが培養に配置される速度が結果に影響ECTIONプロセス、およびので、手順は貴重なサンプルや試薬が使用されている、特に前に、練習のカップルがマスターに実行されますがかかる場合があります。最後に、培養中の後脳組織の折り畳み( 図3F参照 )、通常のFBMの移行を防ぐことができますので、後脳組織は、カルチャーインサート上で開いた本構成に置かれることが重要である。
開示事項
著者はいずれも、興味や利害競合していない。
謝辞
MTは、博士課程の学生の身分[参考文献によってサポートされています。新しい研究者賞によって092839/Z/10/Z]とCR [参考文献。ウェルカムトラストから095623/Z/11/Z]。
資料
| Name | Company | Catalog Number | Comments |
| Eppendorf round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | |
| Cell culture plates, 12-well | Thermo Scientific | 150628 | |
| Plastic cell culture dish, 100 mm | Thermo Scientific | 150288 | |
| 15 mm Netwell insert with Mesh Polyester Membrane | Corning | 3477 | |
| Watchmaker forceps, no. 5 | Dumont | 91150-20 | |
| Phosphate buffered saline | Sigma | P4417 | |
| Laminin mouse protein | Life Technologies | 23017-015 | |
| Primary antibody, Isl1 | Developmental Hybridoma Bank | 39.4D5 | Dilution 1/100 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Life Technologies | A11029 | Dilution 1/200 |
| Neurobasal medium | Life Technologies | 21103 | |
| B27 supplement (50x) | Life Technologies | 17504-044 | |
| Leibovitz’s L-15 | Life Technologies | 21083-027 | |
| Penicillin/ streptomycin | Life Technologies | 15070 | |
| Glucose | VWR | 101174Y | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Triton X-100 | Sigma | T8787 | |
| Paraformaldehyde | Sigma | P6148 | |
| Slowfade Antifade Kit | Life Technologies | S-2828 | Alternative mounting solutions may be used |
| Microscope slides | VWR | 631-0912 | |
| Cover glass | VWR | 631-0137 | |
| Affi-Gel Heparin Beads | Biorad | 153-6173 | Glass, latex, or coloured beads may be used alternatively |
| Recombinant human VEGF165 | R&D Systems | 293-VE | Resuspend in PBS, store aliquots at -80 °C |
| Stereo Microscope, Leica MZ16 | Leica | ||
| Confocal laser scanning microscope LSM710 | Zeiss |
参考文献
- Lumsden, A., Keynes, R. Segmental patterns of neuronal development in the chick hindbrain. Nature. 337 (6206), 424-428 (1989).
- Chandrasekhar, A. Turning heads: development of vertebrate branchiomotor neurons. Dev. Dyn. 229 (1), 143-161 (2004).
- Mapp, O. M., Wanner, S. J., Rohrschneider, M. R., Prince, V. E. Prickle1b mediates interpretation of migratory cues during zebrafish facial branchiomotor neuron migration. Dev. Dyn. 239 (6), 1596-1608 (2010).
- Glasco, D. M., Sittaramane, V., Biol, D. e. v. .., et al. . The mouse Wnt/PCP protein Vangl2 is necessary for migration of facial branchiomotor neurons, and functions independently of Dishevelled. 369 (2), 211-222 (2012).
- Marillat, V., Sabatier, C., et al. The Slit Receptor Rig-1/Robo3 Controls Midline Crossing by Hindbrain Precerebellar Neurons and Axons. Neuron. 43 (1), 69-79 (2004).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298 (5600), 1959-1964 (2002).
- Vivancos, V., Chen, P., et al. Wnt activity guides facial branchiomotor neuron migration and involves the PCP pathway and JNK and ROCK kinases. Neural Dev. 4, 7 (2009).
- Guan, K. -. L., Rao, Y. Signalling mechanisms mediating neuronal responses to guidance cues. Nat. Rev. Neurosci. 4 (12), 941-956 (2003).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat. Rev. 8 (11), 859-871 (2007).
- Garel, S., Garcia-Dominguez, M., Charnay, P. Control of the migratory pathway of facial branchiomotor neurones. Development. 127 (24), 5297-5307 (2000).
- Gavalas, A., Ruhrberg, C., Livet, J., Henderson, C. E., Krumlauf, R. Neuronal defects in the hindbrain of Hoxa1, Hoxb1 and Hoxb2 mutants reflect regulatory interactions among these Hox genes. Development. 130 (23), 5663-5679 (2003).
- Grant, P. K., Moens, C. B. The neuroepithelial basement membrane serves as a boundary and a substrate for neuron migration in the zebrafish hindbrain. Neural Dev. 5, 9 (2010).
- Lumsden, A. Segmentation and compartition in the early avian hindbrain. Mech. Dev. 121 (9), 1081-1088 (2004).
- Tsuchida, T., Ensini, M., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Qu, Y., Glasco, D. M., et al. Atypical cadherins Celsr1-3 differentially regulate migration of facial branchiomotor neurons in mice. J. Neurosci. 30 (28), 9392-9401 (2010).
- Schwarz, Q., Gu, C., et al. Vascular endothelial growth factor controls neuronal migration and cooperates with Sema3A to pattern distinct compartments of the facial nerve. Genes Dev. 18 (22), 2822-2834 (2004).
- Stockinger, P., Maître, J. -. L., Heisenberg, C. -. P. Defective neuroepithelial cell cohesion affects tangential branchiomotor neuron migration in the zebrafish neural tube. Development. 138 (21), 4673-4683 (2011).
- Wanner, S. J., Prince, V. E. Axon tracts guide zebrafish facial branchiomotor neuron migration through the hindbrain. Development. , (2013).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. Neurosci. 20 (1), 206-218 (2000).
- Laird, P. W., Zijderveld, A., Linders, K., Rudnicki, M. A., Jaenisch, R., Berns, A. Simplified mammalian DNA isolation procedure. Nucleic Acids Res. 19 (15), 4293 (1991).
- Srinivas, S., Watanabe, T., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1 (1), 4 (2001).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J. Vis. Exp. (74), (2013).
- Holland, P. J., George, A. M., Worrell, L. T. C., Landsberg, R. L. In vitro electroporation of the lower rhombic lip of midgestation mouse embryos. J. Vis. Exp. (66), (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved