Method Article
Souris Rhombencéphale
Dans cet article
Résumé
Neurones embryonnaires sont nés dans la zone ventriculaire du tube neural, mais migrent pour atteindre les objectifs appropriés. Branchiomotor visage (FBM) neurones sont un modèle utile pour étudier la migration neuronale. Ce protocole décrit la wholemount ex vivo de culture hindbrains d'embryons de souris pour étudier les mécanismes qui régulent la migration FBM.
Résumé
Neurones embryonnaires sont nés dans la zone ventriculaire du cerveau, mais par la suite émigré vers de nouvelles destinations pour atteindre les objectifs appropriés. Décrypter les signaux moléculaires qui guident collaboration migration neuronale dans le cerveau embryonnaire est donc important de comprendre comment les réseaux de neurones complexes forment qui soutiennent plus tard la vie postnatale. Branchiomotor facial (FBM) neurones dans le cerveau postérieur de l'embryon de souris migrent de rhombomère (r) 4 caudale pour former les noyaux faciaux appariés dans la région r6 dérivé du cerveau postérieur. Ici, nous fournissons un protocole détaillé pour wholemount ex vivo de culture hindbrains d'embryon de souris appropriés pour enquêter sur les voies de signalisation qui régulent la migration FBM. Dans cette méthode, hindbrains d'embryons de souris E11.5 sont disséqués et cultivées dans une préparation de livre ouvert sur des inserts de culture cellulaire pour 24 h. Pendant ce temps, les neurones FBM migrent en direction caudale vers r6 et peuvent être exposés à des anticorps de la fonction de blocage et de petit Molecules dans les milieux de culture ou de billes d'héparine chargés de protéines recombinantes d'examiner les rôles des voies impliquées dans l'orientation de la migration neuronale de signalisation.
Introduction
Neurones embryonnaires sont nés dans la zone ventriculaire du cerveau, mais par la suite émigré vers de nouvelles destinations pour atteindre les régions cibles appropriés qui sont situés à une grande distance. Le positionnement correct des corps de cellules neuronales dans des endroits appropriés le long des axes dorso-ventral et antéro-postérieure du cerveau en développement est essentiel pour le câblage correct, la survie et la fonction de ces neurones après l'étape de migration 4.1. Comme pour les mécanismes moléculaires qui contrôlent le guidage axonal 5-7, jeux combinatoires de signaux attractives et répulsives sont censés guider les neurones migrent 1,8. Toutefois, en raison des interactions de plusieurs types de cellules, les signaux de commande de la migration neuronale ont été moins largement étudiés que ceux impliqués dans le guidage axonal, qui peut être étudié cellule autonome. Le cerveau postérieur développement des vertébrés a été utilisé dans plusieurs études récentes de comprendre les mécanismes moléculaires et cellulairesde la migration neuronale, par exemple en poussin, souris, poisson zèbre et 1-4,9. Cet organe comprend plusieurs types de neurones, y compris plusieurs sous-types de précérébelleux et les neurones moteurs 5,7,10,11.
Motoneurones du cerveau postérieur sont nés dans la zone ventriculaire à proximité de la plaque de sol, et ils se différencient en sous-ensembles spécifiques en fonction de leur rhombomère d'origine 1,12. Le branchiomotor visage (FBM) neurones sont générés dans rhombomère (r) 4 dans le cerveau postérieur et étendre leurs axones dorsale par un point de sortie r4 dans le deuxième arc branchial pour innerver les muscles du visage 2,9,13. FBM neurones de poisson zèbre et la souris offrent d'excellents modèles pour étudier les mécanismes moléculaires et cellulaires de la migration neuronale dans un processus qui est facilement visualisé, parce que ces neurones translocation reproductible de leur corps cellulaire dans un processus spatio-temporelle bien définie. Chez la souris, les neurones migrent FBM premier CauDally par r5 et deux en bas et le ventre pour atteindre leur position finale sur le côté pial du cerveau postérieur sur le territoire de r6, où ils forment les noyaux appariés du nerf crânien VII (viin) 10,11,14. Chez le poisson zèbre, les neurones FBM initialement migrent ventralement et ensuite changer de direction à la limite r4-r5 à continuer à migrer vers la surface de la pie-mère d'une manière dépendante de la laminine 4,12,15,16. Cette migration se déroule sur une période de plusieurs jours dans le développement et peut être divisé en phases de migration tangentielle et radiale, ce qui permet l'identification de molécules qui assurent la médiation de ces deux processus distincts. En revanche, les neurones de la FBM poussin cerveau postérieur embryonnaire restent dans r4 3,13,17-19.
Au cours de leur migration, les neurones FBM peuvent être identifiés, comme les autres types ou les neurones moteurs, par leur expression du facteur de transcription homoeodomain îlot 1 (ISL1) 14. Ainsi, grosemount coloration par immunofluorescence ou par hybridation in situ pour ce marqueur à différents stades de développement révèle le courant de migration distincte de FBM somata s'étendant à partir de R4 à R6 dans le poisson-zèbre ou la souris 4,15,16. En outre, les journalistes transgéniques fluorescents tels que ISL1-GFP ont été utilisés comme des outils appropriés pour visualiser la migration des neurones FBM chez le poisson zèbre 3,17-19. En plus de leur aptitude à l'imagerie, de nombreux chercheurs ont étudié la migration des neurones en développement FBM poisson-zèbre, en raison de leurs embryons vivant en liberté peuvent être manipulées facilement par des techniques de transplantation de cellules et de composés pharmacologiques appliqués directement à l'eau de l'aquarium. En revanche, l'embryon de souris développe enfermé dans l'utérus, ce qui empêche l'implantation de billes portant des signaux de guidage ou l'administration d'anticorps de fonction de blocage qui ne traversent pas la barrière placentaire. En outre, les composés pharmacologiques administrés à la mère enceinte peut avoir noneffets secondaires souhaités qui peuvent nuire indirectement embryogenèse. Contourner cette limitation, nous avons développé une méthode ex vivo de la culture pour l'ensemble du cerveau postérieur de la souris qui est compatible avec la migration des neurones FBM et la survie pendant 24 heures après l'explantation 7,16. Cette méthode permet une manipulation facile pharmacologique, l'implantation des billes portant des signaux de guidage ou de l'administration d'anticorps anti-blocage de la fonction et pourrait également être adapté à l'étude de la migration des autres sous-types de neurones dans le cerveau postérieur à différents stades de développement.
Protocole
Une. Facultatif: Préparez Affi-gel perles d'héparine (Perles de gel) pour FBM activité Assay
NOTE: Préparer des billes de gel d'au moins 1 jour avant de commencer la procédure d'explantation.
- Laver 100 ul d'héparine suspension de billes de gel avec du PBS stérile, pendant 20 min sur un rouleau à la température ambiante (RT).
- perles de granulés dans une centrifugeuse de dessus de table pendant 5 min à 13 000 x g. Ajouter PBS stérile et répéter la procédure de lavage 4x.
- Après le dernier lavage, éliminer le PBS et laisser tremper les perles dans un petit volume d'une solution stérile contenant la protéine recombinante de choix, en prenant soin de couvrir les perles avec la solution. Ce protocole utilise 100 ng / ul VEGF165 humain recombinant dans du PBS pour reproduire une expérience précédemment publiée 16.
- Incuber les perles de gel d'héparine avec la solution de protéines recombinantes pour un minimum de 12 heures et un maximum de 1 semaine sur un rouleau à 4 ° C.
2. Revêtement de la Culture Insérers
Des explants sont cultivés cerveau postérieur mises en culture sur des inserts Corning avec une taille de pores de 8 pm, ou inserts équivalents. des inserts de culture peuvent être réutilisées après la fin du protocole, à condition qu'ils soient lavés avec de l'eau distillée, stérilisée avec de l'éthanol, et stockés dans 70% d'éthanol jusqu'à ce que nécessaire.
REMARQUE: Les étapes suivantes doivent être effectuées dans une hotte à flux dans des conditions stériles.
- Préparer explant milieux de culture consistant en milieu Neurobasal additionné de B27 (20 ul / ml), glucose (6 mg / ml) et de la pénicilline / streptomycine (5 ug / ul).
- Culture lavage insère avec PBS stérile pendant 5 min et sec pendant 5-10 min sous la hotte à flux.
- Placez un insert de culture dans chaque puits d'une plaque 12well. Remarque: inserts peuvent avoir besoin d'une petite poussée pour s'adapter étroitement dans le puits.
- Couvrir les inserts de culture avec 10 à 20 pg / ml de laminine de souris dans du milieu Neurobasal et les placer dans un incubateur de culture tissulaire (37 ° C, 5% CO 2) pendant 1 heure. Remarque: revêtement doit être effectué le jour de l'explantation.
3. Dissection de Hindbrains de E11.5 embryons de souris
- Abattre chronométré souris femelle enceinte avec une procédure éthique approuvé le jour embryonnaire (E) de 11,5 et placer l'utérus contenant les embryons dans une boîte en plastique de 100 mm avec support de L15 glacée.
NOTE: Toutes les étapes de dissection doivent être effectuées dans glacée L15. - En utilisant un microscope à dissection et Dumont horloger forceps numéro 5, déchirer la paroi du muscle utérin pour exposer les embryons, libérer chaque embryon, couper le cordon ombilical, et retirez le sac jaune.
- Avec une pipette Pasteur en plastique avec une large ouverture de forage, transférer chaque embryon dans un plat en plastique propre avec de la glace-froid L15.
- En utilisant une pince Dumont, décapiter l'embryon juste au-dessus des pattes avant. Si l'expérience nécessite génotypage des embryons, prélever des échantillons de tissus pour l'isolement de l'ADN génomique (par exemple un petit piece de sac jaune ou bout de la queue 16,20).
- Tournez la face dorsale de la tête et identifier la 4 e ventricule, qui est couverte par une couche de tissu mince (figure 2B). Percer délicatement la roofplate et de commencer à éplucher loin caudale le long de la ligne médiane sur le cerveau postérieur postérieur et la moelle épinière, et rostralement sur le mésencéphale. Le cerveau postérieur devrait maintenant être exposé (figure 2C).
- Taquiner soigneusement loin le mésenchyme de la tête restant et des méninges qui sont attachés au côté pial du cerveau postérieur (figure 2D).
- Retirer le tissu de la moelle épinière et du cerveau moyen afin que le cerveau postérieur se déploie et peut être à plat dans une préparation à livre ouvert (figure 2E).
- L'utilisation d'un grand diamètre en plastique pipette Pasteur, transférer chaque cerveau postérieur disséqué à une plaque de 12 puits contenant de la glace-froid L15 et de les stocker sur la glace jusqu'à ce que tous hindbrains ont été disséqués.
- L'utilisation d'un grand diamètre en plastique pipette Pasteur, transférer un péchégle cerveau postérieur à un plat vide, garder une préparation à livre ouvert, côté ventriculaire jusqu'à, dans une gouttelette d'environ 100 pi L15.
- Transférer quelques microlitres de perles incubées gel d'héparine à la même gouttelette. Remarque: Étant donné que les tailles de perles sont variables, il est conseillé de transférer environ 10 perles, puis choisissez une taille optimale pour la transplantation dans le cerveau postérieur.
- Faire une petite déchirure dans le tissu du cerveau postérieur et insérer soigneusement 1-3 billes de gel dans le tissu du cerveau postérieur au niveau de r5 / 6, à mi-chemin entre la ligne médiane et le bord latéral du cerveau postérieur, les abaisser dans le tissu de sorte que le bourrelet est positionnée juste en dessous de la surface du cerveau postérieur.
NOTE: La procédure de dissection peut prendre entre 5-20 min / cerveau postérieur, selon l'expérience, et peut s'étirer sur une longue période si les portées sont grandes, en tout cas, hindbrains doivent être en culture plus de 3 heures post-mortem pour de bon résultats.
4. RhombencéphaleExplantation Culture
- Retirer la plaque contenant les inserts de culture à partir de l'incubateur, aspirer la solution de revêtement de la laminine.
- Placez un insert de culture dans une boîte de culture distincte rempli de glace-froid L15 et, en utilisant un large tunnel plastique pipette Pasteur, transférer chaque face ventrale du cerveau postérieur vers le haut sur l'insert de culture (figure 2G). Le cerveau postérieur doit se trouver entièrement à plat sur la membrane de l'insert.
- Soulevez délicatement l'insert de la culture de l'antenne et tamponner plusieurs fois sur du papier absorbant propre pour enlever l'excès de liquide. Ce processus garantit que le cerveau postérieur adhère à l'insert de culture, une préparation à livre ouvert plat. Si le cerveau postérieur se recroqueville, son tissu peut irréversible grandir ensemble.
- Remplir la plaque d'origine de 12 puits avec 500 pi milieux de culture préchauffé et placer l'insert de retour dans ce puits. Réglez soigneusement le volume avec un autre 400-600 ul de médias de couvrir tout le cerveau postérieur, veiller à ce que le cerveau postérieur ne flotte pasau large de la membrane. Si elle flotte, retourner à l'étape 4.4 et répéter jusqu'à ce que le cerveau postérieur reste fixée à la membrane.
- A ce stade, il est possible d'ajouter des inhibiteurs biologiques d'intérêt pour les médias d'étudier leur effet sur la migration des neurones FBM.
NOTE: Si l'implantation des perles ou l'administration d'autres traitements, il est recommandé de maintenir au moins deux explants de contrôle dans des conditions normales de croissance par expérience pour s'assurer que l'expérience a été mise en place avec succès. - Incuber 24 à 30 heures pour les explants dans un incubateur de culture de tissu (à 37 ° C, 5% CO 2).
5. Wholemount immunofluorescence de Rhombencéphale explants
- Aspirer les médias de chaque puits, rincer dans du PBS et fixer pendant 2 h à 4 ° C avec agitation douce dans glacée 4% de formaldéhyde (fraîchement préparée ou fraîchement décongelé paraformaldéhyde 4% dissous dans du PBS). Note: Ne pas essayer d'enlever le cerveau postérieur de l'insert de culture avant la fixationest complète.
- Rincer 3x avec PBS. Retirer délicatement les hindbrains des inserts de culture à l'aide de forceps Dumont. Certains explants sont difficiles à décoller, mais peuvent généralement être levées en appliquant une pression douce à travers l'expulsion répétée PBS à partir d'une pipette.
- Transférer les hindbrains à 2,0 ml tubes à fond rond pour marquage en immunofluorescence. Perméabiliser hindbrains pendant 30 min à température ambiante (RT) dans du PBS contenant 0,1% de Triton X-100 (PBT) avec roulement doux.
- Incuber pendant 1 heure à température ambiante dans PBT contenant 10% de sérum de chèvre normal inactivé par la chaleur avec roulement doux.
- Incuber les explants avec roulement doux à 4 ° C pendant 5 jours avec l'anticorps primaire spécifique pour ISL1, dilué à 1:100 dans du PBT contenant 1% de sérum de chèvre normal inactivé à la chaleur.
- Laver les explants à RT 4x avec PBT pendant 15 min chacun.
- Incuber explants avec roulement doux à température ambiante pendant 3 h avec un fluorophore conjugué anticorps de chèvre anti-souris (par exemple, Alexa Fluor 488 de chèvre antisouris, dilué à 1:200) dans PBT contenant 1% de sérum de chèvre normal inactivé à la chaleur.
- Laver les explants 4x à température ambiante avec PBT pendant 15 min chacun avec roulement doux.
- Postfix les explants dans 4% de formaldéhyde pendant 30 min à température ambiante.
- Couvrir une lame de verre avec 3 couches de ruban électrique noir et accises avec un scalpel un petit carré de la bande en couches pour créer une poche pour les explants; alternativement, utiliser une lame de verre de dépression.
- Montez chaque cerveau postérieur dans le réactif SlowFade dans une poche et couvrir avec une lamelle de verre, en évitant soigneusement de bulles d'air de piéger et de l'image en utilisant un microscope confocal à balayage laser.
NOTE: Comme alternative à immunologique, hybridation in situ avec des ribosondes qui reconnaissent FBMS (c.-à-Isl1 ou PHOX2B) en peut être utilisé pour visualiser les neurones FBM 16,21.
Résumé des étapes et le calendrier
~ 14 jours: accouplement pour obtenir des grossesses E11.25 temporisé
Facultatif: Perle préparation (Protocol 1): ~ 2 heures, le jour avant l'isolement de l'embryon
Préparer des inserts de culture et des médias (Protocole 2): ~ 30 min, avant l'isolement de l'embryon
l'isolement de l'embryon et la dissection du cerveau postérieur (étapes 3.1 à 3.4): ~ 10 min / embryon
Dissection du cerveau postérieur (étapes 3.5 à 3.7): ~ 5-10 min / hindbrain
procédure d'explantation (étapes 3.8 à 3.9): ~ 5-10 min / hindbrain
Facultatif: Perle implantation (étapes 3.10 à 3.11): ~ 5-10 min / hindbrain
culture de l'explantation (étape 4.7): 24 h
Fixation pour la coloration des anticorps (étape 5.1): 2 heures
Procédure de coloration et de l'imagerie (protocole n ° 5): 5 jours
Résultats
Cette section présente des exemples de résultats qui peuvent être obtenus par l'étude de FBM migration des neurones dans le cerveau postérieur de la souris à travers la culture ex vivo. Nous montrons que les neurones FBM dans hindbrains explantées du jour 11 embryons de souris subissent d'abord une migration tangentielle (figure 3A) et ensuite commencer à assembler le noyau moteur facial (figure 3B), similaire à leur comportement in utero (voir la figure 1). Nous démontrons en outre que l'implantation d'un cordon de VEGF165 imbibé attire neurones FBM (figures 3C et 3D), comme indiqué précédemment 16. Surtout, ce protocole permet d'étudier la migration FBM en l'absence de vaisseaux sanguins ou de facteurs de navires dérivés qui peuvent influencer la migration FBM in utero, parce que le système vasculaire non perfusée dégénère en culture 16. Ainsi, le marquage des cellules sanguines non spécifique observée lors de l'utilisation de l'anticorps de la souris sur ISL1 fraîchementhindbrains de souris isolées (figure 1) n'est plus présent dans le tissu du cerveau postérieur après 24 h de culture (figures 3A-F). Enfin, nous montrons deux exemples de hindbrains qui n'ont pas été explantés correctement et donc contiennent neurones FBM dans une distribution anormale, soit parce que le cerveau postérieur n'a pas été explantée assez tôt après embryon isolement (figure 3F) ou parce que le tissu du cerveau postérieur replié dans le transwell ( Figure 3F).

Figure 1. FBM migration des neurones confocale z-stack de hindbrains type sauvage de souris après ISL1 immunomarquage wholemount et flatmounting;.. La ligne médiane du cerveau postérieur est indiqué par un astérisque dans tous les panneaux (A) surface ventriculaire du cerveau postérieur un de E11.5 dans le zone contenant les neurones FBM Isl1 positif (flèche), démontrant ainsi leur migration tangentielle de R4 à R6;. la position de R4, R5 et R6 est indiqué (A ') surface Pial de la moitié de la même cerveau postérieur dans la zone contenant l'ébauche . d'un des noyaux FBM appariés (indiqués par viin), ainsi que d'autres populations de neurones de Isl1 positif (B) surface ventriculaire d'un cerveau postérieur de E12.5 neurones contenant FBM que migrent tangentiellement (flèche); la flèche indique un exemple d'un vaisseau sanguin contenant des cellules circulantes qui sont marqués de manière non spécifique par réaction croisée de l'anticorps secondaire anti-souris utilisé pour détecter l'anticorps IgG de souris ISL1. (B ') une surface de Pial moitié du même cerveau postérieur de E12.5, qui contient un des noyaux appariés FBM. La ligne médiane est indiqué par un astérisque dans chaque panneau. La barre d'échelle (tous les panneaux): 200 um. V, ventrale, P, pial./ 51397fig1highres.jpg "target =" _blank "> Cliquez ici pour agrandir l'image.

Figure 2. E11.5 souris hindbrain dissection et la culture ex vivo. (AE) des étapes clés dans le protocole de dissection E11.5 de cerveau postérieur; barre d'échelle: 1. Mm (A) Chef de l'embryon après qu'il a été coupé du reste de l'embryon au niveau des membres antérieurs (B) La partie rostrale du. la tête a été retiré et le reste du tissu de la tête placé de sorte que le 4 e ventricule (flèche) a été orientée vers le haut. (C) Le toit de la 4 ème ventricule a été enlevé par pelage, et le cerveau postérieur a été exposé par le tissu de pelage sous le cerveau postérieur à une distance rostralement et caudale. (D) La membrane pial a été retiré (à noter que dans cette exexemple, certains moelle épinière cervicale (SC) tissu est resté attaché à la rhombencéphale). (E) mésencéphale Excédent (MB) et la moelle épinière (SC) tissu a été retiré pour ne garder que le cerveau postérieur. (inserts F) culture ont été revêtues d' laminine et placé dans une plaque de culture 12 tissulaire bien. (G) Chaque cerveau postérieur a été placé sur un insert et couvert avec les médias. (H) Représentation schématique de la voie empruntée par la migration des neurones FBM (bleu) pendant 24 heures de culture. Cliquez ici pour agrandir l'image.
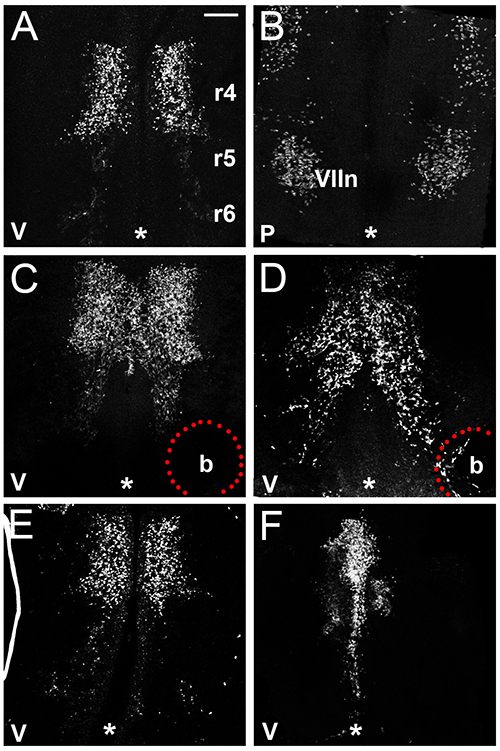
Figure 3. Souris hindbrain ex vivo culture. (A, B) Un cerveau postérieur de E11.5 a été cultivé pendant 24 heures et immunofluoresc ently étiquetés pour ISL1 pour illustrer FBM migration des neurones dans un explant; la fois ventriculaire (A) et la pie-mère (B) et d'autre de la cerveau postérieur sont indiqués (C, D) hindbrains E11.5 de la même portée ont été cultivées en présence d'implantation bourrelet d'héparine trempé. dans du PBS (C) ou VEGF165 (D); noter que les neurones FBM migré vers et sur le talon du VEGF 165, et le flux de migration par conséquent encore étendues en direction caudale par rapport à la face non traitée de la même cerveau postérieur ou le cerveau postérieur contenant la bille de contrôle (E. , F) Exemples de insatisfaisants explants E11.5 de cerveau postérieur, dans lequel FBMS n'ont pas émigré de R4 (E), ou dans lequel le tissu du cerveau postérieur plié lors de la culture (F). La ligne médiane est indiqué par un astérisque dans chaque panneau. La barre d'échelle (pour tous les panneaux): 200 um. V, ventrale, P, pial."> Cliquez ici pour agrandir l'image.
Discussion
Ce protocole décrit la culture de wholemount hindbrains de souris E11.5 dans un système Transwell d'étudier la migration des neurones FBM. Ce protocole permet de motoneurones du cerveau postérieur de la souris pour être maintenus en vie et la migration pour une période de 24 heures, ce qui permet la manipulation ex vivo. Cette méthode présente de nombreux avantages expérimentaux pour les enquêteurs cherchent à identifier les mécanismes moléculaires et cellulaires de la migration neuronale. Attendu que les dosages de migration traditionnels explant de petits morceaux de tissus neuronaux en matrice sur des boîtes de culture et de permettre l'observation des neurones individuels comme ils réagissent à des stimuli exogènes, un avantage majeur de l'essai de puits transversal est son aptitude à manipuler les neurones qui migrent à l'intérieur de l'environnement de l'organe de l'hôte et donc une plus contexte physiologique. Surtout, les substances peuvent être facilement appliquées aux ex vivo du cerveau postérieur explants de tester leur effet sur la migration neuronale, contourner les effets secondaires possibles associés à administesonner ces substances à une souris enceinte. Enfin, le modèle ex vivo permet également à l'essai des substances qui ne traversent pas la barrière placentaire, tels que des anticorps de la fonction de blocage. En raison de ces avantages, la culture ex vivo cerveau postérieur fournit une méthode alternative et complémentaire à l'aide d'embryons de poisson zèbre, qui peuvent être traitées avec des solubles dans l'eau de petites molécules dans l'eau de l'aquarium, ou d'électroporation in utero de cerveaux embryonnaires, ce qui nécessite l'utilisation d'spécialisé l'équipement et est plus difficile à maîtriser que la technique de culture décrit ici. Un autre avantage du protocole décrit ici est sa susceptibilité à l'implantation des billes trempées dans une protéine recombinante ou d'autres réactifs, ce qui permet donc l'application d'une méthode embryologique type conçu pour manipuler des embryons de poulet à un modèle de souris de la migration neuronale. En particulier, le modèle ex vivo de culture peut être appliquée à hindbrains de souris génétiquement modifiées défection des molécules spécifiques impliquées dans la migration neuronale, tels que les récepteurs de facteur de croissance ou d'orientation, et combiné avec des implants de perles de tester si la réactivité des ligands est perdu. En plus de la manipulation pharmacologique, le protocole ex vivo de culture peut également être adapté pour l'électroporation des vecteurs d'expression qui pourraient manipuler l'expression de gènes d'intérêt; méthodes appropriées pour l'électroporation ont déjà été décrits 22,23. Ce protocole peut également être adapté pour visualiser la migration des neurones par microscopie time-lapse dans des explants du cerveau postérieur de souris transgéniques contenant des neurones marqués par fluorescence FBM, par exemple Isl1-Cre; Rosa26Yfp 21. Enfin, ce protocole peut également être utilisé pour étudier d'autres types de neurones qui migrent dans le cerveau postérieur, tels que ceux qui forment l'olive inférieure, bien que cela nécessiterait l'utilisation de hindbrains au âgées embryonnaire et peut exiger la culture jusqu'à 48 h, en fonction de la viabilité neuronale Ex vivo.
Les étapes critiques et dépannage
Pour la réussite de ce protocole, il est crucial que les embryons sont recueillis dès le début E11.5 jour, près de E11.25, quand FBM migration des neurones vient de commencer. Cependant, il n'est pas toujours possible de prendre des embryons à ce stade de développement en raison de la variabilité naturelle de l'accouplement de souris, et, par conséquent, il peut y avoir une certaine variabilité dans l'étendue de la migration entre les différentes expériences FBM. La variabilité de la migration FBM peut aussi être observée si l'expérience n'est pas terminée dans le délai assigné, environ 3 heures, comme on peut le voir sur la figure 3E. Tissus du cerveau postérieur à partir d'embryons de souris E11.25 est délicate. Lors de la dissection et tout au long de la procédure d'expiant, il est important de ne pas déchirer le tissu du cerveau postérieur dans les domaines de r4-r6 où sont situés les neurones FBM. En raison de la nature délicate de la dissprocessus de ection, et parce que la vitesse à laquelle hindbrains sont placés dans la culture influe sur l'état, la procédure pourrait prendre une couple de pratique va à maîtriser, en particulier avant les précieux échantillons ou des réactifs sont utilisés. Enfin, il est important que le tissu du cerveau postérieur est placé dans une configuration ouverte de l'ouvrage sur l'insert de culture, parce que le pliage du tissu du cerveau postérieur pendant la culture permet d'éviter la migration de la FBM normale (voir la figure 3F).
Déclarations de divulgation
Aucun des auteurs ont des intérêts ou des conflits d'intérêts concurrents.
Remerciements
MT est soutenu par une bourse d'études de doctorat [réf. 092839/Z/10/Z] et CR par une bourse de nouveau chercheur [réf. 095623/Z/11/Z] du Wellcome Trust.
matériels
| Name | Company | Catalog Number | Comments |
| Eppendorf round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | |
| Cell culture plates, 12-well | Thermo Scientific | 150628 | |
| Plastic cell culture dish, 100 mm | Thermo Scientific | 150288 | |
| 15 mm Netwell insert with Mesh Polyester Membrane | Corning | 3477 | |
| Watchmaker forceps, no. 5 | Dumont | 91150-20 | |
| Phosphate buffered saline | Sigma | P4417 | |
| Laminin mouse protein | Life Technologies | 23017-015 | |
| Primary antibody, Isl1 | Developmental Hybridoma Bank | 39.4D5 | Dilution 1/100 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Life Technologies | A11029 | Dilution 1/200 |
| Neurobasal medium | Life Technologies | 21103 | |
| B27 supplement (50x) | Life Technologies | 17504-044 | |
| Leibovitz’s L-15 | Life Technologies | 21083-027 | |
| Penicillin/ streptomycin | Life Technologies | 15070 | |
| Glucose | VWR | 101174Y | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Triton X-100 | Sigma | T8787 | |
| Paraformaldehyde | Sigma | P6148 | |
| Slowfade Antifade Kit | Life Technologies | S-2828 | Alternative mounting solutions may be used |
| Microscope slides | VWR | 631-0912 | |
| Cover glass | VWR | 631-0137 | |
| Affi-Gel Heparin Beads | Biorad | 153-6173 | Glass, latex, or coloured beads may be used alternatively |
| Recombinant human VEGF165 | R&D Systems | 293-VE | Resuspend in PBS, store aliquots at -80 °C |
| Stereo Microscope, Leica MZ16 | Leica | ||
| Confocal laser scanning microscope LSM710 | Zeiss |
Références
- Lumsden, A., Keynes, R. Segmental patterns of neuronal development in the chick hindbrain. Nature. 337 (6206), 424-428 (1989).
- Chandrasekhar, A. Turning heads: development of vertebrate branchiomotor neurons. Dev. Dyn. 229 (1), 143-161 (2004).
- Mapp, O. M., Wanner, S. J., Rohrschneider, M. R., Prince, V. E. Prickle1b mediates interpretation of migratory cues during zebrafish facial branchiomotor neuron migration. Dev. Dyn. 239 (6), 1596-1608 (2010).
- Glasco, D. M., Sittaramane, V., Biol, D. e. v. .., et al. . The mouse Wnt/PCP protein Vangl2 is necessary for migration of facial branchiomotor neurons, and functions independently of Dishevelled. 369 (2), 211-222 (2012).
- Marillat, V., Sabatier, C., et al. The Slit Receptor Rig-1/Robo3 Controls Midline Crossing by Hindbrain Precerebellar Neurons and Axons. Neuron. 43 (1), 69-79 (2004).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298 (5600), 1959-1964 (2002).
- Vivancos, V., Chen, P., et al. Wnt activity guides facial branchiomotor neuron migration and involves the PCP pathway and JNK and ROCK kinases. Neural Dev. 4, 7 (2009).
- Guan, K. -. L., Rao, Y. Signalling mechanisms mediating neuronal responses to guidance cues. Nat. Rev. Neurosci. 4 (12), 941-956 (2003).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat. Rev. 8 (11), 859-871 (2007).
- Garel, S., Garcia-Dominguez, M., Charnay, P. Control of the migratory pathway of facial branchiomotor neurones. Development. 127 (24), 5297-5307 (2000).
- Gavalas, A., Ruhrberg, C., Livet, J., Henderson, C. E., Krumlauf, R. Neuronal defects in the hindbrain of Hoxa1, Hoxb1 and Hoxb2 mutants reflect regulatory interactions among these Hox genes. Development. 130 (23), 5663-5679 (2003).
- Grant, P. K., Moens, C. B. The neuroepithelial basement membrane serves as a boundary and a substrate for neuron migration in the zebrafish hindbrain. Neural Dev. 5, 9 (2010).
- Lumsden, A. Segmentation and compartition in the early avian hindbrain. Mech. Dev. 121 (9), 1081-1088 (2004).
- Tsuchida, T., Ensini, M., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Qu, Y., Glasco, D. M., et al. Atypical cadherins Celsr1-3 differentially regulate migration of facial branchiomotor neurons in mice. J. Neurosci. 30 (28), 9392-9401 (2010).
- Schwarz, Q., Gu, C., et al. Vascular endothelial growth factor controls neuronal migration and cooperates with Sema3A to pattern distinct compartments of the facial nerve. Genes Dev. 18 (22), 2822-2834 (2004).
- Stockinger, P., Maître, J. -. L., Heisenberg, C. -. P. Defective neuroepithelial cell cohesion affects tangential branchiomotor neuron migration in the zebrafish neural tube. Development. 138 (21), 4673-4683 (2011).
- Wanner, S. J., Prince, V. E. Axon tracts guide zebrafish facial branchiomotor neuron migration through the hindbrain. Development. , (2013).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. Neurosci. 20 (1), 206-218 (2000).
- Laird, P. W., Zijderveld, A., Linders, K., Rudnicki, M. A., Jaenisch, R., Berns, A. Simplified mammalian DNA isolation procedure. Nucleic Acids Res. 19 (15), 4293 (1991).
- Srinivas, S., Watanabe, T., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1 (1), 4 (2001).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J. Vis. Exp. (74), (2013).
- Holland, P. J., George, A. M., Worrell, L. T. C., Landsberg, R. L. In vitro electroporation of the lower rhombic lip of midgestation mouse embryos. J. Vis. Exp. (66), (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon