Method Article
الماوس الدماغ المؤخر
In This Article
Summary
يولدون الخلايا العصبية الجنينية في منطقة البطين في الأنبوب العصبي، ولكن الهجرة للوصول إلى الأهداف المناسبة. branchiomotor الوجه (FBM) الخلايا العصبية هي نموذجا مفيدا لدراسة هجرة الخلايا العصبية. يصف هذا البروتوكول wholemount فيفو السابقين ثقافة الماوس hindbrains جنين للتحقيق في الآليات التي تنظم الهجرة FBM.
Abstract
يولدون الخلايا العصبية الجنينية في منطقة البطين من الدماغ، ولكن في وقت لاحق الهجرة إلى وجهات جديدة للوصول إلى الأهداف المناسبة. وبالتالي فك رموز الاشارات الجزيئية التي توجه تعاوني هجرة الخلايا العصبية في المخ الجنينية من المهم أن نفهم كيف تشكل الشبكات العصبية المعقدة التي تدعم الحياة في وقت لاحق بعد الولادة. branchiomotor الوجه (FBM) الخلايا العصبية في الدماغ المؤخر جنين فأر ترحيل من قسيم معيني (ص) 4 نحو caudally لتشكيل نواة الوجه تقرن في المنطقة R6-مشتقة من الدماغ المؤخر. ونحن هنا نقدم بروتوكول مفصلة لwholemount فيفو السابقين ثقافة الماوس hindbrains الجنين مناسبة للتحقيق في مسارات الإشارات التي تنظم الهجرة FBM. في هذه الطريقة، يتم تشريح hindbrains الأجنة E11.5 الماوس ومثقف في إعداد كتاب مفتوح على إدراج ثقافة خلية لمدة 24 ساعة. خلال هذا الوقت، الخلايا العصبية FBM تهاجر نحو caudally نحو R6 ويمكن أن يتعرض لعرقلة وظيفة الأجسام المضادة وmolecul الصغيرةوفاق في وسائل الإعلام أو الثقافة أو الخرز الهيبارين محملة البروتينات المؤتلف لدراسة الأدوار لمسارات الإشارات المتورطين في توجيه هجرة الخلايا العصبية.
Introduction
يولدون الخلايا العصبية الجنينية في منطقة البطين من الدماغ، ولكن في وقت لاحق الهجرة إلى وجهات جديدة للوصول إلى المناطق المستهدفة المناسبة التي تقع على مسافة كبيرة. في الموضع الصحيح من أجسام الخلايا العصبية في الأماكن المناسبة على طول محاور ظهراني بطني والأمامي الخلفي من الدماغ النامية أمر ضروري لالأسلاك الصحيح والبقاء، وظيفة هذه الخلايا العصبية بعد المرحلة المهاجرة 1-4. على غرار الآليات الجزيئية التي تتحكم في محوار 5-7 التوجيه، ويعتقد أن مجموعات اندماجي من العظة جذابة ومثيرة للاشمئزاز لتوجيه الخلايا العصبية المهاجرة 1،8. ولكن نظرا لتفاعلات أنواع خلايا متعددة، وإشارات التحكم هجرة الخلايا العصبية وقد تم دراسة على نطاق واسع أقل من تلك التي تشارك في التوجيه محور عصبي، والتي يمكن دراستها خلية مستقلة. وقد استخدم الدماغ المؤخر النامية من الفقاريات في العديد من الدراسات الحديثة لفهم الآليات الجزيئية والخلويةالهجرة العصبية، على سبيل المثال في الفرخ، والماوس، والزرد 1-4،9. هذا الجهاز يحتوي على العديد من أنواع مختلفة من الخلايا العصبية، بما في ذلك عدة أنواع فرعية من الخلايا العصبية الحركية وprecerebellar 5،7،10،11.
يولدون motorneuron الدماغ المؤخر في منطقة البطين بالقرب من floorplate، وأنها تفرق في مجموعات فرعية محددة وفقا لقسيم معيني منشئهم 1،12. يتم إنشاء branchiomotor الوجه (FBM) الخلايا العصبية في قسيم معيني (ص) 4 في الدماغ المؤخر وتوسيع محاور بهم ظهريا من خلال نقطة خروج R4 في القوس الخيشومي الثاني ليعصب عضلات الوجه 2،9،13. الخلايا العصبية FBM من الزرد والفئران توفير نماذج ممتازة لدراسة الآليات الجزيئية والخلوية للهجرة الخلايا العصبية في العملية التي تصور بسهولة، لأن هذه الخلايا العصبية نقل من بتكاثر somata في عملية spatiotemporally محددة جيدا. في الفئران، والخلايا العصبية FBM ترحيل كاو الأولىتوانى عن طريق R5 ثم كلا نحو caudally والبطني للوصول إلى موقفهم النهائي على الجانب حنوني من الدماغ المؤخر في إقليم R6، حيث أنها تشكل نواة الاقتران من العصب القحفي VIIth (VIIn) 10،11،14. في الزرد، الخلايا العصبية FBM تهاجر البداية البطني ومن ثم تغيير الاتجاه في حدود R4-R5 لمواصلة ترحيل نحو السطح حنوني في laminin بطريقة تعتمد على 4،12،15،16. هذه الهجرة العائدات على مدى فترة من عدة أيام في التنمية ويمكن تقسيمها إلى مراحل الهجرة عرضية والشعاعية، مما يتيح تحديد الجزيئات التي تتوسط هذه العمليات مميزة اثنين. في المقابل، تبقى الخلايا العصبية FBM من فرخ الدماغ المؤخر الجنينية في R4 3،13،17-19.
أثناء هجرتها، ويمكن تحديد الخلايا العصبية FBM، مثل أنواع أخرى أو الخلايا العصبية الحركية، من خلال التعبير عنها من homoeodomain النسخ عامل جزيرة 1 (ISL1) 14. وبالتالي، مصنعونemount المناعي تلطيخ أو التهجين في الموقع لهذه العلامة في مراحل تنموية مختلفة يكشف عن تيار المهاجرة متميزة من FBM somata تمتد من R4 لR6 في الزرد أو الماوس 4،15،16. علاوة على ذلك، للصحفيين الفلورسنت المعدلة وراثيا مثل ISL1-GFP استخدمت كأدوات مناسبة لتصور هجرة الخلايا العصبية FBM في الزرد 3،17-19. بالإضافة إلى ملاءمتها للتصوير، درسوا العديد من المحققين هجرة الخلايا العصبية FBM في تطوير الزرد، لأن الأجنة فراغهم المعيشة يمكن التلاعب بها بسهولة مع تقنيات زرع الخلايا والمركبات الدوائية تطبيقها مباشرة على مياه الحوض. في المقابل، يطور المغلقة الجنين الماوس في الرحم، مما يحول دون غرس الخرز تحمل العظة توجيه أو إدارة الأجسام المضادة عرقلة وظيفة التي لا عبور حاجز المشيمة. وعلاوة على ذلك، قد المركبات الدوائية تدار على الأم الحامل لها الامم المتحدةالآثار الجانبية المطلوب الذي يمكن أن يضعف بشكل غير مباشر مرحلة التطور الجنيني. التحايل على هذا التحديد، قمنا بتطوير طريقة فيفو السابقين الثقافة لكامل الدماغ المؤخر الماوس متوافق مع الهجرة FBM الخلايا العصبية والبقاء على قيد الحياة لمدة 24 ساعة بعد explanting 7،16. هذا الأسلوب يسمح التلاعب الدوائية سهلة، زرع من الخرز تحمل العظة توجيه أو إدارة الأجسام المضادة عرقلة وظيفة ويمكن أيضا أن تتكيف مع دراسة هجرة فرعية الخلايا العصبية الأخرى في الدماغ المؤخر في مراحل تنموية مختلفة.
Protocol
1. اختياري: إعداد افى جل الهيبارين الخرز (جل الخرز) لFBM الفحص الجذب
ملاحظة: إعداد حبات هلام قبل بدء الإجراء يزدرع 1 على الأقل يوميا.
- غسل 100 ميكرولتر هلام الهيبارين حبة التعليق مع برنامج تلفزيوني العقيمة لمدة 20 دقيقة على الأسطوانة في درجة حرارة الغرفة (RT).
- الخرز بيليه في جهاز للطرد المركزي أعلى الجدول لمدة 5 دقائق في 13،000 ز س. إضافة برنامج تلفزيوني العقيمة وكرر الإجراء الغسيل 4X.
- بعد غسل النهائي، إزالة برنامج تلفزيوني ونقع حبات في كمية صغيرة من محلول معقم يحتوي على البروتين المؤتلف في الاختيار، مع الحرص على تغطية الخرز مع الحل. يستخدم هذا البروتوكول 100 نانوغرام / ميكرولتر VEGF165 الإنسان المؤتلف في برنامج تلفزيوني لإعادة إنتاج التجربة المنشورة سابقا 16.
- احتضان حبات هلام الهيبارين مع الحل البروتين المؤتلف مدة لا تقل عن 12 ساعة وبحد أقصى 1 الاسبوع على الأسطوانة في 4 درجات مئوية.
2. طلاء الثقافة إدراجق
إإكسبلنتس الدماغ المؤخر يتم تربيتها على ثقافة كورنينج إدراج مع حجم المسام 8 ميكرون، أو إدراج ما يعادلها. إدراج الثقافة يمكن إعادة استخدامها بعد الانتهاء من البروتوكول، شريطة أن يتم غسلها بالماء المقطر، تعقيمها مع الايثانول، وتخزينها في الايثانول 70٪ لحين الحاجة إليها.
ملاحظة: يجب أن تتم الخطوات التالية في غطاء تدفق تحت ظروف معقمة.
- إعداد وسائل الإعلام ثقافة يزدرع تتكون من المتوسطة Neurobasal تستكمل مع B27 (20 ميكرولتر / مل)، والجلوكوز (6 ملغ / مل)، والبنسلين / الستربتوميسين (5 ميكروغرام / ميكرولتر).
- ثقافة غسل يدرج مع برنامج تلفزيوني العقيمة لمدة 5 دقائق وجاف لمدة 5-10 دقيقة تحت غطاء تدفق.
- وضع إدراج ثقافة واحدة في كل بئر الفردية من لوحة 12well. ملاحظة: قد تحتاج إدراج دفعة صغيرة لتناسب بإحكام في البئر.
- تغطية إدراج الثقافة مع 10-20 ميكروغرام / مل laminin الماوس في المتوسطة Neurobasal ووضعها في حاضنة زراعة الأنسجة (37 درجة مئوية، 5٪ CO 2) لمدة 1 ساعة. ملاحظة: طلاء ينبغي الاضطلاع بها في يوم explanting.
3. تشريح Hindbrains من E11.5 أجنة الفئران
- اعدام توقيت الماوس الإناث الحوامل مع إجراء الموافقة أخلاقيا في يوم الجنينية (E) 11.5 ووضع الرحم الذي يحتوي على الأجنة في طبق من البلاستيك 100 ملم مع الثلج الباردة المتوسطة L15.
ملاحظة: يجب أن يتم تنفيذ جميع الخطوات تشريح L15 في الجليد الباردة. - باستخدام مجهر تشريح وملقط دومون ساعاتي عدد 5، تمزق جدار عضلة الرحم للكشف عن الأجنة، وإطلاق سراح كل جنين، قطع الحبل السري، وإزالة بعناية الكيس المحي.
- باستخدام ماصة باستير البلاستيك مع فتحة واسعة الجوف، ونقل كل جنين في طبق من البلاستيك نظيفة مع L15 الجليد الباردة.
- باستخدام ملقط دومون، وقطع رأس الجنين فقط فوق الأمامية. إذا كانت التجربة يتطلب التنميط الجيني للأجنة، وجمع عينات من الأنسجة لعزل الحمض النووي الجيني (مثل PIEC الصغيرة(ه) من الكيس المحي أو الذيل غيض 16،20).
- بدوره الجانب الظهري يصل رئيس وتحديد البطين ال 4، التي تغطيها طبقة رقيقة الأنسجة (الشكل 2B). بيرس بعناية roofplate والبدء في قشر بعيدا نحو caudally على طول خط الوسط على الدماغ المؤخر الخلفي والحبل الشوكي، وrostrally على الدماغ المتوسط. وينبغي الآن أن يتعرض الدماغ المؤخر (الشكل 2C).
- ندف بعناية بعيدا المتبقية اللحمة المتوسطة الرأس وأي السحايا التي تعلق على الجانب حنوني من الدماغ المؤخر (الشكل 2D).
- إزالة أنسجة الحبل الشوكي والدماغ المتوسط بحيث unfurls الدماغ المؤخر، ويمكن أن شقة تقع في إعداد كتاب مفتوح (الشكل 2E).
- باستخدام مجموعة واسعة الجوف باستور ماصة بلاستيكية، ونقل كل تشريح الدماغ المؤخر لوحة 12 جيدا تحتوي على الجليد الباردة L15 وتخزينها على الجليد حتى تم تشريح كل hindbrains.
- باستخدام مجموعة واسعة الجوف باستور ماصة بلاستيكية، ونقل خطيئةغلي الدماغ المؤخر إلى الطبق الفارغ، وابقائها مفتوحة لإعداد الكتاب، الجانب البطين تصل، في قطرات من تقريبي 100 ميكرولتر L15.
- نقل عدد قليل من ميكرولتر من الخرز هلام الهيبارين المحتضنة لنفس الحبرية. ملاحظة: نظرا لأن أحجام من الخرز هي المتغير، فإنه من المستحسن لنقل حوالي 10 حبات ومن ثم اختيار الحجم الأمثل لزرع في الدماغ المؤخر.
- جعل المسيل للدموع صغيرة في الأنسجة الدماغ المؤخر وإدراج بعناية 1-3 حبات هلام في الأنسجة الدماغ المؤخر على مستوى R5 / 6، حوالي نصف الطريق بين خط الوسط والحافة الجانبية من الدماغ المؤخر، وخفض لهم في الأنسجة بحيث يتم وضع حبة فقط تحت سطح الدماغ المؤخر.
ملاحظة: قد يستغرق الإجراء تشريح بين 5-20 دقيقة / الدماغ المؤخر، اعتمادا على الخبرة، ويمكن أن تمتد على مدى فترة ممتدة إذا الفضلات كبيرة، وفي أي حال، ينبغي أن يكون hindbrains في الثقافة لا تزيد عن 3 ساعة بعد الوفاة من أجل الخير النتائج.
4. الدماغ المؤخريزدرع الثقافة
- إزالة لوحة تحتوي على إدراج ثقافة من الحاضنة، نضح الحل laminin الطلاء.
- وضع إدراج ثقافة واحدة في طبق ثقافة منفصلة مليئة الجليد الباردة L15 و، وذلك باستخدام مجموعة واسعة الجوف باستور ماصة بلاستيكية، ونقل كل جانب بطني الدماغ المؤخر حتى على إدراج الثقافة (الشكل 2G). الدماغ المؤخر يجب الاستلقاء تماما على غشاء إدراج.
- رفع بعناية إدراج الثقافة من الطبق وربت عليه عدة مرات على المناديل الورقية النظيفة لإزالة السائل الزائد. هذه العملية يضمن أن الدماغ المؤخر تتمسك إدراج الثقافة في شقة، وإعداد كتاب مفتوح. إذا كان الدماغ المؤخر تجعيد الشعر حتى، نسيجه قد تنمو بشكل لا رجعة فيه معا.
- ملء الأصلي لوحة 12 جيدا مع 500 ميكرولتر سائل الإعلام والثقافة prewarmed ووضع إدراج مرة أخرى في هذه البئر. ضبط دقيق لحجم 400-600 ميكرولتر مع آخر من وسائل الإعلام لتغطية مجرد الدماغ المؤخر، وضمان أن الدماغ المؤخر لا تطفوقبالة الغشاء. إذا كان يطفو، والعودة إلى الخطوة 4.4 وكرر حتى يبقى الدماغ المؤخر تعلق على الغشاء.
- في هذه المرحلة، فمن الممكن إضافة مثبطات البيولوجية التي تهم وسائل الإعلام لدراسة تأثيرها على هجرة الخلايا العصبية FBM.
ملاحظة: إذا زرع الخرز أو إدارة العلاجات الأخرى، فمن المستحسن للحفاظ على الأقل 2 إإكسبلنتس السيطرة في ظل ظروف النمو الطبيعي في التجربة لضمان أنه قد تم تعيين ما يصل التجربة بنجاح. - احتضان إإكسبلنتس ل24-30 ساعة في حاضنة زراعة الأنسجة (37 درجة مئوية، 5٪ CO 2).
5. Wholemount مناعي تلطيخ من الدماغ المؤخر إإكسبلنتس
- نضح وسائل الإعلام من كل بئر، وشطف في برنامج تلفزيوني وإصلاح لمدة 2 ساعة في 4 درجات مئوية مع الإثارة لطيف في الجليد الباردة 4٪ الفورمالديهايد (طازجة أو إذابة حديثا بارافورمالدهيد 4٪ في برنامج تلفزيوني المنحل). ملاحظة: لا تحاول إزالة الدماغ المؤخر من إدراج الثقافة قبل التثبيتاكتمال.
- شطف 3X مع برنامج تلفزيوني. قشر بعناية hindbrains من إدراج الثقافة باستخدام ملقط دومون. بعض إإكسبلنتس يصعب تقشر، ولكن يمكن عادة رفع عن طريق تطبيق ضغط لطيف من خلال طرد بشكل متكرر في برنامج تلفزيوني من ماصة.
- نقل hindbrains إلى 2.0 مل أنابيب القاع مستديرة لوضع العلامات المناعي. Permeabilize hindbrains لمدة 30 دقيقة في درجة حرارة الغرفة (RT) في برنامج تلفزيوني يحتوي على 0.1٪ TritonX-100 (PBT) مع المتداول لطيف.
- احتضان لمدة 1 ساعة على RT في PBT تحتوي على 10٪ مصل الماعز العادية المعطل الحرارة مع المتداول لطيف.
- احتضان إإكسبلنتس مع المتداول لطيف في 4 درجات مئوية لمدة 5 أيام مع الأجسام المضادة الأولية محددة لISL1، المخفف 1:100 في PBT تحتوي على 1٪ الحرارة المعطل مصل الماعز العادية.
- غسل لل explants في RT 4X مع PBT لمدة 15 دقيقة لكل منهما.
- احتضان إإكسبلنتس مع المتداول لطيف على RT لمدة 3 ساعة مع fluorophore مترافق الماعز المضادة للماوس الأجسام المضادة (مثل اليكسا فلور 488 الماعز المضادةالماوس، المخفف 1:200) في PBT تحتوي على 1٪ الحرارة المعطل مصل الماعز العادية.
- غسل لل explants 4X على RT مع PBT لمدة 15 دقيقة لكل منهما مع المتداول لطيف.
- POSTFIX لل explants في 4٪ الفورمالديهايد لمدة 30 دقيقة في RT.
- تغطية شريحة زجاجية مع 3 طبقات من الشريط الكهربائي الأسود والمكوس مع مشرط مربع صغير من الشريط الطبقات لإنشاء جيب لللل explants، بدلا من ذلك، استخدم شريحة زجاجية الاكتئاب.
- كل جبل الدماغ المؤخر في SlowFade كاشف في جيب واحد، وتغطي مع ساترة الزجاج، وتجنب بعناية لفقاعات الهواء فخ والصورة باستخدام المجهر متحد البؤر المسح الضوئي ليزر.
ملاحظة: كبديل لالمناعية، الموقع التهجين مع riboprobes التي تعترف FBMs (أي Isl1 أو Phox2b) في يمكن استخدامها لتصور الخلايا العصبية FBM 16،21.
ملخص من الخطوات وتوقيت
توقيت التزاوج للحصول على الحمل E11.25: ~ 14 يوما
اختياري: حبة إعداد (Protocoل 1): ~ 2 ساعة، في اليوم قبل الجنين العزلة
إعداد إدراج الثقافة والإعلام (بروتوكول 2): ~ 30 دقيقة، قبل الجنين العزلة
عزل الجنين وتشريح الدماغ المؤخر (الخطوات 3،1-3،4): ~ 10 دقيقة / جنين
تشريح الدماغ المؤخر (الخطوات 3،5-3،7): ~ 5-10 دقيقة / الدماغ المؤخر
الإجراء يزدرع (الخطوات 3،8-3،9): ~ 5-10 دقيقة / الدماغ المؤخر
اختياري: زرع حبة (الخطوات 3،10-3،11): ~ 5-10 دقيقة / الدماغ المؤخر
الثقافة ازدراع (الخطوة 4.7): 24 ساعة
تثبيت لتلوين الأجسام المضادة (الخطوة 5.1): 2 ساعة
الإجراء تلطيخ والتصوير (بروتوكول 5): 5 أيام
النتائج
يوضح هذا القسم أمثلة من النتائج التي يمكن الحصول عليها من خلال دراسة الخلايا العصبية FBM الهجرة في الدماغ المؤخر الماوس من خلال فيفو السابقين الثقافة. وتبين لنا أن الخلايا العصبية في FBM hindbrains explanted من يوم 11 أجنة الفئران الخضوع أول هجرة عرضية (الشكل 3A) ومن ثم البدء في تجميع النوى الحركية الوجه (الشكل 3B)، على غرار سلوكهم في الرحم (انظر الشكل 1). علينا أن نبرهن أيضا أن زرع حبة غارقة VEGF165 تجذب الخلايا العصبية FBM (أرقام 3C و 3D)، كما هو موضح سابقا 16. الأهم من ذلك، يسمح هذا البروتوكول دراسة الهجرة FBM في غياب الأوعية الدموية أو عوامل الأوعية الدموية المستمدة التي قد تؤثر على الهجرة FBM في الرحم، وذلك لأن الأوعية الدموية nonperfused ينحط في الثقافة 16. وهكذا، لاحظ وضع العلامات خلايا الدم غير محددة عند استخدام الأجسام المضادة ISL1 الماوس على طازجةhindbrains الماوس معزولة (الشكل 1) لم يعد موجودا في أنسجة الدماغ المؤخر بعد 24 ساعة في الثقافة (أرقام 3A-F). أخيرا، وتبين لنا مثالين من hindbrains التي لم explanted بشكل صحيح، وبالتالي تحتوي على الخلايا العصبية FBM في التوزيع غير طبيعية، إما لأن الدماغ المؤخر لم explanted قريبا بما فيه الكفاية بعد العزلة الجنين (الشكل 3E) أو لأن الأنسجة الدماغ المؤخر مطوية في transwell ( الرقم 3F).

الشكل 1. FBM الخلايا العصبية الهجرة متحد البؤر Z-كومة من hindbrains wildtype الماوس بعد ISL1 immunolabeling wholemount وflatmounting؛. يشار خط الوسط الدماغ المؤخر مع نجمية في جميع لوحات (A) السطح البطيني من الدماغ المؤخر E11.5 في المنطقة التي تحتوي على الخلايا العصبية ISL1 إيجابية FBM (السهم)، مما يدل على هجرتهم عرضية من R4 لR6؛ يشار موقف R4، R5 R6 و(A ') حنوني سطح نصف من نفس الدماغ المؤخر في المنطقة التي تحتوي على بدأة . واحدة من نوى FBM تقرن (المشار إليها مع VIIn)، فضلا عن غيرهم من السكان الخلايا العصبية، ISL1 إيجابية (B) السطح البطيني من الدماغ المؤخر E12.5 تحتوي على الخلايا العصبية FBM التي تهاجر بشكل طفيف (السهم)، ورأس السهم يشير إلى المثال في أحد الاوعية الدموية التي تحتوي على تعميم الخلايا التي وصفت unspecifically عن طريق تفاعل المتبادل من الأجسام المضادة الثانوية المضادة للماوس المستخدمة للكشف عن الأجسام المضادة ISL1 الماوس مفتش (B '). سطح حنوني من نصف واحد من نفس الدماغ المؤخر E12.5، والذي يحتوي على واحدة من نوى FBM المقترنة. يشار إلى خط الوسط مع النجمة في كل لوحة. شريط النطاق (كل اللوحات): 200 ميكرون. V، بطني، P، حنوني./ 51397fig1highres.jpg "الهدف =" _blank "> اضغط هنا لمشاهدة صورة أكبر.

الشكل 2. E11.5 الماوس الدماغ المؤخر تشريح الجسم الحي وخارج الثقافة. (AE) الخطوات الرئيسية في البروتوكول تشريح E11.5 الدماغ المؤخر؛ شريط النطاق: 1 مم (A) رئيس الجنين بعد أن تم قطع عليه بعيدا عن ما تبقى من الجنين في مستوى forelimb (B) الجزء منقاري من. تمت إزالة الرأس وبقية الأنسجة رئيس ضعه بحيث تم الموجهة البطين 4 ال (السهم) صعودا. (C) ومقشر سقف البطين 4 ال بعيدا، وتعرض الدماغ المؤخر بواسطة تقشير الأنسجة تحت الدماغ المؤخر بعيدا rostrally ونحو caudally. (D) تمت إزالة غشاء حنوني (لاحظ أن في هذا السابقينظلت وافرة، وبعض النخاع الشوكي العنقي (SC) الأنسجة التي تعلق على الدماغ المؤخر). (E) الدماغ المتوسط الزائدة (MB) والحبل الشوكي (SC) تمت إزالة الأنسجة للاحتفاظ فقط الدماغ المؤخر. (كانت مغلفة إدراج F) مع الثقافة laminin وضعها في لوحة الثقافة 12 الأنسجة أيضا. (G) وضعت كل الدماغ المؤخر على إدراج واحد وغطت مع وسائل الاعلام. (H) تمثيل تخطيطي لمسار هجرة الخلايا العصبية التي اتخذتها FBM (الأزرق) خلال 24 ساعة من الثقافة. اضغط هنا لمشاهدة صورة أكبر.
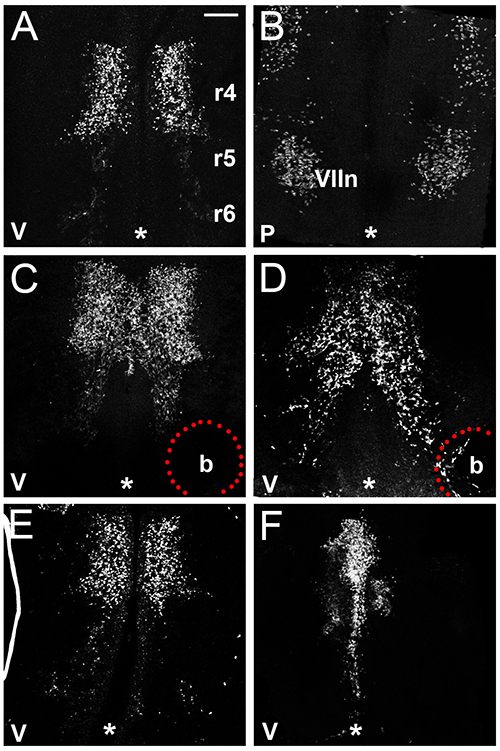
الرقم 3. الماوس الدماغ المؤخر فيفو السابقين الثقافة. (A، B) وكان من الدماغ المؤخر E11.5 مثقف لمدة 24 ساعة وimmunofluoresc وصفت مستديم لISL1 لتوضيح FBM الخلايا العصبية الهجرة في ازدراع، وتظهر كل من البطين (A) وحنوني (B) من جانبي الدماغ المؤخر (C، D) كانت hindbrains E11.5 littermate مثقف في وجود مزروع الهيبارين حبة غارقة. في برنامج تلفزيوني (C) أو VEGF165 (D)، علما أن الخلايا العصبية FBM هاجر نحو وعلى حبة VEGF165، وبالتالي فإن تيار المهاجرة تمديدها نحو caudally مقارنة إلى الجانب غير المعالجة من نفس الدماغ المؤخر أو الدماغ المؤخر تحتوي حبة التحكم (E. ، F) أمثلة على غير مرضية إإكسبلنتس E11.5 الدماغ المؤخر، الذي FBMs لم هاجروا من R4 (E)، أو في أنسجة الدماغ المؤخر الذي مطوية خلال ثقافة (F). يشار إلى خط الوسط مع النجمة في كل لوحة. شريط النطاق (لجميع لوحات): 200 ميكرون. V، بطني، P، حنوني."> اضغط هنا لمشاهدة صورة أكبر.
Discussion
يصف هذا البروتوكول ثقافة wholemount من hindbrains E11.5 الماوس في نظام transwell لدراسة هجرة الخلايا العصبية FBM. هذا البروتوكول يسمح motorneurons الماوس الدماغ المؤخر إلى أن تبقى على قيد الحياة والهجرة لمدة 24 ساعة، مما يتيح التلاعب فيفو السابقين. هذه الطريقة لها العديد من المزايا التجريبية للمحققين الذين يسعون إلى تحديد الآليات الجزيئية والخلوية للهجرة الخلايا العصبية. في حين المقايسات الهجرة التقليدية ازدراع قطع صغيرة الأنسجة العصبية في مصفوفة على أطباق الثقافة وتمكين المراقبة من الخلايا العصبية الفردية كما أنها تستجيب للمؤثرات الخارجية، وميزة كبيرة للمقايسة transwell هو مدى ملاءمتها لمعالجة الخلايا العصبية المهاجرة ضمن بيئة الجهاز المضيف، وبالتالي أكثر سياق الفسيولوجية. الأهم من ذلك، مواد يمكن تطبيقها بسهولة إلى الدماغ المؤخر إإكسبلنتس فيفو السابقين لاختبار تأثيرها على هجرة الخلايا العصبية، التحايل على الآثار الجانبية المحتملة المرتبطة administeترن هذه المواد إلى ماوس الحوامل. أخيرا، يسمح للنموذج الجسم الحي السابقين أيضا اختبار المواد التي لا عبور حاجز المشيمة، مثل الأجسام المضادة حجب وظيفة. نظرا لهذه المزايا، يقدم فيفو السابقين الدماغ المؤخر الثقافة بديل وطريقة مكملة لاستخدام الأجنة الزرد، والتي يمكن علاجها مع الماء جزيئات صغيرة قابلة للذوبان في الماء الحوض، أو في الرحم التثقيب الكهربائي من العقول الجنينية، الأمر الذي يتطلب استخدام المتخصصة معدات وأكثر صعوبة لإتقان هذه التقنية من الثقافة الموصوفة هنا. ميزة أخرى لبروتوكول الموصوفة هنا هو قابليته لزرع حبات غارقة في المؤتلف البروتين أو الكواشف الأخرى، وبالتالي السماح للتطبيق طريقة الجنينية القياسية وضعت لمعالجة الأجنة فرخ لنموذج الفأر من هجرة الخلايا العصبية. على وجه الخصوص، فيفو السابقين نموذج الثقافة يمكن تطبيقها على hindbrains من الفئران المعدلة وراثيا defecTIVE في جزيئات محددة متورطة في هجرة الخلايا العصبية، مثل النمو أو عامل التوجيه المستقبلات، وجنبا إلى جنب مع يزرع حبة لاختبار إذا فقدت القدرة على الاستجابة للبروابط. بالإضافة إلى التلاعب الدوائية، ويمكن أيضا أن تتكيف على فيفو السابقين الثقافة بروتوكول ل electroporate ناقلات التعبير التي يمكن التلاعب التعبير عن الجينات في المصالح؛ الأساليب المناسبة ل electroporation سبق وصفها 22،23. ويمكن أيضا أن تتكيف هذا البروتوكول لتصور هجرة الخلايا العصبية بواسطة الوقت الفاصل بين المجهري في إإكسبلنتس الدماغ المؤخر من الفئران المعدلة وراثيا تحتوي على الخلايا العصبية FBM fluorescently المسمى، على سبيل المثال، لجنة المساواة العرقية Isl1؛ Rosa26Yfp 21. أخيرا، هذا البروتوكول يمكن أن تستخدم أيضا لدراسة أنواع أخرى من الخلايا العصبية المهاجرة في الدماغ المؤخر، مثل تلك التي تشكل الزيتون السفلي، على الرغم من أن هذا من شأنه أن يتطلب استخدام hindbrains في المراحل الجنينية وكبار السن قد تتطلب الثقافة لمدة تصل إلى 48 ساعة، اعتمادا على الجدوى العصبية فيفو السابقين.
الخطوات الحاسمة واستكشاف الأخطاء وإصلاحها
لنجاح هذا البروتوكول، فمن الأهمية بمكان أن يتم جمع الأجنة في وقت مبكر يوم E11.5 اليوم، أقرب إلى E11.25، عندما FBM الخلايا العصبية الهجرة قد بدأت للتو. ومع ذلك، فإنه ليس من الممكن دائما للقبض على الأجنة في هذه المرحلة التنموية بسبب تقلب التزاوج الطبيعي من الفئران، وفقا لذلك، قد يكون هناك بعض التباين في توسيع نطاق الهجرة FBM بين تجارب مختلفة. ويمكن أيضا أن يلاحظ التباين في الهجرة FBM إذا لم يتم الانتهاء من التجربة ضمن الإطار الزمني المعين، حوالي 3 ساعة، كما يمكن أن يرى في الشكل 3E. نسيج الدماغ المؤخر من E11.25 أجنة الفئران حساسة. عند تشريح وطوال الإجراء يزدرع، فمن المهم أن لا تمزق الأنسجة الدماغ المؤخر في مجالات من R4-R6 حيث توجد الخلايا العصبية FBM. نظرا لطبيعة حساسة من ديسعملية ection، ولأن السرعة التي يتم وضعها hindbrains في الثقافة تؤثر النتيجة، قد يستغرق هذا الإجراء بضع الممارسة يعمل لسيده، ولا سيما قبل أن يتم استخدام العينات الثمينة أو الكواشف. أخيرا، من المهم أن يتم وضع الأنسجة في الدماغ المؤخر تكوين كتاب مفتوح على إدراج الثقافة، للطي من الأنسجة الدماغ المؤخر خلال الثقافة ومنع الهجرة FBM العادي (انظر الشكل 3F).
Disclosures
أيا من الكتاب والمصالح أو المصالح المتضاربة المتنافسة.
Acknowledgements
معتمد من قبل MT دكتوراه studentship [المرجع. 092839/Z/10/Z] وCR من قبل جائزة الباحث جديد [المرجع. 095623/Z/11/Z] من ويلكوم ترست.
Materials
| Name | Company | Catalog Number | Comments |
| Eppendorf round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | |
| Cell culture plates, 12-well | Thermo Scientific | 150628 | |
| Plastic cell culture dish, 100 mm | Thermo Scientific | 150288 | |
| 15 mm Netwell insert with Mesh Polyester Membrane | Corning | 3477 | |
| Watchmaker forceps, no. 5 | Dumont | 91150-20 | |
| Phosphate buffered saline | Sigma | P4417 | |
| Laminin mouse protein | Life Technologies | 23017-015 | |
| Primary antibody, Isl1 | Developmental Hybridoma Bank | 39.4D5 | Dilution 1/100 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Life Technologies | A11029 | Dilution 1/200 |
| Neurobasal medium | Life Technologies | 21103 | |
| B27 supplement (50x) | Life Technologies | 17504-044 | |
| Leibovitz’s L-15 | Life Technologies | 21083-027 | |
| Penicillin/ streptomycin | Life Technologies | 15070 | |
| Glucose | VWR | 101174Y | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Triton X-100 | Sigma | T8787 | |
| Paraformaldehyde | Sigma | P6148 | |
| Slowfade Antifade Kit | Life Technologies | S-2828 | Alternative mounting solutions may be used |
| Microscope slides | VWR | 631-0912 | |
| Cover glass | VWR | 631-0137 | |
| Affi-Gel Heparin Beads | Biorad | 153-6173 | Glass, latex, or coloured beads may be used alternatively |
| Recombinant human VEGF165 | R&D Systems | 293-VE | Resuspend in PBS, store aliquots at -80 °C |
| Stereo Microscope, Leica MZ16 | Leica | ||
| Confocal laser scanning microscope LSM710 | Zeiss |
References
- Lumsden, A., Keynes, R. Segmental patterns of neuronal development in the chick hindbrain. Nature. 337 (6206), 424-428 (1989).
- Chandrasekhar, A. Turning heads: development of vertebrate branchiomotor neurons. Dev. Dyn. 229 (1), 143-161 (2004).
- Mapp, O. M., Wanner, S. J., Rohrschneider, M. R., Prince, V. E. Prickle1b mediates interpretation of migratory cues during zebrafish facial branchiomotor neuron migration. Dev. Dyn. 239 (6), 1596-1608 (2010).
- Glasco, D. M., Sittaramane, V., Biol, D. e. v. .., et al. . The mouse Wnt/PCP protein Vangl2 is necessary for migration of facial branchiomotor neurons, and functions independently of Dishevelled. 369 (2), 211-222 (2012).
- Marillat, V., Sabatier, C., et al. The Slit Receptor Rig-1/Robo3 Controls Midline Crossing by Hindbrain Precerebellar Neurons and Axons. Neuron. 43 (1), 69-79 (2004).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298 (5600), 1959-1964 (2002).
- Vivancos, V., Chen, P., et al. Wnt activity guides facial branchiomotor neuron migration and involves the PCP pathway and JNK and ROCK kinases. Neural Dev. 4, 7 (2009).
- Guan, K. -. L., Rao, Y. Signalling mechanisms mediating neuronal responses to guidance cues. Nat. Rev. Neurosci. 4 (12), 941-956 (2003).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat. Rev. 8 (11), 859-871 (2007).
- Garel, S., Garcia-Dominguez, M., Charnay, P. Control of the migratory pathway of facial branchiomotor neurones. Development. 127 (24), 5297-5307 (2000).
- Gavalas, A., Ruhrberg, C., Livet, J., Henderson, C. E., Krumlauf, R. Neuronal defects in the hindbrain of Hoxa1, Hoxb1 and Hoxb2 mutants reflect regulatory interactions among these Hox genes. Development. 130 (23), 5663-5679 (2003).
- Grant, P. K., Moens, C. B. The neuroepithelial basement membrane serves as a boundary and a substrate for neuron migration in the zebrafish hindbrain. Neural Dev. 5, 9 (2010).
- Lumsden, A. Segmentation and compartition in the early avian hindbrain. Mech. Dev. 121 (9), 1081-1088 (2004).
- Tsuchida, T., Ensini, M., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Qu, Y., Glasco, D. M., et al. Atypical cadherins Celsr1-3 differentially regulate migration of facial branchiomotor neurons in mice. J. Neurosci. 30 (28), 9392-9401 (2010).
- Schwarz, Q., Gu, C., et al. Vascular endothelial growth factor controls neuronal migration and cooperates with Sema3A to pattern distinct compartments of the facial nerve. Genes Dev. 18 (22), 2822-2834 (2004).
- Stockinger, P., Maître, J. -. L., Heisenberg, C. -. P. Defective neuroepithelial cell cohesion affects tangential branchiomotor neuron migration in the zebrafish neural tube. Development. 138 (21), 4673-4683 (2011).
- Wanner, S. J., Prince, V. E. Axon tracts guide zebrafish facial branchiomotor neuron migration through the hindbrain. Development. , (2013).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. Neurosci. 20 (1), 206-218 (2000).
- Laird, P. W., Zijderveld, A., Linders, K., Rudnicki, M. A., Jaenisch, R., Berns, A. Simplified mammalian DNA isolation procedure. Nucleic Acids Res. 19 (15), 4293 (1991).
- Srinivas, S., Watanabe, T., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1 (1), 4 (2001).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J. Vis. Exp. (74), (2013).
- Holland, P. J., George, A. M., Worrell, L. T. C., Landsberg, R. L. In vitro electroporation of the lower rhombic lip of midgestation mouse embryos. J. Vis. Exp. (66), (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved