Method Article
ホールマウントラット網膜における免疫組織化学的およびカルシウムイメージング法
要約
免疫組織化学プロトコルは、網膜中の特定のタンパク質の局在化を研究するために使用される。カルシウムイメージング技術は、網膜神経節細胞および軸索のカルシウム動態を研究するために使用される。
要約
本論文では、ツール、試薬、およびのために必要とされる実践的な手順を説明します。免疫組織化学のためのホールマウント網膜の1)成功した準備をして、網膜内カルシウムシグナル伝達を媒介する電位依存性カルシウムチャネル(VGCC)の研究のための2)カルシウムイメージング神経節細胞。われわれが記述するカルシウムイメージング法は、神経節細胞層内に変位アマクリン細胞の非特異的荷重に関する問題を回避する。
概要
現在の1,2チャネルCaは全細胞のこれらの成分の薬理学的遮断を介して決定される網膜神経節細胞(RGC)は、L、N - 、P / Q-およびT-型VGCCを発現する。 VGCCは伝達物質放出、遺伝子転写、細胞調節とシナプス可塑性の3,4,5に関与している膜貫通多量体タンパク質である。チャネルの生物物理学的および薬理学的特性を確立するサブユニットを形成する大規模な、膜貫通α1細孔、2δサブユニットと細胞内のβサブユニットα、主に細胞外の補助:機能VGCCsはサブユニットの少なくとも3つの別個のクラスで構成されています。異なるα1サブユニットと、後者の2つのフォームヘテロメリック複合体および原形質膜6へのチャネルのゲーティング動態および人身売買を変える。
ここ数十年にわたり、多くの技術は、タンパク質expreを研究するために使用されてきたそのような免疫組織化学、酵素免疫測定法、ウエスタン分析およびフローサイトメトリーなどのssion、。これらの技術は、関心対象の所与のタンパク質の検出のための特異的抗体の使用を必要とし、異なる組織における特定のタンパク質の局在化および分布のための強力なツールを提供する。抗体が容易でない場合に、in situハイブリダイゼーション 、cDNAマイクロアレイおよびリボヌクレアーゼ保護アッセイにおいて 、ノーザンブロット分析、RT-PCRなどの特定のタンパク質のmRNA発現レベルを検出および定量するために使用される技法は、リアルタイム定量的RT-PCRは、別のアプローチを提供する入手可能であるか、または特定のタンパク質の発現レベルが7低い場合。しかし、このような分子技術の使用への1つの制限は、遺伝子配列の同定が必要である。
網膜中のタンパク質を局在化するために、免疫組織化学は、ホールマウント網膜上で実行することができる。 RGCのアクセシビリティ、ホールマウントにより準備はRGC細胞体とその軸索に特定のタンパク質の局在を研究するための優れたプラットフォームを提供します。
それらの局在に加えて、RGCの中VGCCsのいくつかの機能的特性は、カルシウムイメージング技術の使用によって実証することができる。私たちは、選択的に細胞内カルシウム動態を測定するためにカルシウム指示薬色素でのRGCを標識するカルシウムイメージングプロトコルを記述する。異なる細胞区画内カルシウムシグナルの異なるVGCCsの寄与は、サブタイプ特異的カルシウムチャネル遮断薬を用いて単離することができる。
おそらく、ここで説明するカルシウムイメージング法の最も有益な側面の一つは、同時に独立複数のRGCおよびその軸索を記録する機能である。例えば、全細胞パッチクランプ記録のような多くの生理学的技術は、高時間分解能の膜電流の記録を、体細胞またはthesというの軸索源を提供するが記録された電子電流が判別できず、記録は、一度に1つのニューロンから作ることができる。多重電極アレイ(MEAは)同時に多数のセルからのスパイクを記録することが可能であるが、カルシウムチャネルの、例えば、異なるサブタイプの活性化を検出することも、区別することもできない。 MEAは、優先的に大きなスパイク9を生成する細胞から、指定された電極8とレコードの近くに位置している細胞から記録します。光学イメージング方法は、単一細胞の微小電極およびパッチクランプ記録とMEAの記録から得られた情報と統合することができる細胞の全集団の同時かつ独立の録音を可能にするための代替戦略を提供する。ここで説明するカルシウムイメージング技術は、RGCのカルシウム動態を研究するために使用されたが、パッチクランプおよびMEAはまた、イオン電流およびRGCのスパイク特性を解明するために並列で使用することができる。
避難アマクリン細胞は10網膜マウスにおける神経節細胞層におけるニューロンの人口の約60%を占めているので、私たちの目標は、選択的に、合成カルシウム指示染料でのRGCを標識するローディング技術を使用していたホールマウントの準備。合成カルシウム指示薬色素が細胞内カルシウム動態の研究のための優れたプラットフォームを提供するが、その広範な使用が効果的に与えられたネットワーク内のニューロンの特定の集団をロードすることができないことによって妨げられてきた。そのようなバルク·ロード11及びエレクトロポレーション8,12などの多くの技術が、細胞の全体の集団が、しかしながら、このような技術は、特定の細胞型を区別しないロードするために行われている。遺伝的にコードされたカルシウム指示薬しかしながら、このような方法は、トランスジェニック動物13の生成を必要とする、選択的に細胞の特定の集団を標識する能力を提供する。私たちの技術は、メトを記述dは選択的にカルシウム指示薬色素の視神経の切り株の注射を介してホールマウント準備でのRGCを標識する。総合すると、この資料に記載されている構造的および生理学的な技法は、RGCを、それらの軸索内局在およびカルシウムシグナルにVGCCsの寄与を研究するためのプラットフォームを提供します。
プロトコル
全ての実験は、実験動物のヒューマンケアと使用に関する米国公衆衛生サービス規定とカリフォルニア大学ロサンゼルス校(UCLA)の動物研究委員会によって発行された実験動物の福祉のためのガイドラインに従って実施した。 3-5週齢の間にオスとメスの成体Sprague-Dawleyラット(チャールズリバー研究所、マサチューセッツ州ウィルミントン)を使用した。
ホールマウント網膜および免疫組織化学プロトコルのための1。動物および組織の準備
- 解剖顕微鏡、非常に微細な先端、はさみ、セルロース濾紙、プラスチックピペット顕微鏡スライド2鉗子:以下の材料やツールを準備します。
- 深くギロチンで断頭続い1〜3%イソフルランで動物を麻酔によって、閉じたチャンバー内にラットを安楽死させる。細胞外溶液を含むペトリ皿にアイリスハサミと場所一対の目を削除します。 A、エイムズ·ミー休止diumまたは生理的溶液を推奨します。
- [フルオ-4でRGCの埋め戻しが必要な場合は、オプションのステップ]。ステップ2.3から2.4に記載されているようにフルオ-4ラベリングを実行します。
- 解剖顕微鏡(光強度:1.6×10 8の光子/ mm 2の⋅sec)を使用して、眼球の前部を切断することによって角膜を除去します。ピンセットで内側の網膜表面からレンズおよび硝子を外します。硝子体を除去するには、1の鉗子でしっかりと強膜を保持することによって眼球を安定させる。静かに他の鉗子と網膜の中心に向かって硝子体ベースをはがします。この段階での製造は、凍結切片のために使用されているアイカップ、呼ばれています。凍結切片についての詳細は参考文献14,15に記載されています。
- アイカップから網膜を削除します。その後、網膜が平らすることを可能にするために4つのカットを行う。静かに光受容体層を上にして顕微鏡スライド上に網膜をマウントします。網膜に、溶液の一滴を追加し、CEを入れる網膜上lluloseろ紙。網膜は、ろ紙に付着すると、溶液中に戻って網膜を配置します。必要に応じて、ブラシや鉗子で網膜を平らに。
- 固定のために10〜15分間、4%PFAにwholemounted網膜を置きます。
- 0.1 Mリン酸緩衝液(PB)(pH7.4)中で30分間wholemounted網膜を3回洗浄する。 4°Cで一晩、0.3%のTriton-X 100および0.1%のNaN 3を含む0.1M PB中の5%正常ヤギ血清またはロバ血清で網膜をブロックする。私たちは、ブロッキングのソリューションおよび抗体を保存するためのすべてのステップを500μlの最終容量を推奨。
- 翌日、4℃で一次抗体5-7日で網膜のwholemountsインキュベートする。最適な希釈は、ユーザによって決定されなければならない。
- PB、0.1Mで網膜3×30分を洗浄し、一次抗体(濃度1:1,000)の種に対して向けられる、対応するフルオロフォア結合二次抗体で4℃で一晩インキュベートする。
- PBで30分間ずつ3回の最終洗浄後、培地を実装する際の網膜をマウントします。長期保管のためのマニキュアでカバーガラスを密封。店舗のサンプルを4℃で、光から保護します。
カルシウムインジケーター色素でラットホールマウント網膜における神経節細胞および軸索の2ラベリング
- 哺乳類リンゲル含む(mM単位)125のNaCl、3のKCl、2 CaCl 2を千ミリリットル、1.25のNaH 2 PO 4、1のMgCl 2、25 NaHCO 3、および95%O 2/5%COで泡立て10グルコースを準備 2。
- ステップ1.2〜1.4で説明したように解剖を行います。
- カルシウム指示薬色素で網膜神経節細胞(RGC)およびその軸索をロードするには、注射器を用いて眼球に視神経の切り株約1mm後方へのFluo-4 pentapotassium塩(H 2 O中の40mMストック)0.5μlのを注入。の[Caの神経節細胞の動的増加を測定する2+ ] iのようなのFluo-4 345 nMで、そのK dでの高い親和性を持つ指標は、最適である。フルオ-4カルシウムと結合すると> 100倍の発光増大をもたらす非常に高い量子効率を有するという付加的な利点を提供しています。
- 哺乳類リンゲル、95%O 2/5%COで泡立てにアイカップを置きます暗所で室温で1時間2。
網膜神経節細胞および軸索のための3カルシウムイメージングプロトコル。
- ステップ1.1から1.4で説明したように、目、レンズと硝子体を除去します。アイカップから網膜を分離し、象限に分ける。マウント1象限神経節細胞をスライドガラス上の面を上にし、それを安定させるためにハープスライスグリッドを使用しています。哺乳類リンゲルで暗順応他の作品は、95%O 2/5%COで泡立ててください後で使用するために氷上で2。
- 哺乳類のリンゲル液で記録チャンバーを表面かん流すると95%O 2/5%CO 2で連続的にバブリングし、溶液を維持する。
- イメージ顕微鏡下で組織。室温(〜23℃)または行動実験は、ステージを温める試料の下に水浴を加熱又は試料の表面に温風を適用することによって、生理的温度を達成する。
注:これは、多くの細胞機能は、細胞内ホメオスタシス16を維持するのに重要な役割を果たして温度によって調節されることに留意することが重要である。しかしながら、温暖化対策の導入は、光退色の速度を増大させる媒体の蒸発と熱膨張17によるドリフトの焦点を合わせることができる。室温の使用は、フルオ-4 18の細胞内区画化を減少させます。 - 薬が存在しない場合に2対に高K +パルスの制御を行います。アクティブにするために、各パルスの間に33秒のために60 mMまでの3mMからO [K +]を上昇させることによりRGCをし、RGC軸索を脱分極8チャンネル重力駆動型灌流システムとVGCCs。上昇したK +溶液中のisosmolarityを維持するために、57 mMのことではNa +を減らします。
- 一般的または特定のカルシウムチャネル遮断薬を用いて、カルシウムシグナルに異なるVGCCsの寄与を評価する。例えば、非特異的なカルシウムチャネル遮断薬の投与後のカルシウムシグナルの減少、コバルトは、高K + -evokedカルシウムシグナルにVGCCsの寄与の半定量的尺度を提供した。
- ( 図2)関心のRGCの周囲の関心領域(ROI)を配置することによって蛍光強度値を取得する。
- 最初の高K +ピークによって生成変化に対して第二の高K +ピークにより生じる蛍光強度の変化を正規化します。その後、特定のカルシウムチャネル遮断薬の試験のために、唯一の対の第二の高K +パルス中に薬物を適用し、これに対してピークを正規化最初のピーク値。高K +ピークに対する薬物の影響を測定するためには、最初のそれによって、第2のK +のピークの振幅を分割します。分析は、薬物の非存在下で測定対に高K +のピークに由来し、その一致したコントロールに対し、これらの値で実行する必要があります。
- 5秒間隔で画像を取得します。光退色を避けるために、できるだけ低いレーザー励起を維持する。光電子増倍管は、505 nmのLPフィルタを通して蛍光発光を収集しながら、アルゴンレーザーの488nmのラインによる励起を提供します。
結果
特異的抗体を用いて免疫標識は、網膜内の関心のある特定のタンパク質の局在を研究するためのプラットフォームを提供し、カルシウムイメージング技術は、網膜神経節細胞とその軸索のカルシウム動態にVGCCsの寄与の研究を可能にする。
選択したRGC 19を標識する神経節細胞タンパク質RBPMS(複数のスプライシングとRNA結合タンパク質)に対する抗体を使用することによって、私たちのFluo-4標識は神経節細胞( 図1)に制限されていることを示すことができた。この技術から予想され得るような切り株注入は、全ての神経節細胞の標識化にはつながらない。
ウサギポリクローナル抗体は、商業ベンダー( 表1)により、RBPMSポリペプチド(RBPMS 4-24)、GGKAEKENTPSEANLQEEEVRのN末端 に対して作製された。 RBPMSは、哺乳動物の間で高度に保存され、ポリペプチド配列を使用免疫化のために(NCBIタンパク質銀行、マウス、ラット、サルおよびヒトにおいて同一であるhttp://www.ncbi.nlm.nih.gov/protein )。ウサギ血清をRBPMSポリペプチド親和性カラムを用いて精製免疫化および親和以下収集した。アフィニティー精製された抗体は、マウスおよびラット網膜における神経節細胞を免疫染色することが示された。 RBPMS免疫染色の特異性を評価するために、前吸収制御がウサギ抗体を用いて行った。簡単に述べると、RBPMS抗体を室温で2時間の1μg/ mlの最終濃度でRBPMSポリペプチドと0.5%トリトンX-100および混合を含む0.1M PB中に希釈した。いいえRBPMS免疫染色は、組織切片RBPMSに前吸収ウサギ抗体と共にインキュベートし、標準的な免疫組織化学法によって処理において存在しなかった。
s.jpg "幅=" 600 "/>
図1:事後神経節細胞へのFluo-4(緑色)の局在を示すためにRGCタンパク質RBPMS(赤)に対する抗体で免疫染色項のAlexa 568ヤギ抗ウサギ二次抗体を使用した。スケールバー:20ミリメートル。
カルシウムイメージング技術は、RGCを、それらの軸索内カルシウムシグナルのVGCCsの寄与を研究するために使用される。蛍光強度値は、関心のRGCを( 図2)上のROIを配置することにより取得した。
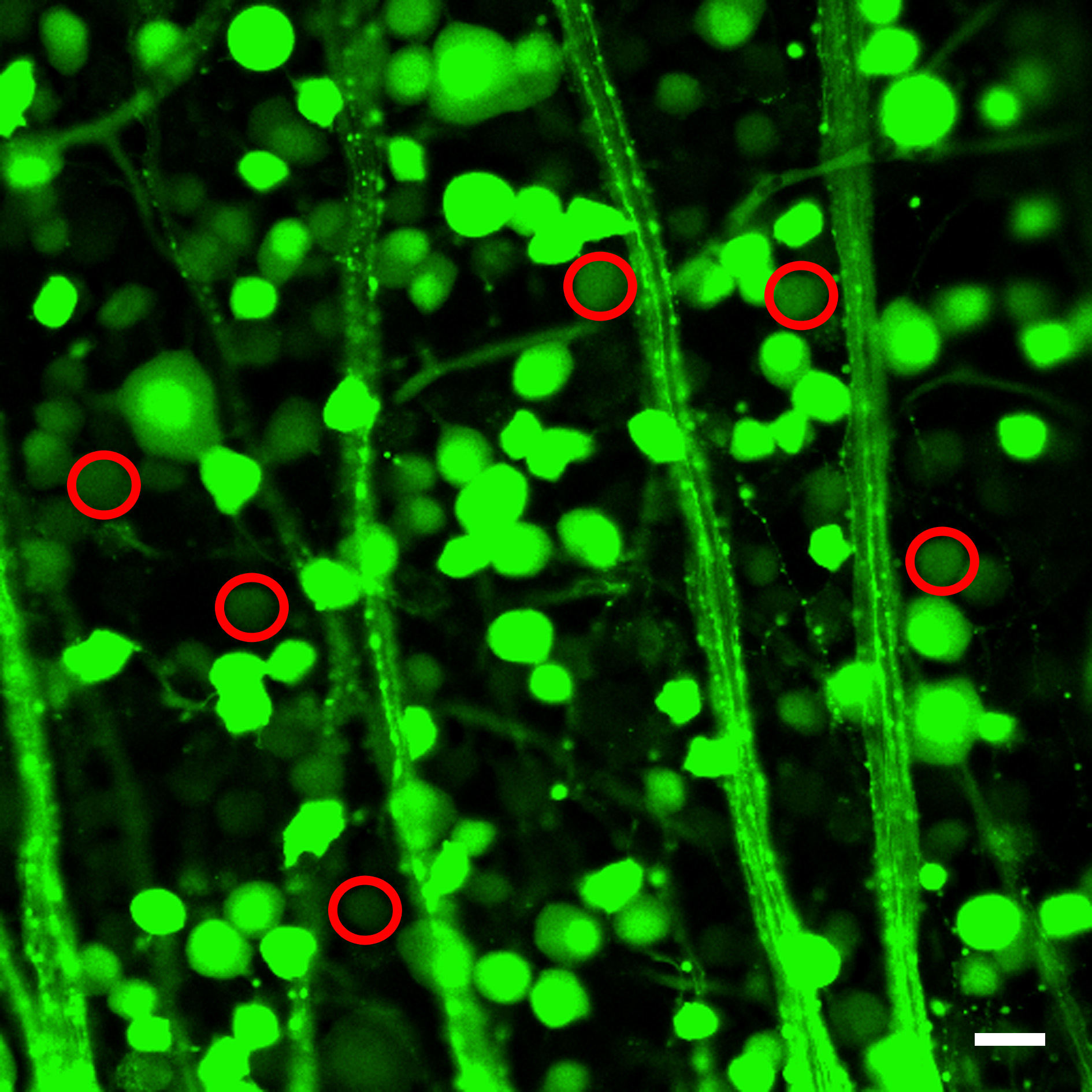
図2:蛍光強度値を取得するために、ROIが神経節細胞の細胞体および/ または軸索上に配置されたスケールバー:50 mmである。
フルオ-4 pentapotassium塩のRGCとその軸索( 図3)標識するために使用した。
:FO "jove_content」 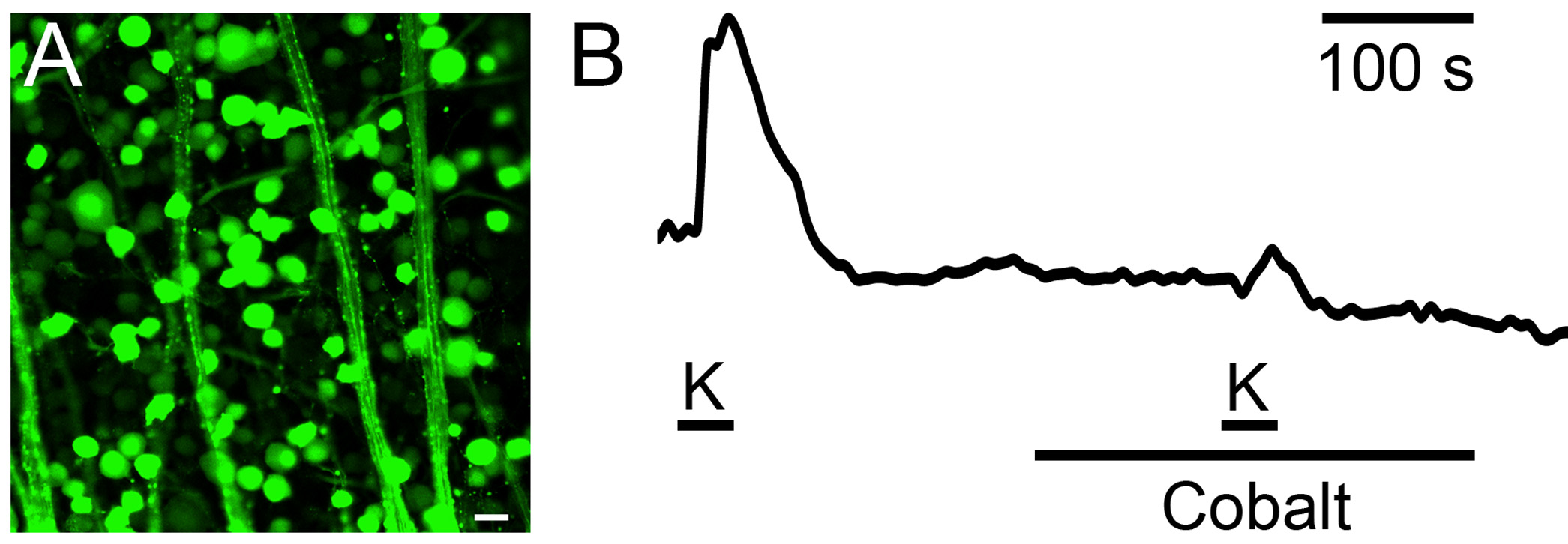
図3:神経節細胞の細胞体とその軸索にカルシウムシグナル伝達に寄与するVGCCサブタイプ。 (A)は 、ベースラインレベルでのホールマウント網膜の共焦点画像。のRGCとのRGC軸索はフルオ4で標識を見ることができる。単一のRGC細胞体から(B)の蛍光シグナルは、高K +(60 mM)を浴溶液とのその後の減少のパルス対によって誘発される平均蛍光強度の増加を示した第二パルス中のコバルトの存在下での蛍光。 Aのスケールバー:20ミリメートル。
ツァイスLM5パスカルシステムは、5秒のフレームレートで画像を取り込むように設定し、各フルフレームスキャンが使用される設定で1.57秒を要した。 318ミクロンのx 318程度の収集領域は512×512円周率の走査領域に含まれていたピクセルあたり0.385平方μm の面積を与えるxels。これらの設定は、所望の解像度に応じて変更することができる。システムは、488nmの励起用の25 mWのアルゴンレーザーを使用しています。私たちは、3%のパワーでこのラインを使用していました。飽和が最初に脱分極刺激に対する強固な応答が得られた後、出力ゲインを減少させることによってカルシウム指示薬色素の最低濃度を選択することによって最小化された。レーザパワーの減少は、ブリーチングを回避するために役立った。インジケーター濃度を測定しなかった。非レシオメトリックイメージングの較正は、カルシウムイオノフォアの使用が可能であるが、埋め戻し技術は同様にレシオメトリック色素を用いて動作する可能性があります。最適な指標濃度を決定するために、1〜40 mMの範囲のFluo-4の切り株を注射した濃度の蛍光の脱分極誘発変化を比較した。円形及び楕円形のROIが安定した蛍光強度を示し、それぞれのRGC及びそれらの軸索の周りに描かれた。外に漂流したRGC軸索による灌流によって引き起こされる動きにフォーカスが選択されていませんでした。
ディスカッション
網膜神経節細胞とその軸索のカルシウム動態を解析するために、網膜wholemountsにおける神経節細胞へのFluo-4の局在化、2)カルシウムイメージングを示すために1)免疫組織化学:この記事では、2つの異なる技術を記載している。
wholemountsを用いた免疫組織化学は、げっ歯類網膜20-23におけるタンパク質の局在を明らかにするために使用されてきた。ただし、いくつかの制限があります。染色の質は、そのそれぞれの抗原および関心のある特定の層に網膜組織に浸透する能力を認識する抗体の能力に大きく依存する。これらの問題は、最大7日間、一次抗体でのインキュベーション時間を増大させるのTriton-Xの濃度を増加させ、および/または神経節細胞層を介して抗体の拡散を可能にするためにろ紙ことなく網膜をインキュベートすることによって向上させることができ、光受容体。他の制限はduratiです上および固定の濃度。他の抗体は、短い固定期間を必要としながら、いくつかの抗体は、組織は1時間固定した場合より良い仕事。特定の抗体は、4%PFA固定で最適に動作しながら、同様に、他の人が減少した濃度で、より良い仕事。私たちは、ユーザーが最適な期間と固定の濃度、インキュベーションの期間、トリトン-Xの濃度と同様に、最適な結果を得るための一次抗体の濃度を決定することをお勧めします。
カルシウムイメージングは、網膜神経節細胞および軸索のカルシウム動態を研究するために使用した。 VGCCブロッキング剤の灌流は、薬物の相対的なブロッキングの有効性と異なるCaチャネルサブタイプの存在の評価を可能にした。のRGC軸索は、高K +に応答しない場合には、高い濃度が飽和につながることができ、カルシウム指示薬色素の濃度を下げてみてください。硝子体の除去が不完全また、RGCを、それらの軸索に到達する高K +を防ぐバリアとして作用することができる。また、適切に網膜の上にハープをマウントする障害は、蛍光強度値を取得することができない、その結果、運動を引き起こすことがある。網膜が移動し続ける場合は、慎重に網膜を囲む領域を乾燥、ハープを削除し、その周囲に多くのグリースを追加することでハープを再マウントします。網膜ホールマウントの硝子体と最小限の動きの完全な除去は、実験の成功に不可欠である。
そのようなN-メチル-D-アスパラギン酸(NMDA)などのRGCによって発現されるカルシウム透過性グルタミン酸受容体のアゴニスト、24,25α -アミノ-3 -ヒドロキシ-5 -メチルイソオキサゾール-4 -プロピオン酸(AMPA)受容体およびカイニン酸型イオンチャネル型グルタミン酸受容体26-29は 、カルシウムの直接入力を呼び起こすならびにVGCCsを活性化する脱分極刺激を提供するために使用することができる。そのようなアゴニストの利用は非につながる可能性RGCの異なるタイプのグルタミン酸受容体サブタイプの発現差異に起因-uniform応答。二光子顕微鏡法はまた、RGCが30とその樹状突起31の光誘発カルシウムシグナルを調査するために利用することができる。
RGCの選択的標識は、フルオ-4 pentapotassium塩カルシウム指示薬色素の膜非透過性の性質に起因して達成された。デキストランコンジュゲートカルシウム指示薬色素が選択的ウサギ32およびラット33における網膜内注射経由でのRGCとその軸索を標識するために使用されてきた。両試験では、RGCは、それらの軸索の選択的標識は、ウサギ32における2時間のインキュベーションまたはラット33における7時間のインキュベーションに続いて、デキストラン共役カルシウム指示色素の網膜内注射を介して達成された。網膜に均一な標識を確実にするために十分なインキュベーション期間を提供するにもかかわらず、そのような方法は、RGCは、それらの増加ラベリングをもたらす注射部位の最も近い軸索は、注射部位に対して遠位の領域においてスパース標識と比較。ボルドリッジ(1996)で説明したように、遠位領域におけるラベリングによる逆行性輸送に起因する可能性が高いが、注射部位での不均一な標識は、露出された(カット)樹状突起での色素取り込みの結果として細胞体の拡散標識に起因している露出した軸索32における色 素の取り込みから。本手法は、RGCの軸索との均一な標識を増加させるために、必要なインキュベーション時間を最小限にするために改良された方法を提供する。
存在する染料ローディング方法は、神経節細胞層内に変位アマクリン細胞の非特異的な荷重をもたらすようなバルク·ロードおよびエレクトロポレーションなどの従来の技術の代替戦略を提供する。特定の神経細胞集団34-38、将来のアプリケーションシートであるプロモーターの制御下tdTomatoまたはEGFPを発現するトランスジェニックマウス系統の可用性とこの技術のアドオンは、特定の網膜神経節細胞サブタイプのカルシウムイメージング研究を含むことができる。
開示事項
著者は全く開示がない。
謝辞
私たちは、カルシウムイメージングプロトコルへの貢献のために博士S.ステラとヘレンヴォンに感謝します。私たちは、インタビューのシーンを撮影するための博士K.シートに感謝します。私たちは、原稿の彼女のコメントに博士アーリーン平野に感謝します。この研究開発プロジェクトは、遠隔医療·先端技術UCLAの医学デビッドゲフィン学校で著者によって実施され、米国陸軍医学研究および資材コマンド(USAMRMC)により授与され、投与された請負契約により可能になるとW81XWH-10-2-0077:契約番号の下MDフォートデストリックで研究センター(TATRC)、、。これらの研究のためのサポートも、NIH EY04067およびVAメリットレビュー(NB)から来た。 NCBは、VAのキャリア研究員である。
資料
| Name | Company | Catalog Number | Comments |
| Straight scissors | WPI | 14124-G | dissecting tools |
| Straight Forceps | WPI | 501985 | dissecting tools |
| curved iris scissors | WPI | 504487 | dissecting tools |
| Cellulose filter paper | Millipore | HABP04700 | |
| Hibernate A | Invitrogen | A12475-01 | Media |
| Vectashield | Vector | H-1000 | Mounting Media for Fluorescence |
| Fluo-4 pentapotassium | Invitrogen | F-14200 | |
| Isoflurane | Abbott Laboratories | 05260-05 | anesthesia |
| Microscope slide | Fisher Scientific | 22-178-277 | |
| Zeiss LSM 5 Pascal microscope | Zeiss | ||
| Axioplan 40x (NA 0.8) objective lens | Zeiss | ||
| Alexa Fluor 488 Goat Anti-Rabbit IgG (H+L) Antibody | Molecular Probes | A-11034 | Secondary antibody |
| RBPMS | ProSci, Poway, CA | A rabbit polyclonal antibody was generated against the N-terminus of the RBPMS polypeptide (RBPMS4-24), GGKAEKENTPSEANLQEEEVR, by a commercial vendor (ProSci, Poway, CA). |
参考文献
- Guenther, E., et al. Separation of calcium currents in retinal ganglion cells from postnatal rat. Brain Res. 633, 223-235 (1994).
- Farrell, S. R., et al. Modulation of voltage-gated ion channels in rat retinal ganglion cells mediated by somatostatin receptor subtype 4. J Neurophysiol. 104, 1347-1354 (2010).
- Caterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu Rev Cell Dev Biol. 16, 521-555 (2000).
- Berridge, M. J., et al. Calcium--a life and death signal. Nature. 395, 645-648 (1998).
- Berridge, M. J. Calcium microdomains Organization and function. Cell Calcium. 40, 405-412 (2006).
- Dolphin, A. C. Calcium channel diversity multiple roles of calcium channel subunits. Curr Opin Neurobiol. 19, 237-244 (2009).
- Rottman, J. B. The ribonuclease protection assay a powerful tool for the veterinary pathologist. Vet Pathol. 39, 2-9 (2002).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. J Neurophysiol. 105, 2601-2609 (2011).
- Segev, R., et al. Recording spikes from a large fraction of the ganglion cells in a retinal patch. Nat Neurosci. 7, 1154-1161 (2004).
- Jeon, C. J., et al. The major cell populations of the mouse retina. J Neurosci. 18, 8936-8946 (1998).
- Blankenship, A. G., et al. Synaptic and extrasynaptic factors governing glutamatergic retinal waves. Neuron. 62, 230-241 (2009).
- Daniels, B. A., Baldridge, W. H. d-Serine enhancement of NMDA receptor-mediated calcium increases in rat retinal ganglion cells. J Neurochem. 112, 1180-1189 (2010).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. J Neurophysiol. 109, 1979-1988 (2013).
- Pérez de Sevilla Müller, L., et al. Expression of voltage-gated calcium channel α(2)δ(4) subunits in the mouse and rat retina. J Comp Neurol. 521 (2), 2486-2501 (2013).
- Hirano, A. A., et al. SNAP25 expression in mammalian retinal horizontal cells. J Comp Neurol. 519, 972-988 (2011).
- Berridge, M. J., et al. Calcium signalling dynamics, homeostasis and remodeling. Nat Rev Mol Cell Biol. 4, 517-529 (2003).
- Dailey, M. E., et al. Maintaining live cells and tissue slices in the imaging setup. Cold Spring Harb ProtocI. , 373-379 (2011).
- Spinelli, K. J., Gillespie, P. G. Monitoring intracellular calcium ion dynamics in hair cell populations with Fluo-4. AM. PLoS One. 7, e51874 (2012).
- Kwong, J. M. K., et al. RNA binding protein with multiple splicing A new marker for retinal ganglion cells. Invest Ophthalmol Vis Sci. 51, 1052-1058 (2010).
- Pérez deSevilla Müller, L., et al. Displaced amacrine cells of the mouse retina. J Comp Neurol. 505, 177-189 (2007).
- Pérez de Sevilla Müller, L., et al. Tracer coupling of intrinsically photosensitive retinal ganglion cells to amacrine cells in the mouse retina. J Comp Neurol. 518, 4813-4824 (2010).
- Raymond, I. D., et al. Cyan fluorescent protein expression in ganglion and amacrine cells in a thy1-CFP transgenic mouse retina. Mol Vis. 14, 1559-1574 (2008).
- Raymond, I. D., et al. A Thy1-CFP DBA/2J mouse line with cyan fluorescent protein expression in retinal ganglion cells. Vis Neurosci. 26, 453-465 (2009).
- Mayer, M. L., Westbrook, G. L. Permeation and block of N-methyl-D-aspartic acid receptor channels by divalent cations in mouse cultured central neurones. J Physiol. 394, 501-527 (1987).
- Ascher, P., Nowak, L. The role of divalent cations in the N-methyl-D-aspartate responses of mouse central neurons in culture. J Physiol. 399, 247-266 (1988).
- Aizenman, E., et al. Responses mediated by excitatory amino acid receptors in solitary retinal ganglion cells from rat. J Physiol. 396, 75-91 (1988).
- Taschenberger, H., et al. Synaptic current kinetics in a solely AMPA-receptor-operated glutamatergic synapse formed by rat retinal ganglion neurons. J Neurophysiol. 74, 1123-1136 (1995).
- Chen, S., Diamond, J. S. Synaptically released glutamate activates extrasynaptic NMDA receptors on cells in the ganglion cell layer of rat retina. J Neurosci. 22, 2165-2173 (2002).
- Jakobs, T. C., et al. Expression of mRNA for glutamate receptor subunits distinguishes the major classes of retinal neurons, but is less specific for individual cell types. Mol Vis. 13, 933-948 (2007).
- Margolis, D. J., Detwiler, P. B. Different mechanisms generate maintained activity in ON and OFF retinal ganglion cells. J NeurosciI. 27, 5994-6005 (2007).
- Margolis, D. J., et al. Dendritic calcium signaling in ON and OFF mouse retinal ganglion cells. J Neurosci. 30, 7127-7138 (2010).
- Baldridge, W. H. Optical recordings of the effects of cholinergic ligands on neurons in the ganglion cell layer of mammalian retina. J Neurosci. 16, 5060-5072 (1996).
- Hartwick, A. T., et al. Functional assessment of glutamate clearance mechanisms in a chronic rat glaucoma model using retinal ganglion cell calcium imaging. J Neurochem. 94, 794-807 (2005).
- Badea, T. C., Nathans, J. Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J Comp Neurol. 480, 331-351 (2004).
- Huberman, A. D., et al. Architecture and activity-mediated refinement of axonal projections from a mosaic of genetically identified retinal ganglion cells. Neuron. 59, 425-438 (2008).
- Kim, I. J., et al. Molecular identification of a retinal cell type that responds to upward motion. Nature. 452, 478-482 (2008).
- Munch, T. A., et al. Approach sensitivity in the retina processed by a multifunctional neural circuit. Nat Neurosci. 12, 1308-1316 (2009).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved