Method Article
生体溶解性接着剤で取り付けられている硬質補強材を用いた柔軟神経プローブの挿入
要約
柔軟な神経微小電極プローブの挿入は、ポリエチレングリコール(PEG)を有する剛性補剛材にプローブを取り付けることによって有効になっている。独自の組立工程は、均一で再現性のある添付ファイルを確実にします。組織内に挿入した後、PEGを溶解し、補強材を抽出する。 インビトロ試験法は、アガロースゲル中の技術を評価する。
要約
生体適合性の薄膜ポリマーから作られる神経インタフェースデバイス用の微小電極アレイは、可撓性材料は、微動により引き起こされる有害な組織反応を最小限に抑えることができるので、機能的な寿命を延長していることが期待される。しかしながら、それらの柔軟性は、正確に神経組織内に挿入されるのを防止する。この記事では、一時的にプローブを正確に、外科的挿入を容易にするために、生体溶解性ポリエチレングリコール(PEG)を使用し、剛性補強材に柔軟な微小電極プローブを接続する方法を示しています。ユニークな補強材の設計は、プローブの長さに沿ったPEG接着剤の均一な分布を可能にする。フリップチップ、マイクロエレクトロニクスのパッケージで使用される一般的なツールは、補強材への正確で再現性の高いアライメントとプローブの取り付けを可能にします。プローブおよび補強材を外科その後PEGは補強材がプローブを出る抽出できるように溶解させ、一緒に移植される所定の位置に。最後に、 インビトロ試験法は、脳組織のアガロースゲルモデルにおける補強材抽出を評価するために使用される。移植のこのアプローチは、長い柔軟なプローブ(> 3ミリメートル)のために特に有利であることが判明している。また、両面フレキシブルなプローブを注入する実現可能な方法を提供する。今日まで、この技術は、ラット皮質からの種々 の生体内の記録データを取得するために使用されている。
概要
微小電極アレイは、神経科学の不可欠なツールだけでなく、このような人工装具などの新興臨床応用である。特に、貫通微小電極プローブは、脳、脊髄、および末梢神経細胞との密接な接触を介して神経活動の刺激と記録を可能にする。移植された神経プローブの主要な課題は、刺激および記録機能の安定性と寿命です。微小電極プローブや神経組織の間の相互作用のモデル化と実験的研究では、分解のための1メカニズムは、プローブと組織1-3の間のわずかな相対運動に起因する神経組織の微小断裂であることを示唆している。一つの解決策は、相対的な微動を最小化するために、より密接に神経組織の嵩剛性特性に一致する柔軟なプローブを製造することである。このように、ポリイミドやパリレン等の生体適合性の薄膜ポリマーは、マイクロエレクトロニクスのための良好な基質として採用されているtrodeプローブ4-8。
フレキシブルプローブのトレードオフは、それらが神経組織に挿入することが困難であることである。研究者は、望ましい機械的特性を維持しながら、柔軟なプローブの挿入を容易にするために様々なアプローチをとっている。デザインの一つのクラスは他の部分のコンプライアンスを維持しつつ、特定のセクション又は軸の剛性を高めるために、ポリマープローブの幾何学的形状を変更する。これは、リブまたは他の材料の層9,10を組み込むことによって達成された。別のアプローチは、生分解性材料11が充填されたポリマープローブの設計に3-Dチャネルを統合する。このプローブは、一時的に剛化、チャネル溶解し、ドレインアウト挿入後の材料することができる。ただし、恒久的に最終的な埋め込まれた装置のジオメトリを変更するこのような方法は、柔軟なプローブの望ましい機能の一部が損なわれることがあります。
Nを行う一つの方法最終的なプローブ形状を変えるotのは、一時的にデバイス12から14を補強するために、生分解性材料とポリマーデバイスをカプセル化することです。しかしながら、典型的な生分解性材料は、シリコンよりも小さい大きさのヤング率次数を有し、その結果、同一の剛性を達成するために、より大きな厚さを必要とするであろう。適切にプローブを塗布して、挿入をより困難に、より丸みを帯び、または丸い先端になることがあります。溶解可能なコーティングが露出しているため、また、それらを組織に接触、あるいは近接するとすぐに溶解するおそれがある。
方法の別のクラスは、組織内に移植された後、剛性が低減する新規プローブ基板材料を使用する。このような材料は、形状記憶ポリマー15と機械的に適応ナノ複合材料16を含む。これらの材料は、挿入後の弾性率が著しく低下することができ、より密接にMATCプローブをもたらすことができる時間神経組織の機械的特性。しかしながら、剛性の達成可能な範囲は依然として限られているので、シリコン又はタングステンワイヤに非常に高い剛性と等価を提供することができない可能性がある。極めて低い剛性を有する非常に長い( 例えば、> 3 mm)であるか、または可撓性のプローブの場合には、一時的に、より剛性の補強材を取り付ける方法が依然として必要とされ得る。
報告されたまた別の有望な方法は、コーティングするために、シャトルと柔軟なプローブ17との間の表面の相互作用をカスタマイズするための恒久的な自己組織化単分子膜(SAM)で補強シャトルです。乾燥時には、プローブは静電塗装、シャトルに準拠しています。挿入後、水をシャトルが抽出できるように、シャトルからプローブを分離する、親水性表面上に移行する。減少プローブ変位とのシャトル抽出(85μm)を実証した。ただし、静電相互作用がTにプローブを保持した彼シャトルは、挿入前との間にシャトルに比べてプローブの滑りのいくつかのリスクがあります。
我々は、可撓性プローブがしっかりと挿入中にプローブを保持するテンポラリ生体溶解性接着材料を有する補強材に付着させる方法を開発した。使用したプローブは2-4 GPaの程度の弾性率を有するポリイミドで作られていた。補強材を約200 GPaの弾性率と、シリコンから製造した。取り付けられたとき、シリコンの剛性は、挿入を容易にする、支配する。一度組織に挿入、接着材料は溶解し、補強材は、その初期の柔軟性にプローブを復元するために抽出される。我々は、生体溶解性接着材料として、ポリエチレングリコール(PEG)を選択した。 PEGは、例えば、神経プローブ、組織工学、薬物送達11,18,19等の移植された用途で使用されている。いくつかの証拠は、PEGは、脳内の神経炎症応答を弱める可能性が示唆されました組織18,20。スクロース、ポリ乳酸 - コ - グリコール酸(PLGA)、およびポリビニルアルコール(PVA)を含む他の可能な材料に比べ、PEGの順に(多くのインプラント手術のために適切なスケールである生物学的液体中の溶解時間を有する分子量に応じて数十分)。また、50〜65℃の範囲の温度、室温と液体で固体このプロパティは、我々の精密組立プロセスのために特に適している。また、SAMと同様の17に記載され、溶解したPEGは、補強材の抽出を容易にする、親水性である。この有利なアプローチは、均一な接着剤の適用範囲および正確で再現性のある位置合わせを確実に新たな補強材の設計および系統的な組立工程で有効になっています。組立工程に加えて、我々は、手術中に取り外し可能な補強材を実現する方法、ならびにSTIの抽出を評価するためのインビトロ手順を示しffener。
ここに提示されたプロトコルは、ユーザーが柔軟なポリマー微小電極プローブを有していることを前提としています。補強材は、このプローブの補強材とアセンブリの製造を関連プロトコルの一部は、微細加工施設で見られる一般的なツールへのアクセスを前提としています。挿抜に関するプロトコルは、おそらく神経科学指向の実験室で行われることになる。
プロトコル
1。補強材へのプローブの組立
プロトコルのこのセクションでは、補強材、シリコン補強材の製造、および薄膜ポリマープローブの組み立てを説明しています。 図1に提案された補強材と一緒に、典型的なポリマー神経プローブを示している。補強材の設計の詳細は、図2に示されている。この設計の新規な特徴は、組み立て中に液状接着剤を分配するために使用され、その長さに沿って浅い「ウィッキング」チャネルである。補強材の広い部分は、アセンブリおよび外科的挿入の際に処理するためのタブです。タブのリザーバは、チャネルに接続します。成分は、標準的な微細加工プロセスを用いてシリコンから製造される。
- ウィッキングチャネルを有するシリコン補強材は、補強材の所望の厚さに等しいデバイス層の厚さ(シリコン·オン·インシュレータ(SOI)ウェハから作製した図3A)。補強材の厚さの合理的な範囲は20〜100μmである。これは、補強材の幅はプローブの上面に接合界面から接着剤のオーバーフローを防ぐことができますプローブ幅より20〜30μmで小さくなることをお勧めします。最初のウィッキングチャンネルをドライエッチング標準ボッシュ法( 図3B)を使用しています。次に、補強材の形状は、埋め込 み酸化物層( 図3C)で停止長いエッチングによって規定される。最後に、補剛材49%フッ化水素酸( 図3D)中の埋め込 み酸化物層を湿式エッチングすることによって解放される。補剛材を徹底的にすすいだ後、15分間それらを脱イオン水に浸す。
- 貯水池への分子量10,000 g /モル( 図4)のポリエチレングリコール(PEG)のペレットを配置します。 PEGが溶融し、毛管作用によってチャネルに発散するように65℃に補強材を加熱する。そして、固化し、室温まで冷却。
- 図5に、セットアップフリップチップボンダーの概略図を示す。ツールヘッドに補強材をピックアップして、フリップチップボンダーのベースステージに逆さまに補強材を配置します。ベースステージに逆さまにプローブを配置します。フリップチップボンダーを用いて、補強材とプローブを合わせた後、補強材を下げ、プローブの上に置きます。
- フリップチップボンダーのステージは、ベース基板を加熱するための加熱素子を有するべきである。補強材を配置した後、65℃に再び集合体を加熱しPEGの1分が再溶融して、プローブと補強材との間のインタフェースを埋めるために始めることができます。固化させる冷却する。
- 以上のアセンブリを回して、上から検査します。 PEGが完全にプローブと補強材との間のインターフェースを充填することを可能にするために、必要に応じて再加熱する。プローブは透明であるので、これは視覚的に評価することができる。アセンブリは、トップ(プローブ)アップサイドヒーターの上に座っているように、手動で1-3 Eを配置タブの上に固体PEGのエクストラペレット彼らはこの地域で、追加の補強( 図6)を提供する、プローブの上に溶融するように。最後に、アセンブリはPEGが凝固するように冷却する。この時点で、アセンブリは、外科的挿入の準備ができている。
2。挿抜
- タブ領域でのマイクロマニピュレータアームに補強材の背面を接着することにより、図7(a)に示すように、マイクロマニピュレータ、プローブ·補強材アセンブリを取り付けます。これは、両面テープや接着剤で行われますが、接着剤でプローブを連絡しないように注意してくださいすることができる。一時的に低い力で容易に除去できるような接着剤、パテの小片にマイクロマニピュレータへのプローブのコネクタ端部を固定する。
- ターゲット上にプローブアセンブリを配置し、所望の挿入速度でプローブを挿入します。このプロトコルを開発する際に0.13〜0.5ミリメートル/秒の挿入速度は、使用された。
- すぐに静かにマイクロマニピュレータからのプローブのコネクタの端を削除して、このような第二マニピュレータアーム( 図7B)として、近くの台の上に置きます。 PEGは、プローブを移動さ避けるために溶解し始める前に、これが行われなければならない。
- PEGは溶解するための時間を確保します。この時間量は、PEGの分子量とプローブと補強材との接触面積に依存するであろう。例えば、10,000 g /モル、微小電極プローブを約6mmと306μm幅であるマッチング補強材のPEG分子量が、15分で十分な時間であることが見出されている。プロトコルの第3節では、必要な溶解時間をテストするための方法を提示します。この時間の間に、ターゲット( 図7C)の上にある任意のPEGを溶解するためにタブを挿入点の周りスポイトを用いてリン酸緩衝生理食塩水(PBS)を適用する。
- 電動マイクロポジショナーを用いて、変位を適用することにより、補強材の抽出を開始する5ミリメートル/秒の速度で100μmである。この最初の速い動きは、どの静止摩擦を克服し、プローブ変位を最小限に抑えることができます。その後、約0.1ミリメートル/秒( 図7D)の低速で補強材の抽出を完了します。
- 実際の手術例では、21で示すように、プローブを固定し、保護するために、挿入部位でゲル、シリコーンおよび/ または歯科アクリルを適用し、通常の手順に進みます。
3。アガロースゲルテスト
プロトコルのこのセクションでは、バルクの機械的性質、pH、および脳組織17,22の塩分濃度を近似する0.6%アガロースゲル中の補強材の抽出を検討するセットアップと手順について説明します。ゲルは、短い距離を介して、ほぼ透明であるため、補強材分離およびプローブ変位を観察することができる。
- リン酸緩衝生理食塩水(PBS)中の0.6%アガロース溶液を調製する。エレメントで混合完全アガロース粉末を溶解するための温度vated。浅いアクリルボックスに溶液を注ぐ。ゲルが深い中3/4- 1でなければなりません。時間室温で設定されたゲルを可能にする。
- それが乾燥しないように硬化ゲルをPBSで飽和していることを確認し、37℃にゲルを加熱し
- 図8に示すように、マイクロマニピュレータ、アガロースゲルの箱、および顕微鏡カメラシステムをセットアップする。
- ゲルと箱の側面( 図8)の間にスライドさせ、ゲルの箱にガラスの参照基準を挿入します。デジタル顕微鏡の視野に、参照基準上の特徴を二乗する歯科ピックを使用してください。
- ステップ2.1で説明したように、マイクロマニピュレータにプローブアセンブリを取り付けます。
- 約1ミリメートルの参照基準の背後にあるシリカゲルのプローブアセンブリを配置します。
- 視野内の所望の深さにそれを導くためにカメラを使用して、ゲル中にプローブを挿入する。
- すぐに近くの表面に載るようにプローブのコネクタの端を移動します。
- プローブ(参照基準の特徴は、わずかに焦点が合っていてもよい)に集中するカメラ画像に対して必要な調整を行います。プローブ位置のスナップショットを作成します。
- PEGは(今回は変更になる場合があり、実際にテストされるべきパラメータであってもよい)を溶解することができます。ゲルの上にある、PEGを溶解するために、タブの近くに、PBSを適用します。
- 必要に応じて、ビデオキャプチャを開始し、ステップ2.5で説明したように補強材の抽出を開始します。抽出が完了すると、プローブ位置の最終的なスナップショットを作成します。
- 補強材の抽出前後の画像を比較する画像処理ツールを使用してください。 (位置合わせ)画像を登録する視野に表示され、参照基準上の機能を使用してください。プローブ上の既知のフィーチャのサイズに基づいて画像の縮尺を校正。プローブ変位の距離を測定します。
結果
この挿入技術は、ISO 10993生体適合性基準に合格しており、慢性の移植のために意図されているLLNL薄膜ポリイミドプローブと組み合わせて使用した。典型的な薄膜ポリイミドプローブは、狭い領域での長約10mmであるシリコン補強材と共に図1に示されている。 図2に示すように、この補強材は、その長さに沿って実行される1つウィッキングチャネルを有する。 図3は、シリコンからこの補強材を作成するために使用さmimcrofabricationプロセスを示す。 図4は、タブのリザーバーに入れた固体PEGのペレットを示し、のように、フリップチップボンダーシステム上のカメラを通して見た。それはフリップチップボンダーのベースステージに組み込まれたヒーターを用いて加熱した後、PEGが溶融し、チャネルに吸い上げ始めた。カメラの視野は、PEGが完全にwhicチャネルを充填するまで、私たちは、ウィッキングプロセスを監視させHは、分子量10,000 g /モルのPEGと約1時間かかった。 PEGは、その後再固化され、 図5に示すように、プローブと補強材のフリップチップボンダーに設置された。 図9(a)は完全にインターフェースを充填整列し、PEGを用いて、添付された後、プローブと補強材の上面図を示す。 図9(b) PEGが原因で粒子が存在していない気泡の一例を示す。組立の最終段階は、取扱い中の余分な補強のため、プローブのケーブル部分の上にタブ領域にPEGを追加することです。この領域は、ターゲットの中に挿入されないため、図6に示すように、それは、ここではPEGの大きな体積を有することが許容される。 図10に示すように、この組立方法は、マルチシャンクデバイスを含む、防撓材に対するプローブの種々の形状を取り付けるために使用されている。
インビトロアガロースゲル試験はqualitativするために使用されているイーリー例えば、PEG分子量、PEGは溶解するのに許される時間、および補強材の幾何学など、さまざまなパラメータを評価する。 PEGおよび補強材の幾何学的形状の各々の組み合わせで、一定時間は溶解させた。リアルタイムプローブ変位を観察しながら、抽出を試みた。プローブは目に見えて補強材に対して分離又は滑ることなく有意に(>200μm)をドラッグした場合は、PEGが完全に溶解しなかったと結論付けた。 表1回変化させ、補強材との分子量を変化させてPEG溶解のいくつかの代表的な観察 結果が得られつまり、6ミリメートル、長さ306μm幅です。その後のテストで別の観察は、補強材( 例えば 220ミクロン)より狭い場合、PEGは(5分たったの)短い時間で溶解したことだった。接着剤の接触面積が減少したため、これは可能性があり、結果として、溶解するPEGのより小さな体積があった。 PEGに影響を与えるとは思われなかったパラメータ溶解またはプローブ変位は補強材(厚さはミクロンを試験した20ミクロン〜100の範囲の)厚さ及びウィッキングチャネル数(1対3)であった。
インビトロ試験はまた、所与のプローブ/補強材/接着剤構成についての平均プローブ変位を定量化するために使用されている。この例では、試験プローブ補強材アセンブリは、アガロースゲルの中に挿入され、コネクタ端面圏内に移動させ、図7に示した挿入/抽出シーケンスを使用して実施し、PEGを溶解させ、そしてさ補強材は、最終的に所定の位置にプローブを残して抽出される。 図8に設置された実験は、マイクロマニピュレータアームに取り付けられており、ゲルの上に配置プローブ補強材アセンブリを示しています。参照基準は、デジタル顕微鏡の視野内にアクリルボックスに対して配置金ドットの配列を有する小さなガラス片であった。
この例ではデバイスは約10μmの厚さで8百μmの直径電極を備えた536μm幅だった。トレースは、Ti-Auの-Ti系金属スタックからなる。シリコン補強材は220ミクロン、幅の6ミリメートル、長さ50μmの厚さであった。プローブ補強材アセンブリは、ゲル中に約5mm挿入した。 図11は 、アガロースゲルで試験したプローブアセンブリの補強材の抽出前と後のスナップショットを示している。画像内の光の金の特徴は、基準からの基準であり、相互に画像を位置合わせする基準フィーチャとして使用した。この寸法は、製造プロセスのばらつきの影響を受けにくいため、電極(200μm)の間の既知のピッチは、画素サイズを較正するために使用した。により補強材抽出純プローブ変位は28±9μmであると推定された(平均値±標準誤差、n = 5)であった。
これまでに、提案手法では、実際のANに拡張されましたラットの大脳皮質にプローブを注入するためのいくつかの場面で位側の手術。組立後、プローブおよび50μmの厚さの補強材を、室温でエタノールで一緒に滅菌した。挿入および抽出を定位固定フレームに取り付けられたマイクロマニピュレーターを用いて行った。プローブ補強材アセンブリは、ラットの皮質に0.13ミリメートル/秒と約4mmに挿入した。 15分後、補強材を所定の位置にプローブを残して、抽出した。手術からの回復後に、神経の記録は、 図12に示すように、実際の手術に成功23にこの方法の実行可能性を実証する覚醒動物から得た。 図13に示すように、この注入技術はまた、表面と裏面の両方に電極を有する両面アレイとのin vivo記録を得るために使用されてきた。
pload/50609/50609fig1.jpg "/>
図1。典型的な神経プローブと提案補強材の概略。典型的な薄膜ポリマープローブは、プローブ端部上の1つ以上の電極を有する。金属トレースは、ケーブル部分の長さに沿って電極から実行して、電気コネクタに接続されているパッドの上に終了します。補強材の長さ(ここでは約10mm)は、プローブの挿入深さに依存し、補強材上の広いタブは取り扱いを可能にする。 ( 画像提供:ダイアナ·ジョージ)
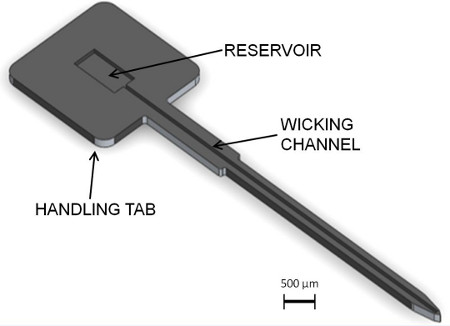
図2。補強材の設計の詳細 。ウィッキングチャネルは、リザーバ内に堆積された液状接着剤を分配するために毛細管現象を利用する。リザーバは、取り扱いを容易に、より広いタブ領域である。 ( 画像提供:ダイアナ·ジョージ)
:FO」jove_content」 
図3。シリコン補強材のための製造シーケンス。シリコン補強材がシリコン·オン·インシュレータ(SOI)ウェーハ(A)上に作製される。まずウィッキングチャネルである標準的なボッシュプロセス(B)を用いてドライエッチングする。次に、補強材の形状は停止し、より長いエッチングによって規定される埋め込 み酸化物層(C)上で、 最後に補剛材49%フッ化水素酸(D)中の埋め込 み酸化物層を湿式エッチングすることによって解放される。

図4。スティフナーリザーバ内のポリエチレングリコールである。補強材のリザーバ内に配置されたポリエチレングリコールのフレーク。一旦加熱、それは、溶融容器を記入し、流れ、ウィッキングチャネルへ。

図5。フリップチップボンディングの概略図。補強材をフリップチップボンダのツールヘッド上の真空によってチャンネルダウンで保持される。神経プローブは、基台側を下に位置しています。

図6。補強材タブのポリエチレングリコール。エクストラポリエチレングリコールは寛大に補強材として補強材のタブに適用されます。ポリイミドプローブのケーブル部分は、補強材の上に表示されている。

図7。中の概略sertion抽出シーケンス。 A)プローブ補強材アセンブリはマイクロマニピュレーターを用いて組織内に挿入されている。B)コネクタ側は、近くの表面に移動します。C)PBSが補強材のタブにPEGを溶解するために適用される。D)に補強材を残して、抽出され、ターゲットプローブ。

図8。in vitro試験は、設置した。リン酸緩衝生理食塩水、0.6%アガロースゲルでのテストプローブ挿入し、補強材の抽出のために設定。プローブ補強材アセンブリは、マイクロマニピュレータアームに取り付けられ、参照基準の近くのゲル標的の上に配置される。デジタル顕微鏡をアガロースゲルにプローブと補強材を観察するために使用されている。

図9。プローブは、補強材に付着した。良好な配向と完全な接着カバーで補強材に取り付けられたプローブのA)の上面図のB)が粒子に接着剤の適用範囲のギャップの例。

図10。マルチシャンクプローブの例提案組立工程は、整合シリコン補強材にこの4シャンクプローブを取り付けるために使用した。

図11。補強材の抽出結果の例。スナップショット(上)前、アガロースゲル中の薄膜ポリイミドプローブで(下)補強材抽出後から。ライトゴールドのドットが点灯している基準及び基準画像を比較し、プローブ変位を測定するための参照特徴として使用される。プローブの推定変位は28±9ミクロン(平均値±標準誤差、n = 5)である。
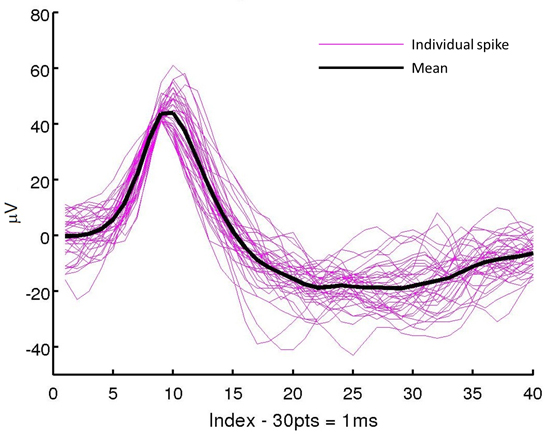
図12。生理学的記録の例。これらの単一ニューロンスパイクは、このプロトコルに記載のように取り外し可能な補強材が注入可撓性微小電極プローブから得た。

図13。両面プローブからのLFPの録音。挿入、表裏両面に電極を持っていた柔軟な配列の取り外し可能な補強材を有効にテストと。これらのLFPの録音は、Cを示し移植後の両側のomparable電極性能。
| PEGの溶解後: | |||||
| プローブ長さ(mm) | 補強材の幅(μm)を | PEG分子量(g /モル) | 10分 | 15分 | 30分 |
| 6 | 306 | 6000 | はい | はい | |
| 万 | はい | ||||
| 2万 | いいえ | はい | |||
表1。 0.6%アガロースゲルにおけるPEGの溶解時間。異なる分子量のPEGの溶解の観察時間の量を変化させた後、シリコン補強材への柔軟なプローブを接続するために使用します。
ディスカッション
ここで説明する方法は、生体溶解性接着剤を用いて別々の補強材に薄膜ポリマープローブを取り付けるための十分に制御された方法を提供する。また、これらの取り外し可能な補強材と所定のプローブ·補強材構成に対して、in vitroでの手順を検証する技術を実現するための推奨の外科的処置がある発表した。補強材を任意に硬質にすることができるので、方法は、比較的長いプローブ(> 3 mm)での挿入を容易にすることができる。このように、挿入方法は、深部脳刺激(DBS)、脊髄刺激、および末梢神経インターフェースのアプリケーションに可能にする技術として期待されている。
ウィッキングチャネルとフリップチップベースの組立工程を有する新規な補強材は、様々な材料およびプローブ構成するのに適している。幾何学的には、補強材は、プローブのフットプリントに一致する必要はなく、例えば、プローブよりも狭くすることができる。 STIの厚さ ffenerも異なる場合があります。我々は、シリコンから作られた補強材を説明してきたが、他の材料と、それは特定の用途のためのより望ましい機械的特性を達成することが可能であってもよい。組み立て工程はまた、液状接着剤の他のタイプに適している。 PEGが原因固化し、複数回再溶融させるその能力ので動作することが特に容易である。この特性を持たない他の液体接着剤の場合には、組立順序は、変更される必要があり得る。これは、PEGに異なる分子量を使用することが可能である。より高い分子量は、手術中に望ましいことであり得る、溶解に時間がかかります。プローブと補強材との接触面積は、プローブ挿入後、接着剤を溶解するのに必要な時間に影響を与える。これは、接着剤を溶解するのに必要な時間を特徴づけるために、セクション3で説明したように選択された分子量のプローブ補強材構成がin vitroで試験することをお勧めします。
_content ">我々は、正確に抽出速度を制御すること最小限のプローブ変位と補強材を抽出するために重要であることを見出した。具体的には、初期の素早い動きが静止摩擦を克服し、この後、プローブからの抽出の残りの部分を補強材を分離するのに役立つことができアガロースゲル試験で観察されたように、ごくわずかな追加の探針変位に遅い速度で完了することが多く、神経科学の研究室がKOPF定位システムを使用して、これらの系に添加することができるKOPF( 例えば、モデル2662)から電動mircopositionerモジュールがある。それは同じようなダイナミック性能を持っていたが、より安価であり、より柔軟な速度制御を持っていたので、我々はニューポートの電動アクチュエータを採用しました。(それは私たちのマイクロポジショナーシステムにアクチュエータを装着するための簡単なブラケットを製作する必要があった。)KOPFシステムは2つの抽出を適用することができます我々が開発したプロトコルと同様の速度であるが、KOPFアクチュエータの最大速度は、しばらく、4ミリメートル/秒である我々は、ニューポートのアクチュエータを使用して初期変位を5ミリメートル/秒を使用していました。インビトロおよびインビボ試験の間、プローブ補強材アセンブリの挿入は0.13〜0.5ミリメートル/秒の範囲の速度で、手動式マイクロマニピュレーター、又は電動式マイクロマニピュレーターのいずれかで実施した。何の損傷またはプローブの剥離は認められなかった。より高い挿入速度は、プローブアセンブリ補強材への損傷の危険性を決定するために評価されていない。
挿入/抽出手順への変更は、プロセスをより堅牢にするために進行中である。具体的には、非常に敏感なステップは、近くの表面にマイクロマニピュレータのオフプローブのコネクタの端を移動している。それが確保される前にプローブを乱すこのステップではリスクがあります。これは、ケーブルの曲がりがプローブの意図しない変位をもたらす、プローブの挿入部にストレスを引き起こす可能性があることも可能である補強材抽出後。現在、これらのリスクは、少なくとも2.5 cmの長さであるケーブルを使用してプローブを使用することによって軽減される。しかし、挿入/抽出プロセスは、プローブ設計にあまり依存しないことが望ましい。マイクロマニピュレータツール終了または一時的に接続をサポートすることができますステージング備品の追加への変更は、おそらく補強材のより信頼性の高い抽出を可能にします。
このメソッドから延びる今後の研究につながる可能性があり、いくつかの未解決の問題があります。 0.6%アガロースゲルは、プローブ変位の最良のインビトロ脳組織代用物で知られており、許可された画像解析を提供しながら、まず、それは正確に脳組織を複製しません。研究は、 生体内でのプローブの位置および変位を調べるために必要とされる。第二に、長期的な移植および組織学的試験は、取り外し可能な補強材を有する可撓性プローブの利点を定量化するために必要とされる。このような研究は、理論を調査することができそのプローブコンプライアンスは微動が減少し、電極性能を拡張します。最後に、より正確にPEGの分解速度を特徴付けるために有益であろう。これは、特定の外科的な必要性のための溶解時間のより良いチューニングを支援する可能性があります。このような測定はまた、溶解したPEGは、PEGの親水性は、補強材の抽出を促進するため、重要であり、プローブと補強材の間に残っている時間の長さを定量化できた。
開示事項
著者らは、競合する金融利害関係はありません。
謝辞
この作品は、NIH NIDCD Y1-DC-8002から01によってサポートされていました。この作業は、契約DE-AC52-07NA27344下ローレンス·リバモア国立研究所で、米国エネルギー省の後援の下で行った。
資料
| Name | Company | Catalog Number | Comments |
| Polyethylene glycol, 10,000 g/mol | Sigma Aldrich | 309028 | |
| Agarose | Sigma Aldrich | A9539 | |
| Flexible Sub-micron Die Bonder | Finetech | Fineplacer lambda | |
| Micromanipulator | KOPF | 1760-61 | |
| Digital Microscope | Hirox | KH-7700 | |
| Dual Illumination Revolver Zoom Lens | Hirox | MXG-2500REZ | |
| Precision Motorized Actuator | Newport | LTA-HS | w/ CONEX-CC controller |
参考文献
- Polikov, V., Tresco, P., Reichert, W. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).
- Lee, Y. T., Hitchcock, R. W., Bridge, M. J., Tresco, P. A. Chronic response of adult rat brain tissue to implants anchored to the skull. Biomaterials. 25 (12), 2229-2237 (2004).
- Subbaroyan, J., Martic, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2, 103-113 (2005).
- Lacour Sun, Y., S,, et al. Assessment of the biocompatibility of photosensitive polyimide for implantable medical device use. Journal of Biomedical Materials Research A. 90 (3), 648-655 (2009).
- Kipke, D. R., Pellinen, D. S., Vetter, R. J. Advanced neural implants using thin-film polymers. IEEE International Symposium on Circuits and Systems. 4, 173-176 (2002).
- Mercanzini, A., Cheung, K., et al. Demonstration of cortical recording using novel flexible polymer neural probes. Sensors and Actuators A. 143, 90-96 (2008).
- Stieglitz, T. Flexible biomedical microdevices with double-sided electrode arrangements for neural applications. Sensor and Actuators A. 90, 203-211 (2001).
- Tooker, A., Tolosa, V., Shah, K. G., Sheth, H., Felix, S., Delima, T., Pannu, S. Polymer neural interface with dual-sided electrodes for neural stimulation and recording. Proceedings of the International Conference of the Engineering in Medicine and Biology Society. , 5999-6002 (2012).
- Parylene microprobes with engineered stiffness and shape for improved insertion. Egert, D., Peterson, R. L., Najafi, K. Proceedings of Transducers '11, Beijing, China, , (2011).
- Lee, K. -K., He, J., et al. Polyimide-based intracortical neural implant with improved structural stiffness. Journal of Micromechanics and Microengineering. 14, 32-37 (2004).
- Takeuchi, S., Ziegler, D., et al. Parylene flexible neural probes integrated with microfluidic channels. Lab On A Chip. 5, 519-523 (2005).
- Improving mechanical stiffness of coated benzocyclobutene (bcb) based neural implant. Singh, A., Zhu, H., He, J. Proceeding of the International Conference of the Engineering in Medicine and Biology Society, , 4298-4301 (2004).
- Lewitus, D., Smith, K. L., et al. Ultrafast resorbing polymers for use as carriers for cortical neural probes. Acta Biomaterialia. 7, 2483-2491 (2011).
- An ultra-compliant, scalable neural probe with molded biodissolvable delivery vehicle. Gilgunn, P. J., Khilwani, R., et al. Proceedings of the 2012 IEEE 25th International Conference on Micro Electro Mechanical Systems (MEMS), , 56-59 (2012).
- Ware, T., Simon, D., et al. Fabrication of responsive, softening neural interfaces. Advanced Functional Materials. 22 (16), 3470-3479 (2012).
- Harris, J. P., Capadona, J. R., et al. Mechanically adaptive intracortical implants improve the proximity of neuronal cell bodies. Journal of Neural Engineering. 8, 1-13 (2011).
- Kozai, T. D. Y., Kipke, D. R. Insertion shuttle with carboxyl terminated self-assembled monolayer coatings for implanting flexible polymer neural probes in the brain. Journal of Neuroscience Methods. 184 (2), 199-205 (2009).
- Bjugstad, K. B., Lampe, D. S., Kern, D. S., Mahoney, M. Biocompatibility of poly(ethylene glycol)-based hydrogels in the brain: An analysis of the glial response across space and time. Journal of Biomedical Materials Research Part A. 95 (1), 79-91 (2010).
- Greenwalk, R. B., Choe, Y. H., McGuire, J., Conover, C. D. Effective drug delivery by pegylated drug conjugates. Advanced Drug Delivery Reviews. 55 (2), 217-250 (2003).
- Effects of adsorbed proteins and an antifouling agent on the impedance of silicon-based neural microelectrodes. Sommakia, S. S., Rickus, J. L., Otto, K. J. Proceedings of the 31st Annual IEEE EMBC International Conference, , 7139-7142 (2009).
- Gage, G. J., Stoetzner, C. R., Richner, T., Brodnick, S. K., Williams, J. C., Kipke, D. R. Surgical Implantation of Chronic Neural Electrodes for Recording Single Unit Activity and Electrocorticographic Signals. J. Vis. Exp. (60), e3565(2012).
- Chen, Z. -J., Gillies, G. T., et al. A realistic brain tissue phantom for intraparenchymal infusion studies. Journal of Neurosurgery. 101 (2), 314-322 (2004).
- Removable silicon insertion stiffeners for neural probes using polyethylene glycol as a biodissolvable adhesive. Felix, S., Shah, K. G., George, D., Tolosa, V., Tooker, A., Sheth, H., Delima, T., Pannu, S. Proceedings of the International Conference of the Engineering in Medicine and Biology Society, , 871-874 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved