Method Article
Einfügen von Flexible Neural Sonden mit starren Versteifungen Biodissolvable mit Klebstoff befestigt
In diesem Artikel
Zusammenfassung
Einführen des flexiblen neuralen Mikrosonden durch Anbringen Sonden starre Versteifungen mit Polyethylenglykol (PEG) aktiviert. Eine einzigartige Montageprozess gewährleistet eine einheitliche und wiederholbare Anhang. Nach dem Einführen in das Gewebe löst sich das PEG und das Versteifungselement herausgezogen. Ein in vitro-Testverfahren beurteilt die Technik in Agarosegel.
Zusammenfassung
Mikroelektroden-Arrays für neuronale Interface-Geräte, die von biokompatiblen Dünnschicht-Polymer hergestellt werden, werden erwartet, um funktionelle Lebensdauer verlängert haben, weil das flexible Material kann negative Gewebereaktion durch Mikrobewegungen zu minimieren. , Jedoch verhindert, dass sie ihre Flexibilität aus, die genau in das Nervengewebe eingesetzt. Dieser Artikel beschreibt eine Methode, um vorübergehend befestigen ein flexibles Mikrosonde an einem starren Versteifung mit biodissolvable Polyethylenglykol (PEG), um präzise, chirurgische Einführen der Sonde zu erleichtern. Eine einzigartige Versteifungs Design ermöglicht eine gleichmäßige Verteilung der PEG-Klebstoff entlang der Länge der Sonde. Flip-Chip-Bonden, ein übliches Werkzeug in der Mikroelektronik Verpackung, ermöglicht eine genaue und wiederholbare Ausrichtung und Befestigung der Sonde an der Versteifung. Die Sonde und Versteifung werden chirurgisch implantiert zusammen, dann ist die PEG wird sich auflösen, so dass die Versteifung extrahiert werden, so dass die Sondean Ort und Stelle. Schließlich wird ein in vitro-Testverfahren verwendet werden, um Versteifungs Extraktion in einem Agarosegel Modell des Hirngewebes zu beurteilen. Für mehr flexible Sonden besonders vorteilhaft hat sich dieser Ansatz der Implantation nachgewiesen (> 3 mm). Es stellt auch eine praktikable Methode, um zweiseitige flexible Sonden implantieren. Bisher wurde die Technik verwendet, um verschiedene In-vivo-Aufnahme von Daten aus der Rattenhirnrinde zu erhalten.
Einleitung
Mikroelektroden-Arrays sind ein unverzichtbares Werkzeug in den Neurowissenschaften sowie neue klinische Anwendungen wie Prothetik. Insbesondere, durchdringenden Mikroelektrodensonden ermöglichen Stimulation und Ableitung neuronaler Aktivität durch den engen Kontakt mit den Zellen im Gehirn, Rückenmark und peripheren Nerven. Eine große Herausforderung für implantierten neuronalen Sonden ist die Stabilität und Langlebigkeit der Stimulation und Aufnahme-Funktionen. Modellierung und experimentelle Untersuchungen über die Wechselwirkung zwischen Mikrosonden und Nervengewebe haben vorgeschlagen, dass ein Mechanismus zum Abbau Mikroreißen von Nervengewebe aufgrund einer geringfügigen Relativbewegung zwischen der Sonde und dem Gewebe 1-3. Eine Lösung ist die flexible Sonden, die stärker die Großsteifigkeitseigenschaften von Nervengewebe, um eine relative Mikrobewegung zu minimieren entsprechen herzustellen. Als solche haben biokompatiblen Dünnschicht Polymere, wie Polyimid, Parylene und als Substrate für günstige Mikroelektronik übernommentrode Sonden 4-8.
Ein Kompromiss von flexiblen Sonden ist, dass sie schwer in das neuronale Gewebe einzufügen sind. Forscher haben verschiedene Ansätze verfolgt, um die Einführung von flexiblen Sonden ermöglichen, unter Beibehaltung der mechanischen Eigenschaften wünschenswert. Eine Klasse von Designs modifiziert die Polymersondengeometrie, um die Steifigkeit in bestimmten Abschnitten oder Achsen zu erhöhen, während in anderen Teilen der Einhaltung. Dies wurde durch den Einbau von Rippen oder Schichten aus anderen Materialien 9,10 erreicht. Ein weiterer Ansatz integriert ein 3-D-Kanal in die Polymersondenkonstruktion, die mit biologisch abbaubaren Material 11 gefüllt ist. Diese Sonde kann vorübergehend versteift werden, und nach dem Einführen des Materials in den Kanal löst und abfließt. Jedoch solche Verfahren, die die Geometrie des endgültigen implantierten Vorrichtung permanent ändern können einige der wünschenswerten Eigenschaften der flexiblen Sonde beeinträchtigen.
Eine Methode, die funktioniert not den endgültigen Sondengeometrie zu verändern ist, um die Polymervorrichtung mit biologisch abbaubarem Material, die Vorrichtung 12-14 vorübergehend versteifen kapseln. Jedoch haben typische biologisch abbaubaren Materialien Elastizitätsmodule um Größenordnungen kleiner als die von Silizium und würde folglich erfordern größere Dicke, um die gleiche Steifigkeit zu erreichen. Ausreichend Beschichtung kann die Sonde in einer abgerundeten oder stumpfen Spitze führen, was Einsetzen schwieriger. Da lösliche Beschichtungen ausgesetzt sind, besteht die Gefahr, dass sie unmittelbar nach dem Kontakt Auflösen oder auch nahe, mit dem Gewebe.
Eine weitere Klasse von Methoden verwendet neuartige Sonde Substratmaterialien, die nach der Implantation in das Gewebe in der Steifigkeit zu reduzieren. Solche Materialien umfassen Formgedächtnispolymere 15 und eine mechanisch adaptive Nanokomposit-16. Diese Materialien sind in der Lage, E-Modul deutlich nach dem Einsetzen zu verringern, und können Sonden, die enger matC führenh die mechanischen Eigenschaften des Nervengewebes. Allerdings ist die erzielbare Reichweite der Steifigkeit noch begrenzt, so dass sie nicht in der Lage, sehr hohe Steifigkeit entspricht Silizium-oder Wolframdrähten bereitzustellen. So ist in dem Fall von flexiblen Sonden, die sehr lange (z. B.> 3 mm), oder dass eine extrem geringe Steifigkeit sind, kann ein Verfahren zum zeitweiligen Anbringen eines starren Versteifungs noch erforderlich.
Noch ein weiteres vielversprechendes Verfahren berichtet, ist die Beschichtung ein Versteifungs Shuttle mit einem Permanentselbstorganisierende Monoschicht (SAM), die Oberflächenwechselwirkung zwischen dem Shuttle und der flexiblen Sonde 17 anpassen. Wenn es trocken ist, hält sich die Sonde auf die elektrostatisch beschichtet Shuttle. Nach dem Einführen wandert Wasser auf der hydrophilen Oberfläche, Abtrennen der Sonde von der Shuttle, so dass der Shuttle extrahiert werden. Shuttle-Extraktion mit reduziertem Hubraum Sonde nachgewiesen (85 um). Doch mit nur elektrostatische Wechselwirkungen Halten der Sonde zu ter-Shuttle, besteht das Risiko von Sonden Schlupf relativ zum Shuttle vor und während der Einführung.
Wir haben ein Verfahren, bei dem die flexible Sonde mit einer Versteifung mit einem temporären biodissolvable Klebematerial, das sicher hält die Sonde während des Einführens angebracht entwickelt. Die verwendeten Sonden waren aus Polyimid, das ein Elastizitätsmodul in der Größenordnung von 2-4 GPa aufweist. Die Versteifung aus Silizium hergestellt ist, mit einem Elastizitätsmodul von ca. 200 GPa. Wenn angebracht, die Steifigkeit des Silizium dominiert, das Einführen. Sobald sie in das Gewebe eingeführt wird, löst das Haftmaterial und das Verstärkungs extrahiert wird, um die Sonde in die Ausgangs Flexibilität wiederherzustellen. Wir wählten Polyethylenglykol (PEG) als biodissolvable Klebstoff. PEG wurde in implantierten Anwendungen wie neuronale Sonden, Tissue Engineering und Drug-Delivery 11,18,19 verwendet. Einige Beweise hat vorgeschlagen, dass PEG kann neuroinflammatorischen Antwort in Gehirn dämpfenGewebe 18,20. Im Vergleich zu anderen möglichen Materialien, einschließlich Saccharose, Polymilchsäure-co-Glykolsäure (PLGA) und Polyvinylalkohol (PVA), PEG hat eine Auflösungszeit in biologischen Flüssigkeiten, der aus einem geeigneten Maßstab für viele Implantat Operationen ist (in der Größenordnung von zehn Minuten, je nach Molekulargewicht). Darüber hinaus ist es bei Raumtemperatur fest und flüssig bei Temperaturen im Bereich von 50 bis 65 ° C. Diese Eigenschaft macht sie besonders geeignet für unsere Präzisionsmontageprozesses. In 17 außerdem ähnlich dem SAM beschrieben, ist die hydrophile PEG gelöst, Erleichterung der Extraktion des Versteifungs. Diese vorteilhafte Ansatz wird durch ein neuartiges Design und methodische Versteifung Montageprozess die eine gleichmäßige Klebeabdeckung und genaue und wiederholbare Ausrichtung zu gewährleisten aktiviert. Zusätzlich zu den Montageprozess, präsentieren wir die Methode der Durchführung des entfernbaren Versteifungs während der Operation sowie ein in vitro-Verfahren zur Extraktion der STI auswertenffener.
Die hier vorgestellte Protokoll geht davon aus, dass der Benutzer eine flexible Polymermikrosonde besitzt. Der Teil des Protokolls über die Herstellung der Versteifung und Montage dieser Sonde zu einer Versteifung nimmt Zugriff auf gemeinsame Werkzeuge in einer Mikroanlage gefunden. Das Protokoll über die Steck-und Zieh würde wahrscheinlich in einem Neuroorientierten Labor durchgeführt werden.
Protokoll
1. Versammlung der Sonde an Stiffener
Dieser Abschnitt des Protokoll beschreibt die Herstellung eines Silizium Aussteifung und die Anordnung eines Dünnfilm-Polymer Sonde mit der Versteifung. Fig. 1 zeigt eine typische Polymer neuronalen Sonde zusammen mit der vorgeschlagenen Versteifungselement. Die Einzelheiten des Versteifungs Design sind in Abbildung 2 dargestellt. Das neue Merkmal dieser Konstruktion ist der flache "Wicking"-Kanal entlang seiner Länge, die verwendet wird, um Flüssigkleber bei der Montage zu verteilen läuft. Der breitere Abschnitt der Versteifung ist ein Register für die Handhabung bei der Montage und chirurgischen Insertion. Ein Reservoir auf der Registerkarte Verbindung mit dem Kanal. Die Komponente aus Silizium unter Verwendung von Standardmikrofabrikationsverfahren hergestellt.
- Die Siliziumversteifungs mit Dochtkanal aus einem Silizium-auf-Isolator (SOI)-Wafer mit einer Vorrichtung Schichtdicke gleich der gewünschten Dicke der Versteifung (hergestellt 3A). Eine angemessene Auswahl von Versteifungs Dicke von 20 bis 100 um. Es wird empfohlen, dass die Breite des Versteifungs werden 20-30 &mgr; m kleiner ist als die Breite Sonde, die ein Überlaufen des Klebstoffs von der Bindungsgrenzfläche zu der Spitze der Sonde zu verhindern hilft. Die erste Dochtwirkungskanäle trocken geätzt unter Verwendung des Standard-Bosch-Verfahren (Fig. 3B). Als nächstes wird die Versteifungsgeometrie eine längere ätzen, die auf der vergrabenen Oxidschicht (3C) stoppt definiert. Schließlich werden die Versteifungen durch Nass-Ätzen der vergrabenen Oxidschicht in 49% Fluorwasserstoffsäure (3D) freigegeben. Nach gründlichem Spülen der Versteifungen, genießen sie in VE-Wasser für 15 min.
- Platzieren eines Pellets aus Polyethylenglykol (PEG) mit einem Molekulargewicht von 10.000 g / mol in den Vorratsbehälter (4). Wärme die Versteifung auf 65 ° C, so daß das PEG schmilzt und leitet in den Kanal durch Kapillarwirkung. Dann Abkühlen auf Raumtemperatur verfestigt.
- Abbildung 5 zeigt eine schematische Darstellung der Flip-Chip-Bonder einrichten. Legen Sie die Versteifung umgedreht auf die Basisstufe des Flip Chip Bonder, dann holen die Versteifung mit dem Werkzeugkopf. Legen Sie die Sonde nach oben auf der Basisstufe. Mit der Flip-Chip-Bonder, richten Sie die Versteifung und die Sonde und senken Sie dann die Versteifung und legen Sie es auf die Sonde.
- Die Basisstufe des Flip-Chip-Bonder sollte ein Heizelement, um Wärme auf das Substrat anzuwenden. Nach dem Platzieren des Versteifungs erhitzen Anordnung wieder auf 65 ° C Eine Minute nach der PEG erneut zu schmelzen und zu beginnen, in der Schnittstelle zwischen der Sonde und der Versteifung zu füllen. Kühle zu verfestigen.
- Drehen Sie die Baugruppe über und prüfen von der Spitze. Erwärmen als nötig ist, damit das PEG an die Schnittstelle zwischen der Sonde und dem Versteifungselement vollständig ausfüllt. Dies kann visuell bewertet werden, da die Sonde transparent. Da die Montage der Heizung sitzt Top-(probe-) Seite nach oben, manuell platzieren 1-3 Extra-Pellets von festen PEG auf die Registerkarte, so dass sie über die Sonde zu schmelzen, die Bereitstellung zusätzlicher Verstärkung in diesem Bereich (Abbildung 6). Schließlich erlauben die Montage auf so cool, dass die PEG erstarrt. An diesem Punkt ist die Montage bereit für chirurgische Insertion.
2. Ein-und Ausbau
- Einbau des Probe-Versteifungsanordnung an einem Mikromanipulator, wie in 7A durch Kleben der Rückseite der Versteifung auf den Mikromanipulator Arm an der Laschenbereich dargestellt. Dies kann mit doppelseitigem Klebeband oder Zement getan werden, aber darauf achten, dass die Sonde mit Klebstoff zu kontaktieren. Vorübergehend sichern das Anschlussende der Sonde an den Mikromanipulator mit einem kleinen Stück Klebemasse, so dass sie leicht mit geringer Kraft entfernt werden.
- Positionieren Sie die Sondenanordnung über dem Ziel und führen Sie die Sonde mit der gewünschten Eintragsgeschwindigkeit. Insertion Geschwindigkeiten von 0,13 bis 0,5 mm / sec wurden verwendet, bei der Entwicklung dieses Protokoll.
- Ziehen Sie sofort den Stecker des Sonde aus dem Mikromanipulator sanft und Ruhe es auf einem nahe gelegenen Oberfläche, wie einer zweiten Manipulatorarmes (Abbildung 7B). Dies muss geschehen, bevor das PEG zu lösen beginnt, um zu vermeiden Verschieben der Sonde.
- Nehmen Sie sich Zeit für PEG, sich aufzulösen. Diese Zeitdauer wird auf PEG-Molekulargewicht und der Kontaktbereich zwischen der Sonde und der Versteifung ab. Beispielsweise mit PEG-Molekulargewicht von 10.000 g / mol, eine Mikrosonde etwa 6 mm und einem passenden Versteifung, die 306 &mgr; m breit ist, 15 min wurde festgestellt, daß eine ausreichende Menge an Zeit. Abschnitt 3 des Protokolls zeigt ein Verfahren, um die gewünschte Auflösungszeit zu prüfen. Während dieser Zeit gelten Phosphat-gepufferter Salzlösung (PBS) mit Hilfe einer Pipette auf der Lasche und Einfügemarke jede PEG, die über dem Ziel (7C) ist, aufzulösen.
- Mit einem motorisierten Mikropositionierer beginnen Extraktion der Versteifung, indem eine Verschiebung des100 &mgr; m bei einer Geschwindigkeit von 5 mm / sec. Diese anfängliche schnelle Bewegung hilft, um statische Reibung zu überwinden und zu minimieren Sonde Verschiebung. Dann füllen Sie das Versteifung Extraktion mit einer langsameren Geschwindigkeit von ca. 0,1 mm / Sekunde (7D).
- Im Fall einer tatsächlichen Operation, mit üblichen Verfahren weiterhin Gel, Silikon und / oder Zahnacryl an der Insertionsstelle Anwendung zur Sicherung und zum Schutz der Sonde, wie in 21 gezeigt.
3. Agarose-Gel-Test
Dieser Abschnitt des Protokoll beschreibt eine Einrichtung und Verfahren, um die Extraktion der Versteifung in einem 0,6% Agarose-Gel, das die Groß mechanische Eigenschaften, pH-Wert und Salzgehalt des Hirngewebes 17,22 annähert zu untersuchen. Da das Gel ist durch kurze Wege fast transparent ist, kann Versteifung Trennung und Sonde Verschiebung beobachtet werden.
- Eine Lösung aus 0,6% Agarose in phosphatgepufferter Salzlösung (PBS). Mischen Sie in einem eleviert Temperatur, um die Agarose-Pulver vollständig aufzulösen. Füllen Sie die Lösung in eine flache Acryl-Box; Gel sollte 3/4- 1 in tief sein. Lassen Sie das Gel bei Raumtemperatur für eine Stunde eingestellt.
- Sicherzustellen, dass die ausgehärtete Gel wird mit PBS gesättigt, so daß sie nicht austrocknen, und das Gel erwärmt auf 37 ° C.
- Einrichten des Mikromanipulators Schachtel Agarosegel und mikroskopische Kamerasystem, wie in Fig. 8 gezeigt.
- Legen Sie ein Glas Referenzbezugsmarkierung in den Strafraum von Gel, indem sie zwischen dem Gel und der Seite der Box (Abbildung 8). Verwenden Sie einen Zahnstocher, um die Funktionen auf der Referenzbezugs um das Blickfeld der Digital-Mikroskop-Platz.
- Montieren Sie die Sondenanordnung auf die Mikromanipulator, wie in Schritt 2.1 beschrieben.
- Positionieren Sie die Sondenanordnung über das Gel ca. 1 mm hinter dem Verweis Bezugs.
- Führen Sie die Sonde in das Gel, mit der Kamera, um sie zu einer gewünschten Tiefe in das Blickfeld zu führen.
- Unmittelbar bewegen Sie den Stecker des Sonde auf einem nahe gelegenen Oberfläche ruhen.
- Nehmen Sie alle erforderlichen Anpassungen an das Kamerabild auf der Sonde (die Referenzbezugsmerkmale können etwas unscharf) konzentrieren. Machen Sie einen Schnappschuss der Sonde Lage.
- PEG ermöglichen, sich aufzulösen (das Zeit kann variieren, und in der Tat kann ein Parameter, der getestet werden kann). Bewerben PBS in der Nähe der Registerkarte PEG aufzulösen, die über dem Gel ist.
- Videoaufnahme zu starten, falls gewünscht, und beginnt die Extraktion des Versteifungs wie in Schritt 2.5 beschrieben. Wenn Extraktion abgeschlossen ist, eine endgültige Momentaufnahme der Sonde Lage.
- Verwenden Sie Bildverarbeitungs-Tools, um die Bilder vor und nach der Extraktion Versteifung vergleichen. Verwenden Sie die Funktionen auf der Referenzbezugs, die in das Blickfeld zu registrieren sichtbar sind (ausgerichtet) der Bilder. Kalibrieren der Waage der Grundlage der Größe des bekannten Merkmalen auf dem Testbild. Messen Sie den Abstand der Sonde Verschiebung.
Ergebnisse
Diese Insertion Technik wurde in Verbindung mit LLNL Dünnschicht-Polyimid-Sonden, die ISO 10993 Biokompatibilität Normen bestanden haben und für chronische Implantation bestimmt ist. Ein typisches Dünnschicht-Polyimid-Sonde ist in Fig. 1 zusammen mit einem Silizium-Versteifung, die etwa 10 mm lang in der schmalen Region ist dargestellt. Diese Versteifung eines Dochtkanals entlang seiner Länge verläuft, wie in Fig. 2 gezeigt. Fig. 3 zeigt die mimcrofabrication Verfahren verwendet, um diese Versteifung von Silizium zu schaffen. Fig. 4 zeigt ein Pellet von festen PEG, die in dem Reservoir der Lasche angeordnet wurde, wie durch die Kamera auf der Flip-Chip-Bonder-System gesehen. Sobald es wurde mit der Heizvorrichtung in die Basisstufe des Flip-Chip-Bonder gebaut erhitzt, geschmolzen und das PEG begann in den Kanal gesaugt. Die Kamera-Ansicht erlaubt es uns, die Docht Prozess zu überwachen, bis die PEG den Kanal, whic vollständig gefüllth dauerte ungefähr eine Stunde mit PEG mit einem Molekulargewicht von 10.000 g / mol. Das PEG wurde dann wieder erstarrt und die Sonde und die Versteifungs wurden in der Flip-Chip-Bonder, wie in Fig. 5 gezeigt eingestellt. 9A zeigt eine Draufsicht einer Sonde und Versteifung nach ausgerichtet und befestigt ist, wobei die PEG-Schnittstelle vollständig ausfüllt. 9B zeigt ein Beispiel einer Luftblase in dem PEG ist nicht vorhanden, da eines Teilchens. Der letzte Schritt in der Montage ist die PEG auf der Registerkarte Region über das Kabel Teil der Sonde während der Handhabung hinzuzufügen, für zusätzliche Verstärkung. Da dieser Bereich nicht in die Scheibe eingesteckt wird, ist es akzeptabel, ein größeres Volumen von PEG hier, wie in Fig. 6 gezeigt. Dieses Montageverfahren ist verwendet worden, um verschiedene Formen von Sonden an Versteifungen anzubringen, einschließlich Multi-Schaftvorrichtungen, wie in Fig. 10 gezeigt.
Die in vitro-Agarose-Gel-Test wurde verwendet, um qualitaivEly bewerten verschiedene Parameter wie PEG Molekulargewicht Frist für PEG zu lösen und Versteifung der Geometrie. Mit jeder Kombination von PEG und Versteifungsgeometrie wurde eine bestimmte Zeit für die Auflösung erlaubt. Dann wurde versucht, Extraktion unter Beachtung Sonde Verschiebung in Echtzeit. Wenn die Sonde signifikant (> 200 um) gezogen ohne sichtbare Trenn oder Gleiten relativ zu der Versteifung, schlossen wir, dass das PEG nicht vollständig gelöst. Tabelle 1 zeigt einige repräsentative Ausführungen der PEG-Lösung bei verschiedenen Zeiten und mit unterschiedlichem Molekulargewicht mit einem Versteifungs das ist 6 mm lang und 306 um breit. Eine weitere Beobachtung in nachfolgenden Tests war, dass das Versteifungselement schmaler ist (z. B. 220 &mgr; m) wurde das PEG in kurzer Zeit (weniger als 5 min) gelöst. Dies ist wahrscheinlich, weil die Klebekontaktfläche verringert wurde, und als Ergebnis wurde ein kleineres Volumen von PEG zu lösen. Parameter, die anscheinend nicht beeinflussen PEGAuflösen oder Sondenverdrängung waren Versteifungs Dicke (Dicke von 20 um bis 100 um wurden getestet) und Anzahl der Dochtkanäle (1 vs 3).
Die in-vitro-Test wurde ebenfalls verwendet, um durchschnittliche Sondenverdrängung für eine gegebene Sonde / Versteifungs / Klebstoff-Konfiguration zu quantifizieren. In diesem Beispiel wurde der Test unter Verwendung der in Fig. 7 dargestellten Einführung / Entnahme-Sequenz, wobei die Sonde-Versteifungseinheit in das Agarose-Gel eingesetzt wird, wird das Verbindungsende zu einem nahe gelegenen Oberfläche bewegt wird, wird das PEG auflösen gelassen, und die Versteifung schließlich extrahiert Verlassen der Sonde an Ort und Stelle. Der Versuchsaufbau in Abbildung 8 zeigt die Sonde-Versteifungseinheit auf den Mikromanipulator Arm befestigt und über das Gel positioniert. Das Referenzbezugsmarkierung war ein kleines Glas-Chip mit einer Anordnung von Goldpunkte gegen die Acryl-Box in das Sichtfeld der digitalen Mikroskop gelegt.
Die Geräte waren in diesem Beispiel etwa 10 um dick und 536 um breit mit acht 100-Mikrometer Durchmesser Elektroden. Die Spuren bestand aus einer Ti-Au-Ti-Metallstapel. Die Silizium-Versteifung war 220 um breit, 6 mm lang und 50 um dick. Die Sonde-Versteifungseinheit wurde ca. 5 mm in das Gel eingelegt. Abbildung 11 zeigt Schnappschüsse vor und nach der Extraktion einer Versteifung von einem Sondenanordnung, die in Agarose-Gel getestet wurde. Die Licht Gold Merkmale in den Bildern sind von der Referenzbezugs und wurden als Referenzmerkmale verwendet werden, um die Bilder zueinander auszurichten. Der bekannte Abstand zwischen den Elektroden (200 &mgr; m) wurde verwendet, um die Pixelgröße zu kalibrieren, da diese Abmessung weniger empfindlich auf Schwankungen in dem Herstellungsprozess. Die Netto-Sonde Verschiebung aufgrund der Versteifung Extraktion wurde auf 28 ± 9 um sein (Mittelwert ± Standardabweichung, n = 5).
Bisher hat das vorgeschlagene Verfahren auf eine tatsächliche ausgedehnt imal Operation mehrmals, um eine Sonde in eine Ratte Cortex implantieren. Nach der Montage der Sonde und 50 &mgr; m dicken Versteifungs wurden in EtOH bei Raumtemperatur sterilisiert. Das Einsetzen und Heraus wurden mit einem Mikromanipulator mit einem stereotaktischen Rahmen befestigt durchgeführt. Die Sonde-Versteifungseinheit wurde bei 0,13 mm / s ca. 4 mm in der Hirnrinde der Ratte eingeführt. Nach 15 Minuten wurde die Versteifung extrahiert, so dass die Sonde an Ort und Stelle. Nach Erholung von der Operation, neuronale Aufnahmen, wie in Fig. 12 gezeigt, wurden erfolgreich aus dem wachen Tier Nachweis der Durchführbarkeit dieses Verfahrens in Echt Operationen 23 erhalten. Diese Implantationstechnik wurde ebenfalls verwendet, um in vivo-Aufnahmen mit beidseitigen Elektroden-Arrays, die auf der Vorder-und Rückseiten haben zu erhalten, wie in Fig. 13 gezeigt.
pload/50609/50609fig1.jpg "/>
Fig. 1 ist. Schematische Darstellung einer typischen neuronalen Sonde und der Versteifung vorgeschlagen. Eine typische Dünnfilm-Polymer Sonde hat eine oder mehrere Elektroden an der Sonde Ende. Metallspuren von den Elektroden verlaufen entlang der Länge des Kabelabschnitts und auf einer Unterlage, die mit einem elektrischen Verbinder angebracht ist, zu beenden. Die Versteifung Länge (in diesem Fall etwa 10 mm) von der Einschubtiefe der Sonde, und eine größere Lasche an der Aussteifung ermöglicht Handhabung. (Bild mit freundlicher Genehmigung Diana George)
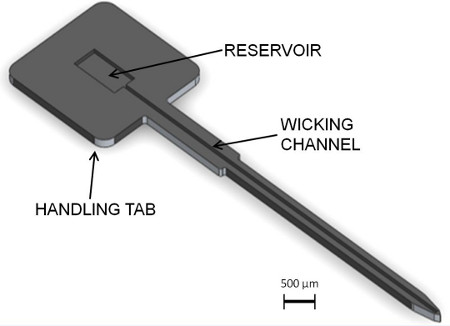
2. Stiffener Design-Details. Eine Dochtkanal nutzt Kapillarwirkung eine flüssige Klebstoff, der in den Behälter aufgebracht worden ist, zu verteilen. Das Reservoir ist auf einer breiteren Registerkarte Region, die Handhabung erleichtert. (Bild mit freundlicher Genehmigung Diana George)

3. Herstellungssequenz für Silizium Versteifung. Die Silizium Versteifung auf einem Silizium-auf-Isolator (SOI)-Wafer (A) hergestellt. Zuerst werden die Dochtkanäle trocken geätzt unter Verwendung des Standard Bosch-Verfahren (B). Als nächstes wird die Versteifungsgeometrie wird durch eine Ätzung, die länger anhält definiert auf der vergrabenen Oxidschicht (C). Schließlich werden die Versteifungen durch Nass-Ätzen der vergrabenen Oxidschicht in 49% Fluorwasserstoffsäure (D) freigegeben.

4. Polyethylenglykol in der Versteifungs Reservoir. Ein plättchen von Polyethylenglykol in dem Reservoir der Versteifung angeordnet ist. Einmal erhitzt, wird es schmelzen, füllen Sie den Behälter und Flussin die Dochtkanal.

5. Schematische Darstellung der Flip-Chip-Bonden. Die Versteifung ist mit dem Kanal nach unten durch ein Vakuum auf der Werkzeugkopf der Flip-Chip-Bonder statt. Das neuronale Sonde liegt auf der Basisstufe nach unten zeigen.

6. Polyethylenglykol auf Versteifung Registerkarte. Extra-Polyethylenglykol ist großzügig auf der Registerkarte der Versteifung als Verstärkung eingesetzt. Der Kabelabschnitt aus einem Polyimid-Sonde auf der Oberseite des Versteifungs sichtbar.

Abbildung 7. Schematische Darstellung der inEinfügungs und Extraktionssequenz. A) Die Sonde-Versteifungseinheit wird mit dem Mikromanipulator. B) Das Verbindungsende zu einem nahe gelegenen Oberfläche bewegt in das Gewebe eingeführt. C) PBS gelten für PEG auf der Registerkarte der Versteifung. D) Die Versteifung extrahiert auflösen, so dass die Sonde in das Ziel.

Abbildung 8. In-vitro-Test einrichten. Die bis zum Testen und Einführen der Sonde Versteifung Extraktion in 0,6% Agarose-Gel in phosphatgepufferter Kochsalzlösung gesetzt. Die Sonde-Versteifungsanordnung mit dem Mikromanipulator Arm befestigt ist und über das Gel in der Nähe der Zielreferenzbezugsmarkierung angeordnet ist. Ein digitales Mikroskop wird verwendet, um die Sonde und Versteifung im Agarosegel beobachten.

Abbildung 9. Sonde an Versteifung geklebt. A) Draufsicht auf eine Sonde zu einem Versteifung mit guter Ausrichtung und vollständige Klebe Abdeckung. B) Ein Beispiel für eine Lücke in der Klebstoffabdeckung durch ein Teilchen angebracht.

Abbildung 10. Beispiel einer Mehrsondenschaft. Die vorgeschlagene Montageprozess wurde verwendet, um dieses Viersondenschaft zu einer passenden Silizium Versteifungs befestigen.

Abbildung 11. Beispiel Versteifung Extraktionsergebnisse. Snapshots von vor (oben) und nach (unten) Versteifung Extraktion mit einem Dünnfilm-Polyimid-Sonde in Agarose-Gel. Die Lichtpunkte sind auf Goldder Referenzbezugs und werden als Referenzmerkmale verwendet werden, um die Bilder zu vergleichen und zu messen Sonde Verschiebung. Die geschätzte Verschiebung der Sonde 28 ± 9 &mgr; m (Mittelwert ± Standardabweichung, n = 5).
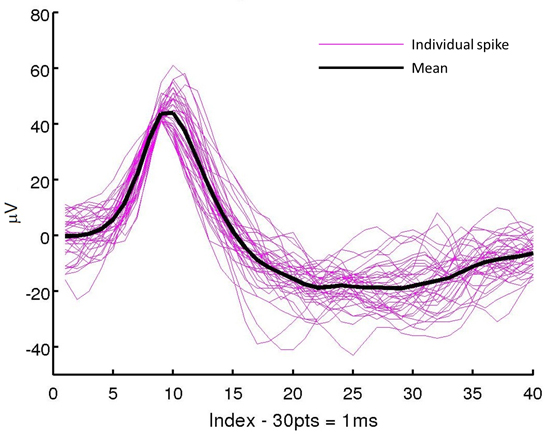
Abbildung 12. Beispiel physiologische Aufnahmen. Diese einzelnes Neuron Spikes wurden aus einer flexiblen Mikrosonde mit einem abnehmbaren Versteifung wie in diesem Protokoll beschrieben implantiert erhalten.

Abbildung 13. LFP-Aufnahmen aus einer doppelseitig Sonde. Insertion mit einer entfernbaren Versteifungs aktiviert Testen einer flexiblen Anordnung, die Elektroden auf der Vorder-und Rückfläche hat. Diese LFP-Aufnahmen gezeigt, comparable Elektrodenleistung auf beiden Seiten nach der Implantation.
| PEG aufgelöst nach: | |||||
| Sondenlänge (mm) | Stiffener Breite (um) | PEG-Molekulargewicht (g / mol) | 10 min | 15 min | 30 min |
| 6 | 306 | 6000 | ja | ja | |
| 10.000 | ja | ||||
| 20.000 | nicht | ja | |||
Tabelle 1. PEG Auflösungszeit in 0,6% Agarose-Gel. Beobachtungen beim Auflösen von PEG mit verschiedenen Molekulargewichtenverwendet, um eine flexible Sonde an ein Silicium Versteifung anzubringen, nachdem verschiedene Mengen an Zeit.
Diskussion
Die hier beschriebene Methode bietet eine gut kontrollierten Prozess zu Dünnfilm-Polymersonden separate Versteifungen mit einem biodissolvable Klebstoff befestigen. Auch dargestellt ist die empfohlene chirurgischen Prozedur, um diese abnehmbar Steifen und ein Verfahren, das Verfahren in vitro für eine bestimmte Sondenversteifungs Konfiguration validieren implementieren. Da kann die Versteifung beliebig starr gemacht werden kann, kann das Verfahren Einführen relativ lange Sonden (> 3 mm) zu erleichtern. So wird erwartet, dass die Einfügung Methode, um eine Technologie für Anwendungen in der tiefen Hirnstimulation (DBS), Rückenmarkstimulation und peripheren Nerven-Schnittstellen sein.
Die neuartige Versteifung mit einem Dochtkanal und dem Flip-Chip-Montageprozess basierend eignen sich für verschiedene Materialien und Sondenanordnungen. Geometrisch ist die Versteifung nicht die Sonde Grundfläche übereinstimmen und können beispielsweise schmaler als die Sonde. Die Dicke der STI ffener kann ebenfalls variieren. Während wir eine Versteifung aus Silizium, mit anderen Materialien beschrieben, kann es möglich sein, wünschenswerte mechanische Eigenschaften für bestimmte Anwendungen zu erreichen. Der Montageprozess ist auch für andere Arten von flüssigem Klebstoff. PEG ist wegen seiner Fähigkeit, mehrfach wieder eingeschmolzen und verfestigt werden, besonders leicht zu verarbeiten. Im Fall von anderen Flüssigklebstoffe, die nicht über diese Eigenschaft, muss die Montagereihenfolge geändert werden. Es ist möglich, ein unterschiedliches Molekulargewicht des PEG verwenden. Ein höheres Molekulargewicht wird länger dauern, sich aufzulösen, was während der Operation wünschenswert sein kann. Der Kontaktbereich zwischen der Sonde und Versteifung wirkt sich auch auf die benötigte Zeit, um den Klebstoff nach dem Einführen der Sonde lösen. Es wird empfohlen, dass die Sonde-Versteifungs Konfiguration mit dem gewählten Molekulargewicht, wie in Abschnitt 3 beschrieben, die erforderliche Zeit, um den Klebstoff zu lösen Charakterisierung in vitro getestet werden.
_content "> Wir haben festgestellt, dass gerade die Steuerung der Extraktion Geschwindigkeit ist entscheidend für das Extrahieren der Versteifung mit minimalen Sondenverdrängung. Genauer gesagt, eine erste schnelle Bewegung hilft, um die Haftreibung zu überwinden und trennen die Versteifung von der Sonde. Danach den Rest der Extraktion kann mit einer langsameren Geschwindigkeit mit vernachlässigbaren zusätzlichen Sondenverdrängung abgeschlossen werden, wie in der Agarose-Gel-Test beobachtet. Viele Neuro Laboratorien KOPF stereotaktischen Systemen, und es ist ein motorisierter mircopositioner Modul KOPF (z. B. Modell 2662), die zu diesen Systemen zugesetzt werden können. Wir haben uns für einen Motorantrieb Newport weil es ähnlich dynamische Leistung, war aber weniger teuer und hatte mehr flexible Drehzahlsteuerung. (Es war notwendig, eine einfache Halterung, um den Antrieb zu unserem Mikropositioniersystemes befestigen herzustellen.) Die KOPF-System kann zwei Extraktions gelten Wie das Protokoll von uns entwickelte Geschwindigkeiten., die maximale Geschwindigkeit der KOPF Aktuator jedoch 4 mm / sec, währendverwendeten wir 5 mm / s für die erste Verschiebung mit der Newport Antrieb.Während der in-vitro-und in vivo-Tests wurde die Einführung der Sonde-Versteifungseinheit mit einem manuell angetriebenen Mikromanipulators oder eines motorisierten Mikromanipulator ausgeführt entweder mit Geschwindigkeiten von 0,13 bis 0,5 mm / sec. Keine Beschädigung oder Delaminierung der Probe wurde beobachtet. Höhere Setzgeschwindigkeiten wurden nicht untersucht, um das Risiko einer Beschädigung der Sonde-Versteifungseinheit zu bestimmen.
Änderungen an der Insertion / Extraktionsverfahren sind im Gange der Prozess robuster zu machen. Insbesondere ist ein sehr sensibler Schritt bewegen Sie den Stecker Ende der Sonde aus der Mikromanipulator auf einem nahe gelegenen Oberfläche. Es besteht ein Risiko in diesem Schritt die Sonde zu stören, bevor sie gesichert wurde. Es ist auch möglich, dass die Biegung in dem Kabel Belastung des eingeführten Abschnitts der Sonde zu bewirken, was zu unbeabsichtigten Verschiebung der SondeVersteifung nach Extraktion. Derzeit werden diese Risiken durch Verwendung einer Sonde mit einem Kabel, das mindestens 2,5 cm lang ist gemildert. Jedoch ist es erwünscht, dass der Einsetz / Herausziehprozess vom Sonde ausgebildet sein. Änderungen an der Mikromanipulator Werkzeugende oder der Zusatz der Inszenierung Armaturen, die vorübergehend unterstützen kann den Stecker wird wahrscheinlich damit mehr zuverlässige Extraktion der Versteifung.
Es gibt einige offene Fragen, die zukünftige Studien, die sich von dieser Methode führen könnte. Zuerst, während der 0,6%-igen Agarosegel, sofern die am besten in vitro Hirngewebe Surrogat bekannt und erlaubt Abbildungsanalyse Sondenverdrängung, ist es nicht genau Hirngewebe replizieren. Studien sind nötig, um Lage und Verschiebung der Sonde in vivo zu untersuchen. Zweitens wird die langfristige Implantation und histologische Tests erforderlich, um Vorteile der flexiblen Sonde mit einem abnehmbaren Versteifung quantifizieren. Solche Studien könnten die Theorie zu untersuchendass Compliance-Sonde reduziert Mikrobewegungen und erweitert Elektrodenleistung. Schließlich wäre es vorteilhaft, um genauer zu charakterisieren Abbaugeschwindigkeit des PEG. Dies könnte zu einer besseren Abstimmung der Lösungszeiten für bestimmte chirurgische Bedürfnissen zu unterstützen. Solche Messungen können auch quantifizieren, wie lange das gelöste PEG verbleibt zwischen der Sonde und der Versteifung, was wichtig ist, da die hydrophile Natur des PEG erleichtert die Extraktion der Versteifung.
Offenlegungen
Die Autoren haben keine finanziellen Interessen konkurrieren.
Danksagungen
Diese Arbeit wurde von NIH NIDCD Y1-DC-8002 bis 01 unterstützt. Diese Arbeit wurde unter der Schirmherrschaft des US-Department of Energy von Lawrence Livermore National Laboratory unter Vertrag DE-AC52-07NA27344 durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Polyethylene glycol, 10,000 g/mol | Sigma Aldrich | 309028 | |
| Agarose | Sigma Aldrich | A9539 | |
| Flexible Sub-micron Die Bonder | Finetech | Fineplacer lambda | |
| Micromanipulator | KOPF | 1760-61 | |
| Digital Microscope | Hirox | KH-7700 | |
| Dual Illumination Revolver Zoom Lens | Hirox | MXG-2500REZ | |
| Precision Motorized Actuator | Newport | LTA-HS | w/ CONEX-CC controller |
Referenzen
- Polikov, V., Tresco, P., Reichert, W. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).
- Lee, Y. T., Hitchcock, R. W., Bridge, M. J., Tresco, P. A. Chronic response of adult rat brain tissue to implants anchored to the skull. Biomaterials. 25 (12), 2229-2237 (2004).
- Subbaroyan, J., Martic, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2, 103-113 (2005).
- Lacour Sun, Y., S,, et al. Assessment of the biocompatibility of photosensitive polyimide for implantable medical device use. Journal of Biomedical Materials Research A. 90 (3), 648-655 (2009).
- Kipke, D. R., Pellinen, D. S., Vetter, R. J. Advanced neural implants using thin-film polymers. IEEE International Symposium on Circuits and Systems. 4, 173-176 (2002).
- Mercanzini, A., Cheung, K., et al. Demonstration of cortical recording using novel flexible polymer neural probes. Sensors and Actuators A. 143, 90-96 (2008).
- Stieglitz, T. Flexible biomedical microdevices with double-sided electrode arrangements for neural applications. Sensor and Actuators A. 90, 203-211 (2001).
- Tooker, A., Tolosa, V., Shah, K. G., Sheth, H., Felix, S., Delima, T., Pannu, S. Polymer neural interface with dual-sided electrodes for neural stimulation and recording. Proceedings of the International Conference of the Engineering in Medicine and Biology Society. , 5999-6002 (2012).
- Parylene microprobes with engineered stiffness and shape for improved insertion. Egert, D., Peterson, R. L., Najafi, K. Proceedings of Transducers '11, Beijing, China, , (2011).
- Lee, K. -K., He, J., et al. Polyimide-based intracortical neural implant with improved structural stiffness. Journal of Micromechanics and Microengineering. 14, 32-37 (2004).
- Takeuchi, S., Ziegler, D., et al. Parylene flexible neural probes integrated with microfluidic channels. Lab On A Chip. 5, 519-523 (2005).
- Improving mechanical stiffness of coated benzocyclobutene (bcb) based neural implant. Singh, A., Zhu, H., He, J. Proceeding of the International Conference of the Engineering in Medicine and Biology Society, , 4298-4301 (2004).
- Lewitus, D., Smith, K. L., et al. Ultrafast resorbing polymers for use as carriers for cortical neural probes. Acta Biomaterialia. 7, 2483-2491 (2011).
- An ultra-compliant, scalable neural probe with molded biodissolvable delivery vehicle. Gilgunn, P. J., Khilwani, R., et al. Proceedings of the 2012 IEEE 25th International Conference on Micro Electro Mechanical Systems (MEMS), , 56-59 (2012).
- Ware, T., Simon, D., et al. Fabrication of responsive, softening neural interfaces. Advanced Functional Materials. 22 (16), 3470-3479 (2012).
- Harris, J. P., Capadona, J. R., et al. Mechanically adaptive intracortical implants improve the proximity of neuronal cell bodies. Journal of Neural Engineering. 8, 1-13 (2011).
- Kozai, T. D. Y., Kipke, D. R. Insertion shuttle with carboxyl terminated self-assembled monolayer coatings for implanting flexible polymer neural probes in the brain. Journal of Neuroscience Methods. 184 (2), 199-205 (2009).
- Bjugstad, K. B., Lampe, D. S., Kern, D. S., Mahoney, M. Biocompatibility of poly(ethylene glycol)-based hydrogels in the brain: An analysis of the glial response across space and time. Journal of Biomedical Materials Research Part A. 95 (1), 79-91 (2010).
- Greenwalk, R. B., Choe, Y. H., McGuire, J., Conover, C. D. Effective drug delivery by pegylated drug conjugates. Advanced Drug Delivery Reviews. 55 (2), 217-250 (2003).
- Effects of adsorbed proteins and an antifouling agent on the impedance of silicon-based neural microelectrodes. Sommakia, S. S., Rickus, J. L., Otto, K. J. Proceedings of the 31st Annual IEEE EMBC International Conference, , 7139-7142 (2009).
- Gage, G. J., Stoetzner, C. R., Richner, T., Brodnick, S. K., Williams, J. C., Kipke, D. R. Surgical Implantation of Chronic Neural Electrodes for Recording Single Unit Activity and Electrocorticographic Signals. J. Vis. Exp. (60), e3565(2012).
- Chen, Z. -J., Gillies, G. T., et al. A realistic brain tissue phantom for intraparenchymal infusion studies. Journal of Neurosurgery. 101 (2), 314-322 (2004).
- Removable silicon insertion stiffeners for neural probes using polyethylene glycol as a biodissolvable adhesive. Felix, S., Shah, K. G., George, D., Tolosa, V., Tooker, A., Sheth, H., Delima, T., Pannu, S. Proceedings of the International Conference of the Engineering in Medicine and Biology Society, , 871-874 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten