Method Article
で逃避行動のOptogenetic刺激
要約
遺伝的にコードされoptogeneticツール内の特定の神経細胞の非侵襲的な操作を可能にショウジョウバエ脳。このようなツールは、そのアクティベーション、特定の行動を誘発または抑制するのに十分である神経細胞を識別することができます。ここでは、自由に歩いてハエの標的ニューロンに発現しているChannelrhodopsin2を活性化するための方法を提案する。
要約
遺伝的にコードされたツールの数が増えてキイロショウジョウバエ 1における特定のニューロンの神経活動の非侵襲的な操作を可能にすることを利用可能になっています。これらの中で最も重要なのはそのままで特定のニューロンの活性化またはサイレンシングを有効にして、自由に明るい光を用いて動物を移動optogeneticツールです。 Channelrhodopsin(ChR2)は青色光によって活性化されると、それを表現するニューロンの脱分極を引き起こし、光活性化陽イオンチャネルである。 ChR2は、CO 2の回避、口先拡張と巨大な繊維媒介驚愕反応2月4日などの特定の行動のための重要な神経細胞を同定するために有効であった。しかしながら、また、ChR2を刺激する光受容体を刺激するために使用される強烈な光源として、これらoptogenetic技術は以前に視覚システムで使用されていない。ここで、我々はデモに光情報伝達を阻害する変異を有するoptogeneticアプローチを組み合わせるハエの視葉は、FOMA-1ニューロンにおける織機敏感なニューロンのクラスターの活性化をnstrate、衝突を回避するために使用されるエスケープ動作を駆動することができます。我々は盲目の飛んでもフォマ-1にChR2の発現を駆動するためにGAL4-UASは転写活性化システムを使用してレンダリングするnorpA遺伝子によってコードされたホスホリパーゼC-β、、、光情報伝達カスケードの重要なコンポーネントのヌル対立遺伝子を用いニューロン。個々のハエは、青色LEDに囲まれた小さなプラットフォーム上に配置されています。 LEDが点灯しているときに、視覚的に駆動織機逃避行動と同様に、飛行中に素早く離陸飛ぶ。我々は、この技術が簡単に自由に飛んで移動中に他の行動を調べるように適合させることができると信じています。
概要
遺伝的にコードされたツールの成長武器は、 キイロショウジョウバエの 1で、特定の細胞の神経活動を操作するために開発されてきた。これらのツールは、無傷で自由に移動する動物の特定の神経細胞の非侵襲的な活性化またはサイレンシングを有効にしてください。それは時間的に制御し、迅速に誘導することができるので、これらのうち、Channelrhodopsin2(ChR2)、光活性化陽イオンチャネルは、重要な利点を提供しています。時急行ChR2それらが急速に脱分極および3-5高架発射速度を示す明るい青色(470 nm)の光にさらされていることをニューロン。自由に移動する動物における特定のニューロンのような標的と活性化は、CO 2の回避3、口吻伸展2,4、および巨大な繊維媒介驚愕応答4などの行動のための特定のニューロンの十分性を明らかにした。しかし、ChR2を刺激するために必要な強烈な光源としてもオペアンプを適用し、光受容体を刺激する視覚系にtogenetic技術が限られていました。光情報伝達を阻害する変異を有するoptogeneticアプローチを組み合わせることで、我々はハエの視葉のニューロンの特定のクラスターの活性化が衝突6を避けるために使用されるエスケープ動作を駆動することができることを実証した。
ほとんどが、すべてではありませんが、視覚的な動物が近づいてくるオブジェクトとの衝突を避けるために逃避行動を示す。迫り来る衝突が表示されたときに、ハエを歩いたり、静止した、離れて対向衝突7月9日から、飛行中に離陸。これらの離陸は離陸と不安定な飛行軌道10,11の前に隆起した翼によって特徴付けられる。この応答は、巨大な繊維媒介驚愕反応、隆起した翼が付いていませんジャンプとは区別され、通常は自由落下転倒4,9になる。 uniquアール視葉、FOMA-1ニューロンで織機感受性ニューロンの特定のクラスタを特定したエリーが近づいてオブジェクトをエンコードするように調整され、我々はハエの織機の逃避行動への関与を調べるためにしようとした。ここでは、選択的に、これらのニューロンを活性化し、ハエの逃避行動を誘発するoptogeneticsの使用例を示します。
我々は、FOMA-1ニューロンでChR2の発現を駆動するためにGAL4-UASの転写活性化システムを使用しています。 ChR2は補因子は全トランスレチナールが必要であり、これはショウジョウバエ中枢神経系における低レベルで検出されたとしてそれはハエの食事で補わなければなりません。明るい光がChR2を活性化するために使用し、ハエが強い走光の挙動を示すされている3,4のように12、我々は、刺激に対する視覚反応の可能性を排除するように努めた。これを行うには、我々は、光情報伝達カスケードの重要なコンポーネントで、ホスホリパーゼC-βをコードしてnorpA遺伝子のヌル対立遺伝子のホモ接合体変異た動物を使用していました。このような変異ハエにおける光受容体は責任することができませんdは13を点灯させる。エスケープ応答のoptogenetic刺激をテストするために、我々は1つのフライを隔離し、明るい青い光でそれを入浴する必要があります。これを行うには、我々は、ピペットチップ内の個々のハエを配置します。一つのピペットチップは、フライがgeotactically長方形のプラットフォーム上にチップと外を歩いていくようなカスタムホルダーに置かれます。ハエが自由にこのプラットフォームの上に歩くことができる。プラットフォームは、そのプラットフォームの上に焦点を当てた4つの青いLEDアレイ、それぞれ含む3つのLEDに囲まれています。ハエがプラットフォーム上に準備したら、LEDが点灯していると、フライの応答は、高速度カメラ6を使用して記録されます。
プロトコル
1。 Channelrhodopsinハエを生成
- あなたが選んだのGal4ドライバーとクロスUAS-ChR2ハエは、我々は視葉では、FOMA-1ニューロンに発現しているG105-GAL4を使用しています。
- 青色光刺激に対する視覚反応の可能性を排除するには、両方のフライラインはAW + norpA背景にあります。
- 最終結果:W + norpA; G105-Gal4/UAS-ChR2 +
- 大人が孵化するの便を運行する航空会社の後、行動分析を実行する前に、3日間、10μM全トランスレチナール(ChR2ために必要な補因子)と光から保護を補った生鮮食品、上で選択しメスを入れた。
2。 10μMのオールトランスレチナール強化食品を作る
- 20mMのは網膜なるように95%エタノール17.6ミリリットルの全トランスレチナール100mgを溶解します。全トランスレチナールは、すべての回で光から保護しておく。
- 電子レンジで標準のコーンミールフライ食品を溶かし、触ると暖かくなるまで冷ます。
- 20mMの50μlを混ぜるフライ食品10mlのバイアルに全トランスレチナール。
- バイアルが冷却し、光から保護しておくましょう。
3。機器
- ピペットチップ:標準千μlのピペットチップは〜2.25ミリメートルの細孔径を作成し、先端付近にカットされています。
- プラットフォーム( 図1を参照)。
- デルリンベース、17センチ×25センチメートルは、¼ "NPTクーラントホースコネクタに合わせて、各角にネジ穴を使用して構築されました。
- デルリンから作られた縦型ホルダは、ベースの中央に取り付けられています。全体の寸法は、X 40ミリメートルX 65ミリメートル(幅×奥行き×高さ)25 mmである。 10mm幅の溝は下部のつまみねじで、ホルダーの長さを実行します。プラットフォームは、ホルダの上部に取り付けられたホルダの溝に整列さ3.5ミリメートル径の穴と25ミリメートル×40ミリメートル×10ミリメートル、されています。
- LEDアレイ( 図1を参照)。
- クーラントホースの4つのアームは、約18センチ、プラットフォームBASに貼付されているクーラントホースコネクタを使用して、e。クーラントホースは、構造的なサポートとしてのみ使用され、冷却目的のために使用されていません。
- 適切に等間隔溝は各アームの先端に固定するために、各アームのヒートシンクをつけ込まれることクーラントの最後のピースにカットされています。
- 青色LED反乱トライスターはプレカット熱接着テープを使用して、それぞれのヒートシンクに取り付けられている。 Carclo 18°トライレンズがそれぞれトライスターに貼付されています。
- LEDのトライスターがBuckPuck DCのドライバと指定どおりに電源に配線されています。我々は、各BuckPuck直列に2トライスターに電力を供給するとのセットアップを配置している。
- すべての4つのLEDがトライスターの照明は700 mAでは、我々のプラットフォームで713 W / m 2の照度が得られた。
- カメラ:カメラは、小型三脚に取り付けられ、プラットフォームの上に置いています。
4。行動アッセイ
- 簡単に言えば氷の上のハエをanaesthetize。
- 閉じるには、テープを使用して、ピペットチップ内の個々のハエを配置双方は、先端の終了。
- ハエが起こされており、積極的にピペットチップを模索していた後、テープを取り出して、垂直ホルダーの溝にピペットを置く。つまみは、所定の位置にピペットチップを保護するために、チップの底を閉じるために使用されます。
- ハエがピペットチップ(一般に30から60秒)を探るように、ハエがプラットフォームに先端から出てくる直前にカメラの記録を開始します。
- ハエがプラットフォーム上に浮上した後、1から2セコ待ってから、青色LEDの電源をオンにします。ハエが飛行を開始するまで手動で時刻を測定するためにタイマーを使用します。
結果
ブラインドはどちらChR2または単独G105ドライバ明るい青色光と、その照明に続いて離陸率の低さを示してを表現飛ぶ。ブラインドは、これらのテイクオフは青色光ではなく、自発的な照明によるものであったことを示唆しているにかかわらず、照明( 図2)の離陸の同じ割合を示し飛ぶ。 ChR2がFoma1ニューロンに発現しているときは、しかし、青色光による照明は、エスケープ応答を誘発する。テストしたハエの50%以上は、照明の1秒以内に離陸し、5秒以内に75%( 図2)。対照的に、対照ハエのわずか10%は、1秒以内に離陸し、5秒以内に20パーセント。 G105のドライバは、FOMA-1ニューロンとキノコ体のγ-葉の両方で表現されるように、我々は特に付加的な制御としてキノコ体(201Y-GAL4)のこの部分で表現ドライバを使用していました。これらのハエは、( 図2を実行し 、他のコントロールと同様に、離陸の速度を示した)、FOMA-1ニューロンのoptogenetic活性化はエスケープ応答を誘発したことを具体的に示す。
optogenetically誘導される応答の毎秒200フレームで撮影した高速イメージングは、これらの応答は織機誘発逃避行動( 図3)と同様であったことを明らかにした。すなわち、飛ぶ撮影の90%は(n = 30)が6テイクオフの前に彼らの翼を上げた。さらに、その後の飛行軌道は、ハエの体が多少垂直方向( 図3)であることと、離陸10自発的よりも安定であったが、巨大な繊維媒介応答9よりも安定。
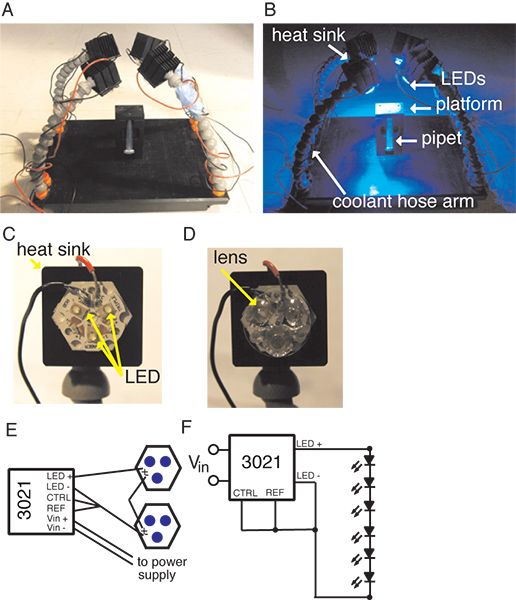
図1:実験的垂直ホルダーおよびそれらに貼付LEDアレイとヒートシンクを保持アームをつけ込まれること4クーラントとプラットフォームを示すセットアップ。 A周囲の照明の下で、セットアップ。 LEDが点灯しているセットアップA、B、。 C言語、ヒートシンク上のLEDトライスターの拡大図。 D、トライレンズが添付されたトライスターのクローズアップ。 E、BuckpuckドライバとLED回路の概略。 F、BuckPuckとLED回路の回路図。
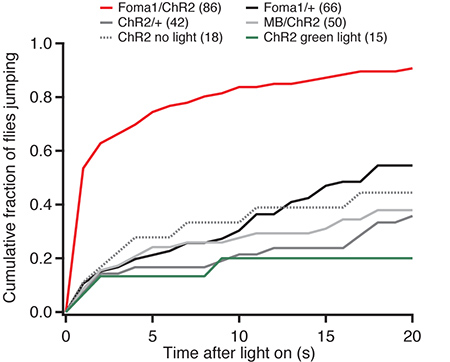
図2:実験群と対照フライラインのエスケープジャンプの時の累積ヒストグラム。すべてのハエ急行W + norpAそれらは視覚的に盲目にレンダリングする。 "FOMA-1"ハエはG105-GAL4ドライバーを持って、 "MB"ハエはキノコ体の発現を駆動201Y-GAL4ドライバーを持っています。

図3 ChR2誘発エスケープ応答の高速ビデオフレーム。フレームはシークエントに番号が付けられiallyフレームとの間に5ミリ秒である。
ディスカッション
私達は明るい青い光でハエを歩いて自由に入浴することによってエスケープ行動のoptogenetic刺激を実証している。このアプローチは、簡単に自由に歩くハエに他の行動を調べるために適合させることができ、単純に我々はより大きな面積で使用されるLEDアレイをタイリングすることにより、より広いプラットフォームにスケーリングすることができます。私たちが説明する安価なカメラのどちらかを使用して、または利用可能な他のカメラシステムは、ユーザーがフレームレートや金利の挙動に合わせて取得された画像の空間分解能を調整することができます。青色LEDは、カメラ用の照明だけでなく、ChR2のアクティベーションを提供するようにさらに、当社のイメージングは、LEDが点灯している時間後に制限されています。これが私たちの行動には十分ですが、それ以前のLED照明へ飛ぶの位置や動きを記録する必要がある場合には、カメラの適切なフィルタリングと組み合わせる赤外線範囲の信号を提供する追加の光源は、組み込むことができる。
_contentは "> Optogeneticsが広く神経活動を操作するための非侵襲的な方法として歓迎されていますしかし、この手法は、視覚的な経路を活性化するでしょうChR2をアクティブにするために使用される光などの視覚システムに主に使用不能となっています。さらに、optogeneticsの使用非視覚的な挙動を調べるためにも明るい光にハエの走光応答によって妨げられる可能性があります。視覚的に失明しているnorpAハエの使用は、私たちは視覚系にoptogeneticツールを使用することができ、他の行動を曖昧にするから走光性を防ぐことができます。このプロトコルは、ChR2はハエが全トランスレチナールに供給することを、選択した神経細胞で発現されること、そしてハエが明るい青色の光に包まれている必要があります。我々が開発したプロトコルでは、これらの要件を満たしている、まだ完全には最適化されていません。例えば、我々は我々が使用する光の量が必要以上に明るくなるかもしれないと信じており、全トランスレチナールのその濃度が高いほど、あるいはより長いtiを供給私は、離陸の高い率につながる可能性があります。私たちは、体系的に、これらのパラメータを検討していない。
我々はアクティブフォマ-1ニューロンはハエのlobula複合体で発見され、従って、脳の後部表面に近い位置しています。それは光がChR2をアクティブにするには、ハエのキューティクルを貫通なければならないので、この実験の成功は、地表近くにある神経細胞に依存している可能性があります。このように、脳内の深い位置の細胞が正常にこのメソッドを使用してアクティブにすることはできません。
G105ドライバは視葉の両側に5ニューロン、FOMA-1ニューロンのクラスタ内だけでなく、キノコ体のγ-葉のニューロンに発現している。幸いなことに、我々は逃避行動におけるキノコ体ニューロンの役割を排除するための対照実験を行うためのドライバを持っていた。ただし、すべての10フォマ-1の活性化は、ニューロンは、この動作のために必要されているかどうか、または1つまたは2つだけが存在するかどうか特定の細胞が十分であり、この時点で決定することはできません。より具体的なドライバが開発されており、表現を制限するための戦略が交差1,14を精緻化されるように、我々はより高い特異性を持つ神経細胞を標的とすることができることを期待。
クリプトは、概日リズムと青の光に敏感な行動に関与する光受容体である。このプロトコルでは、クリプトクロムはおそらくChR2を刺激するために使用される青色光により活性化される。これは(青色光は、FOMA-1ニューロンでChR2をクリプトをアクティブではなくなるため)制御ハエで観察離陸率の低さなど、ここで観察離陸動作に影響を与えることが表示されないことは密接に取るのレートに一致オフ制御で観察は照明なし時や緑の光(クリプトをアクティブにしませんが)で照らさ飛ぶ。しかし、より直接的にクリプトクロムの影響を受けている他の行動のために、これは問題になるかもしれません。ひとつの潜在的なこれを避けるための改善は黄色、589nmで、光15により活性化される赤方偏channelrhodopsinの使用可能性があります。
私たちの実験では、制御ハエの約10%がLED照明の1秒以内に離陸するような自発的な離陸の低レベルを観察し、5秒以内に13から28パーセント。ハエが効果的に任意の照明なしChR2ならびにハエを活性化しなかった緑色の光で照らされたとき、私たちは離陸のこの同じ速度を観察したように、我々はこれらが自発便ではなく、光誘起離陸だったと信じています。逃避行動にフォマ-1ニューロンのChR2活性化の効果は、したがって、この自発的な活動の上に測定する必要があります。ハエは前にテスト動作の実行にプラットフォームから脱出する場合しかし、離陸を伴わない他の行動に関しては、これは試験終了になることがあります。これらの自発的なエスケープが実験的な不便さを表現する程度はobvioです興味のある行動のスケールでusly依存。
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、スタンフォード·ディーンのフェローシップ(SEJdV)、健康ディレクターズパイオニア賞(TRC DP0035350)、マクナイト財団奨学生賞(TRC)とR01 EY022638(TRC)の国立研究所によって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | |||
| 網膜全トランス | アドバンス科学&ケミカル株式会社 | R3041 | |
| 機器 | |||
| 熱は9.2℃/ Wのシンク | Luxeonstar | LPD30-30B | 高30mm角X 30ミリメートル |
| Carclo 18°トライレンズ | Luxeonstar | 10507 | |
| ブルーRebelはトライスターベースのLED | Luxeonstar | MR-B0030-20T | 470nmと、174 LM @ 700ミリアンペア。 |
| 700ミリアンペアBuckPuck dcドライバ | Luxeonstar | 3021-DE-700 | |
| BuckPuckドライバ用ワイヤーハーネス | Luxeonstar | 3021-HE | |
| プレカット熱接着テープ | Luxeonstar | LXT-S-12 | 20ミリメートル六角ベース |
| スナップ-Locのクーラントホース、¼ "のID | マクマスター - カー | 5307K49 | |
| スナップ-Locのクーラントホースコネクタ | マクマスター - カー | 5307K39 | ¼ "NPTおねじ |
| 実験室グレードスイッチングモードプログラマブルDC電源 | BKプレシジョン | 1698 | |
| EXILIMカメラ | カシオ | EX-FH20 |
参考文献
- Venken, K., Simpson, J., Bellen, H. Genetic manipulations of genes and cells in the nervous system of the fruit fly. Neuron. 72, 202-230 (2011).
- Gordon, M., Scott, K. Motor control in a Drosophila taste circuit. Neuron. 61, 373-384 (2009).
- Suh, G. S. B., et al. Light activation of an innate olfactory avoidance response in Drosophila. Current Biology. 17, 905-908 (2007).
- Zhang, W., Ge, W., Wang, Z. A toolbox for light control of Drosophila behaviors through Channelrhodopsin 2-mediated photoactivation of targeted neurons. European Journal of Neuroscience. 26, 2405-2416 (2007).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Science. 100, 13940-13945 (2003).
- de Vries, S., Clandinin, T. Loom-sensitive neurons link computation to action in the Drosophila visual system. Current Biology. 22, 353-362 (2012).
- Card, G. Escape behaviors in insects. Current Opinion in Neurobiology. 22, 1-7 (2012).
- Card, G., Dickinson, M. H. Visually mediated motor planning in the escape response of Drosophila. Current Biology. 18, 1300-1307 (2008).
- Fotowat, H., Fayyazuddin, A., Bellen, H. J., Gabbiani, F. A novel neuronal pathway for visually guided escape in Drosophila melanogaster. Journal of Neurophysiology. 102, 875-885 (2009).
- Card, G., Dickinson, M. H. Performance trade-offs in the flight initiation of Drosophila melanogaster. The Journal of Experimental Biology. 211, 341-353 (2008).
- Hammond, S., O'Shea, M. Escape flight initiation in the fly. Journal of Comparative Phsyiology A. 193, 471-476 (2007).
- Benzer, S. Behavioral mutants of Drosophila isolated by countercurrent distribution. PNAS. 58, 1112-1119 (1967).
- Bloomquist, B., et al. Isolation of a putative phospholipase C gene of Drosophila, norpA, and its role in phototransduction. Cell. 54, 723-733 (1988).
- Gohl, D., et al. A versatile in vivo system for directed dissection of gene expression patterns. Nature Methods. 8, 231-237 (2011).
- Zhang, F., et al. Red-shifted optogenetic excitation: a tool for fast neural control derived from Volvox cateri. Nature Neuroscience. 11, 631-633 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved