Method Article
電気刺激のマウス筋芽細胞前駆細胞およびアプリケーションからの工学骨格筋組織
要約
仕組まれた筋肉組織は、疾患モデルとして、また肉の代替源として、再生医療における大きな可能性を秘めている。ここでは、マウス筋芽細胞の前駆細胞、及び電気パルスによる刺激からこのケースでは、筋肉の構造物の工学を記述します。
要約
仕組まれた筋肉組織は、褥瘡を勉強するなど、in vitroでの疾患モデルとして、再生医療用や肉代替の1として使用するための組織の生産を含む、いくつかの異なる目的に使用できます。最初に報告された3D筋肉構築物は、何年も前に作られ、分野の先駆者はVandenburghや同僚2,3アールされています。筋肉組織工学の進歩は、生化学的要因、幹細胞や前駆細胞の知識の広大なゲインから結果だけではありませんが、特に、物理的な要因が細胞挙動の制御において重要な役割を果たし、その研究によって得られた洞察に基づいている組織開発。最先端の人工筋肉は、現在セル人口ヒドロゲル構造物で構成されて構築されます。私たちの研究室では、これらは一般的に、C2C12、マイルマウス後肢の筋肉から単離されたマウス筋芽細胞の前駆細胞、又はマウス筋芽細胞株で構成されコラーゲン/マトリゲルの混合物でXEDと2アンカーポイントの間で播種し、筋肉の靭帯を模倣する。他のセルは、同様にそのようなL6ラット筋芽細胞4、新生児筋由来前駆細胞は5、そのような人間の6あるいは誘導多能性幹細胞(iPS細胞)7などの他の種由来の成体筋組織由来の細胞として例えば代替細胞株を考慮することができる。細胞収縮は、構築物8,9と文化の約1週間後の筋前駆細胞の分化の長軸に沿った細胞のアラインメントを引き起こします。また、電気刺激の適用はある程度8への分化のプロセスを向上させることができます。その限られたサイズ(8×2×0.5ミリメートル)のために完全な組織は、 例えば生存、分化、細胞アライメントを監視するために、共焦点顕微鏡を用いて分析することができる。特定のアプリケーションにengineeの要件に応じて赤い筋肉組織は変化するであろう、他の種への肉の代替の翻訳が必要であるとして機能するようにしながら再生医療用など使用は、組織の大きさと血管新生のアップスケーリングが必要になります。
プロトコル
1。マウス筋芽細胞前駆細胞またはC2C12筋細胞の培養
- 当初Sheferら10によって発行されて、後でCollins ら 11とBoonenはら 12によって適応プロトコルに従って細胞を分離し、液体窒素中でこれらを格納します。これは、C57BL / 6 例えば 、マウスを必要とします。代替方法は、 例えばLi Y らによって可視化実験誌に発表された方法では、他のラボで使用されています13。試薬や機器の入力は7ページと8ページの表を参照されます。 1マウスの筋からは、一般的に、液体窒素で約20バイアルを凍結保存するのに十分な細胞を得ることができます。次に、我々は、液体窒素貯蔵から細胞を解凍するためのプロトコルを起動します。
- 25cm 2のマトリゲル(1 mg / ml)でコーティングされた組織培養フラスコに1バイアルから細胞を入れて、から成る増殖培地(GM)(335ミリリットルDMEM高度、100ミリリットル胎児bovinを追加電子血清(FBS)、50ミリリットルのHS、5 mlのペニシリン/ストレプトマイシン、5ミリリットルのL-グルタミン、5mlのニワトリ胚エキス(CEE))。
注:室温で2時間コートと吸引によってマトリゲルを削除します。
- 3日ごとに細胞が約1:3サブカル。
これが意味する:3日目:1 75cm 2フラスコから2 150センチメートル2フラスコ(非コートフラスコでpreplating 30分付)への通路細胞:6日目に75cm 2フラスコに1 25cm 2のからの継代細胞。 1トリプル150センチメートル2フラスコに9日目の転送1 150センチメートル2フラスコに、または3 150センチメートル2フラスコ(必要に応じてpreplateが再び細胞の表現型に依存します)が利用できない場合。 12日目に細胞が筋肉構築物中に播種するための準備が整いました。
注意: -トリプル150センチメートル2当たりの細胞数が約4.5×10 6個の細胞になります。
- を介して使用してください播種時の細胞の混合集団を得るためにそれらをミックスするための別のアイソレーションからのLS。
注:初代培養細胞で機能しないことを選択した場合、C2C12筋芽細胞は良い代替手段です。
2。エンジニアリング骨格筋組織
- "硬化剤"(10:1)を持つ "エラストマー"を混合することにより、シリコン接着剤を準備します。 1三角形の辺(; 図1形状の家のような)とマジックテープの5mm角のセグメント+ / -をカットします。正方形の間に約12mmのスペースで6ウェル培養プレートのウェルに接着剤ベルクロ。
注: -のみベルクロのソフト面を使用し、この面を上に直面しています。
- 屋根がお互いに直面していることを確認してください。
- のみシリコン接着剤でマジックテープをカバーする、うまく全体に接着剤が広がらない。
- 後で電気刺激のためには、よくPLの垂直方向に構造物を揃えるために関連しています(長軸に沿って)食べました。
- 気泡を除去するために主に、加熱されていない、真空オーブンで一晩乾燥させるままにしておきます。 15分間インキュベートしたウェルに70%エタノールを添加することにより滅菌する。 PBSで3回リンスし、15分間UV下で置く。ウェルと使用するまでインキュベーター内ベルクロと場所からすべてのPBSを除去。
- 冷蔵庫にマトリゲルソリューションを解凍し、まもなく3D構造物を作る前に所望の濃度にコラーゲン溶液を調製します。無菌の0.02パーセント酢酸(最終濃度3.2 mg / ml)を持つ株式コラーゲンを希釈します。
注:氷の上のすべてのものを残す。
- GMとカウントに再懸濁した細胞を、トリプシン処理。インキュベーター内で遠心分離チューブに細胞を残す。
- 淡いピンクのcoloまで、このコラーゲン溶液に0.5M NaOHを加えるには、チューブ( 表1によると)にしたい構造物の番号については、コラーゲン原液の所望量を追加rは7.5のpHを示す情報である。とを上下にピペッティングにより穏やかに混合し、バブルが形成されるのを防ぐ。その後、マトリゲルを追加し、優しく、しかし、非常に徹底的に混ぜる。最後に、コラーゲン/マトリゲル混合物(適切な量については表1を参照)にGMを追加します。
注意: -氷の上に各ステップを実行します!マトリゲルおよびコラーゲンは温度の上昇で容易にゲルだろう。
- 色は確かにピンクであることを覚えて! pHの上昇はまた急激なゲル化を誘導する。
- コラーゲンの最終濃度:1.6 mg / mlである。
- 5分間1,000 rpmで細胞の所望量を遠心し、上清を除去する。
注 -構築あたりの細胞数を調整する必要がある細胞の活性に応じて。一般的に、細胞数は、構築物75万の間と125万細胞に位置しています。
- 細胞ペレットを再懸濁するためにゲル混合物の一部を使用そして、残りの混合物中に細胞を移し、よく混ぜますが、気泡を導入することなく。
- インキュベーターとピペットベルクロ第一に、セルゲル混合物の0.35 -0.4 mlの予熱ウェルプレートを取り出します。次に、結合部位間の中心から混合物をピペットとベルクロに拡張し始める。最後に、ベルクロ部分の周りに2つのベルクロアンカーとピペットとの間のギャップを埋めるためにゲルの残りの部分を使用しています。
- ゲルが転送されるのに十分な固体であれば慎重に5〜10分後にチェック、 すなわち優しく料理をタップして、ゲルが剛体であれば視覚的に検査する。もしそうであれば、慎重にインキュベーターに皿を置きます。通常、それらは10分後にピックアップすることができます。その後、1〜2時間後に、優しく温かみのあるGMの4mlで各ゲルを重ねます。
注:-DOプレートを取り扱う際には、任意の活発な動きをしない。
- (増殖培地分化培地でGMを置き換える24時間後)ニワトリ胚エキスを伴うものではなく、2〜3日毎に新鮮な培地と交換してください。 7日目には、溶融筋線維に横紋開発のための染色を評価することができるように、成熟した指向の筋繊維を取得している必要があります。
3。電気的な刺激
- 安全キャビネット内の紫外線の下で、70%エタノール、続いて乾いた、使用前(試薬や機器の表を参照)ionoptixプレートから電極を滅菌する。コンストラクトを培養プレート上に電極とプレートを置き、培養プレートインキュベーターへの転送から蓋で覆う。適切なケーブルを使用して、C-Ionoptixペーサーを接続します。
注:電極は筋肉コンストラクト( 図2)と一緒に平行に配置されている。
- 予想通り刺激プロトコルを適用します。
注:我々は、一般的に、4 V / CMを使用する2Hzの周波数で6msのパルス。刺激中に培地ごとに24時間を変更します。
結果
最終製品は、 図3に示されている筋肉の構成要素となります。組織の大きさは長さ約8ミリメートル、幅2mm、厚さ0.5mmとなります。分化中の電気刺激は、ミオシン重鎖アイソフォームの発現を変更しますが、分化培地8によって誘導されるように大きく分化過程を強化しませんが、電気刺激は、筋肉の機能性をチェックするために、プロセスの終了時に適用することができますなぜなら、完全に発達した筋肉はサルコメアと電気パルスにより収縮することができるようになります。
分化と成熟はまた、筋肉の成熟マーカーまたは組織またはホールマウント染色された組織サンプルから作られたいずれかのセクションに横紋開発(αアクチニン用など染色)の遺伝子発現の評価と染色のために定量的PCRを用いて解析することができます。筋肉の成熟と分化相対TEDの遺伝子とミオシン重鎖の発現は、 例えば MyoDの、ミオゲニン、MFR4とMLP、およびMYH = 1、2、4、8 8が含まれています。実際に形成されている筋肉組織は、電気刺激による筋肉の遺伝子発現に基づいて組織、免疫染色と収縮の誘導であることを証明するものが、以前に8と筋芽細胞の前駆細胞とC2C12細胞から作られた筋肉組織の染色された断面を有する図公開されているこの論文から図4に表示されます。
| ソリューション | μlのボリューム(10筋肉を作る場合) |
| コラーゲン(3.2 mg / mlと、0.02%の酢酸で希釈) | 2570年(51.3%) |
| のNaOH(0.5M) | 10(0.2%) |
| マトリゲル | 430(8.6%) |
| 成長培地 | 2000(39.9%) |
| 合計 | 5010(損失をこぼし、ピペッティングのために十分であれば充分です) |
表1組織工学筋肉の生成のための細胞とゲルの混合物で構成している。

図1。ベルクロの部分をカット。

図2。筋肉の下から撮影した写真は、電極の配置を示す6ウェルプレートのウェル内に構築します。電極は(白矢印)筋肉構築物に平行に配置されている。

図3。組織6ウェル培養プレートでマジックテープの2つの部分の間の筋肉を設計した。
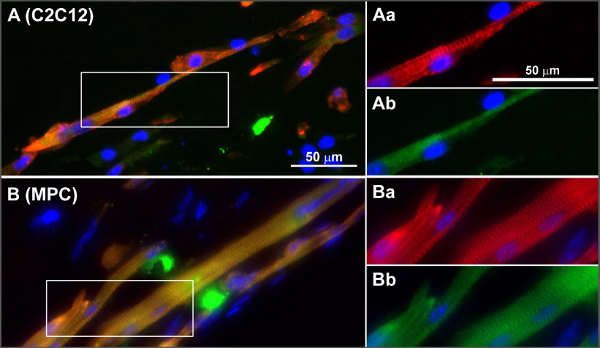
図4。 C2C12筋(A)とMPCでクロス線条の典型的な例は、(B)は、人工骨格筋組織インチ非刺激mBAMs(分化の8日目)の凍結切片をサルコメアα-アクチニン(赤)、サルコメアミオシン(グリーンで染色した)および核(青)。 (A、B)は、α-アクチニンの枠で囲まれたエリア(AA-ABとBa-Bb)の倍率(赤)とサルコメアミオシン(緑)。 8からの許可を得て転載しています拡大図を表示するには、ここをクリックしてください。
ディスカッション
筋肉組織のエンジニアリングは、疾患モデルとして、薬剤スクリーニングのために、再生医療及び食肉生産のために使用するための大きな可能性を秘めている。ただし、これらのアプリケーションのための要件は異なります。コラーゲンは、細胞整列を可能にするため、および以前の2Dの研究12で決定された筋芽細胞の前駆細胞が基底膜由来タンパク質の存在を必要とするため、我々は、コラーゲンやマトリゲルの組み合わせを利用することを選んだ。また、フィブリンゲルは、我々の研究室でテストされ、コラーゲンやマトリゲル™の混合物がないと、特にティッシュコンパクション14につながらないようにしたC2C12筋芽細胞と前駆細胞をサポートしていないように思われてきた。セルライン15を使用している間、ここに説明されているようにモデルが褥瘡の損傷の研究ですでに使用されています。再生医療のアプリケーションでは、人間の衛星細胞への変換は最近6,16を行われている。加えて、肉の消費のための代替ソースとして技術は大きな可能性1を持っています。我々の意見ではしかし、現在の技術では、消費のためだけでなく、診療所での使用を促進するために、次のステージに進める必要があります。例えば、分化は新生児期の周りで停止し、また力の生産は筋肉が生体内で生成するよりもはるかに少ないです。また、農場の動物由来の筋幹細胞の単離、マウス、ラット、ヒト幹細胞を3D構築物に実装することができますが、特に分化と成熟がそこまでまだ1開発されていません。また、マトリゲルと動物由来の血清ニーズの使用は1を省略することができます。再生医学に応用を促進するために、組織のサイズが増加しなければならないし、(ネオ)血管新生と酸素と栄養素の拡散限界を克服するための灌流バイオリアクターシステムを使用する必要があります。小さな構造物Hのいくつかの初期の血管新生研究aveは過去数年9,17,18で行われて。
開示事項
著者らは、開示することは何もない。
謝辞
著者らは、培養するために図2に示す組織をYabin呉に感謝したいと思います、画像はバートバンOverbeekeによって撮影されました。仕事は財政的にSenterNovem、助成金、ISO 42022によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | コメント(オプション) |
| マトリゲル-成長因子低減 | ベクトン·ディッキンソンと | ||
| DMEM(高グルコース)* | ギブコ | 42430 | |
| アドバンストDMEM | ギブコ | 12491 | |
| ウマ血清 | ギブコ | 65050-122 | |
| ウシ胎仔血清 | グライナー | 758075 | |
| 0.45及び0.22μmのシリンジフィルター* | ワットマン(シュライヒャーとScheull) | 10462100 | |
| L-グルタミン酸 | ギブコ | 25030024 | |
| ペニシリン/ストレプトマイシン | ギブコ | 10378016 | |
| アンフォテリシン | ギブコ | 15290-018 | |
| 培養プラスチック | グライナー | 培養フラスコとピペットを含む | |
| ニワトリ胚エキス | 米国生物 | C3500から | |
| パスツールピペット* | Hilgenberg | - 1,1ミリメートル0,9の先端径は230ミリメートル:綿、開口先端Lとくびれのあるパスツールピペット、、 | |
| パスツールピペット* | Hilgenberg | 綿、開口先端Lとくびれとパスツールピペット、、:1,4の先端直径が230ミリメートル - 1.6ミリメートル | |
| パスツールピペット | VWR | 612-1702 | |
| コラゲナーゼI型* | シグマ | C0130-16 | |
| 40μmのセルストレーナー* | BDファルコン | 352340 | |
| 19G針 | |||
| エラストマー | ダウコーニングコーポレーション | 3097358-1004 | シラスティックMDXの#4から4210 |
| 硬化剤 | ダウコーニングコーポレーション | シラスティックMDXの#4から4210 | |
| ベルクロ | 正規店 | あなただけのソフト面を使用し、正規の店でこれを購入することができます | |
| I型コラーゲン、ラットの尾 | BD Biosciences社 | 3544236 | |
| C-PACE EP文化ペーサー | Ionoptix | ||
| 電気刺激のための6ウェル培養皿 | ベックktonディッキンソン·ファルコン | BDファルコン#353846 | |
| C-ディッシュ培養皿電極 | Ionoptix | ||
| *細胞の単離(1.1ポイント)のために必要 #一緒に一つのキットで |
参考文献
- Langelaan, M. L. P., Boonen, K. J. M., Polak, R. B., et al. Meet the new meat: tissue engineered skeletal muscle. Trends Food Sci. Tech. 21 (2), 59-66 (2010).
- Shansky, J., Chromiak, J., Tatto, M., Vandenburgh, H. A simplified method for tissue engineering skeletal muscle organoids in vitro. In Vitro Cell Dev. Biol. Animal. 33 (9), 659-661 (1997).
- Vandenburgh, H., Del Tatto, M., Shansky, J., et al. Tissue-engineered skeletal muscle organoids for reversible gene therapy. Hum. Gene Ther. 7 (17), 2195-2200 (1996).
- Yaffe, D. Retention of differentiation potentialities during prolonged cultivation of myogenic cells. Proc. Natl. Acad. Sci. U.S.A. 61 (2), 477-483 (1968).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J. Cell Biol. 125 (6), 1275-1287 (1994).
- Koning, M., Werker, P. M. N., vander Schaft, D. W. J., Bank, R. A., Harmsen, M. C. MicroRNA-1 and MicroRNA-206 Improve Differentiation Potential of Human Satellite Cells: A Novel Approach for Tissue Engineering of Skeletal Muscle. Tissue Eng. Part A. , (2011).
- Darabi, R., Pan, W., Bosnakovski, D., et al. Functional myogenic engraftment from mouse iPS cells. Stem Cell Rev. 7 (4), 948-957 (2011).
- Langelaan, M. L. P., Boonen, K. J. M., Rosaria-Chak, K. Y., et al. Advanced maturation by electrical stimulation: Differences in response between C2C12 and primary muscle progenitor cells. J. Tissue Eng. Regen. Med. 5 (7), 529-539 (2011).
- van der Schaft, D., van Spreeuwel, A. C., van Assen, H. C., Baaijens, F. Mechanoregulation of vascularization in aligned tissue engineered muscle; a role for VEGF. Tissue Eng. Part A. , (2011).
- Shefer, G., Wleklinski-Lee, M., Yablonka-Reuveni, Z. Skeletal muscle satellite cells can spontaneously enter an alternative mesenchymal pathway. J. Cell. Sci. 117 (Pt. 22), 5393-5404 (2004).
- Collins, C. A., Olsen, I., Zammit, P. S., et al. Stem cell function, self-renewal, and behavioral heterogeneity of cells from the adult muscle satellite cell niche. Cell. 122 (2), 289-301 (2005).
- Boonen, K. J. M., Rosaria-Chak, K. Y., Baaijens, F. P. T., van der Schaft, D. W. J., Post, M. J. Essential environmental cues from the satellite cell niche: optimizing proliferation and differentiation. Am. J. Physiol. Cell Physiol. 296 (6), C1338-C1345 (2009).
- Li, Y., Pan, H., Huard, J. Isolating Stem Cells from Soft Musculoskeletal Tissues. J. Vis. Exp. (41), e2011 (2010).
- Boonen, K. J. M., Langelaan, M. L. P., Polak, R. B., et al. Effects of a combined mechanical stimulation protocol: Value for skeletal muscle tissue engineering. J. Biomech. 43 (8), 1514-1521 (2010).
- Gawlitta, D., Boonen, K. J. M., Oomens, C. W. J., Baaijens, F. P. T., Bouten, C. V. C. The influence of serum-free culture conditions on skeletal muscle differentiation in a tissue-engineered model. Tissue Eng. Part A. 14 (1), 161-171 (2008).
- Koning, M., van Luijn, M., van der Schaft, D. W. J., et al. Human skeletal muscle formation and engraftment In vivo is independent of preconditioning In vitro with HUVEC. , (2013).
- Levenberg, S., Rouwkema, J., Macdonald, M., et al. Engineering vascularized skeletal muscle tissue. Nat. Biotechnol. 23 (7), 879-884 (2005).
- Koffler, J., Kaufman-Francis, K., Yulia, S., et al. Improved vascular organization enhances functional integration of engineered skeletal muscle grafts. Proc. Natl. Acad. Sci. U.S.A. 108 (36), 14789-14794 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved