Method Article
Ingegneria tessuti muscolo scheletrico di cellule murine progenitrici mioblasti e di applicazione di stimolazione elettrica
In questo articolo
Riepilogo
Tessuto muscolare Engineered ha un grande potenziale nel campo della medicina rigenerativa, come modello di malattia e anche come una fonte alternativa per la carne. Qui si descrive la progettazione di un costrutto muscolare, in questo caso da cellule progenitrici mioblasti di topo, e la stimolazione da impulsi elettrici.
Abstract
Tessuti muscolari ingegnerizzati possono essere utilizzati per diversi scopi, tra cui la produzione di tessuti per l'uso come un modello di malattia in vitro, ad esempio uno studio ulcere da decubito, per la medicina rigenerativa e come alternativa carne 1. I primi costrutti riportati muscolari 3D sono stati fatti molti anni fa e pionieri nel campo sono Vandenburgh 2,3 e colleghi. I progressi realizzati in ingegneria del tessuto muscolare non sono solo il risultato della plusvalenza vasta delle conoscenze sui fattori biochimici, cellule staminali e cellule progenitrici, ma sono basati in particolare sulle conoscenze acquisite dai ricercatori che i fattori fisici giocano un ruolo essenziale nel controllo del comportamento delle cellule e tessuti sviluppo. State-of-the-art muscolo ingegneria costruisce attualmente sono costituiti da cellule popolate costrutti idrogel. Nel nostro laboratorio questi in genere sono costituiti da cellule murine progenitrici, mioblasti murini isolati da muscoli degli arti posteriori o una linea cellulare murina mioblasti C2C12, missati con una miscela di collagene / Matrigel e piastrate tra due punti di ancoraggio, imitando i legamenti muscolari. Altre cellule possono essere considerati anche, ad esempio linee cellulari alternativi come mioblasti di ratto L6 4, neonatali cellule progenitrici muscolari derivate 5, le cellule derivate da tessuti muscolari adulti di altre specie come 6 umana o anche cellule staminali pluripotenti indotte (cellule iPS) 7 . Contrattilità cellula causa l'allineamento delle cellule lungo l'asse del costrutto 8,9 e differenziazione delle cellule progenitrici muscolari dopo circa una settimana di cultura. Inoltre, l'applicazione di stimolazione elettrica può migliorare il processo di differenziazione in qualche misura 8. A causa della sua dimensione limitata (8 x 2 x 0,5 mm) del tessuto completo possono essere analizzati mediante microscopia confocale per monitorare redditività esempio, la differenziazione cellulare e allineamento. A seconda dell'applicazione specifica i requisiti per l'engineetessuto muscolare rosso varierà; uso ad esempio per la medicina rigenerativa richiede l'aumento progressivo delle dimensioni e la vascolarizzazione del tessuto, mentre per servire come traduzione alternativa carne da altre specie è necessaria.
Protocollo
1. Coltura di cellule progenitrici dei mioblasti murini C2C12 o cellule
- Isolare cellule secondo il protocollo inizialmente pubblicato da Shefer e colleghi 10 e successivamente adattato da Collins et al. 11 e Boonen et al. 12 e memorizzare questi in azoto liquido. Questo richiede topi, per esempio C57Bl / 6. Metodi alternativi sono utilizzati in altri laboratori, ad esempio un metodo pubblicato in Journal of Experiments visualizzati da Li Y et al. 13. Per i reagenti e le attrezzature si rimanda alla tabella a pagina 7 e 8. Dal muscolo da un mouse è in genere sufficiente per ottenere cellule crioconservare circa 20 fiale in azoto liquido. Successivamente, avviare il protocollo di scongelare le cellule della conservazione in azoto liquido.
- Collocare le celle da 1 fiala in una centimetri 25 2 Matrigel (1 mg / ml) rivestito pallone di coltura tissutale e aggiungere mezzo di crescita (GM) composto (335 ml DMEM advanced, 100 ml bovin fetalee siero (FBS), 50 ml HS, 5 ml di penicillina / streptomicina, 5 ml L-glutamina, 5 ml di estratto di pollo embrione (CEE)).
Nota: cappotto per 2 ore a temperatura ambiente e rimuovere il Matrigel per aspirazione.
- Subculture le cellule circa 1:03 ogni 3 giorni.
Ciò significa: il 3 ° giorno: le cellule passaggio da un 25 cm 2 cm 75 ad un pallone da 2, il giorno 6: cellule di passaggio da una compressa da 75 cm 2 pallone a due 150 centimetri 2 palloni (con 30 min preplating in flaconi non rivestiti). Il giorno 9 trasferimento uno a 150 cm 2 pallone 1 triple 150 centimetri pallone da 2, o se non è disponibile per tre 150 centimetri due beute (se necessario preplate sempre a seconda del fenotipo delle cellule). Il giorno 12 le cellule sono pronte per la semina in un costrutto muscolo.
Note: - Per tripla 150 centimetri 2 il numero di cellule sarà di circa 4,5 x 10 6 cellule.
- Usa vials da isolamenti diversi di mescolare per ottenere una popolazione mista di cellule al momento della semina.
Nota: Se si sceglie di non lavorare con le cellule primarie, mioblasti C2C12 sono una buona alternativa.
2. Ingegneria tessuti muscolari scheletriche
- Preparare la colla al silicone miscelando il "elastomero" con il "catalizzatore" (10:1). Cut + / - 5 mm segmenti quadrati di velcro con un lato triangolare (casa-come figura, la figura 1). Incollare il velcro nei pozzetti di una piastra da 6 pozzetti di coltura ad uno spazio di circa 12 mm tra i quadrati.
Note: - Utilizzare solo il lato morbido del velcro e affrontare questo lato verso l'alto.
- Assicurarsi che i tetti di fronte all'altra.
- Solo coprire il velcro con il silicio colla, non si diffondono in tutta la colla bene.
- Per la stimolazione elettrica dopo che è rilevante per allineare i costrutti in direzione verticale del pozzo plmangiato (lungo l'asse lungo).
- Lasciare asciugare durante la notte in forno sotto vuoto, non riscaldata, in primo luogo per eliminare le bolle d'aria. Sterilizzare con l'aggiunta di 70% EtOH ai pozzetti ed incubare per 15 minuti. Risciacquare 3x con PBS e messo sotto UV per 15 min. Rimuovere tutta la PBS dai pozzetti e il velcro e mettere in incubatrice fino al momento dell'uso.
- Scongelare soluzione Matrigel in frigo e preparare la soluzione di collagene alla concentrazione desiderata poco prima di fare i costrutti 3D. Diluire il collagene di serie con sterile acido acetico 0,02% (concentrazione finale 3,2 mg / ml).
Nota: lasciare tutto su ghiaccio.
- Tripsinizzare le cellule, risospendere in GM e conteggio. Lasciare cellule in provetta da centrifuga nell'incubatore.
- Inserisci la quantità desiderata di soluzione di collagene stock con il numero di costrutti che si vuole fare di un tubo (secondo la Tabella 1), aggiungere 0,5 M NaOH a questa soluzione di collagene fino a un rosa chiaro coloR indica un pH di 7,5. Mescolare delicatamente pipettando su e giù ed evitare la formazione di bolle. Quindi aggiungere il Matrigel e mescolare molto delicatamente ma accuratamente. Infine, aggiungere il GM al collagene / Matrigel miscela (per importi adeguati cfr. tabella 1).
Note: - Eseguire ogni passaggio sul ghiaccio! Matrigel e collagene prontamente gel a temperatura crescente.
- Ricordate che il colore è davvero rosa! Un aumento del pH anche indurre gelificazione rapida.
- Concentrazione finale di collagene: 1,6 mg / ml.
- Centrifugare la quantità desiderata di celle a 1000 rpm per 5 minuti e rimuovere il surnatante.
Nota: - seconda dell'attività delle cellule del numero di cellule per costruire deve essere regolata. Tipicamente, il numero di celle compreso tra 750.000 e 1.250.000 cellule per costrutto.
- Utilizzare alcuni della miscela gel per risospendere il pellet cellularee trasferire le cellule nella miscela rimanente e mescolare accuratamente, ma senza introdurre bolle d'aria.
- Prendete i piatti preriscaldati e fuori dell'incubatore e pipettare 0,35 -0,4 ml della cellula-gel miscela nel primo velcro. Poi, iniziano a pipettare la miscela dal centro tra i siti di attacco ed estendere il Velcro. Infine, utilizzare il resto del gel per riempire il divario tra le due ancore in velcro e pipette in giro per i pezzi di velcro.
- Controllare attentamente dopo 5-10 minuti, se i gel sono solidi abbastanza per essere trasferito, vale a dire toccare delicatamente i piatti e controllare visivamente se il gel è rigida. Se è così, posizionare con attenzione i piatti in un incubatore. Generalmente, possono essere ritirati dopo dieci minuti. Poi, dopo 1-2 ore, delicatamente sovrappongono gel con 4 ml di GM caldo.
Nota:-Non fare movimenti vigorosi nel maneggiare i piatti.
- Sostituire GM da terreno di differenziamento (terreno di crescitasenza estratto pulcino embrione) dopo 24 ore, e sostituirlo con terreno fresco ogni 2-3 giorni. Il giorno 7 si dovrebbe aver ottenuto adulte fibre muscolari orientate, come può essere valutato con colorazione di sviluppo striatura trasversale delle fibre muscolari fusi.
3. Stimolazione elettrica
- Sterilizzare gli elettrodi dalla piastra ionoptix (vedi tabella dei reagenti e apparecchiature) prima dell'uso con il 70% di etanolo e successivamente asciugare sotto UV in cabina di sicurezza. Posizionare la piastra con elettrodi sulla piastra di coltura con i costrutti e coprire con il coperchio dalla piastra di coltura e trasferimento in un incubatore. Collegare il Ionoptix C-pacer con i cavi appropriati.
Nota: elettrodi sono disposte parallelamente lungo il costrutto muscolare (Figura 2).
- Applicare il protocollo di stimolazione come anticipato.
Nota: Generalmente usiamo 4 V / CM,6ms impulsi ad una frequenza di 2Hz. Cambiare mezzo di coltura ogni 24 h durante la stimolazione.
Risultati
Il prodotto finale sarà costrutti muscolari, come indicato in Figura 3. La dimensione del tessuto sarà di circa 8 mm, 2 mm di larghezza e 0,5 mm di spessore. Stimolazione elettrica durante la differenziazione cambierà l'espressione di isoforme della catena pesante della miosina, ma non di migliorare notevolmente il processo di differenziazione indotta dal terreno di differenziamento 8, ma stimolazione elettrica può essere applicata anche al termine del processo per controllare la funzionalità del muscolo , perché un muscolo con sarcomeri completamente sviluppati potranno contratto su un impulso elettrico.
La differenziazione e maturazione possono essere analizzati utilizzando PCR quantitativa per la valutazione dell'espressione genica e la colorazione per i marcatori di maturazione muscolari o di sviluppo striatura trasversale (ad esempio per la colorazione alfa actinina) su entrambi i tratti realizzati con i tessuti o interi campioni di tessuto colorato montaggio. Muscle maturazione e differenziazione relazionited geni e di espressione della miosina catena pesante includono ad esempio MyoD, miogenina, MFR4 e MLP, e MYH 1, 2, 4 e 8 8. La prova che il tessuto muscolare che si forma in realtà è tessuto muscolare, basata sull'espressione genica, colorazioni immunoistochimiche e induzione contrazione da stimolazione elettrica, è stato pubblicato in precedenza 8 e una figura con colorate sezioni di tessuti muscolari a base di cellule progenitrici mioblasti C2C12 e cellule da questa carta è visualizzato in Figura 4.
| Soluzione | Volume (se fare 10 muscoli) in pl |
| Collagene (3,2 mg / ml, diluito con 0,02% di acido acetico) | 2570 (51,3%) |
| NaOH (0,5 M) | 10 (0,2%) |
| Matrigel | 430 (8,6%) |
| La crescita media | 2.000 (39,9%) |
| totale | 5010 (dovrebbe essere sufficiente con sufficiente per versare e pipettaggio perdite) |
Tabella 1. Miscela di cellule e gel per la generazione di un muscolo tessutale costrutto.

Figura 1. Il taglio dei pezzi di velcro.

Figura 2. Un ritratto preso dal fondo di un muscolo costrutto in un pozzetto di una piastra da 6 pozzetti mostra il posizionamento degli elettrodi. Gli elettrodi (indicato con le frecce bianche) sono disposte parallelamente ai costrutti muscolari.

Figura 3. Un tessutoprogettato muscolare tra due pezzi di velcro in una piastra da 6 pozzetti cultura.
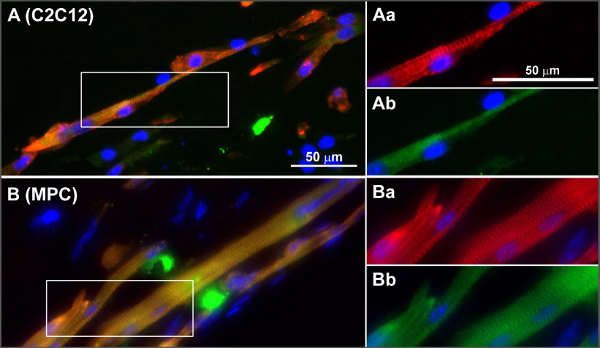
Figura 4. Tipici esempi di cross-striature in C2C12 (A) e MPC (B) in ingegnerizzati tessuti muscolari scheletriche. Sezioni congelate di mBAMs non stimolate (giorno 8 di differenziazione) sono state colorate per sarcomerica α-actinina (rosso), sarcomerica miosina (verde ) e nuclei (blu). (Aa-Ab e Ba-Bb) ingrandimenti di aree boxed in (A, B) α-actinina (rosso) e sarcomerica miosina (verde). Ristampato con il permesso di 8. Clicca qui per ingrandire la figura.
Discussione
L'ingegneria dei tessuti muscolari ha un grande potenziale per l'uso come un modello di malattia, per lo screening di stupefacenti, nella medicina rigenerativa e per la produzione di carne. Tuttavia, i requisiti per queste applicazioni variano. Abbiamo scelto di lavorare con una combinazione di collagene e matrigel, collagene perché permette l'allineamento cellulare e perchè i mioblasti progenitrici richiedono la presenza di proteine della membrana basale derivate come determinato in studi precedenti 2D 12. Inoltre, gel di fibrina sono stati testati nel nostro laboratorio e sembrano non sostenere le cellule progenitrici dei mioblasti C2C12 e così come la miscela di collagene e Matrigel ™ e soprattutto non portare a compattazione dei tessuti 14. Il modello qui descritto è già stato usato in studi su danni delle ulcere da pressione durante l'utilizzo di una linea cellulare 15. Per le applicazioni di medicina rigenerativa, la traduzione di cellule satelliti umane è recentemente venuta a 6,16. Inoltre,come una fonte alternativa per il consumo di carne la tecnica ha un grande potenziale 1. A nostro parere tuttavia, l'attuale tecnologia deve avanzare ad una fase successiva per favorire l'uso in clinica nonché per il consumo. Per esempio, la differenziazione ferma attorno fase neonatale e anche la produzione di forza è molto meno di un muscolo produce in vivo. Inoltre, anche se le cellule staminali di topo, ratto e umano può essere implementato nei costrutti 3D, l'isolamento e soprattutto la differenziazione e maturazione di animali da allevamento derivato cellule staminali muscolari non è ancora ben sviluppato che 1. Inoltre, l'utilizzo di Matrigel e animale esigenze derivati di siero da omessa 1. Per promuovere l'applicazione in medicina rigenerativa, la dimensione del tessuto deve essere aumentato, e richiede (neo) vascolarizzazione e l'uso di sistemi di bioreattori perfusione di superare le limitazioni di diffusione di ossigeno e nutrienti. Alcuni studi iniziali sulla vascolarizzazione piccolo costrutti have stato fatto negli ultimi anni 9,17,18.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori vogliono ringraziare Yabin Wu per la coltura dei tessuti presentati nella figura 2, la foto è stata scattata da Bart van Overbeeke. Il lavoro è stato sostenuto finanziariamente da SenterNovem, concessione ISO 42022.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| Matrigel-fattore di crescita ridotta | Beckton Dickinson e | ||
| DMEM (glucosio) * | Gibco | 42430 | |
| Avanzata DMEM | Gibco | 12491 | |
| Siero di cavallo | Gibco | 65050-122 | |
| Siero fetale bovino | Greiner | 758075 | |
| 0,45 e 0,22 micron siringa filtro * | Whatmann (Schleicher e Scheull) | 10462100 | |
| L-glutammina | Gibco | 25030024 | |
| Penicillina / streptomicina | Gibco | 10378016 | |
| Amfotericina | Gibco | 15290-018 | |
| Cultura plastica | Greiner | Include beute di coltura e delle pipette | |
| Chick embrione estratto | Stati Uniti biologica | C3999 | |
| Pipetta Pasteur * | Hilgenberg | Pipette Pasteur, con la costrizione, con cotone, L aperta punta: 230 mm con diametro di punta di 0,9 - 1,1 mm | |
| Pipetta Pasteur * | Hilgenberg | Pipette Pasteur, con la costrizione, con cotone, L aperta punta: 230 mm con diametro di punta di 1,4 - 1,6 mm | |
| Pipetta Pasteur | VWR | 612-1702 | |
| Collagenasi tipo I* | Sigma | C0130-16 | |
| 40 celle filtro micron * | BD Falcon | 352340 | |
| Ago 19G | |||
| Elastomero | Dow Corning Corporation | 3097358-1004 | Silastic MDX 4-4210 # |
| Agente indurente | Dow Corning Corporation | Silastic MDX 4-4210 # | |
| Velcro | Negozio di regolare | È possibile acquistare questo in un negozio normale, utilizzare solo il lato morbido | |
| Il collagene di tipo I, coda di topo | BD Biosciences | 3544236 | |
| C-Pace EP Cultura Pacer | Ionoptix | ||
| 6 pozzetti piastre di coltura per la stimolazione elettrica | Beckton Dickinson-Falcon | BD Falcon # 353846 | |
| C-Dish cultura piatto elettrodi | Ionoptix | ||
| * È necessario per l'isolamento di cellule (punto 1.1) # Insieme in un unico kit |
Riferimenti
- Langelaan, M. L. P., Boonen, K. J. M., Polak, R. B., et al. Meet the new meat: tissue engineered skeletal muscle. Trends Food Sci. Tech. 21 (2), 59-66 (2010).
- Shansky, J., Chromiak, J., Tatto, M., Vandenburgh, H. A simplified method for tissue engineering skeletal muscle organoids in vitro. In Vitro Cell Dev. Biol. Animal. 33 (9), 659-661 (1997).
- Vandenburgh, H., Del Tatto, M., Shansky, J., et al. Tissue-engineered skeletal muscle organoids for reversible gene therapy. Hum. Gene Ther. 7 (17), 2195-2200 (1996).
- Yaffe, D. Retention of differentiation potentialities during prolonged cultivation of myogenic cells. Proc. Natl. Acad. Sci. U.S.A. 61 (2), 477-483 (1968).
- Rando, T. A., Blau, H. M. Primary mouse myoblast purification, characterization, and transplantation for cell-mediated gene therapy. J. Cell Biol. 125 (6), 1275-1287 (1994).
- Koning, M., Werker, P. M. N., vander Schaft, D. W. J., Bank, R. A., Harmsen, M. C. MicroRNA-1 and MicroRNA-206 Improve Differentiation Potential of Human Satellite Cells: A Novel Approach for Tissue Engineering of Skeletal Muscle. Tissue Eng. Part A. , (2011).
- Darabi, R., Pan, W., Bosnakovski, D., et al. Functional myogenic engraftment from mouse iPS cells. Stem Cell Rev. 7 (4), 948-957 (2011).
- Langelaan, M. L. P., Boonen, K. J. M., Rosaria-Chak, K. Y., et al. Advanced maturation by electrical stimulation: Differences in response between C2C12 and primary muscle progenitor cells. J. Tissue Eng. Regen. Med. 5 (7), 529-539 (2011).
- van der Schaft, D., van Spreeuwel, A. C., van Assen, H. C., Baaijens, F. Mechanoregulation of vascularization in aligned tissue engineered muscle; a role for VEGF. Tissue Eng. Part A. , (2011).
- Shefer, G., Wleklinski-Lee, M., Yablonka-Reuveni, Z. Skeletal muscle satellite cells can spontaneously enter an alternative mesenchymal pathway. J. Cell. Sci. 117 (Pt. 22), 5393-5404 (2004).
- Collins, C. A., Olsen, I., Zammit, P. S., et al. Stem cell function, self-renewal, and behavioral heterogeneity of cells from the adult muscle satellite cell niche. Cell. 122 (2), 289-301 (2005).
- Boonen, K. J. M., Rosaria-Chak, K. Y., Baaijens, F. P. T., van der Schaft, D. W. J., Post, M. J. Essential environmental cues from the satellite cell niche: optimizing proliferation and differentiation. Am. J. Physiol. Cell Physiol. 296 (6), C1338-C1345 (2009).
- Li, Y., Pan, H., Huard, J. Isolating Stem Cells from Soft Musculoskeletal Tissues. J. Vis. Exp. (41), e2011 (2010).
- Boonen, K. J. M., Langelaan, M. L. P., Polak, R. B., et al. Effects of a combined mechanical stimulation protocol: Value for skeletal muscle tissue engineering. J. Biomech. 43 (8), 1514-1521 (2010).
- Gawlitta, D., Boonen, K. J. M., Oomens, C. W. J., Baaijens, F. P. T., Bouten, C. V. C. The influence of serum-free culture conditions on skeletal muscle differentiation in a tissue-engineered model. Tissue Eng. Part A. 14 (1), 161-171 (2008).
- Koning, M., van Luijn, M., van der Schaft, D. W. J., et al. Human skeletal muscle formation and engraftment In vivo is independent of preconditioning In vitro with HUVEC. , (2013).
- Levenberg, S., Rouwkema, J., Macdonald, M., et al. Engineering vascularized skeletal muscle tissue. Nat. Biotechnol. 23 (7), 879-884 (2005).
- Koffler, J., Kaufman-Francis, K., Yulia, S., et al. Improved vascular organization enhances functional integration of engineered skeletal muscle grafts. Proc. Natl. Acad. Sci. U.S.A. 108 (36), 14789-14794 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon