Method Article
クロマチンの相互作用のマッピングと転写調節を理解するためのペアエンドタグシーケンシング(CHIA-PET)によるクロマチンの相互作用の解析
* これらの著者は同等に貢献しました
要約
ペアエンドタグシーケンシング(CHIA-PET)によるクロマチンの相互作用分析のための方法です。 de novoの検出。
要約
ゲノムは、ミクロンサイズの核のスペース内に高次のコンフォメーション7、2、12を採用し 、三次元構造に編成されています。このようなアーキテクチャは、ランダムではなく、遺伝子のプロモーターおよび調節エレメント13との間の相互作用を伴う。特定の調節配列に転写因子の結合は、転写調節と協調1、14のネットワークをもたらす。
ペアエンドタグシーケンシング(CHIA-PET)によるクロマチンの相互作用の解析は、これらの高次クロマチン構造の5,6を識別するために開発されました。セルが固定されており、相互作用する遺伝子座は、共有結合、DNA-タンパク質のクロスリンクによってキャプチャされます。非固有のノイズを最小限に抑え、複雑さを軽減するだけでなく、クロマチンの相互作用分析の特異性を向上させるために、クロマチン免疫沈降(ChIP)は、近接ライゲーションの前に興味のあるクロマチンの断片を豊かにするために、特定のタンパク質因子に対して使用されている。ハーフリンカーを含むライゲーションは、その後、個々のクロマチン複合体の中で一緒につながれたDNA断片のペアの間に共有リンクを形成します。ハーフリンカーに隣接MmeI制限酵素サイトはMmeI消化時のペアの終了タグ - リンカー - タグ構造(PETS)の抽出を可能にします。ハーフリンカーはビオチン化されているように、これらのPETの構造は、ストレプトアビジン磁気ビーズを用いて精製されています。精製したPETSは、次世代シーケンシング·アダプタとの相互作用フラグメントのカタログのようなイルミナGenome Analyzerなどの次世代シーケンサーを経由して生成されますと連結されています。マッピングおよびバイオインフォマティクス解析は、チップに富む結合部位とチップ濃縮クロマチンの相互作用8を識別するために実行されます。
我々は、チップの品質がCHIA-PETライブラリの結果に大きな役割を果たしている特にCHIA-PETプロトコルは、チップの準備の重要な側面を示すためにビデオを制作しています。プロトコルがあるよう非常に長い、唯一の重要なステップは、ビデオで表示されます。
プロトコル
A.クロマチン免疫沈降(ChIP)( 図1を参照)
1。クロマチン結合タンパク質と細胞採取の二重架橋
(ビデオの2時10分時)
クロマチン免疫沈降(ChIP)は、CHIA-PETライブラリーを構築する最初の重要なステップです。このステップでは、複雑さのレベル、バックグラウンドノイズを低減し、特異性を追加することが重要です。 ChIP用の調製は、細胞の種類や金利の要因のために最適化する必要があります。このプロトコルは、我々の研究室で構築したMCF-7細胞9から調製したRNAポリメラーゼII CHIA-PETのライブラリに基づいています。得られたライブラリーが十分複雑であることを確認するために、我々はChIPの材料を準備する1×10 8細胞の使用をお勧めします。ターゲットと細胞株に応じて、得られた収率は300 ngから100 ngの間にすることができます。我々は、100 ngのCHIPの最小値が共存するために使用されるべきことをお勧めしますシーケンス中の冗長性を最小限に抑えるために20人未満のPCRサイクルでCHIA-PETライブラリをnstruct。 ChIP用材料の高金額は、ライブラリの品質を向上させ、冗長性の一層の削減が可能になる。
- リン酸二回1×10 8、MCF-7細胞(2×10 7細胞の5 500センチメートル2平方プレートに相当)洗浄は緩衝生理食塩水(PBS)で37温め℃に
- 1.5 mmの架橋MCF-7細胞は、新たに化学ヒュームフード内で回転しながら室温(22℃)で45分間EthylGlycolビス(スクシンイミジルスクシネート)(EGS))を用意しました。
- 化学物質はドラフト内で回転しながら室温(22℃)で20分間1%の最終濃度に37%ホルムアルデヒドを追加します。

- 200mMの最終濃度を2 Mグリシンを添加することにより架橋を消す。室温で10分間インキュベート(22℃)回転。
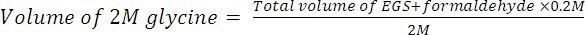
- 廃棄物のフラスコに急冷架橋剤を破棄し、冷PBSで2回細胞を洗浄する。
- スクレイピングでPBSと収穫細胞を破棄します。氷の上で採取した細胞を保持します。セルのコレクションを最大化するために5ミリリットルPBS(プロテアーゼ阻害剤( "+ PI")は、製造元の指示に従って追加されました)でプレートを洗浄します。
- ペレット4℃で10分間1800×gで(3,000 rpm)で細胞を℃に上清を捨て、細胞溶解に進みます。また、-80ペレット℃で保存してください。
2。細胞溶解
(ビデオの04:15)
- ピペッティングにより完全に15ミリリットル、0.1%SDS Lysis Buffer中でペレットを再懸濁し(50mMのHEPES pH7.5、150mMのNaCl、1mMのEDTA、1%トリトンX-100、0.1%デオキシコール酸ナトリウム、0.1%SDS + PI)。 4℃で15分間回転させる
- ペレットは、800×で細胞を溶解し4℃gで10分間(2,000 rpm)で℃、
- 上清を捨て、一度、ステップ2.1と2.2あたりの細胞溶解を繰り返します。
- 孤立した核ペレットは核溶解の準備ができています。また、-80℃の店舗ペレット
3。核の溶解
(ビデオの05:00)
核の溶解は、クロマチンの断片化の前に架橋されたクロマチンを解放するために実行されます。核膜が存在しない場合に、架橋されたクロマチンは、穏やかな条件を使用して超音波処理することができます。無傷の核は遠心分離後に破棄されるため、場合によっては、超音波の強さはケースに核膜を破壊するのに十分でないかもしれませんが、以下のクロマチンが得られます。ただし、異なる種類の細胞は、異なる条件が必要な場合があります。
- 再懸濁し、単離された核ペレットを15 mlの1%SDS溶解バッファー(50 mM HEPES pH7.5、150mMのNaCl、1mMのEDTA、1%トリトンX-100、0.1%ナトリウムDeoxycholate、1%SDS + PI)。高速遠心チューブ(オークリッジ遠心管(ポリプロピレン))に核懸濁液を移し、4℃で15分間回転させる
- ペレットは、4℃で30分間47810×gで(20,000 rpm)で核ペレットを溶解し
- P1000ピペットチップで上清をデカントし、ブレークペレット。
- 30ミリリットル、0.1%SDS溶解バッファー(+ PI)でペレットを洗浄します。
- 4℃で15分間回転させる
- 4℃で30分間、47810×gで(20,000 rpm)でペレットクロマチン
- 上清を捨て、クロマチンの断片化に進む前に、ステップ3.4から3.6に従って回洗浄を繰り返します。また、店舗クロマチンペレット-80℃
4。クロマチンの断片化
(ビデオの07:03)
- 14ミリリットルのポリスチレン丸底試験管に転送するクロマチンペレット。
- クロマチンのPEに1 mlの0.1%SDS溶解バッファー(+ PI)を追加llet。これは超音波処理効率に影響を与えるとして混合物中に気泡が存在しないことを確認してください。
- ブランソンデジタルSonifer細胞攪乱(振幅35%、9分(30秒オン、オフ30秒))と実行することにより、過熱を防ぐために、すべての時点でサンプルは冷たくしておくと200から600塩基対の大きさにせん断クロマチン-DNA寒い部屋で超音波処理( 図2を参照)。
- クロマチンのアリコートを逆架橋して、次の手順で断片化の効率を確認します(次の手順をビデオで表示されません)。
- 超音波処理後のクロマチンのアリコートを10μlの。
- 遠心は4℃で5分間16110 XG(13200 rpm)でクロマチンを超音波処理
- 上清を新しいチューブに移し、プロテイナーゼK溶液2μlを追加します。
- 50℃で30分間インキュベート℃、
- 1.5%アガロースゲル上での逆架橋クロマチンを解決します。
- RepeaDNAのサイズが予想よりも大きい場合、tは超音波処理。
- 4℃で30分間16110×gで(13200 rpm)で、残りのライセートを遠心°Cおよび転送は、磁気ビーズとpreclearing前に新しいチューブにクロマチン(上清)を超音波処理した。十分なクロマチンはChIPを始めるために収集されるまで、あるいは、店は-80℃でクロマチンを超音波処理した。
5。ビーズへの抗体の洗浄、Preclearingとコーティング
(ビデオの午前8時17時)
- クロマチンのPreclearing
- 一つのIPの磁気プロテインGビーズを300μlを使用しています。
- 5ミリリットルビーズ緩衝液(PBS、0.1%トリトンX-100)で3回洗浄したビーズを洗浄します。これと磁気プロテインGビーズを含む将来の洗浄には、次の手順で構成されています。磁気ビーズが出て乾燥させないことを確認してください。
- 磁性粒子の集配信装置を使用してビーズを取り戻す。
- D上清iscard。
- バッファーでビーズを再懸濁します。
- 4℃で5分間回転させる
- 4℃で1分間129×gで(800 rpm)で遠心分離℃、
- 磁性粒子の集配信装置を使用してビーズを取り戻す。
- 上清を捨てる。
- ビーズのクロマチンの結合背景を削除するには、予備洗浄ビーズと超音波クロマチンを兼ね備えています。
- 定量PCR(qPCR)により、その後の濃縮チェックのための "入力"として超音波処理したクロマチン10μlを保つ。 4℃で保管してください
- 一晩4°回転で
- 遠心は4℃で1分間129×gで(800 rpm)でクロマチンを超音波処理
- 磁性粒子コンセントレータ上にチューブを置きます。
- 磁性ビーズにコーティング抗体
- 新鮮な管に磁気プロテインGビーズのアリコートを300μlの。
- 5ミリリットルビーズ洗浄バッファー(PBS、0.1%トリトンX-100)で3回ビーズを洗浄します。
- ビーズ洗浄バッファーと同等のボリュームを(ステップ5.1.3など)を追加します。
- RNAポリメラーゼII(8WG16)モノクローナル抗体の35μgを追加します。
- 一晩4°回転で
- 5ミリリットルビーズ洗浄バッファーで2回抗体被覆ビーズを洗浄します。
- 磁性粒子コンセントレータを使用して、抗体被覆ビーズを取り戻す。
6。クロマチン免疫沈降
(ビデオの午前10時03時)
複雑さとバックグラウンドノイズのレベルを低減するために、特定のタンパク質因子に対する抗体は、近接ライゲーション6の前に関心のある特定のクロマチン断片を豊かにするために使用されます。
ここでは、モノクローナルマウスRNAポリメラーゼIIを使用タンパク質の開始フォームを認識する抗体(8WG16)。 RNAポリメラーゼIIに関連付けられているDNA断片を豊かにすることにより、ライブラリの特異性は、アクティブなプロモーターとそれに対応する調節領域9の間の長期的なクロマチンの相互作用の識別を可能にする、増加させることができる。
- 磁性粒子コンセントレータの助けを借りて、抗体被覆ビーズからの洗浄バッファーを捨てる。
- 転送は、抗体被覆ビーズ(ステップ5.2.7から)に磁性粒子コンセントレータの助けを借りて、クロマチン(ステップ5.1.6からの上清)超音波処理した。
- 一晩4°回転で
7。免疫沈降したDNA-タンパク質複合体の洗浄および溶出
(ビデオの11:13)
- 5ミリリットル、0.1%SDS溶解バッファーで3回クロマチン免疫沈降ビーズを洗浄します。
- 5ミリリットル高塩洗浄バッファー(50 mMのHEPES pH7.5で一回ビーズを洗浄、350 mMのNaCl、1mMのEDTA、1%トリトンX-100、0.1%デオキシコール酸ナトリウム、0.1%SDS)。
- 5 mlの塩化リチウム洗浄バッファー(10mMのトリスpH8.0、250mMのLiClを、1mMのEDTA、0.5%ノニデットP-40、0.5%デオキシコール酸ナトリウム)で一回ビーズを洗浄します。
- 洗浄バッファーを、1mlのTE緩衝液で洗浄したビーズを再懸濁し破棄します。
- 4℃で5分間回転させるサンプルは、定量およびチップ濃縮チェックできるようになります。一度十分なChIPの材料が収集された、サンプルでは、CHIA-PETライブラリに構築する準備ができました。このステップは重要であり、成功したCHIA-PETのライブラリーの構築を確実にするために行わなければなりません。 ChIPの濃縮ビーズ定量、チップ濃縮をチェックし、十分な材料の蓄積を経ている間、4℃で2週間用に保存することができます。
- 溶出と逆架橋、次の手順で"入力" DNAとChIP濃縮ビーズ(次の手順をビデオで示されていません。)
- 200μlのChIPの溶出バッファー(50mMのトリスpH8.0、10mMのEDTA、1%SDS)でChIPの濃縮ビーズの20%を溶出します。 37℃で30分間回転させる℃、 4℃で1分間6100×gで(800 rpm)で溶出したビーズを遠心分離℃、磁性粒子コンセントレータの助けを借りて新しいチューブに溶出したChIPの複合体(上清)を転送します。
- 50℃で2時間2μlのProteinase Kを(0.2グラム/ mlの最終濃度)℃の逆架橋 "入力"と溶出したChIPの複合体
- 2ミリリットルMaXtract高密度(それぞれ)に逆架橋 "入力" DNA溶出したChIPのDNAを転送します。ケミカルドラフト内でチューブに200μlの25:24:1フェノール - クロロホルム - イソアミルアルコールのpH 7.9を加えてよく混ぜて反転させる。室温で16110 XG(13200 rpm)で5分間チューブをスピン。
- 新しいチューブに、沈殿物を逆に架橋されたDNAのウィットに上部の水相を転送H 20μlの3 M酢酸ナトリウムのpH 5.5、200μlのイソプロパノールと1μlの15 mg / mlのGlycoblue。 4℃で16110×gで(13200 rpm)で30分間、30分間、ペレットDNAを-80℃でインキュベート
- イソプロパノール沈殿したDNAの遠心分離後、20μlのTE緩衝液に二度75パーセントの氷冷エタノールでDNAペレットを洗浄し、再懸濁し、DNAペレット。
- ピコグリーンアッセイ10で"入力" DNA(ステップ5.1.3から)とチップのDNAを定量します。
- 定性PCR(定量PCR)を介して濃縮チェックを実行します。
- 溶出と逆架橋、次の手順で"入力" DNAとChIP濃縮ビーズ(次の手順をビデオで示されていません。)
B.ペアエンドタグシーケンシング(CHIA-PET)を用いたクロマチンの相互作用の解析
ビデオの後半では、CHIA-PETライブラリーの構築における重要なステップを強調表示します。
1。 ChIPのDNA断片の末端平滑化
ビデオのこの章では、2メートルを強調AINポイント、磁気ビーズを含む酵素を除去するために磁気ビーズを洗浄し、以前の反応(ステップ1.1、ビデオの午前12時22分まで午前12時54分)と、酵素反応をセットアップする手順の塩をバッファリングのステップバイステップ手順反応混合物(ステップ1.2、ビデオの午前12時54分まで午後01時25分)であった。
- 氷冷TE Bufferで一回のChIP-濃縮ビーズを洗浄します。これと磁気ビーズを含む将来の洗浄には、次の手順で構成されています。
- 4℃で1分間6100×gで(800 rpm)で遠心分離℃、
- 磁性粒子の集配信装置を使用してビーズを取り戻す。
- 上清を捨てる。
- ビーズにバッファを追加します。
- アクションをフリックすることで、バッファでビーズを混ぜます。
- 4℃で1分間6100×gで(800 rpm)で遠心分離℃、
- 磁性粒子の集配信装置を使用してビーズを取り戻す。
- 上清を捨てる。
- 記入するための超音波overhaNGSは、T4 DNAポリメラーゼ、7μlの10 mMのdNTPおよび615.8μlのヌクレアーゼ·フリー水70μlの10×Bufferでマスターミックスを調製する。徹底的にミックスし、マスターミックスで洗浄したビーズを再懸濁します。 700μlの最終容量を7.2μlを9.7 U /μlのT4 DNAポリメラーゼを追加します。混合し、インキュベート40分間37℃回転C(PalicoバイオインテリミキサーRM-2L、F8、30rpmで、U = 50、U = 60を使用)。次の手順を実行して、後続のすべての酵素反応を行います。
- ヌクレアーゼフリー水との反応バッファーで希釈します。
- 希釈したバッファにすべての他の試薬(酵素除く)を追加します。
- 混和します。反応混合物にビーズ/ペレットを再懸濁します。
- 再懸濁したビーズ/ペレット(最大酵素活性を確保するために、すべての回でベンチトップクーラーボックスの酵素を保持)に酵素を追加します。
- パラフィルムでチューブをシールします。
- ビーズが全体incubatioを通してよく混合されていることを確認N。
- 反応混合物を破棄し、氷冷洗浄緩衝液(10mMのトリス-Cl pH7.5の、1mMのEDTA、500mMのNaCl)で3回離れて残った液塩や酵素を洗い流してください。
2。 ChIPのDNAにビオチンハーフリンカーのライゲーション
ビデオのこの章では、CHIA-PETの構造との非特異的および特定のライゲーション産物を区別するヌクレオチドのバーコード組成物の使用(午後01時28分まで14時24分)で使用される半リンカーオリゴヌクレオチドの特性を強調してビデオ)。章では、またハーフリンカーライゲーション反応(ステップ2.2、ビデオの夜02時24分に午前15時54分)の設定のステップバイステップの手順を示します。
ビオチン化したハーフリンカーの2つのタイプは、このプロトコルで導入されており、4つのヌクレオチドの内部コード(TAAGまたはATGT)とタイプIIS制限酵素MmeI(TCCAAC)の認識部位で設計されています。 CHIPは豊かにした後メンターは、クロマチンの断片は2つのアリコートに均等に分割され、最初のB 5,9半リンカまたは半二重リンカのいずれかの過剰と連結されている超音波処理した。
- または半二重リンカーBそれぞれビオチン化半リンカーによってDNAの半リンカーライゲーションの2つのアリコートにChIPの濃縮ビーズを分割します。ヌクレオチドのバーコードとして、これら2つのハーフリンカーは(ATGTハーフリンカーBハーフリンカTAAG付)提供する中央の4つのヌクレオチドを除いて、同じ塩基配列を持っています。ホモ二量体AAまたはBBリンカーを有する配列の集団から識別することができる特定のライゲーションに比べて、近接ライゲーション時に結合されたとき、二つの異なるチップ複合体の間のランダムおよび非特異的ライゲーションには、ヘテロABリンカーを有する配列の集団から識別することができます。
- PEG 140μlの5×T4 DNAリガーゼ緩衝液でライゲーションCHIP-濃縮ビーズ、3.5μlを200 ng /μLのビオチン化したハーフリンカーまたはB、553.5μlヌクレアーゼ自由水と3μl30 U /μlのT4 DNAリガーゼ(リガーゼでも氷の上に不安定であるとしてすべての回でベンチトップクーラーボックスに、T4 DNAリガーゼを保持)。パラフィルムでチューブを密封し、16℃一晩インキュベート°回転したC。
3。 ChIPのDNA断片の溶出と近接ライゲーション
ビデオのこの章では、ビーズからのクロマチン複合体の溶出の際にバッファEB、SDSとトリトンX-100の役割を説明し、また、環状化反応を(ステップ3.9、午前15時54分までの設定のステップバイステップ手順を示しています。ビデオの17:10)。
クロマチン断片にハーフリンカーを連結した後、両画分を合わせて、ビーズから溶出されています。相互作用するDNA断片は、その後、近接ライゲーション時に完全なリンカー配列によって接続されます。
ヌクレオチドのバーコード組成物を用い、配列は3つのカテゴリに分類することができる、すなわち、wiを順序づけそれぞれ目のヘテロABリンカー(バーコードATGT / TAAG)と非特定し、特定のライゲーション産物を区別するためにホモ二量体AAまたはBBリンカー(バーコードTAAG / TAAGまたはATGT / ATGT)のシーケンスを9。
したがって、異なるヌクレオチドのバーコードを持つ2つのハーフリンカーの使用は、異なる実験の仕様を許可または複製するだけでなく、異なるチップの複合体5との間の非特異的ライゲーションキメラ率の監視に。
- 氷冷洗浄緩衝液(10mMのトリス-Cl pH7.5の、1mMのEDTA、500mMのNaCl)で3回半リンカーライゲーションされたビーズを洗浄します。
- 次のように半リンカーライゲーションされたビーズのチューブの両方を兼ね備えています。
- 磁性粒子のコンセントレータ( "チューブ")を使用して半リンカーライゲーションされたビーズのチューブのいずれかを取り戻す。
- 氷の上で半リンカーライゲーションされたビーズ( "チューブB")の他のチューブを保持します。
- バッファー(ステップ3.2.1から)は、fを洗って捨てるROMのチューブと、チューブチューブにチューブBから半リンカーライゲーションしたビーズを(ステップ3.2.2から)転送磁性粒子コレクタにまだある。
- 残った半分リンカーライゲーションされたビーズを収集し、ハーフリンカーライゲーションされたビーズの両方の管が適切に組み合わされていることを確認するためにチューブBに700μlの氷冷した洗浄バッファーを追加します。チューブAに洗浄バッファーを転送し、空のチューブBを破棄
- 70μlの10×T4 DNAリガーゼ緩衝液(NEB)、616μLのNuclease-Free WaterおよびT4 DNAポリヌクレオチドキナーゼの14μlを10 U /μlのリン酸化ハーフリンカーライゲーションされたビーズ。回転に伴って37℃で50分間インキュベートします。
- 磁性粒子の集配信装置を使用してリン酸化されたハーフリンカーライゲーションされたビーズを回収し、反応混合物を破棄します。
- 200μlの新たに調製した溶出バッファー(TEバッファー、1%SDS)で半リンカーライゲーションされたクロマチン-DNA複合体を溶出します。室温で30分間インキュベート(22℃C)回転。
- 新しいチューブに溶出液を移し、900μlのBuffer EBでビーズを洗浄してください。溶出を組み合わせて同じチューブに上清を移します。
- (22℃)、室温で1分間、16110×gで(13200 rpm)で2遠心管フィルタや遠心機のフィルターカップに収集された溶出液を転送します。
- 90μlの20パーセントトリトンX-100を追加することにより、SDSを隔離し、よく混合し反転させます。 37℃で1時間インキュベート℃、
- 環状化は望ましくないキメラDNA分子に生じさせる別のクロマチン複合体の間にライゲーションイベントを最小限に抑えながら、個々の架橋クロマチン複合体の中にライゲーションイベントを有利にするために非常に希薄な条件の下で実行されます。氷の上で作業を、50mlファルコンチューブに溶出液急冷を転送し、7776μLのNuclease-Free Water、1000μlの10×T4 DNAリガーゼ緩衝液(NEB)と33.33μlを30 U /μlのT4 DNAリガーゼを追加します。 16で一晩インキュベート℃の
4。逆架橋及びDNA精製
クロロホルム抽出(ステップ4.3、午前17時11分まで午後5時59分)、ステップ4.4の遠心分離後、ペレット化したDNAのクローズアップ:ビデオのこの章では、フェノールのステップバイステップの手順を示します。
- 逆架橋と100μlの20 mg / mlのプロテイナーゼK溶液を添加することにより劣化したタンパク質。 50℃で2時間インキュベートします。
- 50ミリリットルMaXtract高密度にクロマチンDNAを移し、19ミリリットルの最終的な音量を得るために9ミリリットルのNuclease-Free Waterを追加します。
- ケミカルドラフト内でチューブに19ミリリットル25:24:1フェノール - クロロホルム - イソアミルアルコールのpH 7.9を加えてよく混ぜて反転させる。室温で1800 xgで(3,000 rpm)で5分間チューブをスピン。
- 50ミリリットルオークリッジ遠心チューブ(テフロンFEP)に上部の水相を転送し、1.9ミリリットルの3 M酢酸ナトリウムのpH 5.5、19ミリリットルisopropanとクロマチンDNAを沈殿させるオール及び5μlのGlycoblue。 Glycoblueは、ペレットの視認性を向上させるために追加されます。
- 少なくとも1時間は-80°Cでインキュベートします。 4℃で30分間38720×gで(18,000 rpm)で遠心分離する前に解凍する凍結溶液を許可する
- イソプロパノール沈殿したDNAの遠心分離後、34μlのBuffer EBで二度75パーセントの氷冷エタノールでDNAペレットを洗浄し、再懸濁し、DNAペレット。 1.7ミリリットルのDNA LoBindチューブにDNA混合物を転送します。
- 34μlのBuffer EBで再懸濁し、DNAペレット。
- (その後の洗浄とCHIA-PETプロトコルの精製ステップとしてRNAと社内ライブラリからCHIA-PETシーケンスの手動検査は、RNAの混入の痕跡を表示しなかった汚染除去するために役立つRNase処理はオプションです)。
- 10μlのRNase ONE 10×反応バッファー、55μlのヌクレアーゼ·フリー水および1μlの10 U /μlのRNase ONEリボヌクレアーゼを追加することにより、RNase消化を行います。 37℃でインキュベート時間°C。
- 2ミリリットルMaXtract高密度にクロマチンDNAを転送します。ケミカルドラフト内でチューブに100μlの25:24:1フェノール - クロロホルム - イソアミルアルコールのpH 7.9を加えてよく混ぜて反転させる。室温(22℃)で16110 XG(13200 rpm)で5分間チューブをスピン。
- 新しいチューブに10μlの3 M酢酸ナトリウムのpH 5.5と100μlのイソプロパノールで沈殿逆架橋DNAに上部の水相を転送します。 4℃で16110×gで(13200 rpm)で30分間、30分間、ペレットDNAを-80℃でインキュベート
- イソプロパノール沈殿したDNAの遠心分離後、34μlのBuffer EBで二度75パーセントの氷冷エタノールでDNAペレットを洗浄し、再懸濁し、DNAペレット。
5。ストレプトアビジンビーズにCHIA-PET DNAの固定化
存在に関するこの章交渉の導入MmeIの認識部位およびタグ - リンカー - タグ構造( "ペット"、映像の午後06時02分まで19:10)の抽出を容易にするために半リンカーオリゴヌクレオチド中に存在するビオチン化したTの。さらに、ビデオのこの章では、ステップ5.2、PCR反応(ステップ6.1、ビデオの19時10分〜20:00)を設定し、成功を切り出すのステップバイステップ手順の簡単な全体的なビューを提供CHIA-PETのDNA(ステップ6.9、20:00〜20:30)。
ハーフリンカーおよびBは、MmeIの認識部位に隣接するクロマチン断片の短い "タグ"を生成するために彼らの標的結合部位の下流に20分の18塩基対をカットするために、このタイプIIS制限酵素を可能にする、ペアのタグ - リンカー - タグ構造を生成するを含む( "ペット")。
CHIA-PETの構造のキャプチャおよび精製を可能にする、ストレプトアビジン被覆磁気ビーズ、半リンカーおよびBの両方がビオチンで修飾されることにより、PETのコンストラクトの精製を可能にします。
- リリースC再懸濁させたDNAにx NEBuffer 4、5μlを新たに調製した500μMの(10×)S-アデノシルメチオニン(SAM)と1μlの2 U /μLMmeI5μlの10を追加することにより、aptured CHIA-PET DNA。 MmeIの反応ミックスに5μlの非ビオチン化したハーフリンカーを追加することにより、過剰なMmeIを消すことは過剰に自己抑制することができます。 37℃で2時間インキュベート℃、
- DNAのLoBindチューブに再懸濁したM-280ストレプトアビジンビーズのリリースCHIA-PETのDNA、50μlの転送をキャプチャします。バッファー(10 mMトリス塩酸pH7.5、1mMのEDTA、2 M NaClを2×B&W)の結合および洗浄×2で二回ビーズを洗浄します。 50μlの2×B&Wバッファーで再懸濁し、ビーズと同じ管に消化ミックス50μlを(ステップ5.1から)転送します。よく混ぜ、回転しながら室温で45分間インキュベートします。
- 磁性粒子の集配信装置を使用してビーズを回収し、上清を捨てる。バッファー(5 mMトリス塩酸pH7.5、0.5mMのEDTA、1 M NaClを1×B&W)の結合および洗浄150μlの1×で二回ビーズを洗浄します。 ライゲーション454 GS20アダプタ(このステップで使用されているリガーゼ緩衝液は、ステップ3.9と異なる場合は、このステップで使用されているリガーゼ緩衝液は、同じ会社のものとからであることに注意してくださいT4 DNAリガーゼ)、4μlを200 ng /μLの454 GS20アダプター、4μlの200 ng /μLの454 GS20アダプターB、36μLのヌクレアーゼフリー水、1μlを30 U /μlのT4 DNAリガーゼを提供しています。回転で16°Cで一晩インキュベートします。 CHIA-PET DNAはまた、我々はイルミナから購入したPCRプライマーPE1.0とPCRプライマーPE 2.0を使用してライブラリの増幅を推奨している場合には、イルミナ-NNアダプタを使用して連結することができる。
- 磁性粒子の集配信装置を使用してビーズを回収し、上清を捨てる。 150μlの1×B&W緩衝液で3回ビーズを洗浄します。
- 5μlの10でニック翻訳CHIA-PETのDNAは、x NEBuffer 2、2.5μlの10 mMのdNTPsを、38.5μLのヌクレアーゼフリー水と4μlの10 U /μlに大腸菌DNAポリメラーゼIは一晩インキュベートする。回転しながら室温(22℃)。
- 磁性粒子の集配信装置を使用してビーズを回収し、上清を捨てる。 150μlの1×B&W緩衝液で3回ビーズを洗浄します。
- 50μlのBuffer EBでビーズを再懸濁します。
6。 CHIA-PET DNAの増幅
- 2μlのビーズ懸濁液を用いたPCR反応を、21μlのヌクレアーゼフリーの水、1μlの10μMイルミナ1から454プライマー、1μlの10μMイルミナ2から454のプライマーおよび25μlの备考ハイフィデリティマスターミックスをセットアップします。
- シークエンシングのための十分なPCR産物を生成するために必要なサイクル数を決定するために、16、18および20サイクルの3つのテストPCR反応を設定します。我々は非常に低いライブラリの複雑さでそう結果をやっていることを発見したとして、20サイクルを超えないようにしてください。
| 初期段階 | 30秒 | 98°C | (変性) |
| 18から25サイクル | 10秒 | 98°C | (変性) |
| 30秒 | 65°C | (アニーリング) | |
| 30秒 | 72°C | (拡張子) | |
| 最終段階 | 5分 | 72°C | (最後の拡張子) |
- CHIA-PETのDNAの長さが223塩基対のバンドの存在を確保するため、SYBRグリーンIを4-20%勾配TBEゲルおよび染色でPCR反応を実行することにより、最小限のサイクル数を決定します。
- まだシーケンシングのための十分な収量を得ながら、できるだけ少ないPCRサイクルを持つ大規模PCRでCHIA-PET DNAに結合したストレプトアビジンビーズの残りの部分を増幅する。
- 投稿2新鮮なDNAのLoBindチューブに上清磁性粒子コンセントレータとプールを使用して、すべてのPCR反応からビーズを主張している。 60μlの3 M酢酸ナトリウム、2μlのGlycoBlueとプールされた反応に600μlのイソプロパノールを添加することにより上清の各チューブを沈殿させる。
- 30分間-80℃でインキュベートします。 4℃で30分間16110×gで(13200 rpm)で遠心分離
- イソプロパノールの遠心分離後、100μlのTE緩衝液と色素をロードする5μlの6×のDNA、二回75パーセントの氷冷エタノールで洗浄DNAペレットを再懸濁してDNAペレットを沈殿させた。
- 均等に6%TBEゲルのウェルにPCR産物を配布します。 35分200 Vで1×TBEバッファーでゲルを実行し、SYBRグリーンIで染色すると、ダークリーダーのイルミネーターにゲルを可視化します。
- 慎重にゲルから223 bpのバンドを切り出し、次のように "ゲルクラッシュ" DNA抽出プロトコルを実行します。
- 0.6ミリリットルのMicroCに切り出したゲル断片を配置21-G注射針と下部にピアスされていますentrifugeチューブ。
- 4℃で5分間16110 XG(13200 rpm)で1.5 mlのスクリューキャップチューブと遠心分離機内の各チューブを置きます
- 各チューブに200μlのTE緩衝液pH8.0を追加し、ゲル片が完全にバッファーに浸漬されていることを確認してください。
- 37°Cで一晩時間インキュベートし-80℃で凍結します。
- 4℃で10分間16110×gで(13200 rpm)で遠心分離管フィルタと遠心機のフィルターカップに各チューブ内のバッファと一緒にゲル片を転送
- 200μlのTE緩衝液pH8.0、最初のスピンの完了時に各フィルタユニットへの転送洗浄バッファーで各1.5 mlチューブを洗浄します。
- プールフィルタースルーとイソプロパノールで沈殿。
- 15μlのTEバッファーで再懸濁し、DNAペレット。
7。品質チェックCHIA-PET DNAのd増幅
- AgilentのDNA 1000年アッセイまたはAgilentバイオアナライザ2100アジレント高感度DNA Assayを用いて品質チェックを続行します。
- AgilentのDNAアッセイの電気泳動は、イルミナGenome AnalyzerのIIxはシーケンスに進む前に、平坦なベースラインと共に1つのピークのみが表示されます。
- イルミナGenome AnalyzerのIIxはシーケンシングに先立ち、CHIA-PETのDNAは、理想的には10nMの最低濃度を持つ必要があります。フローセルにロードするサンプルの量を決定するためにイルミナのqPCR定量化プロトコルのガイドに従って、4点定量PCRを実行します。また、次のようにワンポイント定量PCRを行います。
- 100 PM、午後10時午後1時までのコントロールテンプレートを希釈する。イルミナのqPCR定量化プロトコルで説明されているように、コントロールテンプレートは、イルミナのプラットフォーム上でシーケンスの準備任意のライブラリとして定義されており、それは次の点でできるだけようになります。テンプレートのサイズ、GC含量とライブラリの種類。
- 午後10時までCHIA-PET DNAを希釈する。
- PCRは、0.1μlの定量PCRプライマー1.1、0.1μlの定量PCRプライマー2.1、5μlのLightCycler480 DNAのSYBR Green Iマスターミックス、3.8μLのヌクレアーゼフリー水とロシュ·ダイアグノスティックスはライトサイクラー480リアルタイムでテンプレート1μlの各希釈液の三連セットアップPCRシステム。テンプレートとしてのNuclease-Free Waterを1μlを使用して、2つのネガティブコントロールが含まれています。
- 初期変性
- 95°Cで5分間4.8°C / sの
- 増幅
- 95℃10秒4.8°C / sの
- 60°C 1分2.5℃/ sの
- 72℃30秒4.8°C/ sの
- 融解曲線
- 95°C 5秒間4.8°C / sの
- 65°C 1分2.5℃/ sの
- °Cごとに95°C 5買収
- 冷却
- 40°C、10秒2.0℃/ sの
- 初期変性
- ネガティブコントロールは全く増幅を示さないことを確認し、Ct値の標準偏差は、コントロールテンプレートの希釈系列から生成された標準曲線に基づいたライブラリテンプレートの濃度を計算する前に、0.1未満であることを確認します。
- 1.5pM intをロードすることにより、イルミナフロー細胞の表面上のクラスタを生成します。画面上の指示に従って、OイルミナCBOTクラスタ生成システム。
- ライブラリの品質を確認するために単一のレーンで3から454イルミナシーケンシングプライマーと4から454イルミナシーケンシングプライマーを用いてイルミナGenome AnalyzerのIIxは上の配列CHIA-PETのDNAに進みます。 -20℃で残りのCHIA-PETのDNAを保存するライブラリには、良いデータを持っている場合、サンプルレーンの結果に基づいて、必要に応じて、18から20000000ユニークな読み取りを得るために4から8レーンの追加実行するためのサンプルを準備します。
- フローセルにロードされたCHIA-PETのDNA量はイルミナのシーケンス制御·スタジオ、シークエンシングデータ解析ソフトウェアのバージョンに大きく依存します。バージョン2.9については、三分の一からのフィルタリングされた約21百万パスに相当する各タイルの最大容量の半分にローディング濃度範囲は、ペットの読み込み、約950万で読み込みます。
- 削減負荷が正しいベース呼び出しfを保証するために必要ですまたはリンカーのバーコード配列を含む。このエラーは、リンカが配列決定される場合も、同様のヌクレオチドの高い数が配列されたときなどのバーコード情報を取得するには、場合場合に発生します。バーコード情報が望まれていないと、リンカーは、全負荷濃度を使用することができ、読み取りされていない場合。
- オフラインベースの呼び出しによって変換qSeqファイルは、さらにCHIA-PETツールのインストールマニュアル(バージョン4.1)8に従ってCHIA-PETツールを使用して分析することができます。
C.描写CHIA-PETの結果
我々は正常に上記のようにChIPの材料の672 ngを使用したMCF-7細胞(CHM160とCHM163 9)でRNAポリメラーゼII抗体(8WG16)を使用して、CHIA-PETのライブラリを構築した。初期診断ゲルとして、CHIA-PETプロトコルのステップ6.2で述べたように、このPCR増幅ライブラリの実行時に、明るく、明確に定義されたバンドを表示( 図4を参照)を使用するすべてのPCRサイクルのために223塩基対の予想サイズ。
16 PCRサイクルは、CHIA-PETライブラリーを増幅するために使用され、17.1 ngの総収率が得られた。 CHIA-PETプロトコル( 図5を参照)のステップ7.1で述べたように、単一の、強烈な電気泳動のピークは、Agilent DNA 1000の分析を介して223塩基対の予想されるサイズで観察された。

図1。 ChIPの概要。MCF-7細胞は、空間的に隣接したクロマチンとの間に共有リンクでの結果を順次EthylGlycolビス(スクシンイミジルスクシネート(EGS)とホルムアルデヒドとの架橋デュアルです。架橋クロマチンは、細胞を溶解することで、固定したMCF-7細胞から得られたと核溶解は。クロマチンはその後200から600塩基対の大きさの範囲に断片化に供した。Proteiと超音波クロマチンを事前にクリアした後非特異的なDNAを除去するためにN G磁気ビーズは、事前にクリアクロマチンは、目的のクロマチンをキャプチャするために抗体をコーティングしたビーズで一晩免疫沈降を行った。

図2。超音波処理したクロマチン断片のゲル分析。100 bpのDNAラダーは、サイズの参考のために最初と最後のレーンに示されています。超音波処理したクロマチンは、長距離クロマチンの相互作用を取り込むことが理想的である200から600 bpの間に強い強度を表示します。

図3。 CHIA-PETの概要。断片化クロマチンの断片は、エンド平滑化と隣接MmeI制限部位を含むビオチン化ハーフリンカーに連結しています。無傷のクロマチン複合体は、その後の相互作用のDNA断片が県であるように、非常に希薄な条件の下でビーズから溶出させ、近接ライゲーションに供されるerentiallyお互いに連結した。逆架橋DNA結合タンパク質を除去するためにした後、MmeI消化その後、ストレプトアビジンビーズへの結合を選択的に精製されるタグ - リンカー - タグ(PET)の構造を解放するために実施されています。 PETの構造は、高スループットシーケンシング用のアダプタと連結されています。

図4。 PCR増幅後の嘉ペットのゲル分析25 bpのDNAラダーはサイズ参考のためにレーン1および5に示されています。レーンは2から4は、それぞれビーズ固定化テンプレートを2μlからPCRの16の後に生成された製品は、18とPCR増幅の20サイクルである。 223 bpの予想される大きさで、明るく、明確に定義されたバンドで示されるように、これは成功したライブラリです。それぞれのPCR反応の最低バンドはプライマーダイマーから構成されていながら、PCRのサイクル数が増加すると非特異的なスミアが生成されます。
図5。 223 bpの予想されるサイズの単一の強いピークと、成功したライブラリをプロファイリングするAgilent 2100バイオアナライザのエレクトロのイルミナ-454 CHIA -ペットアダプターライゲーションした。スクリーンキャプチャーを精製したAgilent 2100バイオアナライザの解析 。アジレントバイオアナライザアッセイは、通常わずかに予想を上回るサイズを報告しないことに注意してください。このケースでは、所望のピークではなく、223 bpの237 bpの下部に表示されます。これは、Agilentアッセイの10%の誤差範囲内にあります。
ディスカッション
CHIA-PETは、転写調節における長距離相互作用を識別するために開発した方法です。 CHIA-PETライブラリの品質を決定する重要な要因の一つはChIP材料の品質です。
ビデオに示すように、プロトコルは、セルをクロスリンクするEGSとホルムアルデヒドの使用が組み込まれています。より長いスペーサーアームを有する第二架橋試薬と組み合わせて、ホルムアルデヒドの使用は、単独で3,11,15ホルムアルデヒドによってバインドできませんでしたタンパク質の結合に役立つ可能性があります。我々は、堅牢な結合部位との長距離相互作用9を示しているこの方法でライブラリを構築した。しかし、架橋やチップの条件は、関心のある各要因のために最適化し、あまりにも多くの架橋は、超音波処理により断片化が困難になり、おそらく偽のクロマチンの相互作用が生じる可能性があるので、それは過剰架橋に重要ではありませんする必要があります。クロマチンの相互作用CHIA-PETによって識別されるこのような蛍光in situハイブリダイゼーション4などの別の方法によって検証する必要があります。
我々はクロマチン材料の100 ngの最小をお勧めします。我々はクロマチン材料の50 ngから質の良いライブラリを構築しているが、我々は、出発物質の大量の、それにより、各ライブラリのアンプリコンと冗長性を最小限に抑え、16未満のPCRサイクルでCHIA-PETライブラリーの構築を許可することを観察した。この下の冗長性は、それによってシーケンスの少ない車線の、より包括的なクロマチンの相互作用マップを有効にすると、より高いユニークなマップされたタグも使用可能なデータの割合が高いと相関していた。各チューブのビーズの最終的な詰め量はそれぞれ磁気およびセファロースビーズに50μlと100μlのでなければなりません。パックされたビーズのボリュームが述べたよりも小さい場合、DNA有利子ビーズの損失を最小化するために同様に事前にクリアブランク磁気またはセファロースビーズを用いた最小のパックボリュームにもたらす以降のステップでの。ちびのヒントや大規模なコアチップは、セファロースビーズをピペッティングするために使用されるべきです。
次の変更は、以前公開されCHIA-PETプロトコル5次の組み込まれた。まず、磁気Gビーズを洗浄中に、サンプルの損失を最小限に抑えるために使用された。また、セルフライゲーションハーフリンカーまたは/およびアダプタのアンプリコンであることが100 bpおよび138 bpのおおよそのサイズの非特異的なバンドを同定した。したがって、我々は、PCR増幅の間に非特異的バンドを最小限に抑えるために、ビオチン化半リンカーと454 GS20アダプタの濃度を減少させた。近接ライゲーションボリュームは、その後の精製工程中のサンプルの損失を最小限に抑え、また、試薬コストを節約するために50ミリリットルから10ミリリットルに減少した。また、ストレプトアビジンビーズにCHIA-PET DNAの最大のキャプチャを確保するためにビーズにCHIA-PETのDNAを固定するためにインキュベーション時間の増加となりました。
近接ライゲーションステップの間、キメラライゲーションTHAtは、必然的に非特異的とランダムに生成されたin vivoでクロマチンの相互作用で真を表すものではありません。したがって、任意のCHIA-PET実験からのデータの品質を評価するために、キメラ率が特定の塩基バーコードTAAGとATGT 5を持つ2つの異なる半リンカーの使用から推定される。ハイスループットシーケンシングした後、CHIA-PETシーケンスは、最初の8を区別することができる特定のライゲーション産物と非特異的ライゲーション産物から派生したリンカバーの組成と配列について分析されます。知られているキメラの割合(すなわち、ヘテロABリンカー)は、社内でMCF-7 RNAポリメラーゼII CHIA-PETのライブラリが15%未満である本。
CHIA-PETのシーケンスは、その後、すなわち2つのカテゴリ、セルフライゲーションペットと間ライゲーションのペットに分類されます。間ライゲーションのペットがiから派生している間にセルフライゲーションのペットは、クロマチンの断片の自己環状化ライゲーションから得られる2つの異なるDNA断片の間NTER-ライゲーション。後者は、同じ染色体(染色体内間ライゲーションペット)、あるいは両方のタグが2つの異なる染色体(染色体間の相互連結PETS)にマッピングされ、各タグのゲノム距離に基づいて3つのカテゴリに分割さです。我々は、異なるカテゴリ8を整理するCHIA-PETツールのソフトウェアパッケージを開発しました。これは、ライブラリ内にあるDNA断片に基づいて行われます。一般的には、小さなチップの断片は、より高い解像度を提供し、4キロバイト程度であるこれらのRNAポリメラーゼII CHIA-PETライブラリをカットオフします。
さらに、実際のクロマチンの相互作用は相互作用クラスタ内の間ライゲーションのペットの数をカウントすることによって、ランダムノイズと区別することができます。言い換えれば、高いPETカウントのクラスタは、実際のクロマチンの相互作用8であることの確率が高いと言われています。
私たちの偽陽性をフィルタリングするには偶然によって間ライゲーションのペットを形成することができる高濃縮アンカーからの上昇は、統計分析のフレームワークは、2つのアンカー8の任意の間ライゲーションのペットのランダムな形成を考慮して策定されています。
結論として、CHIA-PET技術は、地球規模でのクロマチンの相互作用ネットワークをマッピングすることができます。 CHIA-PETでのチップの実装では、ライブラリの複雑さとバックグラウンドノイズの低減を可能にします。さらに、チップは、特定の転写因子5に関連付けられた特定のクロマチンの相互作用の検討を可能にし、クロマチンの相互作用に特異性を追加します。
開示事項
利害の衝突が宣言されません。
謝辞
著者は、シンガポールのA * STARのサポートされています。さらに、MJFは、科学国立フェローシップとリー·クアンユーポスドクフェローシップの女性のためのA * STAR、国立科学奨学金、ロレアルでサポートされています。 YRはNIH ENCODEの助成金(R01 HG004456-01、R01 HG003521-01)でサポートされています。著者はまた、ビデオ編集およびさんミシェル·テオのために氏ギャラリー一覧ラヒム、シーンを撮影するため、特定の氏ケルビンイッセイ氏、チャン·カイ翔氏とシャーウィンガンの8ピクセルプロダクション、シンガポール、ビデオ撮影チームを認めるボイスオーバー。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| 4から20パーセント勾配TBEゲル | インビトロジェン | EC6225BOX | ステップB、6.3 |
| PEGを用いた5×T4 DNAリガーゼバッファー | インビトロジェン | 46300018 | ステップB、2.2 |
| 6パーセントTBEゲル | インビトロジェン | EC6263BOX | ステップB、6.8 |
| AgilentのDNA 100アッセイ | アジレント·テクノロジー | 5067-1504 | ステップB、7.1 |
| Agilentの高感度DNAアッセイ | アジレント·テクノロジー | 5067-4626 | |
| アジレントバイオアナライザ2100 | アジレント·テクノロジー | G2940CA | |
| (スピン-X)管フィルタを遠心 | コーニング | CLS8160 | ステップB、3.7と6.9 |
| ダークリーダーネーター | クレア化学研究所 | DR46B | ステップB、6.8 |
| デジタル超音波処理細胞攪乱 | ブランソン | 450D-0101063591 | 、4.3ステップ |
| DynaMag-2磁石(磁性粒子コンセントレータ) | インビトロジェン | 123-21D | 洗浄工程のすべての磁気ビーズのために、7.5.1ステップBステップ |
| DynaMag-15マグネット(磁気粒子コンセントレータ) | インビトロジェン | 123.01D | 、5とステップ6 |
| DynaMag-PCR(磁性粒子コンセントレータ) | インビトロジェン | 49から2025 | ステップB、6.5 |
| 大腸菌DNAポリメラーゼI | NEB | M0209 | ステップB、5.6 |
| GlycoBlue | Ambionの | AM9516 | 、7.5.1ステップB、4.3および6.5のステップ |
| イルミナCBOTクラスタ生成システム | イルミナ | SY-301-2002 | ステップB、7.4 |
| イルミナGenome AnalyzerのIIxは | イルミナ | SY-301-1301 | ステップB、7.5 |
| イルミナPEプライマー | イルミナ | PE-102-1004 | ステップB、5.4(必要に応じて) |
| インテリミキサー | Palicoバイオ | RM-2L | ステップB、回転を持つ任意のインキュベーション |
| ライトサイクラー480リアルタイムPCRシステム | ロシュ社 | 04 640 268 001 | 、7.5.3ステップBステップ、7.3 |
| LightCycler480 DNAのSYBR Green Iマスターミックス | ロシュ社 | 03 752 186 001 | ステップB、7.5.3 |
| M-280ストレプトアビジンDynabeads®を | インビトロジェン | 11206D | ステップB、5.2 |
| 磁気(ダイナ)プロテインG | インビトロジェン | 100.03D | 、5.1.1および5.2.1のステップ |
| 高密度(2ミリリットル)をMaXtract | キアゲン | 129056 | 、7.5.1ステップ |
| 高密度(50ミリリットル)をMaXtract | キアゲン | 129073 | ステップB、4.2 |
| MmeI | NEB | R0637 | R0637 |
| アーゼONEリボヌクレアーゼ | プロメガ | M426C | ステップB、4.8 |
| RNAポリメラーゼII(8WG16)モノクローナル抗体 | Covance | MMS-126R | ステップ5.2.4 |
| オークリッジ遠心管(ポリプロピレン) | ナルゲン | 3119-0050 | ステップ3.1 |
| オークリッジ遠心チューブ(テフロンFEP) | ナルゲン | 3114-0050 | ステップB、4.3 |
| Phusイオンハイ·フィデリティマスターミックス | Finnzymes | F-531 | Bは、ステップ6に |
| ピコグリーン(クワント-IT)のdsDNA試薬 | インビトロジェン | P11495 | ステップ7.5.2 |
| ポリスチレン丸底試験管 | BDバイオサイエンス | 352057 | 4.1ステップ |
| プロテアーゼインヒビターカクテル錠(完全、EDTAフリー) | ロシュ社 | 11873580001 | 、1.6以降のステップ |
| プロテイナーゼK溶液(20mg/ml) | Fermentas | E00491 | 、4.4、7.5.1ステップ ステップB 4.1 |
| T4 DNAリガーゼ | Fermentas | EL0013 | ステップB、2.2、3.9および5.4 |
| T4 DNAリガーゼ緩衝液(NEB) | NEB | B0202S | ステップB、3.3および3.9 |
| T4 DNAポリメラーゼ | プロメガ | M4215 | ステップB、1.2 |
| T4 DNAポリヌクレオチドキナーゼ | NEB | M0201 | ステップB、3.3 |
| TruSeq SBSキットV5-GA | イルミナ | FC-104-5001 | イルミナGenome AnalyzerのIIxは、システムのリージェンツ |
| TruSeq PEクラスタキットV2-CBOT-GA | イルミナ | PE-300-2001 | イルミナCBOTクラスタ発電システムで使用できるようにするには |
| SYBR Green Iを | インビトロジェン | S-7585 | ステップB、6.3および6.8 |
| X細胞SureLockミニ細胞電気泳動システム | インビトロジェン | EI0001 | ステップB、6.3および6.8 |
| 名 | シーケンス | コメント | |
| ビオチン化したハーフリンカーA(200ng/μl) | トップ | 5 'GG CCG CGA / iBiodT / ATC TTA TCC AACの3' | 250ナノモル規模HPLC精製された内部ビオチンDT(9) |
| ボット | 5 'GTT GGA TAA GAT ATC GC 3' | 250ナノモルスケールHPLC精製 | |
| ビオチン化したハーフリンカーB(200ng/μl) | トップ | 5 'GGC CGC GA / iBiodT / ATA CAT TCC AACの3' | 250ナノモル規模HPLC精製された内部ビオチンDT(9) |
| ボット | 5 'GTT GGA ATG TAT ATC GC 3' | 250ナノモルスケールHPLC精製 | |
| 非ビオチン化したハーフリンカー(200ng/μl) | トップ | 5 'CGC GGC GAT ATC GGA TCC AACの3' | 250ナノモル規模PCRグレード |
| ボット | 5 'GTT GGA TCC GAT ATC GC 3' | 250ナノモル規模PCRグレード | |
| GS20アダプター(200ng/μl) | トップ | 5 'CCA TCT CAT CCC TGC GTG TCC CATCTG TTC CCT CCC TGT CTC AGN N 3 ' | 250ナノモル規模PCRグレード |
| ボット | 5'CTG AGA CAG GGA GGG AAC AGA TGG GAC ACG CAG GGA TGA GAT GG 3 ' | 250ナノモル規模PCRグレード | |
| GS20アダプターB(200ng/μl) | トップ | 5 'CTG CAC AGA GCA ACA GGG GAT AGG CAA GGC ACA CAG GGG ATA GG 3' | 250ナノモル規模PCRグレード |
| ボット | 5 'CCT ATC CCC TGT GTG CCT TGC CTA TCC CCT GTT TGT GCG CTC AGN N 3' | 250ナノモル規模PCRグレード | |
| イルミナ-NNアダプタ | トップ | 5 'ACA CTC TTT CCC TAC ACG ACG CTC TTC CGA TC 3' | 250ナノモルスケールHPLC精製は、ステップB、5.4を参照してください。 |
| ボット | 5 'リン - GAT CGG AAG AGC TCA GGT GCA GGA ATG CCG AG 3' | 250ナノモルスケールHPLC精製は、5 '末端は、ステップBを参照してください5.4リン酸化 | |
| イルミナ1から454(フォワード)プライマー(10μM) | 5 'AAT GAT ACG GCG ACC ACC GAG ATC TAC ACC CTA TCC CCT GTG TGC CTT G 3' | 250ナノモル規模PCRグレード | |
| イルミナ2から454(リバース)プライマー(10μM) | 5 'CAA GCA GAA GAC GGC ATA CGA CGG GAT TCC ATC TCA TCC CTG CGT GTCの3' | 250ナノモル規模PCRグレード | |
| 定量PCRプライマー1.1(10μM) | 5 '→3 AT AAT GAT ACG GCG ACC ACC GAG' | 10nmole規模PCRグレード | |
| 定量PCRプライマー2.1(10μM) | 5 'CAA GCA GAA GAC GGC ATA CGA 3' | 10nmole規模PCRグレード | |
| イルミナの3から454シークエンシングプライマー(100μM) | 5'TGC GTG TCC CAT TTC CTG CCT CCC TGT CTC AG 3 ' | 100nmoleスケールHPLC精製 | |
| イルミナの4から454の配列決定プライマー(100μM) | 5'GTG CCT TGC CTA TCC CCT GTT TGT GCG CTC AG 3 ' | 100nmole規模HPLC精製 | |
統合されたDNAテクノロジー(IDT)からオリゴおよびアダプタのテーブル。注文オリゴは、10前述と同様にリンカーおよびアダプタを準備します。ハーフリンカーとアダプタあらかじめ準備され、-20℃で数ヶ月の保存が可能
参考文献
- Cai, S., Lee, C. C. SATB1 packages densely looped, transcriptionally active chromatin for coordinated expression of cytokine genes. Nat. Genet. 38, 1278-1288 (2006).
- Cook, P. R. The organization of replication and transcription. Science. 284, 1790-1795 (1999).
- Das, P. M., Ramachandran, K. Chromatin immunoprecipitation assay. Biotechniques. 37, 961-969 (2004).
- Deng, W., Blobel, G. A. Do chromatin loops provide epigenetic gene expression states. Curr. Opin. Genet. Dev. 20, 548-554 (2010).
- Fullwood, M. J., Han, Y. Chromatin interaction analysis using paired-end tag sequencing. Curr. Protoc. Mol. Biol. Chapter 21, 21-25 (2010).
- Fullwood, M. J., Liu, M. H. An oestrogen-receptor-alpha-bound human chromatin interactome. Nature. 462, 58-64 (2009).
- Jackson, D. A., Hassan, A. B. Visualization of focal sites of transcription within human nuclei. EMBO J. 12, 1059-1065 (1993).
- Li, G., Fullwood, M. J. ChIA-PET tool for comprehensive chromatin interaction analysis with paired-end tag sequencing. Genome Biol. 11, R22(2010).
- Li, G., Ruan, X. Extensive Promoter-Centered Chromatin Interactions Provide a Topological Basis for Transcription Regulation. Cell. 148, 84-98 (2012).
- Ng, P., Wei, C. L. Paired-end diTagging for transcriptome and genome analysis. Curr. Protoc. Mol. Biol. Chapter. Chapter 21, 12(2007).
- Nowak, D. E., Tian, B. Two-step cross-linking method for identification of NF-kappaB gene network by chromatin immunoprecipitation. Biotechniques. 39, 715-725 (2005).
- Osborne, C. S., Chakalova, L. Active genes dynamically colocalize to shared sites of ongoing transcription. Nat. Genet. 36, 1065-1071 (2004).
- Rippe, K., von Hippel, P. H. Action at a distance: DNA-looping and initiation of transcription. Trends Biochem. Sci. 20, 500-506 (1995).
- Schoenfelder, S., Sexton, T. Preferential associations between co-regulated genes reveal a transcriptional interactome in erythroid cells. Nat. Genet. 42, 53-61 (2010).
- Zeng, P. Y., Vakoc, C. R. In vivo dual cross-linking for identification of indirect DNA-associated proteins by chromatin immunoprecipitation. Biotechniques. 41, 694-698 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved