Method Article
シンプルで堅牢なと in vitroでアプローチ
要約
を経由して植物細胞に複数のウイルス成分の配信を同期化する、シンプルで効率的かつ強力な方法アグロバクテリウム媒介一過性の発現が記載されている。このアプローチは、レプリケーションを研究するための従順で、カプシドは続く in vitroで再構築の非ウイルス性成分のゲノムには、生物医学アプリケーションに適した光学ウイルスの幽霊を枯渇。
要約
ヒト、動物や植物、子孫カプシド成熟し安定したウイルス粒子へのプラスセンスRNAゲノム病原性のウイルスで、特定のホストの感染の確立時に基本的な位相である。したがって、キャプシドの研究では、ノウハウ感染性ウイルス粒子を形成するためにウイルスのアセンブリを制御するメカニズムのに関する情報を解読する。このような情報はウイルスの拡散や病気のコントロールを抑制する新規の方法を定式化する際に不可欠である。ウイルスのキャプシドは 、in vivo および in vitro で研究することができる。 in vivoでのゲノムのカプシドは、巨大分子の相互作用と細胞内局在を含む高度に調節の選択のプロセスです。したがって、in vivoでのウイルスのキャプシドを包含するイベントを分析するために主要な研究は、ウイルスが増殖し、組み立てる方法を理解する基本的な知識を提供するであろう。最近のin vitroカプシドに医学IMAの分野で研究のために利用されていますパトンと治療への応用。非エンベロープ植物ウイルスは、負に帯電した異物の in vitro でのキャプシドでの合弁会社ではるかに先に立っている。ブロムモザイクウイルス(BMV)、植物への非エンベロープ多RNAウイルスの病原性は、in vivoおよび in vitro におけるゲノムパッケージングを研究するためのモデル系として使用されています。 ニコチアナベンサミプラントのカプシド形成アッセイのために、 アグロバクテリウム媒介一過性の発現は、agroinfiltrationなどを参照して同じセルに複数のコンポーネントの同期配信および発現のための効率的で堅牢な技術です。このアプローチでは、desiredviral mRNAのcDNAを運ぶバイナリープラスミドベクターを有するアグロバクテリウムツメファシエンスの細胞の懸濁液を1 mlの使い捨て注射器(針なし)よりも洗練されたものを使用していない間隙withina葉に浸透されています。植物細胞へのDNA挿入物の転送では、このプロセスの結果、T-DNAインサートは、核内に一時的に留まり、その後ホストポリメラーゼIIによって転写される、一過性の発現につながる。得られたmRNA転写物は(キャップとポリアデニル化)し、翻訳の質に輸出されています。インキュベーションは、約24から48時間後、浸潤葉のセクションはmicroscopyor生化学分析のためにサンプリングすることができます。 Agroinfiltration同時にトランスフェクトされる細胞の大量(数百から数千個)を許可します。 in vitroでのキャプシドのために、BMVの精製ウイルス粒子を遠心分離によりRNAを除去すると非解離のビリオンに続く解離緩衝液を含む塩化カルシウムに対して透析によってキャプシドタンパク質に解離しています。ゲノム枯渇キャプシドタンパク質のサブユニットは、希望するウイルスゲノムのコンポーネントまたはそのような色素インドシアニンなどの非ウイルス性のコンポーネントで組み立てられます。
プロトコル
1。植物性の素材
- キャプシドアッセイで使用されるタバコベンサミ植物は、4葉期(約3-4週齢の植物)であるべきである。
2。 agroinfiltrationによる植物細胞への機能的なウイルスゲノムのコンポーネントの配信と表現
- 1日目:アグロバクテリウム株(例えば、EH 105またはGV 3101)pCass-BMV RNA 1、BMV RNA 2とBMV RNA 3 1,2を保有する 50のカナマイシンmg / mlのを補ったLB寒天プレート上で増殖されている(ために選択します。 pCASSベクトル)とリファンピシンの100mg/ml()は、アグロバクテリウムのために選択します。インキュベーションは、二日間28℃で実施されています。
- 3日目:カナマイシン50 mg / mlおよび28℃で1日リファンピシン100 mg / mlの250℃RPMに設定オービタルシェーカーでCを含有するLB培地2 mlのLB寒天プレートから単一コロニーを接種。
- 4日目:LBブロスサプリメントの50ミリリットルを接種カナマイシン50 mg / mlおよびリファンピシン、10mMのMES pHは5.6と28で16時間の三角フラスコ250mlの文化の1ミリリットル〜250 RPMでオービタルシェーカー上でCと100mMのアセトシリンゴンの100 mg / mlのとED 。
- 5日目:4℃で5000rpmで10分間オークリッジ管または滅菌ファルコンチューブと遠心分離機に(OD 600が 1.0に達したとき)文化を転送
- このステップの抗生物質の完全な除去を確実にする1つのより多くの時間を繰り返して、4℃で5000rpmで10分間、10mMのMgCl 2、遠心10mlにペレットを溶解する。
- 10mMのMgCl 2および10mM MES(pHは5.6)を含む10 mlのバッファーでペレットを一時停止します。
- BMV RNA 1、2、RNA RNA 3の各カルチャのOD 600を測定し、10mMのMgCl 2と10mMのMESを液(pH 5.6)を使用して、0.1 OD 600に調整します。
- 各3つのすべての0.1 OD 600の培養懸濁液1ミリリットルを混ぜる。
- アセトシリンゴン、ミックスゲント100mMのを追加します。LY、3時間室温で混合物が邪魔されずに保持します。
- 1mlに培養懸濁液を描画します。針なしの注射器。
- N. 2-3よく展開葉の背軸側に上記培養懸濁液を浸透させるそっと葉の背軸面の半分に注射器を押すことによって、 ベンサミ (5葉期、3から4週齢の植物)。
- 他の葉に浸潤この手順を繰り返します。
- 24℃で緑色の家に浸透植物を保つ
- 浸透の収穫は3から4日後の浸潤を(dpi)のままになります。
3。 BMVビリオンの精製
- Nを収集するベンサミはすべての 3つの野生型BMVのagrotransformantsを含む混合物でagroinfiltrated残します。
- 0.08 M MgAc、使用直前に追加されるβ-メルカプトエタノールのpHは4.5と1/100量、BMV抽出バッファー(0.5 M NAAC等量の(w / v)の滅菌乳鉢と乳棒の葉を挽く3)。ウイルス収量を最大にするために、それは研削容易かつ効率的に細胞破壊を促進する酸洗浄した砂(〜0.5〜1グラム)を追加することをお勧めします。
- モスリン布の2-3層を介して葉エキスをフィルタリングし、突風を収集します。
- 再び葉材の初期重量にBMV抽出緩衝液と等量のモスリン布上に保持された部分を挽く。
- モスリン布を使用してろ過手順を繰り返します。これらのステップは4℃で行われるべきである
- 遠心管にろ液を移し、懸濁液の色はライトグリーンに変わりまで室温で5分間予備冷却し、クロロホルムと渦の等量(またはシェイク)を追加します。
- 4℃、12,000 rpmで15分間乳化した溶液を遠心分離℃に
- 水相を収集し、残留クロロホルムを除去するためにマグネチックスターラーで30分間攪拌する。
- 滅菌遠心チューブに懸濁液を移す。
- アンダー1ミリリットル。クッションの3として10%ショ糖(ウイルス抽出用緩衝液で調製)。
- 4でベックマン超遠心機で3時間、30,000 rpmで遠心分離℃、
- 上清を捨て、(滅菌蒸留水で1/10に懸濁バッファー希釈BMV抽出緩衝液を調製するために)BMV懸濁バッファーの目的のボリュームでペレットを中断します。
- 上記の手順から部分的に精製されたビリオンの準備は、4℃で28000 rpmで150分間百分の10から40のショ糖密度勾配遠心分離に供される
- 手動で、または分留によるウイルスバンドを収集します。ウイルスバンドは白色光照明の下で青で表示されます。
- ウイルス懸濁液バッファを持つウイルスのサンプルを少なくとも50%を含むショ糖溶液を希釈します。
- 4でベックマン超遠心で30,000 rpmで3時間のショ糖溶液を含む希釈ウイルス℃を遠心分離
- 最後に、VIRの所望の量で高度に精製されたウイルスペレットを一時停止する私達は、懸濁バッファーを。
- OD 260で分光光度計を用いてビリオン(mg / ml)の濃度を測定します。

注意:RNAの内容に基づいて、BMVの吸光係数は5 4です。
- TEM下に表示することにより、ウイルス粒子の純度を確認します(図A)
4。 in vitroでアセンブリのためのキャプシドタンパク質サブユニットの準備
- 5 1Xウイルス解離バッファー(; 50mMトリスHCl、pH7.5で; 1.0mMのEDTA 1.0mMのDTTおよび0.5mM PMSF、0.5MのCaCl 2)の1リットルを準備します。
- Sambrook ら 6に記載の透析膜を準備します。
- 透析バッグにウイルスの精製に必要な濃度を分注する。
- 1Xウイルス解離緩衝液を含むビーカーにウイルスを含む透析バッグを置きます。
- 4°C薬用で24時間透析eは、攪拌した。
- 4℃で15分間12,000 xgで24時間遠心した後、透析バッグから溶液を回収℃にこれは解離ビリオンからBMV RNAを分離します。
- 4ペレット°Cの任意の非解離ウイルス粒子で3時間ベックマン遠心機で35,000 rpmで遠心上清を収集します。
- 上清を収集します。
- この段階では、解離したキャプシドタンパク質のサブユニットから任意の汚染ビリオンRNAを除去するために不可欠です。これを行うには、ステップ8から上清を高速遠心(3時間で30,000 rpmで、続いて任意のRNAを(RNA 1Xアセンブリバッファには、以下を参照してください)を加えることなく、キャプシドタンパク質サブユニットの再構築上の夜の別のラウンドを行うべきである4℃)、ペレット、任意の組み立てビリオンへ。この再構築ステップの後、上清を含有するコートタンパク質のサブユニットは、任意の残留汚染RNAの自由でしょう。しかし、これを確実にするためには、vで、追加を実行することをお勧めしますRNA 1Xアセンブリバッファを使用した場合にのみコートタンパク質サブユニットと再構築itro。再構築上の夜の後、準備が(TEMを使用して確認)組み立てられたビリオンの自由でなければなりません。
- OD 254および280 nmで測定することにより、またはそのようなブラッドフォードアッセイのような他の方法により、キャプシドタンパク質サブユニットの濃度を決定します。
- 12から15パーセント解離キャプシドタンパク質サブユニットの整合性を決定するためにウェスタンブロット、続いてSDS-PAGEを行います。
(5)RNA の in vitroアセンブリでビリオンを含む
- ビリオンに再組み立てするRNA転写物を調製し、濃度7を計算します。
- カプシドタンパク質のサブユニットを混在させると1:5(wt / wt)の5の比率で転写RNAの。
- 透析バッグと、任意のリークを防ぐため、適切にセキュリティで保護された上記混合物を分注する。
- 千ミリリットルを準備します。 5 RNA 1Xアセンブリバッファ(; 50mMトリス-HCl、pH7.2で; 10mMのKClを5mMのMgCl 2、1.0mMのDTT 50mMのNaCl)の。
- ビーカーに1Xアセンブリ緩衝液に対して反応混合物を含有する透析バッグを置いて、かき混ぜる。
- 穏やかに撹拌により24時間4℃で再アセンブリ反応を透析。
- 24時間後に透析バッグから物を収集し、RNAアセンブリバッファの1.5ミリリットルを追加します。
- 30分間低速(2,000×g)で遠心分離することによってセントリコン-100カラムを介して、この混合物を渡します。
- 30分間、4℃でアセンブリバッファの1.5ミリリットルで一回カラムを洗浄します。
- 二回上記洗浄工程を繰り返します。
- 最後に、4℃で10,000 gで遠心分離して再組み立てビリオンを溶出℃を5分間。
- OD 260 nmでビリオン濃度を推定する。
6。光学ウイルスゴーストの作製(OVGs)
- 所望の濃度比で精製されたキャプシドタンパク質(このレポートで使用されているインドシアニングリーンとキャプシドタンパク質の重量比が1:10であった)にグリーン(ICG)8インドシアニン追加 dは、ピペッティングにより混和します。
- キャプシドタンパク質を透析とOVGアセンブリバッファ(1 M NaCl及び1mMのDTT、pH4.8、50 mMのNAAC; 1mMのEDTA)に対してソリューションをICGの4℃で24時間C。
- 24時間後、4℃で1時間90,000 rpmで透析バッグ(12 kDaの孔の大きさ)と、遠心機から溶液を回収°C(図B)
- 4℃でボルテックスまたはそれが一晩BMVの懸濁緩衝液中でそれ自体で中断することにより、上清を除去し、BMV懸濁バッファーに懸濁し
- TEMによるOVGs(図C)の形態を確認します。
- 240 nmから分光光度計(ローリー50、バリアン社製)を用いて950 nmの吸光度を測定し、ICGの存在は、700 nmと790 nmの約8署名の吸光度のピークが確認された。 (図D)
- 〜700 nmと〜800 nmでの典型的なICG蛍光ピークは、分光光度計を使用してOVG液の620 nmの励起(図D)(Fluorolog 3、ジョバンイボン - )に見ることができます。

N.から精製されたネガティブ染色BMVビリオンの図A. TEM像ベンサミ植物は、すべての3つの野生型BMVのagroconstructs(スケールバー= 100 nm)の混合物でagroinfiltrated。

in vitroでの図Bペレットは、高速遠心分離後に含むOVGs ICGの組み立て。

ネガティブ染色ICGの含むOVGsの図CのTEM像(スケールバー= 100 nm)を。
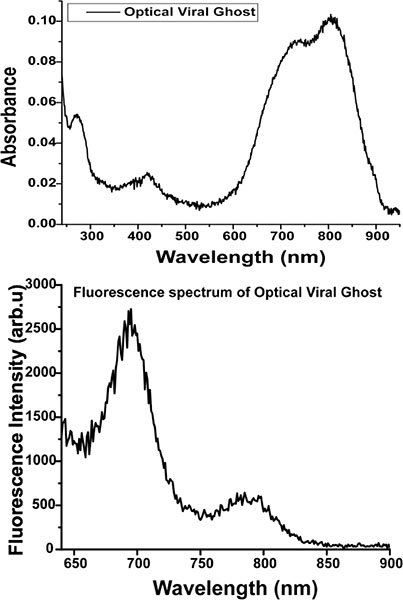
OVGs 図D.吸光度(上)および蛍光(下)スペクトル。 OVG放出wに対して使用される励起波長620 nmの。
ディスカッション
ここに提示Agroinfiltrationのアプローチは、広く植物ウイルスの広い範囲に適用することができます。このアプローチの特徴機能は同じ細胞一般に植物ウイルスの日常的に使用される機械的な接種に関連付けられている主な欠点に複数のagroconstructの配信を同期化されています。in vivoおよび in vitroのアセンブリの研究ではモデルとしてブロムモザイクウイルスを用いて効率的に行うことができるいくつかのヒント(I)Nの成功した浸潤については、次のベンサミ葉は、浸潤前に水を24時間工場をしません。浸潤が4月5日PMの間で行われた場合(ⅱ)アグロバクテリウム懸濁培養では、容易に細胞内の空間に広がるであろうこと、(iii)文化の光学密度を超えてはなりませんOD 600で1.0。高い細胞密度agroculturesの浸潤が著しく、ウイルスの複製とその後のビリオンに影響を与える可能性が細胞毒性と葉の老化9,10を誘導することが知られて形成すること、(iv)浸潤穏やかな圧力の間には、植物の免疫応答を誘発するかもしれません葉に甚大な被害を防ぐため、葉の背軸側に適用する必要があり、10%〜40%(v)のショ糖密度勾配を行うことができます。 BMVの懸濁緩衝液中でショ糖の25%を行うことによってチューブ(最高濃度と最低濃度を加えると2 すなわち 、10%+ 40%/ 2 = 25%で割って)にし、直ちに-80℃で凍結温度2℃ -4時間、さらにスクロースがまっすぐの位置に4℃で一晩維持することによって徐々に解凍することができます。
開示事項
我々は、開示することは何もありません。
謝辞
著者らは、agroinfiltrationの開発およびin vitroアセンブリアッセイにおけるそれらの貴重な提案のための研究室のいくつかのメンバーに感謝したいと思います。この作品は、カリフォルニア大学からの助成金によって賄われていた。本研究では、国立科学財団(CBET-1144237)からの助成金によって部分でサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| MESのナトリウム塩 | Sigma-Aldrich社 | M2993 | |
| インドシアニングリーン | Sigma-Aldrich社 | I2633 | |
| ベックマン超遠心 | ベックマン·コールター | モデル:L8-70M | |
| セントリコン-100カラム | ミリポア | YM-100 | |
| 分光光度計 | キャリー50、バリアン社 | 部品番号 10068900 | |
| 蛍光光度計 | Fluorolog 3、ジョバンイボン - 。 | 部品番号FL3-21 |
参考文献
- Annamalai, P., Rao, A. L. Replication-independent expression of genome components and capsid protein of brome mosaic virus in planta: a functional role for viral replicase in RNA packaging. Virology. 338, 96-111 (2005).
- Annamalai, P., Rofail, F., Demason, D. A., Rao, A. L. Replication-coupled packaging mechanism in positive-strand RNA viruses: synchronized coexpression of functional multigenome RNA components of an animal and a plant virus in Nicotiana benthamiana cells by agroinfiltration. J. Virol. 82, 1484-1495 (2008).
- Annamalai, P., Rao, A. L., Foster, N., Johansen, H. . Plant Virology Protocols. 451, 251-264 (2008).
- Lane, L. C. The bromoviruses. Adv. Virus Res. 19, 151-220 (1974).
- Choi, Y. G., Rao, A. L. Molecular studies on bromovirus capsid protein. VII. Selective packaging on BMV RNA4 by specific N-terminal arginine residuals. Virology. 275, 207-217 (2000).
- Sambrrok, J., Russel, D. W. . Molecular Cloning. A Laboratory Manual. , (2001).
- Dreher, T. W., Rao, A. L., Hall, T. C. Replication in vivo of mutant brome mosaic virus RNAs defective in aminoacylation. J. Mol. Biol. 206, 425-438 (1989).
- Jung, B., Rao, A. L., Anvari, B. Optical nano-constructs composed of genome-depleted brome mosaic virus doped with a near infrared chromophore for potential biomedical applications. A.C.S. Nano. 5, 1243-1252 (2011).
- Voinnet, O., Lederer, C., Baulcombe, D. C. A viral movement protein prevents spread of the gene silencing signal in Nicotiana benthamiana. Cell. 103, 157-167 (2000).
- Wroblewski, T., Tomczak, A., Michelmore, R. Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis. Plant Biotechnol. J. 3, 259-273 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved