Method Article
心臓組織工学のためのフィブリンゲルにおける心筋細胞のカプセル化
要約
我々は、新生児の心筋細胞と組織工学のためのフィブリンハイドロゲルの構造でカプセル化するための細胞の調製の分離を説明します。我々は、電気刺激と細胞の生存および免疫組織染色により発生する活性力を含む培養期間後に心筋培養組織を分析するための方法を説明します。
要約
三次元ハイドロゲルの環境で培養する細胞は組織工学のための構造を開発するだけでなく、in vitroで種々の培養条件下で細胞応答を研究するための重要なテクニックです。三次元環境では、より密接に細胞が原因で、すべての次元1の機械的および化学的刺激のアプリケーションに、in vivoで観察するものを模倣している。三次元のヒドロゲルは、どちらかのようなPEG - DA 2およびPLGA 3またはそのようなコラーゲン4、ヒアルロン酸5またはフィブリン6,7のような天然のタンパク質の数などの合成高分子から行うことができます。フィブリン、天然由来の血液凝固タンパク質、から作成されたハイドロゲルは、身体の自然な創傷治癒のプロセス8の一部であるメッシュを形成するために重合することができます。フィブリンは、組織工学のために理想的な一時的な足場作り、細胞分解性と潜在的に自家9です。
ここでは、3つの日齢の仔ラットと組織工学のためのフィブリンハイドロゲルの構造でカプセル化するための細胞の調製から詳細に新生児心筋細胞の単離を説明します。新生児の心筋細胞は、心臓組織の形成と工学4のin vitro試験で使用される一般的な細胞源です。フィブリンゲルは、酵素トロンビンと混合フィブリノゲンによって作成されます。トロンビンは、他のモノマー10との相互作用の結合部位を明らかに、フィブリノーゲンからfibrinopeptides FPAとFPBを切断する。これらの相互作用は、単量体は、ヒドロゲルのメッシュを形成する繊維に自己集合させる。この酵素反応のタイミングがフィブリノゲンにトロンビンの比、またはトロンビンへのカルシウムの比率を変えることによって調整できるので、一つは射出成形金型は、異なる形状11,12の数で構築できます。さらに我々は文化は13ゲルを制約する方法により、結果として組織のアライメントを生成することができます。
培養静的条件下での二週間のための工学心臓組織の構成要素の後に、心臓の細胞が構造を改造し始めていると電気的ペーシングの条件6歳未満の収縮力を生成することができます。このプロトコルの一部として、我々はまた、機能的な心筋によって生成されたアクティブな力の分析、最終的な細胞の生存を決定するための電気刺激だけでなく、方法によって構築する(ライブデッド含む培養期間後に心筋の設計組織を分析するための方法を説明します。アッセイ)と収縮(ミオシン重鎖またはMHC)と心筋細胞間の細胞結合(コネキシン43またはCx43)のための重要な典型的なタンパク質の発現と形態を調べるために免疫組織染色。
プロトコル
1。新生児の心筋細胞の分離- 準備(前日)
このセクションで作成したソリューション:PBS -グルコース溶液は、メディアを停止します。
- 5 mLのペニシリン - ストレプトマイシン(100単位/ mlと、それぞれ100μg/ ml)を、250 mlの1X滅菌リン酸塩へのグルコースの1.98グラムは(PBS)緩衝生理食塩水追加することにより、PBS -グルコース溶液を調製し、追加で500 mlに溶液の体積をもたらす滅菌1X PBS。
- 250ミリリットル無菌ダルベッコ変法イーグル培地(DMEM)に25ミリリットルFBSおよびペニシリン - ストレプトマイシン(上記と同じ濃度)5mlを加えてメディアを停止し、滅菌が0.2ミクロンフィルターを通して濾過する前に滅菌DMEMを用いて500 mlにボリュームを持って準備する。
- 止血剤、#5鉗子、大きなハサミ、マイクロはさみ、およびメスハンドル(#4):オートクレーブによる分離に必要な手術器具を滅菌する。
2。新生児の心筋細胞の分離- 準備(収穫の日)
無菌性を維持するようにしてください
このセクションで使用されているソリューション:PBS -グルコース溶液、Betadine
- それぞれのごみには、2つの滅菌100ミリメートルペトリ皿を取る、フードに置き、氷冷PBS -グルコースの約10 mLで埋める。これらは、無菌培養フードの氷でいっぱいの氷のバケツに配置する必要があります。
- フードにBetadineの30〜40 mLを250 mLのビーカーを置きます。
- 37℃の水浴にボトル、シールし、所定の位置に50 mLの/ PBS -グルコースのくずを追加。
- 一人一人の場合は、ボンネットの作業面にunderpad吸収ベンチを置き、滅菌ドレープの中央の作業領域を触れないように注意して上に滅菌ドレープを置く。楽器に触れることなく無菌ドレープの上に手術器具と4 × 4ガーゼパッドをダンプします。再び非滅菌手袋で触れないように注意しながら、ドレープの上に滅菌した#20手術用メスの刃とダンプを開きます。
- フードに不透明な容器、場所の子犬にダムや場所から子犬を取る
- 滅菌手袋を着用してください
- 四分の内にガーゼを折る、Betadineビーカーに止血剤と場所でクランプ。
- メスハンドルの上に手術用メスの刃を入れ、脇に置きます。
3。新生児の心筋細胞の分離- 心臓解剖
このセクションで使用されているソリューション:Betadine、PBS -グルコース溶液
- 親指と人差し指の間に肩甲骨の間の皮膚をつまんで、非利き手で子犬を拾う。大きなハサミを使用して、ワンカットで子犬を斬る。背骨が完全に切断されていることを確認するために、子犬に転送の背面からカットしてください。
- betadine浸したガーゼと綿棒はの子犬胸。一緒に肩甲骨をつまんで子犬を固定します。心臓を露出する部分的な開胸術を行います。それによってscalpular解剖用リブを越えて心を強制的に、加圧力を増加させる。
- 大血管を切断し、心臓を削除するには、心臓の後ろにメス刃を実行します。氷の上にあるPBS -グルコースを含むペトリ皿の中心を置きます。
- ごみの各子犬のための手順1〜3を繰り返します。
4。新生児の心筋細胞の分離- 筋細胞の分離
このセクションで作成/使用されるソリューション:PBS -グルコース溶液、コラゲナーゼ溶液、停止液
- 心が分離された後、氷冷PBSのグルコース溶液で洗浄することにより、任意の残留血液や結合組織を除去、氷冷で新鮮なシャーレに心室組織と場所だけを分離するために心臓の上部1 / 3を削除する以前作成したPBSのグルコース、。
- 慎重にマイクロはさみとピンセットを用いて〜1立方ミリメートルに心を飾らない。
- 、無菌トランスファーピペットを取るピペットの口は直径約3 mmとしているハサミを使って先端を切断。 50 mlコニカルや氷の上で所定の場所に組織片およびソリューションのすべてを転送するピペットを使用してください。
- 37のボトルに15000タイプIIコラゲナーゼの仔の一腹当たりの単位(単位/ mgがたくさんに依存する)と場所を秤量℃のPBS -グルコースは、コラゲナーゼ溶液を作成するために事前に準備温めておいた。別々のボトルにも及び滅菌フィルタを混在させる。 37℃の水浴中に戻って置きます。同様に37℃の水浴にワンストップソリューションを置きます。
- みじん切りの組織は、遠心分離管の底に沈降することができます。総体積は約10 mLのようになるまで上清を取り除く。遠心分離管にコラゲナーゼ溶液7 mlを加え。
- 組織片を、37℃のインキュベーターまたはオーブン内のオービタルシェーカー上でチューブのラックへのコラゲナーゼとコニカルチューブを入れて。約60rpmでのオービタルシェーカーを回し、ドアを閉めます。 7分のタイマーを設定します。コラゲナーゼBACを配置してくださいそれを暖かく保つために水浴にK。
- タイマーがオフになると、フードに円錐形のバックをもたらす。また、暖かいコラゲナーゼをもたらすとフードにソリューションを停止する。ゆっくりと5〜7倍はそれらを分割するために組織片を滴定する。滴定後は、ピースが一番下(2-3分)にセトリングすることができます。組織片を吸うように非常に注意しながらできるだけ多くの上清をできるだけオフに吸引除去する。その後、組織片へのコラゲナーゼ溶液7mlのを追加し、7分間シェーカー上インキュベーターに戻して置きます。
- 残りの各ステップのために、穏やかに組織片を分割して10回滴定。組織片をしたら、落ち着く上清を描いて、円錐形の独立した50 mlに、それを収集する。組織片にコラゲナーゼ7 mlを加え、7分間再びダイジェスト。上清をチューブに、消化物からの上清のそれぞれを添加した後、異なる血清ピペットでストップ溶液10 mLを加える。
- コラゲナーゼのすべてが(合計で7段階)に使用されるまで繰り返します。
- 最終的な消化のステップの後、新鮮な円錐形に70μmの細胞のふるいを介して細胞液とフィルターで円錐形を取る。
- 5分間100グラムで、細胞をスピンダウンし、血球計数器を用いてカウントするDMEM 20mLに再懸濁し、氷上で細胞を置きます。
- 場所トリパンブルー溶液(75μlのトリパンブルー、125μlのPBS)に細胞を50μlは、数えるために血球計数器で10μlを入れる前によく混ぜる。死細胞は青色いる間、生きている細胞は明らかです。約80〜90%の生存率と、子犬ラットあたり約300万セルを期待する。
5。鋳造フィブリンゲルの構造- フィブリンゲルを作成するための準備(事前によくやった)
このセクションで作成したソリューション:フィブリノゲンの原液、トロンビン原液、プルロニックソリューション、心筋の構造のメディア。
- HEPESにゆっくり混合フィブリノゲンで0.9%生理食塩水に20 mM HEPES緩衝液にフィブリノーゲンの33 mg / mlストック溶液を調製は37℃で数時間かけて緩衝生理食塩水℃に解決策は2〜8℃で一晩沈殿することができます℃を37℃にソリューションを温める40μmのセルストレーナー、ガラスプレフィルターと0.45μmのボトルトップフィルタ、およびガラスプレフィルタによる0.2μmのボトルトップフィルター:解決策は、連続した一連のフィルタを通して滅菌濾過される。溶液を1 mL及び3 mLのアリコートに分注し、-20℃で保存されています
- を500μlと250μlのアリコートと凍結時に0.2μmのフィルター、分注しを通じて0.9%生理食塩水と滅菌脱イオン水、滅菌フィルター2 mLの18 mLにトロンビンの500 Uを追加することによってトロンビンの25 U / mlストック溶液を調製-80℃
- 脱イオン水700 mLにプルロニックF - 127の50gを溶解することにより、5%w / vのプルロニックF - 127溶液を調製します。追加の脱イオン水で1Lに液量を持ち出す。 0.2μmのフィルターで滅菌フィルター。プルロニックのソリューションは、各使用後に滅菌濾過した場合交換する前に、3回まで使用することができます。
- 10パーセントウマ血清、2%ウシ胎児血清、1%ペニシリン - ストレプトマイシン、および6 mg / DMEMにML -アミノカプロン酸を添加することによってメディアを構築心筋梗塞を準備します。アスコルビン酸の濃度50μg/ mlおよび25μMのHEPES中のインスリン濃度2μg/ mlの給餌直前に追加する必要があります。
- 一緒に1つテフロンロッド、一つテフロンスリーブ、注射の目的のために取り外さノッチ二つテフロンワッシャ、および2つのゴムO -リングを(図2a参照)置くことによってマンドレルを組み立てます。使用前にオートクレーブ。
- 金型とプランジャとして使用する3CC注射器のケーシングの外側の部分は6ccシリンジのケーシングを取る、と(図2a参照)ルアーロック両端を切断し、オートクレーブでそれらを準備します。
6。鋳造フィブリンゲルの構造- フィブリンゲルを作成するための準備(右フィブリンゲルの構造を作る前に)
このセクションで使用されているソリューション:プルロニックソリューション
- 滅菌フィルター使用前に0.2μmフィルターを5%プルロニックF - 127ソリューション。フードで1リットルのビーカーに5%プルロニックのソリューションへの場所は、マンドレルと注射器のケーシング。完全なコーティングを確保するためにボンネットに2〜3時間プルロニック液浸漬部分を残す。プルロニックソリューションコートマンドレルをしてマンドレルに付着するフィブリンゲルを防ぎます。
- 2〜3時間のインキュベーション後、戻ってボトルに5パーセントプルロニック液を注ぎ、ダウンフードの表面に滅菌ドレープを配置し、金型を構築するために滅菌手袋を着用してください。
- O -リングとテフロンワッシャ間の密封性を確保するためにプランジャーとして3CC注射器を使用して、6 ccシリンジのケーシング内に構築されたマンドレルを置きます。
7。鋳造フィブリンゲルは、射出成形を経由して構築
このセクションで作成したソリューション:F溶液、Tソリューション、細胞溶液。
- フィブリンゲル(3.3 mg / mLの最終フィブリノーゲン濃度、25 U / mLの最終的なトロンビン濃度)を1 mLを加えるには、20 mM HEPES緩衝液558μlにフィブリノゲンの株式の112μlを添加して、コニカルチューブにFのソリューションを作成する0.9%生理食塩水。別のコニカルチューブに、トロンビンの株式の17μlを、そして2 NのCaの1.3μlを添加してDMEM 135μlに+ +ソリューションをTソリューションを作成します。表1を参照してください。
- 第三コニカルチューブに、細胞の濃度、2940万細胞/ mLまたは構築物中の細胞の所望の最終濃度の6倍の濃度になるように細胞をスピンダウンし、ボリューム内の細胞を再懸濁することにより、細胞溶液を調製
- あなたがフィブリンゲル構造、準備18G 1 ½インチ長い針付1mLシリンジをキャストする準備ができたら。同様に準備ができて21G 1インチの針を持っている。
- Tソリューション::細胞溶液フィブリンソリューションは、F溶液の4時01分01秒の割合で作成されます。ゲルの1枚のMLを作るために、細胞液の167μLに続く、そして最後にTソリューションの167μlを追加、新しい50 ml遠心チューブにF溶液の667μLを加える。気泡を導入しないように注意しながら一緒に溶液を混合してピペット。ソリューションが混在して一度、反応が開始され、コンストラクトの注入を直ちに行う必要があります。
- 18G針で事前に準備された注射器を取るとフィブリンのソリューションを策定する。針になってから気泡を防ぐために注射器を反転しないように注意してください。 21G針で18G針を交換してください。気泡を強制的に静かに注射器をタップします。
- テフロンO -リングの溝は、次のストッパーとケーシングの間に金型内に注射器を挿入し、金型内にソリューションを注入する。完全な充填を確実にする上に溝を持つ金型を傾けて。シリンジを取り外し、残りの金型を埋めるために続けて。十分なゲル溶液は、同時に複数の金型を埋めるために作成することができます。解決策はすぐにゲル化するので、しかし、、それは一般的に6〜一定時間で注入構造の数を制限することをお勧めします。
- 37 3つのグループとインキュベーターまたはオーブンの代わりにパラフィルムで金型をラップ℃のゲルは、ゲル化時間が重合するように20分間鋳型でインキュベートすることを許可。
- 構造ごとの心筋構造培地21 mLで各培養瓶(Nalgeneストレートサイドjarを)埋める。 DMEMで大きなシャーレに構築物でマンドレルを強制的にプランジャーとケーシング滅菌3 ccシリンジを使用してください。その後、サンプル瓶にコンストラクトを配置します。各4オンスの瓶は2を保持することができますが、各16オンスの瓶は、6の構造を保持することができます。
- jarにキャップをネジ込み、インキュベーターに転送する。インキュベーターの内部に、ガス交換を可能にするために瓶のキャップを緩めます。
- 24時間後、滅菌歯科ピックを取ると(代表的な結果で、図2を参照)構造の均一な配向性を確保するために、リングの金型の両端に白いテフロンO -リングから離れて構築押してください。
8。解析手法(培養2週間後) - 収縮力テスト
このセクションで使用されているソリューション:DMEM、心筋の構造メディア。
- お風呂の電極に配線して刺激から来る鉛の上にワニ口クリップをクランプする。データ集録ボード、パルスジェネレータ、および力変換器の電源を入れます。力変換器は、5gの設定に切り替えると、ゼロにすべきである。力変換器からのデータを表示し、保存するカスタムLabVIEWプログラムを開きます。各サンプルのデータのフォルダ内に新しい、空のテキストファイルを作成します。
- 37℃の水浴中にDMEMを置き、それが構文をテストする前にウォームアップするための時間を考慮してください。一度暖め、場所37 ° C DMEM力測定システムの培地槽(図3Aを参照)へ。
- 静かにピンセットでテフロンのサポートから、構造のリングをスライドさせて、サンプルのjarファイルから構造を外し、力測定システムの培地槽に固定された金属ポスト上にコンストラクトを配置します。ピンセットでコンストラクトをつかまないでください!むしろ、プッシュピンセットを使用してマンドレルのサポートをオフに構築持ち上げます。
- トランスデューサーアーム上の構文のもう一方の端を置き、変換器が0.50Vを読み込むまでの間(約1.0グラムの力または張力の10 millinewtons)、締め
- に記録される収縮力のデータのテキストファイルを選択します。
- 心臓の刺激に(モデル#S88X、グラステクノロジー)、20V(8 V / cm)の、6msの持続時間、及び1 Hzの速度にパルス電圧を設定します。
- ボタンを"オン/オフ出力"を押すことにより、電気的ペーシングを開始します。
- 波形が規則的になるまで録音を開始します。
- 慎重に力測定システムの培地槽から構成要素を削除し、培養液中に戻して置きます。その後、力測定システムの培地槽からDMEMを削除し、additを分析するために、新鮮な、暖かいDMEMと交換してくださいionalサンプル。
- 構造をカットして、構造の長さと幅を測定することができるので、それをアンロール
- 実行可能性、組織型、またはウェスタンブロット測定を含む追加の解析測定に使用するセクションへの構築物をカット。
9。解析手法(培養2週間後) - 実行可能性のためのライブデッドアッセイ(Invitrogen社製LIVE / DEADアッセイ)14:
このセクションで使用されているソリューション:EthD - 1ストック溶液を、カルセインAMストック溶液をPBS
- PBSで3倍の5分間の洗浄でサンプルを洗浄します。
- 徹底的な混合を確実にするために無菌のPBSと渦の10mLに2mMのEthD - 1ストック溶液20μlを添加する。
- カルセインはEthD - 1溶液に在庫stolution午前4 mMの5μlを添加する。徹底的な混合を確実にするために、再度、渦。
- 構造をカバーするために上記の解決策の十分なボリュームを追加します。
- 室温で30分間(染料の光退色を防ぐために)覆われてインキュベートする。
- 色素を取り出し、冷めないようにPBSで置き換えます。観察し、蛍光顕微鏡で画像を記録する。エチジウムホモ二量体A - 1は、528 nmの光があると617 nmの光を発する一方カルセインは、494 nmの光により励起、517 nmの光を発している。サンプルの結果は、図4を参照してください。
10。解析手法(培養2週間後) - 重要な筋細胞のタンパク質の免疫組織化学:
このセクションで使用されているソリューション:PBS、PBS中4%paraformadehyde、PBSで5%ロバ血清、PBS、PBS中の0.1 ng / mLをヘキスト33258で抗体。
- PBSで3倍の5分間の洗浄でサンプルを洗浄します。
- 4℃で2-3時間のためのPBS溶液に4%パラホルムアルデヒドで固定し° C
- PBSで3倍の5分間の洗浄でサンプルを洗浄します。
- サンプルは現在、切片化し、染色された選択肢のプロトコルに従って、埋め込むことができます。このプロトコルの残りの部分は共焦点顕微鏡とイメージングのための全体構造染色をカバーしています。構造に拡散する抗体のためのより多くの時間がある必要があるとして、インキュベーション時間は、組織切片の場合と比べて長いことに注意してください。さらに、残りの手順のすべては、室温で実施しています。
- 細胞膜を透過性に30分間のサンプルをPBSで0.1%のTriton - Xを追加。
- PBSで3倍の10分間の洗浄でサンプルを洗浄します。
- 試料に二次抗体の非特異的結合をブロックするために1時間半のためのサンプルをPBSで5%ロバ血清を追加。
- コネキシン43(1:50希釈)およびミオシン重鎖(1:100希釈)で3時間の試料にPBSで一次抗体を追加。両方のタンパク質をラベルするために連続して、一次抗体は、異なるホスト(すなわち、ウサギおよびマウス)からのものであることを確認する必要があります。
- PBSで3倍の10分間の洗浄でサンプルを洗浄します。
- 3時間PBSで適切な蛍光標識二次抗体を追加。
- PBSで3倍の10分間の洗浄でサンプルをリンス
- ちょうど共焦点顕微鏡でイメージングが試料の前、15分間PBSで0.1 ng / mlのヘキスト33258を追加します。
- PBSで3倍の10分間の洗浄でサンプルを洗浄します。
- 共焦点顕微鏡とイメージング細胞(例の結果については、図4を参照)によってMHCとCx43のサンプルの発現を分析する。
11。代表的な結果/成果:
心筋細胞フィブリン構造は最初に金型の全体の幅(図2B)をカバーしています。に気泡が構造に存在してはいけません、それは全長にわたって均一になるはずです。培養2週間後、約1 / 4の初期の幅(図2C)のための構造を契約。
図3Bに示すように構造が私たちのカスタム収縮力装置(図3A)に電気的にペースになると、収縮力のデータを生成することができます。波形は力、収縮の速度、および緩和の速度を決定するためにMATLAB(MathWorks社)で別々に分析することができます。約1.3 MNの単収縮力は、6を期待されています。
構築物の細胞の生存率は、構造中への酸素の拡散制限があるため、構造の深さ、に依存しています。構造、図4Aの表面には、高い細胞生存率が観察される。共焦点顕微鏡、図4Bで、構造の整列構造は赤で示されて収縮、ために重要である、ミオシン重鎖、MHCによる観測される。緑色で示されているコネキシン43は、心筋細胞間の細胞結合のために必要です。
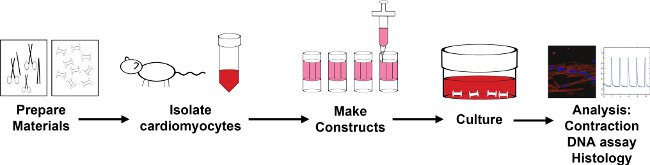
図1:カプセル化プロセスの概要
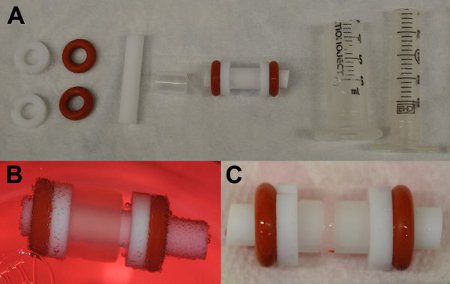
図2:フィブリンゲルを作成するための)個別および複合金型部品。あちこちにmは左から右に2つのテフロンワッシャー、二つのシリコーンOリング、テフロンロッド、テフロンチューブ、完成したマンドレル、マンドレル用アウターケーシング、およびプランジャー)。 B)アウターケーシング(0日)から放出直後の金型を構築します。文化の13日間以下の金型でC)コンパクト化構造(赤矢印)、。
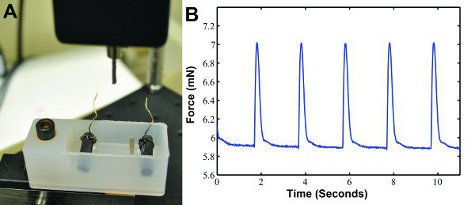
図3:記録の収縮力のための)カスタム収縮力の測定システム。後付力変換器は、収縮力を測定し、コンピュータに結果を出力します。ワイヤーで2つの炭素電極を含む浴はどのペース構造を電気刺激装置に接続します。二つの投稿では、場所の構造を保持する。 B)試料の収縮力の波形データは0.5 Hzの電気刺激で生成。
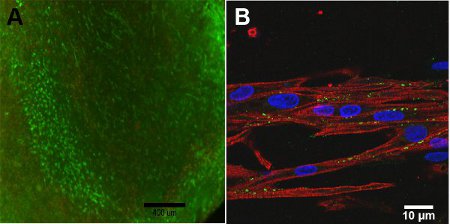
図4:構造、13日目(スケールバー= 400μm)の)ライブ/デッドアッセイ。緑は生きている細胞を表し、赤は死んだ細胞を表しています。ミオシン重鎖(赤)、コネキシン43(緑)とHoescht核染色(青色)(スケールバー= 10μm)のB)共焦点画像。
| Fソリューション | Tソリューション | セルソリューション | |||
| フィブリノゲン | 112μL | トロンビン | 17μlの | DMEMで細胞 | μL170 |
| HEPES | 558μl | のCa + + | μlを1.3 | ||
| DMEM | 152μL | ||||
| 合計 | 670μL | 合計 | μL170 | 合計 | μL170 |
表1。フィブリンゲルソリューション、ゲル1 mLのための量。
注:20mMのHEPESでフィブリノーゲン= 33 mg / mLのフィブリノゲンが緩衝生理食塩水
HEPES = 20mMのHEPES緩衝生理食塩水
0.81パーセントNaCl溶液にトロンビン= 25 U / mLの溶液
のCa + + = 2 Nの塩化カルシウム溶液
ディスカッション
心筋システムのin vitroモデルにおける一貫性と実行可能な三次元におけるフィブリンゲルの結果の新生児ラット心筋細胞のカプセル化。細胞が捕捉されたとき、彼らは代謝活性と、コンパクト化改造およびネイティブの心臓組織12との一貫性のある細胞外マトリックスを再作成することが可能であるため、フィブリンが望ましい生体材料です。我々は心筋細胞はこの環境で自分自身を整列することを可能にするので、それらの機能は、等方性の組織6に比べてより大きな収縮力で、その結果心筋のより特徴的です。潜在的な治療のアプリケーションでは、それは実行可能性と機能性の両方を促進する物質の中で細胞をカプセル化する必要があります。プロトコルは、3次元の微小環境における心筋細胞の挙動を制御するために、フィブリンネットワークを作成するための効率的かつ正確な手段を示すここで紹介。
いくつかの潜在的な問題は、これらのコンストラクトの作成と培養中に発生する可能性があります。つの潜在的な問題は大幅に構造の機能に影響を与える前に、カプセル化に細胞の生存率の維持、である。努力が分離し、フィブリンゲル内の細胞のカプセル化の間の時間を減らすことによって、分離後の細胞死を制限するためになされるべきである。構文は、厳密なスケジュールで一日おきにメディアを提供する必要があります。さらに、使用されるソリューションのすべてに均一性を確保することが重要です。フィブリノーゲン、トロンビンと細胞の混合物は、異機種環境を生成する場合、ECMを改造する細胞の能力は、機械的に夫婦と契約が潜在的に遮断されていない。エンジニアリング組織の継続性の乱れを防ぐために、構造の注入時の気泡の形成を防止することも重要です。この問題を緩和する一つの方法は、シリンジに構造を作り、ゆっくりと注入する必要以上のゲルを描くです。最後に、一度フィブリンマトリックスが設定されていると24時間培養液中にされている、それはフィブリンゲルの細胞ベースの圧縮を促進するため、リング型の側面から構造を切り離すことが不可欠です。金型の中央に構造を維持すること、ガスと栄養素の交換が容易になります。リングの金型の側面への付着はまた、所望の細胞整列が中断される場合があります。
その意識断頭は国立衛生研究所の両方からのガイドラインの下で承認された方法とアメリカ獣医学協会であるこのプロトコルでは安楽死の方法として使用されている点が重要です。しかし、一部の金融機関は、新生児ラットの断頭続いて麻酔を使用することをお勧めします。それは、摘出した心臓組織/細胞のための低酸素条件下での時間の最小量を保証するため、我々は意識的な斬首を選択している。低酸素の比較的少量では虚血と有意にこのプロトコルの結果に影響を与える可能性のある潜在的に心筋細胞死を、筋細胞につながることができます。
開示事項
利害の衝突は宣言されません。
謝辞
国立心肺血液研究所(賞#R00HL093358にLDB) - この作品は、国立衛生研究所によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| ナトリウム塩化 | シグマ | S7653 | PBS |
| カリウム塩化 | シグマ | P9333 | PBS |
| ナトリウム二塩基性リン酸 | シグマ | S7907 | PBS |
| 一塩基性リン酸カリウム | シグマ | P5655 | PBS |
| グルコース | シグマ | G5400 | 分離 |
| 止血剤 | ファイン科学ツール | 91308〜12 | 分離 |
| 細かいピンセット | ファイン科学ツール | 11251〜20 | 分離 |
| 大きなはさみ | ファイン科学ツール | 91401〜14 | 分離 |
| マイクロはさみ | ファイン科学ツール | 91501〜09 | 分離 |
| メスハンドル | ファイン科学ツール | 10008〜13 | 分離 |
| メス刃 | フィッシャーサイエンティフィック | 08から918 - 5A | 分離 |
| 吸収ベンチunderpad | VWR | 56617-014 | 分離 |
| 滅菌ドレープ | フィッシャーサイエンティフィック | GM42526 | 分離 |
| オートクレーブバッグ | フィッシャー | 01-812-54 | 分離 |
| ガーゼのパッド | フィッシャーサイエンティフィック | 13-761-52 | 分離 |
| betadine | パーデュー大学の製品 | 67618-150-01 | 分離 |
| 滅菌手袋 | フィッシャーサイエンティフィック | 19から020 | 分離 |
| 無菌トランスファーピペット | フィッシャーサイエンティフィック | 9962 | 分離 |
| コラゲナーゼ | ワージントン | CLS2 | 分離 |
| テフロンロッド1 / 4インチ直径 | マクマスター - カー | 8546K11 | 型の部 |
| テフロンチューブ1 / 4インチID、1 / 2インチOD | マクマスター - カー | 8547K31 | 型の部 |
| シリコンO -リング1 / 4インチID、1 / 2インチOD | マクマスター - カー | 9396K204 | 型の部 |
| テフロンチューブ1 / 4インチID、5 / 16インチ外径 | マクマスター - カー | 52355K14 | 型の部 |
| ケンドールmonojectシリンジ6cc | フィッシャーサイエンティフィック | 05-561-41 | 型の部 |
| BDシリンジ3CC | フィッシャーサイエンティフィック | 309585 | 型の部 |
| ウシフィブリノーゲン | シグマ | F8630 | 構築する |
| ウシトロンビン | シグマ | T7513 | 構築する |
| 1 M HEPES | シグマ | H0887 | 構築する |
| 塩化ナトリウム | シグマ | S7653 | 構築する |
| DMEM | インビトロジェン | 10569 | 構築する |
| プルロニックF - 127 | シグマ | P2443 | 構築する |
| 塩化カルシウム | シグマ | 383147 | 構築する |
| 0.2ミクロンフィルター | フィッシャーサイエンティフィック | SCGVT05RE | 構築する |
| 40ミクロンのセルストレーナー | フィッシャーサイエンティフィック | 22-363-547 | 構築する |
| 0.45ミクロンのボトルトップフィルター | コーニング | 430627 | 構築する |
| ガラスプレフィルター | ミリポア | AP2007500 | 構築する |
| 18G 1 1 / 2インチの長い針 | フィッシャーサイエンティフィック | 14から826 - 5D | 構築する |
| 21G 1インチの針 | フィッシャーサイエンティフィック | 14 - 826C | 構築する |
| jarファイルを構築する | フィッシャーサイエンティフィック | 2116 | 構築する |
| ペニシリン - ストレプトマイシン | インビトロジェン | 15140 | メディアの |
| 馬血清 | シグマ | H1138 | メディアの |
| ウシ胎仔血清 | インビトロジェン | 16000 | メディアの |
| アミノカプロン酸 | アクロスオーガニック | 103305000 | メディアの |
| アスコルビン酸 | シグマ | A5960 | メディアの |
| インスリン | シグマ | I9278 | メディアの |
| パラホルムアルデヒド、16% | 電子顕微鏡学 | 15710 | 組織学 |
| 最適な切削温度(OCT) | テッドペラ | 27050 | 組織学 |
| 2 - メチルプタン | フィッシャー | 03551〜4 | 組織学 |
| マウスMYH1/2/4/6一次抗体 | サンタクルスバイオテクノロジー | SC - 32732 | 組織学 |
| ウサギコネキシン43の一次抗体 | セルシグナリングテクノロジー | 3512 | 組織学 |
| Dylight 549 -結合ロバ抗マウス二次抗体 | ジャクソンイムノ研究所 | 715-505-151 | 組織学 |
| Dylight 488標識Donke抗ウサギ二次抗体 | ジャクソンイムノ研究所 | 711-485-152 | 組織学 |
| LIVE / DEADアッセイ | インビトロジェン | L - 3224 | 分析 |
参考文献
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 Forthcoming.
- Invitrogen. >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , Invitrogen. (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved