Method Article
La encapsulación de los cardiomiocitos en un hidrogel de fibrina para ingeniería de tejidos cardíacos
En este artículo
Resumen
Se describe el aislamiento de los cardiomiocitos neonatales y la preparación de las células para la encapsulación en las construcciones de hidrogel de fibrina para ingeniería de tejidos. Se describen los métodos para el análisis de la ingeniería tisular miocardio después del período de la cultura como fuerza activa generada a la estimulación eléctrica y la viabilidad celular y tinción inmunohistoquímica.
Resumen
El cultivo de células en un ambiente de hidrogel tridimensional es una técnica importante para el desarrollo de estructuras para la ingeniería de tejidos, así como el estudio de la respuesta celular bajo condiciones de cultivo in vitro diferentes. El entorno de tres dimensiones más se asemeja mucho a lo que las células de observar en vivo debido a la aplicación de estímulos mecánicos y químicos en todas las dimensiones de 1. Tridimensional hidrogeles pueden ser hechas de polímeros sintéticos, tales como el PEG-DA 2 y 3 PLGA o un número de proteínas naturales como el colágeno 4, 5 o ácido hialurónico 6,7 fibrina. Hidrogeles creado a partir de la fibrina, una proteína de la sangre natural de coagulación, puede polimerizar para formar una malla que forma parte de la curación del cuerpo de los procesos naturales de la herida 8. La fibrina es la célula-degradables y potencialmente autólogo 9, por lo que es un ideal andamiaje temporal para la ingeniería de tejidos.
A continuación se describe con detalle el aislamiento de los cardiomiocitos neonatales de tres crías de rata día de edad y la preparación de las células para la encapsulación en las construcciones de hidrogel de fibrina para ingeniería de tejidos. Miocitos neonatales son una fuente de células comunes que se utilizan para estudios in vitro en la formación de tejido cardíaco y la ingeniería de 4. Gel de fibrina se crea por el fibrinógeno se mezcla con la enzima trombina. Trombina escinde fibrinopéptidos FPA y FPB de fibrinógeno, revelando los sitios de unión que interactúan con otros monómeros 10. Estas interacciones causa de los monómeros que se auto-ensamblan en las fibras que forman la malla de hidrogel. Debido a que el calendario de esta reacción enzimática se puede ajustar alterando la relación de la trombina de fibrinógeno, o la proporción de calcio a la trombina, se puede moldear por inyección construye con un número de diferentes geometrías 11,12. De otra parte, puede generar la alineación del tejido resultante por la forma en que restringen el gel en la cultura 13.
Después de cultivar las construcciones de ingeniería de tejido cardíaco para dos semanas bajo condiciones estáticas, las células cardíacas han comenzado a remodelar la construcción y puede generar una fuerza de contracción en condiciones de estimulación eléctrica 6. Como parte de este protocolo, también se describen los métodos para el análisis de la ingeniería tisular del miocardio después de que el período de cultivo, incluyendo el análisis funcional de la fuerza activa generada por el músculo cardíaco construir sobre la estimulación eléctrica, así como los métodos para la determinación de la viabilidad celular final (en vivo-muerto ensayo) y la tinción inmunohistoquímica para examinar la expresión y la morfología de las proteínas típicas importante para la contracción (cadena pesada de miosina o MHC) y el acoplamiento celular (conexina 43 o Cx43) entre los miocitos.
Protocolo
1. Aislamiento neonatal cardiomiocitos - Preparación (días antes)
Las soluciones creadas en esta sección: PBS-Glucosa solución, dejar los medios de comunicación.
- Prepare una solución de PBS-glucosa mediante la adición de 5 ml de penicilina-estreptomicina (100 unidades / ml y 100 ug / ml, respectivamente) y 1,98 g de glucosa en 250 ml 1x estéril tamponada con fosfato (PBS) y llevar el volumen a 500 ml de solución con más 1x PBS estéril.
- Prepare dejar de medios de comunicación mediante la adición de 25 FBS ml y 5 ml de penicilina-estreptomicina (misma concentración que el anterior) a medio modificado de 250 ml estéril Dulbecco Eagle (DMEM) y llevar el volumen a 500 ml con agua estéril DMEM antes de la filtración estéril a través de un micrón de 0,2.
- Esterilizar los instrumentos quirúrgicos necesarios para el aislamiento en autoclave: una pinza hemostática, # 5 pinzas, tijeras grandes, tijeras micro-, y un mango de bisturí (# 4).
2. Aislamiento neonatal cardiomiocitos - Preparación (día de la cosecha)
Asegúrese de mantener la esterilidad
Soluciones que se utilizan en esta sección: PBS-glucosa en solución, Betadine
- De cada camada, tome las dos estériles 100 mm placas de Petri, lugar en el capó y se llenan de unos 10 ml de helado de PBS-glucosa. Estos se deben colocar en un cubo de hielo con hielo en la campana de cultivo estéril.
- Coloque un vaso de 250 ml con 30-40 ml de Betadine en el capó.
- Agregar 50 ml / litro de PBS-glucosa en una botella, el sello y el lugar en un baño de agua a 37 ° C.
- Para cada persona, un lugar un banco absorbente underpad en la superficie de trabajo cubierta y colocar un paño estéril en la parte superior teniendo cuidado de no tocar el área de trabajo central del campo estéril. Volcado de los instrumentos quirúrgicos y una 4 x 4 gasa en el campo estéril sin tocar los instrumentos. Abrir una cuchilla estéril de bisturí # 20 y volcado en caída, otra vez con cuidado de no tocar con guantes no estériles.
- Tome las crías de la madre y colóquelo en un recipiente opaco, los cachorros a cabo en la capilla
- Póngase los guantes estériles
- Doble la gasa en cuartos, con pinza hemostática y ponerlo en un vaso de Betadine.
- Coloque la hoja de bisturí en el mango de bisturí y dejar de lado.
3. Aislamiento neonatal cardiomiocitos - la disección del corazón
Soluciones que se utilizan en esta sección: Betadine, PBS-glucosa en solución
- Recoger el cachorro en su mano no dominante de la piel entre los omóplatos pellizcar entre el pulgar y el dedo índice. Con las tijeras grandes, decapitar al cachorro en una corte. Asegúrese de cortar de la parte de atrás de los delanteros cachorro, para asegurar que la columna está completamente cortada.
- Limpiar el cachorro en el pecho con la gasa empapada betadine. Seguro que el cachorro apretando los omóplatos. Realizar una toracotomía parcial para exponer el corazón. Aumento de la presión aplicada, lo que obligó al corazón el pasado de las costillas para la disección scalpular.
- Ejecutar la hoja de bisturí detrás del corazón para cortar los grandes vasos y quitar el corazón. Coloque el centro de la placa de Petri que contiene PBS-glucosa que se encuentra en el hielo.
- Repita los pasos 1-3 para cada cachorro de la camada.
4. Aislamiento neonatal cardiomiocitos - aislamiento de miocitos
Soluciones creadas / usa en esta sección: PBS-glucosa, solución de colagenasa, solución integral
- Una vez que los corazones se han aislado, eliminar restos de sangre y el tejido conectivo de un enjuague en helado de solución de glucosa PBS, quitar el 1 / 3 superior del corazón para aislar únicamente el tejido ventricular y el lugar en una nueva placa de Petri con helado glucosa en PBS, preparado con anterioridad.
- Con cuidado, el picadillo de corazón en aproximadamente 1 milímetro cúbico con las tijeras y pinzas de micro-la.
- Tome una pipeta de transferencia estéril, cortar la punta con unas tijeras para que la boca de la pipeta es de ~ 3 mm de diámetro. Use la pipeta para la transferencia de las piezas de tejido y de toda la solución en un Erlenmeyer de 50 ml y el lugar en el hielo.
- Pesar 15,000 unidades por camada de cachorros de colagenasa tipo II (unidades / mg depende de la suerte) y ponerlo en la botella de 37 ° C calentado PBS-glucosa preparado anteriormente para crear una solución de colagenasa. Mezclar bien y filtro estéril en una botella separada. Coloque de nuevo en el baño de agua a 37 ° C. Coloque la solución de parada en el baño de agua a 37 ° C también.
- Permitir que el tejido picada a asentarse en el fondo del tubo de centrífuga. Eliminar el sobrenadante hasta que el volumen total es de unos 10 ml. 7 ml de solución de colagenasa al tubo de centrífuga.
- Coloque el tubo cónico con las piezas de tejido y la colagenasa en un bastidor de tubo en un agitador orbital dentro de una incubadora a 37 ° C o en el horno. Encienda el agitador orbital en aproximadamente 60 rpm y cierre la puerta. Establecer un temporizador de 7 minutos. Asegúrese de colocar el bac colagenasak en el baño de agua para mantener el calor.
- Cuando suene la alarma, poner de nuevo en forma cónica de la campana. También trae la colagenasa caliente y dejar la solución en el capó. Suavemente titular de las piezas de tejido 5-7 veces a separarlos. Después del ajuste, permiten a las piezas que se depositan en el fondo (2-3 minutos). Aspirar la mayor cantidad de sobrenadante como sea posible teniendo mucho cuidado de no aspirar los trozos de tejido. Después, 7 ml de solución de colagenasa a las piezas de tejido y colocarlo de nuevo en la incubadora en el agitador durante 7 minutos.
- Para cada paso restante, suavemente titular 10 veces para romper las piezas de tejido. Una vez que las piezas de tejido de un acuerdo, sacar el sobrenadante apagado y recogerla en un aparte cónico de 50 ml. 7 ml de colagenasa a las piezas de tejido y digerir otra vez durante 7 minutos. Para el tubo de sobrenadante, agregar 10 ml de solución de parada con una pipeta serológica diferente después de cada adición de sobrenadante de la digestión.
- Repita hasta que todos los de la colagenasa se ha utilizado (7 pasos en total).
- Después del paso de la digestión final, tomar la forma cónica con la solución de células y el filtro a través del tamiz 70μm en fresco de células cónicas.
- Girar hacia abajo en las células 100 g durante 5 minutos y resuspender en 20 ml de DMEM a contar con un hemocitómetro, y colocar las células en hielo.
- Lugar 50 l de las células en una solución de azul de tripano (75 l azul tripán, 125 l de PBS), se mezcla bien antes de colocar 10 l en el hemocitómetro para contar. Las células vivas son claras, mientras que las células muertas son de color azul. Esperar unos 3 millones de células por las crías de rata, con una viabilidad de aproximadamente 80-90%.
5. Fundición de fibrina construye gel - preparación para la creación de fibrina geles (hecho con mucha antelación)
Las soluciones creadas en esta sección: solución de fibrinógeno de valores, la trombina solución madre, Pluronics solución, los medios de comunicación la construcción de miocardio.
- Prepare un 33 mg / ml de solución madre de fibrinógeno en 20 mM tampón HEPES en el 0,9% de fibrinógeno mezcla lentamente en la solución salina tamponada con HEPES durante varias horas a 37 ° C. Permita que la solución reposar toda la noche a 2-8 º C. Caliente la solución a 37 ° C. La solución es estéril filtrada a través de una serie de filtros consecutivos: 40 filtros de células m, 0,45 m botella de vidrio con tapa filtros pre-filtros y filtros de 0,2 micras botella de vidrio con tapa de pre-filtros. La solución está en alícuotas de 1 ml y 3 ml de alícuotas y almacenado a -20 ° C.
- Prepare un 25 U / mL de solución madre de la trombina por la adición de 500 U de trombina a 18 ml de solución salina al 0,9% y 2 ml de agua estéril desionizada, a través de un filtro estéril 0,2 micras filtro, alícuota en 500 y 250 l alícuotas y se congelan a -80 ° C.
- Preparar un 5% w / v Pluronics F-127 solución, mediante la disolución de 50 g de Pluronics F-127 a 700 ml de agua destilada. Aumentar el volumen solución hasta 1 litro con agua desionizada adicional. Filtro estéril con filtro de 0,2 micras. La solución Pluronics se puede utilizar hasta tres veces antes de cambiar si filtrada estéril después de cada uso.
- Prepare de miocardio construcción de los medios de comunicación mediante la adición de un 10% de suero de caballo, el 2% de suero fetal bovino, 1% de penicilina-estreptomicina, y 6 mg / ml-aminocaproico en DMEM. 50 mg / ml de ácido ascórbico y 2 mg / ml de insulina en HEPES 25 mM hay que añadir inmediatamente antes de la alimentación.
- Ensamble mandril al reunir una barra de teflón, una camisa de teflón, dos arandelas de teflón con una muesca retirado para fines de inyección, y dos juntas tóricas de goma (ver Figura 2a). Autoclave antes de su uso.
- Tener cubiertas 6cc jeringa de la parte exterior del molde y las cubiertas de 3cc jeringa para ser utilizado como émbolos, y los prepara cortando los extremos de cierre luer y esterilización en autoclave (ver Figura 2a).
6. Fundición de fibrina construye gel - preparación para la creación de geles de fibrina (justo antes de hacer las construcciones de gel de fibrina)
Soluciones que se utilizan en esta sección: solución Pluronics
- Filtro estéril el 5% Pluronics F-127 solución con un filtro de 0,2 micras antes de su uso. Mandriles lugar y las cubiertas de la jeringa en solución al 5% Pluronics en un vaso de L 1 en el capó. Deje remojar las partes en la solución Pluronics durante 2-3 horas en la campana para asegurar el revestimiento completo. La solución Pluronics capas de los mandriles y evita que el gel de fibrina se adhiera a los mandriles.
- Después de la incubación de 2-3 horas, se vierte la solución al 5% Pluronics de nuevo en la botella, colocar paños estériles sobre la superficie de la campana y guantes estériles para la construcción de los moldes.
- Coloque los mandriles construidos en las 6 cajas jeringa cc, con la jeringa de 3 cc como un émbolo para asegurar un sello hermético entre las juntas tóricas y arandelas de teflón.
7. Fundición de gel de fibrina construye a través de moldeo por inyección
Las soluciones creadas en esta sección: F solución, la solución de T, la solución de la célula.
- Para hacer 1 ml de gel de fibrina (3,3 mg / ml la concentración de fibrinógeno final, 25 U / ml concentración final de trombina), F crear una solución en un tubo cónico, mediante la adición de 112 l de la población de fibrinógeno a 558 l de 20 mM HEPES buffer en solución salina 0,9%. En un tubo cónico separados, crear una solución de T mediante la adición de 17 l de la acción de trombina, y 1,3 l de N 2 Ca + + solución a 135 l de DMEM. Véase la Tabla 1.
- En un tubo cónico en tercer lugar, preparar una solución de células girando a las células y resuspender las células en un volumen por lo que la concentración de células es de 29,4 millones de células / ml o 6 veces la concentración de la concentración final deseada de las células en la construcción
- Cuando esté listo para lanzar el gel de fibrina construcción, preparación de una jeringa de 1 ml con 18G de 1 ½ pulgada aguja larga. Tiene una aguja 21G de 1 pulgada y listo.
- La solución de fibrina se crea en una proporción de 04:01:01 de solución F: La solución de T: La solución de la célula. Para hacer un ml de gel, añadir 667 l de solución de F en un tubo de centrífuga limpio de 50 ml, seguido de 167 l de solución de células, y por último añadir 167 l de solución de T. Pipeta para mezclar la solución, junto con cuidado de no introducir burbujas. Una vez que las soluciones se mezclan, la reacción ha comenzado y la inyección de las construcciones debe hacerse de inmediato.
- Tome la jeringa previamente preparado con la aguja 18G y elaborar una solución de fibrina. Tenga cuidado de no invertir la jeringa para evitar que las burbujas lleguen a la aguja. Vuelva a colocar la aguja 18G con una aguja 21G. Toque jeringa para forzar la salida de las burbujas de aire.
- Inserte la jeringa en el molde entre el tapón y la carcasa después de la ranura de la junta tórica de teflón y se inyecta la solución en el molde. Incline el molde con la ranura en la parte superior para asegurar el llenado completo. Retire la jeringa y siguen llenando los moldes restantes. Solución de gel lo suficiente puede ser creado para llenar varios moldes al mismo tiempo. Sin embargo, debido a que la solución de los geles con rapidez, es generalmente una buena idea para limitar el número de construcciones de inyección en un momento dado de 6.
- Envolver los moldes en Parafilm en grupos de tres y colocar en la incubadora o en el horno a 37 ° C. Dejar que los geles para la incubación en los moldes durante 20 minutos para que el tiempo de gel para polimerizar.
- Llene cada recipiente de cultivo (Nalgene lados rectos jar) con 21 ml de medio de miocardio construir por construir. Use la jeringa estéril de 3 cc caja como un émbolo para el mandril con la construcción en una gran placa de Petri con medio DMEM. A continuación, coloque la construcción en el frasco de la muestra. Cada frasco de 16 onzas puede contener un máximo de 6 construcciones, mientras que cada frasco de 4 onzas puede contener 2.
- Tornillo de las tapas de los frascos y transferirlos a la incubadora. Dentro de la incubadora, afloje las tapas de los frascos para permitir el intercambio de gases.
- Después de 24 horas, tome un palillo de dientes estéril e impulsar la construcción de las blancas teflón anillos en los extremos del molde de anillo para asegurar una alineación uniforme de la construcción (véase la figura 2 resultados representativos).
8. Técnicas de análisis (después de 2 semanas en la cultura) - prueba de fuerza de contracción
Soluciones que se utilizan en esta sección: DMEM, infarto de construcción de los medios de comunicación.
- Fije el cocodrilo en el cable que viene del estimulador a los cables de los electrodos en el baño. Encienda la tarjeta de adquisición de datos, generador de impulsos, y transductores de fuerza. El transductor de fuerza se debe pasar a la configuración de 5g y puesto a cero. Abrir un programa personalizado de LabVIEW que muestra y guarda los datos del transductor de fuerza. Crear un nuevo archivo de texto vacío en la carpeta de datos para cada muestra.
- DMEM lugar en la 37 ° C baño de agua y dar tiempo para que se caliente antes de la prueba de las construcciones. Una vez calentada, el lugar 37 ° C en el baño de DMEM medio del sistema de medición de fuerza (ver Figura 3a).
- Retire la construcción de la jarra de la muestra haciendo deslizar suavemente el anillo de la construcción del apoyo de teflón con unas pinzas y colocar la construcción sobre el poste de metal fija en el baño de la medida de fuerza media del sistema. No agarre la construcción con las pinzas! Por el contrario, utilice las pinzas para empujar y levantar la construcción fuera de la ayuda del mandril.
- Coloque el otro extremo de la construcción sobre el brazo del transductor y apriete hasta que el transductor se lee 0.50V, (aproximadamente 1,0 gramos de fuerza o 10 milinewtons de tensión)
- Seleccione el archivo de texto para los datos de fuerza de contracción que se registró en.
- En el estimulador cardiaco (Modelo # S88X, Tecnologías de la hierba), ajustar la tensión del pulso de 20V (8 V / cm), la duración de 6 ms, y una tasa de 1 Hz.
- Iniciar la estimulación eléctrica pulsando el botón "salida on / off"
- Iniciar la grabación hasta que se convierte en la forma de onda normal.
- Retire con cuidado la construcción del baño de la medida de fuerza media del sistema y colocarlo de nuevo en medio de cultivo. A continuación, retire el DMEM del baño de la medida de fuerza media del sistema y reemplazar con agua fresca y caliente DMEM para analizar adicmuestras ional.
- Cortar la construcción y desenrolla para que pueda medir la longitud y la anchura de la construcción
- Cortar la construcción en las secciones que se utilizan para las mediciones de análisis adicional, incluyendo la viabilidad, la histología, o mediciones de western blot.
9. Técnicas de análisis (después de 2 semanas en la cultura) - en vivo-muerto de ensayo de la viabilidad (con Invitrogen Live / Dead ensayo) 14:
Soluciones que se utilizan en esta sección: EthD-1 de solución madre, calceína AM solución madre de PBS
- Muestras de enjuague con 3x lavados de 5 minutos en PBS.
- Añadir 20 l de 2 mM EthD-1 de solución madre de 10 ml de PBS estéril y agitar para que se mezcle bien.
- Añadir 5 l de 4 mM calceína AM stolution acciones a EthD-1 solución. Una vez más, vortex para que se mezcle bien.
- Añadir un volumen suficiente de la solución anterior para cubrir la construcción.
- Incubar cubierto (para evitar photobleaching de los tintes) durante 30 minutos a temperatura ambiente.
- Quitar los tintes y reemplazar con PBS caliente. Observar y grabar las imágenes con un microscopio de fluorescencia. Calceína es excitado por la luz y emite 494 nm 517 nm de luz, mientras que homodímero de etidio-1 es por la luz y emite 528 nm 617 nm de luz. Ver Figura 4 de los resultados de la muestra.
10. Técnicas de análisis (después de 2 semanas en la cultura) - inmunohistoquímica de las proteínas de los miocitos importantes:
Soluciones que se utilizan en esta sección: PBS, el 4% paraformadehyde en PBS, 5% de suero de burro en PBS, los anticuerpos en PBS, 0,1 ng / ml Hoechst 33258 en PBS.
- Muestras de enjuague con 3x lavados de 5 minutos en PBS.
- Fijar con paraformaldehído al 4% en solución de PBS, durante 2-3 horas a 4 ° C
- Muestras de enjuague con 3x lavados de 5 minutos en PBS.
- La muestra ahora se puede incrustar, seccionadas y teñidas de acuerdo con el protocolo de elección. La parte restante de este protocolo cubre manchas toda la construcción de imágenes con microscopía confocal. Tenga en cuenta que los tiempos de incubación más largo que el tejido seccionado como es necesario que haya más tiempo para que los anticuerpos se difunden en la construcción. Además, todos los pasos restantes se llevan a cabo a temperatura ambiente.
- Añadir 0,1% Triton-X en PBS a las muestras durante 30 minutos para permeabilizar las membranas celulares.
- Enjuague las muestras con 3x lavados de 10 minutos en PBS.
- Añadir 5% de suero de burro en PBS a las muestras durante 1 hora y media para bloquear cualquier unión no específica del anticuerpo secundario de las muestras.
- Añadir la conexina 43 (dilución 1:50) y la cadena pesada de miosina (dilución 1:100) en PBS anticuerpos primarios de las muestras durante 3 horas. Con el fin de la etiqueta ambas proteínas consecutivamente debe asegurarse de que los anticuerpos primarios son de diferentes hosts (es decir, de conejo y ratón).
- Enjuague las muestras con 3x lavados de 10 minutos en PBS.
- Añada la etiqueta fluorescente secundaria de anticuerpos en PBS durante 3 horas.
- Enjuague las muestras con 3x lavados de 10 minutos en PBS
- Justo antes de exponer las muestras en el microscopio confocal, añadir 0,1 ng / ml Hoechst 33258 en PBS durante 15 minutos.
- Enjuague las muestras con 3x lavados de 10 minutos en PBS.
- Analizar la expresión de MHC muestras y Cx43 por la imagen de las células con un microscopio confocal (Ver Figura 4 para el resultado ejemplo).
11. Los resultados representativos / Resultados:
La construcción de los cardiomiocitos de fibrina inicialmente cubre todo el ancho del molde (Figura 2B). No debe haber burbujas en la construcción y que debería ser uniforme en toda su longitud. Después de dos semanas de cultivo, el contrato de construcción de aproximadamente 1 / 4 de la anchura inicial (Figura 2 C).
Cuando la construcción es eléctricamente ritmo en nuestro dispositivo de medida la fuerza de contracción (Figura 3), los datos de contracción fuerza se puede generar como se muestra en la Figura 3B. La forma de onda se pueden analizar por separado en MATLAB (The Mathworks) para determinar la fuerza, la velocidad de contracción, y la tasa de relajación. Las fuerzas de contracción de alrededor de 1,3 mN se espera 6.
Viabilidad de las células de la construcción depende de la profundidad de la construcción, debido a las limitaciones de difusión de oxígeno en la construcción. En la superficie de la construcción, la figura 4A, la viabilidad celular alta se observa. Con microscopía confocal, la figura 4B, la estructura alineada de la construcción se observa debido a la cadena pesada de miosina, MHC, es importante para la contracción, que se muestra en rojo. Conexina 43, que se muestra en color verde, es necesario para el acoplamiento de celular entre los miocitos.
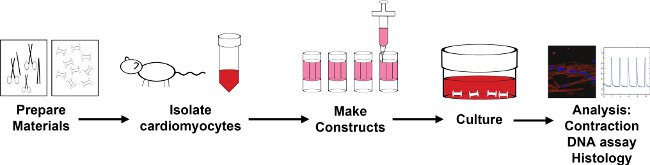
Figura 1: Visión general del proceso de encapsulación
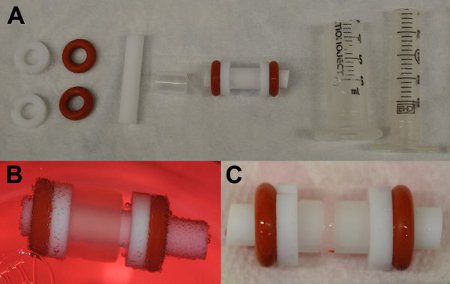
Figura 2: A las piezas de molde) separados y combinados para crear geles de fibrina. From de izquierda a derecha: dos arandelas de teflón, silicona dos juntas tóricas, una barra de teflón, un tubo de teflón, un mandril completado, la carcasa exterior para el mandril, y el émbolo). B) Construir en el molde inmediatamente después de la expulsión de la carcasa exterior (día 0). C) la construcción de compactado en el molde (flecha roja), después de 13 días de la cultura.
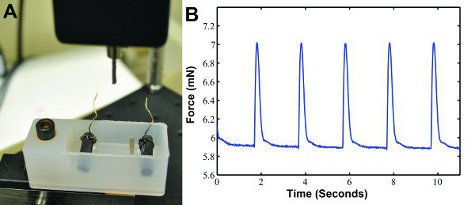
Figura 3: A) la fuerza de contracción de encargo sistema de medición de la fuerza de contracción de grabación. Un transductor de fuerza con un poste mide la fuerza de contracción y envía el resultado a una computadora. Un baño con dos electrodos de carbono con los cables se conecta a un estimulador eléctrico que se pasea por la construcción. Los dos puestos de mantener la construcción en su lugar. B) muestra los datos de forma de onda de contracción fuerza que se genera con la estimulación eléctrica a 0,5 Hz.
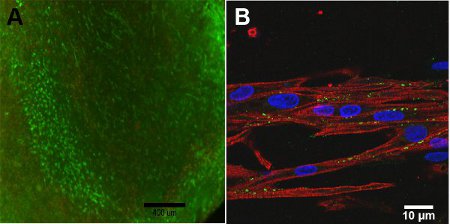
Figura 4: Un ensayo) Live / Dead de construir, día 13 (barra de escala = 400 mm). El verde representa las células vivas y el rojo representa las células muertas. B) Imagen confocal de cadena pesada de miosina (rojo), la conexina 43 (verde) y Hoescht tinción nuclear (azul) (barra de escala = 10 mm).
| F solución | T solución | Solución de células | |||
| Fibrinógeno | 112 l | Trombina | 17 l | Las células en DMEM | L 170 |
| HEPES | 558μl | Ca + + | L 1,3 | ||
| DMEM | 152 l | ||||
| Total | 670 l | Total | L 170 | Total | L 170 |
Tabla 1. Fibrina soluciones de gel, las cantidades de 1 ml de gel.
Nota: Fibrinógeno = 33 mg / ml de fibrinógeno en HEPES 20 mM de solución salina tamponada
HEPES = 20 mM HEPES solución salina tamponada
Trombina = 25 U / ml de solución de 0,81% de NaCl
Ca + + = 2 N solución de cloruro de calcio
Discusión
La encapsulación de los cardiomiocitos de rata neonatal en fibrina resultados geles de forma coherente y viable en tres dimensiones en el modelo in vitro del sistema de miocardio. La fibrina es una biomaterial preferido porque cuando las células están atrapados, son metabólicamente activa y capaz de compactar, remodelación y volver a crear una matriz extracelular que está en consonancia con el tejido del corazón nativo de 12. Porque permitimos que los cardiomiocitos a alinearse en este entorno, su funcionalidad es más característico del músculo cardíaco que resulta en la fuerza de contracción mayor en comparación con los tejidos isotrópico 6. Para posibles aplicaciones terapéuticas, es necesario encapsular las células dentro de un material que promueve tanto la viabilidad y funcionalidad. Los protocolos se presentan demuestran un medio eficiente y preciso para la creación de una red de fibrina para controlar el comportamiento de las células cardíacas en un microambiente tridimensional.
A los posibles problemas de unos pocos puedan surgir durante la creación y la cultura de estas construcciones. Un problema potencial es el mantenimiento de la viabilidad de las células antes de la encapsulación, que afectarán de manera significativa la funcionalidad de la construcción. Debería hacerse lo posible para limitar la muerte celular tras el aislamiento, reduciendo el tiempo entre el aislamiento y la encapsulación de las células dentro del gel de fibrina. Construcciones deben ser siempre los medios de comunicación cada dos días en un horario estricto. Además, es importante para asegurar la homogeneidad en todas las soluciones que se utilizan. Si la mezcla de fibrinógeno, trombina y células produce un entorno heterogéneo, la capacidad de las células de la remodelación de la MEC, mecánicamente par y el contrato es potencialmente obstruida. También es importante para prevenir la formación de burbujas de aire durante la inyección de las construcciones con el fin de evitar perturbaciones en la continuidad de la ingeniería tisular. Una forma de aliviar este problema es atraer a más gel que se necesita para hacer la construcción en la jeringa e inyectar lentamente. Por último, una vez que la matriz de fibrina ha establecido y ha estado en medio de cultivo durante 24 horas, es esencial para separar la construcción de los lados del molde de anillo para promover la compactación a base de células de gel de fibrina. Mantener la construcción en el centro del molde facilita el gas y el intercambio de nutrientes. La adhesión a los lados del molde de anillo también puede alterar la alineación deseada celular.
Es importante tener en cuenta que la decapitación consciente se utiliza como método de eutanasia en este protocolo, que es un método aceptable con arreglo a las directrices tanto del Instituto Nacional de Salud y la American Veterinary Medical Association. Sin embargo, algunas instituciones recomiendan el uso de anestesia seguido por decapitación de ratas recién nacidas. Hemos elegido la decapitación consciente, ya que garantiza la mínima cantidad de tiempo bajo condiciones de hipoxia para el tejido extirpado el corazón / las células. Cantidades relativamente pequeñas de la hipoxia puede conducir a isquemia del miocito y potencialmente la muerte de miocitos, lo cual puede afectar los resultados de este protocolo.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado por los Institutos Nacionales de la Salud - Instituto Nacional del Corazón, los Pulmones y la Sangre (Premio # R00HL093358 a LDB).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Cloruro de sodio | Sigma | S7653 | PBS |
| Cloruro de potasio | Sigma | P9333 | PBS |
| Fosfato sódico dibásico | Sigma | S7907 | PBS |
| Fosfato de potasio monobásico | Sigma | P5655 | PBS |
| Glucosa | Sigma | G5400 | Aislamiento |
| hemostático | Herramientas de Bellas Ciencia | 91308-12 | Aislamiento |
| pinzas finas | Herramientas de Bellas Ciencia | 11251-20 | Aislamiento |
| grandes tijeras | Herramientas de Bellas Ciencia | 91401-14 | Aislamiento |
| micro-tijeras | Herramientas de Bellas Ciencia | 91501-09 | Aislamiento |
| bisturí manejar | Herramientas de Bellas Ciencia | 10008-13 | Aislamiento |
| hoja de bisturí | Fisher Scientific | 08-918-5A | Aislamiento |
| Underpad banco absorbente | VWR | 56617-014 | Aislamiento |
| campo estéril | Fisher Scientific | GM42526 | Aislamiento |
| autoclave bolsa | Pescador | 01-812-54 | Aislamiento |
| gasa pad | Fisher Scientific | 13-761-52 | Aislamiento |
| betadine | Purdue Productos | 67618-150-01 | Aislamiento |
| guantes estériles | Fisher Scientific | 19-020 | Aislamiento |
| pipeta de transferencia estéril | Fisher Scientific | 9962 | Aislamiento |
| colagenasa | Worthington | CLS2 | Aislamiento |
| Teflon varilla 1 / 4 pulgada de diámetro | McMaster-Carr | 8546K11 | Molde de parte |
| Teflon ID tubo de 1 / 4 pulgadas, 1 / 2 pulgada OD | McMaster-Carr | 8547K31 | Molde de parte |
| O-Ring de silicona 1 / 4 pulgada ID, 1 / 2 pulgada OD | McMaster-Carr | 9396K204 | Molde de parte |
| Teflon tubo de 1 / 4 de pulgada ID, 5 / 16 pulgadas de diámetro exterior | McMaster-Carr | 52355K14 | Molde de parte |
| Kendall jeringas Monoject 6 cc | Fisher Scientific | 05-561-41 | Molde de parte |
| BD jeringa de 3 cc | Fisher Scientific | 309585 | Molde de parte |
| El fibrinógeno bovino | Sigma | F8630 | Construir |
| Trombina bovina | Sigma | T7513 | Construir |
| 1 M HEPES | Sigma | H0887 | Construir |
| Cloruro de sodio | Sigma | S7653 | Construir |
| DMEM | Invitrogen | 10569 | Construir |
| Pluronic F-127 | Sigma | P2443 | Construir |
| Cloruro de calcio | Sigma | 383147 | Construir |
| 0,2 micrones | Fisher Scientific | SCGVT05RE | Construir |
| Filtros de 40 micras de células | Fisher Scientific | 22-363-547 | Construir |
| 0,45 micras botella superior del filtro | Corning | 430627 | Construir |
| vidrio pre-filtro | Millipore | AP2007500 | Construir |
| 18G 1 1 / 2 pulgada aguja larga | Fisher Scientific | 14-826-5D | Construir |
| 21G 1 pulgada aguja | Fisher Scientific | 14-826C | Construir |
| la construcción de botes | Fisher Scientific | 2116 | Construir |
| Penicilina-estreptomicina | Invitrogen | 15140 | Medios de comunicación |
| suero de caballo | Sigma | H1138 | Medios de comunicación |
| De suero fetal bovino | Invitrogen | 16000 | Medios de comunicación |
| ácido aminocaproico | Acros orgánicos | 103305000 | Medios de comunicación |
| de ácido ascórbico | Sigma | A5960 | Medios de comunicación |
| insulina | Sigma | I9278 | Medios de comunicación |
| Paraformaldehído, el 16% | Microscopía electrónica de Ciencias | 15710 | Histología |
| La temperatura óptima de corte (OCT) | Ted Pella | 27050 | Histología |
| 2-metilbutano | Pescador | 03551-4 | Histología |
| Ratón MYH1/2/4/6 anticuerpo primario | Santa Cruz de Biotecnología | SC-32732 | Histología |
| Conejo conexina 43 anticuerpo primario | Señalización Celular Tecnología | 3512 | Histología |
| DyLight 549-burro conjugado anti-anticuerpo secundario del ratón | Jackson ImmunoResearch Laboratories | 715-505-151 | Histología |
| DyLight 488-conjugado Donke anticuerpo anti-conejo secundaria | Jackson ImmunoResearch Laboratories | 711-485-152 | Histología |
| Live / Dead ensayo | Invitrogen | L-3224 | Análisis |
Referencias
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, . Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -. H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 .
- Invitrogen. . >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados