Method Article
心肌在心脏组织工程中的纤维蛋白凝胶的封装
摘要
我们描述的隔离乳鼠心肌细胞,并准备在组织工程中的纤维蛋白凝胶结构的封装的细胞。我们描述了分析后,电刺激和细胞活力,免疫组织化学染色后产生的积极力量的文化时期,包括组织工程化心肌的方法。
摘要
培养细胞在一个三维凝胶环境是一个重要的技术发展为组织工程的结构,以及研究各种体外培养条件下细胞的反应。三维环境更紧密地模仿什么细胞在体内观察到的,由于机械和化学刺激的应用在所有尺寸1。三维水凝胶可以从合成的聚合物,如PEG - DA 2 和 PLGA 3或自然产生的蛋白质, 如胶原蛋白4,透明质酸或纤维蛋白6,7。从一种自然产生的凝血蛋白,纤维蛋白,创建的水凝胶,可以聚合,形成一个网格,是身体的自然伤口愈合过程8的一部分。纤维蛋白是细胞降解和潜在的自体9,使其成为一个理想的临时支架用于组织工程。
在这里,我们详细描述了隔离乳鼠心肌细胞进行为期3天的幼鼠和准备在组织工程中的纤维蛋白凝胶结构的封装的细胞。新生儿心肌细胞在心肌组织的形成和工程4体外研究使用一个共同的细胞来源。纤维蛋白胶混合纤维蛋白原酶凝血酶。凝血酶裂解纤维蛋白原fibrinopeptides FPA和FPB,揭示了相互作用的结合位点, 与其他10个单体。这些相互作用导致单体的自组装,形成了水凝胶网状的成纤维。由于这种酶反应的时间可通过改变比例的纤维蛋白原,凝血酶或钙的比例凝血酶的调整,可以注塑模具11,12不同的几何形状结构。此外,我们可以生成所产生的组织保持一致,我们如何限制在13文化凝胶。
心肌细胞培养工程静态条件下两个星期的心肌组织结构后,已经开始改造构造,可以产生 6电起搏条件下的收缩力。作为本协议的一部分,我们还描述分析改造后的文化时期,包括心肌所产生的主动力的功能分析后确定最终的细胞活力电刺激的方法,以及构造(现场死亡的心肌组织的方法法)和免疫组织化学染色检查的收缩(肌球蛋白重链或MHC)和心肌细胞之间的耦合(连接蛋白43或Cx43的)重要的典型蛋白的表达和形态。
研究方案
1。新生儿心肌隔离- 准备(前一天)
在本节中创建的解决方案:PBS -葡萄糖溶液,停止媒体。
- 准备加入5 ml青霉素,链霉素(100单位/毫升和100微克/毫升)和1.98克的葡萄糖250毫升1X无菌磷酸盐缓冲液(PBS)PBS的葡萄糖溶液,并带来额外的500毫升溶液的体积无菌1X PBS。
- 准备加入25毫升胎牛血清和5青霉素,链霉素毫升(如上相同浓度)250毫升无菌贝科的修改鹰的中等(DMEM)停止媒体和携带的无菌DMEM培养液体积无菌过滤前500毫升通过一个0.2微米的过滤器。
- 消毒由高压灭菌隔离所需的手术器械:止血钳,#5钳,大剪刀,微型剪刀,手术刀处理(#4)。
2。新生儿心肌隔离- 准备(丰收的一天)
请务必保持无菌
本节中使用的解决方案:PBS -葡萄糖溶液,优碘
- 对于每个垃圾,采取疏导100毫米的培养皿中,放置在引擎盖和填写〜10毫升冰冷的PBS -葡萄糖。这些应该被放置在一个充满冰桶冰在无菌培养罩。
- 将与30-40毫升的优碘引擎盖到250 mL烧杯中。
- 添加到50毫升/乱抛垃圾的PBS -葡萄糖瓶,密封和成37 ° C水浴。
- 对于每个人,将引擎盖上的工作表面underpad吸水板凳,小心不要触摸无菌悬垂的中心工作区的顶部放置一个无菌的悬垂性。不接触仪器转储到无菌悬垂的手术器械和4 × 4纱布。打开无菌#20手术刀刀片和转储上悬垂,再小心不要触摸与非无菌手套。
- 从引擎盖到大坝和成不透明的容器,放置幼仔的幼崽
- 戴上无菌手套
- 纱布折叠成四分之三,钳,止血和成优碘烧杯。
- 摆上手术刀处理手术刀刀片,待用。
3。新生儿心肌隔离- 心脏夹层
本节中使用的解决方案:优碘,PBS -葡萄糖溶液
- 拿起你非惯用手的拇指和食指之间的肩胛骨之间的捏皮肤的小狗。使用大剪刀,杀头小狗在一切。从后面的小狗转发,一定要削减,以确保脊椎完全切断。
- 优碘浸泡纱布擦拭小狗的胸部。安全肩胛骨捏在一起的小狗。执行部分开胸,暴露心脏。增加施加压力,从而迫使心脏过去scalpular夹层的肋骨。
- 运行背后的手术刀刀片割断大血管,取出心脏的心脏。放置在培养皿菜含有PBS -葡萄糖在冰上的心脏。
- 每个垃圾的小狗重复步骤1-3。
4。新生儿心肌隔离- 心肌细胞隔离
在本节中创建/使用的解决方案:PBS -葡萄糖溶液,胶原酶的解决方案,一站式解决方案
- 一旦心中已被隔离,消除任何残留的血液和结缔组织,在冰冷的PBS葡萄糖溶液冲洗去除最高的1 / 3的心脏心室组织和地方隔离到一个新的用冰冷的Petri菜PBS葡萄糖,准备较早。
- 仔细剁碎成〜1立方毫米,使用微型剪刀和镊子的心。
- 以无菌移液管,使吸管口〜3毫米直径的用剪刀切断提示。使用吸管转移到一个50 ml锥形置于冰上的组织块和所有的解决方案。
- 称取37瓶15000台,每II型胶原酶幼仔乱抛垃圾(单位/毫克依赖于该地段)和地点° C预热准备PBS -葡萄糖,以前创建胶原酶溶液。混合成一个单独的瓶以及无菌过滤。到37 ° C水浴回原位。放置到37℃水浴,以及一站式的解决方案。
- 允许剁碎的组织来解决的离心管底部。去除上清,直到总体积〜10毫升。添加7毫升离心管胶原酶溶液。
- 把锥形管成管架在轨道摇床37℃孵化器或烤箱内的组织块和胶原酶。转动的轨道摇床约60转,关门。设置为7分钟计时器。请务必放置胶原酶BACk入水洗澡,保持温暖。
- 当计时器熄灭,把罩圆锥形回。也带来温暖的胶原酶和停止到油烟机的解决方案。轻轻滴定的组织块,打破他们的5-7倍。滴定后,允许件解决的底部(2-3分钟)。吸过如上清非常小心,不要吸了组织块。之后,加7毫升胶原酶的解决方案,以组织块,放回摇床7分钟,进入孵化器。
- 对于其余的每个步骤,轻轻滴定10倍,打破了组织块。一旦定居的组织块,吸取上清液,并收集在一个单独的50毫升锥形的。添加7毫升胶原酶组织块和消化7分钟。去上清液,管,用不同的血清学吸管添加10毫升的一站式解决方案,除了从消化后每个上清。
- 重复,直到所有的胶原酶(共7步)已被用于。
- 最终经过消化步骤,采取与电池解决方案,并通过70μm细胞筛过滤到新鲜的锥形锥形。
- 自旋细胞在百克5分钟,重新悬浮在20毫升的DMEM使用一个血球计数,并将其放置在冰上的细胞。
- 将50μL的细胞进入一个台盼蓝溶液(75μL,125μLPBS台盼蓝),拌匀,然后放置在血球计数为10μL。活细胞是明确的,而死亡的细胞是蓝色的。预计约300万个细胞的大鼠小狗,约80-90%的可行性。
5。铸造纤维蛋白凝胶结构- 准备创建纤维蛋白胶(提前完成)
解决方案创造了本节中的纤维蛋白原原液,凝血酶原液,Pluronics的解决方案,心肌构建媒体。
- 准备在20毫米HEPES缓冲液33毫克/毫升原液,0.9%的缓慢混合纤维蛋白原纤维蛋白原生理盐水到的HEPES缓冲液几个小时在37 ° C允许解决方案来解决一夜之间在2-8 ° C。温暖的解决方案,以37 ° C。该解决方案是通过一系列连续的过滤器过滤:40微米的细胞过滤器,0.45微米瓶顶部用玻璃预过滤器的过滤器,0.2微米瓶与玻璃的预过滤器顶部的过滤器的无菌。解决的办法是分装成1毫升和3毫升分装,储存于-20 ° C
- 准备加入凝血酶500 U到18毫升0.9%生理盐水和2毫升的无菌去离子水,无菌过滤器通过0.2微米的过滤器,分装成500μL和250μL分装和冻结在了凝血酶25 U / mL的原液-80 ° C。
- 准备5%W / V Pluronics的F - 127的解决方案,700 mL去离子水溶解50克的F - 127 Pluronics。额外的去离子水使溶液体积至1L。与0.2微米的过滤器的无菌过滤。 Pluronics的解决方案,可用于高达三倍如果无菌过滤在每次使用后,然后再更换。
- 准备加入10%马血清,2%胎牛血清,1%的青霉素,链霉素,和6毫克/到ML -氨基己酸的DMEM心肌构建媒体。立即喂奶前需要增加50微克/ ml的抗坏血酸,在25微米的HEPES 2微克/毫升的胰岛素。
- 组装放在一起之一聚四氟乙烯棒,一个聚四氟乙烯套筒,聚四氟乙烯垫圈注射删除了一个档次,和两个橡胶O形圈(见图2a)芯棒。使用高压灭菌器前。
- 以6cc注射器外壳的模具和3CC注射器柱塞使用肠衣的外层部分,并切断了鲁尔锁的两端和高压灭菌(见图2a)做准备。
6。铸造纤维蛋白凝胶结构- 纤维蛋白胶的制备(前纤维蛋白凝胶结构 )
本节中使用的解决方案:Pluronics解决方案
- 无菌过滤器的5%Pluronics的F - 127的解决方案,具有0.2微米的过滤器在使用前。将心轴及注射器的外壳到5%Pluronics解决方案,在1升烧杯中,在引擎盖。在Pluronics溶液浸泡2-3小时在引擎盖保留部分,以确保完整的涂层。 Pluronics解决方案大衣卡具和坚持的心轴,防止纤维蛋白凝胶。
- 2-3小时的潜伏期后放回瓶子,倒入5%Pluronics溶液,放在无菌窗帘罩表面,戴无菌手套,兴建模具。
- 放入6 40cc的注射器外壳构造心轴,柱塞的3CC使用注射器,以确保密封之间的O形圈和聚四氟乙烯垫圈。
7。铸造纤维蛋白胶的结构通过注塑
解决方案在本节创建:F解决方案,T解决方案,电池解决方案 。
- 为了使纤维蛋白凝胶1毫升(3.3毫克/毫升的最终纤维蛋白原浓度,25 U / mL的最后凝血酶浓度),F的解决方案,创建一个锥形管20毫米HEPES缓冲液至558μL加入112μL的纤维蛋白原的股票0.9%的生理盐水溶液。在一个单独的锥形管,创建一个T的解决方案加入凝血酶股票,17μL和1.3μL2 N的钙+ +解决方案,以135μL的DMEM。见表1。
- 在第三个锥形管,准备一个单元格的解决方案,由纺纱细胞和resuspending细胞在卷中的构造,细胞浓度是29.4万细胞/ mL或所需的细胞终浓度浓度的6倍
- 当你准备投纤维蛋白凝胶结构,预习与一个18G的1.5英寸长针1毫升注射器。一个21G的1英寸的针以及准备。
- 纤维蛋白的解决方案是建立在4:1:1的比例F的解决方案:T解决方案:电池解决方案。为了使凝胶毫升,放入一个干净的50 mL离心管,167μL细胞溶液,最后加入167μlT解决方案的667μL的F溶液。吸管小心,不要引入气泡混合在一起的解决方案。一旦混合解决方案,反应已经开始,应该立即注射构造。
- 与18G针先前准备的注射器,并制订纤维蛋白的解决方案。小心不要颠倒,以防止气泡进入针注射器。更换18G与21G针针。塔注射器轻轻迫使气泡。
- 插入瓶塞和套管之间的模具,在聚四氟乙烯O形圈的凹槽后的注射器,注入模具的解决方案。倾斜模具顶部的凹槽,以确保完成灌装。取下注射器,并继续以填补余下的模具。可以创建足够的凝胶溶液,以填补在同一时间几个模具。但是,因为该解决方案快速凝胶,它一般是一个好主意,限制在一个给定的的时间为6注入构造。
- 在封口膜包裹在三组,并在孵化器或烤箱模具,在37 ° C。允许凝胶在20分钟的模具孵育允许聚合的凝胶时间。
- 填写每21毫升每兴建兴建中型心肌文化的陶罐(NALGENE直端JAR)。使用3毫升的无菌注射器套管柱塞力与构造成一个大培养皿菜用DMEM芯棒。然后放置到样品罐的构造。每16盎司JAR最多可容纳6结构,而每4盎司JAR可容纳2。
- 螺丝帽上的罐子,他们转移到孵化器。培养箱内,罐帽松动,以便气体交换。
- 24小时后,以无菌牙科采撷和推动构造环模的两端的白色聚四氟乙烯O型圈,以确保统一的构造对齐(参见图2代表性的结果)。
8。分析技术(文化2周后) - 收缩力测试
本节中使用的解决方案:DMEM,心肌构建媒体 。
- 率先在洗澡的刺激电极导线夹紧弹簧夹。电源,数据采集板,脉冲发生器,力传感器。力传感器应切换到各5g设置归零。打开一个自定义的LabVIEW程序显示和保存从力传感器的数据。在每个样本数据文件夹中创建新的,空的文本文件。
- DMEM培养基放入37℃水浴,让时间来热身之前测试的结构。一旦回暖,37℃DMEM培养成力测量系统的中型洗浴(见图3A)举行。
- 支持铁氟龙镊子轻轻滑动构造环取出样品罐的构造和放置在力测量系统的中型洗浴的构建固定的金属后。不要用镊子夹住构造!相反,使用镊子,以推动和解除芯棒支持兴建。
- 广场的另一端对传感器手臂的构造,并拧紧,直到传感器的读数为0.50V,(约1.0克武力或10 millinewtons紧张)
- 选择收缩力被记录到的数据的文本文件。
- 在心脏起搏器(型号#S88X,草技术),设置脉冲电压20V(8 V / cm时),持续时间为6ms,1 Hz的频率。
- 按下“ON / OFF输出”按钮,启动电起搏
- 开始录音,直到波形变得定期。
- 小心取出力测量系统的中型洗浴的构建和它放入培养液中。然后从力测量系统的中型浴的DMEM,并更换新鲜,温暖的DMEM分析additional样本。
- 剪切构造,并展开它可以测量的长度和宽度的构造
- 切段的结构,要为额外的分析测量,其中包括生存能力,组织学,免疫印迹测量使用。
9。分析技术(文化2周后) - 活死含量可行性(Invitrogen公司现场/死含量)14:
本节中使用的解决方案:EthD - 1原液,钙黄绿素AM原液 PBS
- 3X 5分钟的PBS洗涤,漂洗样品。
- 加入20μL2毫米EthD - 1原液10毫升无菌PBS和涡,以确保充分混合。
- 加入5μl4毫米的钙黄绿素AM股票stolution EthD - 1的解决方案。再次,旋涡,以确保充分混合。
- 加入足够量的上述溶液,以支付兴建。
- 孵育30分钟,在室温下覆盖(以防止染料的漂白)。
- 移除的染料和更换用温水PBS。用荧光显微镜观察并记录图像。钙黄绿素为494 nm的光激发,并发出517纳米的光,而乙啶二聚体- 1是由528纳米的光,并发出617纳米的光。抽样结果参见图4。
10。分析技术(文化2周后) - 重要的心肌细胞蛋白的免疫组化 :
本节中使用的解决方案:PBS中,4%paraformadehyde PBS中,5%驴血清的PBS,PBS,0.1毫微克/毫升的PBS Hoechst 33258荧光抗体 。
- 3X 5分钟的PBS洗涤,漂洗样品。
- 修复用4%多聚甲醛PBS液为2-3小时,在4 ° C
- 3X 5分钟的PBS洗涤,漂洗样品。
- 样品现在可以嵌入,切片和染色根据协议的选择。此协议的剩余部分,涵盖整个构造染色共聚焦显微镜成像。注意:孵育时间长于切片组织需要有更多的时间为抗体扩散到构造。此外,所有剩余的步骤是在室温下进行。
- 添加0.1%的Triton - X在PBS 30分钟通透细胞膜的样品。
- 冲洗10分钟的3倍的PBS洗涤样品。
- 添加5%的PBS驴血清样品为1个半小时,阻止任何非特异性结合的第二抗体的样品。
- 连接蛋白43(1:50稀释)和肌球蛋白重链(1:100稀释)在PBS的主要抗体,3个小时的样品。为了标签连续两个蛋白,你必须确保,从不同的主机(即兔子和鼠标)的主要抗体。
- 冲洗10分钟的3倍的PBS洗涤样品。
- 3小时,加入适当的荧光标记二抗的PBS。
- 冲洗10分钟的3倍的PBS洗涤样品
- 前成像的共聚焦显微镜上的样品,加入15分钟的0.1纳克/毫升的PBS Hoechst 33258荧光。
- 冲洗10分钟的3倍的PBS洗涤样品。
- 成像的共聚焦显微镜的细胞(例如结果参见图4)分析样品的MHC和Cx43的表达。
11。代表性的成果/成果:
心肌纤维蛋白构造初步覆盖整个模具的宽度(图2B)。无气泡,应该存在于构造,它看起来应该在整个长度的统一。经过两个星期的培养,约1 / 4的初始宽度(图2C)的建造合同。
当构造的电气节奏,在我们自定义的收缩力装置(图3A),抽搐力数据可以生成,如图3b所示。波形可以在MATLAB(MathWorks公司)分别进行分析,确定力,收缩率和松弛率。抽搐部队约1.3分钟,预计6。
细胞构造的可行性是依赖于构造的深入,由于进入兴建中的氧气扩散的限制。在表面的构造图4A,观察细胞存活率高。共聚焦显微镜,图4B,对齐的构造结构是由于肌球蛋白重链,MHC的观察,收缩,显示为红色的重要。连接蛋白43,以绿色显示,心肌细胞之间的耦合是必要的。
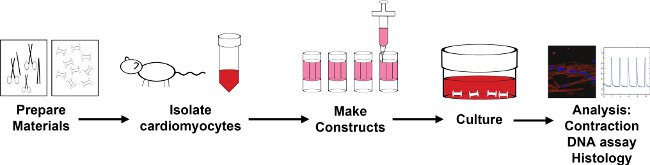
图1:封装过程概述
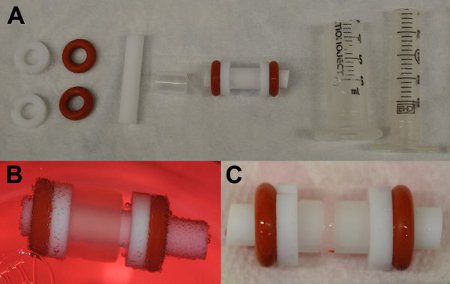
图2:一)单独和联合纤维蛋白胶的模具零件。 FRO米左到右:两个聚四氟乙烯垫圈,两个硅胶O型圈,聚四氟乙烯棒,聚四氟乙烯管,完成芯棒,芯棒的外壳,柱塞)。 b)建造在模具上后,立即从外壳(0天)弹射。三)夯实构建模具(红色箭头),13天的文化。
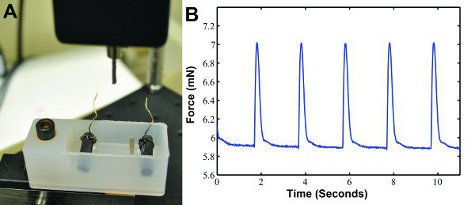
图3:一)自定义的收缩力记录抽搐力测量系统。一个后力传感器措施的收缩力和结果输出到计算机。洗澡含有两个碳电极用导线连接到电刺激的步伐构造。两个职位举行的地方兴建。 b)样品抽搐力波形数据在0.5赫兹的电刺激产生的。
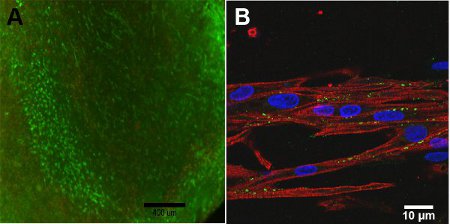
图4:a)活/死构造,第13天(比例尺= 400微米)的检测。绿色代表了活细胞和红色代表的死细胞。 B)共聚焦显微镜图像的肌球蛋白重链(红色),连接蛋白43(绿色)和赫司特核染色(蓝色)(比例尺= 10微米)。
| F解决方案 | T解决方案 | Cell解决方案 | |||
| 纤维蛋白原 | 112μL | 凝血酶 | 17μL | 细胞的DMEM | 170μL |
| HEPES | 558μl | 钙离子 | 1.3μL | ||
| DMEM培养液 | 152μL | ||||
| 共有 | 670μL | 共有 | 170μL | 共有 | 170μL |
表1纤维蛋白凝胶的解决方案,数量为1毫升的凝胶。
注:纤维蛋白原= 33 mg / ml的20毫米的HEPES纤维蛋白原缓冲液
HEPES = 20 mM的HEPES缓冲液
在0.81%NaCl溶液中的凝血酶= 25 U / mL的溶液
钙+ + = 2 N的氯化钙溶液
讨论
乳鼠心肌细胞在纤维蛋白凝胶结果在体外培养的心肌系统模型在一个一致的和可行的的三维封装。纤维蛋白是生物材料的首选,因为当细胞包埋,他们是代谢活跃,并能够压缩,重塑和再造细胞外基质,是符合本机的心脏组织 12 。因为我们允许心肌细胞排列在这种环境下,其功能是心脏肌肉造成较大的收缩力相比,6各向同性组织特征。对于潜在的治疗应用,这是必要的封装内的材料,促进活力和功能的细胞。这里介绍的协议示范创建纤维蛋白网络控制在一个三维微环境的心肌细胞的行为有效率及准确的手段。
一些潜在的问题可能出现在这些结构的建立和文化。一个潜在的问题是维持细胞活力封装之前,这将显著影响构造的功能。应作出努力,通过减少之间的隔离和纤维蛋白凝胶内的细胞封装时间隔离限制细胞死亡。构造应提供媒体隔日一个严格的时间表。此外,重要的是要确保在所有的解决方案,用于同质化。如果纤维蛋白原,凝血酶和细胞的混合物产生异构环境中,细胞的能力,改造的ECM,机械夫妇和合同是潜在的阻碍。同样重要的是为了防止干扰,在工程组织的连续性,以防止注入的构造过程中形成的气泡。缓解这一问题的方法之一是吸引更多的凝胶,比需要构造,使之成为注射器慢慢注入。最后,一旦纤维蛋白基质已成立,并在培养液中24小时,这是必须脱离环模双方的构造,以促进纤维蛋白凝胶细胞为基础的压实。保持在中间的模具构造,有利于气体和营养交换。坚持环模双方还可能破坏所需的细胞对齐。
重要的是要注意在这个协议的euthanization方法,这是一个可以接受的方法,由国家卫生部和美国兽医协会研究院的指引下,自觉斩首。然而,一些机构建议新生大鼠断头的麻醉剂使用。我们选择了有意识的断头,因为它保证最短的时间内切除的心脏组织/细胞缺氧条件下。相对少量的缺氧可导致心肌缺血和潜在的心肌细胞死亡,这可能显著影响本协议的成果。
披露声明
没有利益冲突的声明。
致谢
这项工作是支持的国立卫生研究院 - 国家心脏,肺和血液研究所(奖#R00HL093358以六味地黄丸)。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
|---|---|---|---|
| 氯化钠 | 西格玛 | S7653 | PBS |
| 氯化钾 | 西格玛 | P9333 | PBS |
| 磷酸氢二钠钠 | 西格玛 | S7907 | PBS |
| 磷酸二氢钾 | 西格玛 | P5655 | PBS |
| 血糖 | 西格玛 | G5400 | 隔离 |
| 止血 | 精细科学的工具 | 91308-12 | 隔离 |
| 精细镊子 | 精细科学的工具 | 11251-20 | 隔离 |
| 大剪刀 | 精细科学的工具 | 91401-14 | 隔离 |
| 微型剪刀 | 精细科学的工具 | 91501-09 | 隔离 |
| 手术刀处理 | 精细科学的工具 | 10008-13 | 隔离 |
| 手术刀刀片 | Fisher Scientific则 | 08 - 918 - 5A | 隔离 |
| 吸水板凳underpad | VWR | 56617-014 | 隔离 |
| 无菌悬垂 | Fisher Scientific则 | GM42526 | 隔离 |
| 高压灭菌袋 | 费舍尔 | 01-812-54 | 隔离 |
| 纱布 | Fisher Scientific则 | 13-761-52 | 隔离 |
| 优碘 | 普渡产品 | 67618-150-01 | 隔离 |
| 无菌手套 | Fisher Scientific则 | 19-020 | 隔离 |
| 无菌移液管 | Fisher Scientific则 | 9962 | 隔离 |
| 胶原酶 | 沃辛顿 | CLS2 | 隔离 |
| 聚四氟乙烯棒直径1 / 4英寸 | 麦克马斯特 - 卡尔 | 8546K11 | 模具的一部分 |
| 聚四氟乙烯管的1 / 4英寸的ID,1 / 2英寸外径 | 麦克马斯特 - 卡尔 | 8547K31 | 模具的一部分 |
| 硅胶O型圈1 / 4英寸内径,1 / 2英寸外径 | 麦克马斯特 - 卡尔 | 9396K204 | 模具的一部分 |
| 聚四氟乙烯管的1 / 4英寸内径,5 / 16英寸外径 | 麦克马斯特 - 卡尔 | 52355K14 | 模具的一部分 |
| 肯德尔monoject注射器6cc | Fisher Scientific则 | 05-561-41 | 模具的一部分 |
| BD注射器3CC | Fisher Scientific则 | 309585 | 模具的一部分 |
| 牛纤维蛋白原 | 西格玛 | F8630 | 构建 |
| 牛凝血酶 | 西格玛 | T7513 | 构建 |
| 1 M羟乙基 | 西格玛 | H0887 | 构建 |
| 氯化钠 | 西格玛 | S7653 | 构建 |
| DMEM培养液 | Invitrogen公司 | 10569 | 构建 |
| 聚醚F - 127 | 西格玛 | P2443 | 构建 |
| 氯化钙 | 西格玛 | 383147 | 构建 |
| 0.2微米的过滤器 | Fisher Scientific则 | SCGVT05RE | 构建 |
| 40微米的细胞过滤器 | Fisher Scientific则 | 22-363-547 | 构建 |
| 0.45微米瓶顶部过滤器 | 康宁 | 430627 | 构建 |
| 玻璃预过滤器 | Millipore公司 | AP2007500 | 构建 |
| 18G的1 / 2英寸长针 | Fisher Scientific则 | 14 - 826 - 5D | 构建 |
| 21G 1寸毫针 | Fisher Scientific则 | 14 - 826C | 构建 |
| 构建罐 | Fisher Scientific则 | 2116 | 构建 |
| 青霉素链霉素 | Invitrogen公司 | 15140 | 媒体 |
| 马血清 | 西格玛 | H1138 | 媒体 |
| 胎牛血清 | Invitrogen公司 | 16000 | 媒体 |
| 氨基己酸 | Acros Organics公司 | 103305000 | 媒体 |
| 抗坏血酸的 | 西格玛 | A5960 | 媒体 |
| 胰岛素 | 西格玛 | I9278 | 媒体 |
| 多聚甲醛,16% | 电子显微镜科学 | 15710 | 组织学 |
| 最佳切削温度(OCT) | 特德佩拉 | 27050 | 组织学 |
| 2 - 甲基丁烷 | 费舍尔 | 03551-4 | 组织学 |
| 鼠标MYH1/2/4/6初级抗体 | 圣克鲁斯生物技术 | SC - 32732 | 组织学 |
| 兔连接蛋白43抗体 | 细胞信号技术 | 3512 | 组织学 |
| Dylight 549标记的驴抗鼠二抗 | 杰克逊ImmunoResearch实验室 | 715-505-151 | 组织学 |
| Dylight 488 -共轭Donke抗兔二抗 | 杰克逊ImmunoResearch实验室 | 711-485-152 | 组织学 |
| 活/死检测 | Invitrogen公司 | L - 3224 | 分析 |
参考文献
- Stegemann, J. P., Hong, H., Nerem, R. M. Mechanical, biochemical, and extracellular matrix effects on vascular smooth muscle cell phenotype. Journal of applied physiology. 98, 2321-2327 (2005).
- Guarnieri, D. Covalently immobilized RGD gradient on PEG hydrogel scaffold influences cell migration parameters. Acta. 6, 2532-2539 (2010).
- Krebs, . Injectable poly(lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering. Acta. 5, 2847-2859 (2009).
- Zimmermann, W. -. H. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature. 12, 452-458 (2006).
- Chung, C., Burdick, J. A. Influence of Three-Dimensional Hyaluronic Acid Stem Cell Chondrogenesis. Tissue engineering. 15, (2009).
- Black, L. D. Cell-induced alignment augments twitch force in fibrin gel-based engineered myocardium via gap junction modification. Tissue engineering. 15, 3099-3108 (2009).
- Syedain, Z. H., Weinberg, J. S., Tranquillo, R. T. Cyclic distension of fibrin-based tissue constructs: evidence of adaptation during growth of engineered connective tissue. Proceedings of the National Academy of Sciences of the United States of America. 105, 6537-6542 (2008).
- Falvo, M. R., Gorkun, O. V., Lord, S. T. The molecular origins of the mechanical properties of fibrin. Biophysical chemistry. , 152-155 (2010).
- Jockenhoevel, S. Fibrin gel - advantages of a new scaffold in cardiovascular tissue engineering. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 19, 424-430 (2001).
- Ryan, E. Structural Origins of Fibrin Clot Rheology. Biophysical Journal. 77, 2813-2826 (1999).
- Williams, C. Cell sourcing and culture conditions for fibrin-based valve constructs. Tissue engineering. 12, 1489-1502 (2006).
- Grassl, E. D., Oegema, T. R., Tranquillo, R. T. A fibrin-based arterial media equivalent. Journal of biomedical materials research. 66 (Part A. , 550-561 (2003).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of biomechanical engineering. 119, 137-145 .
- Invitrogen. . >LIVE/DEAD Viability/Cytotoxicity Kit *for mammalian cells. , (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。