Polimerizzazione
Panoramica
Fonte: Vy M. Dong e Jan Riedel, Dipartimento di Chimica, Università della California, Irvine, CA
I polimeri sono costituiti da macromolecole, che sono composte da unità ripetitive (le cosiddette unità monomeriche). Nel nostro mondo moderno, i polimeri svolgono un ruolo importante. Uno dei primi polimeri importanti è stato il nylon, che è una poliammide. Ha trovato un'applicazione diffusa negli spazzolini da denti e nelle calze.
Principi
Esistono due tipi principali di polimerizzazione. Uno è la reazione di crescita a catena, che può essere differenziata in polimerizzazione radicale, cationica, anionica e coordinativa. La polimerizzazione a crescita graduale è l'altro metodo principale per produrre polimeri. I monomeri bifunzionali o multifunzionali reagiscono alla fine formando polimeri. La polimerizzazione a crescita graduale può essere ulteriormente differenziata in polimerizzazione a condensazione e polimerizzazione ad addizione.
In una polimerizzazione aggiuntiva, i monomeri si aggiungeranno l'un l'altro per formare il polimero. Mentre in una polimerizzazione a condensazione, due monomeri si aggiungeranno in una reazione di condensazione sotto il rilascio di acqua o di un'altra piccola molecola come l'acido cloridrico.
Nella seguente sintesi di una poliammide, un cloruro di acido dicarbossilico si condensa con una diammina per formare una poliammide, sotto il rilascio di acido cloridrico. La notazione 6,10 nel nome della poliammide-6,10 riflette il numero di carboni nel monomero diamminico (sei in questo caso) e il numero di carboni nel monomero cloruro di acido dicarbossilico (dieci in questo caso).
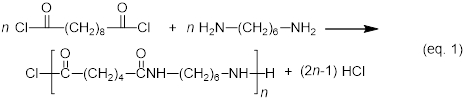
Una caratteristica di una polimerizzazione a crescita graduale è la dipendenza della lunghezza della catena e la conversione della polimerizzazione. All'inizio della reazione la maggior parte dei monomeri si condenserà per formare principalmente dimeri e trimeri. Con ulteriori progressi, i dimeri e i trimeri si combineranno in oligomeri e solo dopo alti tassi di conversione, quando la maggior parte dei monomeri avrà reagito, gli oligomeri si condenseranno per formare polimeri con un elevato numero di unità monomeriche. Questo fenomeno è illustrato nella Figura 1.
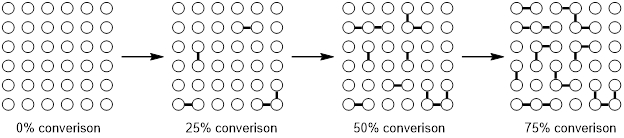
Figura 1. Polimerizzazione a condensazione.
In questo esperimento, la poliammide si forma attraverso una cosiddetta polimerizzazione superficiale. In una soluzione disomogenea, costituita da una soluzione acquosa e organica, la polimerizzazione avverrà all'interfaccia dei due strati. Il monomero diammina viene sciolto in acqua, mentre l'acido dicarbossilico viene sciolto in un solvente organico.
Procedura
1. Preparazione
- A un becher da 250 mL, aggiungere 3 mL (14 mmol) di cloruro di sebacoile in 100 mL di n-esano.
- A un becher da 150 mL aggiungere 4,4 g (38 mmol) di 1,6-diaminoesano in 50 ml di acqua distillata.
- Aggiungere circa 5 gocce di una soluzione di fenolftaleina alla soluzione di 1,6-diaminoesano.
2. Polimerizzazione superficiale
- Sovrapporre accuratamente la soluzione acquosa con la soluzione di cloruro di sebacoile.
- Si noti che uno strato sottile si formerà all'interfaccia tra la soluzione acquosa e la soluzione organica.
- Si noti che la fenolftaleina aggiunta renderà visibile l'interfaccia.
3. Raccolta del polimero
- Estrarre il film di poliammide formato dall'interfaccia con una pinzetta e avvolgerlo attorno a un'asta di vetro.
- Avvolgere la poliammide sull'asta di vetro.
- Lavare il polimero con acetone e poi con abbondanti quantità di acqua.
- Asciugare il polimero a 50 °C a pressione ridotta.
Risultati
Si ottiene un filo cavo e lungo di poliammide.
Applicazione e Riepilogo
Questo esperimento mostra in modo vivido la sintesi di un polimero in modo semplice. La polimerizzazione a condensazione di 1,6-diaminoesano e cloruro di sebacoile dà una poliammide-6,10, che polimerizza all'interfaccia di due strati liquidi. Questa polimerizzazione superficiale formerà un filo cavo di poliammide, dopo aver tirato il polimero dall'interfaccia e averlo avvolto attorno a un'asta di vetro per avvolgerlo.
Polimeri e poliammide trovano una varietà di usi diversi nella nostra vita quotidiana. Inizialmente utilizzato per spazzolini da denti e calze. Oggi, la poliammide viene utilizzata nella produzione di tessuti, come cappotti antipioggia, vestiti da esterno, cappotti da laboratorio e giacche da volo. Grazie alla sua forza e tenacità, le poliammidi sono utilizzate anche in paracadute, corde da arrampicata e vele. Queste applicazioni rendono le poliammidi uno dei polimeri più importanti in uso oggi.
Vai a...
Video da questa raccolta:

Now Playing
Polimerizzazione
Organic Chemistry II
93.9K Visualizzazioni

Pulizia della vetreria
Organic Chemistry II
123.5K Visualizzazioni

Sostituzione nucleofila
Organic Chemistry II
99.5K Visualizzazioni

Agenti riducenti
Organic Chemistry II
43.1K Visualizzazioni

Reazione di Grignard
Organic Chemistry II
149.0K Visualizzazioni

Titolazione di n-butillitio
Organic Chemistry II
47.7K Visualizzazioni

Dispositivo di Dean Stark
Organic Chemistry II
100.2K Visualizzazioni

Ozonolisi degli alcheni
Organic Chemistry II
67.0K Visualizzazioni

Organocatalisi
Organic Chemistry II
16.6K Visualizzazioni

Reazione di accoppiamento catalizzata da palladio
Organic Chemistry II
34.3K Visualizzazioni

Sintesi in fase solida
Organic Chemistry II
41.0K Visualizzazioni

Idrogenazione
Organic Chemistry II
49.6K Visualizzazioni

Punto di fusione
Organic Chemistry II
149.8K Visualizzazioni

Spettroscopia infrarossa
Organic Chemistry II
214.6K Visualizzazioni

Polarimetro
Organic Chemistry II
99.9K Visualizzazioni