Determinazione della formula empirica (minima)
Panoramica
Fonte: Laboratorio del Dr. Neal Abrams - SUNY College of Environmental Science and Forestry
Determinare la formula chimica di un composto è al centro di ciò che i chimici fanno in laboratorio ogni giorno. Sono disponibili molti strumenti per aiutare in questa determinazione, ma uno dei più semplici (e più accurati) è la determinazione della formula empirica. Perché è utile? A causa della legge di conservazione della massa, qualsiasi reazione può essere seguita gravimetricamente o da un cambiamento di massa. La formula empirica fornisce il più piccolo rapporto di numero intero tra elementi (o composti) all'interno di un composto molecolare. In questo esperimento, l'analisi gravimetrica sarà utilizzata per determinare la formula empirica dell'idrato di cloruro di rame, CuxCly·nH2O.
Principi
Gli idrati sono composti chimici che hanno molecole d'acqua attaccate (ma non legate covalentemente) al composto. Le formule idratate sono simboleggiate da un punto ("·") tra il composto e la molecola d'acqua. Idrata facilmente perdere molecole d'acqua al riscaldamento, lasciando dietro di sé il composto anidro (senza acqua). In questo caso, sarebbe cloruro di rame, CuxCly. La differenza di massa tra le forme anidra e idratata del sale corrisponde alla massa (e ai moli) dell'acqua nel composto chimico CuxCly· nH2O. Il cloruro di rame anidro viene quindi disciolto in acqua e il rame viene rimosso attraverso una reazione redox con l'alluminio per formare rame solido. La differenza di massa tra l'idrato totale di cloruro di rame e la somma delle molecole ridotte di rame metallico e acqua corrisponde alla massa di cloruro nel campione. La massa di ogni componente (Cu, Cl, H2O) viene convertita in moli, per cui la legge delle proporzioni multiple consente l'uso di un rapporto per determinare la formula empirica del composto. La vera formula chimica del composto non può essere determinata senza conoscere la sua massa molecolare, ma il rapporto rimarrà sempre lo stesso.
Procedura
1. Disidratare l'idrato
- Pesare accuratamente un campione di cloruro di rame idrato e metterlo in un crogiolo pre-essiccato e catramato. È importante che il crogiolo venga essiccato al di sopra di 120 °C per allontanare l'umidità adsorbita. In genere, 1-2 g di composto saranno sufficienti.
- Riscaldare il campione utilizzando un bruciatore Bunsen o un'altra fonte di fiamma fino a quando non cambia colore da blu-verdastro a bruno-rossastro (Figura 1). Questo cambiamento di colore è indicativo della forma anidra del cloruro di rame. Il coperchio può rimanere sul crogiolo per evitare schizzi, ma deve essere aperto leggermente per consentire al vapore acqueo di fuoriuscire.
- Mescolare il campione per assicurarsi che l'acqua venga espulsa dall'intero campione e che il colore sia costante in tutto.
- In alternativa, il campione può essere posto in un forno di essiccazione a temperatura superiore a 110 °C.
- Raffreddare il campione in un essiccatore. Ciò impedisce all'acqua di reidratare il campione.
- Misurare la massa del campione anidro. La differenza corrisponde all'acqua dell'idrato che è stato perso durante il riscaldamento.

Figura 1. Bruciatore Bunsen con crogiolo in ceramica.
2. Isolamento del rame
- Trasferire il campione in un becher da 100 mL e sciogliere il campione in 50 mL di acqua deionizzata. La soluzione dovrebbe diventare di nuovo blu, in genere più blu del solido idratato.
- Aggiungere una piccola quantità (~ 0,20 g) di metallo alluminio al becher. Ciò farà sì che il rame si riduca a un metallo rossastro e l'alluminio si ossiderà in Al3+ incolore. Il colore blu della soluzione dovrebbe scomparire poiché gli ioni Cu2+ formano Cu0. Dopo 30 minuti, aggiungere altri piccoli pezzi di alluminio per garantire che tutto il rame sia ridotto a rame solido.
- La soluzione ora contiene ioni Al3+, rame solido e una piccola quantità di alluminio solido.
- Sciogliere l'alluminio in eccesso aggiungendo ~ 5 mL di 6 M HCl. L'alluminio è anfotero, il che significa che può reagire e dissolversi in presenza di un acido o di una base.
- Filtrare sottovuoto la soluzione incolore in un imbuto Büchner contenente un pezzo di carta da filtro pre-pesato. Risciacquare con etanolo assoluto. Asciugare all'aria (non a secco il forno) il campione per prevenire la formazione di ossido di rame (II).
- Misurare la massa del solido di rame per determinare la massa dello ione cloruro per differenza.
3. Calcoli
- Determinare la massa dello ione cloruro per differenza:
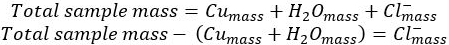
- Utilizzare la massa molare di ciascun componente del composto per determinare le moli di ciascun componente.
- Dividere le moli di ciascun componente per le moli del componente più piccolo per dare il più piccolo rapporto di numeri interi di componenti, noto anche come formula empirica del composto.
Risultati
- Rsperimento
- Riscaldare 1,25 g di cloruro di rame idrato in un crogiolo. Dopo il riscaldamento e quindi il raffreddamento, la massa finale è di 0,986 g di cloruro di rame, CuxCly.
- Sciogliere il campione CuxCly in 50 ml di acqua deionizzata e aggiungere 0,2 g di rete fine di alluminio al becher.
- Dopo aver reagito e sciolto l'alluminio in eccesso, vengono recuperati 0,198 g di metallo di rame essiccato.
- Sottrarre la massa di rame e acqua dall'idrato di cloruro di rame iniziale per ottenere la massa di ione cloruro nel campione:
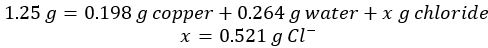
- Dati
- Per determinare il più piccolo rapporto di numero intero di componenti nel composto, convertire la massa di ciascun componente in moli e quindi dividere ciascuno per il minor numero di moli nel campione (rame in questo caso):
Componente Messa (g) Massa molare (g/mol) Talpe Rapporto Rapporto numerico intero calcolato Rame 0.479 63.55 7,53 x 10-3 
1 Cloruro 0.533 35.45 1,50 x 10-2 
1.99 ≈ 2 Acqua 0.273 18.01 1,51 x 10-2 
2.01 ≈ 2 Tabella 1. Risultati sperimentali.
- Il rapporto numerico più piccolo risultante produce una formula di CuCl2· 2H2O.
- Nel caso in cui il rapporto finale produca valori decimali, l'intera formula verrebbe moltiplicata per una costante per dare valori di numeri interi. I valori frazionari comuni sono 0,25, 0,333, 0,50, 0,667 e 0,75. Ad esempio, se un più piccolo rapporto di numeri interi producesse la formula prodotta C7H9NO2,5, l'intera formula verrebbe moltiplicata per 2 per dare la formula empirica C14H18N2O5.
- Una formula molecolare non può essere determinata dalla formula empirica senza conoscere la massa molecolare del composto. La ragione di ciò è dimostrata nell'esempio seguente:
Nome Formula molecolare Formula empirica Acido acetico CH3COOH CH2O Formaldeide CH2O CH2O Glucosio C6H12O6 CH2O Tabella 2. Esempio di formula empirica comune.
Tutti e tre i composti hanno la stessa formula empirica, ma formule molecolari molto diverse.
Applicazione e Riepilogo
In un esempio, supponiamo che una biomolecola sconosciuta contenente solo C, H e O agisca bene come un nuovo combustibile. Un modo per determinare la formula del carburante sarebbe quello di bruciarlo in aria e analizzare i prodotti:
CxHyOz + O2 → mCO2 + nH2O
Mentre O2 è in eccesso, sapremmo che tutto il carbonio in CO2 ha origine dalla biomolecola e tutto l'idrogeno sarebbe presente in H2O. La differenza tra quella massa totale e la massa del campione iniziale sarebbe la massa di ossigeno nella molecola. Potremmo quindi convertirci in talpe e determinare la formula empirica.
In un altro esempio, un campione di idrato di MgxCly· nH2O è dato. La massa delle molecole d'acqua sarebbe di nuovo facilmente determinata dal riscaldamento. Usando alcune regole di solubilità, il cloruro viene quindi precipitato con ioni d'argento, Ag+, per formare AgCl(s). Una volta trovata la massa di AgCl(s), le moli di Cl- vengono determinate usando la massa molare di AgCl(s) e quindi convertite in grammi di Cl-. Questo ci permetterebbe di determinare la massa di Mg nel campione seguita dalla formula empirica.
Determinare una formula empirica è al centro dell'identificazione della formula della molecola reale. Dai prodotti farmaceutici alla medicina legale, la determinazione di una formula molecolare è la chiave per identificare un composto sconosciuto, il che significa portare la formula empirica al passo successivo. Tipicamente, la determinazione di una formula empirica è accoppiata con l'analisi elementare per ottenere informazioni sulla percentuale di peso elementare. Da questi dati, vengono calcolati i rapporti molari e viene determinata la formula empirica. Possiamo determinare la massa della molecola usando un altro strumento analitico, come uno spettrometro di massa. Quindi, il rapporto tra la massa molecolare e la massa empirica viene calcolato per determinare la vera formula molecolare.
Vai a...
Video da questa raccolta:

Now Playing
Determinazione della formula empirica (minima)
General Chemistry
183.9K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
659.5K Visualizzazioni

Soluzioni e concentrazioni
General Chemistry
275.6K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
557.1K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
383.9K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.6K Visualizzazioni

Uso del pH-metro
General Chemistry
347.0K Visualizzazioni

Introduzione alla titolazione
General Chemistry
425.8K Visualizzazioni

Legge dei gas perfetti
General Chemistry
79.5K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.9K Visualizzazioni

Principio di Le Châtelier
General Chemistry
265.9K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
160.9K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.5K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.8K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.8K Visualizzazioni