Method Article
Creazione di un modello fisiologico di microtumore vascolarizzato umano per la ricerca sul cancro
In questo articolo
Riepilogo
Questo protocollo presenta un modello tumore-on-a-chip fisiologicamente rilevante per eseguire ricerche di base e traslazionali sul cancro umano ad alto rendimento, facendo progredire lo screening dei farmaci, la modellazione delle malattie e gli approcci di medicina personalizzata con una descrizione delle procedure di carico, manutenzione e valutazione.
Abstract
La mancanza di modelli tumorali convalidati che ricapitolino il microambiente tumorale dei tumori solidi in vitro rimane un collo di bottiglia significativo per la ricerca preclinica sul cancro e lo sviluppo terapeutico. Per ovviare a questo problema, abbiamo sviluppato il microtumore vascolarizzato (VMT), o chip tumorale, un sistema microfisiologico che modella realisticamente il complesso microambiente tumorale umano. Il VMT si forma de novo all'interno di una piattaforma microfluidica mediante co-coltura di più tipi di cellule umane in condizioni di flusso dinamico e fisiologico. Questo costrutto microtumorale di ingegneria tissutale incorpora una rete vascolare perfusa vivente che supporta la massa tumorale in crescita proprio come fanno i vasi neoformati in vivo. È importante sottolineare che i farmaci e le cellule immunitarie devono attraversare lo strato endoteliale per raggiungere il tumore, modellando in vivo le barriere fisiologiche alla somministrazione e all'efficacia terapeutica. Poiché la piattaforma VMT è otticamente trasparente, è possibile ottenere l'imaging ad alta risoluzione di processi dinamici come lo stravaso di cellule immunitarie e le metastasi con la visualizzazione diretta delle cellule marcate con fluorescenza all'interno del tessuto. Inoltre, il VMT mantiene l'eterogeneità tumorale in vivo , le firme di espressione genica e le risposte ai farmaci. Praticamente qualsiasi tipo di tumore può essere adattato alla piattaforma e le cellule primarie dei tessuti chirurgici freschi crescono e rispondono al trattamento farmacologico nella VMT, aprendo la strada a una medicina veramente personalizzata. Qui vengono delineati i metodi per stabilire la VMT e utilizzarla per la ricerca oncologica. Questo approccio innovativo apre nuove possibilità per lo studio dei tumori e delle risposte ai farmaci, fornendo ai ricercatori un potente strumento per far progredire la ricerca sul cancro.
Introduzione
Il cancro rimane una delle principali preoccupazioni per la salute in tutto il mondo ed è la seconda causa di morte negli Stati Uniti. Solo per l'anno 2023, il National Center for Health Statistics prevede più di 1,9 milioni di nuovi casi di cancro e oltre 600.000 decessi per cancro negli Stati Uniti1, evidenziando l'urgente necessità di approcci terapeutici efficaci. Tuttavia, attualmente, solo il 5,1% delle terapie antitumorali che entrano negli studi clinici alla fine ottiene l'approvazione della FDA. L'incapacità dei candidati promettenti di progredire con successo negli studi clinici può essere in parte attribuita all'uso di sistemi modello non fisiologici, come colture 2D e sferoidi, durante lo sviluppo preclinicodel farmaco 2. Questi modelli di cancro classici mancano di componenti essenziali del microambiente tumorale, come una nicchia stromale, cellule immunitarie associate e vascolarizzazione perfusa, che sono determinanti chiave della resistenza terapeutica e della progressione della malattia. Pertanto, è necessario un nuovo sistema modello che imita meglio il microambiente tumorale umano in vivo per migliorare la traduzione clinica dei risultati preclinici.
Il campo dell'ingegneria tissutale sta progredendo rapidamente, fornendo metodi migliorati per lo studio delle malattie umane in laboratorio. Uno sviluppo significativo è l'emergere di sistemi microfisiologici (MPS), noti anche come chip d'organo o chip tissutali, che sono organi umani funzionali e miniaturizzati in grado di replicare condizioni sane o malate 3,4,5. In questo contesto, sono stati sviluppati chip tumorali, che sono modelli tumorali umani in vitro basati sulla microfluidica tridimensionale, per la ricerca oncologica 2,3,4,5,6,7,8,9,10,11,12,13 . Questi modelli avanzati incorporano segnali biochimici e biofisici all'interno di un microambiente tumorale dinamico, consentendo ai ricercatori di studiare il comportamento del tumore e le risposte ai trattamenti in un contesto fisiologicamente più rilevante. Tuttavia, nonostante questi progressi, pochi gruppi hanno incorporato con successo una vascolarizzazione funzionale vivente, in particolare uno che si auto-modella in risposta al flusso fisiologico 3,4,5,6. L'inclusione di una rete vascolare funzionale è fondamentale in quanto consente di modellare le barriere fisiche che influenzano la somministrazione di farmaci o cellule, l'homing cellulare in microambienti distinti e la migrazione transendoteliale di cellule tumorali, stromali e immunitarie. Includendo questa caratteristica, il chip tumorale può rappresentare meglio le complessità osservate nel microambiente tumorale in vivo.
Per rispondere a questa esigenza insoddisfatta, abbiamo sviluppato una nuova piattaforma di screening farmacologico che consente la formazione di reti di microvasi all'interno di un dispositivo microfluidico 8,9,10,11,12,13,14,15,16. Questa piattaforma di chip per organi di base, denominata microorgano vascolarizzato (VMO), può essere adattata praticamente a qualsiasi sistema di organi per replicare la fisiologia tissutale originale per la modellazione di malattie, lo screening di farmaci e le applicazioni di medicina personalizzata. I VMO sono stabiliti co-coltivando cellule endoteliali derivate da cellule (ECFC-EC), HUVEC o iPSC-EC (di seguito EC) e più cellule stromali nella camera, compresi i normali fibroblasti polmonari umani (NHLF), che rimodellano la matrice, e i periciti che avvolgono e stabilizzano i vasi. Il VMO può anche essere stabilito come sistema modello di cancro co-coltivando le cellule tumorali con lo stroma associato per creare un micro-tumore vascolarizzato (VMT)8,9,10,11,12,13, o modello di chip tumorale. Attraverso la co-coltura di più tipi cellulari in un ambiente di flusso dinamico, reti microvascolari perfuse si formano de novo nelle camere tissutali del dispositivo, dove la vasculogenesi è strettamente regolata da velocità di flusso interstiziale14,15. Il fluido viene guidato attraverso i canali microfluidici del dispositivo da una testa di pressione idrostatica che fornisce alle cellule circostanti della camera tissutale i nutrienti esclusivamente attraverso i micro-vasi, con un coefficiente di permeabilità di 1,2 x 10-7 cm/s, simile a quello osservato per i capillari in vivo8.
L'incorporazione di micro-vasi auto-organizzanti nel modello VMT rappresenta un significativo passo avanti perché: 1) imita la struttura e la funzione delle masse tumorali vascolarizzate in vivo; 2) è in grado di modellare le fasi chiave delle metastasi, comprese le interazioni tumore-endoteliale e delle cellule stromali; 3) stabilisce barriere fisiologicamente selettive per la somministrazione di nutrienti e farmaci, migliorando lo screening farmaceutico; e 4) consente la valutazione diretta di farmaci con capacità anti-angiogeniche e anti-metastatiche. Replicando la somministrazione in vivo di nutrienti, farmaci e cellule immunitarie in un complesso microambiente 3D, la piattaforma VMO/VMT è un modello fisiologicamente rilevante che può essere utilizzato per eseguire screening farmacologici e studiare il cancro, la biologia vascolare o organo-specifica. È importante sottolineare che il VMT supporta la crescita di vari tipi di tumori, tra cui il cancro del colon, il melanoma, il cancro al seno, il glioblastoma, il cancro ai polmoni, la carcinosi peritoneale, il cancro ovarico e il cancro al pancreas 8,9,10,11,12,13. Oltre ad essere a basso costo, facilmente stabilibile e disponibile per esperimenti ad alto rendimento, la piattaforma microfluidica è completamente compatibile otticamente per l'analisi delle immagini in tempo reale delle interazioni tumore-stromali e della risposta a stimoli o terapie. Ogni tipo di cellula nel sistema è etichettato con un diverso marcatore fluorescente per consentire la visualizzazione diretta e il monitoraggio del comportamento cellulare durante l'intero esperimento, creando una finestra sul microambiente dinamico del tumore. Abbiamo precedentemente dimostrato che la VMT modella più fedelmente in vivo la crescita, l'architettura, l'eterogeneità, le firme di espressione genica e le risposte ai farmaci rispetto alle modalità di coltura standard10. È importante sottolineare che il VMT supporta la crescita e lo studio di cellule derivate dal paziente, comprese le cellule tumorali, che modellano meglio la patologia dei tumori genitori rispetto alle colture di sferoidi standard e fanno progredire ulteriormente gli sforzi di medicina personalizzata11. Questo manoscritto delinea i metodi per stabilire la VMT, mostrando la sua utilità per lo studio dei tumori umani.
Protocollo
1. Progettazione e fabbricazione
- Progettazione del dispositivo
- Per la fabbricazione di dispositivi microfluidici, creare uno stampo SU-8 utilizzando uno strato di 200 μm di SU-8 rivestito in spin su un wafer di silicio (RCA-1 pulito e trattato con acido fluoridrico (HF) al 2%), seguito da una singola fase di fotolitografia a maschera come descritto in precedenza 8,9.
- Fondere una replica di polidimetilsilossano (PDMS) di 4 mm di spessore dallo stampo SU-8 per generare uno stampo in poliuretano durevole per le fasi di fabbricazione a valle. È possibile utilizzare varie iterazioni di progettazione 8,9,10,11,12,13,14,15.
- Nell'iterazione corrente, progettare il dispositivo microfluidico in modo che sia adattato su misura a un formato standard a piastre a 96 pozzetti e costituito da uno strato di caratteristiche PDMS di 2 mm di spessore con 12 unità di dispositivo microfluidico racchiuse da un sottile strato di membrana polimerica trasparente (1/16 di pollice) sul fondo (Figura 1A).
- Assicurarsi che le singole unità tissutali siano costituite da una camera tissutale affiancata da un ingresso di carico del gel (L1) e da un'uscita (L2), da un regolatore di pressione (PR)16 e da canali microfluidici disaccoppiati collegati a 2 ingressi e uscite del fluido su ciascun lato (M1-M2, M3-M4; Figura 1B).
- Posizionare ogni ingresso e uscita all'interno di un singolo pozzetto che funge da serbatoio del fluido per stabilire la pressione idrostatica (10 mm H2O) attraverso il canale microfluidico. Per consentire l'anastomosi della rete vascolare con i canali esterni, collegare i canali microfluidici alla camera tissutale tramite pori di comunicazione larghi 50 μm (6 in alto, 6 in basso).
NOTA: I resistori microfluidici creano un gradiente di pressione interstiziale di 5 mm H2O attraverso la camera tissutale che diventa intraluminale una volta che la rete vascolare è completamente formata 8,10. Le procedure successive iniziano con una piastra ad alta produttività completamente assemblata.

Figura 1. Progettazione di piattaforme microfluidiche. (A) Lo schema dell'assemblaggio della piattaforma mostra il feature layer PDMS con 12 unità di dispositivo legate a una piastra a 96 pozzetti senza fondo e sigillate con una sottile membrana polimerica trasparente. Ogni unità del dispositivo occupa una colonna di pozzetti sulla piastra. L'unità a dispositivo singolo evidenziata in rosso è mostrata con i dettagli in (B). (B) Lo schema di un'unità del dispositivo mostra una singola camera tissutale posizionata all'interno di un pozzetto della piastra a 96 pozzetti e due porte di carico con foro di ingresso e uscita (L1-L2) perforato per consentire l'introduzione della miscela cellula-matrice. Gli ingressi e le uscite del fluido (M1-M2, M3-M4) sono perforati e posizionati all'interno di pozzetti che fungono da serbatoi di fluidi. Diversi volumi di terreno stabiliscono un gradiente di pressione idrostatica attraverso la camera del tessuto attraverso canali microfluidici disaccoppiati. L'unità di regolazione della pressione (PR) funge da valvola di scoppio del gel per aumentare la facilità di carico. Si noti che il dispositivo è profondo 200 μm e la camera del tessuto è di 2 mm x 6 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Preparativi prima del carico
- Colture cellulari
- Mantenere le celle secondo le raccomandazioni del produttore in un incubatore umidificato a 37 °C e 5% di CO2 .
- Piastra T75 di EC, NHLF o altre cellule fibroblastiche/stromali trasdotte e cellule tumorali desiderate 3-4 giorni prima del caricamento a una densità indicata dai protocolli del produttore e dell'utente. Per questo protocollo, prelevare 1 x 106 cellule per matraccio per ciascun tipo di cellula. Colture EC in terreni completi EGM2 (Endothelial Growth Media 2), NHLF in Dulbecco's Modified Eagle Medium (DMEM) con il 10% di FBS e cellule tumorali in terreni appropriati a seconda del tipo di cellula.
- Mantenere le cellule alimentandole con i rispettivi terreni ogni 2-3 giorni e riconfermare l'efficienza di trasduzione o marcatura visualizzando le cellule al microscopio a fluorescenza. Il giorno del carico, assicurarsi che EC sia confluente all'80%-100%, mentre NHLF sia subconfluente al 70%-80%.
- Preparazione del fibrinogeno
- Preparare la soluzione di fibrinogeno alla concentrazione desiderata (tipicamente, 5-8 mg/mL supportano la formazione di una robusta rete vascolare), tenendo conto della percentuale di coagulazione del fibrinogeno. Calcola la quantità di fibrinogeno necessaria con la seguente equazione:
Fibrinogeno (mg) = (volume (mL)) x (concentrazione (mg/mL))/ (% di coagulazione) - Sciogliere il fibrinogeno in un volume appropriato di mezzo basale endoteliale 2 (EBM2), riscaldato a 37 °C, agitando delicatamente la provetta (non vorticare). Incubare il fibrinogeno a bagnomaria a 37 °C per consentirgli di entrare completamente in soluzione. È importante sottolineare che non utilizzare un mezzo completo.
- Soluzione di fibrinogeno con filtro sterile con filtro da 0,22 μm e aliquota al volume desiderato, tipicamente 400 μL per provetta per microcentrifuga.
NOTA: Altre proteine della matrice (ad es. collagene, fibronectina o laminina) possono essere aggiunte alla miscela di fibrinogeno.
- Preparare la soluzione di fibrinogeno alla concentrazione desiderata (tipicamente, 5-8 mg/mL supportano la formazione di una robusta rete vascolare), tenendo conto della percentuale di coagulazione del fibrinogeno. Calcola la quantità di fibrinogeno necessaria con la seguente equazione:
3. Caricamento dei campioni
NOTA: Il caricamento è sensibile al tempo e deve essere completato dall'inizio (sollevamento delle celle) alla fine (aggiunta dei supporti ai dispositivi) entro circa 1,5-1,75 ore per garantire risultati ottimali. Ogni passaggio è annotato con un timer suggerito per aiutare a mantenere l'utente in pista.
- Preparazione dei materiali (Giorno di carico)
- Mettere a bagnomaria a 37 °C per 10-15 minuti: soluzione salina bilanciata di Hank (HBSS) o soluzione salina tamponata con fosfato (PBS) per il lavaggio delle cellule, reagente di dissociazione cellulare, terreni (ad es. EGM2, DMEM)
- Conservare i seguenti reagenti in frigorifero a 4 °C fino al momento dell'uso: trombina, laminina (scongelati per una notte a 4 °C).
- Scongelare l'aliquota di fibrinogeno a temperatura ambiente. Preparare aliquote di trombina da 1,5 μL in provette per microcentrifuga da 500 μL, con una provetta per unità di dispositivo. Assicurarsi che l'aliquota di trombina si trovi sul fondo di ciascuna provetta per facilitare il caricamento.
- Posizionare le piastre ad alta produttività sterilizzate con raggi UV in un essiccatore per almeno 30 minuti prima del caricamento per rimuovere l'aria intrappolata nella microfluidica.
- Preparazione delle celle (avvio del timer = inizio a 0 min)
- Controllare le cellule al microscopio con un ingrandimento 4x per confermare la confluenza e l'efficienza di trasduzione.
- Lavare ogni matraccio di cellule T75 2 volte con 5 mL di HBSS e aspirare completamente. Aggiungere 1 mL di reagente di dissociazione in ciascun matraccio e incubare a 37 °C, 5% CO2 per 1-2 minuti.
- Picchiettare delicatamente la piastra con il palmo della mano e controllare che tutte le cellule siano state sollevate.
- Lavare le cellule dal matraccio con 9 mL di terreno appropriato e raccoglierle in un recipiente conico da 15 mL. Rimuovere immediatamente una piccola aliquota per il conteggio delle cellule.
- Centrifugare le cellule a 300 x g per 3-5 minuti a 4 °C. Durante la centrifugazione delle celle, contare le celle. Un matraccio confluente T75 di EC o NHLF dovrebbe produrre almeno 2 x 106 cellule.
- Dopo la centrifugazione, aspirare il terreno e risospendere il pellet in un terreno appropriato a una concentrazione di 1 x 106 cellule/mL. Mantieni le cellule sul ghiaccio.
- Preparazione della miscela di cellule e fibrinogeno (Timer = inizio a 20 min)
- Determinare il numero di dispositivi da caricare, aggiungendone 1-2 per tenere conto della perdita di pipettaggio, e moltiplicare per il volume di miscela cellula/fibrinogeno necessaria per dispositivo. Ciò dipenderà dalla configurazione del dispositivo, ma per la progettazione del dispositivo presentata in questo articolo, sono necessari 6 μL per dispositivo.
- La concentrazione di ciascun tipo di cellula deve essere determinata sperimentalmente. Come punto di partenza, caricare EC a una concentrazione di circa 7 x 106 cellule/mL e NHLF a una concentrazione di 3,5 x 106 cellule/mL. La concentrazione di cellule tumorali può variare considerevolmente in base al loro tasso di crescita, ma in genere è compresa tra 0,5-2 x 106 cellule/mL. Usa questa equazione per calcolare il numero di celle necessarie:
Numero di cellule necessarie = (volume di fibrina (μL))/1000 μL x (concentrazione di cellule) - Risospendere le cellule a una concentrazione di 1 x 106 cellule/mL e utilizzare la seguente equazione per determinare il volume di cellule necessario:
Volume di celle necessarie (μL) = (numero di cellule necessarie)/1000 - Miscelare i rispettivi volumi di cellule EC, NHLF e tumorali (solo per VMT) in una provetta conica e centrifugare a 300 x g per 3-5 minuti a 4 °C.
- Dopo la centrifuga, aspirare con cura il materiale e pipettare via eventuali residui di terreno vicino al pellet. Risospendere delicatamente ma accuratamente il pellet nel volume calcolato di fibrinogeno, facendo particolare attenzione a non introdurre bolle d'aria. Tieniti sul ghiaccio.
- Portare le piastre sterilizzate e le aliquote di trombina nella cappa per coltura tissutale.
- Dispositivi di caricamento (Timer = inizio a 30-35 min)
- Utilizzando una pipetta P20, pipettare 6 μL di volume dalla miscela cellula/fibrina. Assicurarsi di pipettare la miscela su e giù almeno 5 volte per garantire una sospensione cellulare uniforme. Tenere la miscela sul ghiaccio per rallentare la coagulazione.
- Mescolare delicatamente la cellula/fibrina in una provetta di trombina inserendo la punta della pipetta direttamente nell'aliquota di trombina sul fondo della provetta. Pipettare immediatamente su e giù almeno 2 volte, facendo attenzione a non introdurre bolle d'aria. La fibrina inizierà a coagulare una volta mescolata con la trombina, quindi completare rapidamente ma deliberatamente i passaggi 3.4.3. e 3.4.4. prima che la fibrina si gelifichi nel puntale della pipetta (~3 s).
- Sollevare la piastra ad alta produttività inclinata e inserire rapidamente il puntale della pipetta in una delle porte di caricamento del dispositivo (L1 o L2). Vedere la Figura 2A per lo schema.
- Spingere lo stantuffo della pipetta verso il basso fino al primo arresto con un movimento fluido e fluido per iniettare la miscela cellula/fibrina nella camera del tessuto. Osserva che il gel attraversi completamente la camera.
NOTA: L'applicazione di troppa pressione durante questa fase può portare alla fuoriuscita del gel nei canali microfluidici nella parte superiore e/o inferiore delle camere tissutali. - Riposizionare delicatamente la piastra nella cappa per colture tissutali senza rimuovere il puntale della pipetta, rilasciare lo stantuffo della pipetta o disturbare la pipetta. Utilizzare la mano per ruotare e rimuovere il puntale della pipetta dal P20 e lasciarlo nel foro della porta di caricamento. Non utilizzare il pulsante di espulsione per rimuovere la punta in quanto ciò causerebbe troppa pressione.
- Procedere con i passaggi 3.4.1-3.4.5 per i dispositivi rimanenti.
- Al termine del caricamento, lasciare riposare indisturbata la piastra per 2 minuti nella cappa per coltura tissutale.
- Rimuovere i puntali delle pipette ruotandoli delicatamente ed estraendoli dalle porte di caricamento. Riposizionare il coperchio sulla piastra.
- Incubare l'intera piastra per 15-20 minuti in un incubatore a 37 °C per consentire al gel di polimerizzare completamente.
- Dopo l'incubazione, controllare ogni unità del dispositivo al microscopio. Verificare che le cellule siano distribuite uniformemente in tutta la camera senza bolle d'aria e che vi sia un'interfaccia in gel chiaramente visibile tra la camera tissutale e i canali microfluidici, come nella Figura 2B-C.
- Rivestimento del canale con laminina (Timer = inizio a 45-50 min)
- Dopo che i gel sono completamente solidi, introdurre la laminina nei canali microfluidici per promuovere l'anastomosi vascolare.
- Utilizzando un P20, introdurre 4 μL di laminina in ciascun canale microfluidico (superiore e inferiore) del dispositivo. Inserire il puntale della pipetta in M1 o M3 ed espellere lentamente la laminina, assicurandosi che la laminina ricopra l'intero canale superiore, quindi ripetere per M2 o M4 per rivestire l'intero canale inferiore.
- Determinare l'orientamento pipettando la laminina dal lato opposto al regolatore di pressione per consentire una pressione sufficiente per spingerla attraverso. Tuttavia, se la laminina non viaggia facilmente da un lato, rimuovere la punta da un lato e spingere la laminina dall'altro lato. Potrebbe essere necessario andare al secondo arresto della pipetta (cioè spingere lo stantuffo fino in fondo) per generare una pressione sufficiente a spingere la laminina attraverso l'intero canale.
- Rimuovere delicatamente la punta dall'ingresso/uscita del supporto. Non utilizzare il pulsante di espulsione sul P20.
- Ripetere i passaggi 3.5.1-3.5.4 per ciascun dispositivo e incubare la piastra a 37 °C, 5% CO2 per 10 min.
- Aggiunta di supporti (Timer = inizio a circa 1 ora e 10 minuti)
- Aggiungere 275 μL di terreno completo di EGM2 nei serbatoi di terreno disaccoppiati dei pozzetti nelle file A e B o G e H. Questo sarà il lato alto e l'orientamento dovrebbe essere determinato rendendo i pozzetti sul lato opposto al regolatore di pressione ad alto volume per iniziare. I supporti saranno spinti dall'alto per gravità.
- Utilizzando una pipetta P200, introdurre 75 μL di terreno negli ingressi/uscite del fluido dei pozzetti contenenti i 275 μL di EGM2. Inserire la punta nel foro di ingresso del supporto ed espellere lentamente il supporto, osservando che il supporto viaggi attraverso il canale e si formi di bolle sull'altro lato.
- Rimuovere il puntale della pipetta e spingere il terreno rimanente dal puntale nel serbatoio del terreno in modo che il volume totale sul lato alto sia di 350 μL.
- Ripetere i passaggi 3.6.1-3.6.3 per ciascuna unità del dispositivo, canali superiore e inferiore.
- Aggiungere 50 μL di terreno per coprire completamente il lato basso, i pozzetti nelle file A e B o G e H, a seconda dell'orientamento sopra descritto. Assicurarsi che ci sia uno strato uniforme di supporto che copra il fondo del pozzetto. Fare riferimento alla Figura 2D per uno schema che mostra i volumi di fluidi nei serbatoi.
- Rimozione delle bolle d'aria (post-caricamento)
NOTA: La rimozione delle bolle è un passaggio fondamentale per garantire un flusso corretto in ciascun dispositivo. Entro il giorno 2, le cellule endoteliali e i fibroblasti inizieranno ad allungarsi in risposta al flusso (Figura 2E).- Una volta aggiunti tutti i terreni, incubare le piastre per 1-2 ore in un incubatore a 37 °C, 5% di CO2 prima di verificare la presenza di bolle d'aria nei canali o negli ingressi/uscite del fluido.
- Visualizzare le bolle nei canali del mezzo al microscopio ed espellerle reintroducendo 75 μL di terreno nei canali per spingere fuori le bolle.
- Visualizza le bolle negli ingressi/uscite del fluido a occhio. Utilizzare una pipetta P200 per rimuovere le bolle d'aria intrappolate negli ingressi e nelle uscite del fluido spingendo lo stantuffo verso il basso, introducendo il puntale nel foro ed estraendo la bolla sollevando lo stantuffo per applicare una pressione negativa e aspirare la bolla.

Figura 2. Schema di caricamento del dispositivo. (A) Utilizzando una pipetta P20, la miscela cellula/fibrina viene introdotta nella camera tissutale di ciascuna unità del dispositivo attraverso una delle porte di caricamento. (B) La micrografia in campo chiaro mostra un dispositivo microfluidico che ha caricato EC, fibroblasti e cellule tumorali per formare un VMT. Barra di scala = 500 μm. (C) Micrografia a fluorescenza del dispositivo in B che mostra EC in rosso, tumore in ciano e fibroblasti in blu. (D) Lo schema mostra l'aggiunta di fluido nei serbatoi, con 350 μL sul lato alto e 50 μL sul lato basso per generare il carico di pressione idrostatica. (E) Il giorno 2 della coltura VMT mostra che i fibroblasti e l'EC iniziano ad allungarsi per formare la rete vascolare. Barra della scala = 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Manutenzione dei dispositivi e applicazioni sperimentali
- Mantenimento e trattamento farmacologico
NOTA: Per mantenere il flusso nel sistema, la pressione idrostatica deve essere ristabilita giornalmente pipettando il volume del fluido dal lato basso al lato alto o viceversa, assicurando che il volume totale nel lato alto rimanga a 350 μL. La direzione del flusso viene cambiata ogni giorno dopo il giorno 2 dell'impianto VMO o VMT. Ulteriori dettagli sulla manutenzione e sul trattamento sono forniti di seguito.- Cambiare terreno a giorni alterni con EGM2 completo fino a quando la vascolarizzazione non è completamente stabilita (giorno 5-6). Aspirare completamente i vecchi fluidi e sostituire i pozzetti ad alta pressione (350 μL) e i pozzetti a bassa pressione (50 μL).
NOTA: La determinazione sperimentale di formulazioni di terreni ottimizzati può essere condotta per altri tipi di cellule, spesso coinvolgendo una miscela 50:50 o l'aggiunta di componenti specifici in EGM2. - Una volta che la rete vascolare si è formata e il tessuto è completamente sviluppato (giorni 4-7), eseguire un test di perfusione del destrano prima di utilizzare i dispositivi per gli esperimenti (passaggio 4.2.1.). Utilizzare solo dispositivi che abbiano una perfusione sufficiente nella camera del tessuto.
- Per gli esperimenti terapeutici, il giorno stesso in cui inizia il trattamento, acquisire immagini in tutti i canali fluorescenti per ciascun dispositivo. Questo servirà come linea di base.
- Trattare i dispositivi con la terapia desiderata sostituendo il terreno con terreno fresco contenente il farmaco diluito alla concentrazione desiderata. Assicurarsi che i farmaci siano diluiti in veicoli appropriati a seconda delle raccomandazioni del produttore, ma non superare lo 0,01% di DMSO nei terreni.
- Esporre i dispositivi al farmaco per il periodo di tempo desiderato (in genere 48 ore, ma può essere informato dalla farmacocinetica).
- Visualizzare l'immagine di ogni canale di ciascun dispositivo all'intervallo di tempo desiderato per monitorare la risposta al trattamento. Mantenere le piastre come indicato al punto 4.1.1 per tutta la durata dell'esperimento.
- Al termine dell'esperimento, sbiancare le piastre e metterle in un contenitore a rischio biologico, fissare con PFA al 4% per la colorazione immunofluorescente (passaggio 4.3.) o raccogliere per l'isolamento di cellule vive o RNA (passaggio 4.4.).
- Cambiare terreno a giorni alterni con EGM2 completo fino a quando la vascolarizzazione non è completamente stabilita (giorno 5-6). Aspirare completamente i vecchi fluidi e sostituire i pozzetti ad alta pressione (350 μL) e i pozzetti a bassa pressione (50 μL).
- Saggi di perfusione
- Perfusione di destrano
NOTA: La permeabilità/pervietà vascolare può essere determinata perfondendo la rete vascolare con destrano marcato in fluorescenza di peso molecolare variabile (40 kD, 70 kD o 150 kD). A seconda dell'etichetta fluorescente della CE, è possibile utilizzare FITC o destrano di rodamina.- Prima della perfusione, determinare l'esposizione appropriata del canale FITC o della rodamina aggiungendo alcuni μL di destrano all'interno del canale fluidico o della camera di un dispositivo vuoto. Impostare il tempo di esposizione appena al di sotto del livello di saturazione attraverso l'uso di un software di microscopio per visualizzare un istogramma delle intensità dei pixel, garantendo una gamma dinamica caratterizzata da pixel uniformemente distribuiti senza alcuna concentrazione notevole di valori ad alta intensità.
- Eseguire micrografie di tutti i dispositivi nei canali di interesse, inclusa un'immagine di sfondo di tutti i dispositivi nel canale del destrano fluorescente, per calibrare sullo sfondo. Utilizzare la stessa esposizione determinata sopra e allineare la camera del tessuto al centro del fotogramma dell'immagine per garantire immagini coerenti per la quantificazione.
- Preparare una scorta principale di destrano FITC o destrano di rodamina a una concentrazione di 5 mg/mL in 1x DPBS. Questo brodo può essere conservato a 4 °C.
- Per preparare un materiale di lavoro, diluire 5 mg/mL di materiale in EGM2 fino a una concentrazione finale di 50 μg/mL.
- Sostituire il terreno nei serbatoi con la soluzione di destrano diluito a metà volume massimo (175 μL in un pozzetto e sul lato alto del canale superiore o inferiore della camera tissutale). Sostituire il mezzo negli altri pozzetti in modo che il lato superiore disaccoppiato riceva 175 μL di EGM2 fresco senza destrano e i pozzetti sul lato basso abbiano solo 50 μL in ciascuno.
NOTA: Il destrano deve essere aggiunto solo su un lato dei canali microfluidici (superiore o inferiore) per consentire la visualizzazione del colorante che viaggia attraverso il lato ad alta pressione, nel letto vascolare e fuori dal lato a bassa pressione. - Al microscopio, osserva il destrano fluorescente che fluisce attraverso la rete vascolare. Ciò si verifica in genere entro circa 2 minuti dall'aggiunta del colorante al serbatoio del supporto.
- Iniziare l'imaging del canale del destrano fluorescente (e di altri canali, se lo si desidera). Questo è il punto temporale T = 0. Scatta immagini aggiuntive in più punti temporali (in genere ogni 10 minuti) o in una singola immagine finale.
- Perfusione di cellule
NOTA: Vari tipi di cellule possono essere perfusi attraverso la vascolarizzazione a seconda del disegno dello studio, compresi i linfociti o i macrofagi per gli studi di immunologia del cancro, nonché le cellule tumorali per gli studi sulle metastasi. Le cellule devono essere marcate in modo fluorescente per facilitarne il monitoraggio nel tempo.- Almeno 2 ore prima di perfondere le cellule, eseguire la perfusione del destrano su tutti i dispositivi come descritto sopra. Questo passaggio è importante per determinare la pervietà vascolare prima di aggiungere cellule.
- Determinare l'esposizione appropriata della fotocamera per le cellule da perfondere. Prelevare un piccolo campione di cellule da visualizzare al microscopio e impostare il tempo di esposizione per quel marcatore fluorescente. Impostare il tempo di esposizione appena al di sotto del livello di saturazione.
- Eseguire micrografie di tutti i dispositivi nei canali di interesse, inclusa un'immagine di sfondo di tutti i dispositivi nel canale del destrano fluorescente, per calibrare sullo sfondo. Utilizzare la stessa esposizione determinata al punto 4.2.2.1.
- Verificare che il destrano si sia diffuso completamente al di fuori delle camere tissutali prima di raccogliere le cellule per la perfusione. Raccogli e conta le celle di interesse.
- Risospendere le cellule alla densità appropriata in EGM2. Ad esempio, le cellule T vengono in genere aggiunte a circa 1 x 106 cellule/mL per imitare la concentrazione nel sangue.
NOTA: Gli EC sono sensibili alla composizione dei mezzi, ma possono tollerare fino al 50% di miscelazione con la maggior parte degli altri mezzi. Prova in anticipo. - Aggiungere 175 μL di sospensione cellulare in un pozzetto sul lato alto di ciascun dispositivo e aggiungere 175 μL di EGM2 completo nell'altro pozzetto. Sul lato basso, aggiungere 50 μL di terreno completo EGM2 a entrambi i pozzetti.
- Al microscopio, osserva le cellule fluorescenti che fluiscono attraverso la rete vascolare. Ciò si verifica in genere entro circa 2 minuti dall'aggiunta delle celle al serbatoio del terreno.
- Una volta stabilito il flusso cellulare, iniziare l'imaging del canale cellulare fluorescente (e di altri canali, se lo si desidera). Questo è il punto temporale T = 0. Acquisire immagini aggiuntive in più punti temporali o in una singola immagine finale, a seconda del disegno dello studio. Ad esempio, l'imaging ogni 10 minuti si tradurrà in corsi temporali ad alta risoluzione o ogni 6-12 ore per tracciare i movimenti periodici delle cellule.
- Perfusione di destrano
- Colorazione immunofluorescente (IF)
- Aspirare i terreni dai pozzetti. Aggiungere 200 μL di PFA al 4% su entrambi i pozzetti del lato alto di ciascuna unità del dispositivo e 50 μL sul lato basso. Lasciare fluire il PFA attraverso le camere per 15 minuti a temperatura ambiente o 30 minuti a 4°C.
- Durante l'incubazione, preparare una piastra da 24 pozzetti con 500 μL di PBS 1x per pozzetto. Calcola quanti pozzetti sono necessari per colorare ogni dispositivo.
- Rimuovere completamente il PFA dai pozzetti. Capovolgere la piastra e rimuovere con cautela il supporto in plastica sulla membrana.
NOTA: La colorazione IF può essere eseguita anche in situ senza rimuovere la membrana e il dispositivo. A tal fine, eseguire le fasi di colorazione perfondendo i reagenti attraverso il VMO/VMT e aumentare la durata di ciascuna fase di incubazione di circa 6 volte. - Staccare molto delicatamente e con attenzione lo strato inferiore della membrana dallo strato caratteristico del dispositivo per esporre le camere del tessuto afferrando entrambi gli angoli e tirando verso il basso con un movimento lento e fluido. La maggior parte del tessuto deve rimanere nella camera del tessuto. Fare riferimento alla Figura 3A.
- Utilizzare una lama di rasoio o un bisturi per applicare una forza sufficiente per tagliare completamente il livello delle caratteristiche e tagliare un piccolo rettangolo attorno a ogni singola unità del dispositivo, come mostrato nella Figura 3B.
- Incuneare una spatola tra il feature layer e la piastra del pozzetto. Applicare una leggera pressione sotto il feature layer per rimuovere con cautela l'intero feature layer contenente la camera tissutale dalla piastra a pozzetti.
- Posizionare ogni pezzo rettangolare del feature layer PDMS contenente il tessuto rivolto verso il basso in un singolo pozzetto contenente PBS.
- Una volta che tutte le unità sono nei pozzetti, lavare con PBS posizionando la piastra su un bilanciere delicato per 5 minuti, aspirando PBS dal pozzetto e sostituendolo con 500 μL di PBS fresco. Ripetere per un totale di 3 lavaggi.
- Aspirare PBS da ciascun pozzetto e permeabilizzare i tessuti con 500 μL di Triton-X allo 0,5% in PBS, 2 volte per 10 minuti ciascuna su un bilanciere delicato. Rimuovere la soluzione di permeabilizzazione.
- Bloccare in 500 μL di siero al 10% in Triton-X allo 0,1% per dispositivo per 1 ora a temperatura ambiente con un leggero dondolio.
- Diluire gli anticorpi primari in siero al 3% in Triton-X allo 0,1% fino alla concentrazione e al volume desiderati. Rimuovere la soluzione bloccante e aggiungere una quantità sufficiente di soluzione anticorpale primaria per coprire completamente il fondo di ciascun pozzetto e consentire il libero movimento dei tessuti del dispositivo (~200 μL). Coprire il piatto con una pellicola trasparente.
- Incubare la piastra oscillando per una notte a 4 °C. Il giorno successivo, riportare la piastra contenente i fazzoletti del dispositivo a temperatura ambiente (~15 min).
- Aspirare la soluzione anticorpale primaria da ciascun pozzetto e dalle camere di lavaggio con 500 μL di PBS, 3 volte per 5 minuti ciascuna su un bilanciere delicato.
- Aggiungere 200 μL di anticorpo secondario in siero al 3% in Triton-X allo 0,1% alla concentrazione desiderata. Incubare la piastra con un leggero dondolio per 1 ora a temperatura ambiente al buio.
- Aspirare la soluzione anticorpale secondaria e lavare con PBS, 3 volte per 5 minuti ciascuna con un leggero dondolio. Aggiungere una soluzione di 1x DAPI in Triton-X allo 0,1% per 10 minuti mentre si dondola al buio.
- Rimuovere i ritagli rettangolari del dispositivo contenenti tessuti macchiati dalla piastra utilizzando una pinzetta e posizionare il fazzoletto con il lato rivolto verso l'alto su un tovagliolo di carta.
- Pipettare alcuni μL (~10 μL) di soluzione antisbiadimento direttamente su ciascuna camera e vetrino coprioggetto, facendo attenzione a non introdurre bolle. Lasciare indurire l'antisbiadimento sulle camere durante la notte a temperatura ambiente al buio e quindi procedere con l'imaging.
- Isolamento di tessuti e cellule per saggi molecolari
NOTA: Ogni piastra ad alta produttività conterrà circa 1-2 x 105 celle, a seconda del momento del raccolto. Ridimensionare il numero di repliche sperimentali per tenere conto delle cellule totali e della potenziale perdita durante la raccolta.- Analisi su singole cellule
- Aspirare i terreni da ciascun pozzetto e capovolgere la piastra ad alta produttività in modo che lo strato del dispositivo sia rivolto verso l'alto.
- Rimuovere il supporto in plastica sulla membrana. Staccare molto delicatamente e con attenzione la membrana inferiore del PDMS dallo strato caratteristico del dispositivo per esporre le camere tissutali afferrando entrambi gli angoli e tirando verso il basso con un movimento lento e regolare.
- La membrana può essere rimossa anche con un corretto incollaggio. La maggior parte del tessuto dovrebbe rimanere nella camera del tessuto dopo aver rimosso la membrana; Tuttavia, se una parte è attaccata alla membrana, seguire i passaggi seguenti sulla membrana stessa.
- Lavare ogni unità del dispositivo con 500 μL di HBSS o PBS. A ciascuna unità del dispositivo, aggiungere 100 μL di reagente di dissociazione e lasciarlo riposare come una gocciolina sulla parte superiore del dispositivo. Rimettere la piastra nell'incubatrice a 37 °C per 5 min.
- Dopo la digestione, utilizzare una pipetta P200 per pipettare su e giù attraverso le camere tissutali e raccogliere i tessuti nel reagente di dissociazione. Muovere il puntale della pipetta avanti e indietro su ciascun dispositivo per garantire la rimozione completa del tessuto e raccoglierlo in un conico da 15 mL con 500 μL di EGM2 per neutralizzare il reagente di dissociazione.
- Per la rimozione completa delle cellule rimanenti dalla camera del tessuto, aggiungere 500 μL di EGM2 a ciascuna unità del dispositivo e lavare con una pipetta P200.
- Centrifugare la soluzione di digestione contenente i tessuti staccati a 300 x g per 5 minuti a 4 °C per pellettare singole cellule e tessuti interi.
- Aspirare accuratamente i terreni e aggiungere ai tessuti 500 μL di 1 mg/mL (200 U/mL) di collagenasi di tipo IV, 0,1 mg/mL di ialuronidasi di tipo V e 200 U/mL di DNAsi di tipo IV in HBSS.
- Dopo una delicata risospensione lasciare riposare la soluzione per 2 minuti a temperatura ambiente prima di pipettare delicatamente per dissociare il gel.
- Lavare la miscela di digestione con 10 mL di EGM2 e centrifugare a 300 x g per 5 minuti a 4 °C. Risospendere le cellule in 1x DPBS con 1% di BSA o HSA e passare attraverso un filtro da 70 μm pre-bagnato ruotando a 200 x g per 1 minuto.
- Contare le cellule e regolare il volume in modo che la concentrazione finale sia di 1000 cellule per μL. Le sospensioni cellulari possono quindi essere sottoposte a FACS, citometria a flusso o sequenziamento dell'RNA a singola cellula.
- Isolamento dell'RNA da tessuti interi
- Seguire i passaggi 4.4.1.1 e 4.4.1.2 precedenti.
- Aggiungere circa 10 μL di tampone di lisi dell'RNA su ciascuna camera tissutale esposta, assicurandosi che il tampone si accumuli direttamente sopra i tessuti. Non utilizzare più di 100 μL di tampone di lisi dell'RNA in totale.
- Incubare per 3 minuti a temperatura ambiente. Utilizzare il P20 per pipettare su e giù su ciascuna unità del dispositivo e utilizzare la punta della pipetta per raschiare il materiale residuo dalla camera del tessuto, se necessario.
- Trasferire la maggior quantità possibile di tampone di lisi in una provetta per microcentrifuga da 1,5 mL. Ripetere i passaggi da 4.4.2.2. a 4.4.2.3. per i dispositivi rimanenti e i campioni di pool nella provetta da 1,5 mL.
- Seguire le istruzioni del produttore per isolare l'RNA, a seconda del kit o dei reagenti.
- Analisi su singole cellule

Figura 3. Piattaforma di preparazione per l'immunocolorazione. (A) Schema della piattaforma del dispositivo completamente assemblata con uno strato di membrana sulla parte superiore. Per rimuovere la membrana, tirare con cautela ogni angolo dello strato esterno verso il basso con un movimento costante e delicato. (B) Una volta rimosso completamente lo strato di membrana, utilizzare una lama, un bisturi o un coltello per tagliare rettangoli attorno alla camera del tessuto di ciascuna unità del dispositivo, facendo attenzione a non tagliare il tessuto stesso. Una spatola può quindi essere incastrata sotto ogni rettangolo per rimuoverla dalla piastra e posizionare ciascuna unità in un singolo pozzetto di una piastra a 24 pozzetti con PBS per la colorazione. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Seguendo i protocolli qui descritti, i VMO e i VMT sono stati stabiliti utilizzando EC, NHLF e, per VMT, la linea cellulare di carcinoma mammario triplo negativo MDA-MB-231 acquistata commercialmente. I VMO stabiliti sono stati anche perfusi con cellule tumorali per imitare le metastasi. In ogni modello, entro il 5° giorno di co-coltura, una rete vascolare si auto-assembla in risposta al flusso guidato dalla gravità attraverso la camera tissutale, fungendo da condotto per la consegna in vivo di nutrienti, terapie e cellule tumorali o immunitarie alla nicchia stromale (Figura 4). I VMO sono stati stabiliti per la prima volta introducendo EC marcata con mCherry nella camera del tessuto, come mostrato nella Figura 4A (giorno 0 della coltura), con una distribuzione uniforme delle cellule. Il giorno 2 della coltura VMO, le EC iniziano ad allungarsi e a lumenizzarsi (Figura 4B) e al giorno 4, le EC si sono anastomizzate con i canali microfluidici esterni e formano una rete vascolare continua (Figura 4C). Dopo che la vascolarizzazione ha formato anastomosi e ha rivestito i canali esterni, il tessuto VMO è stato perfuso con 70 kD di destrano FITC per confermare la pervietà vascolare (Figura 4D). Il destrano FITC è stato introdotto nel serbatoio del terreno con la più alta pressione idrostatica e ha permesso di perfondere attraverso la camera del tessuto attraverso micro-recipienti dal lato ad alta pressione al lato a bassa pressione, come indicato dalle frecce. Nel VMO, il destrano FITC ha perfuso completamente la rete microvascolare entro 15 minuti con una perdita vascolare minima, confermando la funzione di barriera vascolare stretta (Figura 4E). Le cellule MDA-MB-231 sono state quindi perfuse in VMO, dove le cellule hanno aderito al rivestimento endoteliale (Figura 4F) e stravasate nello spazio extravascolare entro 24 ore dalla perfusione, formando micrometastasi multiple all'interno della camera tissutale (Figura 4G). Sono state scattate immagini fluorescenti microscopiche time-lapse ogni 50 ms con obiettivi aerei 4x e 10x su un microscopio confocale invertito per osservare le cellule tumorali che perfondono attraverso la microvascolarizzazione in tempo reale (Video supplementare 1, Video supplementare 2).
Nel VMO, le cellule T possono essere viste stravasare nello spazio extracellulare nel corso di 45 minuti (Figura 4H-I). Micrografie fluorescenti time-lapse sono state effettuate su un microscopio confocale per acquisire una z-stack di 150 μm di profondità ogni 15 minuti per osservare lo stravaso delle cellule T in tempo reale (Video supplementare 3). Come mostrato nella Figura 4J, MDA-MB-231 VMT con vasi completamente formati e non permeabili è stato perfuso con cellule T (giallo), molte delle quali hanno aderito rapidamente alla parete vascolare (punte di freccia; Figura 4K, Video supplementare 4, Video supplementare 5). Questi risultati, in aggiunta ai precedenti studi 8,9,10,11,12,13,14,15, dimostrano l'utilità delle piattaforme VMO e VMT rispettivamente per la ricerca immunologica e immuno-oncologica.
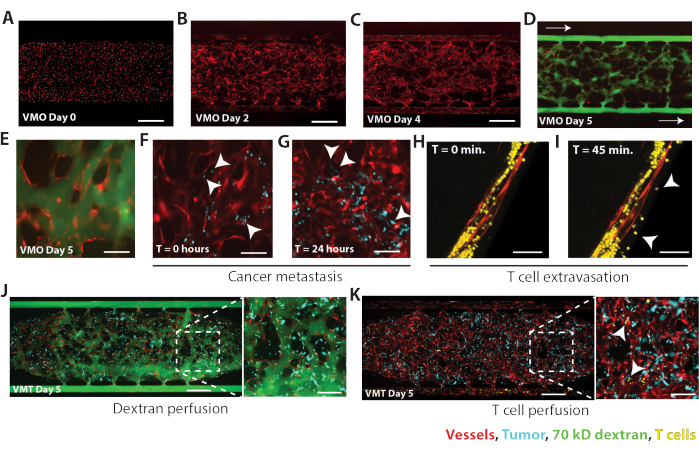
Figura 4. Risultati rappresentativi per MDA-MB-231 VMT e VMO. (A) VMO il giorno 0 immediatamente dopo aver caricato le cellule nella camera del tessuto. EC sono mostrati in rosso. Barra di scala = 500 μm. (B) Entro il giorno 2 della coltura VMO, l'EC inizia ad allungarsi in risposta al flusso. (C) Il VMO giorno 4 mostra che la rete vascolare è anastomizzata con i canali microfluidici esterni e i vasi sono quasi maturi. (D) Le reti VMO sono completamente perfuse e brevettate il giorno 5 della coltura. Recipienti mostrati in rosso, 70 kD FITC-destrano verde. La direzione del flusso è indicata da frecce. Barra della scala = 500 μm. (E) Vista zoom del VMO perfuso. Barra della scala = 100 μm. (F) MDA-MB-231 (ciano) viene perfuso attraverso la stessa rete VMO mostrata in E e, al tempo 0, le cellule tumorali hanno aderito al rivestimento dei vasi endoteliali (punte di freccia). Barra della scala = 100 μm. (G) Entro 24 ore, le cellule MDA-MB-231 hanno stravasato nello spazio extracellulare, stabilendo micro-metastasi multiple all'interno della nicchia vascolare. Barra della scala = 100 μm. (H) La microscopia a fluorescenza confocale time-lapse rivela lo stravaso di cellule T attraverso un microvaso all'interno del VMO (I) nel corso di 45 minuti. Le punte di freccia denotano aree di stravaso. Barra della scala = 50 μm. (J) La linea cellulare di carcinoma mammario triplo negativo MDA-MB-231 viene stabilita nel VMT e perfusa il giorno 5. Barra della scala = 500 μm. La rete vascolare mostra una perdita minima a 15 minuti dopo la perfusione (inserto, barra della scala = 100 μm). (K) MDA-MB-231 VMT (come in B) è perfuso con cellule T (giallo), con più aree di aderenza delle cellule T alla parete vascolare (punte di freccia). Barra della scala = 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Video supplementare 1. Perfusione di cellule di carcinoma ovarico nel VMO. Microscopia fluorescente time-lapse di cellule COV362 (ciano) perfuse attraverso una rete vascolare (rosso) e riprese con obiettivo 4x ogni 50 ms per 1 minuto. Clicca qui per scaricare questo video.
Video supplementare 2. Perfusione di cellule di carcinoma mammario triplo negativo nel VMO. Microscopia a fluorescenza time-lapse di cellule MDA-MB-231 (ciano) perfuse attraverso una rete vascolare (rosso) e riprese con obiettivo 10x ogni 50 ms per 30 s. Fare clic qui per scaricare questo video.
Video supplementare 3. Perfusione delle cellule T del VMO. La microscopia fluorescente confocale time-lapse ha catturato il processo di stravaso delle cellule T attraverso un microvaso all'interno del VMO per una durata di 45 minuti. Le immagini Z-stack sono state ottenute ogni 15 minuti, con una dimensione del passo di 2 μm e una profondità di 150 μm. Il vaso è rosso, le cellule T sono gialle. Clicca qui per scaricare questo video.
Video supplementare 4. Perfusione di cellule T di VMT. Microscopia a fluorescenza time-lapse di cellule T perfuse tramite MDA-MB-231 VMT a obiettivo 4x. Le immagini sono state acquisite ogni 50 ms per 30 secondi. Le cellule T sono mostrate in giallo, MDA-MB-231 in ciano e i vasi/EC in rosso. Clicca qui per scaricare questo video.
Video supplementare 5. Vista zoom della perfusione T cellula-VMT. Vista ingrandita 10x di MDA-MB-231 VMT perfuso con cellule T (dal video supplementare 4). Le immagini sono state acquisite ogni 50 ms per 30 secondi. Le cellule T sono mostrate in giallo, MDA-MB-231 in ciano e i vasi/EC in rosso. Clicca qui per scaricare questo video.
Discussione
Quasi tutti i tessuti del corpo ricevono sostanze nutritive e ossigeno attraverso la vascolarizzazione, rendendolo un componente fondamentale per la modellazione realistica delle malattie e lo screening dei farmaci in vitro. Inoltre, diverse neoplasie maligne e stati patologici sono definiti dalla disfunzione endoteliale vascolare e dall'iperpermeabilità3. In particolare, nel cancro, la vascolarizzazione associata al tumore è spesso mal perfusa, interrotta e permeabile, agendo così come una barriera alla somministrazione di cellule terapeutiche e immunitarie al tumore. Inoltre, la vascolarizzazione funge da condotto attraverso il quale le cellule tumorali possono metastatizzare per seminare tessuti distanti e facilita le comunicazioni cellula-cellula che smorzano la risposta immunitaria promuovendo ulteriormente la crescita e la disseminazione delle cellule tumorali. Questi fenomeni evidenziano il ruolo cruciale che la nicchia vascolare gioca nella resistenza terapeutica e nella progressione del cancro e la necessità di modellare accuratamente il microambiente tumorale durante lo studio preclinico. Tuttavia, i sistemi modello standard in vitro non riescono a includere componenti stromali e vascolari appropriati o a incorporare condizioni di flusso dinamico. Per affrontare queste carenze negli attuali sistemi modello, sono stati presentati metodi per stabilire un sistema microfisiologico ben caratterizzato che supporti la formazione di un micro-tumore umano vivente e perfuso (VMT) per la ricerca oncologica fisiologica. È importante sottolineare che il VMT modella le caratteristiche chiave dei vasi associati al tumore aberrante e delle interazioni tumore-stromale, rendendolo ideale per la modellazione di malattie biomimetiche e i test di efficacia terapeutica10.
Per facilità d'uso, la piattaforma non richiede pompe o valvole esterne e, grazie al formato della piastra a 96 pozzetti, può essere adattata alle apparecchiature di coltura e ai flussi di lavoro standard. Inoltre, sono state convalidate diverse iterazioni del dispositivo per affrontare questioni biologiche distinte e compartimenti specifici del tessuto e del paziente 8,9,10,11,12,13,14,15,16,17 . Sebbene la piattaforma possa essere adattata praticamente a qualsiasi uso specifico di organi o tessuti integrando vari tipi di cellule, le cellule devono essere prima testate per la crescita e la capacità vasculogenica all'interno del VMO/VMT a concentrazioni cellulari variabili per determinare la densità di semina ottimale e le condizioni di co-coltura. Per stabilire la vascolarizzazione, le cellule endoteliali derivate da cellule endoteliali umane formanti colonie (ECFC-EC) possono essere acquistate in commercio o appena isolate dal sangue del cordone ombelicale selezionando le cellule CD31+. Le cellule endoteliali della vena ombelicale umana (HUVEC) possono anche essere utilizzate per stabilire la vascolarizzazione all'interno del VMO/VMT e possono essere acquistate commercialmente o appena isolate dal cordone ombelicale. Inoltre, le cellule endoteliali derivate da cellule staminali pluripotenti indotte (iPSC-EC) sono state testate con successo nella piattaforma, aprendo la possibilità di un sistema completamente autologo18. I fibroblasti di derivazione commerciale (fibroblasti polmonari umani standard e normali per il loro potenziale vasculogenico) funzionano bene nel VMO/VMT e anche alcune popolazioni di cellule stromali di derivazione primaria possono essere incorporate o sostituite. I tumori di derivazione primaria possono essere introdotti nella VMT come cellule singole, sferoidi, organoidi o pezzi di tumore. La composizione della matrice può essere modificata in base alle esigenze sperimentali, tra cui l'aggiunta di collageni, laminina, fibronectina o persino matrici di tessuto decellularizzato19.
Il protocollo include diversi passaggi critici in cui è essenziale prestare particolare attenzione per evitare problemi comuni (Figura 5). Durante il carico, garantire una miscelazione omogenea del liquame di cellule/fibrina mediante un attento pipettaggio e un'introduzione regolare nella camera del tessuto (Figura 5A). Applicare una pressione adeguata per espellere completamente il gel nella camera per evitare il caricamento parziale (Figura 5B). La visualizzazione del liquame di cellule/fibrina che attraversa l'intera camera tissutale è necessaria per garantire il riempimento completo della camera e può essere facilitata posizionando un dito guantato dietro l'unità del dispositivo. Evitare di premere troppo forte sullo stantuffo della micropipetta per evitare che la miscela cellula/fibrina scoppi nei canali microfluidici (Figura 5C). È necessario prestare attenzione a non introdurre bolle d'aria durante il pipettaggio per evitare interferenze con lo sviluppo dei tessuti e le applicazioni a valle (Figura 5D). Una corretta velocità di miscelazione e caricamento è fondamentale per evitare aree di coagulazione incoerenti (Figura 5E), mentre la rimozione prematura del puntale della pipetta può anche danneggiare il gel nella camera (Figura 5F). Si consiglia di eseguire caricamenti di esercitazione per familiarizzare gli utenti con l'elemento temporizzato della procedura e la fase di caricamento. Inoltre, la corretta introduzione della laminina nei canali microfluidici è fondamentale per la migrazione dell'EC, l'anastomosi con i canali esterni e la formazione di una rete continua e perfusabile per la consegna dei nutrienti. Un rivestimento del canale incompleto o assente porterà a scarsi risultati di perfusione e VMO/VMT inutilizzabili.
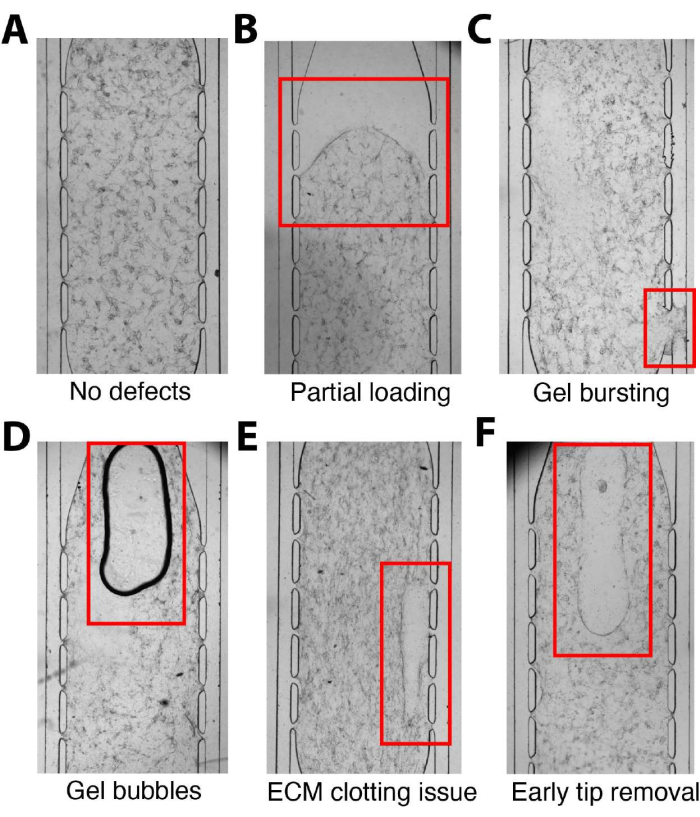
Figura 5. Errori comuni con il caricamento. (A) Unità del dispositivo microfluidico correttamente caricata senza difetti. (B) La miscela cellula/fibrina non è stata introdotta completamente nella camera, con conseguente caricamento parziale. (C) Troppa pressione applicata durante il carico, con conseguente scoppio del gel nel canale microfluidico, bloccando il flusso. (D) Bolle d'aria introdotte nella miscela cellula/fibrina all'interno della camera durante il pipettaggio. (E) Miscelazione impropria della miscela cellula/fibrina o caricamento lento che causa incongruenze nella coagulazione. (F) La rimozione del puntale della pipetta dalla porta di caricamento prima che il gel si sia indurito a sufficienza provocherà l'interruzione della miscela cellula/fibrina nella camera del tessuto. Fare clic qui per visualizzare una versione più grande di questa figura.
Flussi di lavoro robusti e standardizzati per l'analisi sono fondamentali negli studi VMO/VMT, in quanto generano notevoli quantità di dati di imaging. L'elaborazione delle immagini e i metodi analitici per VMO/VMT sono stati descritti in precedenza 8,9,10,11,12,13. Per l'analisi quantitativa del tumore, l'intensità della fluorescenza nel canale di colore che rappresenta le cellule tumorali viene misurata utilizzando software open source come ImageJ/Fiji (National Institute of Health)20 o CellProfiler (Broad Institute)21. La soglia delle immagini micrografiche tumorali è impostata per selezionare la regione tumorale fluorescente e l'intensità media della fluorescenza viene misurata all'interno di tale regione. L'intensità fluorescente totale del tumore viene calcolata come il prodotto dell'area fluorescente per la sua intensità media, normalizzata ai valori basali (pre-trattamento) per ottenere la variazione della crescita tumorale per dispositivo durante il periodo sperimentale. Per quanto riguarda l'analisi quantitativa dei vasi, è possibile utilizzare AngioTool (National Cancer Institute)22, gli script macro ImageJ/Fiji o il software MATLAB, come REAVER23, per quantificare la lunghezza totale del vaso, il numero di endpoint, il numero di giunzioni, la lunghezza media del vaso, il diametro del vaso, la lacunarità media e l'area percentuale del vaso. Gli algoritmi di apprendimento automatico possono essere integrati nei flussi di lavoro per l'analisi automatica delle immagini vascolari per identificare i composti che interrompono efficacemente la vascolarizzazione24. Le immagini di perfusione vengono analizzate misurando la variazione dell'intensità della fluorescenza all'interno delle regioni dello spazio extracellulare e calcolando il coefficiente di permeabilità10. Le simulazioni agli elementi finiti del flusso intraluminale all'interno di una rete microvascolare possono essere eseguite utilizzando COMSOL Multiphysics25. L'implementazione di metodi analitici standardizzati è fondamentale per estrarre informazioni significative dalla grande quantità di dati generati negli studi VMT.
Il protocollo qui delineato consentirà all'utente di sfruttare la piattaforma VMO/VMT per studiare molti aspetti della biologia del tumore, tra cui la crescita/progressione del tumore, le metastasi tumorali, la dinamica delle cellule T intra-tumorali e la risposta del tumore alla chemioterapia e al trattamento anti-angiogenico. Per consentire studi immuno-oncologici fisiologicamente rilevanti, è stato dimostrato come le cellule T appena isolate si perfondono attraverso la microvascolarizzazione, stravastrano attraverso la barriera cellulare endoteliale e migrano nel costrutto tissutale. L'imaging confocale microscopico time-lapse è stato presentato come uno strumento per visualizzare eventi spazialmente casuali e temporalmente rapidi, incluso lo stravaso di cellule T, che non sono facilmente visualizzabili con altri sistemi modello. Inoltre, abbiamo precedentemente testato diversi tipi di farmaci antineoplastici nel VMT, tra cui chemioterapici, inibitori di piccole molecole/tirosin-chinasi, anticorpi monoclonali (come anti-PD1 e bevacizumab), composti anti-angiogenici e agenti stabilizzanti vascolari, sottolineando come la piattaforma possa essere utilizzata per testare diverse classi di farmaci che hanno come bersaglio sia il tumore che lo stromaassociato 8. 9,10,11,12,13. L'effluente può essere raccolto dalla piattaforma e analizzato per varie citochine ed esosomi. In studi futuri, la piattaforma VMT può essere utilizzata per valutare la sensibilità delle cellule tumorali all'attacco mediato dalle cellule T a livello di singolo paziente. In conclusione, la VMT è una piattaforma flessibile e potente, ideale per lo studio della biologia dei tumori, dove il rimodellamento delle componenti vascolari e stromali è fondamentale per la progressione del tumore.
Divulgazioni
CCWH ha una partecipazione azionaria in Aracari Biosciences, Inc., che sta commercializzando una versione della tecnologia descritta in questo documento. I termini di questo accordo sono stati esaminati e approvati dall'Università della California, Irvine, in conformità con le sue politiche sul conflitto di interessi. Non ci sono altri conflitti di interesse.
Riconoscimenti
Ringraziamo i membri del laboratorio del Dr. Christopher Hughes per il loro prezioso contributo alle procedure descritte, così come i nostri collaboratori del laboratorio del Dr. Abraham Lee per la loro assistenza nella progettazione e fabbricazione della piattaforma. Questo lavoro è stato sostenuto dalle seguenti sovvenzioni: UG3/UH3 TR002137, R61/R33 HL154307, 1R01CA244571, 1R01 HL149748, U54 CA217378 (CCWH) e TL1 TR001415 e W81XWH2110393 (SJH).
Materiali
| Name | Company | Catalog Number | Comments |
| Fabrication | |||
| (3-Mercaptopropyl)trimethoxysilane, 95% | Sigma-Aldrich | 175617-100G | |
| Greiner Bio-One μClear Bottom 96-well Polystyrene Microplates | Greiner Bio-One | 655096 | |
| Methanol ≥99.8% ACS | VWR Chemicals BDH | BDH1135-1LP | |
| MILTEX Sterile Disposable Biopsy Punch with Plunger, 1mm diameter, | Integra Miltex | 33-31AA-P/25 | |
| PDMS membrane | PAX Industries | HT-6240 | |
| Plasma Cleaner PDC-001 | Harrick Plasma | N/A | |
| Smooth-Cast 385 | Smooth-On | N/A | |
| SP Bel-Art Lab Companion Clear Polycarbonate Cabinet Style Vacuum Desiccator | Bel-Art | F42400-4031 | |
| Standard Lids with Condensation Rings, 96-well plate | VWR | 82050-827 | |
| SYLGARD 184 Silicone Elastomer Kit (PDMS) | Dow | 4019862 | |
| Cell culture/Loading | |||
| BioTek Lionheart FX Automated Microscope | Agilent | CYT5MFAW | |
| CELLvo Human Endothelial Progenitor Cells | StemBioSys | N/A | |
| Collagen I, rat tail | Enzo Life Sciences | ||
| Collagenase from Clostridium histolyticum (type 4) | Sigma-Aldrich | C5138 | |
| Corning Hank’s Balanced Salt Solution, 1X without calcium and magnesium | Corning | 21-021-CV | |
| Corning DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10013CV | |
| DAPI | Sigma-Aldrich | D9542 | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Fibrinogen from bovine plasma | Neta Scientific | SIAL-341573 | |
| Fibronectin human plasma | Sigma-Aldrich | F0895 | |
| Fluorescein isothiocyanate–dextran (70kDa) | Sigma-Aldrich | FD70S-1G | |
| Gelatin from porcine skin | Sigma-Aldrich | G1890 | |
| Hyaluronidase from sheep testes (type 4) | Sigma-Aldrich | H6254 | |
| Laminin Mouse Protein | Gibco | 23017015 | |
| Leica TCS SP8 | Leica | N/A | |
| MDA-MB-231 | ATCC | HTB-26 | |
| NHLF – Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Nikon Eclipse Ti | Nikon | N/A | |
| Paraformaldehyde 4% in 0.1M Phosphate BufferSaline, pH 7.4 | Electron Microscopy Sciences | 15735-90-1L | |
| PBMCs - Peripheral blood mononuclear cells | Lonza | CC-2702 | |
| PBS, pH 7.4 | Gibco | 10010049 | |
| Premium Grade Fetal Bovine Serum (FBS), Heat Inactivated | Avantor Seradigm | 97068-091 | |
| ProLong Gold Antifade Mountant | Invitrogen | P10144 | |
| Quick-RNA Microprep Kit | Zymo Research | R1051 | |
| Thrombin from bovine plasma | Sigma-Aldrich | T4648 | |
| Triton X-100 (Electrophoresis), | Fisher BioReagents | BP151-100 | |
| TrypLE Express Enzyme (1X), phenol red | Gibco | 12605028 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 | |
| Vasculife | Lifeline Cell Technology | LL-0003 |
Riferimenti
- Siegel, R. L., Miller, K. D., Wagle, N. S., Jemal, A. Cancer statistics, 2023. CA Cancer J Clin. 73 (1), 17-48 (2023).
- Hachey, S. J., Hughes, C. C. W. Applications of tumor chip technology. Lab Chip. 18 (19), 2893-2912 (2018).
- Ewald, M. L., Chen, Y. H., Lee, A. P., Hughes, C. C. W. The vascular niche in next generation microphysiological systems. Lab Chip. 21 (17), 3615-3616 (2021).
- Osaki, T., Sivathanu, V., Kamm, R. D. Vascularized microfluidic organ-chips for drug screening, disease models and tissue engineering. Curr Opin Biotechnol. 52, 116-123 (2018).
- Shirure, V. S., Hughes, C. C. W., George, S. C. Engineering vascularized organoid-on-a-chip models. Annu Rev Biomed Eng. 23, 141-167 (2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798 (2021).
- Sontheimer-Phelps, A., Hassell, B. A., Ingber, D. E. Modelling cancer in microfluidic human organs-on-chips. Nat Rev Cancer. 19 (2), 65-81 (2019).
- Sobrino, A., et al. 3D microtumors in vitro supported by perfused vascular networks. Sci Rep. 6, 31589 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Hachey, S. J., et al. An in vitro vascularized micro-tumor model of human colorectal cancer recapitulates in vivo responses to standard-of-care therapy. Lab Chip. 21 (7), 1333-1351 (2021).
- Hachey, S. J., et al. A Human Vascularized Micro-Tumor Model of Patient-Derived Colorectal Cancer Recapitulates Clinical Disease. Transl Res. 255, 97-108 (2023).
- Liu, Y., et al. Human in vitro vascularized micro-organ and micro-tumor models are reproducible organ-on-a-chip platforms for studies of anticancer drugs. Toxicology. 445, 152601 (2020).
- Jahid, S., et al. Structure-based Design of CDC42 Effector Interaction Inhibitors for the Treatment of Cancer. Cell Rep. 39 (4), 110760 (2022).
- Hsu, Y. H., Moya, M. L., Hughes, C. C. W., George, S. C., Lee, A. P. A microfluidic platform for generating large-scale nearly identical human microphysiological vascularized tissue arrays. Lab Chip. 13 (15), 2990-2998 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Christopher, C. W. H., George, S. C. In vitro perfused human capillary networks. Tissue Eng - Part C: Methods. 19 (9), 730-737 (2013).
- Wang, X., et al. An on-chip microfluidic pressure regulator that facilitates reproducible loading of cells and hydrogels into microphysiological system platforms. Lab Chip. 16 (5), 868-876 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Exp Biol Med. 242 (17), 1669-1678 (2017).
- Kurokawa, Y. K., et al. Human induced pluripotent stem cell-derived endothelial cells for three-dimensional microphysiological systems. Tissue Eng Part C: Methods. 23 (8), 474-484 (2017).
- Romero-López, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Carpenter, A. E., et al. CellProfiler: Image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS one. 6 (11), e27385 (2011).
- Corliss, B. A., et al. REAVER: A program for improved analysis of high-resolution vascular network images. Microcirculation. 27 (5), e12618 (2020).
- Urban, G., et al. Deep learning for drug discovery and cancer research: Automated analysis of vascularization images. IEEE/ACM Trans Comput Biol Bioinform. 16 (3), 1029-1035 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon