Method Article
إنشاء نموذج فسيولوجي للأورام الدقيقة الوعائية البشرية لأبحاث السرطان
In This Article
Summary
يقدم هذا البروتوكول نموذجا ذا صلة من الناحية الفسيولوجية للورم على الرقاقة لإجراء أبحاث السرطان البشري الأساسية والتحويلية عالية الإنتاجية ، وتطوير فحص الأدوية ، ونمذجة الأمراض ، ومناهج الطب الشخصي مع وصف لإجراءات التحميل والصيانة والتقييم.
Abstract
لا يزال الافتقار إلى نماذج السرطان التي تم التحقق من صحتها والتي تلخص البيئة المكروية للورم للسرطانات الصلبة في المختبر يمثل عنق زجاجة كبير لأبحاث السرطان قبل السريرية والتطوير العلاجي. للتغلب على هذه المشكلة ، قمنا بتطوير الورم المجهري الوعائي (VMT) ، أو رقاقة الورم ، وهو نظام فسيولوجي دقيق يقوم بشكل واقعي بنمذجة البيئة المكروية المعقدة للورم البشري. يتشكل VMT من جديد داخل منصة الموائع الدقيقة من خلال الزراعة المشتركة لأنواع متعددة من الخلايا البشرية في ظل ظروف التدفق الفسيولوجي الديناميكي. يشتمل هذا البناء الهندسي للورم الدقيق المصمم على الأنسجة على شبكة أوعية دموية حية تدعم كتلة الورم المتنامية تماما كما تفعل الأوعية المشكلة حديثا في الجسم الحي. الأهم من ذلك ، يجب أن تعبر الأدوية والخلايا المناعية الطبقة البطانية للوصول إلى الورم ، ونمذجة الحواجز الفسيولوجية في الجسم الحي أمام التسليم العلاجي والفعالية. نظرا لأن منصة VMT شفافة بصريا ، يمكن تحقيق تصوير عالي الدقة للعمليات الديناميكية مثل تسرب الخلايا المناعية وورم خبيث من خلال التصور المباشر للخلايا ذات العلامات الفلورية داخل الأنسجة. علاوة على ذلك ، يحتفظ VMT بعدم تجانس الورم في الجسم الحي ، وتوقيعات التعبير الجيني ، والاستجابات الدوائية. يمكن تكييف أي نوع من الأورام تقريبا مع المنصة ، وتنمو الخلايا الأولية من الأنسجة الجراحية الطازجة وتستجيب للعلاج الدوائي في VMT ، مما يمهد الطريق نحو الطب الشخصي حقا. هنا ، يتم تحديد طرق إنشاء VMT واستخدامه لأبحاث الأورام. يفتح هذا النهج المبتكر إمكانيات جديدة لدراسة الأورام والاستجابات الدوائية ، مما يوفر للباحثين أداة قوية لتطوير أبحاث السرطان.
Introduction
لا يزال السرطان مصدر قلق صحي كبير في جميع أنحاء العالم وهو السبب الرئيسي الثاني للوفاة في الولايات المتحدة. بالنسبة لعام 2023 وحده ، يتوقع المركز الوطني للإحصاءات الصحية حدوث أكثر من 1.9 مليون حالة سرطان جديدة وأكثر من 600000 حالة وفاة بالسرطان في الولايات المتحدة1 ، مما يسلط الضوء على الحاجة الملحة لنهج علاجية فعالة. ومع ذلك ، في الوقت الحالي ، فإن 5.1٪ فقط من العلاجات المضادة للسرطان التي تدخل التجارب السريرية تحصل في النهاية على موافقة إدارة الغذاء والدواء. يمكن أن يعزى فشل المرشحين الواعدين في التقدم بنجاح من خلال التجارب السريرية جزئيا إلى استخدام أنظمة النماذج غير الفسيولوجية ، مثل 2D والثقافات الكروية ، أثناء تطوير الأدوية قبل السريرية2. تفتقر نماذج السرطان الكلاسيكية هذه إلى المكونات الأساسية للبيئة المكروية للورم ، مثل مكانة اللحمة ، والخلايا المناعية المرتبطة بها ، والأوعية الدموية المثقوبة ، والتي تعد محددات رئيسية للمقاومة العلاجية وتطور المرض. وبالتالي ، فإن نظاما نموذجيا جديدا يحاكي بشكل أفضل البيئة المكروية للورم البشري في الجسم الحي ضروري لتحسين الترجمة السريرية للنتائج قبل السريرية.
يتقدم مجال هندسة الأنسجة بسرعة ، مما يوفر طرقا محسنة لدراسة الأمراض البشرية في البيئات المختبرية. أحد التطورات المهمة هو ظهور الأنظمة الفسيولوجية الدقيقة (MPS) ، والمعروفة أيضا باسم رقائق الأعضاء أو رقائق الأنسجة ، وهي أعضاء بشرية وظيفية مصغرة قادرة على تكرار الحالات الصحية أو المريضة3،4،5. في هذا السياق ، تم تطوير رقائق الورم ، وهي نماذج أورام بشرية ثلاثية الأبعاد تعتمد على الموائع الدقيقة في المختبر ، لأبحاث الأورام2،3،4،5،6،7،8،9،10،11،12،13. تتضمن هذه النماذج المتقدمة إشارات كيميائية حيوية وفيزيائية حيوية داخل بيئة دقيقة ديناميكية للورم ، مما يمكن الباحثين من دراسة سلوك الورم والاستجابات للعلاجات في سياق أكثر صلة من الناحية الفسيولوجية. ومع ذلك ، على الرغم من هذه التطورات ، نجحت مجموعات قليلة في دمج الأوعية الدموية الحية والوظيفية ، لا سيما تلك التي تتبع الأنماط الذاتية استجابة للتدفق الفسيولوجي3،4،5،6. يعد تضمين شبكة الأوعية الدموية الوظيفية أمرا بالغ الأهمية لأنه يسمح بنمذجة الحواجز المادية التي تؤثر على توصيل الدواء أو الخلايا ، وتوجيه الخلايا إلى بيئات دقيقة متميزة ، والهجرة عبر البطانية للورم والخلايا اللحمية والخلايا المناعية. من خلال تضمين هذه الميزة ، يمكن لشريحة الورم أن تمثل بشكل أفضل التعقيدات التي لوحظت في البيئة المكروية للورم في الجسم الحي .
لتلبية هذه الحاجة غير الملباة ، قمنا بتطوير منصة جديدة لفحص الأدوية تمكن شبكات الأوعية الدقيقة من التشكل داخل جهاز الموائع الدقيقة8،9،10،11،12،13،14،15،16. يمكن تكييف منصة رقاقة الأعضاء الأساسية هذه ، والتي يطلق عليها اسم العضو الدقيق الوعائي (VMO) ، مع أي نظام عضوي تقريبا لتكرار فسيولوجيا الأنسجة الأصلية لنمذجة الأمراض وفحص الأدوية وتطبيقات الطب الشخصي. يتم إنشاء VMOs عن طريق الزراعة المشتركة للخلايا البطانية المشتقة من الخلايا المكونة للمستعمرة البطانية (ECFC-EC) ، HUVEC أو iPSC-EC (المشار إليها فيما يلي باسم EC) ، والخلايا اللحمية المتعددة في الغرفة ، بما في ذلك الخلايا الليفية الرئوية البشرية الطبيعية (NHLF) ، التي تعيد تشكيل المصفوفة ، والخلايا المحيطة التي تلف الأوعية وتستقرها. يمكن أيضا إنشاء VMO كنظام نموذجي للسرطان عن طريق زراعة الخلايا السرطانية مع السدى المرتبط بها لإنشاء ورم دقيق وعائي (VMT) 8،9،10،11،12،13 ، أو نموذج رقاقة الورم. من خلال الثقافة المشتركة لأنواع متعددة من الخلايا في بيئة تدفق ديناميكية ، تتشكل شبكات الأوعية الدموية الدقيقة المثقوبة من جديد في غرف الأنسجة بالجهاز ، حيث يتم تنظيم تكوين الأوعية الدموية عن كثب من خلال معدلات التدفق الخلالي14,15. يتم دفع الوسط عبر قنوات الموائع الدقيقة للجهاز بواسطة رأس ضغط هيدروستاتيكي يزود الخلايا المحيطة بغرفة الأنسجة بالمغذيات حصريا من خلال الأوعية الدقيقة ، مع معامل نفاذية يبلغ 1.2 × 10-7 سم / ثانية ، على غرار ما يظهر للشعيرات الدموية في الجسم الحي8.
يمثل دمج الأوعية الدقيقة ذاتية التنظيم في نموذج VMT إنجازا كبيرا لأنه: 1) يحاكي بنية ووظيفة كتل الورم الوعائية في الجسم الحي. 2) يمكن نمذجة الخطوات الرئيسية للورم الخبيث ، بما في ذلك تفاعلات الخلايا البطانية والورم ؛ 3) يضع حواجز انتقائية من الناحية الفسيولوجية لتوصيل المغذيات والأدوية ، وتحسين الفحص الصيدلاني ؛ و 4) يسمح بالتقييم المباشر للأدوية ذات القدرات المضادة لتولد الأوعية ومكافحة النقيلي. من خلال تكرار التسليم في الجسم الحي للمغذيات والأدوية والخلايا المناعية في بيئة دقيقة 3D معقدة ، فإن منصة VMO / VMT هي نموذج ذي صلة من الناحية الفسيولوجية يمكن استخدامه لإجراء فحص الأدوية ودراسة السرطان أو الأوعية الدموية أو البيولوجيا الخاصة بالأعضاء. الأهم من ذلك ، أن VMT يدعم نمو أنواع مختلفة من الأورام ، بما في ذلك سرطان القولون ، وسرطان الجلد ، وسرطان الثدي ، والورم الأرومي الدبقي ، وسرطان الرئة ، وسرطان البريتوني ، وسرطان المبيض ، وسرطان البنكرياس8،9،10،11،12،13. بالإضافة إلى كونها منخفضة التكلفة ، وسهلة التأسيس ، ومصفوفة للتجارب عالية الإنتاجية ، فإن منصة الموائع الدقيقة متوافقة بصريا تماما لتحليل الصور في الوقت الفعلي للتفاعلات بين الورم وانسجة والاستجابة للمنبهات أو العلاجات. يتم تمييز كل نوع من الخلايا في النظام بعلامة فلورسنت مختلفة للسماح بالتصور المباشر وتتبع سلوك الخلية طوال التجربة بأكملها ، مما يخلق نافذة على البيئة المكروية الديناميكية للورم. لقد أظهرنا سابقا أن VMT أكثر دقة في نمو الورم الحي ، والهندسة المعمارية ، وعدم التجانس ، وتوقيعات التعبير الجيني ، واستجابات الأدوية من طرائق الثقافة القياسية10. الأهم من ذلك ، أن VMT يدعم نمو ودراسة الخلايا المشتقة من المريض ، بما في ذلك الخلايا السرطانية ، والتي تقدم نماذج أفضل لأمراض الأورام الأم من الثقافات الكروية القياسية وتزيد من تقدم جهود الطب الشخصي11. توضح هذه المخطوطة طرق إنشاء VMT ، وتعرض فائدتها في دراسة السرطانات البشرية.
Protocol
1. التصميم والتصنيع
- تصميم الجهاز
- لتصنيع أجهزة الموائع الدقيقة ، قم بإنشاء قالب SU-8 باستخدام طبقة 200 ميكرومتر من SU-8 المغلفة بالدوران على رقاقة Si (RCA-1 تنظيفها و 2٪ فلوريد الهيدروجين (HF)) ، متبوعة بخطوة طباعة حجرية ضوئية لقناع واحد كما هو موضح سابقا 8,9.
- قم بصب نسخة طبق الأصل من البولي ثنائي ميثيل سيلوكسان (PDMS) بسمك 4 مم من قالب SU-8 لإنشاء قالب بولي يوريثين متين لخطوات التصنيع النهائية. يمكن استخدام تكرارات التصميم المختلفة8،9،10،11،12،13،14،15.
- في التكرار الحالي ، صمم جهاز الموائع الدقيقة ليتم تركيبه خصيصا في شكل لوحة قياسي مكون من 96 بئرا ويتكون من طبقة ميزة PDMS بسمك 2 مم مع 12 وحدة جهاز ميكروفلويديك محاطة بطبقة غشاء بوليمر شفافة رقيقة (1/16 بوصة) في الأسفل (الشكل 1 أ).
- تأكد من أن وحدات الأنسجة الفردية تتكون من حجرة نسيج محاطة بمدخل تحميل هلام (L1) ومخرج (L2) ، ومنظم ضغط (PR) 16 ، وقنوات موائع دقيقة منفصلة متصلة بمدخلين ومنافذ وسائط على كل جانب (M1-M2 ، M3-M4 ؛ M3-M4). الشكل 1 ب).
- ضع كل مدخل ومخرج داخل بئر واحد يعمل كخزان متوسط لإنشاء ضغط هيدروستاتيكي (10 مم H2O) عبر قناة الموائع الدقيقة. للسماح بمفاغرة شبكة الأوعية الدموية مع القنوات الخارجية ، قم بتوصيل قنوات الموائع الدقيقة بغرفة الأنسجة عبر مسام اتصال بعرض 50 ميكرومتر (6 في الأعلى ، 6 في الأسفل).
ملاحظة: تخلق مقاومات الموائع الدقيقة تدرج ضغط خلالي 5 مم H2O عبر غرفة الأنسجة التي تصبح داخل اللمعة بمجرد تكوين شبكة الأوعية الدموية بالكامل 8,10. تبدأ الإجراءات اللاحقة بلوحة إنتاجية عالية مجمعة بالكامل.

الشكل 1. تصميم منصة الموائع الدقيقة. (أ) يظهر الرسم التخطيطي لمجموعة المنصة طبقة ميزة PDMS مع 12 وحدة جهاز مرتبطة بلوحة 96 بئرا بلا قاع ومختومة بغشاء بوليمر شفاف رقيق. تحتل كل وحدة جهاز عمودا من الآبار على اللوحة. تظهر وحدة الجهاز الواحد الموضحة باللون الأحمر مع التفاصيل في (B). (ب) يظهر الرسم التخطيطي لوحدة جهاز واحدة حجرة نسيج واحدة موضوعة داخل بئر واحد من لوحة 96 بئرا ومنفذي تحميل مع فتحة مدخل ومخرج (L1-L2) مثقوبة للسماح بإدخال مزيج مصفوفة الخلية. المداخل والمنافذ المتوسطة (M1-M2 ، M3-M4) مثقوبة وموضوعة داخل الآبار التي تعمل كخزانات وسائط. تنشئ أحجام مختلفة من الوسائط تدرجا للضغط الهيدروستاتيكي عبر غرفة الأنسجة عبر قنوات الموائع الدقيقة المنفصلة. تعمل وحدة منظم الضغط (PR) كصمام انفجار هلام لزيادة سهولة التحميل. لاحظ أن الجهاز يبلغ عمقه 200 ميكرومتر ، وغرفة الأنسجة 2 مم × 6 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
2. الاستعدادات قبل التحميل
- زراعة الخلايا
- الحفاظ على الخلايا وفقا لتوصيات الشركة المصنعة في حاضنة CO2 مرطبة 37 درجة مئوية و 5٪.
- قوارير الصفيحة T75 من EC أو NHLF أو غيرها من الخلايا الليفية / اللحمية والخلايا السرطانية المرغوبة قبل 3-4 أيام من التحميل بكثافة مستنيرة من قبل الشركة المصنعة وبروتوكولات المستخدم. بالنسبة لهذا البروتوكول ، لوحة 1 × 106 خلايا لكل قارورة لكل نوع خلية. ثقافة EC في وسائط النمو البطاني 2 (EGM2) وسائط كاملة ، NHLF في وسط النسر المعدل في Dulbecco (DMEM) مع 10٪ FBS ، والخلايا السرطانية في الوسائط المناسبة اعتمادا على نوع الخلية.
- حافظ على الخلايا عن طريق التغذية بالوسائط المعنية كل 2-3 أيام وإعادة تأكيد كفاءة النقل أو وضع العلامات عن طريق تصور الخلايا تحت مجهر الفلورسنت. في يوم التحميل ، تأكد من أن EC متقاربة بنسبة 80٪ -100٪ ، في حين أن NHLF متقاربة عند 70٪ -80٪.
- إعداد الفيبرينوجين
- تحضير محلول الفيبرينوجين للتركيز المطلوب (عادة ، 5-8 مجم / مل يدعم تكوين شبكة الأوعية الدموية القوية) ، وهو ما يمثل النسبة المئوية لتخثر الفيبرينوجين. احسب كمية الفيبرينوجين المطلوبة بالمعادلة التالية:
الفيبرينوجين (ملغ) = (الحجم (مل)) × (التركيز (ملغم / مل)) / (تخثر٪) - قم بإذابة الفيبرينوجين في حجم مناسب من الوسائط القاعدية البطانية 2 (EBM2) ، مع تسخينه إلى 37 درجة مئوية ، عن طريق تحريك الأنبوب برفق (لا دوامة). احتضان الفيبرينوجين في حمام مائي 37 درجة مئوية للسماح له بالدخول تماما في المحلول. الأهم من ذلك ، لا تستخدم وسيلة كاملة.
- محلول الفيبرينوجين المعقم مع مرشح 0.22 ميكرومتر و Aliquot إلى الحجم المطلوب ، عادة 400 ميكرولتر لكل أنبوب طرد مركزي دقيق.
ملاحظة: يمكن زيادة بروتينات المصفوفة الأخرى (مثل الكولاجين أو الفبرونيكتين أو اللامينين) في مزيج الفيبرينوجين.
- تحضير محلول الفيبرينوجين للتركيز المطلوب (عادة ، 5-8 مجم / مل يدعم تكوين شبكة الأوعية الدموية القوية) ، وهو ما يمثل النسبة المئوية لتخثر الفيبرينوجين. احسب كمية الفيبرينوجين المطلوبة بالمعادلة التالية:
3. تحميل العينات
ملاحظة: التحميل حساس للوقت ويجب إكماله من البداية (رفع الخلايا) إلى النهاية (إضافة الوسائط إلى الأجهزة) في غضون حوالي 1.5-1.75 ساعة لضمان أفضل النتائج. تتم الإشارة إلى كل خطوة بمؤقت مقترح للمساعدة في إبقاء المستخدم على المسار الصحيح.
- تحضير المواد (يوم التحميل)
- ضع ما يلي في حمام مائي على حرارة 37 درجة مئوية لمدة 10-15 دقيقة: محلول الملح المتوازن من هانك (HBSS) أو محلول ملحي مخزن بالفوسفات (PBS) لغسل الخلايا ، وكاشف تفكك الخلايا ، والوسائط (على سبيل المثال ، EGM2 ، DMEM)
- احتفظ بالكواشف التالية في ثلاجة 4 درجات مئوية حتى تصبح جاهزة للاستخدام: الثرومبين ، اللامينين (يذوب طوال الليل عند 4 درجات مئوية).
- ذوبان قسامة الفيبرينوجين في درجة حرارة الغرفة. قم بإعداد حصص 1.5 ميكرولتر من الثرومبين في أنابيب طرد مركزي دقيقة 500 ميكرولتر ، مع أنبوب واحد لكل وحدة جهاز. تأكد من أن حصص الثرومبين في أسفل كل أنبوب لتسهيل التحميل.
- ضع الألواح عالية الإنتاجية المعقمة بالأشعة فوق البنفسجية في مجفف لمدة 30 دقيقة على الأقل قبل التحميل لإزالة الهواء المحبوس في الموائع الدقيقة.
- تحضير الخلية (بدء المؤقت = يبدأ في 0 دقيقة)
- افحص الخلايا الموجودة تحت المجهر عند تكبير 4x لتأكيد كفاءة الالتقاء والنقل.
- اغسل كل قارورة T75 من الخلايا 2x مع 5 مل من HBSS ونضح تماما. أضف 1 مل من كاشف التفكك إلى كل قارورة واحتضانها عند 37 درجة مئوية ، 5٪ CO2 لمدة 1-2 دقيقة.
- اضغط برفق على اللوحة باستخدام راحة يدك وتحقق من رفع جميع الخلايا.
- اغسل الخلايا من الدورق ب 9 مل من الوسائط المناسبة واجمعها في مخروطي 15 مل. قم بإزالة حصصة صغيرة على الفور لعد الخلايا.
- أجهزة الطرد المركزي الخلايا عند 300 × جم لمدة 3-5 دقائق عند 4 درجات مئوية. أثناء خلايا الطرد المركزي ، عد الخلايا. يجب أن ينتج عن قارورة T75 المتقاربة من EC أو NHLF ما لا يقل عن 2 × 106 خلايا.
- بعد الطرد المركزي ، قم بشفط الوسائط وإعادة تعليق الحبيبات في الوسائط المناسبة بتركيز 1 × 106 خلايا / مل. الحفاظ على الخلايا على الجليد.
- تحضير خليط الخلية والفيبرينوجين (المؤقت = يبدأ في 20 دقيقة)
- حدد عدد الأجهزة التي سيتم تحميلها ، مع إضافة 1-2 لحساب فقدان السحب ، واضربه في حجم مزيج الخلية / الفيبرينوجين المطلوب لكل جهاز. سيعتمد هذا على تكوين الجهاز ، ولكن بالنسبة لتصميم الجهاز المقدم في هذه المقالة ، يلزم 6 ميكرولتر لكل جهاز.
- يجب تحديد تركيز كل نوع من الخلايا تجريبيا. بالنسبة لنقطة البداية ، قم بتحميل EC بتركيز حوالي 7 × 106 خلايا / مل و NHLF بتركيز 3.5 × 106 خلايا / مل. يمكن أن يختلف تركيز الخلايا السرطانية اختلافا كبيرا بناء على معدل نموها ولكنه يقع عادة في نطاق 0.5-2 × 106 خلايا / مل. استخدم هذه المعادلة لحساب عدد الخلايا المطلوبة:
عدد الخلايا المطلوبة = (حجم الفيبرين (ميكرولتر)) / 1000 ميكرولتر × (تركيز الخلايا) - أعد تعليق الخلايا بتركيز 1 × 106 خلايا / مل واستخدم المعادلة التالية لتحديد حجم الخلايا المطلوبة:
حجم الخلايا المطلوبة (ميكرولتر) = (عدد الخلايا المطلوبة) / 1000 - امزج الأحجام الخاصة من EC و NHLF والخلايا السرطانية (ل VMT فقط) في أنبوب مخروطي وجهاز طرد مركزي عند 300 × جم لمدة 3-5 دقائق عند 4 درجات مئوية.
- بعد الدوران ، قم بشفط الوسائط بعناية وقم بإزالة أي وسائط متبقية بالقرب من الحبيبات. أعد تعليق الحبيبات برفق ولكن بدقة في الحجم المحسوب للفيبرينوجين ، مع الحرص الشديد على عدم إدخال فقاعات الهواء. ابق على الجليد.
- أحضر الألواح المعقمة وقسامات الثرومبين إلى غطاء زراعة الأنسجة.
- تحميل الأجهزة (المؤقت = يبدأ في 30-35 دقيقة)
- باستخدام ماصة P20 ، ماصة 6 ميكرولتر من الحجم من مزيج الخلية / الفيبرين. تأكد من سحب الخليط لأعلى ولأسفل 5x على الأقل لضمان تعليق خلية موحد. احتفظ بالمزيج على الثلج لإبطاء التخثر.
- امزج الخلية / الفيبرين برفق في أنبوب واحد من الثرومبين عن طريق وضع طرف الماصة مباشرة في قسامة الثرومبين في أسفل الأنبوب. ماصة على الفور صعودا وهبوطا على الأقل 2x ، مع الحرص على عدم إدخال فقاعات الهواء. سيبدأ الفيبرين في التجلط بمجرد خلطه بالثرومبين ، لذا أكمل الخطوات 3.4.3 بسرعة ولكن عن عمد. و3.4.4. قبل المواد الهلامية الفيبرين في طرف ماصة (~ 3 ثوان).
- ارفع لوحة الإنتاجية العالية بزاوية وأدخل طرف الماصة بسرعة في أحد منافذ تحميل الجهاز (L1 أو L2). انظر الشكل 2 أ للتخطيط.
- ادفع مكبس الماصة لأسفل إلى المحطة الأولى بحركة سلسة وسائلة لحقن مزيج الخلية / الفيبرين في حجرة الأنسجة. راقب عبور الجل بالكامل عبر الغرفة.
ملاحظة: يمكن أن يؤدي الضغط الزائد خلال هذه الخطوة إلى انفجار الجل في قنوات الموائع الدقيقة في الجزء العلوي و / أو السفلي من غرف الأنسجة. - ضع اللوحة برفق بشكل مسطح في غطاء زراعة الأنسجة دون إزالة طرف الماصة أو تحرير مكبس الماصة أو إزعاج الماصة. استخدم يدك للف وإزالة طرف الماصة من P20 واتركه في فتحة منفذ التحميل. لا تستخدم زر القاذف لإزالة الطرف لأن ذلك سيسبب الكثير من الضغط.
- تابع الخطوات 3.4.1-3.4.5 للأجهزة المتبقية.
- عند اكتمال التحميل ، اترك اللوحة تجلس لمدة 2 دقيقة دون عائق في غطاء زراعة الأنسجة.
- قم بإزالة أطراف الماصة عن طريق لفها برفق وسحبها من منافذ التحميل. استبدل الغطاء الموجود على اللوحة.
- احتضن اللوحة بأكملها لمدة 15-20 دقيقة في حاضنة 37 درجة مئوية للسماح للهلام بالبلمرة بالكامل.
- بعد الحضانة ، تحقق من كل وحدة جهاز تحت المجهر. تحقق لمعرفة أن الخلايا موزعة بالتساوي في جميع أنحاء الغرفة دون أي فقاعات هواء وأن هناك واجهة هلامية واضحة للعيان بين حجرة الأنسجة وقنوات الموائع الدقيقة ، كما في الشكل 2B-C.
- طلاء القناة مع laminin (الموقت = تبدأ في 45-50 دقيقة)
- بعد أن تصبح المواد الهلامية صلبة تماما ، أدخل اللامينين في قنوات الموائع الدقيقة لتعزيز مفاغرة الأوعية الدموية.
- باستخدام P20 ، أدخل 4 ميكرولتر من اللامينين في كل قناة ميكروفلويديك (أعلى وأسفل) من الجهاز. أدخل طرف الماصة في M1 أو M3 واطرد اللامينين ببطء ، وراقب للتأكد من أن الصفيحة تغطي القناة العلوية بأكملها ، ثم كرر ذلك مع M2 أو M4 لتغطية القناة السفلية بأكملها.
- حدد الاتجاه عن طريق سحب الصفيحة من الجانب المقابل لمنظم الضغط للسماح بضغط كاف لدفعه من خلاله. ومع ذلك ، إذا لم ينتقل اللامينين بسهولة من جانب واحد ، فقم بإزالة الطرف من جانب واحد وادفع اللامينين من الجانب الآخر. قد تكون هناك حاجة للذهاب إلى المحطة الثانية من الماصة (أي دفع المكبس لأسفل) لتوليد ضغط كاف لدفع الصفيحة عبر القناة بأكملها.
- قم بإزالة الطرف برفق من مدخل / مخرج الوسائط. لا تستخدم زر القاذف في P20.
- كرر الخطوات 3.5.1-3.5.4 لكل جهاز واحتضان اللوحة عند 37 درجة مئوية ، 5٪ CO2 لمدة 10 دقائق.
- إضافة الوسائط (المؤقت = يبدأ في حوالي 1 ساعة و 10 دقائق)
- أضف 275 ميكرولتر من الوسائط الكاملة EGM2 إلى خزانات الوسائط غير المقترنة للآبار في الصفوف A و B أو G و H. سيكون هذا هو الجانب المرتفع ، ويجب تحديد الاتجاه عن طريق جعل الآبار على الجانب المقابل لمنظم الضغط عالية الحجم للبدء. سيتم دفع الوسائط من الجانب العالي عن طريق الجاذبية.
- باستخدام ماصة P200 ، أدخل 75 ميكرولتر من الوسائط في مداخل / منافذ الآبار المتوسطة التي تحتوي على 275 ميكرولتر من EGM2. أدخل الطرف في فتحة مدخل الوسائط واطرد الوسيط ببطء ، وشاهد أن الوسائط تنتقل عبر القناة والفقاعات على الجانب الآخر.
- قم بإزالة طرف الماصة وادفع الوسائط المتبقية من الطرف إلى خزان الوسائط بحيث يكون الحجم الإجمالي على الجانب المرتفع 350 ميكرولتر.
- كرر الخطوات من 3.6.1 إلى 3.6.3 لكل وحدة جهاز والقنوات العلوية والسفلية.
- أضف 50 ميكرولتر من الوسائط لتغطية الجانب المنخفض بالكامل ، والآبار في الصفوف A و B أو G و H ، اعتمادا على الاتجاه الموضح أعلاه. تأكد من وجود طبقة متساوية من الوسائط تغطي قاع البئر. راجع الشكل 2D للحصول على رسم تخطيطي يوضح أحجام الوسائط في الخزانات.
- إزالة فقاعات الهواء (بعد التحميل)
ملاحظة: تعد إزالة الفقاعات خطوة حاسمة لضمان التدفق المناسب في كل جهاز. بحلول اليوم الثاني ، ستبدأ الخلايا البطانية والخلايا الليفية في التمدد استجابة للتدفق (الشكل 2E).- بمجرد إضافة جميع الوسائط ، احتضان الألواح لمدة 1-2 ساعةفي حاضنة CO 2 37 درجة مئوية ، 5٪ قبل التحقق من وجود فقاعات هواء في القنوات أو عند المداخل / المنافذ المتوسطة.
- تصور الفقاعات في قنوات الوسائط على المجهر واطردها عن طريق إعادة إدخال 75 ميكرولتر من الوسائط في القنوات لدفع الفقاعات للخارج.
- تصور الفقاعات في المداخل / المنافذ المتوسطة بالعين. استخدم ماصة P200 لإزالة فقاعات الهواء المحبوسة عند المداخل والمنافذ المتوسطة عن طريق دفع المكبس لأسفل ، وإدخال الطرف في الفتحة ، وسحب الفقاعة للخارج عن طريق رفع المكبس لتطبيق الضغط السلبي وامتصاص الفقاعة.

الشكل 2. رسم تخطيطي لتحميل الجهاز. (أ) باستخدام ماصة P20 ، يتم إدخال مزيج الخلية / الفيبرين في غرفة الأنسجة لكل وحدة جهاز عبر أحد منافذ التحميل. (ب) تظهر الصورة المجهرية لبرايتفيلد جهاز الموائع الدقيقة الذي يحمل EC والخلايا الليفية والخلايا السرطانية لتكوين VMT. شريط المقياس = 500 ميكرومتر. (C) صورة مجهرية مضان للجهاز في B تظهر EC باللون الأحمر ، والورم باللون السماوي ، والخلايا الليفية باللون الأزرق. (د) يوضح الرسم التخطيطي إضافة وسط إلى الخزانات ، مع 350 ميكرولتر على الجانب المرتفع و 50 ميكرولتر على الجانب المنخفض لتوليد رأس الضغط الهيدروستاتيكي. (ه) يظهر اليوم 2 من ثقافة VMT أن الخلايا الليفية و EC بدأت في التمدد لتشكيل شبكة الأوعية الدموية. شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. صيانة الجهاز والتطبيقات التجريبية
- الصيانة والعلاج من تعاطي المخدرات
ملاحظة: للحفاظ على التدفق في النظام ، يجب إعادة إنشاء الضغط الهيدروستاتيكي يوميا عن طريق سحب حجم الوسائط من الجانب المنخفض إلى الجانب المرتفع أو العكس ، مما يضمن بقاء الحجم الإجمالي في الجانب المرتفع عند 350 ميكرولتر. يتم تبديل اتجاه التدفق كل يوم بعد اليوم 2 من إنشاء VMO أو VMT. يتم توفير تفاصيل الصيانة والعلاج الإضافية أدناه.- قم بتغيير الوسائط كل يومين مع اكتمال EGM2 حتى يتم تثبيت الأوعية الدموية بالكامل (اليوم 5-6). نضح الوسائط القديمة تماما واستبدل آبار الضغط العالي (350 ميكرولتر) وآبار الضغط المنخفض (50 ميكرولتر).
ملاحظة: يمكن إجراء التحديد التجريبي لتركيبات الوسائط المحسنة لأنواع الخلايا الأخرى ، وغالبا ما تتضمن مزيجا بنسبة 50:50 أو إضافة مكونات محددة إلى EGM2. - بمجرد تشكيل شبكة الأوعية الدموية وتطوير الأنسجة بالكامل (اليوم 4-7) ، قم بإجراء اختبار نضح ديكستران قبل استخدام الأجهزة للتجارب (الخطوة 4.2.1). استخدم فقط الأجهزة التي تحتوي على نضح كاف في غرفة الأنسجة.
- بالنسبة للتجارب التي تستخدم العلاجات ، في اليوم الذي يبدأ فيه العلاج ، التقط صورا في جميع قنوات الفلورسنت لكل جهاز. سيكون هذا بمثابة خط أساس.
- عالج الأجهزة بالعلاج المطلوب عن طريق استبدال الوسط بوسط جديد يحتوي على الدواء المخفف بالتركيز المطلوب. تأكد من تخفيف الأدوية في المركبات المناسبة اعتمادا على توصية الشركة المصنعة ، ولكن لا تتجاوز 0.01٪ DMSO في وسائل الإعلام.
- تعريض الأجهزة للدواء لفترة زمنية مرغوبة (عادة 48 ساعة ولكن يمكن إبلاغها عن طريق الحرائك الدوائية).
- قم بتصوير كل قناة من كل جهاز في الفاصل الزمني المطلوب لمراقبة استجابة العلاج. حافظ على اللوحات كما هو موضح في الخطوة 4.1.1 طوال مدة التجربة.
- عند الانتهاء من التجربة ، قم بألواح التبييض وضعها في حاوية بيولوجية ، ثبت بنسبة 4٪ PFA للتلطيخ المناعي (الخطوة 4.3) ، أو الحصاد لعزل الخلايا الحية أو الحمض النووي الريبي (الخطوة 4.4.).
- قم بتغيير الوسائط كل يومين مع اكتمال EGM2 حتى يتم تثبيت الأوعية الدموية بالكامل (اليوم 5-6). نضح الوسائط القديمة تماما واستبدل آبار الضغط العالي (350 ميكرولتر) وآبار الضغط المنخفض (50 ميكرولتر).
- مقايسات التروية
- نضح ديكستران
ملاحظة: يمكن تحديد نفاذية / سالكية الأوعية الدموية عن طريق تعطير شبكة الأوعية الدموية مع ديكستران المسمى بالفلورسنت بأوزان جزيئية مختلفة (40 كيلو دالتون أو 70 كيلو دالتون أو 150 كيلو دالتون). يمكن استخدام FITC- أو رودامين-ديكستران اعتمادا على ملصق الفلورسنت الخاص ب EC.- قبل التروية ، حدد التعرض المناسب لقناة FITC أو الرودامين عن طريق إضافة بضعة ميكرولتر من ديكستران داخل القناة السائلة أو غرفة جهاز فارغ. اضبط وقت التعرض أقل بقليل من مستوى التشبع من خلال استخدام برنامج المجهر لعرض رسم بياني لشدة البكسل ، مما يضمن نطاقا ديناميكيا يتميز بوحدات بكسل موزعة بشكل موحد دون أي تركيز ملحوظ للقيم عالية الكثافة.
- التقط صورا مجهرية لجميع الأجهزة في القنوات ذات الاهتمام ، بما في ذلك صورة خلفية لجميع الأجهزة في قناة ديكستران الفلورية ، للمعايرة على الخلفية. استخدم نفس التعريض الضوئي كما هو محدد أعلاه وقم بمحاذاة حجرة الأنسجة في مركز إطار الصورة لضمان صور متسقة للقياس الكمي.
- تحضير مخزون رئيسي من FITC-dextran أو رودامين-ديكستران بتركيز 5 ملغ / مل في 1x DPBS. يمكن الاحتفاظ بهذا المخزون عند 4 درجات مئوية.
- لتحضير مخزون عامل، قم بتخفيف مخزون 5 ملغم/مل إلى تركيز نهائي قدره 50 ميكروغرام/مل في EGM2.
- استبدل الوسائط الموجودة في الخزانات بمحلول ديكستران المخفف كنصف الحجم الأقصى (175 ميكرولتر في بئر واحد بالإضافة إلى الجانب العالي على القناة العلوية أو السفلية لغرفة الأنسجة). استبدل الوسائط في الآبار الأخرى بحيث يحصل الجانب المرتفع غير المنفصل على 175 ميكرولتر من EGM2 الطازج بدون ديكستران ، وتحتوي الآبار الموجودة على الجانب المنخفض على 50 ميكرولتر فقط في كل منها.
ملاحظة: يجب إضافة ديكستران فقط إلى جانب واحد من قنوات الموائع الدقيقة (أعلى أو أسفل) للسماح بتصور الصبغة التي تنتقل عبر جانب الضغط العالي ، إلى السرير الوعائي ، وخارج جانب الضغط المنخفض. - تحت المجهر ، راقب تدفق ديكستران الفلورسنت عبر شبكة الأوعية الدموية. سيحدث هذا عادة في غضون 2 دقيقة تقريبا بعد إضافة الصبغة إلى خزان الوسائط.
- ابدأ تصوير قناة ديكستران الفلورية (والقنوات الأخرى ، إذا رغبت في ذلك). هذه هي النقطة الزمنية T = 0. التقط صورا إضافية في نقاط زمنية متعددة (عادة كل 10 دقائق) أو صورة نقطة نهاية واحدة.
- تروية الخلايا
ملاحظة: يمكن اختراق أنواع مختلفة من الخلايا من خلال الأوعية الدموية اعتمادا على تصميم الدراسة ، بما في ذلك الخلايا الليمفاوية أو الضامة لدراسات المناعة السرطانية ، وكذلك الخلايا السرطانية لدراسات ورم خبيث. يجب تسمية الخلايا بالفلورسنت لتسهيل التتبع بمرور الوقت.- على الأقل 2 ساعة قبل تعطير الخلايا ، قم بإجراء نضح ديكستران على جميع الأجهزة كما هو موضح أعلاه. هذه الخطوة مهمة لتحديد سالكية الأوعية الدموية قبل إضافة الخلايا.
- حدد التعرض المناسب للكاميرا للخلايا المراد فتحها. خذ عينة صغيرة من الخلايا لعرضها تحت المجهر واضبط وقت التعرض لعلامة الفلورسنت هذه. اضبط وقت التعرض أقل بقليل من مستوى التشبع.
- التقط صورا مجهرية لجميع الأجهزة في القنوات ذات الاهتمام ، بما في ذلك صورة خلفية لجميع الأجهزة في قناة ديكستران الفلورية ، للمعايرة على الخلفية. استخدم نفس التعرض كما هو محدد في الخطوة 4.2.2.1.
- تأكد من أن ديكستران قد انتشر تماما خارج غرف الأنسجة قبل حصاد الخلايا للتروية. حصاد وحساب الخلايا ذات الاهتمام.
- إعادة تعليق الخلايا بكثافة مناسبة في EGM2. على سبيل المثال ، تضاف الخلايا التائية عادة عند حوالي 1 × 106 خلايا / مل لمحاكاة التركيز في الدم.
ملاحظة: EC حساسة لتكوين الوسائط ولكن يمكنها تحمل ما يصل إلى 50٪ من الخلط مع معظم الوسائط الأخرى. اختبار مسبقا. - أضف 175 ميكرولتر من تعليق الخلية إلى بئر واحد على الجانب العلوي من كل جهاز وأضف 175 ميكرولتر من EGM2 كاملة إلى البئر الآخر. على الجانب المنخفض ، أضف 50 ميكرولتر من الوسائط الكاملة EGM2 إلى كلا البئرين.
- تحت المجهر ، راقب تدفق الخلايا الفلورية عبر شبكة الأوعية الدموية. سيحدث هذا عادة في غضون 2 دقيقة تقريبا بعد إضافة الخلايا إلى مستودع الوسائط.
- بمجرد إنشاء تدفق الخلية ، ابدأ في تصوير قناة الخلية الفلورية (والقنوات الأخرى ، إذا رغبت في ذلك). هذه هي النقطة الزمنية T = 0. التقط صورا إضافية في نقاط زمنية متعددة أو صورة نقطة نهاية واحدة ، اعتمادا على تصميم الدراسة. على سبيل المثال ، سيؤدي التصوير كل 10 دقائق إلى دورات زمنية عالية الدقة أو كل 6-12 ساعة لتتبع حركات الخلايا الدورية.
- نضح ديكستران
- تلطيخ المناعي (IF)
- نضح الوسائط من الآبار. أضف 200 ميكرولتر من 4٪ PFA إلى كل من آبار الجانب المرتفع لكل وحدة جهاز و 50 ميكرولتر إلى الجانب المنخفض. اترك PFA يتدفق عبر الغرف لمدة 15 دقيقة في درجة حرارة الغرفة أو 30 دقيقة عند 4 درجات مئوية.
- أثناء الحضانة ، قم بإعداد صفيحة 24 بئرا مع 500 ميكرولتر من 1x PBS لكل بئر. احسب عدد الآبار اللازمة لتلطيخ كل جهاز.
- إزالة PFA تماما من الآبار. اقلب اللوحة رأسا على عقب وقم بإزالة الدعامة البلاستيكية على الغشاء بعناية.
ملاحظة: إذا كان من الممكن أيضا إجراء تلطيخ في الموقع دون إزالة الغشاء والجهاز. للقيام بذلك ، قم بإجراء خطوات التلوين عن طريق تعطير الكواشف من خلال VMO / VMT وزيادة مدة كل خطوة حضانة بحوالي 6 أضعاف. - قم بتقشير طبقة الغشاء السفلي برفق وحذر شديد من طبقة ميزة الجهاز لفضح غرف الأنسجة عن طريق الإمساك بكلتا الزاويتين وسحبها لأسفل بحركة بطيئة وسلسة. يجب أن تبقى معظم الأنسجة في غرفة الأنسجة. يرجى الرجوع إلى الشكل 3 أ.
- استخدم شفرة حلاقة أو مشرطا لتطبيق قوة كافية لقطع طبقة الميزة بالكامل وقطع مستطيل صغير حول كل وحدة جهاز فردية ، كما هو موضح في الشكل 3 ب.
- إسفين ملعقة بين طبقة الميزة ولوحة البئر. ضع ضغطا لطيفا أسفل طبقة الميزة لإزالة طبقة الميزة بأكملها التي تحتوي على حجرة الأنسجة بعناية من لوحة البئر.
- ضع كل قطعة طبقة مستطيلة من PDMS تحتوي على وجه الأنسجة لأسفل في بئر واحد يحتوي على PBS.
- بمجرد أن تكون جميع الوحدات في الآبار ، اغسلها باستخدام برنامج تلفزيوني عن طريق وضع اللوحة على هزاز لطيف لمدة 5 دقائق ، واستنشاق PBS من البئر ، واستبدالها ب 500 ميكرولتر من برنامج تلفزيوني طازج. كرر لما مجموعه 3 غسلات.
- نضح PBS من كل بئر وتخلل الأنسجة مع 500 ميكرولتر من 0.5٪ Triton-X في PBS ، 2x لمدة 10 دقائق لكل منهما على هزاز لطيف. إزالة محلول النفاذية.
- احجب 500 ميكرولتر من مصل 10٪ في 0.1٪ Triton-X لكل جهاز لمدة ساعة واحدة في درجة حرارة الغرفة مع هزاز لطيف.
- تمييع الأجسام المضادة الأولية في مصل 3 ٪ في 0.1 ٪ Triton-X إلى التركيز والحجم المطلوبين. قم بإزالة محلول الحجب وأضف ما يكفي من محلول الأجسام المضادة الأولية لتغطية قاع كل بئر بالكامل والسماح بحرية حركة أنسجة الجهاز (~ 200 ميكرولتر). غطي اللوحة بفيلم شفاف.
- احتضان لوحة هزاز بين عشية وضحاها عند 4 درجات مئوية. في اليوم التالي ، أعد اللوحة التي تحتوي على أنسجة الجهاز إلى درجة حرارة الغرفة (~ 15 دقيقة).
- نضح محلول الأجسام المضادة الأولية من كل بئر واغسل الغرف ب 500 ميكرولتر من PBS ، 3 مرات لمدة 5 دقائق لكل منها على هزاز لطيف.
- أضف 200 ميكرولتر من الأجسام المضادة الثانوية في مصل 3٪ في 0.1٪ Triton-X بالتركيز المطلوب. احتضان اللوحة مع هزاز لطيف لمدة 1 ساعة في درجة حرارة الغرفة في الظلام.
- نضح محلول الأجسام المضادة الثانوي واغسله باستخدام برنامج تلفزيوني ، 3 مرات لمدة 5 دقائق لكل منهما مع هزاز لطيف. أضف محلول 1x DAPI في 0.1٪ Triton-X لمدة 10 دقائق أثناء التأرجح في الظلام.
- قم بإزالة فتحات الجهاز المستطيلة التي تحتوي على مناديل ملطخة من اللوحة باستخدام الملقط وضع جانب المناديل لأعلى على منشفة ورقية.
- ماصة بضعة ميكرولتر (~ 10 ميكرولتر) من محلول مضاد للتلاشي مباشرة على كل غرفة وغطاء ، مع الحرص على عدم إدخال فقاعات. اسمح لمضاد التلاشي بالشفاء على الغرف طوال الليل في درجة حرارة الغرفة في الظلام ثم تابع التصوير.
- عزل الأنسجة والخلايا للمقايسات الجزيئية
ملاحظة: ستحتوي كل لوحة عالية الإنتاجية على ما يقرب من 1-2 × 105 خلايا ، اعتمادا على النقطة الزمنية للحصاد. قم بقياس عدد النسخ المتماثلة التجريبية لحساب إجمالي الخلايا بالإضافة إلى الخسارة المحتملة أثناء الحصاد.- تحليلات الخلية الواحدة
- قم بشفط الوسائط من كل بئر واقلب اللوحة عالية الإنتاجية بحيث تكون طبقة الجهاز متجهة لأعلى.
- قم بإزالة الدعامة البلاستيكية على الغشاء. قم بتقشير الغشاء السفلي PDMS برفق شديد وبعناية من طبقة ميزة الجهاز لكشف غرف الأنسجة عن طريق الإمساك بكلتا الزاويتين والسحب لأسفل بحركة بطيئة وسلسة.
- يمكن إزالة الغشاء حتى مع الترابط المناسب. يجب أن تبقى معظم الأنسجة في غرفة الأنسجة بعد إزالة الغشاء ؛ ومع ذلك ، إذا كان أي جزء عالقا بالغشاء ، فاتبع الخطوات أدناه على الغشاء نفسه.
- اغسل كل وحدة جهاز ب 500 ميكرولتر من HBSS أو PBS. لكل وحدة جهاز ، أضف 100 ميكرولتر من كاشف التفكك واتركه يجلس كقطرة فوق الجهاز. ضع الطبق مرة أخرى في حاضنة 37 درجة مئوية لمدة 5 دقائق.
- بعد الهضم ، استخدم ماصة P200 للسحب لأعلى ولأسفل عبر غرف الأنسجة وجمع الأنسجة في كاشف التفكك. حرك طرف الماصة ذهابا وإيابا عبر كل جهاز لضمان الإزالة الكاملة للأنسجة وتجميعها في مخروطي 15 مل مع 500 ميكرولتر من EGM2 لتحييد كاشف التفكك.
- للإزالة الكاملة للخلايا المتبقية من غرفة الأنسجة ، أضف 500 ميكرولتر من EGM2 إلى كل وحدة جهاز واغسلها باستخدام ماصة P200.
- الطرد المركزي محلول الهضم الذي يحتوي على الأنسجة المخلوعة عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية لحبيبات الخلايا المفردة والأنسجة الكاملة.
- نضح الوسائط بعناية وأضف 500 ميكرولتر من 1 مجم / مل (200 وحدة / مل) كولاجيناز من النوع الرابع ، 0.1 مجم / مل هيالورونيداز من النوع الخامس ، و 200 وحدة / مل من الحمض النووي من النوع الرابع في HBSS إلى الأنسجة.
- بعد التعليق اللطيف ، اترك المحلول لمدة 2 دقيقة في درجة حرارة الغرفة قبل سحب الماصة برفق مرة أخرى لفصل الجل.
- اغسل مزيج الهضم ب 10 مل من EGM2 وأجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد تعليق الخلايا في 1x DPBS مع 1٪ BSA أو HSA وقم بالمرور عبر مرشح 70 ميكرومتر مبلل مسبقا عن طريق الدوران عند 200 × جم لمدة دقيقة واحدة.
- عد الخلايا واضبط الحجم بحيث يكون التركيز النهائي 1000 خلية لكل ميكرولتر. يمكن بعد ذلك إخضاع المعلقات الخلوية ل FACS أو قياس التدفق الخلوي أو تسلسل الحمض النووي الريبي أحادي الخلية.
- عزل الحمض النووي الريبي من الأنسجة الكاملة
- اتبع الخطوتين 4-4-1-1 و4-4-1-2 أعلاه.
- أضف ما يقرب من 10 ميكرولتر من محلول تحلل الحمض النووي الريبي على كل غرفة أنسجة مكشوفة ، مما يضمن أن المخزن المؤقت يتجمع مباشرة فوق الأنسجة. لا تستخدم أكثر من 100 ميكرولتر من المخزن المؤقت لتحلل الحمض النووي الريبي في المجموع.
- احتضان لمدة 3 دقائق في درجة حرارة الغرفة. استخدم P20 للسحب لأعلى ولأسفل على كل وحدة جهاز واستخدم طرف الماصة لكشط أي مادة متبقية من حجرة الأنسجة إذا لزم الأمر.
- انقل أكبر قدر ممكن من محلول التحلل إلى أنبوب طرد مركزي دقيق سعة 1.5 مل. كرر الخطوات 4-4-2-2-4-4-3. للأجهزة المتبقية وعينات التجميع في أنبوب سعة 1.5 مل.
- اتبع تعليمات الشركة المصنعة لعزل الحمض النووي الريبي ، اعتمادا على المجموعة أو الكواشف.
- تحليلات الخلية الواحدة

الشكل 3. إعداد منصة للتلطيخ المناعي. (أ) رسم تخطيطي لمنصة الجهاز المجمعة بالكامل مع طبقة غشاء في الأعلى. لإزالة الغشاء ، اسحب بعناية كل ركن من أركان الطبقة الخارجية لأسفل بحركة ثابتة ولطيفة. (ب) بمجرد إزالة طبقة الغشاء تماما ، استخدم شفرة أو مشرطا أو سكينا لقطع المستطيلات حول حجرة الأنسجة لكل وحدة جهاز ، مع الحرص على عدم قطع الأنسجة نفسها. يمكن بعد ذلك تثبيت ملعقة تحت كل مستطيل لإخراجها من اللوحة ووضع كل وحدة في بئر واحدة من صفيحة 24 بئرا مع برنامج تلفزيوني للتلطيخ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
باتباع البروتوكولات الموضحة هنا ، تم إنشاء VMOs و VMTs باستخدام EC و NHLF المشتراة تجاريا ، وبالنسبة ل VMT ، خط خلايا سرطان الثدي الثلاثي السلبي MDA-MB-231. كما تم دمج VMOs الراسخة مع الخلايا السرطانية لتقليد ورم خبيث. في كل نموذج ، بحلول اليوم 5 من الثقافة المشتركة ، تتجمع شبكة الأوعية الدموية ذاتيا استجابة للتدفق المدفوع بالجاذبية عبر غرفة الأنسجة ، وتعمل كقناة في الجسم الحي مثل توصيل العناصر الغذائية والعلاجات والسرطان أو الخلايا المناعية إلى مكانة اللحمة (الشكل 4). تم إنشاء VMOs لأول مرة عن طريق إدخال EC المسمى mCherry في غرفة الأنسجة ، كما هو موضح في الشكل 4A (اليوم 0 من الثقافة) ، مع توزيع متساو للخلايا. في اليوم 2 من ثقافة VMO ، تبدأ EC في التمدد والتجويف (الشكل 4B) ، وبحلول اليوم 4 ، تكون EC مفاغرة مع قنوات الموائع الدقيقة الخارجية وتشكل شبكة وعائية مستمرة (الشكل 4C). بعد أن شكلت الأوعية الدموية مفاغرة واصطفت القنوات الخارجية ، تم تثقيب أنسجة VMO ب 70 كيلو فولت FITC-dextran لتأكيد سالكية الأوعية الدموية (الشكل 4D). تم إدخال FITC-dextran في خزان الوسائط بأعلى ضغط هيدروستاتيكي وسمح له بالتسرب عبر غرفة الأنسجة عبر الأوعية الدقيقة من جانب الضغط العالي إلى جانب الضغط المنخفض ، كما هو موضح في الأسهم. في VMO ، قام FITC-dextran باختراق شبكة الأوعية الدموية الدقيقة بالكامل في غضون 15 دقيقة مع الحد الأدنى من تسرب الأوعية الدموية ، مما يؤكد وظيفة الحاجز الوعائي الضيق (الشكل 4E). ثم تم ضخ خلايا MDA-MB-231 في VMO ، حيث التصقت الخلايا بالبطانة البطانية (الشكل 4F) وتسربت إلى الفضاء خارج الأوعية الدموية في غضون 24 ساعة بعد التروية ، وشكلت العديد من النقائل الدقيقة داخل غرفة الأنسجة (الشكل 4G). تم التقاط صور الفلورسنت المجهرية ذات الفاصل الزمني كل 50 مللي ثانية مع أهداف هوائية 4x و 10x على مجهر متحد البؤر مقلوب لمراقبة الخلايا السرطانية التي تتخلل الأوعية الدموية الدقيقة في الوقت الفعلي (الفيديو التكميلي 1 ، الفيديو التكميلي 2).
في VMO ، يمكن رؤية الخلايا التائية وهي تتسرب إلى الفضاء خارج الخلية على مدار 45 دقيقة (الشكل 4H-I). تم أخذ الصور المجهرية الفلورية ذات الفاصل الزمني على مجهر متحد البؤر للحصول على كومة z بعمق 150 ميكرومتر كل 15 دقيقة لمراقبة تسرب الخلايا التائية في الوقت الفعلي (الفيديو التكميلي 3). كما هو موضح في الشكل 4J ، تم اختراق MDA-MB-231 VMT مع الأوعية غير المتسربة كاملة التكوين بالخلايا التائية (الصفراء) ، والتي التصق الكثير منها بسرعة بجدار الأوعية الدموية (رؤوس الأسهم. الشكل 4K ، الفيديو التكميلي 4 ، الفيديو التكميلي 5). توضح هذه النتائج ، بالإضافة إلى الدراسات السابقة8،9،10،11،12،13،14،15 ، فائدة منصات VMO و VMT لأبحاث علم المناعة والأورام المناعية ، على التوالي.
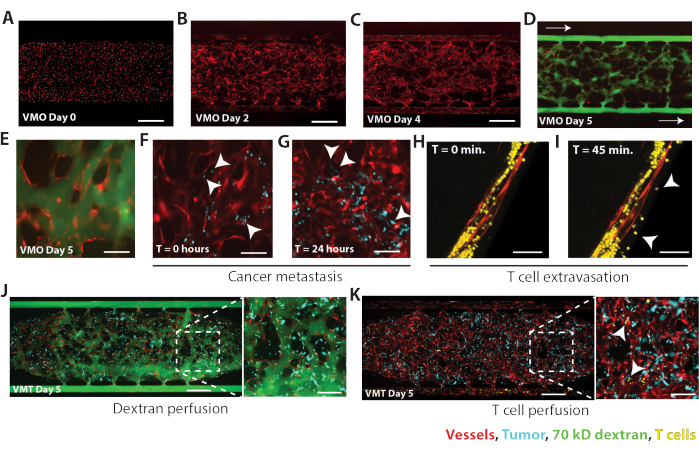
الشكل 4. النتائج التمثيلية ل MDA-MB-231 VMT و VMO. (أ) VMO في اليوم 0 مباشرة بعد تحميل الخلايا في حجرة الأنسجة. EC موضحة باللون الأحمر. شريط المقياس = 500 ميكرومتر. (ب) بحلول اليوم 2 من ثقافة VMO ، تبدأ EC في التمدد استجابة للتدفق. (ج) يوضح اليوم 4 من VMO أن شبكة الأوعية الدموية مفاغرة مع قنوات الموائع الدقيقة الخارجية ، والأوعية ناضجة تقريبا. (د) شبكات VMO مطبقة بالكامل وبراءة اختراع في اليوم 5 من الثقافة. السفن معروضة باللون الأحمر ، 70 كيلو دينار كويتي FITC-dextran أخضر. يشار إلى اتجاه التدفق بالأسهم. شريط المقياس = 500 ميكرومتر. (E) عرض التكبير / التصغير ل VMO المفعم. شريط المقياس = 100 ميكرومتر. (F) يتم اختراق MDA-MB-231 (سماوي) من خلال نفس شبكة VMO الموضحة في E ، وفي الوقت 0 ، التصقت الخلايا السرطانية ببطانة الأوعية البطانية (رؤوس الأسهم). شريط المقياس = 100 ميكرومتر. (G) بحلول 24 ساعة ، تكون خلايا MDA-MB-231 قد تسربت إلى الفضاء خارج الخلية ، مما أدى إلى إنشاء نقائل دقيقة متعددة داخل مكانة الأوعية الدموية. شريط المقياس = 100 ميكرومتر. (H) يكشف الفحص المجهري الفلوري متحد البؤر ذو الفاصل الزمني عن تسرب الخلايا التائية من خلال وعاء دقيق داخل VMO (I) على مدار 45 دقيقة. تشير رؤوس الأسهم إلى مناطق التسرب. شريط المقياس = 50 ميكرومتر. (J) تم إنشاء خط خلايا سرطان الثدي الثلاثي السلبي MDA-MB-231 في VMT ويتم تغذيته في اليوم 5. شريط المقياس = 500 ميكرومتر. تظهر شبكة الأوعية الدموية الحد الأدنى من التسرب عند 15 دقيقة بعد التروية (أقحم ، شريط المقياس = 100 ميكرومتر). (K) MDA-MB-231 VMT (كما في B) يتخلل مع الخلايا التائية (صفراء) ، مع مناطق متعددة من التصاق الخلايا التائية بجدار الأوعية الدموية (رؤوس الأسهم). شريط المقياس = 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو تكميلي 1. نضح خلايا سرطان المبيض في VMO. الفحص المجهري الفلوري بفاصل زمني لخلايا COV362 (السماوية) التي يتم اختراقها من خلال شبكة الأوعية الدموية (الحمراء) ويتم تصويرها بمعدل 4x كل 50 مللي ثانية لمدة 1 دقيقة. الرجاء الضغط هنا لتنزيل هذا الفيديو.
فيديو تكميلي 2. تروية خلايا سرطان الثدي الثلاثية السلبية في VMO. الفحص المجهري الفلوري بفاصل زمني لخلايا MDA-MB-231 (سماوي) يتخلل شبكة الأوعية الدموية (أحمر) ويتم تصويره بمعدل 10 أضعاف كل 50 مللي ثانية لمدة 30 ثانية. الرجاء الضغط هنا لتنزيل هذا الفيديو.
فيديو تكميلي 3. نضح الخلايا التائية من VMO. التقط المجهر الفلوري البؤري الفاصل الزمني عملية تسرب الخلايا التائية من خلال وعاء صغير داخل VMO على مدار 45 دقيقة. تم الحصول على صور Z-stack كل 15 دقيقة ، بحجم خطوة 2 ميكرومتر وعمق 150 ميكرومتر. الوعاء أحمر ، والخلايا التائية صفراء. الرجاء الضغط هنا لتنزيل هذا الفيديو.
فيديو تكميلي 4. تروية الخلايا التائية من VMT. الفحص المجهري الفلوري بفاصل زمني للخلايا التائية التي يتم اختراقها من خلال MDA-MB-231 VMT عند هدف 4x. تم الحصول على الصور كل 50 مللي ثانية لمدة 30 ثانية. تظهر الخلايا التائية باللون الأصفر ، و MDA-MB-231 باللون السماوي ، والأوعية / EC باللون الأحمر. الرجاء الضغط هنا لتنزيل هذا الفيديو.
فيديو تكميلي 5. عرض تكبير/تصغير تروية الخلايا التائية-VMT. عرض مكبرة 10x ل MDA-MB-231 VMT مع الخلايا التائية (من الفيديو التكميلي 4). تم الحصول على الصور كل 50 مللي ثانية لمدة 30 ثانية. تظهر الخلايا التائية باللون الأصفر ، و MDA-MB-231 باللون السماوي ، والأوعية / EC باللون الأحمر. الرجاء الضغط هنا لتنزيل هذا الفيديو.
Discussion
يتلقى كل نسيج في الجسم تقريبا العناصر الغذائية والأكسجين من خلال الأوعية الدموية ، مما يجعله مكونا حاسما لنمذجة المرض الواقعية وفحص الأدوية في المختبر. علاوة على ذلك ، يتم تعريف العديد من الأورام الخبيثة وحالات المرض من خلال خلل وظيفي في بطانة الأوعية الدموية وفرط النفاذية3. والجدير بالذكر أنه في السرطان ، غالبا ما تكون الأوعية الدموية المرتبطة بالورم سيئة التسرب ومضطربة ومتسربة ، وبالتالي تعمل كحاجز أمام توصيل الخلايا العلاجية والمناعية إلى الورم. علاوة على ذلك ، تعمل الأوعية الدموية كقناة يمكن من خلالها للخلايا السرطانية أن تنتقل إلى بذر الأنسجة البعيدة وتسهل الاتصالات بين الخلايا الخلوية التي تثبط الاستجابة المناعية مع زيادة تعزيز نمو الخلايا السرطانية ونشرها. تسلط هذه الظواهر الضوء على الدور الحاسم الذي تلعبه مكانة الأوعية الدموية في المقاومة العلاجية وتطور السرطان والحاجة إلى نمذجة البيئة المكروية للورم بدقة أثناء الدراسة قبل السريرية. ومع ذلك ، تفشل أنظمة النماذج القياسية في المختبر في تضمين المكونات اللحمية والأوعية الدموية المناسبة أو دمج ظروف التدفق الديناميكية. لمعالجة أوجه القصور هذه في أنظمة النماذج الحالية ، تم تقديم طرق لإنشاء نظام فسيولوجي دقيق جيد المواصفات يدعم تكوين ورم دقيق بشري حي ومثقوب (VMT) لأبحاث الأورام الفسيولوجية. الأهم من ذلك ، أن نماذج VMT الخصائص الرئيسية للأوعية الشاذة المرتبطة بالورم والتفاعلات بين الورم واللحمة ، مما يجعلها مثالية لنمذجة أمراض المحاكاة الحيوية واختبار الفعالية العلاجية10.
لسهولة الاستخدام ، لا تتطلب المنصة أي مضخات أو صمامات خارجية ، وبسبب تنسيق لوحة 96 بئرا يمكن تكييفها مع معدات الاستزراع القياسية وسير العمل. علاوة على ذلك ، تم التحقق من صحة تكرارات الأجهزة المختلفة لمعالجة الأسئلة البيولوجية المتميزة والمقصورات الخاصة بالأنسجة والمريض8،9،10،11،12،13،14،15،16،17. بينما يمكن تكييف المنصة مع أي استخدام خاص بالأعضاء أو الأنسجة تقريبا من خلال دمج أنواع مختلفة من الخلايا ، يجب اختبار الخلايا أولا من أجل النمو والقدرة الوعائية داخل VMO / VMT بتركيزات مختلفة من الخلايا لتحديد كثافة البذر المثلى وظروف الاستزراع المشترك. لإنشاء الأوعية الدموية ، يمكن شراء الخلايا البطانية المشتقة من الخلايا المكونة للمستعمرة البطانية البشرية (ECFC-EC) تجاريا أو عزلها حديثا من دم الحبل السري عن طريق اختيار خلايا CD31 +. يمكن أيضا استخدام الخلايا البطانية للوريد السري البشري (HUVEC) لإنشاء الأوعية الدموية داخل VMO / VMT ويمكن شراؤها تجاريا أو عزلها حديثا من الحبل السري. بالإضافة إلى ذلك ، تم اختبار الخلايا البطانية المستحثة المشتقة من الخلايا الجذعية متعددة القدرات (iPSC-EC) بنجاح في المنصة ، مما يفتح إمكانية وجود نظام ذاتي تماما18. تعمل الخلايا الليفية المشتقة تجاريا (الخلايا الليفية الرئوية البشرية القياسية والطبيعية لإمكاناتها الوعائية) بشكل جيد في VMO / VMT ، ويمكن دمج بعض مجموعات الخلايا اللحمية المشتقة من الأولية أو استبدالها أيضا. يمكن إدخال الأورام المشتقة الأولية في VMT كخلايا مفردة أو كروية أو عضويات أو قطع ورم. يمكن تعديل تكوين المصفوفة وفقا للاحتياجات التجريبية ، بما في ذلك الارتفاع باستخدام الكولاجين أو اللامينين أو الفبرونيكتين أو حتى مصفوفات الأنسجة المنزوعة الخلايا19.
يتضمن البروتوكول العديد من الخطوات الحاسمة حيث تكون الرعاية الخاصة ضرورية لتجنب المشكلات الشائعة (الشكل 5). أثناء التحميل ، تأكد من الخلط المتجانس لملاط الخلية / الفيبرين عن طريق السحب الدقيق والإدخال السلس في غرفة الأنسجة (الشكل 5 أ). قم بالضغط المناسب لطرد الجل تماما في الحجرة لمنع التحميل الجزئي (الشكل 5 ب). يعد تصور ملاط الخلية / الفيبرين الذي يعبر حجرة الأنسجة بأكملها ضروريا لضمان ملء الغرفة بالكامل ويمكن تسهيله عن طريق وضع إصبع قفاز خلف وحدة الجهاز. تجنب الضغط بشدة على مكبس الماصة الدقيقة لمنع انفجار مزيج الخلية / الفيبرين في قنوات الموائع الدقيقة (الشكل 5C). يجب الحرص على عدم إدخال فقاعات الهواء أثناء السحب لمنع التداخل مع نمو الأنسجة والتطبيقات النهائية (الشكل 5 د). تعد سرعة الخلط والتحميل المناسبة أمرا بالغ الأهمية لتجنب مناطق التخثر غير المتناسقة (الشكل 5E) بينما قد تؤدي إزالة طرف الماصة قبل الأوان إلى تعطيل الجل في الحجرة (الشكل 5F). يوصى بتحميل الممارسة لتعريف المستخدمين بالعنصر المحدد بوقت الإجراء وخطوة التحميل. علاوة على ذلك ، فإن إدخال اللامينين بشكل صحيح في قنوات الموائع الدقيقة أمر بالغ الأهمية لهجرة EC ، والمفاغرة مع القنوات الخارجية ، وتشكيل شبكة مستمرة قابلة للنفاذ لتوصيل المغذيات. ستؤدي بطانة القناة غير المكتملة أو الغائبة إلى نتائج نضح ضعيفة و VMO / VMT غير قابل للاستخدام.
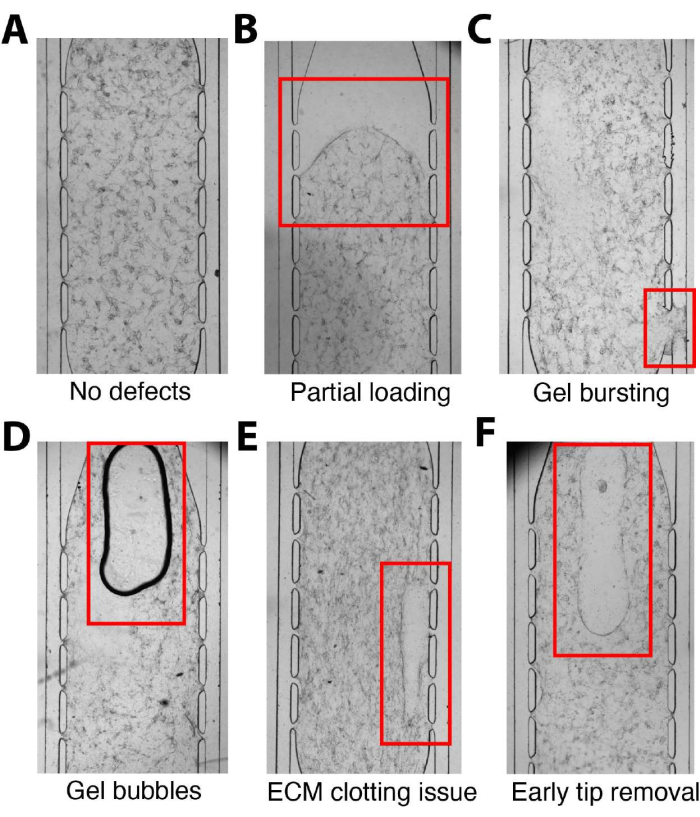
الشكل 5. الأخطاء الشائعة في التحميل. (أ) وحدة جهاز الموائع الدقيقة محملة بشكل صحيح دون عيوب. (ب) لم يتم إدخال مزيج الخلية/الفيبرين بالكامل إلى الحجرة، مما أدى إلى تحميل جزئي. (ج) الضغط الزائد أثناء التحميل ، مما يؤدي إلى انفجار الهلام في قناة الموائع الدقيقة ، مما يمنع التدفق. (د) إدخال فقاعات هواء إلى مزيج الخلية/الفيبرين داخل الحجرة أثناء سحب الماصة. (ه) الخلط غير الصحيح لمزيج الخلية/الفيبرين أو التحميل البطيء الذي يسبب عدم اتساق في التخثر. (F) سيؤدي إزالة طرف الماصة من منفذ التحميل قبل ضبط الجل بشكل كاف إلى تعطيل مزيج الخلية / الفيبرين في حجرة الأنسجة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تعد تدفقات العمل القوية والموحدة للتحليل أمرا بالغ الأهمية في دراسات VMO / VMT ، لأنها تولد كميات كبيرة من بيانات التصوير. تم وصف معالجة الصور والطرق التحليلية ل VMO / VMT سابقا8،9،10،11،12،13. بالنسبة للتحليل الكمي للورم ، يتم قياس شدة الفلورسنت في قناة اللون التي تمثل الخلايا السرطانية باستخدام برنامج مفتوح المصدر مثل ImageJ / Fiji (المعهد الوطني للصحة) 20 أو CellProfiler (معهد واسع) 21. يتم تعيين عتبة الصور المجهرية للورم لتحديد منطقة الورم الفلوري ، ويتم قياس متوسط شدة التألق داخل تلك المنطقة. يتم حساب إجمالي كثافة الفلورسنت للورم كمنتج لمنطقة الفلورسنت ومتوسط شدته ، ويتم تطبيعه إلى قيم خط الأساس (المعالجة المسبقة) للحصول على تغير الطي في نمو الورم لكل جهاز خلال الفترة التجريبية. فيما يتعلق بالتحليل الكمي للسفينة ، يمكن استخدام AngioTool (المعهد الوطني للسرطان) 22 ، أو البرامج النصية الكلية ImageJ / Fiji ، أو برنامج MATLAB ، مثل REAVER23 ، لتحديد إجمالي طول السفينة ، وعدد نقاط النهاية ، وعدد التقاطعات ، ومتوسط طول الوعاء ، وقطر الوعاء ، ومتوسط الثغرة ، ومساحة النسبة المئوية للسفينة. يمكن دمج خوارزميات التعلم الآلي في سير العمل للتحليل التلقائي لصور الأوعية الدموية لتحديد المركبات التي تعطل الأوعية الدموية بشكل فعال24. يتم تحليل صور التروية عن طريق قياس التغير في شدة التألق داخل مناطق الفضاء خارج الخلية وحساب معامل النفاذية10. يمكن إجراء محاكاة العناصر المحدودة للتدفق داخل اللمعة داخل شبكة الأوعية الدموية الدقيقة باستخدام COMSOL Multiphysics25. يعد تنفيذ الأساليب التحليلية الموحدة أمرا بالغ الأهمية لاستخراج رؤى ذات مغزى من الكم الهائل من البيانات التي تم إنشاؤها في دراسات VMT.
سيسمح البروتوكول الموضح هنا للمستخدم بالاستفادة من منصة VMO / VMT لدراسة العديد من جوانب بيولوجيا الورم ، بما في ذلك نمو / تطور الورم ، ورم خبيث للورم ، وديناميكيات الخلايا التائية داخل الورم ، واستجابة الورم للعلاج الكيميائي والعلاج المضاد لتولد الأوعية. لتمكين دراسات الأورام المناعية ذات الصلة من الناحية الفسيولوجية ، تم إثبات كيف تتغلغل الخلايا التائية المعزولة حديثا من خلال الأوعية الدموية الدقيقة ، وتتسرب عبر حاجز الخلايا البطانية ، وتهاجر إلى بنية الأنسجة. تم تقديم التصوير المجهري البؤري بفاصل زمني كأداة لعرض الأحداث العشوائية مكانيا والسريعة زمنيا ، بما في ذلك تسرب الخلايا التائية ، والتي لا يمكن تصورها بسهولة مع أنظمة النماذج الأخرى. بالإضافة إلى ذلك ، قمنا سابقا باختبار أنواع متعددة من الأدوية المضادة للأورام في VMT ، بما في ذلك العلاج الكيميائي ، ومثبطات كيناز الجزيئات الصغيرة / التيروزين ، والأجسام المضادة وحيدة النسيلة (مثل مضادات PD1 و bevacizumab) ، والمركبات المضادة لتولد الأوعية ، وعوامل تثبيت الأوعية الدموية ، مما يؤكد كيف يمكن استخدام المنصة لاختبار فئات مختلفة من الأدوية التي تستهدف كل من الورم والسدى المرتبطبه 8 ، 9،10،11،12،13. يمكن جمع النفايات السائلة من المنصة وتحليلها بحثا عن السيتوكينات المختلفة وكذلك الإكسوسومات. في الدراسات المستقبلية ، يمكن استخدام منصة VMT لتقييم حساسية الخلايا السرطانية للهجوم بوساطة الخلايا التائية على مستوى المريض الفردي. في الختام ، يعد VMT منصة مرنة وقوية ومثالية لدراسة بيولوجيا الورم ، حيث تعد إعادة تشكيل مكونات الأوعية الدموية واللحمية أمرا أساسيا لتطور الورم.
Disclosures
لدى CCWH حصة في الأسهم في شركة Aracari Biosciences، Inc. ، التي تقوم بتسويق نسخة من التكنولوجيا الموصوفة في هذه الورقة. تمت مراجعة شروط هذا الترتيب والموافقة عليها من قبل جامعة كاليفورنيا ، إيرفين ، وفقا لسياسات تضارب المصالح الخاصة بها. لا يوجد تضارب آخر في المصالح.
Acknowledgements
نشكر أعضاء مختبر الدكتور كريستوفر هيوز على مساهمتهم القيمة في الإجراءات الموصوفة ، وكذلك المتعاونين معنا في مختبر الدكتور أبراهام لي لمساعدتهم في تصميم المنصة وتصنيعها. تم دعم هذا العمل من خلال المنح التالية: UG3 / UH3 TR002137 و R61 / R33 HL154307 و 1R01CA244571 و 1R01 HL149748 و U54 CA217378 (CCWH) و TL1 TR001415 و W81XWH2110393 (SJH).
Materials
| Name | Company | Catalog Number | Comments |
| Fabrication | |||
| (3-Mercaptopropyl)trimethoxysilane, 95% | Sigma-Aldrich | 175617-100G | |
| Greiner Bio-One μClear Bottom 96-well Polystyrene Microplates | Greiner Bio-One | 655096 | |
| Methanol ≥99.8% ACS | VWR Chemicals BDH | BDH1135-1LP | |
| MILTEX Sterile Disposable Biopsy Punch with Plunger, 1mm diameter, | Integra Miltex | 33-31AA-P/25 | |
| PDMS membrane | PAX Industries | HT-6240 | |
| Plasma Cleaner PDC-001 | Harrick Plasma | N/A | |
| Smooth-Cast 385 | Smooth-On | N/A | |
| SP Bel-Art Lab Companion Clear Polycarbonate Cabinet Style Vacuum Desiccator | Bel-Art | F42400-4031 | |
| Standard Lids with Condensation Rings, 96-well plate | VWR | 82050-827 | |
| SYLGARD 184 Silicone Elastomer Kit (PDMS) | Dow | 4019862 | |
| Cell culture/Loading | |||
| BioTek Lionheart FX Automated Microscope | Agilent | CYT5MFAW | |
| CELLvo Human Endothelial Progenitor Cells | StemBioSys | N/A | |
| Collagen I, rat tail | Enzo Life Sciences | ||
| Collagenase from Clostridium histolyticum (type 4) | Sigma-Aldrich | C5138 | |
| Corning Hank’s Balanced Salt Solution, 1X without calcium and magnesium | Corning | 21-021-CV | |
| Corning DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10013CV | |
| DAPI | Sigma-Aldrich | D9542 | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Fibrinogen from bovine plasma | Neta Scientific | SIAL-341573 | |
| Fibronectin human plasma | Sigma-Aldrich | F0895 | |
| Fluorescein isothiocyanate–dextran (70kDa) | Sigma-Aldrich | FD70S-1G | |
| Gelatin from porcine skin | Sigma-Aldrich | G1890 | |
| Hyaluronidase from sheep testes (type 4) | Sigma-Aldrich | H6254 | |
| Laminin Mouse Protein | Gibco | 23017015 | |
| Leica TCS SP8 | Leica | N/A | |
| MDA-MB-231 | ATCC | HTB-26 | |
| NHLF – Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Nikon Eclipse Ti | Nikon | N/A | |
| Paraformaldehyde 4% in 0.1M Phosphate BufferSaline, pH 7.4 | Electron Microscopy Sciences | 15735-90-1L | |
| PBMCs - Peripheral blood mononuclear cells | Lonza | CC-2702 | |
| PBS, pH 7.4 | Gibco | 10010049 | |
| Premium Grade Fetal Bovine Serum (FBS), Heat Inactivated | Avantor Seradigm | 97068-091 | |
| ProLong Gold Antifade Mountant | Invitrogen | P10144 | |
| Quick-RNA Microprep Kit | Zymo Research | R1051 | |
| Thrombin from bovine plasma | Sigma-Aldrich | T4648 | |
| Triton X-100 (Electrophoresis), | Fisher BioReagents | BP151-100 | |
| TrypLE Express Enzyme (1X), phenol red | Gibco | 12605028 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 | |
| Vasculife | Lifeline Cell Technology | LL-0003 |
References
- Siegel, R. L., Miller, K. D., Wagle, N. S., Jemal, A. Cancer statistics, 2023. CA Cancer J Clin. 73 (1), 17-48 (2023).
- Hachey, S. J., Hughes, C. C. W. Applications of tumor chip technology. Lab Chip. 18 (19), 2893-2912 (2018).
- Ewald, M. L., Chen, Y. H., Lee, A. P., Hughes, C. C. W. The vascular niche in next generation microphysiological systems. Lab Chip. 21 (17), 3615-3616 (2021).
- Osaki, T., Sivathanu, V., Kamm, R. D. Vascularized microfluidic organ-chips for drug screening, disease models and tissue engineering. Curr Opin Biotechnol. 52, 116-123 (2018).
- Shirure, V. S., Hughes, C. C. W., George, S. C. Engineering vascularized organoid-on-a-chip models. Annu Rev Biomed Eng. 23, 141-167 (2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798 (2021).
- Sontheimer-Phelps, A., Hassell, B. A., Ingber, D. E. Modelling cancer in microfluidic human organs-on-chips. Nat Rev Cancer. 19 (2), 65-81 (2019).
- Sobrino, A., et al. 3D microtumors in vitro supported by perfused vascular networks. Sci Rep. 6, 31589 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Hachey, S. J., et al. An in vitro vascularized micro-tumor model of human colorectal cancer recapitulates in vivo responses to standard-of-care therapy. Lab Chip. 21 (7), 1333-1351 (2021).
- Hachey, S. J., et al. A Human Vascularized Micro-Tumor Model of Patient-Derived Colorectal Cancer Recapitulates Clinical Disease. Transl Res. 255, 97-108 (2023).
- Liu, Y., et al. Human in vitro vascularized micro-organ and micro-tumor models are reproducible organ-on-a-chip platforms for studies of anticancer drugs. Toxicology. 445, 152601 (2020).
- Jahid, S., et al. Structure-based Design of CDC42 Effector Interaction Inhibitors for the Treatment of Cancer. Cell Rep. 39 (4), 110760 (2022).
- Hsu, Y. H., Moya, M. L., Hughes, C. C. W., George, S. C., Lee, A. P. A microfluidic platform for generating large-scale nearly identical human microphysiological vascularized tissue arrays. Lab Chip. 13 (15), 2990-2998 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Christopher, C. W. H., George, S. C. In vitro perfused human capillary networks. Tissue Eng - Part C: Methods. 19 (9), 730-737 (2013).
- Wang, X., et al. An on-chip microfluidic pressure regulator that facilitates reproducible loading of cells and hydrogels into microphysiological system platforms. Lab Chip. 16 (5), 868-876 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Exp Biol Med. 242 (17), 1669-1678 (2017).
- Kurokawa, Y. K., et al. Human induced pluripotent stem cell-derived endothelial cells for three-dimensional microphysiological systems. Tissue Eng Part C: Methods. 23 (8), 474-484 (2017).
- Romero-López, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Carpenter, A. E., et al. CellProfiler: Image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS one. 6 (11), e27385 (2011).
- Corliss, B. A., et al. REAVER: A program for improved analysis of high-resolution vascular network images. Microcirculation. 27 (5), e12618 (2020).
- Urban, G., et al. Deep learning for drug discovery and cancer research: Automated analysis of vascularization images. IEEE/ACM Trans Comput Biol Bioinform. 16 (3), 1029-1035 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved