Method Article
Establecimiento de un modelo fisiológico de microtumor vascularizado humano para la investigación del cáncer
En este artículo
Resumen
Este protocolo presenta un modelo de tumor en un chip fisiológicamente relevante para realizar investigaciones básicas y traslacionales de alto rendimiento sobre el cáncer humano, avanzando en la detección de fármacos, el modelado de enfermedades y los enfoques de medicina personalizada con una descripción de los procedimientos de carga, mantenimiento y evaluación.
Resumen
La falta de modelos de cáncer validados que recapitulen el microambiente tumoral de los cánceres sólidos in vitro sigue siendo un obstáculo importante para la investigación preclínica del cáncer y el desarrollo terapéutico. Para superar este problema, hemos desarrollado el microtumor vascularizado (VMT), o chip tumoral, un sistema microfisiológico que modela de forma realista el complejo microambiente tumoral humano. El VMT se forma de novo dentro de una plataforma microfluídica mediante el cocultivo de múltiples tipos de células humanas en condiciones dinámicas de flujo fisiológico. Esta construcción microtumoral de ingeniería tisular incorpora una red vascular perfundida viva que soporta la creciente masa tumoral al igual que lo hacen los vasos recién formados in vivo. Es importante destacar que los fármacos y las células inmunitarias deben atravesar la capa endotelial para llegar al tumor, modelando in vivo las barreras fisiológicas para la administración y eficacia terapéuticas. Dado que la plataforma VMT es ópticamente transparente, se pueden lograr imágenes de alta resolución de procesos dinámicos como la extravasación de células inmunitarias y la metástasis con la visualización directa de células marcadas con fluorescencia dentro del tejido. Además, el VMT conserva la heterogeneidad tumoral in vivo , las firmas de expresión génica y las respuestas a fármacos. Prácticamente cualquier tipo de tumor se puede adaptar a la plataforma, y las células primarias de los tejidos quirúrgicos frescos crecen y responden al tratamiento farmacológico en el VMT, allanando el camino hacia una medicina verdaderamente personalizada. Aquí, se describen los métodos para establecer el VMT y utilizarlo para la investigación oncológica. Este enfoque innovador abre nuevas posibilidades para el estudio de los tumores y las respuestas a los fármacos, proporcionando a los investigadores una poderosa herramienta para avanzar en la investigación del cáncer.
Introducción
El cáncer sigue siendo un importante problema de salud en todo el mundo y es la segunda causa principal de muerte en los Estados Unidos. Solo para el año 2023, el Centro Nacional de Estadísticas de Salud anticipa más de 1.9 millones de nuevos casos de cáncer y más de 600,000 muertes por cáncer en los EE. UU.1, lo que destaca la necesidad urgente de enfoques de tratamiento efectivos. Sin embargo, en la actualidad, solo el 5,1% de las terapias contra el cáncer que entran en ensayos clínicos finalmente obtienen la aprobación de la FDA. El fracaso de los candidatos prometedores para progresar con éxito a través de los ensayos clínicos puede atribuirse parcialmente al uso de sistemas modelo no fisiológicos, como cultivos 2D y esferoides, durante el desarrollo preclínico de fármacos2. Estos modelos clásicos de cáncer carecen de componentes esenciales del microambiente tumoral, como un nicho estromal, células inmunitarias asociadas y vasculatura perfundida, que son determinantes clave de la resistencia terapéutica y la progresión de la enfermedad. Por lo tanto, es necesario un nuevo sistema modelo que imite mejor el microambiente tumoral humano in vivo para mejorar la traslación clínica de los hallazgos preclínicos.
El campo de la ingeniería de tejidos está avanzando rápidamente, proporcionando métodos mejorados para estudiar enfermedades humanas en entornos de laboratorio. Un desarrollo significativo es la aparición de los sistemas microfisiológicos (MPS), también conocidos como chips de órganos o chips de tejido, que son órganos humanos funcionales y miniaturizados capaces de replicar condiciones sanas o enfermas 3,4,5. En este contexto, se han desarrollado chips tumorales, que son modelos tumorales humanos in vitro tridimensionales basados en microfluídica, para la investigación oncológica 2,3,4,5,6,7,8,9,10,11,12,13 . Estos modelos avanzados incorporan señales bioquímicas y biofísicas dentro de un microambiente tumoral dinámico, lo que permite a los investigadores estudiar el comportamiento tumoral y las respuestas a los tratamientos en un contexto fisiológicamente más relevante. Sin embargo, a pesar de estos avances, pocos grupos han incorporado con éxito una vasculatura viva y funcional, particularmente una que se automodela en respuesta al flujo fisiológico 3,4,5,6. La inclusión de una red vascular funcional es crucial, ya que permite modelar las barreras físicas que afectan a la administración de fármacos o células, la localización celular en distintos microambientes y la migración transendotelial de células tumorales, estromales e inmunitarias. Al incluir esta característica, el chip tumoral puede representar mejor las complejidades observadas en el microambiente tumoral in vivo.
Para hacer frente a esta necesidad insatisfecha, hemos desarrollado una novedosa plataforma de cribado de fármacos que permite la formación de redes de microvasos dentro de un dispositivo microfluídico 8,9,10,11,12,13,14,15,16. Esta plataforma de chip de órgano base, denominada microórgano vascularizado (VMO), se puede adaptar a prácticamente cualquier sistema de órganos para replicar la fisiología del tejido original para el modelado de enfermedades, la detección de fármacos y las aplicaciones de medicina personalizada. Las VMO se establecen mediante el cocultivo de células derivadas de células formadoras de colonias endoteliales (ECFC-EC), HUVEC o iPSC-EC (en adelante, EC) y múltiples células estromales en la cámara, incluidos los fibroblastos pulmonares humanos normales (NHLF), que remodelan la matriz, y los pericitos que envuelven y estabilizan los vasos. El VMO también se puede establecer como un sistema modelo de cáncer mediante el cocultivo de células tumorales con el estroma asociado para crear un modelo de microtumor vascularizado (VMT)8,9,10,11,12,13 o chip tumoral. A través del cocultivo de múltiples tipos celulares en un ambiente de flujo dinámico, las redes microvasculares perfundidas se forman de novo en las cámaras tisulares del dispositivo, donde la vasculogénesis está estrechamente regulada por las tasas de flujo intersticial14,15. El medio es conducido a través de los canales microfluídicos del dispositivo por un cabezal de presión hidrostática que suministra nutrientes a las células circundantes de la cámara tisular exclusivamente a través de los microvasos, con un coeficiente de permeabilidad de 1,2 x 10-7 cm/s, similar al observado para los capilares in vivo8.
La incorporación de microvasos autoorganizados en el modelo VMT representa un avance significativo porque: 1) imita la estructura y función de las masas tumorales vascularizadas in vivo; 2) puede modelar los pasos clave de la metástasis, incluidas las interacciones tumoral-endotelial y de células estromales; 3) establece barreras fisiológicamente selectivas para la administración de nutrientes y fármacos, mejorando el cribado farmacéutico; y 4) permite la evaluación directa de fármacos con capacidades antiangiogénicas y antimetastásicas. Al replicar la administración in vivo de nutrientes, fármacos y células inmunitarias en un complejo microentorno 3D, la plataforma VMO/VMT es un modelo fisiológicamente relevante que puede utilizarse para realizar el cribado de fármacos y estudiar la biología del cáncer, vascular o específica de órganos. Es importante destacar que el VMT apoya el crecimiento de varios tipos de tumores, incluidos el cáncer de colon, el melanoma, el cáncer de mama, el glioblastoma, el cáncer de pulmón, la carcinomatosis peritoneal, el cáncer de ovario y el cáncer de páncreas 8,9,10,11,12,13. Además de ser de bajo costo, fácil de establecer y estar preparada para experimentos de alto rendimiento, la plataforma microfluídica es totalmente compatible ópticamente para el análisis de imágenes en tiempo real de las interacciones tumor-estroma y la respuesta a estímulos o terapias. Cada tipo de célula en el sistema está marcada con un marcador fluorescente diferente para permitir la visualización directa y el seguimiento del comportamiento celular a lo largo de todo el experimento, creando una ventana al microambiente tumoral dinámico. Hemos demostrado previamente que el VMT modela más fielmente el crecimiento tumoral in vivo, la arquitectura, la heterogeneidad, las firmas de expresión génica y las respuestas a los fármacos que las modalidades de cultivo estándar10. Es importante destacar que el VMT apoya el crecimiento y el estudio de las células derivadas de los pacientes, incluidas las células cancerosas, lo que modela mejor la patología de los tumores progenitores que los cultivos esferoides estándar y avanza aún más en los esfuerzos de la medicina personalizada11. Este manuscrito describe los métodos para establecer el VMT, mostrando su utilidad para el estudio de los cánceres humanos.
Protocolo
1. Diseño y fabricación
- Diseño del dispositivo
- Para la fabricación de dispositivos microfluídicos, cree un molde SU-8 utilizando una capa de 200 μm de SU-8 recubierta por centrifugación sobre una oblea de Si (RCA-1 limpia y tratada con fluoruro de hidrógeno (HF) al 2%), seguido de un paso de fotolitografía de máscara única como se describió anteriormente 8,9.
- Funda una réplica de polidimetilsiloxano (PDMS) de 4 mm de espesor a partir del molde SU-8 para generar un molde de poliuretano duradero para los pasos de fabricación posteriores. Se pueden utilizar varias iteraciones de diseño 8,9,10,11,12,13,14,15.
- En la iteración actual, diseñe el dispositivo microfluídico para que se ajuste a medida en un formato de placa estándar de 96 pocillos y que consista en una capa de características de PDMS de 2 mm de espesor con 12 unidades de dispositivos microfluídicos encerradas por una capa delgada (1/16 de pulgada) de membrana de polímero transparente en la parte inferior (Figura 1A).
- Asegúrese de que las unidades de tejido individuales consten de una cámara de tejido flanqueada por una entrada de carga de gel (L1) y una salida (L2), un regulador de presión (PR)16 y canales microfluídicos desacoplados conectados a 2 entradas y salidas de medios a cada lado (M1-M2, M3-M4; Figura 1B).
- Coloque cada entrada y salida dentro de un solo pozo que sirva como depósito medio para establecer la presión hidrostática (10 mm H2O) a través del canal microfluídico. Para permitir la anastomosis de la red vascular con los canales externos, conecte los canales microfluídicos a la cámara tisular a través de poros de comunicación de 50 μm de ancho (6 en la parte superior, 6 en la parte inferior).
NOTA: Las resistencias microfluídicas crean un gradiente de presión intersticial de 5 mm H2O a través de la cámara tisular que se vuelve intraluminal una vez que la red vascular está completamente formada 8,10. Los procedimientos posteriores comienzan con una placa de alto rendimiento completamente ensamblada.

Figura 1. Diseño de plataforma microfluídica. (A) El esquema del conjunto de la plataforma muestra la capa de características del PDMS con 12 unidades de dispositivo unidas a una placa sin fondo de 96 pocillos y sellada con una delgada membrana de polímero transparente. Cada unidad de dispositivo ocupa una columna de pocillos en la placa. La unidad de dispositivo único delineada en rojo se muestra con los detalles en (B). (B) El esquema de una unidad de dispositivo muestra una sola cámara de tejido colocada dentro de un pocillo de la placa de 96 pocillos y dos puertos de carga con orificio de entrada y salida (L1-L2) perforado para permitir que se introduzca la mezcla de matriz celular. Las entradas y salidas medianas (M1-M2, M3-M4) están perforadas y colocadas dentro de pozos que sirven como depósitos de medios. Diferentes volúmenes de medios establecen un gradiente de presión hidrostática a través de la cámara tisular a través de canales microfluídicos desacoplados. La unidad reguladora de presión (PR) sirve como una válvula de rotura de gel para aumentar la facilidad de carga. Tenga en cuenta que el dispositivo tiene una profundidad de 200 μm y la cámara de tejido mide 2 mm x 6 mm. Haga clic aquí para ver una versión más grande de esta figura.
2. Preparativos previos a la carga
- Cultivo celular
- Mantenga las células de acuerdo con las recomendaciones del fabricante en una incubadora humidificada a 37 °C y 5% de CO2 .
- Matraces de placa T75 de células transducidas de EC, NHLF u otro fibroblasto/célula estromal y células cancerosas deseadas 3-4 días antes de la carga a una densidad informada por el fabricante y los protocolos del usuario. Para este protocolo, coloque 1 x 106 celdas por matraz para cada tipo de célula. Cultivo de EC en medios de crecimiento endotelial 2 (EGM2) completos, NHLF en medio Eagle Modificado (DMEM) de Dulbecco con 10% de FBS y células cancerosas en medios apropiados según el tipo de célula.
- Mantenga las células alimentándolas con los medios respectivos cada 2-3 días y reconfirme la eficiencia de transducción o marcaje visualizando las células bajo un microscopio fluorescente. El día de la carga, asegúrese de que la EC tenga una confluente del 80 % al 100 %, mientras que la NHLF es subconfluente del 70 % al 80 %.
- Preparación de fibrinógeno
- Prepare la solución de fibrinógeno a la concentración deseada (por lo general, 5-8 mg/ml favorece la formación de una red vascular robusta), teniendo en cuenta el porcentaje de coagulación del fibrinógeno. Calcula la cantidad de fibrinógeno necesaria con la siguiente ecuación:
Fibrinógeno (mg) = (volumen (mL)) x (concentración (mg/mL))/ (% de coagulación) - Disolver el fibrinógeno en un volumen adecuado de medio basal endotelial 2 (EBM2), calentado a 37 °C, agitando suavemente el tubo (no hacer vórtice). Incubar el fibrinógeno en un baño de agua a 37 °C para permitir que se disuelva completamente. Es importante destacar que no utilice un medio completo.
- Solución de fibrinógeno de filtro estéril con filtro de 0,22 μm y alícuota al volumen deseado, normalmente 400 μL por tubo de microcentrífuga.
NOTA: Otras proteínas de la matriz (p. ej., colágenos, fibronectina o laminina) se pueden agregar a la mezcla de fibrinógeno.
- Prepare la solución de fibrinógeno a la concentración deseada (por lo general, 5-8 mg/ml favorece la formación de una red vascular robusta), teniendo en cuenta el porcentaje de coagulación del fibrinógeno. Calcula la cantidad de fibrinógeno necesaria con la siguiente ecuación:
3. Carga de muestras
NOTA: La carga es sensible al tiempo y debe completarse desde el inicio (elevación de la célula) hasta el final (adición de medios a los dispositivos) dentro de aproximadamente 1,5-1,75 h para garantizar resultados óptimos. Cada paso se anota con un temporizador sugerido para ayudar al usuario a mantenerse en el camino.
- Preparación de materiales (Día de carga)
- Coloque lo siguiente en un baño de agua a 37 °C durante 10-15 min: solución salina equilibrada de Hank (HBSS) o solución salina tamponada con fosfato (PBS) para lavar celdas, reactivo de disociación celular, medios (p. ej., EGM2, DMEM)
- Conserve los siguientes reactivos en una nevera a 4 °C hasta que estén listos para su uso: trombina, laminina (descongelada durante la noche a 4 °C).
- Descongele la alícuota de fibrinógeno a temperatura ambiente. Prepare 1,5 μL de alícuotas de trombina en tubos de microcentrífuga de 500 μL, con un tubo por unidad de dispositivo. Asegúrese de que la alícuota de trombina esté en la parte inferior de cada tubo para facilitar la carga.
- Coloque las placas de alto rendimiento esterilizadas con UV en un desecador durante al menos 30 minutos antes de cargarlas para eliminar el aire atrapado en la microfluídica.
- Preparación de la célula (inicio del temporizador = inicio a los 0 minutos)
- Compruebe las células bajo el microscopio con un aumento de 4x para confirmar la confluencia y la eficiencia de la transducción.
- Lave cada matraz T75 de células 2 veces con 5 ml de HBSS y aspire completamente. Añadir 1 ml de reactivo de disociación a cada matraz e incubar a 37 °C, 5% de CO2 durante 1-2 min.
- Golpee suavemente la placa con la palma de la mano y compruebe que se han levantado todas las células.
- Lave las células del matraz con 9 ml de medios apropiados y recójalas en un recipiente cónico de 15 ml. Retire inmediatamente una pequeña alícuota para el recuento de células.
- Centrifugar las células a 300 x g durante 3-5 min a 4 °C. Mientras centrifuga las células, cuente las células. Un matraz T75 confluente de EC o NHLF debe producir al menos 2 x 106 células.
- Después de la centrifugación, aspire el medio y vuelva a suspender el gránulo en el medio apropiado a una concentración de 1 x 106 células/ml. Mantenga las células en hielo.
- Preparación de la mezcla de células y fibrinógeno (Temporizador = comienza a los 20 min)
- Determine cuántos dispositivos se cargarán, sumando 1-2 para tener en cuenta la pérdida de pipeteo, y multiplíquelo por el volumen de mezcla de célula y fibrinógeno necesario por dispositivo. Esto dependerá de la configuración del dispositivo, pero para el diseño del dispositivo presentado en este artículo, se requieren 6 μL por dispositivo.
- La concentración de cada tipo de célula debe determinarse experimentalmente. Como punto de partida, cargue la CE a una concentración de aproximadamente 7 x 106 células/ml y el NHLF a una concentración de 3,5 x 106 células/ml. La concentración de células cancerosas puede variar considerablemente en función de su tasa de crecimiento, pero normalmente se encuentra dentro del rango de 0,5-2 x 106 células/ml. Utilice esta ecuación para calcular el número de celdas necesarias:
Número de células necesarias = (volumen de fibrina (μL))/1000 μL x (concentración de células) - Vuelva a suspender las células a una concentración de 1 x 106 células/ml y utilice la siguiente ecuación para determinar el volumen de células necesario:
Volumen de células necesarias (μL) = (número de células necesarias)/1000 - Mezclar los volúmenes respectivos de EC, NHLF y células cancerosas (solo para VMT) en un tubo cónico y centrifugar a 300 x g durante 3-5 min a 4 °C.
- Después de centrifugar, aspire con cuidado el medio y pipetee cualquier medio residual cerca del gránulo. Vuelva a suspender el gránulo de forma suave pero completa en el volumen calculado de fibrinógeno, teniendo especial cuidado de no introducir burbujas de aire. Mantener en hielo.
- Coloque las placas esterilizadas y las alícuotas de trombina en la campana de cultivo de tejidos.
- Carga de dispositivos (Temporizador = comienza a los 30-35 minutos)
- Con una pipeta P20, pipetee 6 μL de volumen de la mezcla de célula y fibrina. Asegúrese de pipetear la mezcla hacia arriba y hacia abajo al menos 5 veces para garantizar una suspensión celular uniforme. Mantenga la mezcla en hielo para que se coagule lentamente.
- Mezcle suavemente la célula/fibrina en un tubo de trombina colocando la punta de la pipeta directamente en la alícuota de trombina en la parte inferior del tubo. Pipetear inmediatamente hacia arriba y hacia abajo al menos 2 veces, teniendo cuidado de no introducir burbujas de aire. La fibrina comenzará a coagularse una vez mezclada con la trombina, por lo que completa rápida pero deliberadamente los pasos 3.4.3. y 3.4.4. antes de que la fibrina se gelifique en la punta de la pipeta (~3 s).
- Levante la placa de alto rendimiento en ángulo e inserte rápidamente la punta de la pipeta en uno de los puertos de carga del dispositivo (L1 o L2). Consulte la Figura 2A para ver el esquema.
- Empuje el émbolo de la pipeta hasta el primer tope con un movimiento suave y fluido para inyectar la mezcla de célula y fibrina en la cámara de tejido. Esté atento a que el gel atraviese completamente la cámara.
NOTA: Aplicar demasiada presión durante este paso puede provocar el estallido del gel en los canales microfluídicos en la parte superior y/o inferior de las cámaras tisulares. - Vuelva a colocar suavemente la placa en posición horizontal en la cubierta de cultivo de tejidos sin quitar la punta de la pipeta, soltar el émbolo de la pipeta ni alterar la pipeta. Utilice la mano para girar y retirar la punta de la pipeta del P20 y déjela en el orificio del puerto de carga. No utilice el botón eyector para quitar la punta, ya que esto causará demasiada presión.
- Continúe con los pasos 3.4.1-3.4.5 para los dispositivos restantes.
- Cuando se complete la carga, deje reposar la placa durante 2 minutos sin tocarla en la campana de cultivo de tejidos.
- Retire las puntas de las pipetas girándolas suavemente y tirando de ellas desde los puertos de carga. Vuelva a colocar la tapa en el plato.
- Incubar toda la placa durante 15-20 minutos en una incubadora a 37 °C para permitir que el gel polimerice completamente.
- Después de la incubación, revise cada unidad del dispositivo bajo el microscopio. Verifique que las células estén distribuidas uniformemente por toda la cámara sin burbujas de aire y que haya una interfaz de gel claramente visible entre la cámara de tejido y los canales microfluídicos, como se muestra en la Figura 2B-C.
- Recubrimiento de canales con laminina (Temporizador = comienza a los 45-50 min)
- Una vez que los geles estén completamente sólidos, introduzca laminina en los canales microfluídicos para promover la anastomosis vascular.
- Con un P20, introduzca 4 μL de laminina en cada canal microfluídico (superior e inferior) del dispositivo. Inserte la punta de la pipeta en M1 o M3 y expulse la laminina lentamente, vigilando que la laminina cubra todo el canal superior, y luego repita para M2 o M4 para cubrir todo el canal inferior.
- Determine la orientación pipeteando la laminina desde el lado opuesto al regulador de presión para permitir que haya suficiente presión para empujarla. Sin embargo, si la laminina no se desplaza fácilmente desde un lado, retire la punta de un lado y empuje la laminina desde el otro lado. Es posible que sea necesario ir a la segunda parada de la pipeta (es decir, empujar el émbolo hasta el fondo) para generar suficiente presión para empujar la laminina a través de todo el canal.
- Retire la punta suavemente de la entrada/salida del material. No utilice el botón eyector del P20.
- Repita los pasos 3.5.1-3.5.4 para cada dispositivo e incube la placa a 37 °C, 5% de CO2 durante 10 min.
- Adición de medios (temporizador = comienza aproximadamente a 1 h 10 min)
- Agregue 275 μL de medio completo EGM2 en los depósitos de medios desacoplados de los pocillos en las filas A y B o G y H. Este será el lado alto, y la orientación debe determinarse haciendo que los pozos en el lado opuesto al regulador de presión tengan un volumen alto para comenzar. Los medios serán empujados desde el lado alto por la gravedad.
- Con una pipeta P200, introducir 75 μL de medio en las entradas/salidas del medio de los pocillos que contienen los 275 μL de EGM2. Inserte la punta en el orificio de entrada del medio y expulse lentamente el medio, observando que el medio viaja a través del canal y burbujea hacia arriba en el otro lado.
- Retire la punta de la pipeta y empuje el medio restante de la punta hacia el depósito del medio de modo que el volumen total en el lado superior sea de 350 μL.
- Repita los pasos 3.6.1 a 3.6.3 para cada unidad de dispositivo, canales superior e inferior.
- Agregue 50 μL de medio para cubrir completamente el lado bajo, los pocillos en las filas A y B o G y H, según la orientación descrita anteriormente. Asegúrese de que haya una capa uniforme de medios que cubra el fondo del pozo. Consulte la Figura 2D para ver un esquema que muestra los volúmenes de medios en los depósitos.
- Eliminación de burbujas de aire (post-carga)
NOTA: Eliminar las burbujas es un paso fundamental para garantizar un flujo adecuado en cada dispositivo. Para el día 2, las células endoteliales y los fibroblastos comenzarán a estirarse en respuesta al flujo (Figura 2E).- Una vez añadidos todos los medios, incubar las placas durante 1-2 h en una incubadora a 37 °C y 5% de CO2 antes de comprobar si hay burbujas de aire en los canales o en las entradas/salidas del medio.
- Visualice las burbujas en los canales de medios en el microscopio y expulse reintroduciendo 75 μL de medios en los canales para expulsar las burbujas.
- Visualice las burbujas en las entradas/salidas del medio a simple vista. Utilice una pipeta P200 para eliminar las burbujas de aire atrapadas en las entradas y salidas del medio empujando el émbolo hacia abajo, introduciendo la punta en el orificio y sacando la burbuja levantando el émbolo para aplicar presión negativa y succionar la burbuja.

Figura 2. Esquema de carga del dispositivo. (A) Utilizando una pipeta P20, la mezcla de célula y fibrina se introduce en la cámara de tejido de cada unidad del dispositivo a través de uno de los puertos de carga. (B) La micrografía de campo claro muestra un dispositivo microfluídico cargado de EC, fibroblastos y células cancerosas para formar un VMT. Barra de escala = 500 μm. (C) Micrografía de fluorescencia del dispositivo en B que muestra CE en rojo, tumor en cian y fibroblastos en azul. (D) El esquema muestra la adición de medio en los depósitos, con 350 μL en el lado alto y 50 μL en el lado bajo para generar la carga de presión hidrostática. (E) El día 2 del cultivo de VMT muestra que los fibroblastos y la CE comienzan a estirarse para formar la red vascular. Barra de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
4. Mantenimiento de dispositivos y aplicaciones experimentales
- Mantenimiento y tratamiento farmacológico
NOTA: Para mantener el flujo en el sistema, la presión hidrostática debe restablecerse diariamente pipeteando el volumen de medios desde el lado bajo hacia el lado alto o viceversa, asegurando que el volumen total en el lado alto permanezca en 350 μL. La dirección del flujo se cambia todos los días después del día 2 del establecimiento de VMO o VMT. A continuación se proporcionan detalles adicionales de mantenimiento y tratamiento.- Cambie el medio cada dos días con EGM2 completo hasta que la vasculatura esté completamente establecida (día 5-6). Aspire completamente los medios viejos y reemplace los pocillos de alta presión (350 μL) y los pocillos de baja presión (50 μL).
NOTA: La determinación experimental de formulaciones de medios optimizadas se puede llevar a cabo para otros tipos de células, a menudo involucrando una mezcla 50:50 o la adición de componentes específicos en EGM2. - Una vez formada la red vascular y completamente desarrollado el tejido (día 4-7), realizar una prueba de perfusión de dextrano antes de utilizar los dispositivos para experimentos (paso 4.2.1.). Utilice únicamente dispositivos que tengan suficiente perfusión en la cámara de tejidos.
- En el caso de los experimentos con terapia, el día en que comience el tratamiento, tome imágenes en todos los canales fluorescentes de cada dispositivo. Esto servirá como línea de base.
- Trate los dispositivos con la terapéutica deseada reemplazando el medio con medio fresco que contenga el fármaco diluido a la concentración deseada. Asegúrese de que los medicamentos se diluyan en los vehículos apropiados según la recomendación del fabricante, pero no exceda el 0.01% de DMSO en los medios.
- Exponga los dispositivos al fármaco durante el tiempo deseado (normalmente 48 horas, pero puede ser informado por la farmacocinética).
- Tome imágenes de cada canal de cada dispositivo en el intervalo de tiempo deseado para monitorear la respuesta al tratamiento. Mantenga las placas como se indica en el paso 4.1.1 durante todo el experimento.
- Al finalizar el experimento, lejía en placas y colóquelas en un recipiente de riesgo biológico, fíjelas con PFA al 4% para tinción inmunofluorescente (paso 4.3.) o recoja para aislamiento de células vivas o ARN (paso 4.4.).
- Cambie el medio cada dos días con EGM2 completo hasta que la vasculatura esté completamente establecida (día 5-6). Aspire completamente los medios viejos y reemplace los pocillos de alta presión (350 μL) y los pocillos de baja presión (50 μL).
- Ensayos de perfusión
- Perfusión de dextrano
NOTA: La permeabilidad/permeabilidad vascular se puede determinar mediante la perfusión de la red vascular con dextrano marcado con fluorescencia de diferentes pesos moleculares (40 kD, 70 kD o 150 kD). Se puede utilizar FITC- o rodamina-dextrano dependiendo de la etiqueta fluorescente de la CE.- Antes de la perfusión, determine la exposición adecuada del FITC o del canal de rodamina añadiendo unos pocos μL de dextrano dentro del canal fluídico o de la cámara de un dispositivo vacío. Establezca el tiempo de exposición justo por debajo del nivel de saturación mediante el uso de un software de microscopio para mostrar un histograma de intensidades de píxeles, lo que garantiza un rango dinámico caracterizado por píxeles distribuidos uniformemente sin ninguna concentración notable de valores de alta intensidad.
- Tome micrografías de todos los dispositivos en los canales de interés, incluida una imagen de fondo de todos los dispositivos en el canal de dextrano fluorescente, para calibrarlas con el fondo. Utilice la misma exposición que la determinada anteriormente y alinee la cámara de tejido en el centro del marco de la imagen para garantizar imágenes consistentes para la cuantificación.
- Preparar una reserva principal de FITC-dextrano o rodamina-dextrano a una concentración de 5 mg/ml en 1x DPBS. Este stock se puede mantener a 4 °C.
- Para preparar un material de trabajo, diluir 5 mg/ml de material hasta una concentración final de 50 μg/ml en EGM2.
- Reemplace el medio en los depósitos con la solución de dextrano diluida como la mitad del volumen máximo (175 μL en un pocillo y el lado alto en el canal superior o inferior de la cámara de tejido). Reemplace los medios en los otros pocillos de modo que el lado superior desacoplado obtenga 175 μL de EGM2 fresco sin dextrano, y los pocillos en el lado bajo solo tengan 50 μL en cada uno.
NOTA: El dextrano solo debe agregarse a un lado de los canales microfluídicos (superior o inferior) para permitir la visualización del colorante que viaja a través del lado de alta presión, hacia el lecho vascular y hacia afuera por el lado de baja presión. - Bajo el microscopio, observe si el dextrano fluorescente fluye a través de la red vascular. Por lo general, esto ocurrirá aproximadamente 2 minutos después de agregar el tinte al depósito de medios.
- Comience a obtener imágenes del canal fluorescente de dextrano (y otros canales, si lo desea). Esto es T = 0 punto de tiempo. Tome imágenes adicionales en varios puntos de tiempo (normalmente cada 10 minutos) o en una sola imagen de punto final.
- Perfusión de células
NOTA: Se pueden perfundir varios tipos de células a través de la vasculatura según el diseño del estudio, incluidos los linfocitos o macrófagos para los estudios de inmunología del cáncer, así como las células cancerosas para los estudios de metástasis. Las células deben marcarse con fluorescencia para facilitar el seguimiento a lo largo del tiempo.- Al menos 2 h antes de la perfusión de células, realice la perfusión de dextrano en todos los dispositivos como se ha descrito anteriormente. Este paso es importante para determinar la permeabilidad vascular antes de agregar células.
- Determine la exposición adecuada de la cámara para las células que se van a perfundir. Tome una pequeña muestra de células para verla bajo el microscopio y establezca el tiempo de exposición para ese marcador fluorescente. Ajuste el tiempo de exposición justo por debajo del nivel de saturación.
- Tome micrografías de todos los dispositivos en los canales de interés, incluida una imagen de fondo de todos los dispositivos en el canal de dextrano fluorescente, para calibrarlas con el fondo. Utilice la misma exposición que se determina en el paso 4.2.2.1.
- Confirme que el dextrano se ha difundido completamente fuera de las cámaras tisulares antes de recolectar las células para su perfusión. Cosecha y cuenta las celdas de interés.
- Vuelva a suspender las células a la densidad adecuada en EGM2. Por ejemplo, las células T generalmente se agregan aproximadamente a 1 x 106 células/ml para imitar la concentración en la sangre.
NOTA: Los EC son sensibles a la composición de los medios, pero pueden tolerar hasta un 50% de mezcla con la mayoría de los demás medios. Pruebe de antemano. - Agregue 175 μL de suspensión celular en un pocillo en el lado alto de cada dispositivo y agregue 175 μL de EGM2 completo al otro pocillo. En el lado bajo, agregue 50 μL de medio completo EGM2 a ambos pocillos.
- Bajo el microscopio, observe si las células fluorescentes fluyen a través de la red vascular. Por lo general, esto ocurrirá aproximadamente 2 minutos después de agregar las celdas al depósito de medios.
- Una vez que se establece el flujo celular, comience a obtener imágenes del canal celular fluorescente (y otros canales, si lo desea). Esto es T = 0 punto de tiempo. Tome imágenes adicionales en varios puntos de tiempo o en una sola imagen de punto final, según el diseño del estudio. Por ejemplo, la obtención de imágenes cada 10 minutos dará como resultado cursos de tiempo de alta resolución o cada 6-12 h para rastrear los movimientos celulares periódicos.
- Perfusión de dextrano
- Tinción inmunofluorescente (IF)
- Aspirar medios de los pocillos. Agregue 200 μL de PFA al 4% a ambos pocillos del lado superior de cada unidad de dispositivo y 50 μL al lado bajo. Deje que el PFA fluya a través de las cámaras durante 15 minutos a temperatura ambiente o 30 minutos a 4 °C.
- Durante la incubación, prepare una placa de 24 pocillos con 500 μL de 1x PBS por pocillo. Calcule cuántos pocillos se necesitan para teñir cada dispositivo.
- Elimine completamente el PFA de los pozos. Dale la vuelta a la placa y retira con cuidado el respaldo de plástico de la membrana.
NOTA: La tinción IF también se puede realizar in situ sin quitar la membrana y el dispositivo. Para ello, realice los pasos de tinción mediante la perfusión de reactivos a través del VMO/VMT y aumente la duración de cada paso de incubación en aproximadamente 6 veces. - Retire con mucha suavidad y cuidado la capa inferior de la membrana de la capa característica del dispositivo para exponer las cámaras de tejido agarrando ambas esquinas y tirando hacia abajo con un movimiento lento y suave. La mayor parte del tejido debe permanecer en la cámara tisular. Consulte la Figura 3A.
- Utilice una cuchilla de afeitar o un bisturí para aplicar la fuerza suficiente para cortar completamente la capa de entidades y corte un pequeño rectángulo alrededor de cada unidad de dispositivo individual, como se muestra en la Figura 3B.
- Coloque una espátula entre la capa de características y la placa de pocillos. Aplique una presión suave debajo de la capa de características para eliminar con cuidado toda la capa de entidades que contiene la cámara de tejido de la placa de pocillos.
- Coloque cada pieza rectangular de la capa de entidades PDMS que contiene el tejido boca abajo en un solo pocillo que contenga PBS.
- Una vez que todas las unidades estén en los pocillos, lávese con PBS colocando la placa en un balancín suave durante 5 minutos, aspirando PBS del pocillo y reemplazándolo con 500 μL de PBS fresco. Repita para un total de 3 lavados.
- Aspirar PBS de cada pocillo y permeabilizar los tejidos con 500 μL de Triton-X al 0,5% en PBS, 2 veces durante 10 minutos cada una en un balancín suave. Retire la solución de permeabilización.
- Bloquee 500 μL de suero al 10 % en Triton-X al 0,1 % por dispositivo durante 1 h a temperatura ambiente con un balanceo suave.
- Diluir los anticuerpos primarios en suero al 3% en Triton-X al 0,1% hasta la concentración y el volumen deseados. Retire la solución de bloqueo y agregue suficiente solución de anticuerpos primarios para cubrir completamente el fondo de cada pocillo y permitir el libre movimiento de los tejidos del dispositivo (~ 200 μL). Cubra el plato con una película transparente.
- Incubar la placa meciéndose durante la noche a 4 °C. Al día siguiente, vuelva a colocar la placa que contiene los pañuelos del dispositivo a temperatura ambiente (~15 min).
- Aspire la solución de anticuerpos primarios de cada pocillo y lave las cámaras con 500 μL de PBS, 3 veces durante 5 minutos cada una en un balancín suave.
- Añadir 200 μL de anticuerpo secundario en suero al 3% en Triton-X al 0,1% a la concentración deseada. Incubar la placa con un balanceo suave durante 1 h a temperatura ambiente en la oscuridad.
- Aspire la solución de anticuerpos secundarios y lávese con PBS, 3 veces durante 5 minutos cada una con un balanceo suave. Añade una solución de 1x DAPI en Triton-X al 0,1% durante 10 minutos mientras te meces en la oscuridad.
- Retire los recortes rectangulares del dispositivo que contienen pañuelos manchados del plato con unas pinzas y colóquelos con el pañuelo hacia arriba sobre una toalla de papel.
- Pipetear unos pocos μL (~10 μL) de solución antidecoloración directamente en cada cámara y cubreobjetos, teniendo cuidado de no introducir burbujas. Deje que el antidecoloración se cure en las cámaras durante la noche a temperatura ambiente en la oscuridad y luego proceda con la obtención de imágenes.
- Aislamiento de tejidos y células para ensayos moleculares
NOTA: Cada placa de alto rendimiento contendrá aproximadamente 1-2 x 105 celdas, dependiendo del momento de la cosecha. Escale el número de réplicas experimentales para tener en cuenta el total de células, así como la posible pérdida durante la recolección.- Análisis de una sola célula
- Aspire los medios de cada pocillo e invierta la placa de alto rendimiento de modo que la capa del dispositivo quede hacia arriba.
- Retire el respaldo de plástico de la membrana. Retire con mucha suavidad y cuidado la membrana inferior del PDMS de la capa característica del dispositivo para exponer las cámaras de tejido agarrando ambas esquinas y tirando hacia abajo con un movimiento lento y suave.
- La membrana se puede quitar incluso con una unión adecuada. La mayor parte del tejido debe permanecer en la cámara tisular después de retirar la membrana; Sin embargo, si alguna parte está pegada a la membrana, siga los pasos a continuación en la membrana.
- Lave cada unidad de dispositivo con 500 μL de HBSS o PBS. A cada unidad del dispositivo, agregue 100 μL de reactivo de disociación y deje que se asiente como una gota en la parte superior del dispositivo. Vuelva a colocar la placa en la incubadora a 37 °C durante 5 min.
- Después de la digestión, utilice una pipeta P200 para pipetear hacia arriba y hacia abajo a través de las cámaras de tejido y recoger los tejidos en el reactivo de disociación. Mueva la punta de la pipeta hacia adelante y hacia atrás a través de cada dispositivo para garantizar la eliminación completa del tejido y recójalo en un cónico de 15 ml con 500 μl de EGM2 para neutralizar el reactivo de disociación.
- Para la eliminación completa de las células restantes de la cámara de tejido, agregue 500 μL de EGM2 a cada unidad del dispositivo y lave con una pipeta P200.
- Centrifugar la solución de digestión que contiene los tejidos desprendidos a 300 x g durante 5 min a 4 °C para granular células individuales y tejidos enteros.
- Aspire cuidadosamente los medios y agregue 500 μL de 1 mg/ml (200 U/mL) de colagenasa tipo IV, 0,1 mg/ml de hialuronidasa tipo V y 200 U/ml de ADNasa tipo IV en HBSS a los tejidos.
- Después de una resuspensión suave, deje reposar la solución durante 2 minutos a temperatura ambiente antes de pipetear suavemente nuevamente para disociar el gel.
- Lavar la mezcla de digestión con 10 mL de EGM2 y centrifugar a 300 x g durante 5 min a 4 °C. Vuelva a suspender las células en 1x DPBS con BSA o HSA al 1% y páselas a través de un filtro prehumedecido de 70 μm girando a 200 x g durante 1 min.
- Cuente las células y ajuste el volumen para que la concentración final sea de 1000 células por μL. Las suspensiones celulares se pueden someter a FACS, citometría de flujo o secuenciación de ARN de una sola célula.
- Aislamiento de ARN de tejidos enteros
- Siga los pasos 4.4.1.1 y 4.4.1.2 anteriores.
- Agregue aproximadamente 10 μL de tampón de lisis de ARN en cada cámara de tejido expuesta, asegurando que el tampón se acumule directamente sobre los tejidos. No utilice más de 100 μL de tampón de lisis de ARN en total.
- Incubar durante 3 minutos a temperatura ambiente. Utilice el P20 para pipetear hacia arriba y hacia abajo en cada unidad del dispositivo y utilice la punta de la pipeta para raspar cualquier material residual de la cámara de tejido si es necesario.
- Transfiera la mayor cantidad posible de tampón de lisis a un tubo de microcentrífuga de 1,5 ml. Repita los pasos 4.4.2.2.-4.4.2.3. para el resto de los dispositivos y agrupar las muestras en el tubo de 1,5 ml.
- Siga las instrucciones del fabricante para aislar el ARN, según el kit o los reactivos.
- Análisis de una sola célula

Figura 3. Preparación de la plataforma para la inmunotinción. (A) Esquema de la plataforma del dispositivo completamente ensamblada con la capa de membrana en la parte superior. Para quitar la membrana, tire con cuidado de cada esquina de la capa exterior hacia abajo con un movimiento constante y suave. (B) Una vez que la capa de membrana se haya eliminado por completo, use una cuchilla, bisturí o cuchillo para cortar rectángulos alrededor de la cámara de tejido de cada unidad del dispositivo, teniendo cuidado de no cortar el tejido en sí. A continuación, se puede colocar una espátula debajo de cada rectángulo para desalojarlo de la placa y colocar cada unidad en un solo pocillo de una placa de 24 pocillos con PBS para teñir. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Siguiendo los protocolos descritos aquí, los VMO y VMT se establecieron utilizando EC, NHLF y, para VMT, la línea celular de cáncer de mama triple negativo MDA-MB-231 adquirida comercialmente. Los VMO establecidos también se perfundieron con células cancerosas para imitar la metástasis. En cada modelo, en el día 5 de cocultivo, una red vascular se autoensambla en respuesta al flujo impulsado por la gravedad a través de la cámara de tejido, sirviendo como un conducto para la entrega in vivo de nutrientes, terapias y células cancerosas o inmunitarias al nicho estromal (Figura 4). Las VMO se establecieron por primera vez mediante la introducción de CE marcada con mCherry en la cámara tisular, como se muestra en la Figura 4A (día 0 de cultivo), con una distribución uniforme de las células. En el día 2 del cultivo de VMO, las CE comienzan a estirarse y a iluminarse (Figura 4B), y en el día 4, las CE se han anastomosado con los canales microfluídicos externos y forman una red vascular continua (Figura 4C). Después de que la vasculatura formara anastomosis y recubriera los canales externos, el tejido VMO se perfundió con 70 kD de FITC-dextrano para confirmar la permeabilidad vascular (Figura 4D). El FITC-dextrano se introdujo en el depósito de medios con la presión hidrostática más alta y se dejó perfundir a través de la cámara tisular a través de microvasos desde el lado de alta presión hasta el lado de baja presión, como lo indican las flechas. En el VMO, el FITC-dextrano perfundió completamente la red microvascular en 15 minutos con una fuga vascular mínima, lo que confirmó una función de barrera vascular ajustada (Figura 4E). A continuación, las células MDA-MB-231 se perfundieron en VMO, donde las células se adhirieron al revestimiento endotelial (Figura 4F) y se extravasaron al espacio extravascular dentro de las 24 h posteriores a la perfusión, formando múltiples micrometástasis dentro de la cámara tisular (Figura 4G). Se tomaron imágenes fluorescentes microscópicas de lapso de tiempo cada 50 ms con objetivos de aire de 4x y 10x en un microscopio confocal invertido para observar las células cancerosas que se perfunden a través de la microvasculatura en tiempo real (Video complementario 1, Video complementario 2).
En el VMO, se puede ver que las células T se extravasan en el espacio extracelular en el transcurso de 45 minutos (Figura 4H-I). Se tomaron micrografías fluorescentes de lapso de tiempo en un microscopio confocal para adquirir una pila z de 150 μm de profundidad cada 15 minutos para observar la extravasación de células T en tiempo real (Video complementario 3). Como se muestra en la Figura 4J, el VMT MDA-MB-231 con vasos completamente formados y sin fugas se perfundió con células T (amarillo), muchas de las cuales se adhirieron rápidamente a la pared vascular (puntas de flecha; Figura 4K, Video complementario 4, Video complementario 5). Estos resultados, sumados a estudios previos 8,9,10,11,12,13,14,15, demuestran la utilidad de las plataformas VMO y VMT para la investigación en inmunología e inmuno-oncología, respectivamente.
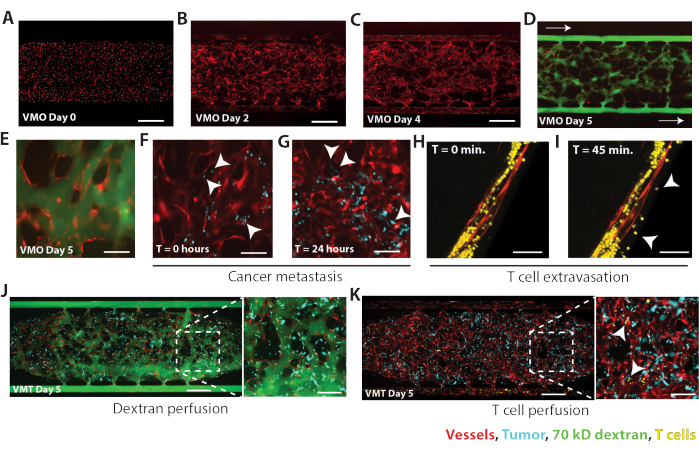
Figura 4. Resultados representativos para MDA-MB-231 VMT y VMO. (A) VMO en el día 0 inmediatamente después de cargar las células en la cámara tisular. EC se muestran en rojo. Barra de escala = 500 μm. (B) Para el día 2 del cultivo de VMO, la CE comienza a estirarse en respuesta al flujo. (C) El día 4 de VMO muestra que la red vascular está anastomosada con los canales microfluídicos externos y los vasos están casi maduros. (D) Las redes VMO están completamente perfundidas y patentadas en el día 5 de cultivo. Los recipientes se muestran en rojo, 70 kD FITC-dextrano verde. La dirección del flujo se indica con flechas. Barra de escala = 500 μm. (E) Vista de zoom de VMO perfundido. Barra de escala = 100 μm. (F) MDA-MB-231 (cian) se perfunde a través de la misma red VMO que se muestra en E y, en el momento 0, las células cancerosas se han adherido al revestimiento de los vasos endoteliales (puntas de flecha). Barra de escala = 100 μm. (G) A las 24 h, las células MDA-MB-231 se han extravasado al espacio extracelular, estableciendo múltiples micrometástasis dentro del nicho vascular. Barra de escala = 100 μm. (H) La microscopía fluorescente confocal de lapso de tiempo revela la extravasación de células T a través de un microvaso dentro del VMO (I) en el transcurso de 45 min. Las puntas de flecha denotan áreas de extravasación. Barra de escala = 50 μm. (J) La línea celular de cáncer de mama triple negativo MDA-MB-231 se establece en el VMT y se perfunde en el día 5. Barra de escala = 500 μm. La red vascular muestra una fuga mínima a los 15 min después de la perfusión (recuadro, barra de escala = 100 μm). (K) MDA-MB-231 VMT (igual que en B) se perfunde con células T (amarillo), con múltiples áreas de adherencia de células T a la pared vascular (puntas de flecha). Barra de escala = 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
Video complementario 1. Perfusión de células cancerosas de ovario en el VMO. Microscopía fluorescente de lapso de tiempo de células COV362 (cian) perfundidas a través de una red vascular (rojo) y obtenidas en imágenes a un objetivo de 4x cada 50 ms durante 1 minuto. Haga clic aquí para descargar este video.
Video complementario 2. Perfusión de células de cáncer de mama triple negativo en el VMO. Microscopía fluorescente de lapso de tiempo de células MDA-MB-231 (cian) perfundidas a través de una red vascular (rojo) y obtenidas en imágenes a 10x objetivo cada 50 ms durante 30 s. Haga clic aquí para descargar este video.
Video complementario 3. Perfusión de células T de VMO. La microscopía fluorescente confocal de lapso de tiempo capturó el proceso de extravasación de células T a través de un microvaso dentro del VMO durante 45 minutos de duración. Las imágenes de la pila Z se obtuvieron cada 15 min, con un tamaño de paso de 2 μm y una profundidad de 150 μm. El vaso es rojo, los linfocitos T son amarillos. Haga clic aquí para descargar este video.
Video complementario 4. Perfusión de células T de VMT. Microscopía fluorescente time-lapse de células T perfundidas a través de MDA-MB-231 VMT a 4x objetivo. Las imágenes se adquirieron cada 50 ms durante 30 s. Las células T se muestran en amarillo, MDA-MB-231 en cian y los vasos/CE en rojo. Haga clic aquí para descargar este video.
Video complementario 5. Vista ampliada de la perfusión de células T-VMT. Vista ampliada de 10x del VMT MDA-MB-231 perfundido con células T (del vídeo complementario 4). Las imágenes se adquirieron cada 50 ms durante 30 s. Las células T se muestran en amarillo, MDA-MB-231 en cian y los vasos/CE en rojo. Haga clic aquí para descargar este video.
Discusión
Casi todos los tejidos del cuerpo reciben nutrientes y oxígeno a través de la vasculatura, lo que la convierte en un componente crítico para el modelado realista de enfermedades y la detección de fármacos in vitro. Además, varias neoplasias malignas y estados patológicos se definen por la disfunción endotelial vascular y la hiperpermeabilidad3. En particular, en el cáncer, la vasculatura asociada al tumor a menudo está mal perfundida, interrumpida y permeable, lo que actúa como una barrera para la entrega de células terapéuticas e inmunitarias al tumor. Además, la vasculatura sirve como un conducto a través del cual las células cancerosas pueden hacer metástasis para sembrar tejidos distantes y facilita las comunicaciones célula-célula que amortiguan la respuesta inmunitaria al tiempo que promueven aún más el crecimiento y la diseminación de las células cancerosas. Estos fenómenos ponen de relieve el papel crucial que desempeña el nicho vascular en la resistencia terapéutica y la progresión del cáncer, así como la necesidad de modelar con precisión el microambiente tumoral durante el estudio preclínico. Sin embargo, los sistemas modelo in vitro estándar no incluyen componentes estromales y vasculares apropiados ni incorporan condiciones de flujo dinámico. Para abordar estas deficiencias en los sistemas modelo actuales, se presentaron métodos para establecer un sistema microfisiológico bien caracterizado que apoye la formación de un microtumor humano vivo y perfundido (VMT) para la investigación de oncología fisiológica. Es importante destacar que el VMT modela las características clave de los vasos aberrantes asociados al tumor y las interacciones tumor-estroma, lo que lo hace ideal para el modelado biomimético de enfermedades y las pruebas de eficacia terapéutica10.
Para facilitar su uso, la plataforma no requiere bombas ni válvulas externas y, gracias al formato de placa de 96 pocillos, puede adaptarse a los equipos de cultivo y flujos de trabajo estándar. Además, se han validado diferentes iteraciones de dispositivos para abordar distintas cuestiones biológicas y compartimentos específicos establecidos para tejidos y pacientes 8,9,10,11,12,13,14,15,16,17 . Si bien la plataforma se puede adaptar a prácticamente cualquier uso específico de órganos o tejidos mediante la integración de varios tipos de células, primero se debe probar el crecimiento y la capacidad vasculogénica de las células dentro del VMO/VMT a concentraciones celulares variables para determinar la densidad de siembra óptima y las condiciones de cocultivo. Para establecer la vasculatura, las células endoteliales derivadas de células derivadas de colonias endoteliales humanas (ECFC-EC) pueden comprarse comercialmente o recién aisladas de la sangre del cordón umbilical seleccionando células CD31+. Las células endoteliales de la vena umbilical humana (HUVEC) también se pueden utilizar para establecer la vasculatura dentro del VMO/VMT y pueden comprarse comercialmente o recién aisladas de los cordones umbilicales. Además, las células endoteliales derivadas de células madre pluripotentes inducidas (iPSC-EC) se han probado con éxito en la plataforma, lo que abre la posibilidad de un sistema completamente autólogo18. Los fibroblastos de origen comercial (fibroblastos pulmonares humanos normales estándar por su potencial vasculogénico) funcionan bien en el VMO/VMT, y algunas poblaciones de células estromales derivadas primarias también pueden incorporarse o sustituirse. Los tumores de origen primario se pueden introducir en el VMT como células individuales, esferoides, organoides o trozos tumorales. La composición de la matriz puede modificarse de acuerdo con las necesidades experimentales, incluyendo la adición de colágenos, laminina, fibronectina o incluso matrices de tejido descelularizado19.
El protocolo incluye varios pasos críticos en los que es esencial tener especial cuidado para evitar problemas comunes (Figura 5). Durante la carga, asegúrese de que la mezcla homogénea de la célula/suspensión de fibrina se realice un pipeteo cuidadoso y se introduzca suavemente en la cámara de tejido (Figura 5A). Aplique la presión adecuada para expulsar el gel completamente dentro de la cámara para evitar una carga parcial (Figura 5B). La visualización de la suspensión de células/fibrina atravesando toda la cámara de tejido es necesaria para garantizar el llenado completo de la cámara y puede facilitarse colocando un dedo enguantado detrás de la unidad del dispositivo. Evite presionar demasiado fuerte el émbolo de la micropipeta para evitar que la mezcla de célula y fibrina explote en los canales microfluídicos (Figura 5C). Se debe tener cuidado de no introducir burbujas de aire durante el pipeteo para evitar interferencias con el desarrollo del tejido y las aplicaciones posteriores (Figura 5D). La velocidad adecuada de mezcla y carga es crucial para evitar áreas de coagulación inconsistente (Figura 5E), mientras que la extracción prematura de la punta de la pipeta también puede alterar el gel en la cámara (Figura 5F). Se recomienda practicar las cargas para familiarizar a los usuarios con el elemento cronometrado del procedimiento y el paso de carga. Además, la introducción adecuada de laminina en los canales microfluídicos es crucial para la migración de la CE, la anastomosis con los canales externos y la formación de una red continua y perfusible para el suministro de nutrientes. El revestimiento incompleto o ausente del canal conducirá a resultados de perfusión deficientes y VMO/VMT inutilizable.
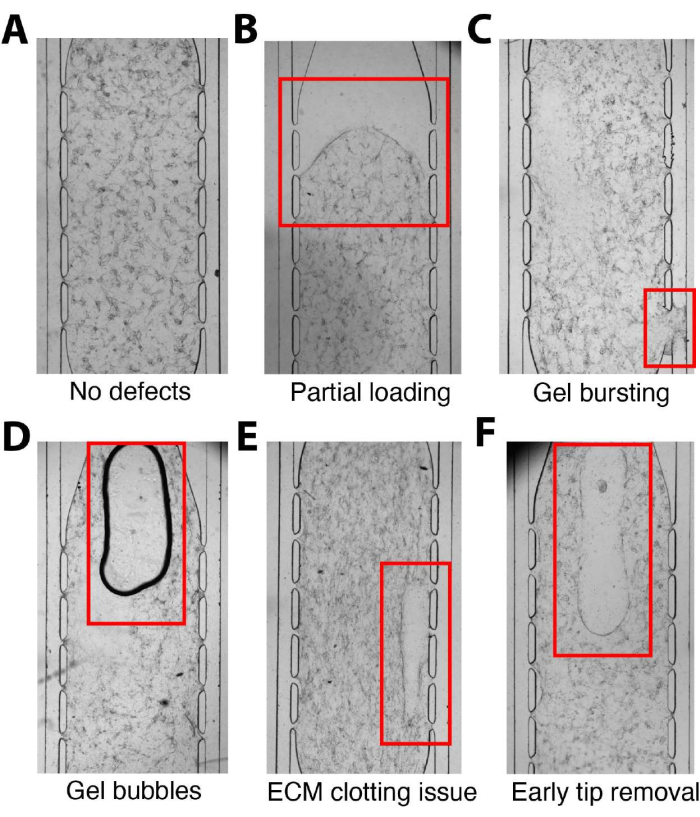
Figura 5. Errores comunes con la carga. (A) Unidad de dispositivo microfluídico correctamente cargada sin defectos. (B) La mezcla de celda y fibrina no se introdujo completamente en la cámara, lo que resultó en una carga parcial. (C) Se aplica demasiada presión durante la carga, lo que hace que el gel estalle en el canal microfluídico, bloqueando el flujo. (D) Burbujas de aire introducidas en la mezcla de celda y fibrina dentro de la cámara durante el pipeteo. (E) Mezcla inadecuada de la mezcla de célula / fibrina o carga lenta que causa inconsistencias en la coagulación. (F) Retirar la punta de la pipeta del puerto de carga antes de que el gel se haya fraguado lo suficiente provocará la interrupción de la mezcla de células/fibrina en la cámara de tejidos. Haga clic aquí para ver una versión más grande de esta figura.
Los flujos de trabajo robustos y estandarizados para el análisis son cruciales en los estudios VMO/VMT, ya que generan cantidades sustanciales de datos de imágenes. El procesamiento de imágenes y los métodos analíticos para VMO/VMT se han descrito anteriormente 8,9,10,11,12,13. Para el análisis cuantitativo tumoral, la intensidad fluorescente en el canal de color que representa las células tumorales se mide utilizando software de código abierto como ImageJ/Fiji (National Institute of Health)20 o CellProfiler (Broad Institute)21. El umbral de las imágenes micrográficas tumorales se establece para seleccionar la región tumoral fluorescente y se mide la intensidad media de fluorescencia dentro de esa región. La intensidad fluorescente total del tumor se calcula como el producto del área fluorescente y su intensidad media, normalizada a valores basales (pretratamiento) para obtener el cambio de pliegue en el crecimiento tumoral por dispositivo durante el período experimental. En cuanto al análisis cuantitativo de los vasos, se pueden utilizar AngioTool (Instituto Nacional del Cáncer)22, los macroscripts de ImageJ/Fiji o el software de MATLAB, como REAVER23, para cuantificar la longitud total de los vasos, el número de criterios, el número de uniones, la longitud media de los vasos, el diámetro de los vasos, la lacunaridad media y el área porcentual de los vasos. Los algoritmos de aprendizaje automático se pueden integrar en los flujos de trabajo para el análisis automático de imágenes vasculares con el fin de identificar compuestos que alteran eficazmente la vasculatura24. Las imágenes de perfusión se analizan midiendo el cambio en la intensidad de la fluorescencia dentro de las regiones del espacio extracelular y calculando el coeficiente de permeabilidad10. Las simulaciones de elementos finitos del flujo intraluminal dentro de una red microvascular se pueden realizar utilizando COMSOL Multiphysics25. La implementación de métodos analíticos estandarizados es fundamental para extraer información significativa de la gran cantidad de datos generados en los estudios VMT.
El protocolo descrito aquí permitirá al usuario aprovechar la plataforma VMO/VMT para estudiar muchos aspectos de la biología tumoral, incluido el crecimiento/progresión tumoral, la metástasis tumoral, la dinámica de las células T intratumorales y la respuesta tumoral a la quimioterapia y el tratamiento antiangiogénico. Para permitir estudios inmuno-oncológicos fisiológicamente relevantes, se demostró cómo las células T recién aisladas se perfunden a través de la microvasculatura, se extravasan a través de la barrera de células endoteliales y migran a la construcción del tejido. Las imágenes confocales microscópicas de lapso de tiempo se presentaron como una herramienta para ver eventos espacialmente aleatorios y temporalmente rápidos, incluida la extravasación de células T, que no se visualizan fácilmente con otros sistemas modelo. Además, hemos probado previamente múltiples tipos de fármacos antineoplásicos en el VMT, incluidos quimioterápicos, inhibidores de moléculas pequeñas/tirosina quinasa, anticuerpos monoclonales (como anti-PD1 y bevacizumab), compuestos antiangiogénicos y agentes estabilizadores vasculares, lo que subraya cómo la plataforma se puede utilizar para probar diferentes clases de fármacos dirigidos tanto al tumor como al estroma asociado. 9,10,11,12,13. El efluente se puede recolectar de la plataforma y analizar en busca de varias citoquinas, así como exosomas. En estudios futuros, la plataforma VMT se puede utilizar para evaluar la sensibilidad de las células tumorales al ataque mediado por células T a nivel de paciente individual. En conclusión, el VMT es una plataforma flexible y potente e ideal para estudiar la biología tumoral, donde la remodelación de los componentes vasculares y estromales es clave para la progresión tumoral.
Divulgaciones
CCWH tiene una participación accionaria en Aracari Biosciences, Inc., que está comercializando una versión de la tecnología descrita en este documento. Los términos de este acuerdo han sido revisados y aprobados por la Universidad de California, Irvine, de acuerdo con sus políticas de conflicto de intereses. No hay otros conflictos de intereses.
Agradecimientos
Agradecemos a los miembros del laboratorio del Dr. Christopher Hughes por su valiosa contribución a los procedimientos descritos, así como a nuestros colaboradores en el laboratorio del Dr. Abraham Lee por su ayuda con el diseño y la fabricación de la plataforma. Este trabajo contó con el apoyo de las siguientes subvenciones: UG3/UH3 TR002137, R61/R33 HL154307, 1R01CA244571, 1R01 HL149748, U54 CA217378 (CCWH) y TL1 TR001415 y W81XWH2110393 (SJH).
Materiales
| Name | Company | Catalog Number | Comments |
| Fabrication | |||
| (3-Mercaptopropyl)trimethoxysilane, 95% | Sigma-Aldrich | 175617-100G | |
| Greiner Bio-One μClear Bottom 96-well Polystyrene Microplates | Greiner Bio-One | 655096 | |
| Methanol ≥99.8% ACS | VWR Chemicals BDH | BDH1135-1LP | |
| MILTEX Sterile Disposable Biopsy Punch with Plunger, 1mm diameter, | Integra Miltex | 33-31AA-P/25 | |
| PDMS membrane | PAX Industries | HT-6240 | |
| Plasma Cleaner PDC-001 | Harrick Plasma | N/A | |
| Smooth-Cast 385 | Smooth-On | N/A | |
| SP Bel-Art Lab Companion Clear Polycarbonate Cabinet Style Vacuum Desiccator | Bel-Art | F42400-4031 | |
| Standard Lids with Condensation Rings, 96-well plate | VWR | 82050-827 | |
| SYLGARD 184 Silicone Elastomer Kit (PDMS) | Dow | 4019862 | |
| Cell culture/Loading | |||
| BioTek Lionheart FX Automated Microscope | Agilent | CYT5MFAW | |
| CELLvo Human Endothelial Progenitor Cells | StemBioSys | N/A | |
| Collagen I, rat tail | Enzo Life Sciences | ||
| Collagenase from Clostridium histolyticum (type 4) | Sigma-Aldrich | C5138 | |
| Corning Hank’s Balanced Salt Solution, 1X without calcium and magnesium | Corning | 21-021-CV | |
| Corning DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10013CV | |
| DAPI | Sigma-Aldrich | D9542 | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| EGM-2 Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Fibrinogen from bovine plasma | Neta Scientific | SIAL-341573 | |
| Fibronectin human plasma | Sigma-Aldrich | F0895 | |
| Fluorescein isothiocyanate–dextran (70kDa) | Sigma-Aldrich | FD70S-1G | |
| Gelatin from porcine skin | Sigma-Aldrich | G1890 | |
| Hyaluronidase from sheep testes (type 4) | Sigma-Aldrich | H6254 | |
| Laminin Mouse Protein | Gibco | 23017015 | |
| Leica TCS SP8 | Leica | N/A | |
| MDA-MB-231 | ATCC | HTB-26 | |
| NHLF – Normal Human Lung Fibroblasts | Lonza | CC-2512 | |
| Nikon Eclipse Ti | Nikon | N/A | |
| Paraformaldehyde 4% in 0.1M Phosphate BufferSaline, pH 7.4 | Electron Microscopy Sciences | 15735-90-1L | |
| PBMCs - Peripheral blood mononuclear cells | Lonza | CC-2702 | |
| PBS, pH 7.4 | Gibco | 10010049 | |
| Premium Grade Fetal Bovine Serum (FBS), Heat Inactivated | Avantor Seradigm | 97068-091 | |
| ProLong Gold Antifade Mountant | Invitrogen | P10144 | |
| Quick-RNA Microprep Kit | Zymo Research | R1051 | |
| Thrombin from bovine plasma | Sigma-Aldrich | T4648 | |
| Triton X-100 (Electrophoresis), | Fisher BioReagents | BP151-100 | |
| TrypLE Express Enzyme (1X), phenol red | Gibco | 12605028 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300062 | |
| Vasculife | Lifeline Cell Technology | LL-0003 |
Referencias
- Siegel, R. L., Miller, K. D., Wagle, N. S., Jemal, A. Cancer statistics, 2023. CA Cancer J Clin. 73 (1), 17-48 (2023).
- Hachey, S. J., Hughes, C. C. W. Applications of tumor chip technology. Lab Chip. 18 (19), 2893-2912 (2018).
- Ewald, M. L., Chen, Y. H., Lee, A. P., Hughes, C. C. W. The vascular niche in next generation microphysiological systems. Lab Chip. 21 (17), 3615-3616 (2021).
- Osaki, T., Sivathanu, V., Kamm, R. D. Vascularized microfluidic organ-chips for drug screening, disease models and tissue engineering. Curr Opin Biotechnol. 52, 116-123 (2018).
- Shirure, V. S., Hughes, C. C. W., George, S. C. Engineering vascularized organoid-on-a-chip models. Annu Rev Biomed Eng. 23, 141-167 (2021).
- Del Piccolo, N., et al. Tumor-on-chip modeling of organ-specific cancer and metastasis. Adv Drug Deliv Rev. 175, 113798 (2021).
- Sontheimer-Phelps, A., Hassell, B. A., Ingber, D. E. Modelling cancer in microfluidic human organs-on-chips. Nat Rev Cancer. 19 (2), 65-81 (2019).
- Sobrino, A., et al. 3D microtumors in vitro supported by perfused vascular networks. Sci Rep. 6, 31589 (2016).
- Phan, D. T. T., et al. A vascularized and perfused organ-on-a-chip platform for large-scale drug screening applications. Lab Chip. 17 (3), 511-520 (2017).
- Hachey, S. J., et al. An in vitro vascularized micro-tumor model of human colorectal cancer recapitulates in vivo responses to standard-of-care therapy. Lab Chip. 21 (7), 1333-1351 (2021).
- Hachey, S. J., et al. A Human Vascularized Micro-Tumor Model of Patient-Derived Colorectal Cancer Recapitulates Clinical Disease. Transl Res. 255, 97-108 (2023).
- Liu, Y., et al. Human in vitro vascularized micro-organ and micro-tumor models are reproducible organ-on-a-chip platforms for studies of anticancer drugs. Toxicology. 445, 152601 (2020).
- Jahid, S., et al. Structure-based Design of CDC42 Effector Interaction Inhibitors for the Treatment of Cancer. Cell Rep. 39 (4), 110760 (2022).
- Hsu, Y. H., Moya, M. L., Hughes, C. C. W., George, S. C., Lee, A. P. A microfluidic platform for generating large-scale nearly identical human microphysiological vascularized tissue arrays. Lab Chip. 13 (15), 2990-2998 (2013).
- Moya, M. L., Hsu, Y. H., Lee, A. P., Christopher, C. W. H., George, S. C. In vitro perfused human capillary networks. Tissue Eng - Part C: Methods. 19 (9), 730-737 (2013).
- Wang, X., et al. An on-chip microfluidic pressure regulator that facilitates reproducible loading of cells and hydrogels into microphysiological system platforms. Lab Chip. 16 (5), 868-876 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Exp Biol Med. 242 (17), 1669-1678 (2017).
- Kurokawa, Y. K., et al. Human induced pluripotent stem cell-derived endothelial cells for three-dimensional microphysiological systems. Tissue Eng Part C: Methods. 23 (8), 474-484 (2017).
- Romero-López, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Carpenter, A. E., et al. CellProfiler: Image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Zudaire, E., Gambardella, L., Kurcz, C., Vermeren, S. A computational tool for quantitative analysis of vascular networks. PLoS one. 6 (11), e27385 (2011).
- Corliss, B. A., et al. REAVER: A program for improved analysis of high-resolution vascular network images. Microcirculation. 27 (5), e12618 (2020).
- Urban, G., et al. Deep learning for drug discovery and cancer research: Automated analysis of vascularization images. IEEE/ACM Trans Comput Biol Bioinform. 16 (3), 1029-1035 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados