Method Article
Visualizzazione della microscopia elettronica a scansione di microdissezione e montaggio intero del plesso coroideo del topo
In questo articolo
Riepilogo
Il plesso coroideo (CP), un tessuto poco studiato nelle neuroscienze, svolge un ruolo chiave nella salute e nella malattia del sistema nervoso centrale. Questo protocollo descrive una tecnica di microdissezione per isolare il CP e l'uso della microscopia elettronica a scansione per ottenere una visione d'insieme della sua struttura cellulare.
Abstract
Il plesso coroideo (CP), una struttura altamente vascolarizzata che sporge nei ventricoli del cervello, è uno dei tessuti più poco studiati nelle neuroscienze. Poiché sta diventando sempre più chiaro che questa piccola struttura svolge un ruolo cruciale nella salute e nella malattia del sistema nervoso centrale (SNC), è della massima importanza sezionare correttamente il CP dai ventricoli cerebrali in modo da consentire l'elaborazione a valle, che va dall'analisi funzionale a quella strutturale. Qui viene descritto l'isolamento del CP del topo del ventricolo cerebrale laterale e del quarto senza la necessità di strumenti o attrezzature specializzate. Questa tecnica di isolamento preserva la vitalità, la funzione e la struttura delle cellule all'interno del CP. A causa della sua elevata vascolarizzazione, la CP può essere visualizzata fluttuante all'interno delle cavità ventricolari del cervello utilizzando un microscopio binoculare. Tuttavia, la perfusione transcardica necessaria per l'analisi a valle può complicare l'identificazione del tessuto CP. A seconda delle ulteriori fasi di elaborazione (ad esempio, analisi dell'RNA e delle proteine), questo può essere risolto visualizzando la CP tramite perfusione transcardica con blu di bromofenolo. Dopo l'isolamento, la CP può essere elaborata utilizzando diverse tecniche, tra cui RNA, proteine o analisi di singole cellule, per ottenere ulteriori informazioni sulla funzione di questa speciale struttura cerebrale. Qui, la microscopia elettronica a scansione (SEM) su CP a montaggio intero viene utilizzata per ottenere una visione d'insieme della struttura.
Introduzione
Barriere strette separano il sistema nervoso centrale (SNC) dalla periferia, compresa la barriera emato-encefalica (BBB) e la barriera sangue-liquido cerebrospinale (CSF). Queste barriere proteggono il SNC dagli insulti esterni e garantiscono un microambiente equilibrato e controllato 1,2,3. Mentre la BBB è stata ampiamente studiata nel tempo, la barriera emato-liquorale situata nel plesso coroideo (CP) ha guadagnato solo un crescente interesse di ricerca nell'ultimo decennio. Quest'ultima barriera può essere trovata nei quattro ventricoli del cervello (Figura 1A, B) ed è caratterizzata da un singolo strato di cellule epiteliali del plesso coroideo (CPE) che circondano uno stroma centrale, capillari permeabili, fibroblasti e una popolazione di cellule linfoidi e mieloidi (Figura 1C)4,5,6. Le cellule CPE sono saldamente interconnesse da giunzioni strette, impedendo così la fuoriuscita dai capillari sanguigni fenestrati sottostanti nel liquido cerebrospinale e nel cervello. Inoltre, il trasporto attraverso le cellule CPE è regolato da una serie di sistemi di trasporto verso l'interno e verso l'esterno che gestiscono l'afflusso di composti benefici (ad esempio, nutrienti e ormoni) dal sangue al liquido cerebrospinale e l'efflusso di molecole nocive (ad esempio, rifiuti metabolici, neurotrasmettitori in eccesso) nella direzione opposta 1,6. Per essere in grado di esercitare la loro funzione di trasporto attivo, le cellule CPE contengono numerosi mitocondri nel loro citoplasma7. Inoltre, il CP è la principale fonte di CSF e agisce come il guardiano del cervello dalla presenza di cellule infiammatorie residenti1. Grazie alla sua posizione unica tra il sangue e il cervello, il CP è anche perfettamente posizionato per effettuare la sorveglianza immunitaria8.
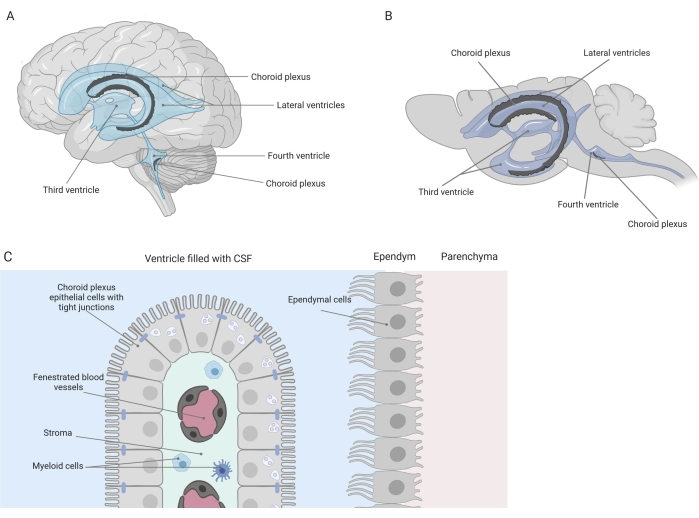
Figura 1: Panoramica schematica della posizione e della composizione del plesso coroideo (CP). (A,B) Il tessuto CP si trova all'interno dei due ventricoli laterali, terzi e quarti del cervello (A) umano e (B) del topo. (C) Il tessuto CP è costituito da un singolo strato di cellule dell'epitelio CP cuboide (CPE) strettamente connesse che circondano i capillari fenestrati, il tessuto connettivo sciolto e le cellule linfoidi e mieloidi, e forma la barriera emato-liquido cerebrospinale (adattata e modificata dal riferimento23). Figura creata con Biorender.com. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Negli ultimi dieci anni, prove crescenti, tra cui diversi rapporti del nostro gruppo di ricerca, hanno rivelato che il CP svolge un ruolo centrale nella salute e nella malattia 9,10,11,12,13,14,15,16,17,18 . Ad esempio, è noto che la barriera emato-CSF che invecchia mostra alterazioni morfologiche, tra gli altri, nei nuclei, nei microvilli e nella membrana basale 1,19. Inoltre, nel contesto della malattia di Alzheimer, l'integrità complessiva della barriera è compromessa e tutti questi cambiamenti legati all'età sembrano essere ancora più pronunciati 1,8,20. Oltre ai cambiamenti morfologici, il trascrittoma, il proteoma e il secretoma della CP sono alterati durante la malattia 12,21,22,23. Pertanto, la conoscenza avanzata della CP è essenziale per comprendere meglio il suo ruolo nelle malattie neurologiche e potenzialmente sviluppare nuove strategie terapeutiche.
Un metodo efficiente per una microdissezione accurata del CP dai ventricoli cerebrali è il primo passo inestimabile per consentire una corretta indagine di questa piccola struttura cerebrale. A causa della sua natura altamente vascolarizzata (Figura 2B), il CP fluttuante all'interno delle cavità ventricolari del cervello può essere identificato utilizzando un microscopio binoculare. Tuttavia, la perfusione transcardica è spesso richiesta per l'analisi a valle, complicando la corretta identificazione e isolamento del tessuto CP (Figura 2C). Se le ulteriori fasi di elaborazione lo consentono (ad esempio, nel caso dell'analisi dell'RNA e delle proteine), la CP può essere visualizzata tramite perfusione transcardica con blu di bromofenolo (Figura 2A). Diverse pubblicazioni descrivono già l'isolamento del CP dal cervello del ratto24 e del topo25. Qui, viene descritta una tecnica di isolamento della microdissezione per isolare il CP dai topi adulti. È importante sottolineare che questa tecnica di isolamento preserva la vitalità, la funzione e la struttura delle cellule all'interno del CP. L'isolamento del CP galleggiante nel quarto ventricolo laterale è descritto qui. In breve, i topi sono anestetizzati terminalmente e, se necessario, perfusi transcardialmente. Tuttavia, va notato che la perfusione può danneggiare la struttura delle cellule all'interno del CP. Di conseguenza, se il campione deve essere analizzato utilizzando la microscopia elettronica a trasmissione (TEM), la microscopia elettronica a scansione a blocchi seriali (SBF-SEM) o il fascio ionico focalizzato SEM (FIB-SEM), la perfusione non deve essere eseguita. Successivamente, l'intero cervello è isolato e il forcipe viene utilizzato per emisecare sagittalmente il cervello. Da qui, i CP che galleggiano nei ventricoli laterali possono essere identificati e sezionati, mentre i CP dal quarto ventricolo possono essere isolati dal lato cerebellare del cervello.
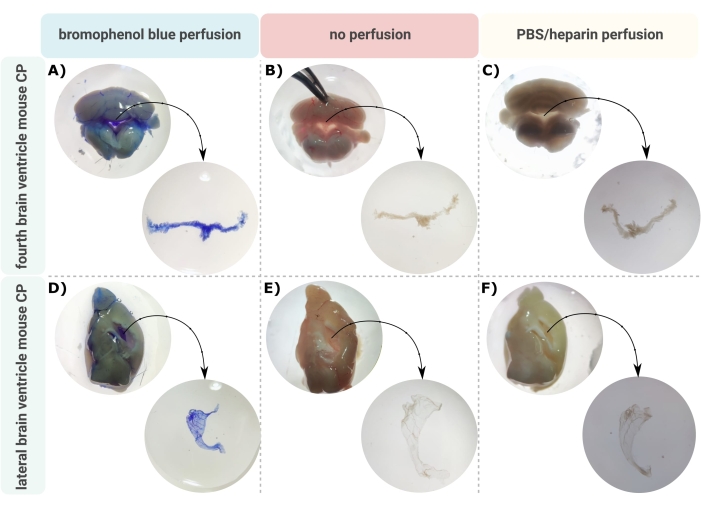
Figura 2: Visualizzazione del quarto plesso coroideo (A-C) e (D-F) ventricolo laterale (CP) dopo (A,D) perfusione blu di bromofenolo, (B,E) nessuna perfusione e (C,F) perfusione con PBS/eparina. Le immagini sono prese con un microscopio stereo (ingrandimento 8x-32x). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Una volta che il CP è correttamente sezionato dai ventricoli cerebrali, un intero repertorio di tecniche può essere applicato per ottenere ulteriori informazioni sulla funzione di questa struttura. Ad esempio, la citometria a flusso o il sequenziamento dell'RNA a singola cellula possono essere eseguiti per quantificare e analizzare fenotipicamente le cellule infiammatorie infiltranti in determinate condizioni di malattia26,27. Oltre alla composizione cellulare, la composizione molecolare del CP può essere analizzata per valutare la presenza di citochine e chemochine tramite saggio immunoassorbente enzimatico (ELISA), immunoblot o attraverso l'analisi simultanea di più citochine utilizzando il citokine bead array28. Inoltre, le analisi del trascrittoma, vascolare, dell'istologia delle cellule immunitarie e del secretoma possono essere eseguite sugli espianti CP microdissecati29. Qui, la microscopia elettronica a scansione (SEM) su CP a montaggio intero viene utilizzata per ottenere una visione d'insieme della struttura CP. SEM utilizza un fascio di elettroni focalizzati per scansionare la superficie e creare un'immagine della topografia e della composizione della superficie. Poiché la lunghezza d'onda degli elettroni è molto più piccola di quella della luce, la risoluzione del SEM è nell'intervallo nanometrico e superiore a quella di un microscopio ottico. Di conseguenza, gli studi morfologici a livello subcellulare possono essere eseguiti tramite SEM. In breve, il CP sezionato viene immediatamente trasferito in un fissativo contenente glutaraldeide per una fissazione notturna, seguita da osmicazione e colorazione dell'acetato di uranile. I campioni vengono quindi trattati con macchie di aspartato di piombo, disidratati e infine incorporati per l'imaging.
Pertanto, questo protocollo facilita l'isolamento efficiente del CP dai ventricoli cerebrali del topo, che può essere ulteriormente analizzato utilizzando una varietà di tecniche a valle per studiarne la struttura e la funzione.
Protocollo
Tutti gli esperimenti sugli animali descritti in questo studio sono stati condotti secondo la legislazione nazionale (legge belga 14/08/1986 e 22/12/2003, regio decreto belga 06/04/2010) ed europea (direttive UE 2010/63/UE, 86/609/CEE). Tutti gli esperimenti su topi e protocolli animali sono stati approvati dal comitato etico dell'Università di Gand (numero di permesso LA1400091 e CE 2017-026).
1. Preparazione
- Anestetici: preparare un anestetico terminale. Ad esempio, può essere preparata una soluzione di pentobarbital di sodio (≥100 mg/kg) in soluzione salina tamponata fosfato (PBS).
- Soluzione di perfusione transcardica: preparare 10 ml (per topo) di soluzione PBS/eparina (contenente eparina allo 0,2%) integrata con blu di bromofenolo allo 0,5%.
NOTA: Se le fasi di elaborazione a valle lo consentono (ad esempio, nel caso dell'analisi dell'RNA e delle proteine), il plesso coroideo (CP) può essere visualizzato tramite perfusione transcardica con blu di bromofenolo. Se il blu di bromofenolo non è compatibile con le ulteriori fasi di elaborazione (ad esempio, per l'imaging), utilizzare PBS / eparina per perfondere. - Preparare le soluzioni necessarie per l'analisi SEM.
- Preparare un tampone Na-cacodilato 0,1 M (pH 7,4). Preparare una soluzione di paraformaldeide al 2% e glutaraldeide al 2,5% in tampone Na-cacodilato 0,1 M. Produrre 20 ml di questa soluzione per campione.
- Preparare tetrossido di osmio al 2% in tampone Na-cacodilato da 0,1 M (5 mL per campione).
- Preparare soluzioni EtOH al 50%, 70%, 85% e 100%. Preparare 5 ml di ciascuna soluzione di EtOH per campione.
2. Microdissezione del plesso coroideo fuori dal ventricolo laterale e quarto
NOTA: In questo studio sono stati utilizzati topi femmina C57BL / 6 di 9 settimane. Tuttavia, la tecnica di isolamento descritta è indipendente dal ceppo, dal sesso e dall'età del topo adulto.
- Isolare il cervello del topo.
- Iniettare per via intraperitoneale una dose letale di un barbiturico a breve durata d'azione (>100 mg/kg, preparato nella fase 1.1) utilizzando un ago da 26G per anestetizzare terminalmente il topo. Controlla il riflesso del piede del mouse pizzicando la zampa posteriore con una pinza.
- Quando non c'è riflesso del piede, posizionare l'animale anestetizzato terminale nella posizione del decubito dorsale e fissare il topo bloccando gli arti su un piatto.
NOTA: se la perfusione transcardica dei topi non è necessaria, a seconda del metodo di analisi a valle (ad esempio, per l'imaging SEM), procedere al punto 2.1.7. Tuttavia, se la perfusione è necessaria per rimuovere le cellule del sangue o altri componenti nel sangue, il CP può essere visualizzato come una struttura blu che galleggia nei ventricoli cerebrali tramite perfusione con blu di bromofenolo. - Disinfettare il torace spruzzando il 70% di etanolo. Posizionare un drappo sterile intorno all'area chirurgica. Fare un'incisione di ~ 4 cm appena sotto il diaframma usando una lama chirurgica in acciaio al carbonio (vedi Tabella dei materiali).
- Aprire la pelle ed esporre il torace usando le forbici chirurgiche. Tagliare completamente il diaframma.
- Separare il torace per esporre i polmoni e il cuore pulsante.
- Perfondere transcardicamente i topi con 10 mL di soluzione di perfusione ad una velocità di 4,5 mL/min, utilizzando una pompa di perfusione (vedere Tabella dei materiali). La perfusione richiederà ~ 2 min. Inserire un ago 26G nel ventricolo sinistro per pompare la soluzione nel circuito sistemico. Inoltre, fare un taglio con forbici chirurgiche nell'atrio destro in modo che il sangue possa uscire dalla circolazione.
NOTA: Una pompa di perfusione è preferibile alla somministrazione manuale del fluido, in quanto fornirà i fluidi a una velocità programmata con precisione e assicurerà che le forze di taglio causate dalla perfusione non siano troppo forti. Forze di taglio eccessive comprometteranno la vitalità e la struttura delle cellule all'interno del CP. Inoltre, la portata di perfusione qui raccomandata è ottimale per perfondere topi adulti da 7 settimane in poi. Se vengono utilizzati topi più giovani, dovrebbe essere utilizzata una portata inferiore. È anche importante tamponare il sangue che esce dall'atrio destro per preservare un sito chirurgico pulito. - Decapitare il topo.
NOTA: Prestare attenzione a tagliare la testa il più in basso possibile alla spalla per preservare la struttura del cervello. Se il taglio è troppo alto, il cervelletto può essere danneggiato. - Dopo la decapitazione, tagliare il cuoio capelluto facendo un'incisione da tra le orecchie a superiore agli occhi. Tirare la pelle lateralmente per esporre il cranio. Quindi, tagliare il cranio seguendo le suture squamosali, verso la parte nasale.
NOTA: È importante rimuovere delicatamente il cranio per mantenere l'integrità del cervello. - Metti il cervello in una capsula di Petri ghiacciata e aggiungi 1 ml di 1x PBS ghiacciato sul tessuto cerebrale.
NOTA: non è necessario il rivestimento del piatto.
- Isolare il CP galleggiante nel quarto ventricolo.
- Tagliare delicatamente il cervelletto dal cervello con un bisturi. Il cervello è la parte più grande del cervello, mentre il cervelletto è una parte molto più piccola nella parte posteriore del cervello. Se necessario, rimuovere le parti rimanenti del tessuto del tronco cerebrale dal cervelletto.
- Ruota il cervello in modo che la linea di taglio sia rivolta verso l'alto. Assicurarsi che la quarta cavità ventricolare sia ora visibile al centro della sezione, con il CP che galleggia nel sito dorsale. Se necessario, aprire un po 'il ventricolo aprendo il tessuto connettivo con una pinza affilata. In questo modo, il CP sarà più visibile e più facile da raggiungere.
- Strappare delicatamente il CP dalla parete del ventricolo usando una piccola pinza affilata.
NOTA È importante toccare ed estrarre il CP solo in questa fase per non contaminare il campione con il tessuto circostante. L'apertura dei ventricoli come descritto al punto 2.2.2 faciliterà la fase 2.2.3.
- Isolare il CP che sporge dal ventricolo laterale.
- Usa piccole pinze affilate per tagliare sagittalmente il cervello in due emisferi.
- Ruota il cervello in modo che la linea di taglio sia rivolta verso l'alto. Per rivelare il ventricolo laterale, allontanare delicatamente la corteccia dal talamo.
- Ritrarre l'ippocampo sulla linea di taglio mediosagittale. Il ventricolo laterale è ora visibile con il CP che giace nella parte inferiore del ventricolo. Se necessario, aprire un po 'il ventricolo aprendo il tessuto connettivo con una pinza affilata. In questo modo, il CP sarà più visibile e più facile da raggiungere.
- Utilizzare una piccola pinza affilata per strappare delicatamente il CP dalla parete del ventricolo.
NOTA: È importante toccare ed estrarre il CP solo in questa fase per non contaminare il campione con il tessuto circostante. L'apertura dei ventricoli come descritto al punto 2.3.4 faciliterà la fase 2.3.5. Usare la necessaria cautela in questo passaggio per preservare il più possibile la struttura del CP. È più facile iniziare a tirare il CP nella direzione da rostrale a caudale.
3. Analisi morfologica del tessuto CP mediante microscopia elettronica a scansione (SEM)
ATTENZIONE: Le soluzioni tossiche vengono utilizzate nelle seguenti fasi di lavorazione. Si consiglia di eseguire la preparazione del campione in una cappa aspirante.
- Eseguire la preparazione del campione per SEM come descritto di seguito.
- Trasferire il CP fresco isolato in una soluzione di fissazione appena fatta contenente il 2% di paraformaldeide e il 2,5% di glutaraldeide in tampone Na-cacodilato 0,1 M (pH 7,4). Incubare per una notte a 4 °C.
NOTA: Poiché il tessuto CP è molto fragile e sottile, il tessuto deve essere messo in piccoli cesti di campioni (vedi Tabella dei materiali) per trasferirlo tra i tamponi. In questo modo, la struttura del tessuto sarà meglio preservata. Un fissativo a base di cacodilato viene utilizzato su uno a base di PBS, poiché il forte tampone cacodilato può contrastare il basso pH della glutaraldeide nel fissativo EM. - Lavare il campione 3 volte per 5 minuti ciascuno con 3-5 ml di tampone Na-cacodilato da 0,1 M (pH 7,4).
- Post-fissare i campioni in 3-5 ml di tetrossido di osmio al 2% in tampone Na-cacodilato 0,1 M per 30 minuti. Lavare i campioni 3 volte per 5 minuti ciascuno con 3-5 ml di acqua ultrapura.
- Disidratare i campioni in una serie di soluzioni ghiacciate di concentrazioni crescenti di EtOH (50%, 70%, 85%, 100%), per 15 minuti per soluzione di EtOH. Utilizzare un essiccatore a punti critici per asciugare correttamente il campione.
NOTA Il passaggio dalla fase liquida a quella gassosa influisce sulla tensione superficiale, causando danni alla struttura superficiale. La fase di essiccazione del punto critico consente la conservazione della struttura superficiale. - Posizionare il campione con attenzione su un supporto per campioni dotato di un adesivo carbone (vedere Tabella dei materiali).
- Rivestire i campioni con uno strato sottile (2-5 nm) di platino. Per fare ciò, montare una sorgente di platino in un sistema di vuoto tra due terminali elettrici ad alta corrente e riscaldare il platino alla sua temperatura di evaporazione. Un flusso fine di platino viene depositato sul campione.
NOTA: un protocollo più dettagliato per questo passaggio è fornito nel riferimento30. Oltre al platino, possono essere utilizzati anche oro o oro / palladio.
- Trasferire il CP fresco isolato in una soluzione di fissazione appena fatta contenente il 2% di paraformaldeide e il 2,5% di glutaraldeide in tampone Na-cacodilato 0,1 M (pH 7,4). Incubare per una notte a 4 °C.
- Visualizza i campioni CP con SEM (vedi Tabella dei materiali). La procedura di visualizzazione del tessuto CP tramite SEM è simile a quella di altri tipi di tessuti e dipende dal software e dagli strumenti utilizzati. Un protocollo SEM passo dopo passo con un video di accompagnamento è disponibile nel riferimento31 o riferimento30.
Risultati
Il protocollo descritto facilita l'isolamento efficiente del CP dal cervello del topo nei ventricoli laterali (Figura 2A-C) e quarti (Figura 2D-F). Dopo aver isolato l'intero cervello, le pinze vengono utilizzate per emisecare sagittalmente il cervello e identificare i CP che galleggiano nei ventricoli laterali. Il CP dal quarto ventricolo può essere isolato dal lato cerebellare del cervello. La perfusione con blu di bromofenolo può essere utilizzata per visualizzare il CP (Figura 2A,D); tuttavia, quando il blu di bromofenolo non è consentito nelle ulteriori fasi di lavorazione, è possibile eseguire la perfusione con PBS / eparina (Figura 2C, F) o nessuna perfusione (Figura 2B, E). Dopo aver isolato il CP dai ventricoli cerebrali, è possibile eseguire un intero repertorio di analisi sul tessuto. Questi includono il profilo di espressione genica (RT-qPCR)28, il profilo del tipo di cellula (citometria a flusso32, sequenziamento dell'RNA a singola cellula 26,27) e il rilevamento di citochine e chemochine 28tramite saggio immunoassorbente enzimatico (ELISA), immunoblot o saggi immunologici multiplex. Inoltre, la CP microdissezionata può essere messa in coltura per rendere espianti di CP per chiarire ulteriormente la funzione e, ad esempio, studiare il suo secretoma in risposta a uno stimolo specifico23,28,29. In questo manoscritto, descriviamo come eseguire la microscopia elettronica a scansione (SEM) per analizzare morfologicamente la superficie delle cellule epiteliali del plesso coroideo (CPE). La Figura 3 mostra immagini generali della CP isolata dal quarto ventricolo (Figura 3A) e della CP isolata dal ventricolo laterale (Figura 3B), ottenute tramite SEM. Queste immagini mostrano chiaramente la tipica forma a forma di C del CP laterale e la struttura a due bracci del quarto ventricolo CP.

Figura 3: Panoramica delle immagini al microscopio elettronico a scansione (SEM) del tessuto del plesso coroideo (CP) sezionato . (A,B) Immagine SEM rappresentativa del CP isolata dai ventricoli (A) quarto e (B) laterale del cervello del topo. Barra di scala = 100 μm. Impostazioni: elettrone alta tensione (EHT) = 5,00 kV; distanza di lavoro (WD) = 4,8 mm Fare clic qui per visualizzare una versione ingrandita di questa figura.
Ingrandendo le celle CPE, è possibile rilevare altre celle sul lato apicale delle celle CPE (Figura 4A). La cellula catturata nell'immagine è probabilmente una cellula epiplexus, una cellula simile a un macrofago che risiede sulla superficie apicale del CP. Tuttavia, non è possibile identificare la natura specifica di questa cellula tramite SEM. Oltre all'imaging SEM, è possibile eseguire l'imaging a due fotoni dell'epitelio del plesso coroideo in espianti vivi, come mostrato da Shipley et al.29. Mentre SEM facilita la visualizzazione delle strutture superficiali del CP, l'imaging a due fotoni può consentire la visualizzazione di una vasta gamma di cellule e processi cellulari purché possano essere monitorati in modo fluorescente. Ciò include la visualizzazione delle cellule vascolari e immunitarie, nonché gli eventi secretori nell'espianto CP29.
Un maggiore ingrandimento SEM ha rivelato strutture simili a vescicole sul lato apicale delle cellule CPE (Figura 4B) e dei microvilli (Figura 4C). Questi microvilli sporgono nel liquido cerebrospinale (CSF) e aumentano la superficie delle cellule CPE tra le cellule e il CSF. Questi risultati mostrano che le alterazioni morfologiche delle cellule CPE in condizioni di malattia possono essere studiate utilizzando SEM.

Figura 4: Immagini dettagliate al microscopio elettronico a scansione (SEM ) del tessuto del plesso coroideo (CP). (A) Una cellula sul lato apicale delle cellule epiteliali del plesso coroideo (CPE). Barra di scala = 2 μm. (B) Strutture simili a vescicoli sul lato apicale delle celle CPE. Barra di scala = 10 μm. (C) Visualizzazione della superficie di una cellula CPE con i suoi microvilli. Barra della scala = 1 μm. Impostazioni: elettrone alta tensione (EHT) = 5,00 kV; distanza di lavoro (WD) = 4,9 mm; Ingrandimento 3.000x. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Qui viene descritto un metodo per isolare il plesso coroideo (CP) dal ventricolo laterale e dal quarto ventricolo di un cervello di topo. L'intero metodo di montaggio del CP facilita ulteriori analisi utilizzando un repertorio di tecniche per ottenere una visione completa della morfologia CP, della composizione cellulare, del trascrittoma, del proteoma e del secretoma. Tali analisi sono cruciali per ottenere una migliore comprensione di questa straordinaria struttura che sporge dai ventricoli del cervello. Questa conoscenza è di immenso interesse di ricerca, poiché sta diventando sempre più chiaro che il CP svolge un ruolo cruciale nella salute e nella malattia 9,10,11,12,13,14,15,16,17,18.
Passaggi critici, modifiche e risoluzione dei problemi del metodo
È della massima importanza controllare il riflesso del piede del mouse per assicurarsi che l'anestesia terminale sia ben eseguita. Oltre alle ragioni etiche, questo assicura anche che il topo sia mantenuto nel posto giusto durante l'esecuzione della procedura sperimentale. L'obiettivo è quello di anestetizzare l'animale in modo che non provi dolore durante la procedura mentre il cuore batte al momento della perfusione. Se l'ulteriore elaborazione del tessuto richiede la rimozione del sangue, è possibile eseguire la perfusione transcardica. La soluzione salina contenente eparina viene utilizzata qui per evitare la coagulazione del sangue. L'EDTA può anche essere utilizzato per questo scopo, tuttavia, se è necessario preservare la vitalità cellulare, l'eparina è una scelta migliore rispetto all'EDTA. La perfusione deve essere iniziata immediatamente quando il cuore smette di battere a causa di un'anestesia eccessiva. Una pompa di perfusione è preferibile alla somministrazione manuale del fluido, in quanto consente l'erogazione del fluido a una velocità programmata con precisione e garantisce che le forze di taglio causate dalla perfusione non siano troppo forti. Forze di taglio eccessive comprometteranno la vitalità e la struttura delle celle all'interno del CP.
Ci vuole un occhio allenato per essere in grado di vedere il CP galleggiare nei ventricoli cerebrali del topo. Per questo motivo, è della massima importanza praticare molto. Si raccomanda di iniziare l'allenamento su topi perfusi con blu di bromofenolo, poiché ciò macchierà la CP in blu e renderà più facile discriminare il piccolo tessuto CP dal resto del cervello (Figura 2A,D). Nelle prove successive, il CP può essere isolato da un mouse non perfuso. Questo è più difficile rispetto all'isolamento CP da un topo bromofenolo perfuso di blu, ma il tessuto CP può ancora essere identificato dalla sua natura altamente vascolarizzata (Figura 2B, E). Solo dopo un allenamento approfondito è possibile isolare il tessuto CP dai ventricoli cerebrali da un topo non perfuso senza contaminazione con parenchima cerebrale (Figura 2C,F).
Il CP è una struttura molto fragile e sottile, il che implica che il suo isolamento dovrebbe essere eseguito con la necessaria prudenza al fine di preservare la vitalità, la funzione e la struttura delle cellule al suo interno. Pertanto, diversi passaggi nel protocollo descritto devono essere eseguiti con la precisione e la cautela necessarie per preservare l'integrità del cervello. Innanzitutto, è importante decapitare il mouse vicino alle spalle. Se il taglio è troppo alto, il cervelletto può essere danneggiato, complicando l'isolamento del CP nel quarto ventricolo. Successivamente, il cranio deve essere rimosso con attenzione per non danneggiare il cervello. Una volta che il cervello è isolato, è fondamentale tenerlo freddo per evitare che il cervello diventi molle, poiché ciò complicherà significativamente l'isolamento CP. Per fare ciò, è importante posizionare il cervello su una capsula di Petri ghiacciata e aggiungere PBS ghiacciato sul cervello. È necessario un certo livello di addestramento per eseguire la tecnica di isolamento descritta in quanto ciò ridurrà significativamente il tempo di elaborazione tra la decapitazione del topo e l'isolamento finale del CP. Un breve processo di isolamento migliorerà la vitalità e la conservazione della struttura del tessuto isolato. Infine, gli strumenti utilizzati per l'isolamento, in particolare le pinze, devono essere affilati e appuntiti per facilitare l'isolamento rapido ed efficiente del CP dai ventricoli. Tuttavia, è necessario prestare attenzione a non danneggiare l'integrità della struttura durante l'isolamento.
Per preservare l'integrità del tessuto durante l'elaborazione del campione per SEM, il CP può essere messo in piccoli cesti di campioni durante il trasferimento tra tamponi, in modo da evitare il contatto con il tessuto stesso. Inoltre, si raccomanda di eseguire l'essiccazione dei punti critici quando si sposta il tessuto fuori dalle soluzioni EtOH. Ciò garantisce la conservazione della struttura superficiale del CP, compresi i microvilli. La tensione superficiale, causata dal passaggio dalla fase liquida a quella gassosa, potrebbe danneggiare tali strutture.
Limitazioni del metodo
Come accennato in precedenza, la CP è una struttura minuscola e, a seconda delle analisi a valle (ad esempio, citometria a flusso), potrebbe essere necessario raggruppare la CP da topi diversi. Un ostacolo significativo nell'isolamento CP è l'identificazione della struttura quando è ancora galleggiante nel ventricolo. La natura altamente vascolarizzata della CP facilita la sua corretta identificazione (dopo un certo allenamento) all'interno delle cavità ventricolari del cervello. Tuttavia, se i componenti contenenti sangue devono essere rimossi per ulteriori analisi, la perfusione transcardica è essenziale. A seconda dell'analisi a valle, può essere eseguita la perfusione con blu di bromofenolo, che macchierà il blu CP, facilitando così l'isolamento del tessuto. Sfortunatamente, questa tecnica di visualizzazione non è sempre possibile (ad esempio, per la colorazione immunoistochimica). In questi casi, il CP deve essere isolato ciecamente, il che richiede una formazione adeguata. Giocare con la diffrazione della luce del microscopio può aiutare a identificare il CP che galleggia nei ventricoli. Inoltre, questo manoscritto descrive l'isolamento del CP galleggiante nel quarto ventricolo e nei ventricoli laterali, mentre l'isolamento del terzo ventricolo CP non è discusso.
Importanza rispetto ai metodi esistenti
In questo protocollo, il CP viene prima sezionato dai ventricoli cerebrali prima che vengano eseguite ulteriori analisi. Se una procedura di colorazione viene utilizzata come lettura di follow-up, è anche possibile colorare le sezioni cerebrali che contengono la CP. Il valore aggiunto di quest'ultima tecnica è che l'orientamento del tessuto CP all'interno dei ventricoli e del cervello è ancora visibile, il che non è il caso se il CP viene prima microdissezionato dai ventricoli cerebrali. D'altra parte, colorare una sezione cerebrale contenente CP fornisce informazioni solo da quella sezione specifica, mentre colorare la CP isolata può aiutare a raccogliere informazioni sull'intera CP.
Il vantaggio della tecnica descritta è che preserva la vitalità, la funzione e la struttura delle cellule all'interno del CP. Inoltre, questo metodo facilita il completo isolamento del CP galleggiante nel quarto ventricolo cerebrale laterale nei topi adulti. Sono stati precedentemente riportati metodi per l'isolamento della CP (ad esempio, dal cervello di ratto24 e dal cervello di cucciolo di topo25). Tuttavia, è importante considerare che la tecnica di isolamento può differire da specie a specie e tra età giovane e adulta.
Ulteriori applicazioni della tecnica
Oltre a preservare la vitalità, la funzione e la struttura delle cellule all'interno del CP, questa tecnica di isolamento facilita l'applicazione di tecniche a valle per ottenere una comprensione più profonda della funzione CP. Ad esempio, la citometria a flusso o il sequenziamento dell'RNA a singola cellula possono essere eseguiti per quantificare e analizzare fenotipicamente le cellule CP e le cellule infiltranti in determinate condizioni di malattia26,27. Inoltre, la composizione molecolare del CP può essere studiata per valutare la presenza di citochine e chemochine tramite saggio di immunoassorbimento enzimatico (ELISA), immunoblot o analisi simultanee di citochine multiple mediante un cosiddetto array di perline di citochine. Inoltre, le analisi del trascrittoma, vascolare, dell'istologia delle cellule immunitarie e del secretoma possono essere eseguite sugli espianti CP microdissecati29.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione belga per la ricerca sull'Alzheimer (SAO; numero di progetto: 20200032), dalla Fondazione di ricerca Fiandre (FWO Vlaanderen; numeri di progetto: 1268823N, 11D0520N, 1195021N) e dal Fondo Baillet Latour. Ringraziamo il VIB BioImaging Core per la formazione, il supporto e l'accesso al parco strumenti.
Materiali
| Name | Company | Catalog Number | Comments |
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
Riferimenti
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer's disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer's disease. Journal of Alzheimer's Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer's disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon