Method Article
Mikrodissektion und Whole-Mount-Rasterelektronenmikroskopie Visualisierung des Aderhautplexus der Maus
In diesem Artikel
Zusammenfassung
Der Plexus choroideus (CP), ein in den Neurowissenschaften wenig erforschtes Gewebe, spielt eine Schlüsselrolle bei der Gesundheit und Erkrankung des zentralen Nervensystems. Dieses Protokoll beschreibt eine Mikrodissektionstechnik zur Isolierung des CP und die Verwendung von Rasterelektronenmikroskopie, um einen Gesamtüberblick über seine zelluläre Struktur zu erhalten.
Zusammenfassung
Der Plexus choroideus (CP), eine stark vaskularisierte Struktur, die in die Ventrikel des Gehirns hineinragt, ist eines der am wenigsten untersuchten Gewebe in den Neurowissenschaften. Da immer deutlicher wird, dass diese winzige Struktur eine entscheidende Rolle für die Gesundheit und Erkrankung des Zentralnervensystems (ZNS) spielt, ist es von größter Bedeutung, die CP aus den Hirnventrikeln so zu präparieren, dass eine nachgelagerte Verarbeitung von der funktionellen bis zur strukturellen Analyse möglich ist. Hier wird die Isolierung des lateralen und vierten Hirnventrikels der Maus beschrieben, ohne dass spezielle Werkzeuge oder Geräte erforderlich sind. Diese Isolationstechnik bewahrt die Lebensfähigkeit, Funktion und Struktur der Zellen innerhalb des CP. Aufgrund seiner hohen Vaskularisation kann der CP mit einem binokularen Mikroskop in den Ventrikelhöhlen des Gehirns schwebend dargestellt werden. Die transkardiale Perfusion, die für die nachgelagerte Analyse erforderlich ist, kann jedoch die Identifizierung des CP-Gewebes erschweren. Abhängig von den weiteren Verarbeitungsschritten (z.B. RNA- und Proteinanalyse) kann dies durch die Visualisierung des CP über transkardiale Perfusion mit Bromphenolblau gelöst werden. Nach der Isolierung kann der CP mit verschiedenen Techniken verarbeitet werden, darunter RNA-, Protein- oder Einzelzellanalysen, um weitere Erkenntnisse über die Funktion dieser speziellen Gehirnstruktur zu gewinnen. Hier wird die Rasterelektronenmikroskopie (REM) auf dem CP der ganzen Montierung eingesetzt, um einen Gesamtüberblick über die Struktur zu erhalten.
Einleitung
Enge Barrieren trennen das zentrale Nervensystem (ZNS) von der Peripherie, einschließlich der Blut-Hirn-Schranke (BHS) und der Blut-Liquor-Schranke (Liquor). Diese Barrieren schützen das ZNS vor äußeren Beleidigungen und sorgen für eine ausgewogene und kontrollierte Mikroumgebung 1,2,3. Während die BHS im Laufe der Zeit ausgiebig untersucht wurde, hat die Blut-Liquor-Schranke am Plexus choroideus (CP) erst in den letzten zehn Jahren an Forschungsinteresse gewonnen. Diese letztere Barriere befindet sich in den vier Ventrikeln des Gehirns (Abbildung 1A, B) und ist gekennzeichnet durch eine einzelne Schicht von CPE-Zellen (Aderhautplexus-Epithelzellen), die ein zentrales Stroma, undichte Kapillaren, Fibroblasten und eine lymphatische und myeloische Zellpopulation umgeben (Abbildung 1C)4,5,6. Die CPE-Zellen sind durch Tight Junctions fest miteinander verbunden und verhindern so ein Austreten aus den darunter liegenden gefensterten Blutkapillaren in den Liquor und das Gehirn. Darüber hinaus wird der Transport durch die CPE-Zellen durch eine Reihe von ein- und ausgehenden Transportsystemen reguliert, die den Zustrom nützlicher Verbindungen (z. B. Nährstoffe und Hormone) aus dem Blut in den Liquor und den Ausfluss schädlicher Moleküle (z. B. Stoffwechselabfälle, überschüssige Neurotransmitter) in die andere Richtung steuern 1,6. Um ihre aktive Transportfunktion ausüben zu können, enthalten die CPE-Zellen zahlreiche Mitochondrien in ihrem Zytoplasma7. Darüber hinaus ist der CP die Hauptquelle für Liquor und fungiert durch das Vorhandensein residenter Entzündungszellen als Torwächter des Gehirns1. Aufgrund seiner einzigartigen Lage zwischen Blut und Gehirn ist der CP auch perfekt positioniert, um eine Immunüberwachung durchzuführen8.
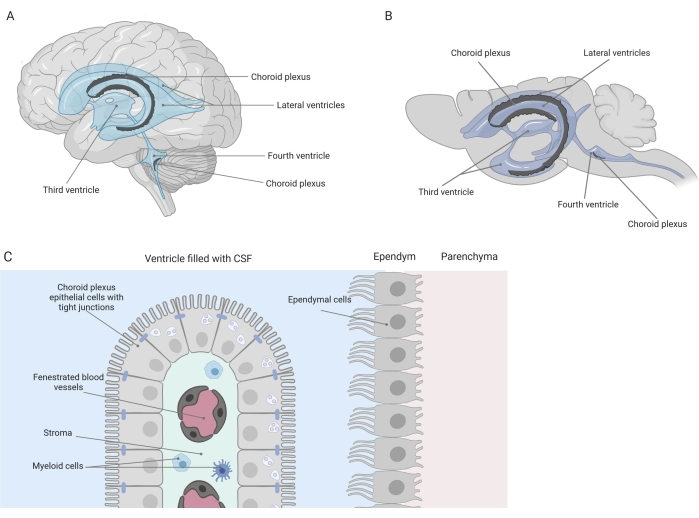
Abbildung 1: Schematische Übersicht über die Lage und Zusammensetzung des Plexus choroideus (CP). (A,B) CP-Gewebe befindet sich in den beiden lateralen, dem dritten und vierten Ventrikel von (A) menschlichen und (B) Mausgehirnen. (C) Das CP-Gewebe besteht aus einer einzigen Schicht eng verbundener quaderförmiger CP-Epithelzellen (CPE), die gefensterte Kapillaren, lockeres Bindegewebe sowie lymphatische und myeloische Zellen umgeben, und bildet die Blut-Liquor-Schranke (angepasst und modifiziert ab Referenz23). Figur erstellt mit Biorender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
In den letzten zehn Jahren haben immer mehr Beweise, darunter mehrere Berichte unserer Forschungsgruppe, gezeigt, dass die CP eine zentrale Rolle bei Gesundheit und Krankheit spielt. 9,10,11,12,13,14,15,16,17,18 . So ist beispielsweise bekannt, dass die alternde Blut-Liquor-Schranke morphologische Veränderungen unter anderem in den Zellkernen, Mikrovilli und der Basalmembran aufweist 1,19. Darüber hinaus ist im Zusammenhang mit der Alzheimer-Krankheit die allgemeine Barriereintegrität beeinträchtigt und all diese altersbedingten Veränderungen scheinen noch ausgeprägter zu sein 1,8,20. Zusätzlich zu den morphologischen Veränderungen sind das Transkriptom, das Proteom und das Sekretom des CP während der Erkrankung verändert 12,21,22,23. Daher ist ein fortgeschrittenes Wissen über die CP unerlässlich, um ihre Rolle bei neurologischen Erkrankungen besser zu verstehen und möglicherweise neue therapeutische Strategien zu entwickeln.
Eine effiziente Methode zur genauen Mikrodissektion des CP aus den Hirnventrikeln ist der erste unschätzbare Schritt, um eine ordnungsgemäße Untersuchung dieser winzigen Gehirnstruktur zu ermöglichen. Aufgrund seiner stark vaskularisierten Beschaffenheit (Abbildung 2B) kann der CP, der in den Ventrikelhöhlen des Gehirns schwimmt, mit einem binokularen Mikroskop identifiziert werden. Für die nachgelagerte Analyse ist jedoch häufig eine transkardiale Perfusion erforderlich, was die korrekte Identifizierung und Isolierung des CP-Gewebes erschwert (Abbildung 2C). Wenn es die weiteren Verarbeitungsschritte zulassen (z.B. bei RNA- und Proteinanalysen), kann der CP über eine transkardiale Perfusion mit Bromphenolblau visualisiert werden (Abbildung 2A). Mehrere Veröffentlichungen beschreiben bereits die Isolierung des CP aus Rattengehirnen24 und Mäusewelpen25. In dieser Arbeit wird eine Mikrodissektions-Isolationstechnik beschrieben, um den CP aus erwachsenen Mäusen zu isolieren. Wichtig ist, dass diese Isolationstechnik die Lebensfähigkeit, Funktion und Struktur der Zellen innerhalb des CP bewahrt. Die Isolierung des im vierten und lateralen Ventrikel schwimmenden CP wird hier beschrieben. Kurz gesagt, die Mäuse werden unheilbar betäubt und bei Bedarf transkardiale Perfundierte durchgeführt. Es ist jedoch zu beachten, dass die Perfusion die Struktur der Zellen innerhalb des CP schädigen kann. Wenn die Probe mit Transmissionselektronenmikroskopie (TEM), serieller Blockflächen-Rasterelektronenmikroskopie (SBF-REM) oder fokussiertem Ionenstrahl-SEM (FIB-REM) analysiert werden soll, sollte daher keine Perfusion durchgeführt werden. Als nächstes wird das gesamte Gehirn isoliert und eine Zange verwendet, um das Gehirn sagittal zu halbisieren. Von hier aus können die in den Seitenventrikeln schwimmenden CPs identifiziert und präpariert werden, während die CPs aus dem vierten Ventrikel von der Kleinhirnseite des Gehirns isoliert werden können.
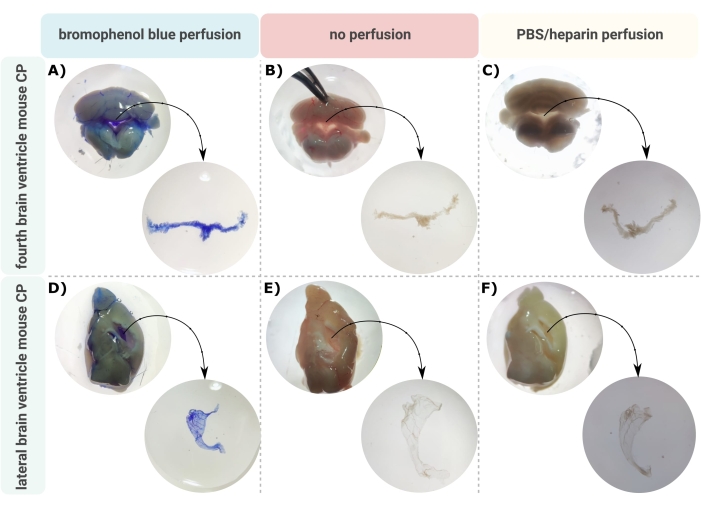
Abbildung 2: Darstellung des (A-C) vierten und (D-F) lateralen Ventrikelplexus choroideus (CP) nach (A,D)-Bromphenolblau-Perfusion, (B,E) keiner Perfusion und (C,F)-Perfusion mit PBS/Heparin. Die Bilder werden mit einem Stereomikroskop (8x-32-fache Vergrößerung) aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Sobald der CP richtig aus den Hirnventrikeln herauspräpariert ist, kann ein ganzes Repertoire an Techniken angewendet werden, um die Funktion dieser Struktur besser zu verstehen. Beispielsweise kann eine Durchflusszytometrie oder Einzelzell-RNA-Sequenzierung durchgeführt werden, um die infiltrierenden Entzündungszellen unter bestimmten Krankheitsbedingungen zu quantifizieren und phänotypisch zu analysieren26,27. Zusätzlich zur zellulären Zusammensetzung kann die molekulare Zusammensetzung des CP analysiert werden, um das Vorhandensein von Zytokinen und Chemokinen über den Enzyme-linked Immunosorbent Assay (ELISA), Immunoblot oder durch gleichzeitige Analyse mehrerer Zytokine unter Verwendung des Zytokin-Bead-Arrays28 zu beurteilen. Darüber hinaus können Transkriptom-, Gefäß-, Immunzell-Histologie- und Sekretomanalysen an den mikropräparierten CP-Explantatendurchgeführt werden 29. Hier wird die Rasterelektronenmikroskopie (REM) am gesamten CP eingesetzt, um einen Gesamtüberblick über die CP-Struktur zu erhalten. Das REM verwendet einen Strahl fokussierter Elektronen, um die Oberfläche abzutasten und ein Bild der Topographie und Zusammensetzung der Oberfläche zu erstellen. Da die Wellenlänge von Elektronen viel kleiner ist als die von Licht, liegt die Auflösung des REM im Nanometerbereich und ist der eines Lichtmikroskops überlegen. Folglich können morphologische Untersuchungen auf subzellulärer Ebene mittels REM durchgeführt werden. Kurzzeitig wird das präparierte CP sofort in ein glutaraldehydhaltiges Fixiermittel für eine nächtliche Fixierung überführt, gefolgt von Osmication und Uranylacetat-Färbung. Die Proben werden dann mit Blei-Aspartat-Färbung behandelt, dehydriert und schließlich für die Bildgebung eingebettet.
Somit ermöglicht dieses Protokoll die effiziente Isolierung des CP aus den Hirnventrikeln der Maus, die mit einer Vielzahl von nachgeschalteten Techniken weiter analysiert werden können, um seine Struktur und Funktion zu untersuchen.
Protokoll
Alle in dieser Studie beschriebenen Tierversuche wurden gemäß den nationalen (belgisches Gesetz vom 14.08.1986 und 22.12.2003, belgisches Königliches Dekret vom 06.04.2010) und europäischen Rechtsvorschriften (EU-Richtlinien 2010/63/EU, 86/609/EWG) durchgeführt. Alle Versuche an Mäusen und Tierprotokollen wurden von der Ethikkommission der Universität Gent genehmigt (Genehmigungsnummern LA1400091 und EC 2017-026).
1. Vorbereitung
- Anästhetika: Bereiten Sie ein Endanästhetikum vor. Beispielsweise kann eine Natrium-Pentobarbital-Lösung (≥100 mg/kg) in phosphatgepufferter Kochsalzlösung (PBS) hergestellt werden.
- Transkardiale Perfusionslösung: Bereiten Sie 10 ml (pro Maus) PBS/Heparin-Lösung (mit 0,2 % Heparin) vor, die mit 0,5 % Bromphenolblau ergänzt wird.
HINWEIS: Wenn es die nachgelagerten Verarbeitungsschritte zulassen (z. B. bei RNA- und Proteinanalysen), kann der Plexus choroideus (CP) über eine transkardiale Perfusion mit Bromphenolblau dargestellt werden. Wenn Bromphenolblau mit den weiteren Verarbeitungsschritten (z. B. für die Bildgebung) nicht verträglich ist, verwenden Sie PBS/Heparin zum Perfundieren. - Bereiten Sie die für die REM-Analyse erforderlichen Lösungen vor.
- 0,1 M Na-Cacodylat-Puffer (pH 7,4) herstellen. Bereiten Sie eine Lösung aus 2 % Paraformaldehyd und 2,5 % Glutaraldehyd in 0,1 M Na-Cacodylatpuffer vor. Stellen Sie 20 ml dieser Lösung pro Probe her.
- Bereiten Sie 2%iges Osmiumtetroxid in 0,1 M Na-Cacodylat-Puffer (5 ml pro Probe) vor.
- Bereiten Sie 50 %, 70 %, 85 % und 100 % EtOH-Lösungen vor. Bereiten Sie 5 ml jeder EtOH-Lösung pro Probe vor.
2. Mikrodissektion des Plexus choroideus aus dem lateralen und vierten Ventrikel
HINWEIS: In dieser Studie wurden weibliche, 9 Wochen alte C57BL/6-Mäuse verwendet. Die beschriebene Isolationstechnik ist jedoch unabhängig von der Belastung, dem Geschlecht und dem Alter der erwachsenen Maus.
- Isolieren Sie das Gehirn der Maus.
- Intraperitoneal wird eine tödliche Dosis eines kurzwirksamen Barbiturats (>100 mg/kg, hergestellt in Schritt 1.1) mit einer 26G-Nadel injiziert, um die Maus terminal zu betäuben. Überprüfe den Fußreflex der Maus, indem du ihre Hinterpfote mit einer Pinzette kneifst.
- Wenn kein Fußreflex vorhanden ist, bringen Sie das unheilbar betäubte Tier in die dorsale Dekubitusposition und fixieren Sie die Maus, indem Sie die Gliedmaßen auf eine Platte stecken.
HINWEIS: Wenn eine transkardiale Perfusion der Mäuse je nach nachgeschalteter Analysemethode (z. B. für die REM-Bildgebung) nicht erforderlich ist, fahren Sie mit Schritt 2.1.7 fort. Wenn jedoch eine Perfusion erforderlich ist, um Blutzellen oder andere Bestandteile im Blut zu entfernen, kann der CP als blaue Struktur dargestellt werden, die durch die Perfusion mit Bromphenolblau in den Hirnventrikeln schwimmt. - Desinfizieren Sie die Brust, indem Sie 70% Ethanol aufsprühen. Legen Sie ein steriles Tuch um den Operationsbereich. Machen Sie einen Schnitt von ~4 cm direkt unter der Membran mit einer chirurgischen Klinge aus Kohlenstoffstahl (siehe Materialtabelle).
- Öffnen Sie die Haut und legen Sie den Brustkorb mit einer chirurgischen Schere frei. Schneiden Sie die Membran vollständig auf.
- Trennen Sie den Brustkorb, um die Lunge und das schlagende Herz freizulegen.
- Die Mäuse werden mit einer Perfusionspumpe transkardialerweise mit 10 ml der Perfusionslösung mit einer Rate von 4,5 ml/min perfundiert (siehe Materialtabelle). Die Perfusion dauert ~2 min. Führen Sie eine 26G-Nadel in die linke Herzkammer ein, um die Lösung in den Systemkreislauf zu pumpen. Machen Sie außerdem mit einer chirurgischen Schere einen Schnitt in den rechten Vorhof, damit das Blut aus dem Kreislauf abfließen kann.
HINWEIS: Eine Perfusionspumpe wird der manuellen Verabreichung der Flüssigkeit vorgezogen, da sie die Flüssigkeiten mit einer genau programmierten Geschwindigkeit fördert und sicherstellt, dass die durch die Perfusion verursachten Scherkräfte nicht zu stark sind. Übermäßige Scherkräfte beeinträchtigen die Lebensfähigkeit und Struktur der Zellen innerhalb des CP. Darüber hinaus ist die hier empfohlene Perfusionsflussrate optimal, um erwachsene Mäuse ab 7 Wochen zu perfundieren. Wenn jüngere Mäuse verwendet werden, sollte eine geringere Flussrate verwendet werden. Es ist auch wichtig, das Blut, das aus dem rechten Vorhof austritt, abzutupfen, um eine saubere Operationsstelle zu erhalten. - Enthaupte die Maus.
Anmerkungen: Achten Sie darauf, den Kopf so tief wie möglich zur Schulter abzuschneiden, um die Gehirnstruktur zu erhalten. Ist der Schnitt zu hoch, kann das Kleinhirn geschädigt werden. - Schneiden Sie nach der Enthauptung die Kopfhaut auf, indem Sie einen Schnitt zwischen den Ohren machen, der über den Augen liegt. Ziehe die Haut seitlich heraus, um den Schädel freizulegen. Schneiden Sie dann den Schädel auf, indem Sie den Plattenepithelnähten in Richtung des Nasenteils folgen.
HINWEIS: Es ist wichtig, den Schädel vorsichtig zu entfernen, um die Integrität des Gehirns zu erhalten. - Legen Sie das Gehirn in eine eiskalte Petrischale und geben Sie 1 ml eiskaltes 1x PBS auf das Hirngewebe.
Anmerkungen:Eine Beschichtung der Schale ist nicht erforderlich.
- Isolieren Sie den CP, der im vierten Ventrikel schwimmt.
- Schneiden Sie das Kleinhirn vorsichtig mit einem Skalpell vom Großhirn ab. Das Großhirn ist der größte Teil des Gehirns, während das Kleinhirn ein viel kleinerer Teil im hinteren Teil des Gehirns ist. Falls erforderlich, entfernen Sie verbleibende Teile des Hirnstammgewebes aus dem Kleinhirn.
- Drehen Sie das Gehirn so, dass die Schnittlinie nach oben zeigt. Stellen Sie sicher, dass die vierte Ventrikelhöhle nun in der Mitte des Schnitts sichtbar ist und der CP an der dorsalen Stelle schwimmt. Öffne bei Bedarf die Herzkammer ein wenig, indem du das Bindegewebe mit einer scharfen Pinzette aufziehst. Auf diese Weise wird der CP besser sichtbar und leichter zu erreichen.
- Reißen Sie den CP vorsichtig mit einer winzigen scharfen Pinzette aus der Ventrikelwand.
HINWEIS Es ist wichtig, den CP in diesem Schritt nur zu berühren und herauszunehmen, um die Probe nicht mit dem umgebenden Gewebe zu kontaminieren. Das Öffnen der Herzkammern, wie in Schritt 2.2.2 beschrieben, erleichtert Schritt 2.2.3.
- Isolieren Sie den CP, der aus dem lateralen Ventrikel herausragt.
- Verwenden Sie eine winzige scharfe Pinzette, um das Gehirn sagittal in zwei Hemisphären zu schneiden.
- Drehen Sie das Gehirn so, dass die Schnittlinie nach oben zeigt. Um den seitlichen Ventrikel freizulegen, ziehen Sie die Hirnrinde vorsichtig vom Thalamus weg.
- Ziehen Sie den Hippocampus bis zur mittelsagittalen Schnittlinie zurück. Der laterale Ventrikel ist nun sichtbar, wobei der CP am unteren Ende des Ventrikels liegt. Öffne bei Bedarf die Herzkammer ein wenig, indem du das Bindegewebe mit einer scharfen Pinzette aufziehst. Auf diese Weise wird der CP besser sichtbar und leichter zu erreichen.
- Verwenden Sie eine winzige scharfe Pinzette, um den CP vorsichtig aus der Ventrikelwand zu reißen.
HINWEIS: Es ist wichtig, den CP in diesem Schritt nur zu berühren und herauszunehmen, um die Probe nicht mit dem umgebenden Gewebe zu kontaminieren. Das Öffnen der Herzkammern, wie in Schritt 2.3.4 beschrieben, erleichtert Schritt 2.3.5. Seien Sie in diesem Schritt vorsichtig, um die Struktur des CP so weit wie möglich zu erhalten. Am einfachsten ist es, den CP in rostraler bis kaudaler Richtung zu ziehen.
3. Morphologische Analyse von CP-Gewebe mittels Rasterelektronenmikroskopie (REM)
ACHTUNG: In den folgenden Verarbeitungsschritten werden toxische Lösungen verwendet. Es wird empfohlen, die Probenvorbereitung in einem Abzug durchzuführen.
- Führen Sie die Probenvorbereitung für das REM wie unten beschrieben durch.
- Das frisch isolierte CP wird in eine frisch hergestellte Fixierungslösung mit 2 % Paraformaldehyd und 2,5 % Glutaraldehyd in 0,1 M Na-Cacodylatpuffer (pH 7,4) überführt. Über Nacht bei 4 °C inkubieren.
Anmerkungen: Da das CP-Gewebe sehr zerbrechlich und dünn ist, sollte das Gewebe in kleine Probenkörbe (siehe Materialtabelle) gegeben werden, um es zwischen den Puffern zu transferieren. Auf diese Weise wird die Struktur des Gewebes besser erhalten. Ein Fixiermittel auf Cacodylatbasis wird einem Fixiermittel auf PBS-Basis vorgezogen, da der starke Cacodylatpuffer dem niedrigen pH-Wert von Glutaraldehyd im EM-Fixiermittel entgegenwirken kann. - Waschen Sie die Probe 3x für je 5 min mit 3-5 mL 0,1 M Na-Cacodylatpuffer (pH 7,4).
- Die Proben werden in 3-5 ml 2%igem Osmiumtetroxid in 0,1 M Na-Cacodylat-Puffer für 30 min fixiert. Waschen Sie die Proben 3x für jeweils 5 min mit 3-5 ml Reinstwasser.
- Die Proben werden in einer Reihe von eiskalten Lösungen mit steigenden EtOH-Konzentrationen (50 %, 70 %, 85 %, 100 %) für 15 Minuten pro EtOH-Lösung dehydriert. Verwenden Sie einen Trockner an kritischen Punkten, um die Probe ordnungsgemäß zu trocknen.
HINWEIS Der Wechsel von der flüssigen zur gasförmigen Phase wirkt sich auf die Oberflächenspannung aus und verursacht Schäden an der Oberflächenstruktur. Der Trocknungsschritt am kritischen Punkt ermöglicht die Erhaltung der Oberflächenstruktur. - Positionieren Sie die Probe vorsichtig auf einer Probenhalterung, die mit einem Kohleaufkleber versehen ist (siehe Materialtabelle).
- Beschichten Sie die Proben mit einer dünnen Schicht (2-5 nm) Platin. Montieren Sie dazu eine Platinquelle in einem Vakuumsystem zwischen zwei elektrischen Hochstromklemmen und erhitzen Sie das Platin auf seine Verdampfungstemperatur. Ein feiner Platinstrahl wird auf der Probe abgeschieden.
HINWEIS: Ein detaillierteres Protokoll für diesen Schritt finden Sie in Referenz30. Neben Platin kann auch Gold oder Gold/Palladium verwendet werden.
- Das frisch isolierte CP wird in eine frisch hergestellte Fixierungslösung mit 2 % Paraformaldehyd und 2,5 % Glutaraldehyd in 0,1 M Na-Cacodylatpuffer (pH 7,4) überführt. Über Nacht bei 4 °C inkubieren.
- Visualisieren Sie die CP-Proben mit REM (siehe Materialtabelle). Die Visualisierung von CP-Gewebe mittels REM ähnelt der anderer Gewebetypen und ist abhängig von der verwendeten Software und den Instrumenten. Ein Schritt-für-Schritt-REM-Protokoll mit begleitendem Video ist in Referenz31 oderReferenz 30 verfügbar.
Ergebnisse
Das beschriebene Protokoll ermöglicht die effiziente Isolierung des CP aus dem lateralen (Abbildung 2A-C) und vierten (Abbildung 2D-F) Ventrikel des Maushirns. Nach der Isolierung des gesamten Gehirns wird eine Pinzette verwendet, um das Gehirn sagittal zu hemisectieren und die in den Seitenventrikeln schwimmenden CPs zu identifizieren. Der CP aus dem vierten Ventrikel kann von der Kleinhirnseite des Gehirns isoliert werden. Die Perfusion mit Bromphenolblau kann zur Visualisierung des CP verwendet werden (Abbildung 2A,D); Wenn Bromphenolblau jedoch in den weiteren Verarbeitungsschritten nicht zugelassen ist, kann eine Perfusion mit PBS/Heparin (Abbildung 2C,F) oder keine Perfusion (Abbildung 2B,E) durchgeführt werden. Nach der Isolierung des CP aus den Hirnventrikeln kann ein ganzes Repertoire an Analysen am Gewebe durchgeführt werden. Dazu gehören die Erstellung von Genexpressionsprofilen (RT-qPCR)28, die Erstellung von Zelltypprofilen (Durchflusszytometrie32, Einzelzell-RNA-Sequenzierung26,27) und der Nachweis von Zytokinen und Chemokinen 28mittels ELISA, Immunoblot oder Multiplex-Immunoassays. Darüber hinaus kann das mikrodissektierte CP in Kultur gebracht werden, um CP-Explantaten herzustellen, um die Funktion weiter aufzuklären und beispielsweise sein Sekretom als Reaktion auf einen spezifischen Stimulus zu untersuchen23,28,29. In diesem Manuskript beschreiben wir, wie man Rasterelektronenmikroskopie (REM) durchführt, um die Oberfläche von Epithelzellen des Plexus choroideus (CPE) morphologisch zu analysieren. Abbildung 3 zeigt Übersichtsbilder des aus dem vierten Ventrikel isolierten CP (Abbildung 3A) und des aus dem lateralen Ventrikel isolierten CP (Abbildung 3B), die mittels REM aufgenommen wurden. Diese Bilder zeigen deutlich die typische C-förmige Form des lateralen CP und die zweiarmige Struktur des vierten Ventrikels CP.

Abbildung 3: Übersicht über die Rasterelektronenmikroskopie (REM) des präparierten Gewebes des Plexus choroideus (CP). (A,B) Repräsentatives REM-Bild des CP, isoliert aus dem (A) vierten und (B) lateralen Ventrikel des Mäusegehirns. Maßstabsleiste = 100 μm. Einstellungen: Elektronenhochspannung (EHT) = 5,00 kV; Arbeitsabstand (WD) = 4,8 mm Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Durch Heranzoomen an die CPE-Zellen können andere Zellen auf der apikalen Seite der CPE-Zellen erkannt werden (Abbildung 4A). Bei der auf dem Bild eingefangenen Zelle handelt es sich möglicherweise um eine Epiplexuszelle, eine makrophagenähnliche Zelle, die sich auf der apikalen Oberfläche des CP befindet. Es ist jedoch nicht möglich, die spezifische Beschaffenheit dieser Zelle mittels REM zu identifizieren. Zusätzlich zur REM-Bildgebung ist es möglich, eine Zwei-Photonen-Bildgebung des Epithels des Plexus choroideus in lebenden Explantaten durchzuführen, wie Shipley et al.29 gezeigt haben. Während das REM die Visualisierung von Oberflächenstrukturen des CP erleichtert, kann die Zwei-Photonen-Bildgebung die Visualisierung eines breiten Spektrums von Zellen und zellulären Prozessen ermöglichen, solange diese fluoreszenzüberwacht werden können. Dazu gehört die Visualisierung von Gefäß- und Immunzellen sowie der sekretorischen Ereignisse im CP-Explantat29.
Eine höhere REM-Vergrößerung zeigte vesikelartige Strukturen auf der apikalen Seite von CPE-Zellen (Abbildung 4B) sowie Mikrovilli (Abbildung 4C). Diese Mikrovilli ragen in den Liquor cerebrospinalis (CSF) und vergrößern die CPE-Zelloberfläche zwischen den Zellen und dem Liquor. Diese Ergebnisse zeigen, dass die morphologischen Veränderungen der CPE-Zellen unter Krankheitsbedingungen mit Hilfe von REM untersucht werden können.

Abbildung 4: Detaillierte Rasterelektronenmikroskopie (REM)-Aufnahmen von Gewebe des Plexus choroideus (CP ). (A) Eine Zelle auf der apikalen Seite von CPE-Zellen (Aderhautplexus-Epithelzellen). Maßstabsbalken = 2 μm. (B) Vesikelartige Strukturen auf der apikalen Seite von CPE-Zellen. Maßstabsbalken = 10 μm. (C) Visualisierung einer CPE-Zelloberfläche mit ihren Mikrovilli. Maßstabsleiste = 1 μm. Einstellungen: Elektronenhochspannung (EHT) = 5,00 kV; Arbeitsabstand (WD) = 4,9 mm; 3.000-fache Vergrößerung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
In dieser Arbeit wird eine Methode beschrieben, um den Plexus choroideus (CP) aus dem lateralen Ventrikel und dem vierten Ventrikel eines Mausgehirns zu isolieren. Diese gesamte Montagemethode des CP erleichtert die weitere Analyse unter Verwendung eines Repertoires von Techniken, um einen vollständigen Überblick über die CP-Morphologie, die zelluläre Zusammensetzung, das Transkriptom, das Proteom und das Sekretom zu erhalten. Solche Analysen sind entscheidend, um diese bemerkenswerte Struktur, die aus den Herzkammern des Gehirns herausragt, besser zu verstehen. Dieses Wissen ist von immensem Forschungsinteresse, da immer deutlicher wird, dass der CP eine entscheidende Rolle für Gesundheit und Krankheit spielt 9,10,11,12,13,14,15,16,17,18.
Kritische Schritte, Änderungen und Fehlerbehebung der Methode
Es ist von größter Bedeutung, den Fußreflex der Maus zu überprüfen, um sicherzustellen, dass die terminale Anästhesie gut durchgeführt wird. Dies stellt neben ethischen Gründen auch sicher, dass die Maus bei der Durchführung des Versuchsverfahrens an der richtigen Stelle gehalten wird. Ziel ist es, das Tier so zu betäuben, dass es während des Eingriffs keine Schmerzen verspürt, während das Herz zum Zeitpunkt der Perfusion schlägt. Wenn die Weiterverarbeitung des Gewebes die Entnahme von Blut erfordert, kann eine transkardiale Perfusion durchgeführt werden. Heparinhaltige Kochsalzlösung wird hier eingesetzt, um eine Blutgerinnung zu vermeiden. EDTA kann auch für diesen Zweck verwendet werden, aber wenn es notwendig ist, die Lebensfähigkeit der Zellen zu erhalten, ist Heparin eine bessere Wahl als EDTA. Die Perfusion sollte sofort begonnen werden, wenn das Herz aufgrund einer übermäßigen Anästhesie aufhört zu schlagen. Eine Perfusionspumpe ist der manuellen Verabreichung der Flüssigkeit vorzuziehen, da sie eine exakt programmierte Flüssigkeitsabgabe ermöglicht und sicherstellt, dass die durch die Perfusion verursachten Scherkräfte nicht zu stark sind. Übermäßige Scherkräfte beeinträchtigen die Lebensfähigkeit und Struktur der Zellen innerhalb des CP.
Es braucht ein geschultes Auge, um den CP in den Hirnkammern der Maus schwimmen zu sehen. Aus diesem Grund ist es von größter Wichtigkeit, viel zu üben. Es wird empfohlen, das Training an Mäusen zu beginnen, die mit Bromphenolblau durchblutet wurden, da dies die CP blau färbt und es einfacher macht, das winzige CP-Gewebe vom Rest des Gehirns zu unterscheiden (Abbildung 2A, D). In späteren Versuchen kann der CP aus einer nicht perfundierten Maus isoliert werden. Dies ist schwieriger als die CP-Isolierung aus einer mit Bromphenolblau perfundierten Maus, aber das CP-Gewebe kann immer noch anhand seiner stark vaskularisierten Natur identifiziert werden (Abbildung 2B, E). Erst nach ausgiebigem Training ist es möglich, das CP-Gewebe aus den Hirnventrikeln einer nicht perfundierten Maus ohne Kontamination mit Hirnparenchym zu isolieren (Abbildung 2C,F).
Der CP ist eine sehr zerbrechliche und dünne Struktur, was bedeutet, dass seine Isolierung mit der notwendigen Vorsicht durchgeführt werden sollte, um die Lebensfähigkeit, Funktion und Struktur der darin enthaltenen Zellen zu erhalten. Daher müssen verschiedene Schritte des beschriebenen Protokolls mit der notwendigen Präzision und Vorsicht ausgeführt werden, um die Integrität des Gehirns zu erhalten. Zuerst ist es wichtig, die Maus nahe an den Schultern zu enthaupten. Wenn der Schnitt zu hoch ist, kann das Kleinhirn geschädigt werden, was die Isolierung des CP im vierten Ventrikel erschwert. Als nächstes muss der Schädel vorsichtig entfernt werden, um das Gehirn nicht zu schädigen. Sobald das Gehirn isoliert ist, ist es wichtig, es kalt zu halten, um zu verhindern, dass das Gehirn matschig wird, da dies die CP-Isolierung erheblich erschwert. Dazu ist es wichtig, das Gehirn auf eine eiskalte Petrischale zu legen und eiskaltes PBS über das Gehirn zu geben. Um die beschriebene Isolationstechnik durchzuführen, ist ein gewisses Maß an Training erforderlich, da dies die Verarbeitungszeit zwischen der Enthauptung der Maus und der endgültigen Isolierung des CP erheblich verkürzt. Ein kurzer Isolationsprozess verbessert die Lebensfähigkeit und den Strukturerhalt des isolierten Gewebes. Schließlich müssen die für die Isolierung verwendeten Werkzeuge, insbesondere die Pinzette, scharf und spitz sein, um eine schnelle und effiziente Isolierung des CP aus den Ventrikeln zu ermöglichen. Es sollte jedoch darauf geachtet werden, dass die Integrität der Struktur während der Isolierung nicht beschädigt wird.
Um die Gewebeintegrität während der Probenverarbeitung für das REM zu erhalten, kann der CP beim Transfer zwischen den Puffern in kleine Probenkörbe gelegt werden, so dass ein Berühren des Gewebes selbst vermieden werden kann. Darüber hinaus wird empfohlen, eine Trocknung an kritischen Punkten durchzuführen, wenn das Gewebe aus den EtOH-Lösungen entnommen wird. Dadurch wird sichergestellt, dass die Oberflächenstruktur des CP, einschließlich der Mikrovilli, erhalten bleibt. Die Oberflächenspannung, die durch den Übergang von der flüssigen zur gasförmigen Phase entsteht, könnte solche Strukturen beschädigen.
Einschränkungen der Methode
Wie bereits erwähnt, handelt es sich bei der CP um eine winzige Struktur, und abhängig von den nachgeschalteten Analysen (z. B. Durchflusszytometrie) kann es erforderlich sein, die CP von verschiedenen Mäusen zu bündeln. Eine wesentliche Hürde bei der CP-Isolierung ist die Identifizierung der Struktur, wenn sie noch im Ventrikel schwimmt. Die stark vaskularisierte Natur des CP erleichtert seine korrekte Identifizierung (nach einigem Training) in den ventrikulären Hohlräumen des Gehirns. Wenn jedoch bluthaltige Bestandteile für die weitere Analyse entfernt werden müssen, ist eine transkardiale Perfusion unerlässlich. Abhängig von der nachgelagerten Analyse kann eine Perfusion mit Bromphenolblau durchgeführt werden, wodurch das CP-Blau gefärbt wird, wodurch die Isolierung des Gewebes erleichtert wird. Leider ist diese Visualisierungstechnik nicht immer möglich (z.B. für immunhistochemische Färbungen). In solchen Fällen muss der CP blind isoliert werden, was eine angemessene Ausbildung erfordert. Das Spiel mit der Lichtbeugung des Mikroskops kann helfen, den in den Ventrikeln schwimmenden CP zu identifizieren. Darüber hinaus beschreibt dieses Manuskript die Isolierung des im vierten und lateralen Ventrikel schwimmenden CP, während die Isolierung des dritten Ventrikels CP nicht diskutiert wird.
Bedeutung im Hinblick auf bestehende Methoden
Bei diesem Protokoll wird der CP zunächst aus den Hirnventrikeln herauspräpariert, bevor eine weitere Analyse durchgeführt wird. Wird ein Färbeverfahren als Nachlese eingesetzt, ist es auch möglich, Hirnschnitte zu färben, die den CP enthalten. Der Mehrwert dieser letzteren Technik besteht darin, dass die Orientierung des CP-Gewebes innerhalb der Ventrikel und des Gehirns noch sichtbar ist, was nicht der Fall ist, wenn das CP zuerst aus den Hirnventrikeln herauspräpariert wird. Auf der anderen Seite liefert die Färbung eines Gehirnabschnitts, der CP enthält, nur Informationen aus diesem spezifischen Abschnitt, während die Färbung des isolierten CP dazu beitragen kann, Informationen über den gesamten CP zu sammeln.
Der Vorteil der beschriebenen Technik besteht darin, dass sie die Lebensfähigkeit, Funktion und Struktur der Zellen innerhalb des CP bewahrt. Darüber hinaus ermöglicht diese Methode die vollständige Isolierung des CP, der im vierten und lateralen Hirnventrikel schwimmt, bei erwachsenen Mäusen. Methoden zur Isolierung des CP (z.B. aus Rattengehirnen24 und Mäusewelpengehirnen25) wurden bereits berichtet. Es ist jedoch wichtig zu bedenken, dass die Isolationstechnik von Art zu Art und zwischen jungem und erwachsenem Alter unterschiedlich sein kann.
Weitere Anwendungen der Technik
Neben der Erhaltung der Lebensfähigkeit, Funktion und Struktur der Zellen innerhalb des CP erleichtert diese Isolationstechnik die Anwendung nachgeschalteter Techniken, um ein tieferes Verständnis der CP-Funktion zu erlangen. Beispielsweise kann Durchflusszytometrie oder Einzelzell-RNA-Sequenzierung durchgeführt werden, um CP-Zellen und infiltrierende Zellen unter bestimmten Krankheitsbedingungen zu quantifizieren und phänotypisch zu analysieren26,27. Darüber hinaus kann die molekulare Zusammensetzung des CP untersucht werden, um das Vorhandensein von Zytokinen und Chemokinen durch einen Enzyme-linked Immunosorbent Assay (ELISA), Immunoblot oder simultane Analysen mehrerer Zytokine durch ein sogenanntes Zytokin-Bead-Array zu beurteilen. Darüber hinaus können Transkriptom-, Gefäß-, Immunzell-Histologie- und Sekretomanalysen an den mikropräparierten CP-Explantatendurchgeführt werden 29.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der Belgischen Stiftung für Alzheimer-Forschung (SAO; Projektnummer: 20200032), der Forschungsstiftung Flandern (FWO Vlaanderen; Projektnummern: 1268823N, 11D0520N, 1195021N) und dem Baillet Latour Fund unterstützt. Wir danken dem VIB BioImaging Core für die Schulung, den Support und den Zugang zum Instrumentenpark.
Materialien
| Name | Company | Catalog Number | Comments |
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
Referenzen
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer's disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer's disease. Journal of Alzheimer's Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer's disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten