Method Article
التشريح المجهري والمجهر الإلكتروني الماسح الكامل للجبل تصور الضفيرة المشيمية للفأر
In This Article
Summary
تلعب الضفيرة المشيمية (CP) ، وهي نسيج غير مدروس في علم الأعصاب ، دورا رئيسيا في صحة ومرض الجهاز العصبي المركزي. يصف هذا البروتوكول تقنية التشريح المجهري لعزل CP واستخدام المجهر الإلكتروني الماسح للحصول على رؤية شاملة لهيكله الخلوي.
Abstract
الضفيرة المشيمية (CP) ، وهي بنية شديدة الأوعية الدموية تبرز في بطينات الدماغ ، هي واحدة من أكثر الأنسجة غير المدروسة في علم الأعصاب. نظرا لأنه أصبح من الواضح بشكل متزايد أن هذا الهيكل الصغير يلعب دورا حاسما في صحة ومرض الجهاز العصبي المركزي (CNS) ، فمن الأهمية بمكان تشريح الشلل الدماغي بشكل صحيح من البطينين في الدماغ بطريقة تسمح بالمعالجة النهائية ، بدءا من التحليل الوظيفي إلى التحليل الهيكلي. هنا ، يتم وصف عزل فأر البطين الدماغي الجانبي والرابع CP دون الحاجة إلى أدوات أو معدات متخصصة. تحافظ تقنية العزل هذه على صلاحية الخلايا ووظيفتها وهيكلها داخل CP. بسبب الأوعية الدموية العالية ، يمكن تصور CP عائما داخل تجاويف البطين في الدماغ باستخدام مجهر مجهر. ومع ذلك ، فإن التروية عبر القلب المطلوبة لتحليل المصب يمكن أن تعقد تحديد أنسجة CP. اعتمادا على خطوات المعالجة الإضافية (على سبيل المثال ، تحليل الحمض النووي الريبي والبروتين) ، يمكن حل ذلك عن طريق تصور CP عن طريق التروية عبر القلب مع بروموفينول الأزرق. بعد العزلة ، يمكن معالجة CP باستخدام العديد من التقنيات ، بما في ذلك تحليل الحمض النووي الريبي أو البروتين أو الخلية المفردة ، لاكتساب مزيد من الفهم لوظيفة بنية الدماغ الخاصة هذه. هنا ، يتم استخدام المجهر الإلكتروني الماسح (SEM) على CP الكامل للحصول على رؤية شاملة للهيكل.
Introduction
تفصل الحواجز الضيقة الجهاز العصبي المركزي (CNS) عن المحيط ، بما في ذلك الحاجز الدموي الدماغي (BBB) وحاجز السائل الدموي النخاعي (CSF). تحمي هذه الحواجز الجهاز العصبي المركزي من الإهانات الخارجية وتضمن بيئة دقيقة متوازنة وخاضعة للرقابة1،2،3. في حين تمت دراسة BBB على نطاق واسع بمرور الوقت ، فإن حاجز الدم CSF الموجود في الضفيرة المشيمية (CP) اكتسب اهتماما بحثيا متزايدا خلال العقد الماضي. يمكن العثور على هذا الحاجز الأخير في البطينين الأربعة للدماغ (الشكل 1 أ ، ب) ويتميز بطبقة واحدة من خلايا الضفيرة الظهارية المشيمية (CPE) المحيطة بالسدى المركزي ، والشعيرات الدموية المتسربة ، والخلايا الليفية ، وعدد الخلايا اللمفاوية والنخاعية (الشكل 1C)4,5,6 . ترتبط خلايا CPE ارتباطا وثيقا عن طريق تقاطعات ضيقة ، وبالتالي تمنع التسرب من الشعيرات الدموية الأساسية إلى السائل الدماغي الشوكي والدماغ. بالإضافة إلى ذلك ، يتم تنظيم النقل عبر خلايا CPE من خلال عدد من أنظمة النقل الداخلية والخارجية التي تدير تدفق المركبات المفيدة (مثل العناصر الغذائية والهرمونات) من الدم إلى السائل الدماغي الشوكي وتدفق الجزيئات الضارة (مثل النفايات الأيضية والناقلات العصبية الزائدة) في الاتجاه الآخر 1,6. لتكون قادرة على ممارسة وظيفة النقل النشطة ، تحتوي خلايا CPE على العديد من الميتوكوندريا في السيتوبلازم7. علاوة على ذلك ، فإن CP هو المصدر الرئيسي ل CSF ويعمل كحارس بوابة للدماغ من خلال وجود الخلايا الالتهابية المقيمة1. نظرا لموقعه الفريد بين الدم والدماغ ، فإن CP في وضع مثالي لإجراء المراقبة المناعية8.
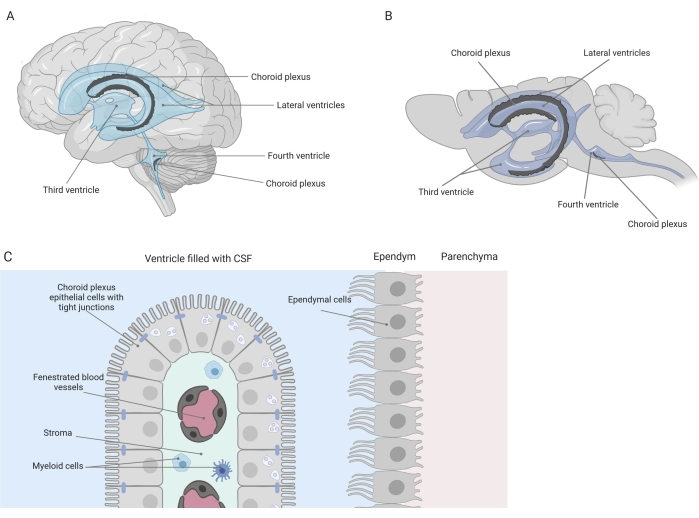
الشكل 1: نظرة عامة تخطيطية على موقع وتكوين الضفيرة المشيمية (CP). (أ ، ب) يوجد نسيج CP داخل البطينين الجانبيين والثالث والرابع من (أ) دماغ الإنسان و (ب) الفأر. (ج) يتكون نسيج CP من طبقة واحدة من خلايا ظهارة CP مكعبة متصلة بإحكام (CPE) تحيط بالشعيرات الدموية الملتزة ، والنسيج الضام الرخو ، والخلايا اللمفاوية والنخاعية ، وتشكل حاجز السائل الدموي النخاعي (تم تكييفه وتعديله من المرجع23). تم إنشاء الشكل باستخدام Biorender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
على مدى العقد الماضي، كشفت أدلة متزايدة، بما في ذلك العديد من التقارير الصادرة عن مجموعتنا البحثية، أن الإنتاج الأنظف يلعب دورا مركزيا في الصحة والمرض9،10،11،12،13،14،15،16،17،18. على سبيل المثال ، من المعروف أن حاجز الدم CSF القديم يعرض تغيرات مورفولوجية في ، من بين أمور أخرى ، النوى ، الزغابات الدقيقة ، والغشاء القاعدي 1,19. بالإضافة إلى ذلك ، في سياق مرض الزهايمر ، تتعرض سلامة الحاجز العام للخطر ويبدو أن كل هذه التغييرات المرتبطة بالعمر أكثر وضوحا1،8،20. بالإضافة إلى التغيرات المورفولوجية ، يتم تغيير النسخ والبروتين وإفراز CP أثناء المرض12،21،22،23. وبالتالي ، فإن المعرفة المتقدمة بالإنتاج الأنظف ضرورية لفهم دوره في الأمراض العصبية بشكل أفضل وربما تطوير استراتيجيات علاجية جديدة.
طريقة فعالة للتشريح الدقيق لل CP من البطينين في الدماغ هي الخطوة الأولى التي لا تقدر بثمن للسماح بالتحقيق المناسب في بنية الدماغ الصغيرة هذه. نظرا لطبيعته الوعائية العالية (الشكل 2 ب) ، يمكن التعرف على CP العائم داخل تجاويف البطين في الدماغ باستخدام مجهر مجهر. ومع ذلك ، غالبا ما يكون التروية عبر القلب مطلوبا للتحليل النهائي ، مما يعقد التحديد الصحيح وعزل أنسجة CP (الشكل 2C). إذا سمحت خطوات المعالجة الإضافية (على سبيل المثال ، في حالة تحليل الحمض النووي الريبي والبروتين) ، يمكن تصور CP عن طريق التروية عبر القلب مع بروموفينول الأزرق (الشكل 2 أ). تصف العديد من المنشورات بالفعل عزل CP عن أدمغة الجرذ24 وجرو الفأر25. هنا ، يتم وصف تقنية عزل التشريح المجهري لعزل CP عن الفئران البالغة. الأهم من ذلك ، أن تقنية العزل هذه تحافظ على صلاحية الخلايا ووظيفتها وهيكلها داخل CP. يتم وصف عزل CP العائم في البطينين الرابع والجانبي هنا. باختصار ، يتم تخدير الفئران بشكل نهائي ، وإذا لزم الأمر ، يتم تعطيرها عبر القلب. ومع ذلك ، تجدر الإشارة إلى أن التروية يمكن أن تلحق الضرر ببنية الخلايا داخل CP. وبالتالي ، إذا كان سيتم تحليل العينة باستخدام المجهر الإلكتروني النافذ (TEM) ، أو المجهر الإلكتروني الماسح الإلكتروني للوجه التسلسلي (SBF-SEM) ، أو حزمة الأيونات المركزة SEM (FIB-SEM) ، فلا ينبغي إجراء التروية. بعد ذلك ، يتم عزل الدماغ كله ، ويستخدم الملقط لتشويه الدماغ سهميا. من هنا ، يمكن تحديد CPs العائمة في البطينين الجانبيين وتشريحها ، بينما يمكن عزل CP من البطين الرابع من الجانب المخيخي من الدماغ.
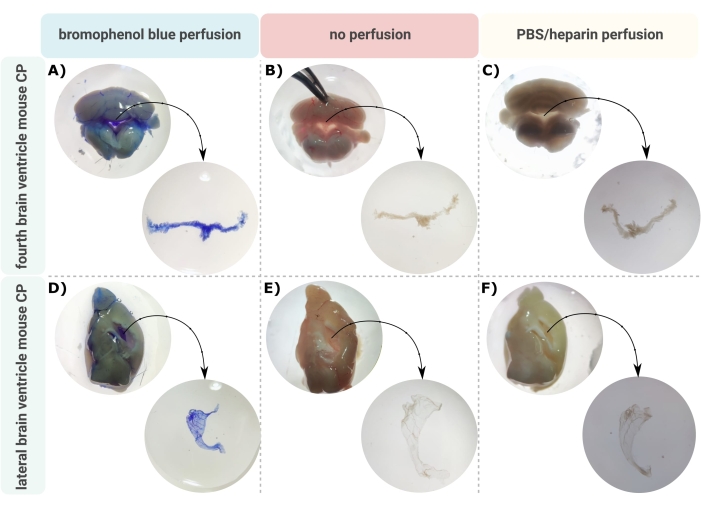
الشكل 2: تصور الضفيرة المشيمية البطينية الجانبية (A-C) الرابعة و (D-F) بعد (A ، D) نضح البروموفينول الأزرق ، (B ، E) بدون تروية ، و (C ، F) التروية مع PBS / الهيبارين. يتم التقاط الصور بمجهر ستيريو (تكبير 8x-32x). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بمجرد تشريح الشلل الدماغي بشكل صحيح من البطينين الدماغيين ، يمكن تطبيق ذخيرة كاملة من التقنيات لاكتساب مزيد من الفهم حول وظيفة هذا الهيكل. على سبيل المثال ، يمكن إجراء قياس التدفق الخلوي أو تسلسل الحمض النووي الريبي أحادي الخلية لتحديد وتحليل الخلايا الالتهابية المتسللة في ظل ظروف مرضية معينة26,27. بالإضافة إلى التركيب الخلوي ، يمكن تحليل التركيب الجزيئي لل CP لتقييم وجود السيتوكينات والكيموكينات عبر مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) ، أو اللطخة المناعية ، أو من خلال التحليل المتزامن للعديد من السيتوكينات باستخدام مصفوفة حبة السيتوكين28. علاوة على ذلك ، يمكن إجراء تحليلات النسخ والأوعية الدموية وأنسجة الخلايا المناعية والإفرازات على نباتات CP المجهرية29. هنا ، يتم استخدام المجهر الإلكتروني الماسح (SEM) على CP الكامل للحصول على رؤية شاملة لهيكل CP. يستخدم SEM حزمة من الإلكترونات المركزة لمسح السطح وإنشاء صورة لتضاريس السطح وتكوينه. نظرا لأن الطول الموجي للإلكترونات أصغر بكثير من الطول الموجي للضوء ، فإن دقة SEM تقع في نطاق النانومتر وتتفوق على دقة المجهر الضوئي. وبالتالي ، يمكن إجراء الدراسات المورفولوجية على المستوى دون الخلوي عبر SEM. باختصار ، يتم نقل CP التشريح على الفور إلى مثبت يحتوي على الجلوتارالدهيد للتثبيت بين عشية وضحاها ، يليه التناضح وتلطيخ خلات اليورانيل. ثم تتم معالجة العينات بصبغة الرصاص والأسبارتات ، المجففة ، وتضمينها في النهاية للتصوير.
وبالتالي ، فإن هذا البروتوكول يسهل العزل الفعال لل CP من البطينين في دماغ الفأر ، والذي يمكن تحليله بشكل أكبر باستخدام مجموعة متنوعة من تقنيات المصب للتحقيق في هيكله ووظيفته.
Protocol
أجريت جميع التجارب على الحيوانات الموصوفة في هذه الدراسة وفقا للتشريعات الوطنية (القانون البلجيكي 14/08/1986 و 22/12/2003 ، المرسوم الملكي البلجيكي 06/04/2010) والتشريعات الأوروبية (توجيهات الاتحاد الأوروبي 2010/63 / EU ، 86/609 / EEC). تمت الموافقة على جميع التجارب على الفئران والبروتوكولات الحيوانية من قبل لجنة الأخلاقيات بجامعة غنت (أرقام التصاريح LA1400091 و EC 2017-026).
1. التحضير
- التخدير: تحضير مخدر نهائي. على سبيل المثال ، يمكن تحضير محلول بنتوباربيتال الصوديوم (≥100 مجم / كجم) في محلول ملحي مخزن بالفوسفات (PBS).
- محلول التروية عبر القلب: تحضير 10 مل (لكل فأر) من محلول PBS / الهيبارين (يحتوي على 0.2٪ هيبارين) مكمل ب 0.5٪ بروموفينول أزرق.
ملاحظة: إذا سمحت خطوات المعالجة النهائية (على سبيل المثال ، في حالة تحليل الحمض النووي الريبي والبروتين) ، يمكن تصور الضفيرة المشيمية (CP) عن طريق التروية عبر القلب مع بروموفينول الأزرق. إذا كان بروموفينول الأزرق غير متوافق مع خطوات المعالجة الإضافية (على سبيل المثال ، للتصوير) ، استخدم PBS / الهيبارين للتعطيل. - إعداد الحلول المطلوبة لتحليل التسويق عبر محرك البحث.
- تحضير 0.1 M Na-cacodylate العازلة (درجة الحموضة 7.4). تحضير محلول من 2 ٪ بارافورمالدهيد و 2.5 ٪ غلوتارالدهيد في 0.1 M Na-cacodylate العازلة. اصنع 20 مل من هذا المحلول لكل عينة.
- تحضير 2٪ رابع أكسيد الأوزميوم في محلول Na-cacodylate 0.1 M (5 مل لكل عينة).
- قم بإعداد حلول EtOH بنسبة 50٪ و 70٪ و 85٪ و 100٪. تحضير 5 مل من كل محلول EtOH لكل عينة.
2. التشريح المجهري للضفيرة المشيمية من البطين الجانبي والرابع
ملاحظة: تم استخدام إناث الفئران C57BL / 6 البالغة من العمر 9 أسابيع في هذه الدراسة. ومع ذلك ، فإن تقنية العزل الموصوفة مستقلة عن سلالة وجنس وعمر الفأر البالغ.
- عزل دماغ الفأر.
- حقن جرعة مميتة داخل الصفاق من الباربيتورات قصيرة المفعول (>100 ملغم / كغم ، أعدت في الخطوة 1.1) باستخدام إبرة 26G لتخدير الفأر نهائيا. تحقق من منعكس القدم للماوس عن طريق الضغط على مخلبه الخلفي بالملقط.
- عندما لا يكون هناك منعكس للقدم ، ضع الحيوان المخدر نهائيا في وضع الاستلقاء الظهري وقم بتثبيت الماوس عن طريق تثبيت الأطراف على طبق.
ملاحظة: إذا لم تكن هناك حاجة إلى نضح الفئران عبر القلب ، اعتمادا على طريقة تحليل المصب (على سبيل المثال ، لتصوير SEM) ، فانتقل إلى الخطوة 2.1.7. ومع ذلك ، إذا كانت هناك حاجة إلى التروية لإزالة خلايا الدم أو المكونات الأخرى في الدم ، فيمكن تصور CP كهيكل أزرق يطفو في بطينات الدماغ عن طريق التروية مع البروموفينول الأزرق. - تطهير الصدر عن طريق رش 70 ٪ من الإيثانول. ضع ستارة معقمة حول منطقة الجراحة. قم بعمل شق ~ 4 سم أسفل الحجاب الحاجز مباشرة باستخدام شفرة جراحية من الفولاذ الكربوني (انظر جدول المواد).
- افتح الجلد وكشف الصدر باستخدام مقص جراحي. قطع الحجاب الحاجز مفتوحة تماما.
- افصل الصدر لكشف الرئتين والقلب النابض.
- قم بتغذية الفئران عبر القلب ب 10 مل من محلول التروية بمعدل 4.5 مل / دقيقة ، باستخدام مضخة التروية (انظر جدول المواد). سوف يستغرق التروية ~ 2 دقيقة. أدخل إبرة 26G في البطين الأيسر لضخ المحلول في الدائرة الجهازية. بالإضافة إلى ذلك ، قم بعمل قطع بمقص جراحي في الأذين الأيمن حتى يخرج الدم من الدورة الدموية.
ملاحظة: تفضل مضخة التروية على الإدارة اليدوية للسائل ، لأنها ستوصل السوائل بمعدل مبرمج بدقة وتضمن أن قوى القص الناتجة عن التروية ليست قوية جدا. ستؤثر قوى القص المفرطة على صلاحية الخلايا وهيكلها داخل CP. بالإضافة إلى ذلك ، فإن معدل تدفق التروية الموصى به هنا هو الأمثل لتعطير الفئران البالغة من 7 أسابيع فصاعدا. إذا تم استخدام الفئران الأصغر سنا ، فيجب استخدام معدل تدفق أقل. من المهم أيضا التخلص من الدم الذي يخرج من الأذين الأيمن من أجل الحفاظ على موقع جراحي نظيف. - قطع رأس الماوس.
ملاحظة: انتبه لقطع الرأس إلى أدنى مستوى ممكن من الكتف للحفاظ على بنية الدماغ. إذا كان الجرح مرتفعا جدا ، فقد يتلف المخيخ. - بعد قطع الرأس ، قم بفتح فروة الرأس عن طريق إجراء شق من بين الأذنين لأعلى من العينين. اسحب الجلد بشكل جانبي لكشف الجمجمة. ثم ، افتح الجمجمة باتباع الغرز الحرشفية ، باتجاه الجزء الأنفي.
ملاحظة: من المهم إزالة الجمجمة برفق للحفاظ على سلامة الدماغ. - ضع الدماغ في طبق بتري بارد وأضف 1 مل من الثلج البارد 1x PBS على أنسجة المخ.
ملاحظة: ليست هناك حاجة لطلاء الطبق.
- عزل CP العائم في البطين الرابع.
- قطع بلطف المخيخ من المخ بمشرط. المخ هو الجزء الأكبر من الدماغ ، في حين أن المخيخ هو جزء أصغر بكثير في الجزء الخلفي من الدماغ. إذا لزم الأمر، قم بإزالة أجزاء أنسجة جذع الدماغ المتبقية من المخيخ.
- قم بتدوير الدماغ بحيث يكون خط القطع متجها لأعلى. تأكد من أن تجويف البطين الرابع مرئي الآن في منتصف القسم ، مع طفو CP في الموقع الظهري. إذا لزم الأمر ، افتح البطين قليلا عن طريق فتح النسيج الضام بالملقط الحاد. وبهذه الطريقة، سيكون الإنتاج الأنظف أكثر وضوحا وأسهل في الوصول إليه.
- قم بتمزيق CP برفق من جدار البطين باستخدام ملقط حاد صغير.
ملاحظة من المهم لمس الشلل الدماغي وإخراجه فقط في هذه الخطوة حتى لا تلوث العينة بالأنسجة المحيطة. فتح البطينين كما هو موضح في الخطوة 2.2.2 سيسهل الخطوة 2.2.3.
- عزل CP جاحظ من البطين الجانبي.
- استخدم ملقط حاد صغير لقطع الدماغ سهميا إلى نصفي الكرة الأرضية.
- قم بتدوير الدماغ بحيث يكون خط القطع متجها لأعلى. للكشف عن البطين الجانبي، اسحب القشرة برفق بعيدا عن المهاد.
- اسحب الحصين إلى خط القطع السهمي. البطين الجانبي مرئي الآن مع CP ملقى في أسفل البطين. إذا لزم الأمر ، افتح البطين قليلا عن طريق فتح النسيج الضام بالملقط الحاد. وبهذه الطريقة، سيكون الإنتاج الأنظف أكثر وضوحا وأسهل في الوصول إليه.
- استخدم ملقط حاد صغير لتمزيق CP برفق من جدار البطين.
ملاحظة: من المهم لمس الشلل الدماغي وإخراجه فقط في هذه الخطوة حتى لا تلوث العينة بالأنسجة المحيطة. فتح البطينين كما هو موضح في الخطوة 2.3.4 سيسهل الخطوة 2.3.5. توخي الحذر اللازم في هذه الخطوة للحفاظ على بنية الإنتاج الأنظف قدر الإمكان. من الأسهل البدء في سحب CP في المنبر إلى الاتجاه الذيلي.
3. التحليل المورفولوجي لأنسجة CP باستخدام المجهر الإلكتروني الماسح (SEM)
تنبيه: تستخدم المحاليل السامة في خطوات المعالجة التالية. يوصى بإجراء تحضير العينة في غطاء الدخان.
- قم بإعداد العينة ل SEM كما هو موضح أدناه.
- انقل CP المعزول الطازج إلى محلول تثبيت طازج يحتوي على 2٪ بارافورمالدهيد و 2.5٪ جلوتارالدهيد في محلول Na-cacodylate 0.1 M (درجة الحموضة 7.4). احتضان بين عشية وضحاها في 4 درجة مئوية.
ملاحظة: نظرا لأن نسيج CP هش ورقيق للغاية ، يجب وضع الأنسجة في سلال عينات صغيرة (انظر جدول المواد) لنقلها بين المخازن المؤقتة. بهذه الطريقة ، سيتم الحفاظ على بنية الأنسجة بشكل أفضل. يتم استخدام المثبت القائم على الكاكوديلات على المثبت القائم على PBS ، حيث يمكن للمخزن المؤقت القوي للكاكوديلات مواجهة انخفاض درجة الحموضة للجلوتارالدهيد في مثبت EM. - اغسل العينة 3 مرات لمدة 5 دقائق لكل منها 3-5 مل من محلول Na-cacodylate 0.1 M (درجة الحموضة 7.4).
- بعد إصلاح العينات في 3-5 مل من رابع أكسيد الأوزميوم 2٪ في 0.1 متر محلول Na-cacodylate لمدة 30 دقيقة. اغسل العينات 3 مرات لمدة 5 دقائق لكل منها 3-5 مل من الماء عالي النقاء.
- قم بتجفيف العينات في سلسلة من المحاليل الباردة الثلجية لزيادة تركيزات EtOH (50٪ ، 70٪ ، 85٪ ، 100٪) ، لمدة 15 دقيقة لكل محلول EtOH. استخدم مجفف النقاط الحرجة لتجفيف العينة بشكل صحيح.
ملاحظة يؤثر التغيير من الطور السائل إلى الطور الغازي على التوتر السطحي ، مما يتسبب في تلف بنية السطح. تسمح خطوة تجفيف النقطة الحرجة بالحفاظ على بنية السطح. - ضع العينة بعناية على حامل عينة مزود بملصق كربوني (انظر جدول المواد).
- قم بتغطية العينات بطبقة رقيقة (2-5 نانومتر) من البلاتين. للقيام بذلك ، قم بتركيب مصدر بلاتين في نظام تفريغ بين طرفين كهربائيين عالي التيار وقم بتسخين البلاتين إلى درجة حرارة التبخر. يتم ترسيب تيار دقيق من البلاتين على العينة.
ملاحظة: يرد بروتوكول أكثر تفصيلا لهذه الخطوة في المرجع30. إلى جانب البلاتين ، يمكن أيضا استخدام الذهب أو الذهب / البلاديوم.
- انقل CP المعزول الطازج إلى محلول تثبيت طازج يحتوي على 2٪ بارافورمالدهيد و 2.5٪ جلوتارالدهيد في محلول Na-cacodylate 0.1 M (درجة الحموضة 7.4). احتضان بين عشية وضحاها في 4 درجة مئوية.
- تصور عينات الإنتاج الأنظف باستخدام التسويق عبر محرك البحث (انظر جدول المواد). يشبه إجراء التصور لأنسجة CP عبر SEM إجراء الأنواع الأخرى من الأنسجة ويعتمد على البرامج والأدوات المستخدمة. يتوفر بروتوكول SEM خطوة بخطوة مع فيديو مصاحب في المرجع31 أو المرجع30.
النتائج
يسهل البروتوكول الموصوف العزل الفعال لل CP من البطينين الجانبي لدماغ الفأر (الشكل 2A-C) والرابع (الشكل 2D-F). بعد عزل الدماغ كله ، يتم استخدام الملقط لسهمي الدماغ وتحديد CPs العائمة في البطينين الجانبيين. يمكن عزل CP من البطين الرابع من الجانب المخيخي من الدماغ. يمكن استخدام التروية مع البروموفينول الأزرق لتصور CP (الشكل 2A ، D) ؛ ومع ذلك ، عندما لا يسمح ببروموفينول أزرق في خطوات المعالجة الإضافية ، يمكن إجراء التروية باستخدام PBS / الهيبارين (الشكل 2C ، F) أو عدم التروية (الشكل 2B ، E). بعد عزل الشلل الدماغي خارج البطينين الدماغيين ، يمكن إجراء مجموعة كاملة من التحليلات على الأنسجة. وتشمل هذه التنميط الجيني (RT-qPCR)28 ، التنميط نوع الخلية (قياس التدفق الخلوي32 ، تسلسل الحمض النووي الريبي أحادي الخلية 26,27) ، والكشف عن السيتوكينات والكيموكينات 28 عبر مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) ، أو اللطخة المناعية ، أو المقايسات المناعية المتعددة. علاوة على ذلك ، يمكن وضع CP المصغر في الثقافة لجعل CP explants لمزيد من توضيح الوظيفة ، وعلى سبيل المثال ، دراسة إفرازه استجابة لحافز معين23،28،29. في هذه المخطوطة ، نصف كيفية إجراء المجهر الإلكتروني الماسح (SEM) للتحليل الشكلي لسطح خلايا الضفيرة المشيمية الظهارية (CPE). يوضح الشكل 3 صورا عامة ل CP المعزول من البطين الرابع (الشكل 3A) و CP المعزول من البطين الجانبي (الشكل 3B) ، الذي تم الحصول عليه عبر SEM. تظهر هذه الصور بوضوح الشكل النموذجي على شكل C لل CP الجانبي وهيكل ذراعين للبطين الرابع CP.

الشكل 3: نظرة عامة على مسح صور المجهر الإلكتروني (SEM) لأنسجة الضفيرة المشيمية (CP) المشرحة . (أ ، ب) صورة SEM تمثيلية ل CP معزولة من البطينين الجانبيين (A) الرابع و (B) لدماغ الفأر. شريط المقياس = 100 ميكرومتر. الإعدادات: التوتر العالي للإلكترون (EHT) = 5.00 كيلو فولت ؛ مسافة العمل (WD) = 4.8 مم الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
من خلال تكبير خلايا CPE ، يمكن اكتشاف خلايا أخرى على الجانب القمي لخلايا CPE (الشكل 4A). من المحتمل أن تكون الخلية الملتقطة في الصورة خلية epiplexus ، وهي خلية تشبه البلاعم الموجودة على السطح القمي لل CP. ومع ذلك ، لا يمكن تحديد الطبيعة المحددة لهذه الخلية عبر SEM. بالإضافة إلى التصوير ب SEM ، من الممكن إجراء تصوير ثنائي الفوتون لظهارة الضفيرة المشيمية في النباتات الحية ، كما هو موضح بواسطة Shipley et al.29. بينما يسهل SEM تصور الهياكل السطحية للإنتاج الأنظف ، يمكن للتصوير ثنائي الفوتون أن يتيح تصور مجموعة واسعة من الخلايا والعمليات الخلوية طالما يمكن مراقبتها بالفلورسنت. وهذا يشمل تصور الخلايا الوعائية والمناعية ، وكذلك الأحداث الإفرازية في CP explant29.
كشف تكبير SEM الأعلى عن هياكل تشبه الحويصلة على الجانب القمي لخلايا CPE (الشكل 4B) وكذلك الزغابات الدقيقة (الشكل 4C). تبرز هذه الزغابات الدقيقة في السائل النخاعي (CSF) وتزيد من مساحة سطح خلية CPE بين الخلايا والسائل الدماغي الشوكي. تظهر هذه النتائج أنه يمكن التحقيق في التغيرات المورفولوجية لخلايا CPE في حالات المرض باستخدام SEM.

الشكل 4: صور تفصيلية للفحص المجهري الإلكتروني (SEM) لأنسجة الضفيرة المشيمية (CP). أ: خلية على الجانب القمي من خلايا الضفيرة المشيمية الطلائية. شريط المقياس = 2 ميكرومتر. (ب) هياكل تشبه الحويصلة على الجانب القمي لخلايا CPE. شريط المقياس = 10 ميكرومتر. (ج) تصور سطح خلية CPE مع الزغابات الدقيقة. شريط المقياس = 1 ميكرومتر. الإعدادات: التوتر العالي للإلكترون (EHT) = 5.00 كيلو فولت ؛ مسافة العمل (WD) = 4.9 مم ؛ تكبير 3000x. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا ، يتم وصف طريقة لعزل الضفيرة المشيمية (CP) من البطين الجانبي والبطين الرابع لدماغ الفأر. تسهل طريقة التركيب الكاملة للإنتاج الأنظف إجراء مزيد من التحليل باستخدام مجموعة من التقنيات للحصول على رؤية كاملة لمورفولوجيا الإنتاج الأنظف والتركيب الخلوي والنسخ والبروتين والإفرازات. مثل هذه التحليلات ضرورية للحصول على فهم أفضل لهذا الهيكل الرائع البارز من البطينين في الدماغ. هذه المعرفة ذات أهمية بحثية كبيرة ، حيث أصبح من الواضح بشكل متزايد أن الإنتاج الأنظف يلعب دورا حاسما في الصحة والمرض9،10،11،12،13،14،15،16،17،18.
الخطوات الهامة والتعديلات واستكشاف الأخطاء وإصلاحها للطريقة
من الأهمية بمكان التحقق من منعكس القدم للماوس للتأكد من أن التخدير النهائي يتم تنفيذه بشكل جيد. إلى جانب الأسباب الأخلاقية ، يضمن هذا أيضا الاحتفاظ بالماوس في المكان المناسب أثناء تنفيذ الإجراء التجريبي. الهدف هو تخدير الحيوان حتى لا يعاني من الألم أثناء العملية بينما ينبض القلب في وقت التروية. إذا كانت المعالجة الإضافية للأنسجة تتطلب إزالة الدم ، فيمكن إجراء نضح عبر القلب. يستخدم الهيبارين المحتوي على محلول ملحي هنا لتجنب تخثر الدم. يمكن أيضا استخدام EDTA لهذا الغرض ، ومع ذلك ، إذا كان من الضروري الحفاظ على صلاحية الخلية ، فإن الهيبارين هو خيار أفضل من EDTA. يجب أن يبدأ التروية فورا عندما يتوقف القلب عن النبض بسبب التخدير المفرط. يفضل استخدام مضخة التروية على الإدارة اليدوية للسائل ، حيث يتيح ذلك توصيل السوائل بمعدل مبرمج بدقة ويضمن أن قوى القص الناتجة عن التروية ليست قوية جدا. ستؤثر قوى القص المفرطة على صلاحية الخلايا وهيكلها داخل CP.
يتطلب الأمر عينا مدربة لتكون قادرة على رؤية CP العائم في البطينين في دماغ الفأر. لهذا السبب ، من الأهمية بمكان ممارسة الكثير. يوصى ببدء التدريب على الفئران المليئة بالبروموفينول الأزرق ، لأن هذا سيؤدي إلى تلطيخ CP باللون الأزرق ويسهل تمييز أنسجة CP الصغيرة عن بقية الدماغ (الشكل 2A ، D). في التجارب اللاحقة ، يمكن عزل CP من فأر غير مطبق. هذا أصعب مقارنة بعزل CP من فأر بروموفينول أزرق النفاذية ، ولكن لا يزال من الممكن تحديد نسيج CP من طبيعته شديدة الأوعية الدموية (الشكل 2B ، E). فقط بعد التدريب المكثف ، يمكن عزل أنسجة CP خارج البطينين في الدماغ من فأر غير معطر دون تلوث بحمة الدماغ (الشكل 2C ، F).
إن CP عبارة عن بنية هشة ورقيقة للغاية ، مما يعني أنه يجب إجراء عزلها بالحكمة اللازمة من أجل الحفاظ على صلاحية الخلايا ووظيفتها وهيكلها داخلها. وبالتالي ، يجب تنفيذ خطوات مختلفة في البروتوكول الموصوف بالدقة والحذر اللازمين للحفاظ على سلامة الدماغ. أولا ، من المهم قطع رأس الماوس بالقرب من الكتفين. إذا كان الجرح مرتفعا جدا ، فقد يتلف المخيخ ، مما يعقد عزل CP في البطين الرابع. بعد ذلك ، يجب إزالة الجمجمة بعناية حتى لا تتلف الدماغ. بمجرد عزل الدماغ ، من الضروري إبقائه باردا لمنع الدماغ من أن يصبح طريا ، لأن هذا سيعقد بشكل كبير عزلة الشلل الدماغي. للقيام بذلك ، من المهم وضع الدماغ على طبق بتري بارد وإضافة برنامج تلفزيوني بارد على الدماغ. من الضروري وجود مستوى معين من التدريب لأداء تقنية العزل الموصوفة لأن هذا سيقصر بشكل كبير وقت المعالجة بين قطع رأس الماوس والعزل النهائي لل CP. ستعزز عملية العزل القصيرة صلاحية الأنسجة المعزولة والحفاظ على هيكلها. أخيرا ، يجب أن تكون الأدوات المستخدمة للعزل ، وخاصة الملقط ، حادة وموجهة لتسهيل العزل السريع والفعال لل CP خارج البطينين. ومع ذلك ، يجب توخي الحذر لعدم الإضرار بسلامة الهيكل أثناء العزل.
للحفاظ على سلامة الأنسجة أثناء معالجة العينات ل SEM ، يمكن وضع CP في سلال عينات صغيرة عند النقل بين المخازن المؤقتة ، بحيث يمكن تجنب لمس الأنسجة نفسها. علاوة على ذلك ، يوصى بإجراء تجفيف النقاط الحرجة عند نقل الأنسجة خارج محاليل EtOH. وهذا يضمن الحفاظ على البنية السطحية للإنتاج الأنظف، بما في ذلك الزغابات الدقيقة. التوتر السطحي ، الناجم عن الانتقال من المرحلة السائلة إلى المرحلة الغازية ، يمكن أن يضر بهذه الهياكل.
حدود الطريقة
كما ذكرنا سابقا، فإن الإنتاج الأنظف عبارة عن بنية صغيرة، واعتمادا على التحليلات النهائية (على سبيل المثال، قياس التدفق الخلوي)، قد يكون من الضروري تجميع الإنتاج الأنظف من فئران مختلفة. تتمثل إحدى العقبات المهمة في عزل الشلل الدماغي في تحديد الهيكل عندما لا يزال يطفو في البطين. تسهل الطبيعة الوعائية للغاية لل CP تحديده الصحيح (بعد بعض التدريب) داخل تجاويف البطين في الدماغ. ومع ذلك ، إذا كانت هناك حاجة لإزالة المكونات المحتوية على الدم لمزيد من التحليل ، فإن التروية عبر القلب ضرورية. اعتمادا على تحليل المصب ، يمكن إجراء التروية مع البروموفينول الأزرق ، والتي سوف تلطخ CP الأزرق ، وبالتالي تسهيل عزل الأنسجة. لسوء الحظ ، فإن تقنية التصور هذه ليست ممكنة دائما (على سبيل المثال ، لتلطيخ الكيمياء المناعية). في مثل هذه الحالات، يجب عزل الحزب الشيوعي بشكل أعمى، الأمر الذي يتطلب تدريبا كافيا. يمكن أن يساعد اللعب بحيود الضوء في المجهر في تحديد CP العائم في البطينين. بالإضافة إلى ذلك ، تصف هذه المخطوطة عزل CP العائم في البطينين الرابع والجانبي ، بينما لم تتم مناقشة عزل البطين الثالث CP.
الأهمية فيما يتعلق بالأساليب الحالية
في هذا البروتوكول ، يتم تشريح CP أولا من البطينين في الدماغ قبل إجراء مزيد من التحليل. إذا تم استخدام إجراء تلطيخ كقراءة متابعة ، فمن الممكن أيضا تلطيخ أقسام الدماغ التي تحتوي على CP. القيمة المضافة لهذه التقنية الأخيرة هي أن اتجاه نسيج CP داخل البطينين والدماغ لا يزال مرئيا ، وهذا ليس هو الحال إذا تم تشريح CP أولا من البطينين الدماغيين. من ناحية أخرى ، فإن تلطيخ قسم الدماغ الذي يحتوي على CP يوفر معلومات فقط من هذا القسم المحدد ، في حين أن تلطيخ CP المعزول يمكن أن يساعد في جمع معلومات حول CP بأكمله.
ميزة التقنية الموصوفة هي أنها تحافظ على صلاحية ووظيفة وهيكل الخلايا داخل CP. علاوة على ذلك ، تسهل هذه الطريقة العزلة الكاملة لل CP العائم في البطينين الدماغيين الرابع والجانبي في الفئران البالغة. تم الإبلاغ سابقا عن طرق عزل CP (على سبيل المثال ، من أدمغة الفئران24 وأدمغة جرو الفئران25). ومع ذلك ، من المهم مراعاة أن تقنية العزل يمكن أن تختلف من نوع إلى آخر وبين الأعمار الصغيرة والبالغة.
تطبيقات إضافية لهذه التقنية
إلى جانب الحفاظ على صلاحية الخلايا ووظيفتها وهيكلها داخل CP ، تسهل تقنية العزل هذه تطبيق تقنيات المصب لاكتساب فهم أعمق لوظيفة الإنتاج الأنظف. على سبيل المثال ، يمكن إجراء قياس التدفق الخلوي أو تسلسل الحمض النووي الريبي أحادي الخلية لتحديد خلايا CP وتحليلها ظاهريا والخلايا المتسللة في ظل ظروف مرضية معينة26,27. بالإضافة إلى ذلك ، يمكن التحقيق في التركيب الجزيئي لل CP لتقييم وجود السيتوكينات والكيموكينات عبر مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) ، أو اللطخة المناعية ، أو التحليلات المتزامنة للعديد من السيتوكينات بواسطة ما يسمى بمجموعة حبات السيتوكين. علاوة على ذلك ، يمكن إجراء تحليلات النسخ والأوعية الدموية وأنسجة الخلايا المناعية والإفرازات على نباتات CP المجهرية29.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة البلجيكية لأبحاث الزهايمر (SAO ؛ رقم المشروع: 20200032) ، ومؤسسة الأبحاث فلاندرز (FWO Vlaanderen ؛ أرقام المشروع: 1268823N ، 11D0520N ، 1195021N) وصندوق Baillet Latour. نشكر VIB BioImaging Core على التدريب والدعم والوصول إلى حديقة الأدوات.
Materials
| Name | Company | Catalog Number | Comments |
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
References
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer's disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer's disease. Journal of Alzheimer's Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer's disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved