Method Article
Isolamento e coltura di macrofagi derivati dal midollo osseo da topi
In questo articolo
Riepilogo
Il presente protocollo descrive l'isolamento e la coltura di macrofagi derivati dal midollo osseo dai topi.
Abstract
I macrofagi hanno importanti funzioni effettrici nell'omeostasi e nell'infiammazione. Queste cellule sono presenti in ogni tessuto del corpo e hanno l'importante capacità di modificare il loro profilo in base agli stimoli presenti nel microambiente. Le citochine possono influenzare profondamente la fisiologia dei macrofagi, in particolare l'IFN-γ e l'interleuchina 4, generando rispettivamente i tipi M1 e M2. A causa della versatilità di queste cellule, la produzione di una popolazione di macrofagi derivati dal midollo osseo può essere un passo fondamentale in molti modelli sperimentali di biologia cellulare. Lo scopo di questo protocollo è quello di aiutare i ricercatori nell'isolamento e nella coltura di macrofagi derivati da progenitori del midollo osseo. I progenitori del midollo osseo di topi C57BL/6 privi di patogeni vengono trasformati in macrofagi dopo l'esposizione al fattore stimolante le colonie di macrofagi (M-CSF) che, in questo protocollo, è ottenuto dal surnatante della linea di fibroblasti murini L-929. Dopo l'incubazione, i macrofagi maturi sono disponibili per l'uso dal 7° al 10° giorno. Un singolo animale può essere la fonte di circa 2 x 107 macrofagi. Pertanto, è un protocollo ideale per ottenere grandi quantità di macrofagi primari utilizzando metodi di base di coltura cellulare.
Introduzione
I monociti e i macrofagi sono fagociti mononucleati che possono essere derivati dai progenitori nel midollo osseo. Studi recenti hanno riportato che i macrofagi hanno origine anche da progenitori eritro-mieloidi derivati dal sacco vitellino1. Indipendentemente dalla loro derivazione, questi leucociti hanno importanti funzioni effettrici nell'omeostasi e nell'infiammazione 2,3. I monociti sono cellule del sangue periferico che possono differenziarsi ulteriormente in macrofagi nel tessuto 2,4, mentre i macrofagi sono cellule eterogenee che presentano fenotipi e funzioni regolate dall'esposizione locale di fattori di crescita e citochine5. Poiché i macrofagi mostrano tale diversità funzionale, sono stati studiati in molti modelli di malattia. Pertanto, la coltura in vitro dei macrofagi è diventata uno strumento importante per comprendere la loro fisiologia e il loro ruolo in diverse malattie. Il midollo osseo è un'importante fonte di cellule progenitrici, compresi i progenitori dei macrofagi, che possono essere isolati e moltiplicati, aumentando esponenzialmente il numero di macrofagi ottenuti. Inoltre, i macrofagi derivati dal midollo osseo sono particolarmente importanti per evitare gli effetti generati dal microambiente tissutale, poiché i macrofagi cambiano il loro fenotipo in risposta a diversi stimoli nei tessuti 6,7. I progenitori del midollo osseo si trasformano in macrofagi in seguito all'esposizione al fattore stimolante le colonie di macrofagi (M-CSF)8. I macrofagi derivati dal midollo osseo non possono essere distinti dai macrofagi derivati dai monociti mediante marcatori biochimici nei tessuti. Queste cellule rappresentano una popolazione altamente omogenea di cellule primarie, che per molti altri aspetti sono paragonabili ai macrofagi peritoneali 6,9.
A causa del loro insieme eterogeneo di funzioni cellulari, i macrofagi sono stati a lungo studiati a fondo dai ricercatori. Queste cellule possono essere utilizzate in diversi modelli sperimentali, comprese le malattie infettive e infiammatorie, poiché sono presenti in questi processi10,11. Possono anche essere utili per studiare la polarizzazione dei macrofagi in risposta a vari stimoli microambientali 12,13. Pertanto, viene fornito un protocollo semplice e affidabile allo scopo di ottenere un numero elevato di macrofagi primari dal midollo osseo di topo.
Protocollo
Questo protocollo è stato realizzato in accordo con il Consiglio Nazionale per il Controllo della Sperimentazione Animale (Concea) e con l'approvazione del Comitato Etico e Uso degli Animali (CEUA). I topi C57BL/6 sono stati acquistati da Biotério Central dell'Università Federale di Minas Gerais (UFMG), Belo Horizonte, Brasile. I dispositivi di protezione individuale (DPI) come camici da laboratorio, guanti e protezioni per gli occhi devono essere utilizzati in tutte le fasi descritte in questo protocollo.
1. Preparazione del surnatante del lignaggio dei fibroblasti L-929 come fonte di M-CSF
- Scongelare le cellule del lignaggio dei fibroblasti L-929 (American Type Culture Collection Certified Cell Line-ATCC CCL1) e avviare immediatamente il processo di coltura per preservarne la vitalità.
- In una cappa di biosicurezza a flusso laminare, utilizzando una pipetta da 1.000 μl, trasferire le cellule del lignaggio dei fibroblasti L-929 dalla fiala a una provetta da centrifuga sterile da 50 ml.
- Utilizzare una pipetta sierologica per aggiungere 50 mL di soluzione salina sterile tamponata con fosfato (PBS), priva di calcio e magnesio.
- Centrifugare a 300 x g, 4 °C per 10 min. Scartare il surnatante.
- Risospendere il pellet in 20 mL di Dulbecco's modified medium-F12 integrato con il 10% di siero fetale bovino (FBS) e 1 mL di penicillina/streptomicina (P/S) (DMEM/F12-10) utilizzando una pipetta sierologica.
- Trasferire le cellule risospese in un pallone per coltura cellulare T75.
- Incubare in un incubatore a 37 °C, 5% CO2 fino alla completa confluenza.
NOTA: Durante la manipolazione del pallone, fare attenzione a evitare di bagnare il coperchio con la soluzione, poiché ciò può essere una fonte di contaminazione. Per ottenere una quantità conveniente di surnatante, è necessario replicare le cellule dopo che hanno coperto l'intera superficie del pallone di coltura cellulare. Le cellule L-929 sono inibite dal contatto. Riscaldare la soluzione di tripsina/acido etilendiamminotetraacetico (EDTA), DMEM/F12-10 e PBS sterile a 37 °C per avviare l'espansione della coltura cellulare, come descritto nei passaggi seguenti. - Una volta raggiunta la piena confluenza, scartare il surnatante dal pallone di coltura cellulare, all'interno della cabina di biosicurezza a flusso laminare.
- Lavare il pallone di coltura cellulare con 20 mL di PBS sterile utilizzando una pipetta sierologica ed eliminare la soluzione.
- Aggiungere 10 mL di tripsina/EDTA (soluzione allo 0,05%) al pallone di coltura cellulare contenente le cellule aderite.
- Trasferire il pallone per colture cellulari dal flusso laminare a un incubatore a 37 °C, CO2 al 5% e incubare per 3 minuti.
- Agitare il pallone di coltura cellulare per dissociare le cellule dalla superficie del pallone di coltura e utilizzare un microscopio per assicurarsi che tutte le cellule siano state dissociate.
- Inattivare la tripsina/EDTA (soluzione allo 0,05%) con 10 mL di terreno DMEM/F12-10.
- Trasferire la soluzione utilizzando una pipetta sierologica in una provetta da centrifuga sterile da 50 mL.
- Centrifugare a 300 x g a 4 °C per 10 min. Scartare il surnatante.
- Risospendere il pellet in 10 mL di terreno DMEM/F12-10.
- Aggiungere 1 mL di sospensione cellulare a un pallone per colture cellulari T175 (coltura 1:10).
- Ripetere la procedura per ottenere dieci matracci per colture cellulari T175.
- Aggiungere 50 mL di DMEM/F12-10 a ciascun pallone per colture cellulari.
- Incubare in un incubatore a 37 °C, 5% CO2 fino alla completa confluenza.
NOTA: Questi passaggi garantiscono 500 ml di surnatante cellulare L-929. Il giorno 5, dopo che le cellule hanno coperto la superficie del pallone di coltura cellulare T175, il surnatante sarà arricchito per M-CSF e dovrà essere raccolto14. - Rimuovere il pallone di coltura cellulare dall'incubatore il giorno 5 dopo l'inibizione del contatto.
- Trasferire il terreno in una provetta da centrifuga sterile da 50 mL.
- Centrifugare a 3.200 x g, a 4 °C per 10 min.
- Raccogliere il surnatante arricchito con M-CSF e trasferire la soluzione in una provetta da centrifuga sterile da 50 mL. Conservare in congelatore a -20 °C.
NOTA: La centrifugazione è estremamente importante per rimuovere cellule e detriti dai surnatanti. - Il surnatante L-929 è una fonte conveniente ed economica di fattore stimolante le colonie di macrofagi (M-CSF) e contiene tipicamente da 5 a 10 ng/mL di M-CSF8. Questi surnatanti contengono anche tracce di altre citochine e fattori di crescita, ma non esercitano un'influenza profonda sulla fisiologia dei macrofagi15. Tuttavia, l'M-CSF purificato può essere acquistato e utilizzato in alternativa ai surnatanti di L-929 a concentrazioni comprese tra 1 e 2 ng/mL8.
2. Rimozione del femore e della tibia
- Procedere con l'eutanasia di topo maschio wild-type C57BL-6 di 8 settimane mediante lussazione cervicale dopo asfissia da anidride carbonica, in conformità con la risoluzione normativa numero 18 del Consiglio Nazionale per la Sperimentazione Animale (Concea) e con l'approvazione del Comitato per l'Etica e l'Uso degli Animali (CEUA).
- Immergere il topo con una soluzione di etanolo al 70% e utilizzare forbici sterili per praticare un'incisione di 1 cm lungo l'addome.
- Rimuovere la pelle fino a quando il muscolo delle zampe posteriori non è completamente esposto.
- Rimuovere le zampe posteriori all'altezza dei fianchi, facendo attenzione a non rompere il femore e la tibia.
- Mettere le zampe posteriori in una provetta da centrifuga conica con una soluzione di etanolo al 70%.
NOTA: Utilizzare sempre mouse privi di agenti patogeni. Assicurati di raccogliere entrambe le gambe per ottenere un numero maggiore di celle. La fase 2 viene eseguita in un ambiente non sterile (da banco). Pertanto, è importante rimuovere con cura il femore e la tibia in modo che rimangano intatti per evitare la contaminazione batterica. Le fasi rimanenti di questa procedura vengono eseguite in una cabina di biosicurezza a flusso laminare. Il tempo di esposizione delle zampe alla soluzione di etanolo al 70% deve essere limitato a 10 minuti. Se il tempo è più lungo, i progenitori del midollo osseo possono essere colpiti.
3. Ottenere progenitori del midollo osseo dal lume della tibia e del femore
- Rimuovere le gambe dalla soluzione di etanolo al 70% e trasferirle in PBS sterile.
- Utilizzo di pinze e salviette disinfettanti per rimuovere tutti i muscoli e la fascia. L'osso dovrebbe essere pulito dopo questo passaggio.
- Utilizzare una lama di bisturi chirurgico sterile per tagliare l'epifisi ossea su entrambe le estremità per esporre il midollo osseo.
- Riempire una siringa da 20 ml con 10 ml di PBS sterile integrato con una soluzione di penicillina/streptomicina al 2% e collegare un ago da 26 G.
- Tenere l'osso usando una pinza anatomica per dissezione con una mano e usare l'altra per inserire l'ago nella cavità ossea. Fare attenzione a non schiacciare l'osso con il forcipe.
- Lavare l'interno dell'osso con il PBS e raccogliere il midollo osseo in una provetta da centrifuga conica sterile. Dopo questo passaggio, la cavità ossea dovrebbe apparire bianca.
- Centrifugare le cellule raccolte per 10 minuti a 300 x g a 4 °C.
- Scartare il surnatante e risospendere il pellet cellulare in 1 mL di DMEM/F12-10.
- Omogeneizzare e aggiungere altri 9 mL di terreno DMEM/F12-10 per portare le cellule a un totale di 10 mL.
4. Coltura dei macrofagi
- Aggiungere 1 mL di progenitori cellulari a ciascuna delle piastre di Petri rotonde di plastica da 100 mm x 20 mm (per un totale di 10 piatti), distribuendo le cellule sulle piastre con una pipetta per ottenere una distribuzione uniforme. Non utilizzare piastre trattate con coltura tissutale.
- Aggiungere 9 mL di DMEM/F12-10 integrati con il 20% del surnatante cellulare L-929 a ciascuna piastra.
- Incubare in un incubatore a 37 °C, 5% CO2 .
- Il 3° giorno, aggiungere 10 mL di terreno DMEM/F12-10 integrato con il 20% del surnatante delle cellule L-929 a ciascun piatto. In questo modo, le piastre di coltura hanno ora un totale di 20 mL di terreno di coltura, sufficienti per la crescita delle cellule fino alla fine della loro maturazione.
NOTE: Le piastre trattate con coltura tissutale non devono essere utilizzate perché i macrofagi, in quanto cellule aderenti naturali caratterizzate da forti interazioni con le superfici, non si dissociano facilmente dalla piastra in seguito. Di solito, i progenitori cellulari di un topo (due femori) possono essere seminati in 10 piastre di coltura. I progenitori cellulari si trasformeranno in macrofagi, che possono essere utilizzati dal giorno di incubazione 7 al 10. La conferma della maturazione è identificata dai cambiamenti sulla morfologia dei macrofagi. I macrofagi maturi sono aderenti e mostrano una morfologia eterogenea, spiegata dall'emissione di pseudopodi in diverse direzioni. Esempi di queste cellule mature sono mostrati nei risultati rappresentativi.
5. Raccolta dei macrofagi
- Scartare i surnatanti da tutti i piatti di coltura.
- Lavare ogni piatto di coltura con 10 mL di PBS sterile caldo (37 °C) privo di Mg2+ e Ca2+ .
- Scartare la soluzione da ogni piatto.
- Preriscaldare la soluzione di dissociazione cellulare non enzimatica a 37 °C e aggiungere 3 mL a ciascuna piastra. Incubare per 10 minuti in un incubatore a 37 °C, 5% CO2 . Utilizzare un microscopio invertito per visualizzare se i macrofagi si stanno dissociando dai piatti di coltura.
NOTA: L'uso di piastre di plastica non trattate con colture tissutali dovrebbe consentire la facile dissociazione delle cellule ed evitare la necessità di raschiare le cellule dalla piastra. - Lavare le stoviglie utilizzando una pipetta sierologica con la soluzione di dissociazione cellulare non enzimatica più e più volte, eseguendo movimenti circolari per confermare che tutti i macrofagi siano dissociati dalla piastra.
- Raccogliere la soluzione di tutte le piastre di coltura in una provetta da centrifuga conica da 50 mL.
- Aggiungere 10 mL di PBS sterile preriscaldato alle piastre di coltura vuote e procedere come al punto 5.4. Questa procedura è una ripetizione del passaggio 5.4 e ha lo scopo di garantire che tutti i macrofagi vengano raccolti.
- Centrifugare a 300 x g, 4 °C per 10 min.
- Scartare il surnatante e risospendere il pellet con 1 mL di DMEM/F12-10. Omogeneizzare lentamente e con attenzione su e giù utilizzando la pipetta per evitare di danneggiare le cellule.
- Preparare un'aliquota di 10 μL di soluzione di macrofagi diluita con 10 μL di Blu di Tripano per contare le cellule utilizzando l'emocitometro.
NOTA: Al giorno 7, ogni piatto produrrà circa 2 x 106 macrofagi. Ciò significa che un topo può produrre circa 2 x 107 macrofagi primari quando viene raccolto in dieci piastre. Poiché l'M-CSF guida solo la maturazione dei macrofagi, la procedura garantisce una popolazione di cellule che è essenzialmente solo macrofagi e priva di altri leucociti contaminanti16.
Risultati
I macrofagi sono cellule grandi e aderenti con particolari caratteristiche fisiologiche. Mostrano una diversità di presentazioni morfologiche in coltura a causa della capacità di aderire al vetro e alla plastica, e la loro tipica morfologia diffusa è correlata all'emissione di estensioni citoplasmatiche (Figura 1). Una volta che i progenitori del midollo osseo sono esposti a M-CSF dal surnatante cellulare L-929 e iniziano la trasformazione in macrofagi maturi, diventano aderenti alla piastra di Petri.
La Figura 2 mostra la cinetica della trasformazione dei progenitori del midollo osseo in macrofagi maturi. Il giorno 3 compaiono alcuni macrofagi immaturi, la maggior parte dei quali mostra una tipica morfologia di forma rotonda con poche proiezioni di membrana (Figura 3). Sebbene si trasformino lungo l'intero processo, di solito sono necessari 7 giorni per raggiungere un numero e una maturità adeguati a garantire la massima efficienza del presente protocollo.
Inoltre, i macrofagi sono fagociti (macro = grande; phagos = mangiare) in grado di fagocitare grandi quantità di particelle antigeniche o non antigeniche. Fenotipicamente, sono caratterizzati dall'espressione di molecole di superficie F4/80 e CD11b. L'analisi mediante citometria a flusso mostra che i macrofagi ottenuti attraverso il presente protocollo rappresentano una popolazione omogenea in termini di dimensioni e granularità (Figura 4). Inoltre, il 100% della popolazione esprimeva F4/80 e CD11b, formando un'unica popolazione di cellule ben definita. Inoltre, l'analisi della fagocitosi dei parassiti principali della Leishmania ha mostrato un'enorme capacità di fagocitosi, dimostrando che sono macrofagi maturi e ben differenziati (Figura 5).
I dati microscopici mostrati in questo lavoro sono stati ottenuti utilizzando la microscopia a fluorescenza e a contrasto di fase nel Centro di acquisizione ed elaborazione delle immagini (CAPI-ICB/UFMG).

Figura 1: Coltura di macrofagi derivati da progenitori del midollo osseo, che mostrano diverse morfologie mentre aderiscono alla piastra, al giorno 5. I macrofagi emettono lunghe estensioni citoplasmatiche che consentono loro di muoversi e fagocitare. La luminosità e il contrasto sono stati regolati dopo l'acquisizione delle immagini utilizzando un filtro DIC (Differential Interference Contrast) 20x. Barra = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Cinetica della trasformazione dai progenitori del midollo osseo ai macrofagi maturi ai giorni 1, 3, 5 e 7. La luminosità e il contrasto sono stati regolati dopo l'acquisizione delle immagini utilizzando un filtro DIC 20x. Barra = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
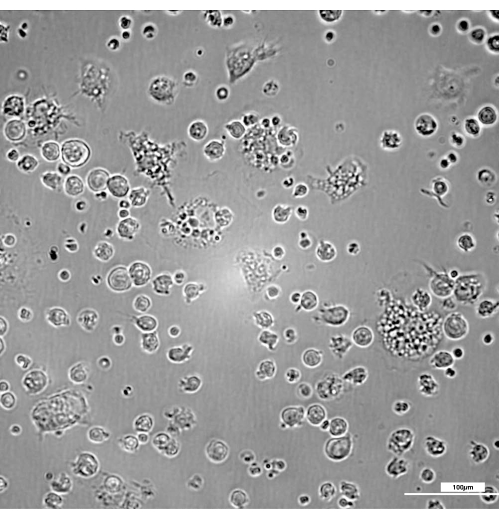
Figura 3: Presenza di macrofagi immaturi leggermente aderenti al giorno 3 con una tipica morfologia di forma rotonda con poche proiezioni di membrana. La luminosità e il contrasto sono stati regolati dopo l'acquisizione delle immagini utilizzando un filtro DIC 20x. Barra = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Analisi in citometria a flusso di macrofagi derivati dal midollo osseo. I macrofagi sono stati staccati dalle piastre del piatto (cell stripper) e colorati con anti-F4/80 FITC e anti-CD11b PE-Cy7. (A) L'aspetto delle cellule in base alle dimensioni e alla granularità (FSC x SSC). (B) L'espressione dei marcatori cellulari F4/80 e CD11b. Clicca qui per visualizzare una versione più grande di questa figura.
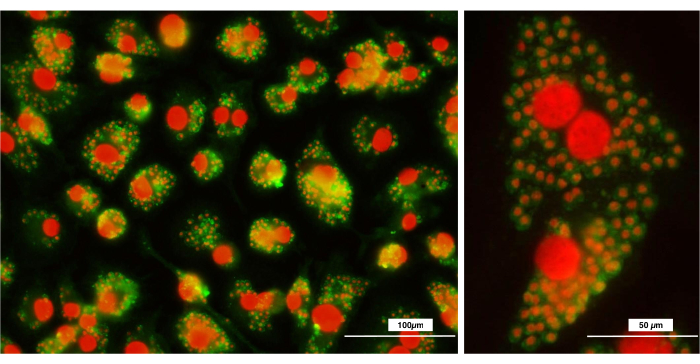
Figura 5: Analisi al microscopio a fluorescenza dopo fagocitosi dei principali parassiti della Leishmania . I macrofagi sono stati staccati dalle piastre e seminati su vetrini rotondi, a cui sono stati aggiunti i principali parassiti della Leishmania . La figura mostra i parassiti fagocitati all'interno dei macrofagi. I parassiti della Leishmania major sono stati colorati con anticorpi FITC anti-Leishmania e i nuclei cellulari (macrofagi e Leishmania major) sono stati controcolorati con ioduro di propidio. (A) 20x; (B) 40x. Barra = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La produzione di una popolazione di macrofagi derivati dal midollo osseo è un passo fondamentale in molti modelli sperimentali di biologia cellulare, soprattutto quando è importante ottenere una popolazione omogenea di cellule primarie. Come accennato, i progenitori cellulari possono trasformarsi in macrofagi solo in presenza di M-CSF. I surnatanti cellulari L-929 possono essere utilizzati come fonte principale di M-CSF. A parte il costo, non ci sono problemi nell'utilizzare l'M-CSF ricombinante stesso 8,17. Ci sono alcune prove che i macrofagi M-CSF ricombinanti mostrano una migliore uniformità in coltura; tuttavia, l'uso di r-M-CSF o surnatante L-929 non fa alcuna differenza significativa nell'espressione genica dei principali marcatori macrofagici e nella produzione di citochine15.
Le cellule progenitrici del midollo osseo sono molto suscettibili. Per evitare la contaminazione, è essenziale l'uso di una cappa di biosicurezza a flusso laminare pulita. Nelle prime fasi di questo protocollo, la rimozione del muscolo dalla superficie ossea produce residui che possono essere fonte di contaminazione. Si consiglia di pulire il cappuccio prima di tagliare l'epifisi ossea ed esporre il midollo osseo. Una volta che i progenitori sono fuori dalla cavità ossea, è importante ricordarsi di maneggiare queste cellule con cura per mantenere la sterilità e la vitalità ottimale.
I topi C57BL/6 sono utilizzati in questo protocollo, ma i topi BALB/C sono ugualmente adatti. I topi di età compresa tra 6 e 10 settimane sono raccomandati per la raccolta di una buona popolazione di macrofagi derivati dal midollo osseo, con la stima di 2 x 107 cellule per topo. I topi più giovani in genere forniscono un numero simile di cellule, ma i femori più piccoli possono presentare alcune sfide alla procedura di isolamento. In genere non osserviamo molte variazioni tra la resa dei macrofagi di diversi ceppi di topi wild-type, nei nostri studi precedenti, ma riconosciamo che alcuni ceppi di topi knockout possono presentare una certa variabilità nella resa 6,8.
Il presente protocollo descrive un modo affidabile per acquisire una colonia primaria di macrofagi utilizzando il surnatante L-929, una tecnica che è stata ben consolidata e utilizzata dai ricercatori per molti anni 18,19. Rispetto ad altri metodi esistenti, questa procedura eccelle per il numero di cellule e l'omogeneità della popolazione, soprattutto se confrontata con i macrofagi peritoneali. Il numero di macrofagi peritoneali residenti è spesso insufficiente, poiché di solito sono necessari milioni di cellule per ogni test e i macrofagi sono solo una piccola frazione trovata nel lavaggio peritoneale 8,20. Il lavaggio peritoneale fornisce anche altri tipi di cellule, come i linfociti e le cellule dendritiche, rendendo impossibile evitare l'interazione e ottenere una coltura di macrofagi non stimolati. Poiché il peritoneo ha un microambiente molto più complesso rispetto alla vitro, la variabilità può essere uno svantaggio per alcune applicazioni 6,21.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni della Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG), della Rede de Pesquisa em Doenças Infecciosas Humanas e Animais do Estado de Minas Gerais (RED-00313-16) e della Rede Mineira de Engenharia de Tecidos e Terapia Celular - REMETTEC (RED-00570-16), e del Consiglio Nazionale Brasiliano per lo Sviluppo Scientifico e Tecnologico (CNPq).
Materiali
| Name | Company | Catalog Number | Comments |
| 20-cc syringe | DESCARPACK | SI100S4G | Sterile syringe |
| 26-G needles | BD | 497AQDKT7 | Sterile needles |
| 50-ml conical centrifuge tube | SARSTEDT | 62547254 | Plastic conical tubes suitable for centrifugation |
| 70% ethanol solution | EMFAL | 490 | Ethanol solution for esterilization |
| Anatomical dissection forceps | 3B SCIENTIFIC | W1670 | Maintain in sterile beaker containing 70% ethanol solution |
| C57Bl/6 wild type mouse | Purchased from Biotério Central at Federal University of Minas Gerais | Not applicable | Mice must be specific-pathogen-free, age between 6 and 10 weeks. Mice need be accommodated at least one week earlier for recovering from the stress of transportation |
| Cell culture flask T175 | GREINER | C7481-50EA | T-175 flask, canted neck, surface area 75 cm2, with filter cap, DNase free, RNase free |
| Cell culture flask T75 | GREINER | C7231-120EA | T-75 flask, canted neck, surface area 75 cm2, with filter cap, DNase free, RNase free |
| Disinfecting or baby Wipes? | CLOROX | Not applicable | It helps cleaning the bone |
| Distilled Water | GIBCO | 15230 | Sterile distilled water |
| DMEM/F12-10 | Not applicable | Not applicable | Add 10 mL of Fetal Bovine Serum (FBS) and 1 mL of Penicillin/ Streptomycin (P/S) to DMEM/F12 (q.s.p. 100 mL) |
| DMEM/F12-10 + supernatant of L-929 cells | Not applicable | Not applicable | Add 20% of supernatant of L929 cells culture on DMEM/F-12-10 |
| Dulbecco′s Modified Eagle′s Medium - F12 (DMEM/F12) | GIBCO | 12500096 | DMEM: F-12 Medium contains 2.5 mM L-glutamine, 15 mM HEPES, 0.5 mM sodium pyruvate, and 1200 mg/L sodium bicarbonate.Resuspend powder to 1 liter of distilled water and add 3,7 g of sodium bicarbonate. Adjust pH to 7,2 and filter with 0,22 µM. Storage at 2 - 8 °C freezer |
| Fetal Bovine Serum, certified, heat inactivated, United States (FBS) | GIBCO | 10082147 | Enrichment for DMEM-F12 |
| Hemocytometer | SIGMA-ALDRICH | Z359629 | Used to count macrophages at microscopy |
| L-929 cells | SIGMA-ALDRICH | ATCC # CCL-1 | L-929 is a lineage of mouse fibroblast cells used as a source of macrophage colony stimulating factor (M-CSF) |
| Nikon TI eclipse | NIKON | Not applicable | Nikon TI Eclipse is a fluorescence and phase contrast microscope |
| Non-enzymatic cell dissociation solution | CELLSTRIPER (CORNING) | 25-056-CI | Non-enzimatic cell dissociation solution remove macrophages from the plate without damaging them |
| Non-treated round culture dishes 100 × 20–mm | CORNING | CLS430591 | Do not use tissue culture treated petri dishes or any tissue culture treated plate |
| P3199 Penicillin G Potassium Salt | USBIOLOGICAL | 113-98-4 | Antibiotics |
| Penicillin and streptomycin (P/S) solution | Use 0,26 grams of penicillin and 0,40 grams of streptomycin. Mix with 40 mL of sterile PBS. Inside a horizontal laminar flow cabinet, use a 0,22 µM filter and store aliquots of 1.0 mL in 1.5 ml microfuge tubes in the freezer (-20°C) | ||
| Phosphate Buffered Saline free from Calcium and Magnesium (PBS) | MEDIATECH | 21-040-CM | Sterile |
| S7975 Streptomycin Sulfate, 650-850U/mg | USBIOLOGICAL | 3810-74-0 | Antibiotics |
| Serological pipettes of 10mL or 25 mL | SARSTEDT | 861254001 | Serological pipettes is used volumes higher than 1 mL |
| Sodium Bicarbonate | SIGMA-ALDRICH | 144-55-8 | pH correction for DMEM-F12 |
| Software Nis Elements Viewer | NIKON | Not applicable | NIS-Elements Viewer is a free standalone program to view image files and datasets |
| Sterile PBS and 2% of P/S solution | LABORCRIN | 590338 | Add 1 mL of P/S in 40 mL of sterile PBS |
| Straight iris scissors | KATENA | Not applicable | Maintain in sterile beaker containing 70% ethanol solution |
| Supernatant of L-929 cells | Not applicable | Not applicable | L-929 is a lineage of mouse fibroblast cells used as a source of macrophage colony stimulating factor (M-CSF). L-929 supernatant was obtain from the protocol |
| Surgical Scalpel Blade No.24 Stainless Steel | SWANN-MORTON | 311 | Used for exposing epiphysis from bones |
| Trypan Blue Solution, 0.4% | GIBCO | 15250061 | Trypan Blue Solution, 0.4%, is routinely used as a cell stain to assess cell viability using the dye exclusion test |
| Trypsin/EDTA solution 0,05% | GIBCO | 25300-062 | Used to dissociate cells from culture bottle |
| Water for Injection (WFI) for Cell Culture | GIBCO | A12873 | Sterile and endotoxin-free water |
Riferimenti
- Gomez Perdiguero, E., et al. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors. Nature. 518 (7540), 547-551 (2015).
- van Furth, R., Cohn, Z. A. The origin and kinetics of mononuclear phagocytes. The Journal of Experimental Medicine. 128 (3), 415-435 (1968).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Medzhitov, R. Origin and physiological roles of inflammation. Nature. 454 (7203), 428-435 (2008).
- Shapouri-Moghaddam, A., et al. Macrophage plasticity, polarization, and function in health and disease. Journal of Cellular Physiology. 233 (9), 6425-6440 (2018).
- Davies, J. Q., Gordon, S. Isolation and culture of murine macrophages. Methods in Molecular Biology. 290, 91-103 (2005).
- Jin, X., Kruth, H. S. Culture of macrophage colony-stimulating factor differentiated human monocyte-derived macrophages. Journal of Visualized Experiments. (112), e54244 (2016).
- Gonçalves, R., Mosser, D. M. The isolation and characterization of murine macrophages. Current Protocols in Immunology. 111 (1), 1-16 (2015).
- Varol, C., Mildner, A., Jung, S. Macrophages: development and tissue specialization. Annual Review of Immunology. 33, 643-675 (2015).
- Andrés, V., Pello, O. M., Silvestre-Roig, C. Macrophage proliferation and apoptosis in atherosclerosis. Current Opinion in Lipidology. 23 (5), 429-438 (2012).
- Pineda-Torra, I., Gage, M., de Juan, A., Pello, O. M. Isolation, culture, and polarization of murine bone marrow-derived and peritoneal macrophages. Methods in Molecular Biology. 1339, 101-109 (2015).
- Edwards, J. P., Zhang, X., Frauwirth, K. A., Mosser, D. M. Biochemical and functional characterization of three activated macrophage populations. Journal of Leukocyte Biology. 80 (6), 1298-1307 (2006).
- Hamczyk, M. R., Villa-Bellosta, R., Andrés, V. In vitro macrophage phagocytosis assay. Methods in Molecular Biology. 1339, 235-246 (2015).
- Hosoe, S., et al. Induction of tumoricidal macrophages from bone marrow cells of normal mice or mice bearing a colony-stimulating-factor-producing tumor. Cancer Immunology, Immunotherapy. 28 (2), 116-122 (1989).
- Rice, H. M., et al. rM-CSF efficiently replaces L929 in generating mouse and rat bone marrow-derived macrophages for in vitro functional studies of immunity to intracellular bacteria. Journal of Immunological Methods. 477, 112693 (2020).
- Boltz-Nitulescu, G., et al. Differentiation of rat bone marrow cells into macrophages under the influence of mouse L929 cell supernatant. Journal of Leukocyte Biology. 41 (1), 83-91 (1987).
- Weischenfeldt, J., Porse, B. Bone marrow-derived macrophages (BMM): isolation and applications. Cold Spring Harbor Protocols. 2008 (12), (2008).
- Austin, P. E., Mcculloch, E. A., Till, J. E. Characterization of the factor in L-cell conditioned medium capable of stimulating colony formation by mouse marrow cells in culture. Journal of Cellular Physiology. 77 (2), 121-134 (1971).
- Stanley, E. R. Macrophage colony-stimulating factor (CSF-1). Encyclopedia of Immunology. 116 (1983), 1650-1654 (1998).
- Bou Ghosn, E. E., et al. Two physically, functionally, and developmentally distinct peritoneal macrophage subsets. Proceedings of the National Academy of Sciences. 107 (6), 2568-2573 (2010).
- Ray, A., Dittel, B. N. Isolation of mouse peritoneal cavity cells. Journal of Visualized Experiments. (35), e1488 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon