Method Article
Isolierung und Kultivierung von Makrophagen aus dem Knochenmark aus Mäusen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Isolierung und Kultivierung von aus dem Knochenmark gewonnenen Makrophagen aus Mäusen.
Zusammenfassung
Makrophagen haben wichtige Effektorfunktionen bei der Homöostase und Entzündung. Diese Zellen sind in jedem Gewebe des Körpers vorhanden und haben die wichtige Fähigkeit, ihr Profil entsprechend den in der Mikroumgebung vorhandenen Reizen zu ändern. Zytokine können die Physiologie von Makrophagen tiefgreifend beeinflussen, insbesondere IFN-γ und Interleukin 4 und erzeugen M1- bzw. M2-Typen. Aufgrund der Vielseitigkeit dieser Zellen kann die Produktion einer Population von Makrophagen aus dem Knochenmark ein grundlegender Schritt in vielen experimentellen Modellen der Zellbiologie sein. Das Ziel dieses Protokolls ist es, Forschern bei der Isolierung und Kultivierung von Makrophagen zu helfen, die aus Knochenmarkvorläufern gewonnen werden. Knochenmarkvorläuferzellen von pathogenfreien C57BL/6-Mäusen werden in Makrophagen umgewandelt, wenn sie dem Makrophagen-Kolonie-stimulierenden Faktor (M-CSF) ausgesetzt werden, der in diesem Protokoll aus dem Überstand der murinen Fibroblastenlinie L-929 gewonnen wird. Nach der Inkubation stehen reife Makrophagen zur Verfügung, die vom 7. bis zum 10. Tag verwendet werden können. Ein einzelnes Tier kann die Quelle von etwa 2 x 107 Makrophagen sein. Daher ist es ein ideales Protokoll für die Gewinnung großer Mengen primärer Makrophagen mit grundlegenden Methoden der Zellkultur.
Einleitung
Monozyten und Makrophagen sind mononukleäre Fresszellen, die aus Vorläuferzellen im Knochenmark gewonnen werden können. Neuere Studien haben berichtet, dass Makrophagen auch von erythro-myeloischen Vorläuferzellen aus Dottersäcken stammen1. Unabhängig von ihrer Herkunft haben diese Leukozyten wichtige Effektorfunktionen bei der Homöostase und Entzündung 2,3. Monozyten sind Zellen aus dem peripheren Blut, die sich im Gewebe weiter zu Makrophagen differenzieren können 2,4, während Makrophagen heterogene Zellen sind, die Phänotypen und Funktionen aufweisen, die durch die lokale Exposition von Wachstumsfaktoren und Zytokinen reguliert werden5. Da Makrophagen eine solche funktionelle Vielfalt aufweisen, wurden sie in vielen Krankheitsmodellen untersucht. So ist die In-vitro-Kultur von Makrophagen zu einem wichtigen Werkzeug geworden, um ihre Physiologie und ihre Rolle bei verschiedenen Krankheiten zu verstehen. Das Knochenmark ist eine wichtige Quelle für Vorläuferzellen, einschließlich Makrophagen-Vorläuferzellen, die isoliert und vermehrt werden können, wodurch die Anzahl der erhaltenen Makrophagen exponentiell erhöht wird. Darüber hinaus sind aus dem Knochenmark gewonnene Makrophagen besonders wichtig, um die Auswirkungen der Gewebemikroumgebung zu vermeiden, da Makrophagen ihren Phänotyp als Reaktion auf verschiedene Reize im Gewebe ändern 6,7. Knochenmarkvorläuferzellen verwandeln sich in Makrophagen, wenn sie dem Makrophagen-Kolonie-stimulierenden Faktor (M-CSF) ausgesetzt werden8. Aus dem Knochenmark gewonnene Makrophagen können nicht durch biochemische Marker im Gewebe von Monozyten-abgeleiteten Makrophagen unterschieden werden. Diese Zellen stellen eine sehr homogene Population von Primärzellen dar, die in vielerlei Hinsicht mit den Peritonealmakrophagen vergleichbar sind 6,9.
Aufgrund ihrer heterogenen zellulären Funktionen wurden Makrophagen von Forschern lange Zeit gründlich untersucht. Diese Zellen können in verschiedenen experimentellen Modellen verwendet werden, einschließlich Infektions- und Entzündungskrankheiten, da sie in diesen Prozessen eine Rolle spielen10,11. Sie können auch nützlich sein, um die Polarisation von Makrophagen als Reaktion auf verschiedene Mikroumgebungsreize zu untersuchen12,13. Somit wird hier ein einfaches und zuverlässiges Protokoll zur Verfügung gestellt, um eine hohe Anzahl primärer Makrophagen aus dem Knochenmark der Maus zu gewinnen.
Protokoll
Dieses Protokoll wurde in Übereinstimmung mit dem Nationalen Rat für die Kontrolle von Tierversuchen (Concea) und mit Genehmigung des Ethik- und Verwendungsausschusses für Tiere (CEUA) erstellt. C57BL/6-Mäuse wurden vom Biotério Central der Federal University of Minas Gerais (UFMG), Belo Horizonte, Brasilien, gekauft. Persönliche Schutzausrüstung (PSA) wie Laborkittel, Handschuhe und Augenschutz sollten bei allen in diesem Protokoll beschriebenen Schritten verwendet werden.
1. Vorbereitung des Überstands der Fibroblasten-L-929-Linie als Quelle für M-CSF
- Tauen Sie Zellen der L-929-Fibroblastenlinie auf (American Type Culture Collection Certified Cell Line-ATCC CCL1) und beginnen Sie sofort mit dem Kulturprozess, um die Lebensfähigkeit zu erhalten.
- In einer Laminar-Flow-Biosicherheitswerkbank werden die Zellen der L-929-Fibroblastenlinie mit einer 1.000-μl-Pipette aus dem Fläschchen in ein steriles 50-ml-Zentrifugenröhrchen übertragen.
- Verwenden Sie eine serologische Pipette, um 50 ml sterile phosphatgepufferte Kochsalzlösung (PBS) hinzuzufügen, die frei von Kalzium und Magnesium ist.
- Zentrifugieren bei 300 x g, 4 °C für 10 min. Entsorgen Sie den Überstand.
- Resuspendieren Sie das Pellet in 20 ml Dulbeccos modifiziertem Eagle's Medium-F12, ergänzt mit 10 % fötalem Rinderserum (FBS) und 1 ml Penicillin/Streptomycin (P/S) (DMEM/F12-10) unter Verwendung einer serologischen Pipette.
- Die resuspendierten Zellen werden in einen T75-Zellkulturkolben überführt.
- In einem 37 °C, 5 % CO2 -Inkubator bis zur vollständigen Konfluenz inkubieren.
HINWEIS: Achten Sie bei der Handhabung des Kolbens darauf, dass der Deckel nicht mit Lösung benetzt wird, da dies eine Kontaminationsquelle sein kann. Um eine geeignete Menge an Überstand zu erhalten, ist es notwendig, die Zellen zu replizieren, nachdem sie die gesamte Oberfläche des Zellkulturkolbens bedeckt haben. L-929-Zellen werden durch Kontakt gehemmt. Erwärmen Sie die Trypsin/Ethylendiamintetraessigsäure (EDTA)-Lösung, DMEM/F12-10, und steriles PBS auf 37 °C, um die Zellkulturerweiterung zu starten, wie in den folgenden Schritten beschrieben. - Sobald die vollständige Konfluenz erreicht ist, entsorgen Sie den Überstand aus dem Zellkulturkolben in der Laminar-Flow-Biosicherheitswerkbank.
- Waschen Sie den Zellkulturkolben mit 20 ml sterilem PBS mit einer serologischen Pipette und verwerfen Sie die Lösung.
- 10 ml Trypsin/EDTA (0,05%ige Lösung) in den Zellkulturkolben geben, der die anhaftenden Zellen enthält.
- Den Zellkulturkolben von der laminaren Strömung in einen 37°C-Inkubator mit 5 % CO2 überführen und 3 Minuten lang inkubieren.
- Schütteln Sie den Zellkulturkolben, um die Zellen von der Oberfläche des Kulturkolbens zu trennen, und stellen Sie mit einem Mikroskop sicher, dass alle Zellen dissoziiert wurden.
- Inaktivieren Sie das Trypsin/EDTA (0,05%ige Lösung) mit 10 mL DMEM/F12-10 Medium.
- Übertragen Sie die Lösung mit einer serologischen Pipette in ein steriles 50-ml-Zentrifugenröhrchen.
- Bei 300 x g bei 4 °C 10 min zentrifugieren. Entsorgen Sie den Überstand.
- Resuspendieren Sie das Pellet in 10 mL DMEM/F12-10 Medium.
- 1 ml der Zellsuspension in einen T175-Zellkulturkolben (1:10-Kultur) geben.
- Wiederholen Sie den Vorgang, um zehn T175-Zellkulturflaschen zu erhalten.
- Geben Sie 50 ml DMEM/F12-10 in jeden Zellkulturkolben.
- In einem 37 °C, 5 % CO2 -Inkubator bis zur vollständigen Konfluenz inkubieren.
HINWEIS: Diese Schritte garantieren 500 ml L-929-Zellüberstand. Am Tag 5, nachdem die Zellen die Oberfläche des T175-Zellkulturkolbens bedeckt haben, wird der Überstand mit M-CSF angereichert und muss entnommen werden14. - Nehmen Sie den Zellkulturkolben am 5. Tag nach der Kontakthemmung aus dem Inkubator.
- Übertragen Sie das Medium in ein steriles 50-ml-Zentrifugenröhrchen.
- Zentrifugieren bei 3.200 x g, bei 4 °C für 10 min.
- Der mit M-CSF angereicherte Überstand wird aufgefangen und die Lösung in ein steriles 50-ml-Zentrifugenröhrchen überführt. Im Gefrierschrank bei -20 °C lagern.
HINWEIS: Die Zentrifugation ist äußerst wichtig, um Zellen und Ablagerungen aus den Überständen zu entfernen. - Der Überstand L-929 ist eine praktische und kostengünstige Quelle für den Makrophagen-Kolonie-stimulierenden Faktor (M-CSF) und enthält typischerweise 5 bis 10 ng/ml M-CSF8. Diese Überstände enthalten auch Spuren anderer Zytokine und Wachstumsfaktoren, üben aber keinen tiefgreifenden Einfluss auf die Makrophagenphysiologie aus15. Gereinigtes M-CSF kann jedoch als Alternative zu L-929-Überständen in Konzentrationen von 1 bis 2 ng/mL8 erworben und verwendet werden.
2. Entfernung des Oberschenkelknochens und des Schienbeins
- Fahren Sie fort mit der Euthanasie der 8 Wochen alten männlichen Wildtyp-Maus C57BL-6 durch Gebärmutterhalsdislokation nach Kohlendioxid-Erstickung, in Übereinstimmung mit der normativen Resolution Nr. 18 des Nationalen Rates für Tierversuche (Concea) und mit Genehmigung des Ethik- und Verwendungsausschusses für Tiere (CEUA).
- Tränken Sie die Maus mit 70%iger Ethanollösung und verwenden Sie eine sterile Schere, um einen 1 cm langen Schnitt entlang des Bauches zu machen.
- Entfernen Sie die Haut, bis der Muskel der Hinterbeine vollständig freigelegt ist.
- Entfernen Sie die Hinterbeine auf Hüfthöhe und achten Sie darauf, den Oberschenkelknochen und das Schienbein nicht zu brechen.
- Legen Sie die Hinterbeine in ein konisches Zentrifugenröhrchen mit 70%iger Ethanollösung.
HINWEIS: Verwenden Sie immer pathogenfreie Mäuse. Achten Sie darauf, beide Beine zu sammeln, um eine größere Anzahl von Zellen zu erreichen. Schritt 2 wird in einer unsterilen Umgebung (Benchtop) durchgeführt. Daher ist es wichtig, den Oberschenkelknochen und das Schienbein vorsichtig zu entfernen, damit sie intakt bleiben und eine bakterielle Kontamination vermieden werden. Die restlichen Schritte dieses Verfahrens werden in einer Laminar-Flow-Biosicherheitswerkbank durchgeführt. Die Zeit, in der die Beine einer 70%igen Ethanollösung ausgesetzt sind, sollte auf 10 Minuten begrenzt werden. Ist die Zeit länger, können Vorläuferzellen des Knochenmarks betroffen sein.
3. Gewinnung von Knochenmarkvorläuferzellen aus dem Lumen der Tibia und des Femurs
- Entfernen Sie die Beine aus der 70%igen Ethanollösung und geben Sie sie in steriles PBS.
- Verwenden Sie eine Pinzette und Desinfektionstücher, um alle Muskeln und Faszien zu entfernen. Der Knochen sollte nach diesem Schritt sauber sein.
- Verwenden Sie eine sterile chirurgische Skalpellklinge, um die Knochenepiphyse an beiden Enden zu durchtrennen, um das Knochenmark freizulegen.
- Füllen Sie eine 20-ml-Spritze mit 10 mL sterilem PBS, ergänzt mit 2%iger Penicillin/Streptomycin-Lösung, und schließen Sie eine 26-g-Nadel an.
- Halten Sie den Knochen mit einer anatomischen Dissektionezange mit einer Hand fest und führen Sie die Nadel mit der anderen Hand in die Knochenhöhle ein. Achte darauf, dass du den Knochen nicht mit der Pinzette zerquetschst.
- Waschen Sie das Innere des Knochens mit dem PBS aus und sammeln Sie das Knochenmark in einem sterilen konischen Zentrifugenröhrchen. Nach diesem Schritt sollte die Knochenhöhle weiß erscheinen.
- Die gesammelten Zellen 10 min bei 300 x g bei 4 °C zentrifugieren.
- Den Überstand verwerfen und das Zellpellet in 1 ml DMEM/F12-10 resuspendieren.
- Homogenisieren Sie und fügen Sie weitere 9 mL DMEM/F12-10 Medium hinzu, um die Zellen auf insgesamt 10 mL zu bringen.
4. Makrophagen-Kultur
- Geben Sie 1 ml Zellvorläuferzellen in jede der 100 mm x 20 mm großen runden Petrischalen aus Kunststoff (insgesamt 10 Schale) und verteilen Sie die Zellen mit einer Pipette auf den Platten, um eine gleichmäßige Verteilung zu erhalten. Verwenden Sie kein mit Gewebekulturen behandeltes Geschirr.
- 9 ml DMEM/F12-10, ergänzt mit 20 % des L-929-Zellüberstandes, in jede Schale geben.
- Inkubieren Sie in einem 37 °C heißen Inkubator mit 5 % CO2 .
- Am 3. Tag geben Sie 10 ml DMEM/F12-10-Medium, ergänzt mit 20 % des Überstands an L-929-Zellen, in jede Schale. Auf diese Weise stehen den Kulturschalen nun insgesamt 20 mL Kulturmedium zur Verfügung, ausreichend für das Wachstum der Zellen bis zum Ende ihrer Reifung.
HINWEISE: Mit Gewebekulturen behandelte Schalen dürfen nicht verwendet werden, da Makrophagen als natürliche adhärente Zellen, die durch starke Wechselwirkungen mit Oberflächen gekennzeichnet sind, später nicht leicht von der Schale dissoziieren. Normalerweise können Zellvorläuferzellen einer Maus (zwei Femure) in 10 Kulturschalen ausgesät werden. Zellvorläuferzellen verwandeln sich in Makrophagen, die vom 7. bis 10. Inkubationstag verwendet werden können. Die Reifungsbestätigung wird durch Veränderungen an der Morphologie der Makrophagen identifiziert. Reife Makrophagen sind adhärent und zeigen eine heterogene Morphologie, die durch die Emission von Pseudopodien in verschiedene Richtungen erklärt wird. Beispiele für diese reifen Zellen sind in den repräsentativen Ergebnissen dargestellt.
5. Ernte von Makrophagen
- Entsorgen Sie die Überstände aus allen Kulturschalen.
- Waschen Sie jede Kulturschale mit 10 ml warmem (37 °C) sterilem Mg2+ und Ca2+ freiem PBS.
- Entsorge die Lösung aus jeder Schale.
- Die nicht-enzymatische Zelldissoziationslösung auf 37 °C vorwärmen und 3 ml in jede Schale geben. 10 min in einem 37 °C heißen Inkubator mit 5 % CO2 inkubieren. Verwenden Sie ein inverses Mikroskop, um zu visualisieren, ob sich die Makrophagen von den Kulturschalen dissoziieren.
HINWEIS: Die Verwendung von Kunststoffplatten, die nicht mit Gewebekulturen behandelt wurden, sollte eine einfache Dissoziation der Zellen ermöglichen und die Notwendigkeit vermeiden, die Zellen von der Platte abzukratzen. - Spülen Sie das Geschirr mit einer serologischen Pipette immer wieder mit der nicht-enzymatischen Zelldissoziationslösung und führen Sie kreisende Bewegungen aus, um zu bestätigen, dass alle Makrophagen von der Schale dissoziiert sind.
- Sammeln Sie die Lösung aller Kulturschalen zusammen in einem konischen 50-ml-Zentrifugenröhrchen.
- Geben Sie 10 mL steriles, vorgewärmtes PBS in die leeren Kulturschalen und gehen Sie wie in Schritt 5.4 vor. Dieses Verfahren ist eine Wiederholung von Schritt 5.4 und soll gewährleisten, dass alle Makrophagen gesammelt werden.
- Zentrifugieren bei 300 x g, 4 °C für 10 min.
- Den Überstand verwerfen und das Pellet mit 1 ml DMEM/F12-10 resuspendieren. Homogenisieren Sie langsam und vorsichtig mit der Pipette auf und ab, um eine Beschädigung der Zellen zu vermeiden.
- Bereiten Sie ein Aliquot von 10 μl Makrophagenlösung vor, die mit 10 μl Trypanblau verdünnt ist, um die Zellen mit dem Hämozytometer zu zählen.
HINWEIS: An Tag 7 produziert jede Schale ca. 2 x 106 Makrophagen. Das bedeutet, dass eine Maus etwa 2 x 107 primäre Makrophagen produzieren kann, wenn sie in zehn Platten geerntet wird. Da M-CSF nur die Reifung von Makrophagen antreibt, garantiert das Verfahren eine Population von Zellen, die im Wesentlichen nur aus Makrophagen besteht und frei von anderen kontaminierenden Leukozytenist 16.
Ergebnisse
Makrophagen sind große und anhaftende Zellen mit besonderen physiologischen Eigenschaften. Sie zeigen eine Vielfalt morphologischer Erscheinungsformen in Kultur, da sie an Glas und Kunststoff haften können, und ihre typische Ausbreitungsmorphologie hängt mit der Emission zytoplasmatischer Fortsätze zusammen (Abbildung 1). Sobald die Vorläuferzellen des Knochenmarks M-CSF aus dem L-929-Zellüberstand ausgesetzt sind und die Umwandlung in reife Makrophagen beginnen, haften sie an der Petriplatte.
Abbildung 2 zeigt die Kinetik der Transformation von Knochenmarkvorläuferzellen zu reifen Makrophagen. Am Tag 3 erscheinen einige unreife Makrophagen, von denen die meisten eine typische runde Morphologie mit wenigen Membranvorsprüngen aufweisen (Abbildung 3). Obwohl sie sich während des gesamten Prozesses verändern, sind in der Regel 7 Tage erforderlich, um eine angemessene Anzahl und Reife zu erreichen, um die maximale Effizienz des vorliegenden Protokolls zu gewährleisten.
Darüber hinaus sind Makrophagen Phagozyten (Makro = groß; Phagos = Fressen), die in der Lage sind, große Mengen an antigenen oder nicht-antigenen Partikeln zu phagozytieren. Phänotypisch zeichnen sie sich durch die Expression der Oberflächenmoleküle F4/80 und CD11b aus. Die Analyse mittels Durchflusszytometrie zeigt, dass die mit dem vorliegenden Protokoll erhaltenen Makrophagen eine homogene Population in Bezug auf Größe und Granularität darstellen (Abbildung 4). Darüber hinaus exprimierten 100% der Population F4/80 und CD11b, was eine einzige, genau definierte Zellpopulation bildete. Darüber hinaus zeigte die Analyse der Phagozytose von Leishmania-Hauptparasiten eine enorme Fähigkeit zur Phagozytose, was beweist, dass es sich um reife und gut differenzierte Makrophagen handelt (Abbildung 5).
Die in dieser Arbeit gezeigten mikroskopischen Daten wurden mit Hilfe der Fluoreszenz- und Phasenkontrastmikroskopie im Image Acquisition and Processing Center (CAPI-ICB/UFMG) gewonnen.

Abbildung 1: Kultur von Makrophagen, die von Knochenmarkvorläufern abgeleitet wurden und unterschiedliche Morphologien zeigten, während sie an der Platte hafteten, an Tag 5. Makrophagen geben lange zytoplasmatische Fortsätze ab, die es ihnen ermöglichen, sich zu bewegen und zu phagozytieren. Helligkeit und Kontrast wurden nach der Aufnahme der Bilder mit einem 20-fachen Filter mit differentiellem Interferenzkontrast (DIC) eingestellt. Balken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Kinetik der Transformation von Knochenmarkvorläufern zu reifen Makrophagen an Tag 1, 3, 5 und 7. Helligkeit und Kontrast wurden nach der Aufnahme der Bilder mit einem DIC 20x-Filter angepasst. Balken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
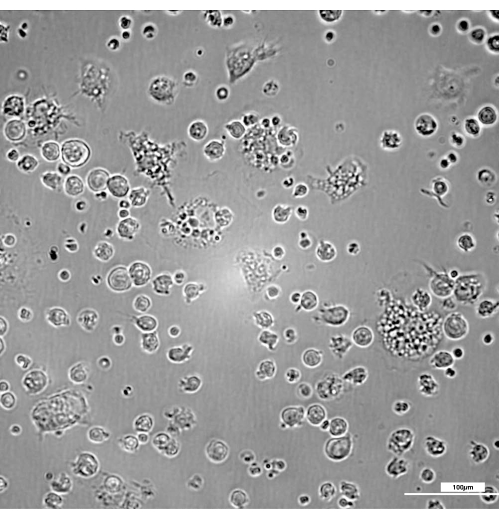
Abbildung 3: Vorhandensein von leicht anhaftenden unreifen Makrophagen am Tag 3 mit einer typischen runden Morphologie mit wenigen Membranprojektionen. Helligkeit und Kontrast wurden nach der Aufnahme der Bilder mit einem DIC 20x-Filter angepasst. Balken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Durchflusszytometrische Analyse von Makrophagen aus dem Knochenmark. Makrophagen wurden von den Schalenplatten abgetrennt (Zellstripper) und mit anti-F4/80 FITC und anti-CD11b PE-Cy7 gefärbt. (A) Der Aspekt der Zellen basierend auf Größe und Granularität (FSC x SSC). (B) Die Expression von F4/80- und CD11b-Zellmarkern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
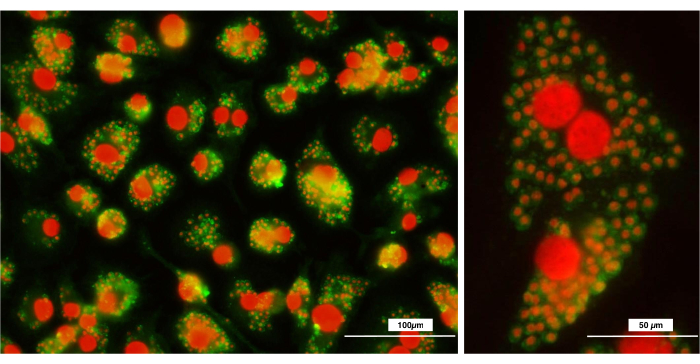
Abbildung 5: Fluoreszenzmikroskopische Analyse nach Phagozytose von Leishmania major Parasiten. Makrophagen wurden von den Platten gelöst und auf runde Glasdeckgläser ausgesät, denen die Hauptparasiten Leishmania zugesetzt wurden. Die Abbildung zeigt die phagozytierten Parasiten in den Makrophagen. Leishmania major-Parasiten wurden mit FITC-Anti-Leishmania-Antikörpern gefärbt und Zellkerne (Makrophagen und Leishmania major) mit Propidiumiodid gegengefärbt. (A) das 20-fache; (B) 40x. Balken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Herstellung einer Population von Makrophagen aus dem Knochenmark ist ein grundlegender Schritt in vielen zellbiologischen Versuchsmodellen, insbesondere wenn es wichtig ist, eine homogene Population von Primärzellen zu erreichen. Wie bereits erwähnt, können sich Zellvorläuferzellen nur in Gegenwart von M-CSF in Makrophagen verwandeln. L-929-Zellüberstände können als Hauptquelle für M-CSF verwendet werden. Abgesehen von den Kosten gibt es kein Problem, rekombinantes M-CSF selbstzu verwenden 8,17. Es gibt Hinweise darauf, dass rekombinante M-CSF-Makrophagen eine bessere Uniformität in Kultur aufweisen; Die Verwendung von r-M-CSF oder L-929-Überstand macht jedoch keinen signifikanten Unterschied in der Genexpression der Hauptmakrophagenmarker und der Zytokinproduktion15.
Knochenmarkvorläuferzellen sind sehr anfällig. Um eine Kontamination zu vermeiden, ist die Verwendung einer sauberen Laminar-Flow-Biosicherheitshaube unerlässlich. In den ersten Schritten dieses Protokolls entstehen bei der Entfernung von Muskeln von der Knochenoberfläche Rückstände, die eine Kontaminationsquelle darstellen können. Es wird empfohlen, die Haube zu reinigen, bevor die Knochenepiphyse durchtrennt und das Knochenmark freigelegt wird. Sobald die Vorläuferzellen aus der Knochenhöhle heraus sind, ist es wichtig, daran zu denken, diese Zellen sorgfältig zu behandeln, um die Sterilität und optimale Lebensfähigkeit zu erhalten.
In diesem Protokoll werden C57BL/6-Mäuse verwendet, aber BALB/C-Mäuse sind ebenso geeignet. Mäuse im Alter von 6-10 Wochen werden für die Entnahme einer guten Population von Knochenmark-Makrophagen empfohlen, mit einer Schätzung von 2 x 107 Zellen pro Maus. Jüngere Mäuse liefern in der Regel eine ähnliche Anzahl von Zellen, aber die kleineren Oberschenkelknochen können einige Herausforderungen für das Isolierungsverfahren darstellen. In unseren früheren Studien haben wir in der Regel keine großen Unterschiede zwischen der Makrophagenausbeute verschiedener Wildtyp-Mäusestämme beobachtet, aber wir erkennen an, dass einige Stämme von Knockout-Mäusen eine gewisse Variabilität in der Ausbeute aufweisen können 6,8.
Das vorliegende Protokoll beschreibt eine zuverlässige Methode zur Gewinnung einer primären Makrophagenkolonie unter Verwendung des L-929-Überstandes, einer Technik, die seit vielen Jahren von Forschern gut etabliert ist18,19. Im Vergleich zu anderen bestehenden Methoden zeichnet sich dieses Verfahren durch die Anzahl der Zellen und die Homogenität der Population aus, insbesondere im Vergleich zu peritonealen Makrophagen. Die Anzahl der peritonealen residenten Makrophagen ist oft unzureichend, da in der Regel Millionen von Zellen für jeden Assay benötigt werden und Makrophagen nur einen kleinen Bruchteil der Peritonealwäsche ausmachen 8,20. Die Peritonealwäsche liefert auch andere Zelltypen wie Lymphozyten und dendritische Zellen, so dass es unmöglich ist, Wechselwirkungen zu vermeiden und eine Kultur mit unstimulierten Makrophagen zu erhalten. Da das Peritoneum eine wesentlich komplexere Mikroumgebung aufweist als in vitro, kann die Variabilität für einige Anwendungen von Nachteil sein 6,21.
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Diese Arbeit wurde durch Zuschüsse der Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG), durch Rede de Pesquisa em Doenças Infecciosas Humanas e Animais do Estado de Minas Gerais (RED-00313-16) und Rede Mineira de Engenharia de Tecidos e Terapia Celular - REMETTEC (RED-00570-16) sowie des brasilianischen Nationalen Rates für wissenschaftliche und technologische Entwicklung (CNPq) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 20-cc syringe | DESCARPACK | SI100S4G | Sterile syringe |
| 26-G needles | BD | 497AQDKT7 | Sterile needles |
| 50-ml conical centrifuge tube | SARSTEDT | 62547254 | Plastic conical tubes suitable for centrifugation |
| 70% ethanol solution | EMFAL | 490 | Ethanol solution for esterilization |
| Anatomical dissection forceps | 3B SCIENTIFIC | W1670 | Maintain in sterile beaker containing 70% ethanol solution |
| C57Bl/6 wild type mouse | Purchased from Biotério Central at Federal University of Minas Gerais | Not applicable | Mice must be specific-pathogen-free, age between 6 and 10 weeks. Mice need be accommodated at least one week earlier for recovering from the stress of transportation |
| Cell culture flask T175 | GREINER | C7481-50EA | T-175 flask, canted neck, surface area 75 cm2, with filter cap, DNase free, RNase free |
| Cell culture flask T75 | GREINER | C7231-120EA | T-75 flask, canted neck, surface area 75 cm2, with filter cap, DNase free, RNase free |
| Disinfecting or baby Wipes? | CLOROX | Not applicable | It helps cleaning the bone |
| Distilled Water | GIBCO | 15230 | Sterile distilled water |
| DMEM/F12-10 | Not applicable | Not applicable | Add 10 mL of Fetal Bovine Serum (FBS) and 1 mL of Penicillin/ Streptomycin (P/S) to DMEM/F12 (q.s.p. 100 mL) |
| DMEM/F12-10 + supernatant of L-929 cells | Not applicable | Not applicable | Add 20% of supernatant of L929 cells culture on DMEM/F-12-10 |
| Dulbecco′s Modified Eagle′s Medium - F12 (DMEM/F12) | GIBCO | 12500096 | DMEM: F-12 Medium contains 2.5 mM L-glutamine, 15 mM HEPES, 0.5 mM sodium pyruvate, and 1200 mg/L sodium bicarbonate.Resuspend powder to 1 liter of distilled water and add 3,7 g of sodium bicarbonate. Adjust pH to 7,2 and filter with 0,22 µM. Storage at 2 - 8 °C freezer |
| Fetal Bovine Serum, certified, heat inactivated, United States (FBS) | GIBCO | 10082147 | Enrichment for DMEM-F12 |
| Hemocytometer | SIGMA-ALDRICH | Z359629 | Used to count macrophages at microscopy |
| L-929 cells | SIGMA-ALDRICH | ATCC # CCL-1 | L-929 is a lineage of mouse fibroblast cells used as a source of macrophage colony stimulating factor (M-CSF) |
| Nikon TI eclipse | NIKON | Not applicable | Nikon TI Eclipse is a fluorescence and phase contrast microscope |
| Non-enzymatic cell dissociation solution | CELLSTRIPER (CORNING) | 25-056-CI | Non-enzimatic cell dissociation solution remove macrophages from the plate without damaging them |
| Non-treated round culture dishes 100 × 20–mm | CORNING | CLS430591 | Do not use tissue culture treated petri dishes or any tissue culture treated plate |
| P3199 Penicillin G Potassium Salt | USBIOLOGICAL | 113-98-4 | Antibiotics |
| Penicillin and streptomycin (P/S) solution | Use 0,26 grams of penicillin and 0,40 grams of streptomycin. Mix with 40 mL of sterile PBS. Inside a horizontal laminar flow cabinet, use a 0,22 µM filter and store aliquots of 1.0 mL in 1.5 ml microfuge tubes in the freezer (-20°C) | ||
| Phosphate Buffered Saline free from Calcium and Magnesium (PBS) | MEDIATECH | 21-040-CM | Sterile |
| S7975 Streptomycin Sulfate, 650-850U/mg | USBIOLOGICAL | 3810-74-0 | Antibiotics |
| Serological pipettes of 10mL or 25 mL | SARSTEDT | 861254001 | Serological pipettes is used volumes higher than 1 mL |
| Sodium Bicarbonate | SIGMA-ALDRICH | 144-55-8 | pH correction for DMEM-F12 |
| Software Nis Elements Viewer | NIKON | Not applicable | NIS-Elements Viewer is a free standalone program to view image files and datasets |
| Sterile PBS and 2% of P/S solution | LABORCRIN | 590338 | Add 1 mL of P/S in 40 mL of sterile PBS |
| Straight iris scissors | KATENA | Not applicable | Maintain in sterile beaker containing 70% ethanol solution |
| Supernatant of L-929 cells | Not applicable | Not applicable | L-929 is a lineage of mouse fibroblast cells used as a source of macrophage colony stimulating factor (M-CSF). L-929 supernatant was obtain from the protocol |
| Surgical Scalpel Blade No.24 Stainless Steel | SWANN-MORTON | 311 | Used for exposing epiphysis from bones |
| Trypan Blue Solution, 0.4% | GIBCO | 15250061 | Trypan Blue Solution, 0.4%, is routinely used as a cell stain to assess cell viability using the dye exclusion test |
| Trypsin/EDTA solution 0,05% | GIBCO | 25300-062 | Used to dissociate cells from culture bottle |
| Water for Injection (WFI) for Cell Culture | GIBCO | A12873 | Sterile and endotoxin-free water |
Referenzen
- Gomez Perdiguero, E., et al. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors. Nature. 518 (7540), 547-551 (2015).
- van Furth, R., Cohn, Z. A. The origin and kinetics of mononuclear phagocytes. The Journal of Experimental Medicine. 128 (3), 415-435 (1968).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Medzhitov, R. Origin and physiological roles of inflammation. Nature. 454 (7203), 428-435 (2008).
- Shapouri-Moghaddam, A., et al. Macrophage plasticity, polarization, and function in health and disease. Journal of Cellular Physiology. 233 (9), 6425-6440 (2018).
- Davies, J. Q., Gordon, S. Isolation and culture of murine macrophages. Methods in Molecular Biology. 290, 91-103 (2005).
- Jin, X., Kruth, H. S. Culture of macrophage colony-stimulating factor differentiated human monocyte-derived macrophages. Journal of Visualized Experiments. (112), e54244 (2016).
- Gonçalves, R., Mosser, D. M. The isolation and characterization of murine macrophages. Current Protocols in Immunology. 111 (1), 1-16 (2015).
- Varol, C., Mildner, A., Jung, S. Macrophages: development and tissue specialization. Annual Review of Immunology. 33, 643-675 (2015).
- Andrés, V., Pello, O. M., Silvestre-Roig, C. Macrophage proliferation and apoptosis in atherosclerosis. Current Opinion in Lipidology. 23 (5), 429-438 (2012).
- Pineda-Torra, I., Gage, M., de Juan, A., Pello, O. M. Isolation, culture, and polarization of murine bone marrow-derived and peritoneal macrophages. Methods in Molecular Biology. 1339, 101-109 (2015).
- Edwards, J. P., Zhang, X., Frauwirth, K. A., Mosser, D. M. Biochemical and functional characterization of three activated macrophage populations. Journal of Leukocyte Biology. 80 (6), 1298-1307 (2006).
- Hamczyk, M. R., Villa-Bellosta, R., Andrés, V. In vitro macrophage phagocytosis assay. Methods in Molecular Biology. 1339, 235-246 (2015).
- Hosoe, S., et al. Induction of tumoricidal macrophages from bone marrow cells of normal mice or mice bearing a colony-stimulating-factor-producing tumor. Cancer Immunology, Immunotherapy. 28 (2), 116-122 (1989).
- Rice, H. M., et al. rM-CSF efficiently replaces L929 in generating mouse and rat bone marrow-derived macrophages for in vitro functional studies of immunity to intracellular bacteria. Journal of Immunological Methods. 477, 112693 (2020).
- Boltz-Nitulescu, G., et al. Differentiation of rat bone marrow cells into macrophages under the influence of mouse L929 cell supernatant. Journal of Leukocyte Biology. 41 (1), 83-91 (1987).
- Weischenfeldt, J., Porse, B. Bone marrow-derived macrophages (BMM): isolation and applications. Cold Spring Harbor Protocols. 2008 (12), (2008).
- Austin, P. E., Mcculloch, E. A., Till, J. E. Characterization of the factor in L-cell conditioned medium capable of stimulating colony formation by mouse marrow cells in culture. Journal of Cellular Physiology. 77 (2), 121-134 (1971).
- Stanley, E. R. Macrophage colony-stimulating factor (CSF-1). Encyclopedia of Immunology. 116 (1983), 1650-1654 (1998).
- Bou Ghosn, E. E., et al. Two physically, functionally, and developmentally distinct peritoneal macrophage subsets. Proceedings of the National Academy of Sciences. 107 (6), 2568-2573 (2010).
- Ray, A., Dittel, B. N. Isolation of mouse peritoneal cavity cells. Journal of Visualized Experiments. (35), e1488 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten